-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
Coronary-subclavian steal syndrome, a complication following surgical revascularization of myocardium
Coronary-subclavian steal syndrom (CSS) is defined as a reversal of flow in a previously constructed internal mammary artery coronary conduit, producing myocardial ischemia. The most often cause is a proximal subclavian artery stenosis or closure. For the first time was CSS described in 1974 and initially was believed to be rare. However, today is the internal mammary artery to the left anterior descending coronary artery used in cardiosurgery as a standard and we can see increasing documentation of this phenomenon. A case report is presented and possibilities of management are discussed in the article.
Key words:
coronary-subclavian steal syndrom – subclavian artery stenosis – coronary artery bypass – internal mammary artery
Autoři: V. Gloger 1,2
Působiště autorů: Klinik für Herz- und Gefäßchirurgie, Herz- und Kreislaufzentrum Rotenburg an der Fulda, Germany, přednosta Privatdozent Dr. Med. Oster Hartmut 1; Interní klinika IPVZ Praha a Krajské nemocnice Tomáše Bati, a. s., Zlín, přednosta prim. MUDr. Jiří Latta 2
Vyšlo v časopise: Vnitř Lék 2012; 58(11): 871-874
Kategorie: Kazuistiky
Souhrn
Koronární-subklaviální steal syndrom je definován jako ischemie myokardu způsobená obrácením krevního toku ve štěpu z mamární tepny po konstrukci koronárního bypassu. Jeho nejčastější příčinou je stenóza nebo uzávěr podklíčkové tepny. Poprvé byl popsán v roce 1974 a zpočátku byl považován za vzácnou komplikaci. Se standardizací využití mamárních tepen v kardiochirurgii se však dnes s tímto fenoménem setkáváme relativně častěji, jak dokládají sdělení v odborné literatuře. V práci jsou, s ilustrací na konkrétním případu, rozebrány možnosti diagnostiky a léčby.
Klíčová slova:
koronární-subklaviální steal syndrom – stenóza a. subclavia – aortokoronární bypass – a. mammaria internaÚvod
Předpokladem vzniku koronárního--subklaviálního steal syndromu je existence bypassu z mamární tepny (zpravidla levé – LIMA), jejíž proximální konec zůstává in situ v a. subclavia (v případě LIMA a. subclavia sinistra – ASS). Pokud je současně přítomna významná stenóza ASS proximálně od odstupu LIMA, tlakový gradient mezi koronárním řečištěm a podklíčkovou tepnou umožní obrácení toku v LIMA, která pak v podstatě funguje jako kolaterální zásobení levé horní končetiny. Výsledkem je ischemie myokardu. Poprvé byl tento fenomén popsán v roce 1974 [1]. Zpočátku byl považován za vzácnou komplikaci chirurgické revaskularizace myokardu (coronary artery bypass graft – CABG). Literatura dokumentuje nárůst počtu případů, což patrně souvisí s nyní již standardním využíváním levé mamární tepny (LIMA) v kardiochirurgii a se zlepšením diagnostických metod [2,3]. Kazuistika popisuje CSS jako časnou a závažnou komplikaci po CABG.
Popis případu
64letý muž byl přijat k elektivní CABG. V anamnéze měl diabetes mellitus 2. typu léčený dietou a perorálními antidiabetiky, hypertenzní nemoc 2. stupně dle WHO, smíšenou hyperlipoproteinemii a obezitu (BMI 59). Jednalo se o kuřáka s chronickou obstrukční plicní nemocí I. stupně dle GOLD. Dále byl po pravostranné nefrektomii pro tumor (clearence kreatininu 89 ml/min). Echokardiograficky byla zjištěna koncentrická hypertrofie levé komory s poruchou diastolického plnění a dobrou systolickou funkcí a při duplexním vyšetření karotického povodí byla dokumentována na obou stranách stenóza a. carotis interna 50 % a stenóza a. carotis externa 70 %, dále pak stenóza a. vertebralis dextra 50 %. Dva dny před přijetím na kardiochirurgickou kliniku byla provedena selektivní koronarografie. S ohledem na morbidní obezitu byl volen přístup přes tepny pravé horní končetiny. Po neúspěšné kanylaci a. radialis dextra bylo zavedeno vyšetřovací instrumentarium přes pravostrannou brachiální tepnu a provedena diagnostická koronarografie s nálezem: 90% stenóza střední a. coronaria dextra, 90% stenóza ramus interventricularis anterior v bifurkaci, 90% stenóza ramus circumflexus v bifurkaci, 80% stenóza ramus posterolateralis sinister, 90% stenóza ramus intermedius. Pacient byl indikován k CABG. Při vlastní operaci bylo zvoleno našití levé mamární tepny (LIMA) na ramus interventricularis anterior (RIA) a dále jako T-štěp sekvenčně bypass z pravé mamární tepny na ramus intermedius a ramus marginalis 1 a 2. Po odpojení od mimotělního oběhu byla nápadná diskrepance mezi invazivně měřeným tlakem v levé a. radialis a palpací aorty a při následném měření tlaku v aortě byla zjištěna diference až 60 mm Hg. Vzhledem k dobrému krevnímu toku v LIMA při předchozí preparaci se operatér rozhodl pokračovat ve zvoleném postupu a došetřit přítomnost ev. stenózy a. subclavia sinistra ve druhé době s případnou perkutánní intervencí. Po operaci byl pacient standardně předán oběhově stabilní a řízeně ventilovaný na pooperační jednotku intenzivní péče, kde byl po 9 hod extubován. Spastický poslechový nález na plicích a suboptimální hodnoty krevních plynů si vyžádaly intermitentní neinvazivní umělou plicní ventilaci a broncholytickou léčbu. V následujícím průběhu se objevila hypotenze, bez přítomnosti krvácení, s nedostatečnou odpovědí na volumexpanzi a vyžadující katecholaminovou podporu. Echokardiograficky byla vyloučena jako příčina tamponáda. V dynamice srdečních enzymů došlo po obvyklém úvodním pooperačním poklesu k jejich opětovnému vzestupu (CK MB 57 … 88 … 58 … 111 IU, norma laboratoře 20 IU). Proto byla indikována akutně koronarografie a angiografie bypassů. Při pokusu o kanylaci LIMA byl zjištěn uzávěr a. subclavia sinistra krátce po odstupu z aortálního oblouku (obr. 1) a při nástřiku levé koronární tepny retrográdní tok v LIMA a plnění levé podklíčkové tepny (obr. 2), což odpovídá definici CSS. Při následné operační revizi byl proximální konec levé mamární tepny přenesen na aortu. Po reoperaci přetrvávalo srdeční selhání s nutností podávání středních dávek katecholaminů, inhibitorů fosfodiesterázy a závislost na umělé plicní ventilaci. Dále se objevily infekční komplikace (pneumonie, enteritis) vyžadující antibiotickou léčbu. Pro renální selhání byl pacient připojen ke kontinuální hemodiafiltraci. Osmý pooperační den se rozvinula heparinem indukovaná trombocytopenie, kterou jsme řešili podáváním agatrobanu. Trvající porucha vědomí s klinickými známkami parézy pravé horní končetiny nás vedla k podezření na mozkovou ischemii, která byla následně na CT prokázána. Přes intenzivní péči pacient 13. pooperační den zemřel pod obrazem multiorgánového selhání.
Obr. 1. Uzávěr a. subclavia sinistra po odstupu z aortálního oblouku (bílá šipka). 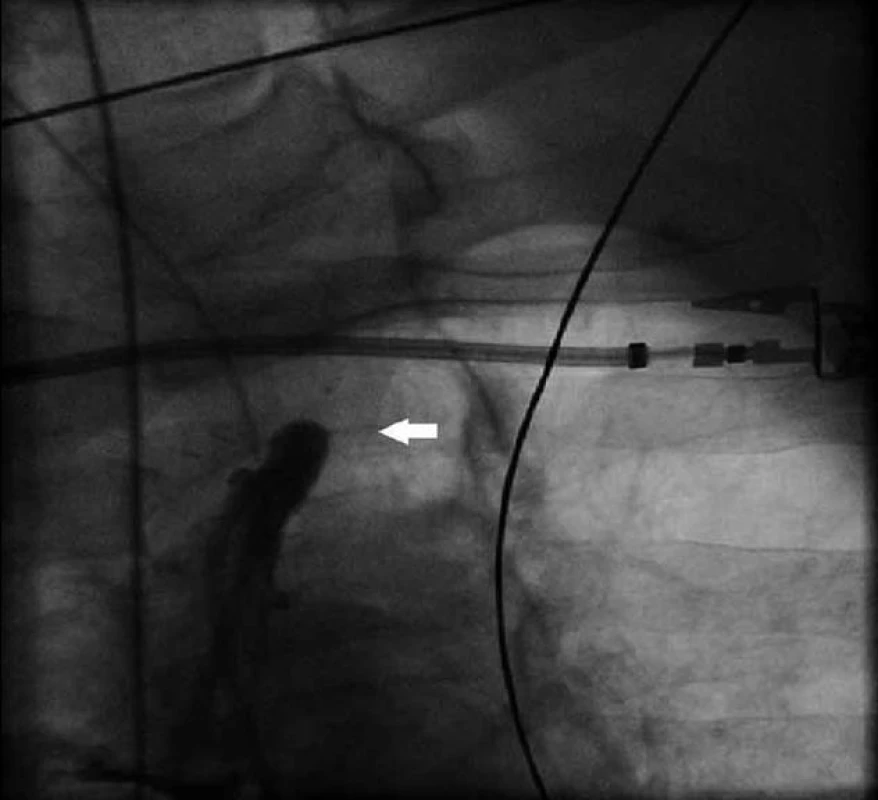
Obr. 2. Levá věnčitá tepna se zobrazením zpětného toku v LIMA (bílá šipka). 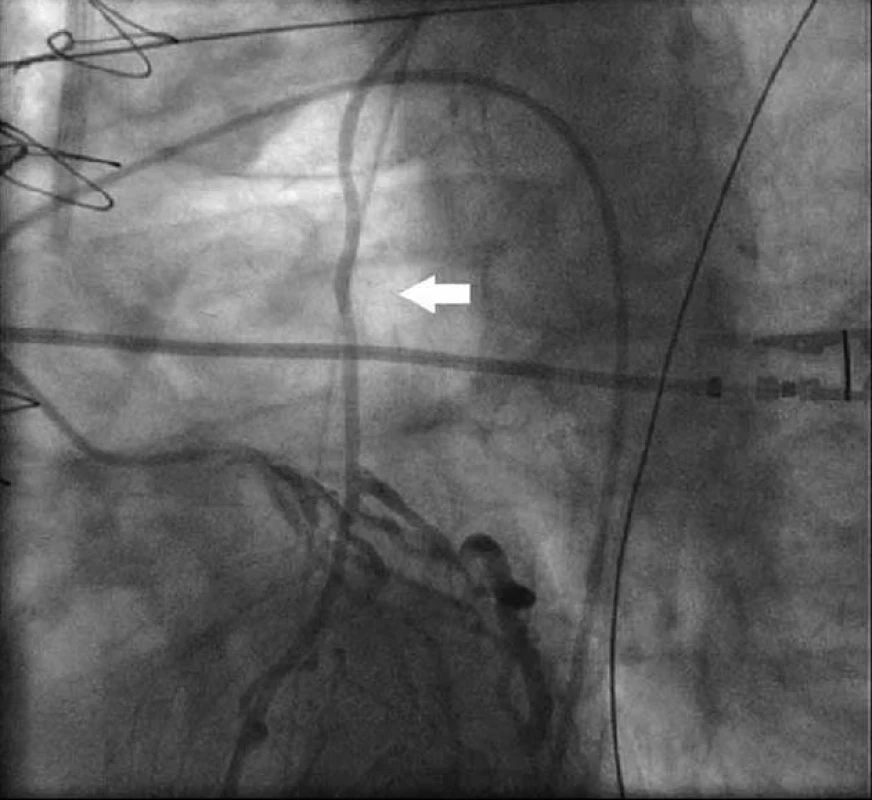
Diskuze
Ať při preexistující, ale předoperačně neodhalené stenóze ASS, nebo při vzniku stenózy ASS až s časovým odstupem po CABG, v obou případech hrozí obrácení toku v LIMA s rozvojem ischemie myokardu. To odpovídá definici CSS [1]. Incidence významné stenózy ASS u pacientů plánovaných k CABG je uváděna 0,1–0,2 % [4]. Nejčastější příčinou stenózy ASS je ateroskleróza [2], může se však vyskytnout u Takayasuovy [5] nebo u poradiační [6] arteritidy. CSS byl také popsán u arterio-venózní hemodialyzační píštěle [7] a raritně u anomálního spojení ASS s levou plicnicovou tepnou [8]. Z rizikových faktorů je nejsilnějším prediktorem stenózy ASS přítomnost ischemické choroby dolních končetin (ICHDK) [9]. Při fyzikálním vyšetření může být nápadný stranový rozdíl při měření krevního tlaku (TK), v různých sestavách udávaný 10–20 mm Hg [10–12]. Není to však podmínkou. Stenóza může postihovat současně i druhostrannou podklíčkovou tepnu nebo truncus brachiocephalicus [13]. U našeho případu zhodnocení stranové diference TK těsně před operací znemožnil rozsáhlejší hematom po koronarografickém vyšetření na pravé horní končetině. Ani v předchozí dokumentaci nebyl rozdílný TK na horních končetinách zmiňován. Varováním mohou být příznaky z vertebrobazilární insuficience a ischemie horní končetiny (tab. 1). Stenózu ASS je možné diagnostikovat ultrazvukem a potvrdit pomocí CT, MRI nebo angiograficky. Předoperačně ASS rutinně vyšetřována nebývá, i když některá pracoviště provádějí její selektivní zobrazení současně s koronarografií v případě zvažované CABG [2]. Peroperační posouzení adekvátnosti toku v LIMA je na chirurgovi a neexistuje univerzální standard. Zpravidla je hodnocen průtok po lokální aplikaci papaverinu a vyloučen trombus pomocí sondy. Důležitá je šetrná, netraumatická preparace LIMA [13]. CCS se klinicky zpravidla prezentuje jako stabilní angina pectoris, případně akutní koronární syndrom [2,14–16]. Možná je ale i němá ischemie [17], stejně tak manifestace pod obrazem srdečního selhání [18] nebo komorových tachykardií [19] (tab. 1). Doba mezi operací a manifestací CSS se uvádí od 1 měsíce po několik let [20,21]. U našeho případu se jednalo o akutní komplikaci, která se objevila 2. pooperační den.
Tab. 1. Příznaky při stenóze podklíčkové tepny a koronárním-subklaviálním steal syndromu. 
Pokud je významná stenóza ASS diagnostikována před vlastní revaskularizací myokardu, je možným řešením perkutánní transluminální angioplastika (PTA) s implantací stentu. Časná trombóza nebo reokluze (< 30 dní) nebyla v literatuře popsána [2,13]. Výskyt restenózy do 2 let je udáván 5,7 % a dlouhodobě 10,7 % [22]. Druhou možností je při CABG přenesení proximálního konce LIMA na aortu. Průchodnost tohoto tzv. volného štěpu se pohybuje dlouhodobě nad 90 % [23]. Pokud se stenóza ASS manifestuje až po CABG jako CSS, je možná chirurgická konstrukce bypassu (aorto--subklaviální, karoticko-subklaviální, případně axilo-axilární) [24–26], který zůstává patentní po 10 letech ve více než 90 % [2]. Druhou možností je PTA, která přináší úlevu od symptomů, je méně invazivní, krátkodobé výsledky jsou srovnatelné s operací a má menší počet komplikací. V delším časovém horizontu je však riziko restenózy o něco vyšší [22]. Co se týká antiagregační léčby, pacient by již z indikace ICHS měl užívat kyselinu acetylsalicylovou. Role clopidogrelu zatím nebyla studována [13].
V případě CCS spojeného s akutním koronárním syndromem je možným řešením transpozice proximálního konce LIMA na aortu [2,13,27], jak bylo provedeno u našeho případu. Alternativu operace může představovat PTA nativních koronárních tepen [28].
Závěr
Uvedená kazuistika ukazuje, že CSS může být závažnou, život ohrožující komplikací po CABG. S narůstajícím počtem pacientů operovaných s použitím mamárních tepen a obecným stárnutím populace (a pokročilejší aterosklerózou) bychom na riziko koincidující stenózy ASS měli před zvažovanou CABG myslet. Pokud je stenóza ASS přítomna již před operací, může na ni upozornit rozdílný TK na obou pažích (10–20 mm Hg), příznaky vertebrobazilární insuficience či ischemie levé horní končetiny. Nejsilnějším prediktorem je ICHDK. V těchto případech je na místě podrobnější vyšetření (duplexní sonografie, CT, MR, angiografie). Dalším postupem je pak před kardiochirurgickým zákrokem PTA a stenting, nebo během operace našití volného štěpu LIMA na aortu. Pokud zůstane stenóza ASS nezjištěna, nebo pokud vznikne až po CABG, může se kromě výše uvedených příznaků v různě dlouhém časovém odstupu projevit ischemií myokardu. Koronarografické vyšetření pak odhalí steal fenomén s obrácením toku v LIMA a angiografie a. subclavia následně potvrdí její stenózu či uzávěr. Dalším krokem je buď operační přemostění stenózy ASS (s prokázanou dlouhodobou průchodností 90 %) nebo perkutánní intervence, která je méně invazivní a rovněž přináší úlevu od symptomů, i když dlouhodobé riziko restenózy ASS je o něco vyšší. Je proto vhodné klinické sledování. Při vzniku akutního koronárního syndromu na podkladě CSS je možným řešením transpozice LIMA na aortu, případně PTCA nativních koronárních tepen.
MUDr. Vít Gloger
e-mail: glogerv@seznam.cz
www.kntb.cz
Doručeno do redakce: 17. 5. 2012
Přijato po recenzi: 29. 8. 2012
Zdroje
1. Harjola PT, Valle M. The Importance of aortic arch or subclavian angiography before coronary reconstruction. Chest 1974; 66 : 436–438.
2. Takach TJ, Reul GJ, Cooley DA et al. Myocardial Thievery: The Coronary-Subclavian Steal Syndrom. Ann Thorac Surg 2006; 81 : 386–392.
3. Guidelines and indications for coronary artery bypass graft surgery. A report of the American College of Cardiology/American Heart Assosiation Task Force on Assessment of Diagnostic and Therapeutic Cardiovascular Procedures [Subcomitee on Coronary Bypass Graft Surgery]. J Am Coll Cardiol 1991; 17 : 543–589.
4. Takach TJ, Reul GJ, Duncan JM et al. Concomitant brachiocephalic and coronary artery disease: outcome and decision analysis. Ann Thorac Surg 2005; 80 : 564–569.
5. Cardon A, Leclercq C, Brenugat S et al. Coronary subclavian steal syndrome after left internal mammary bypass in a patient with Takayasu´s disease. J Cardiovasc Surg [Torino] 2002; 43 : 471–473.
6. Hull MC, Morris CG, Pepine CJ et al. Valvular dysfunction and carotid, subclavian, and coronary artery disease in survivors of Hodgkin lymphoma treatitd with radiation therapy. JAMA 2003; 290 : 2831–2837.
7. Crowley SD, Butterly DW, Peter RH et al. Coronary steal from a left internal mammary artery coronary bypass graft by a left upper extremity arteriovenous hemodialysis fistula. Am Kidney Dis 2002; 40 : 852–855.
8. McMahon CJ, Thompson KS, Kearney DL et al. Subclavian steal syndrome in anomalous connection of left subclavian artery to the pulmonary artery in d-transposition of the great arteries. Pediatr Cardiol 2001; 22 : 60–62.
9. Shadman R, Criqui MH, Bundens WP et al. Subclavian artery stenosis: Prevalence, risk factors, and association with cardiovascular diseases. J Am Coll Cardiol 2004; 44 : 618–623.
10. Osborn LA, Vernon SM, Reynolds B et al. Screening for subclavian artery stenosis in patients who are candidates for coronary bypass surgery. Catheter Cardiovasc Interv 2002; 56 : 162–165.
11. English JA, Carell ES, Guidera SA et al. Angiographic prevalence and clinical predictors of left subclavian stenosis in patients undergoing diagnostic cardiac cathetrization. Catheter Cardiovac Interv 2001; 54 : 8–11.
12. Lobato EB, Kern KB, Bauder-Heit J et al. Incidence of coronary-subclavian steal syndrome in patients undergoing noncardiac surgery. J Cardiothorac Vasc Anesth 2001; 15 : 689–692.
13. Rogers JH, Calhoun RF2nd. Diagnosis and management of subclavian artery stenosis prior to coronary artery bypass grafting in the current era. J Card Surg.2007; 22 : 20–25.
14. Bilku RS, Khogali SS, Been M. Subclavian artery stenosis as a cause for recurrent angina after LIMA graft stenting. Heart 2003; 89 : 1429.
15. Edwards WH. An unsuspected cause for recurrent angina: subclavian artery stenosis. Am Surg 1995; 61 : 1057–1060.
16. Komenaka IK, Nguyen ET, Oyogoa SO et al. Subclavian steal syndrome in acute myocardial infarction masquerading as acute embolism to left upper extremity: a case report. Angiology 2004; 55 : 209–212.
17. Fitz-Gibbon GM, Keon WJ. Coronary subclavian steal: a recurrent case with notes on detecting the threat potential. Ann Thorac Surg 1995; 60 : 1810–1812.
18. Blemker DL, Trippi JA. Coronary-subclavian steal as a cause of dyspnea. Indiana Med 1992; 85 : 136–138.
19. Kursaklioglu H, Kose S, Iyisoy A et al. Coronary-subclavian steal syndrome presenting with ventricular tachycardia. Yonsei Med J 2009; 50 : 852–855.
20. Bryan FC, Allen RC, Lumsden AB. Coronary-subclavian steal syndrome: report of five cases. Ann Vasc Surg 1995; 9 : 115–122.
21. Elian D, Gerniak A, Guetta V et al. Subclavian coronary steal syndrome: an obligatory common fate betwean subclavian artery, internal mammary graft and coronary circulation. Cardiology 2002; 97 : 175–179.
22. Bates MC, Broce M, Lavigne PS et al. Subclavian artery stenting: Factors infuencing long-term outcome. Catheter Cardiovasc Interv 2004; 61 : 5–11.
23. Tatoulis J, Buxton BF, Fuller JA. Patencies of 2127 arterial to coronary conduits over 15 years. Ann Thorac Surg 2004; 77 : 93–101.
24. Takach TJ, Reul GJ, Duncan JM et al. Concomitant brachiocephalic and coronary artery disease: outcome and decision analysis. Ann Thorac Surg 2005; 80 : 564–569.
25. Paty PS, Mehta M, Darling RC 3rd et al. Surgical treatment of coronary subclavian steal syndrome with carotid subclavian bypass. Ann Vasc Surg 2003; 17 : 22–26.
26. Iwaki H, Kuraoka S, Tatebe S. Coronary subclavian steal syndrome: report of a case. Kyobu Geka 2003; 56 : 235–238.
27. Chung DA, Large SR. Relocation of the internal mammary artery graft in a case of coronary-subclavian steal. Thorac Cardiovasc Surg 2000; 48 : 39–40.
28. Serryus PW, Morice MC, Kappetein AP et al. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary disease. N Engl J Med 2009; 360 : 961–972.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 11- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Adiponektin ve vztahu k ledvinné dysfunkci u nemocných s diabetes mellitus 2. typu – editorial
- Profylaxe tromboembolické nemoci včera, dnes a zítra – editorial
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta – editorial
- Kostní minerální denzita u nemocných s chronickým selháním ledvin při zahájení hemodialyzační léčby
- Adiponektín vo vzťahu k obličkovej dysfunkcii u chorých s diabetes mellitus 2. typu
- Je syndróm polycystických ovárií asociovaný s autoimunitnou tyreoiditídou?
- Revmatoidní artritida – nezávislý rizikový faktor kardiovaskulárních onemocnění
- Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
- Kombinovaná kinezio-flebotromboemboloprofylaxia, mechano-flebotromboemboloprofylaxia a farmako-flebotromboemboloprofylaxia vénovej tromboembólie v internej medicíne
- Účinnost lenalidomidu u vzácných krevních chorob: u histiocytózy z Langerhansových buněk, multicentrické Castlemanovy choroby, POEMS syndromu, Erdheimovy-Chesterovy choroby a angiomatózy. Popis případů a přehled literatury
- Karcinoid a jeho kardiální manifestace
- Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
- Neobvyklá příčina defektu nohy u nemocného s diabetes mellitus
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta
- Každý tep se počítá
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
- Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta
- Karcinoid a jeho kardiální manifestace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



