-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Účinnost lenalidomidu u vzácných krevních chorob: u histiocytózy z Langerhansových buněk, multicentrické Castlemanovy choroby, POEMS syndromu, Erdheimovy-Chesterovy choroby a angiomatózy. Popis případů a přehled literatury
The effect of lenalidomide on rare blood disorders: Langerhans cell histiocytosis, multicentric Castleman disease, POEMS syndrome, Erdheim-Chester disease and angiomatosis
Lenalidomide has been licenced for the treatment of multiple myeloma and, in 2012, it is used as a standard treatment of relapses of the disease. Literature contains a number of publications on the effects of lenalidomide in myelodysplastic syndrome, in malignant lymphomas and chronic B lymphocytic leukaemia. The effects of the drug in rare diseases, however, have not been investigated so far. In this paper, we summarize our experience with lenalidomide in rare blood disorders. We observed an excellent effect of lenalidomide in multifocal aggressive, repeatedly relapsing Langerhans cell histiocytosis where it led to complete remission. This patient was treated with 2-chlorodeoxyadenosine and with CHOEP (cyclophosphamide, etoposide, doxorubicin, vincristine and prednisone) chemotherapy and high dose BEAM chemotherapy with autologous transplantation of haematopoietic tissue for an early disease relapse. Following another early relapse, the patient was treated with lenalidomide (25 mg). Treatment with lenalidomide induced complete remission on PET-CT. The patient was consolidated during the remission with a reduced intensity conditioning regimen and allogeneic transplantation of haematopoietic tissue. Following allogeneic transplantation, the patient has been in full remission for 10 months. We further showed an excellent effect of lenalidomide in multicentric Castleman disease with generalized involvement of lymphatic nodes, B symptoms and vasculitis. The patient was first treated R-CHOP chemotherapy (rituximab, cyclophosphamide, adriamycin, vincristine and prednisone). Due to a lack of efficacy, this was changed to the CVD combination (cyclophosphamide, thalidomide, dexamethazone). This treatment delivered complete remission but was complicated by thalidomide-associated neuropathy. Due to persistent neuropathy, thalidomide could not be used to manage further relapse and thus lenalidomide (25 mg, 11 cycles) was used. The patient has been in complete PET-CT remission for 7 months following this treatment. We observed partial efficacy in Erdheim-Chester disease. We used 2-chlorodeoxyadenosine as part of initial treatment that delivered partial regression of brain infiltrates only; fluorodeoxyglucose accumulation in the bones has not changed. Lenalidomide 25 mg was used as second line treatment. This led to complete regression of CNS infiltrates on MRI but fluorodeoxyglucose accumulation in bone lesions did not change. Regression of clinical signs and regression of fibrosis of retroperitoneum was achieved with an ongoing treatment with anakinra. A patient with multiple angiomatosis affecting the abdominal cavity, mediastinum and vertebrae and digestive tract had been stabilized with zoledronate (4 mg once every 2 months) and thalidomide (100 – 200 mg/den) for several years. However, several years of this treatment led to severe neuropathy. Consequently, we attempted to substitute thalidomide for lenalidomide. However, 10 mg of lenalidomide alone was not sufficiently effective and thus low dose of 50 mg of thalidomide was added. Combined treatment with zoledronate, lenalidomide 10 mg/day and thalidomide 50 mg/day stabilized the condition for 9 months. Due to relapsed gastrointestinal bleeding the treatment had to be changed after 9 months to thalidomide 100 mg/day and Sandostatin 0.1 mg twice daily s.c. A patient with osteosclerotic myeloma and POEMS syndrome was initially treated with CAD chemotherapy (cyclophosphamide, adriamycine and dexamethazone) that was followed by tandem high dose chemotherapy (melphalan 100 mg/m2) and autologous transplantation. Treatment with thalidomide was given due to insufficient efficacy but was not tolerated. Lenalidomide was administered as the fourth line treatment. Even though literature describes remission of POEMS syndrome following lenalidomide, four cycles did not lead to remission in our patient. Conclusion: We showed an effect of lenalidomide in Langerhans cell histiocytosis and in Castleman disease. The treatment led to regression of brain infiltrates in a patient with Erdheim-Chester disease. A dose of 10 mg of lenalidomide daily in combination with 50 mg of thalidomide stabilized a course of angiomatosis. Lenalidomide did not deliver the required treatment response in a patient with POEMS syndrome and multiple previous therapies.
Key words:
lenalidomide – thalidomide – cladribin – anakinra – Langerhans cell histiocytosis – Erdheim-Chester disease – Castleman disease – POEMS syndrome – angiomatosis
Autori: Z. Adam 1; L. Pour 1; M. Krejčí 1; L. Zahradová 1; P. Szturz 1; R. Koukalová 2; Z. Řehák 2; T. Nebeský 3; R. Hájek 1; Z. Král 1; J. Mayer 1
Pôsobisko autorov: Interní hematologická a onkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení nukleární medicíny, centrum PET Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák 2; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc., MBA 3
Vyšlo v časopise: Vnitř Lék 2012; 58(11): 856-866
Kategória: Kazuistiky
Súhrn
Lenalidomid je registrovaným lékem pro mnohočetný myelom. V roce 2012 je standardně používán pro léčbu relapsu této nemoci. V literatuře je hodně publikací o účinku lenalidomidu u myelodysplastického syndromu, dále u maligních lymfomů a chronické B lymfocytární leukemie. U vzácných krevních chorob však zatím nebyl testován. V této práci sumarizujeme naše zkušenosti s účinností lenalidomidu u vzácných krevních chorob. Prokázali jsme excelentní účinek lenalidomidu, dosažení kompletní remise, u multifokální agresivní, opakovaně recidivující histiocytózy z Langerhansových buněk. Tento pacient byl léčen 2-chlorodeoxyadenosinem, pro časný relaps nemoci byl léčen chemoterapií CHOEP (cyklofosfamid, etoposid, doxorubicin, vinkristin a prednison) a vysokodávkovanou chemoterapií BEAM (BCNU, etoposid, cytosin-arabinosid, melfalan)s autologní transplantací krvetvorné tkáně. Při dalším časném relapsu byl léčen lenalidomidem (25 mg). Léčba lenalidomidem indukovala kompletní remisi dle PET-CT hodnocení. Pacient byl v remisi konsolidován přípravným režimem s redukovanou intenzitou a alogenní transplantací krvetvorné tkáně. Toho času je pacient 10 měsíců po alogenní transplantaci v kompletní remisi. Dále jsme prokázali excelentní účinek lenalidomidu u multicentrické Castlemanovy choroby s generalizovaným postižením lymfatických uzlin, B symptomy a vaskulitidou. Léčba byla zahájena chemoterapií R-CHOP (rituximab, cyklofosfamid, adriamycin, vinkristin a prednison). Pro neúčinnost této léčby změněno na kombinaci CVD (cyklofosfamid, thalidomid, dexametazon). Tato léčba vedla ke kompletní remisi, ale komplikovala ji neuropatie po thalidomidu. Při relapsu nešlo pro přetrvávající neuropatii použít thalidomid, proto byl podán lenalidomid (25 mg, 11 cyklů). Po této léčbě je pacient již 7 měsíců v kompletní remisi dle PET-CT hodnocení. Parciální léčebný efekt jsme prokázali u Erdheimovy-Chesterovy nemoci. V rámci iniciální léčby byl použit 2-chlorodeoxyadenosin. Po něm jen částečně regredovaly infiltráty v mozku, akumulace fluorodeoxyglukózy v kostech se nezměnila. V rámci druhé linie léčby byl použit lenalidomid 25 mg. Při této léčbě kompletně vymizely infiltráty v CNS dle MR hodnocení, ale nezměnila se akumulace fluorodeoxyglukózy v kostních ložiscích. Ústup klinických příznaků a regresi fibrózy retroperitonea navodila probíhající léčba anakinrou. Pacienta s mnohočetnou angiomatózou, postihující břišní dutinu, mediastinum a obratle a trávicí trubici, jsme po několik let stabilizovali zoledronatem (4 mg 1krát za 2 měsíce) a thalidomidem (100–200 mg/den). Tato léčba však způsobila po letech těžkou neuropatii. Proto jsme zkoušeli vyměnit thalidomid za lenalidomid. Samotný lenalidomid v dávce 10 mg však nebyl dostatečně účinný. Proto jsme k němu přidali thalidomid v nízké dávce 50 mg. Kombinovaná léčba, zoledronat, lenalidomid 10 mg/den a thalidomid 50 mg/den stabilizovala stav na 9 měsíců. Pro obnovení krvácení do trávicí trubice jsme po 9 měsících museli změnit léčbu na thalidomid 100 mg/den a přidat Sandostatin 0,1 mg 2krát denně s.c. Nemocná s osteosklerotickým myelomem a POEMS syndromem (což je akronym pro polyneuropatii, organomegalii, endokrinopatii, monoklonální gamopatii a kožní změny) byla léčena iniciálně chemoterapií CAD (cyklofosfamid, adriamycin a dexametazon) s následující tandemovou vysokodávkovanou chemoterapií (melfalan 100 mg/m2) a autologní transplantací. Pro nedosažení kompletní remise byla podána léčba s thalidomidem, který netolerovala. V rámci čtvrté linie léčby byl použit lenalidomid. Po 4 cyklech nebyla dosažena léčebná odpověď, ačkoliv jinak odborná literatura popisuje remise POEMS syndromu po léčbě lenalidomidem. Závěr: Prokázali jsme účinek lenalidomidu u histiocytózy z Langerhansových buněk a u Castlemanovy nemoci. U Erdheimovy-Chesterovy nemoci vymizely v průběhu léčby infiltráty v mozku. Lenalidomid v dávce 10 mg denně v kombinaci s 50 mg thalidomidu stabilizoval průběh angiomatózy. Pouze u pacientky s POEMS syndromem a četnými předchozími léčebnými liniemi nenavodil lenalidomid očekávanou léčebnou odpověď.
Klíčová slova:
lenalidomid – thalidomid – kladribin – anakinra – histiocytóza z Langerhansových buněk – Erdheimova-Chesterova choroba – Castlemanova choroba – POEMS syndrom – angiomatózaÚvod
Lanalidomid je dnes standardním lékem pro mnohočetný myelom. V České republice se používá pro léčbu recidivy mnohočetného myelomu. Jako iniciální léčba mnohočetného myelomu je zatím používán jen v rámci klinických studií. Nižší dávky lenalidomidu se osvědčily u mnohočetného myelomu jako udržovací léčba, která je podávána dlouhodobě, až do recidivy nemoci. Tato udržovací léčba má potenciál oddálit recidivu nemoci. Pro rozhodování o aplikaci lenalidomidu pacientům s mnohočetným myelomem je vždy zásadní správně vyhodnotit aktivitu nemoci a potřebu léčby. Tento problém byl v České republice intenzivně analyzován mnoha autory [1–14].
Lenalidomid se také standardně používá u subtypu myelodysplastického syndromu s 5q - [15,16].
V literatuře lze však nalézt informace o mnoha dalších chorobách, u nichž byla prokázána účinnost lenalidomidu. V četných publikacích, jejichž závěry shrnujeme v diskuzi, je dokumentována účinnost lenalidomidu u maligních lymfomů, u Hodgkinova lymfomu a dále u chronické B lymfocytární leukemie.
Když se podíváme do oblasti solidních tumorů, tak i u těchto chorob byly publikovány zprávy, které popisují protinádorový účinek lenalidomidu. Poslední publikovaný přehled zkušeností s lenalidomidem u solidních tumorů uvádí léčebné odpovědi u pacientů s karcinomem prostaty, karcinomem štítné žlázy, s hepatocelulárním, pankreatickým i renálním karcinomem a také u pacientů s melanomem [17,18].
Naproti tomu v literatuře chybí informace o účinnosti lenalidomidu u vzácných chorob. Díky podpoře firmy CELGENE jsme měli možnost získat zkušenosti s léčbou některých vzácných chorob lenalidomidem. Cílem tohoto textu je shrnout tyto zkušenosti.
Popis případů
Léčba agresivní formy histiocytózy z Langerhansových buněk lenalidomidem
Histiocytóza z Langerhansových buněk (LCH) u dospělých je ve většině případů příznivě probíhající nemocí. Zcela ojediněle se však vyskytne LCH s multisystémovým (multiorgánovým) postižením, která nereaguje na klasickou léčbu první linie (vinblastin, merkaptopurin, prednison anebo etoposid) a nereaguje ani na léčbu 2-chlorodeoxyadenosinem. U těchto pacientů je nutno testovat jiné léčebné alternativy.
V roce 2009 jsme začali léčit pacienta s LCH, která způsobila generalizovanou lymfadenopatii, infiltrovala plicní parenchym a kůži. Aktivitu nemoci vždy provázely B symptomy (úbytek hmotnosti, subfebrilie a febrilie, noční pocení). Histologické vyšetření opakovaně prokázalo vyšší proliferační aktivitu, než je obvyklá u dospělých pacientů s LCH. Exprese proliferačního markeru Ki-67 dosahovala až 30 % a v zorném poli mikroskopu bylo 8–10 mitóz.
Proto byla léčba zahájena sběrem kmenových krvetvorných buněk z periferní krve po aplikaci stimulačního režimu (cyklofosfamid 2 g/m2 den 1 a etoposid 200 mg/m2 den 1–3). Následovala léčba 2-chlorodeoxyadenosinem, v prvních 3 cyklech v monoterapii, 5 mg/m2 s.c. den 1–5 ve 28denních cyklech, v dalších 3 cyklech v kombinaci s cyklofosfamidem, 150 mg/m2 den 1–5 a metylprednisolonem 250 mg den 1–5. Za 2 měsíce od ukončení léčby však nemoc relabovala. Tato časná recidiva byla léčena 4 cykly chemoterapie CHOEP. Po 4. cyklu CHOEP následovala vysokodávkovaná chemoterapie BEAM s transplantací autologních kmenových buněk. Dle kontrolního PET-CT bylo po této léčbě dosaženo kompletní remise. Ale za 5 měsíců od podání vysokodávkované chemoterapie došlo k relapsu LCH opět v uzlinách, v plicích, v kůži a i v kostech. Progrese byla dokumentována pomocí PET-CT vyšetření.
V rámci čtvrté linie léčby byl podán lenalidomid 25 mg denně po dobu 21 dní ve 28denních cyklech a 1krát týdně dexametazon 20 mg. Po 4. cyklu léčby lenalidomidem bylo provedeno kontrolní PET-CT vyšetření. Dle CT zobrazení došlo k výraznému (o > 50 %) zmenšení uzlin. Dle PET hodnocení došlo k výraznému poklesu akumulace fluorodeoxyglukózy v postižených uzlinách i v kostních ložiscích. Dle HRCT vymizely plicní nodularity. U pacienta poklesly hodnoty CRP v průběhu léčby a vystoupila hodnota hemoglobinu ze 110 g/l na 141 g/l. Takže po 4 cyklech bylo dosaženo parciální remise. Od 6. cyklu byl k dvojkombinaci lenalidomid a dexametazon přidán etoposid (100 mg i.v.) ve dnech 22, 23 a 24 výše uvedeného 28denního cyklu. Přidání etoposidu dále výrazně prohloubilo léčebnou odpověď. Celkem bylo podáno 11 cyklů této chemoterapie, která navodila dle kontrolního PET-CT kompletní remisi. V dosažené remisi byla provedena konsolidace pomocí alogenní transplantace kostní dřeně po přípravném režimu s redukovanou intenzitou (reduced intensity conditioning) FLAMSA bez amsakrinu. Při poslední kontrole v červenci roku 2012 byl 10 měsíců po alogenní transplantaci a byl bez recidivy nemoci.
Závěr: prokázali jsme léčebnou odpověď velmi agresivní formy LCH po podání lenalidomidu. Po 4 cyklech bylo dosaženo parciální remise a léčebná odpověď byla dále prohloubena kombinací lenalidomid, dexametazon a etoposid do kompletní remise.
Léčba Erdheimovy-Chesterovy choroby lenalidomidem
Erdheimova-Chesterova nemoc je velmi vzácná choroba dospělých, dle WHO klasifikace krevních chorob z roku 2009 patří mezi histiocytární choroby, do skupiny juvenilního xantogranulomu. Typicky způsobuje hyperostózu dlouhých končetin, fibrózu retroperitonea, zesílení stěny aorty a může tvořit i infiltráty ve stopce hypofýzy a v dalších částech mozku. Pacienti často mívají teploty způsobené touto nemocí a bolesti v dolních končetinách. Vzácnost těchto případů je důvodem, proč pro léčbu této nemoci neexistují žádná doporučení. Proto popisujeme naše zkušenosti s aplikací lenalidomidu u pacienta s malou léčebnou odpovědí po 2-chlorodeoxyadenosinu.
Prvním příznakem nemoci byl diabetes insipidus a v průběhu 4 let se postupně rozvíjející neurologické problémy (dysartrie, pravostranná hemiparéza). Diagnóza byla stanovena histologickým vyšetřením kostní dřeně lopaty kosti pánevní. V době stanovení diagnózy měl nemocný již vícečetné infiltráty v mozku, zesílenou stěnu hrudní a břišní aorty, fibrotické změny v retroperitoneu a typickou hyperostózu dlouhých kostí dolních končetin s vysokou akumulací jak techneciumpyrofosfátu, tak i fluorodeoxyglukózy.
Léčbu jsme zahájili monoterapií 2-chlorodeoxyadenosinem 5 mg/m2 s.c. 5 dní po sobě ve 28denních cyklech. V průběhu 3. cyklu na provedeném MR mozku nebyla zřetelná léčebná odpověď a tak 4.–6. cyklus probíhal ve složení 2-chlorodexyadenosin 5 mg/m2 + cyklofosfamid 150 mg/m2 + dexametazon 24 mg 1.–5. den ve 28denním cyklu. Po 6 cyklech bylo provedeno kontrolní MR vyšetření mozku, které prokázalo parciální regresi ložisek. Kontrolní PET-CT vyšetření však prokázalo nárůst akumulace fluorodeoxyglukózy v kostních ložiscích nemoci.
V rámci léčby druhé linie byl podán lenalidomid 25 mg denně 1.–21. den v 28denních cyklech. Tolerance lenalidomidu byla excelentní, počet neutrofilů a trombocytů byl po celou dobu léčby ve fyziologickém rozmezí. Kontrolní MR vyšetření prokázalo úplné vymizení ložisek v mozku. Kontrolní PET-CT vyšetření však prokázalo další nárůst akumulace fluorodeoxyglukózy v kostních ložiscích dolních končetin.
U pacienta došlo k parciální regresi ložisek Erdheimovy-Chesterovy nemoci v mozku po léčbě 2-chlorodeoxyadenosinovým režimem a ke kompletní regresi ložisek v mozku po léčbě lenalidomidem. V oblasti dlouhých kostí po celou dobu léčby narůstá akumulace fluorodeoxyglukózy. Příčinu, proč došlo v oblasti mozku ke kompletní regresi nemoci dle MR hodnocení, zatímco v oblasti dlouhých kostí nemoc dle PET-CT vyšetření progreduje, neumíme vysvětlit. Lenalidomid je perspektivní lék pro tuto nemoc, vyžadující další testování.
Léčba mnohočetné angiomatózy lenalidomidem
Mnohočetná angiomatóza je raritní onemocnění s postižením více orgánů a tkání angiomatózními útvary s rizikem smrtelného krvácení.
V tomto případě byly postiženy kosti, pleurální i peritoneální dutina a trávicí trubice. Pacient dlouhodobě dostává zoledronat, již po 2. dávce zoledronatu vymizely bolesti kostní. Účinnost antiangiogenních léků jsme hodnotili dle CT a MR zobrazení. Protože angiomatózní proliferace je spojena s chronickou diseminovanou intravaskulární koagulací (DIC) a anemizací, hodnotíme léčebnou odpověď také dle krevního obrazu a dle koncentrace fibrinogenu, D-dimerů a průkazu solubilních fibrinových monomerů.
Před léčbou byly hodnoty D-dimerů vyšší než 20 µg/ml, fibrinogen 1,4 g/l a byly přítomné solubilní fibrinové monomery.
Při léčbě interferonem α 6 mil. j. 3krát týdně s redukcí dávky po 10 měsících se zvýšil medián koncentrace fibrinogenu na 1,5 (1,2–2,0) g/l, poklesl medián hodnoty D-dimerů na 17,2 (13,4–20,0) µg/ml, stále byly přítomné fibrinové monomery.
Při terapii thalidomidem (100 mg/den) poklesl medián D-dimerů na 6,07 (4,71–10,21) µg/ml a zvýšil se medián hodnoty fibrinogenu na 1,9 g/l, solubilní fibrinové monomery nebyly průkazné. Dle CT zobrazení se výrazně zmenšily angiomatózní masy. Progredující neuropatie byla důvodem pro snížení dávky thalidomidu na 50 mg/den, při níž se ale zvýšily D-dimery. To signalizovalo, že thalidomid ve snížené dávce neudrží stabilitu nemoci. Protože lenalidomid má také antiangioproliferativní působení podobně jako thalidomid, ale nezpůsobuje neuropatii, chtěli jsme zjistit, zda antiangiogenní účinek lenalidomidu může tuto nemoc stabilizovat. Zvolili jsme dávku 10 mg, která by s velkou jistotou neměla způsobovat cytopenii a tedy trombocytopenii. Pokles počtu trombocytů byl u pacienta s krvácením z angiomatózy byl velmi nebezpečný.
Při podávání lenalidomidu 10 mg/den se zvýšil medián koncentrace D-dimerů na 10,8 (10,8–17,35) µg/ml a poklesla hodnota hemoglobinu na medián 124 (135–117) g/l. Opět byl pozitivní průkaz solubilních fibrinových monomerů. Z toho jsme vyvodili, že lenalidomid v dávce 10 mg denně nemá dostačující antiangioproliferativní účinek.
Proto jsme kombinovali nízkou dávku lenalidomidu 10 mg/den s thalidomidem 100 mg a posléze 50 mg denně. Při léčbě lenalidomidem 10 mg a thalidomidem 50 mg byl medián hodnoty D-dimerů 9,32 µg/ml a onemocnění bylo po 9 měsíců stabilní.
Thalidomid 100 mg/den stabilizoval mnohočetnou angiomatózu lépe než interferon α. Thalidomid 50 mg/den již neudržel stabilitu nemoci. Lenalidomid v dávce 10 mg byl dobře tolerován, ale tato dávka nedostačovala pro udržení stabilně nízkých hodnot D-dimerů a normální koncentrace hemoglobinu. Kombinace 10 mg lenalidomidu a 50 mg thalidomidu denně stabilizovala nemoc na dlouhých 9 měsíců. Lenalidomid v dávce 10 mg v kombinaci s thalidomidem představuje tedy jednu z alternativ pro léčbu mnohočetné angiomatózy, které nemá tak silné neurotoxické účinky jako thalidomid dlouhodobě podávaný ve vyšších dávkách.
Léčba multicentrické Castlemanovy choroby lenalidomidem
Muž, narozen roku 1961, byl k nám přijat v roce 2008 pro lymfadenopatii, vaskulitidu, neuropatii a stav po cévní mozkové příhodě, která velmi pravděpodobně souvisela s vaskulitidou. Histologické vyšetření opakovaně odebíraných uzlin bylo uzavřeno jako Castlemanova choroba, histologicky plazmocelulární multicentrický typ. Lymfadenopatie byla generalizovaná.
Léčba byla zahájena 3 cykly R-CHOP (rituximab, cyklofosfamid, adriamycin a dexametazon). Po 3 cyklech nebyl však zřetelný žádný léčebný účinek, a proto v této léčbě nebylo dále pokračováno. V březnu roku 2009 byla zahájena chemoterapie CTD (cyklofosfamid 50 mg denně, thalidomid 100 mg denně a dexametazon 20 mg 1.–4. den cyklu a 15.–18. den cyklu). Po 4 cyklech bylo dle PET-CT dosaženo parciální remise. V lednu roku 2010 byl ukončen 9. cyklus chemoterapie CTD. Po krátkém intervalu několika měsíců se však aktivita nemoci znovu obnovila. Projevila se jednak progresí lymfadenopatie a jednak projevy vaskulitidy na horních i dolních končetinách. Proto od dubna roku 2010 pokračovat léčba thalidomidem, cyklofosfamidem a pulzy dexametazonu. Z časné recidivy po přerušení léčby jsme získali dojem, že tato forma Castlemanovy choroby potřebuje léčbu založenou na thalidomidu trvale, jako takzvanou udržovací léčbu. Jenže léčba thalidomidem má své nežádoucí účinky (neuropatie, útlum vyšší mozkové činnosti a patologickou únavu – fatigue). Ke konci roku 2010 již byly nežádoucí účinky thalidomidu intenzivní a výrazně snižovaly kvalitu života nemocného. Proto jsme od listopadu roku 2010 zahájili léčbu lenalidomidem v klasickém dávkování, jak je běžné u mnohočetného myelomu (25 mg 1.–21. den cyklu). Cyklu se opakují ve 28–30denních intervalech. Důvod pro volbu lenalidomidu byl podobný mechanizmus účinku, jako má thalidomid, při absenci neurotoxicity.
Pacient dostal celkem 12 cyklů léčby lenalidomidem. Léčba byla ukončena v prosinci roku 2011. Kontrolní PET-CT vyšetření prokázalo zmenšení uzlin na fyziologické hodnoty a taktéž akumulace fluorodeoxyglukózy v uzlinách odpovídala fyziologickému nález. Další PET-CT vyšetření, provedené v červenci roku 2012, potvrdilo trvání kompletní remise nemoci.
Protože jde o první zkušenost s touto léčbou, zvažovali jsme, jak dále. Jedna možnost byla léčbu ukončit, pacienta sledovat metodou PET-CT vyšetření a léčbu obnovit až při prokázané recidivě nemoci. Alternativou by bylo podávat nižší dávky lenalidomidu podobně, jako se podává udržovací léčba u mnohočetného myelomu. Po diskuzi s plátcem zdravotní péče nebyla udržovací léčba podána.
Zajímavé a důležité je, že po celou dobu léčby lenalidomidem v dávce 25 mg jsme neměli žádnou cytopenii.
Léčba POEMS syndromu a osteosklerotického myelomu lenalidomidem
Žena, narozena roku 1944, k nám byla přijata v roce 2005 s diagnózou osteosklerotický myelom. Svými příznaky splňovala kritéria POEMS syndromu. Z příznaků POEMS byla přítomna těžká polyneuropatie, která velmi limitovala její chůzi. Endokrinopatie se manifestovala jako diabetes mellitus, který vyžadoval vysoké dávky inzulinu. Po vysokodávkované chemoterapii, spojené s poklesem monoklonálního imunoglobulinu, výrazně poklesla spotřeba inzulinu oproti stavu před zahájením cytostatické léčby. Pozdějším projevem endokrinopatie byla hypertyreóza. Koncentrace monoklonálního imunoglobulinu třídy IgG byla při stanovení diagnózy byla 17,7 g/l.
Na skeletu byla velmi jasná osteosklerotická ložiska. Obr. 1–3 ukazují, jak vypadá klasický myelom na RTG snímcích, a obr. 4–6, jak naopak vypadá člověk s osteosklerotickým myelomem na RTG snímcích.
Obr. 1. Předozadní RTG snímek s typickými osteolytickými ložisky pro mnohočetný myelom. 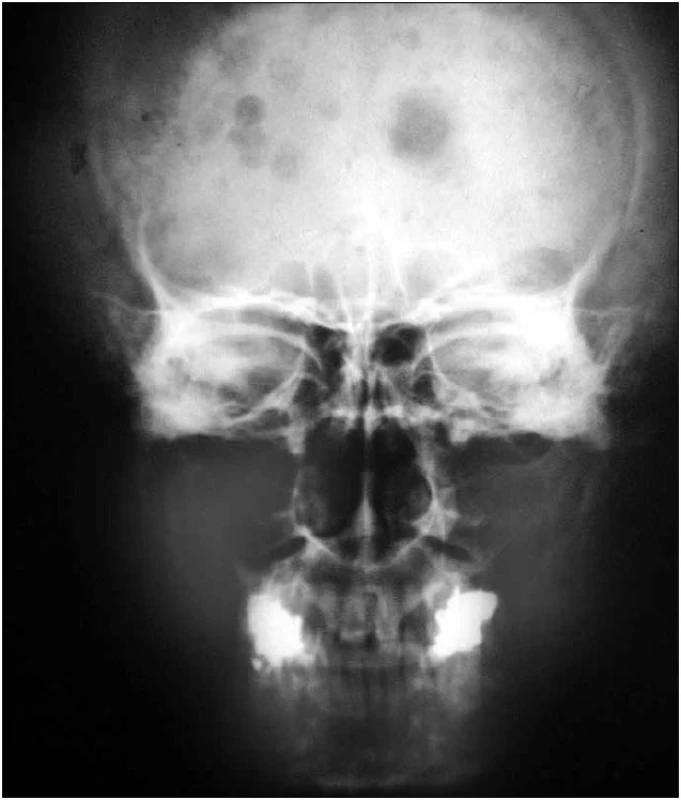
Obr. 2. Boční RTG snímek s typickým osteolytickými ložisky u pacienta s mnohočetným myelomem. 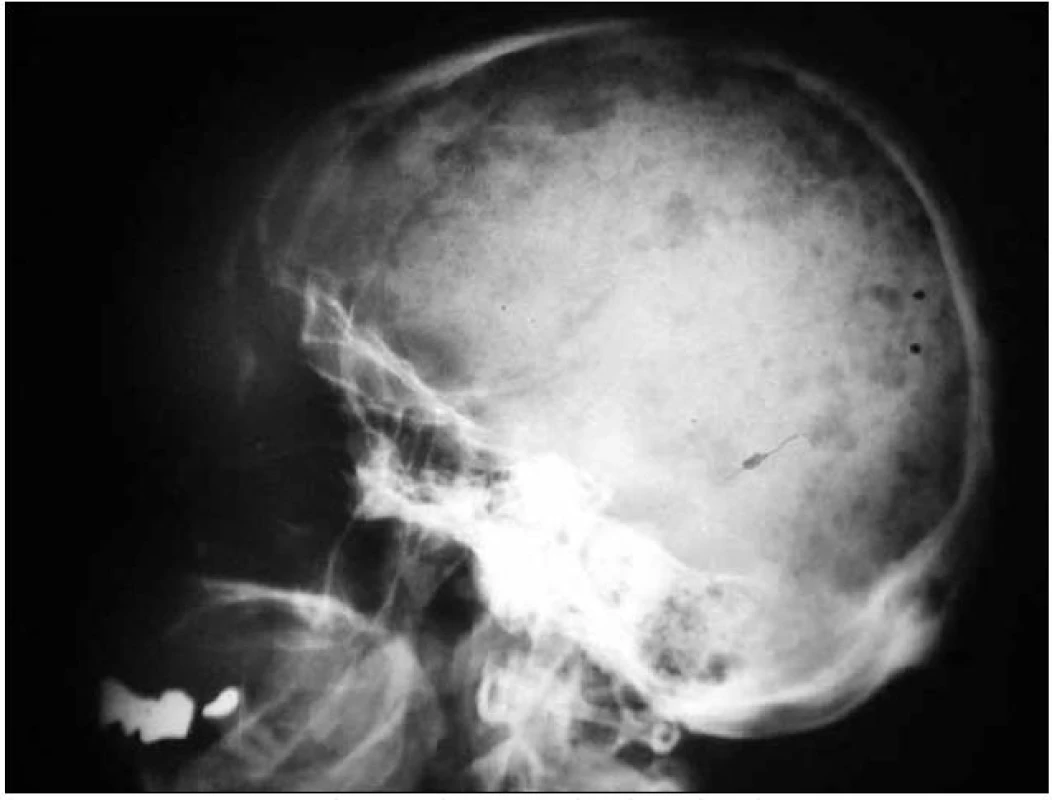
Obr. 3. RTG lebky s osteolytickými ložisky u pacienta s mnohočetným myelomem. 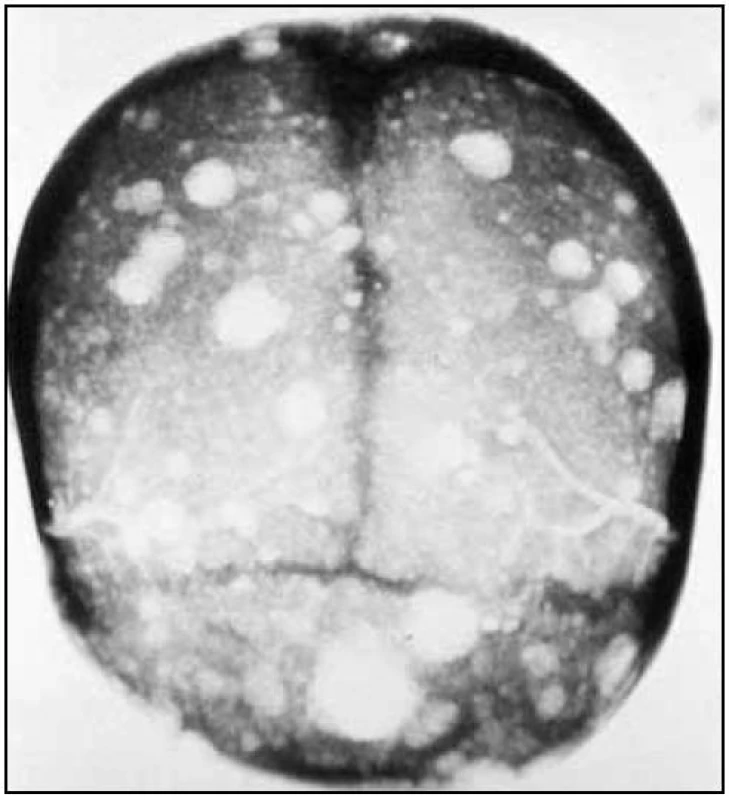
Obr. 4. Předozadní RTG snímek lebky s osteosklerotickými ložisky u pacientky s osteosklerotickým myelomem a POEMS syndromem. 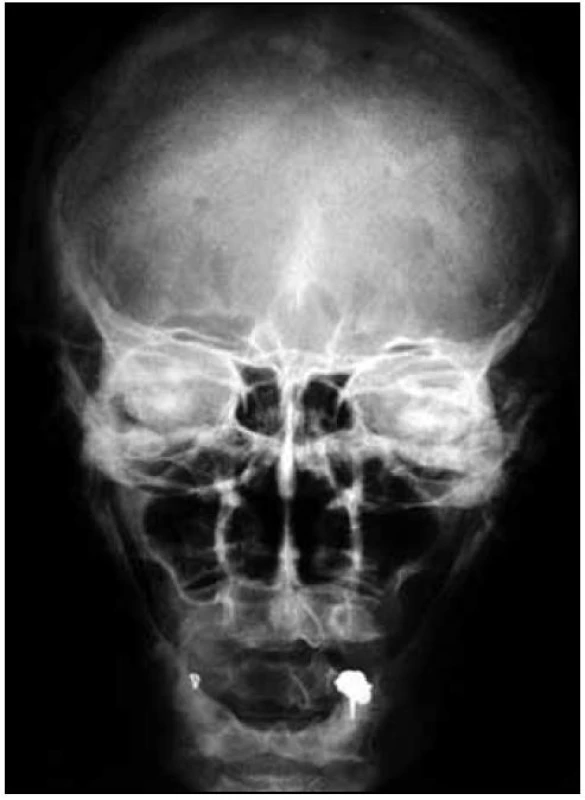
Obr. 5. Boční RTG snímek páteře u pacientky s osteosklerotickým mnohočetným myelomem a POEMS syndromem. 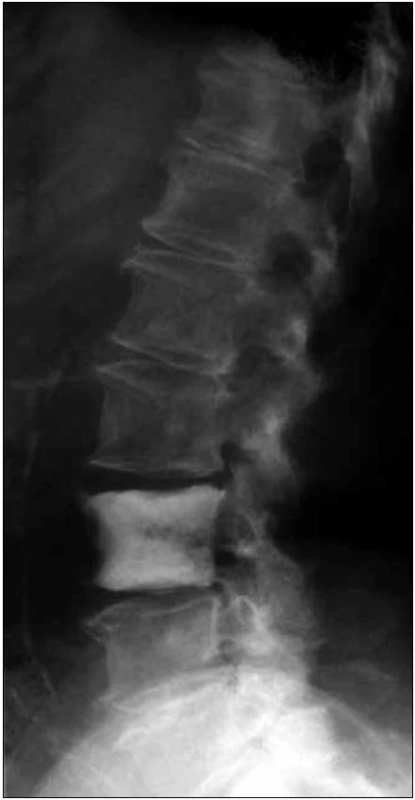
Obr. 6. Boční rentgenový snímek lebky u pacientky s osteosklerotickým mnohočetným myelomem a POEMS syndromem s četnými osteosklerotickými ložisky na lebce. 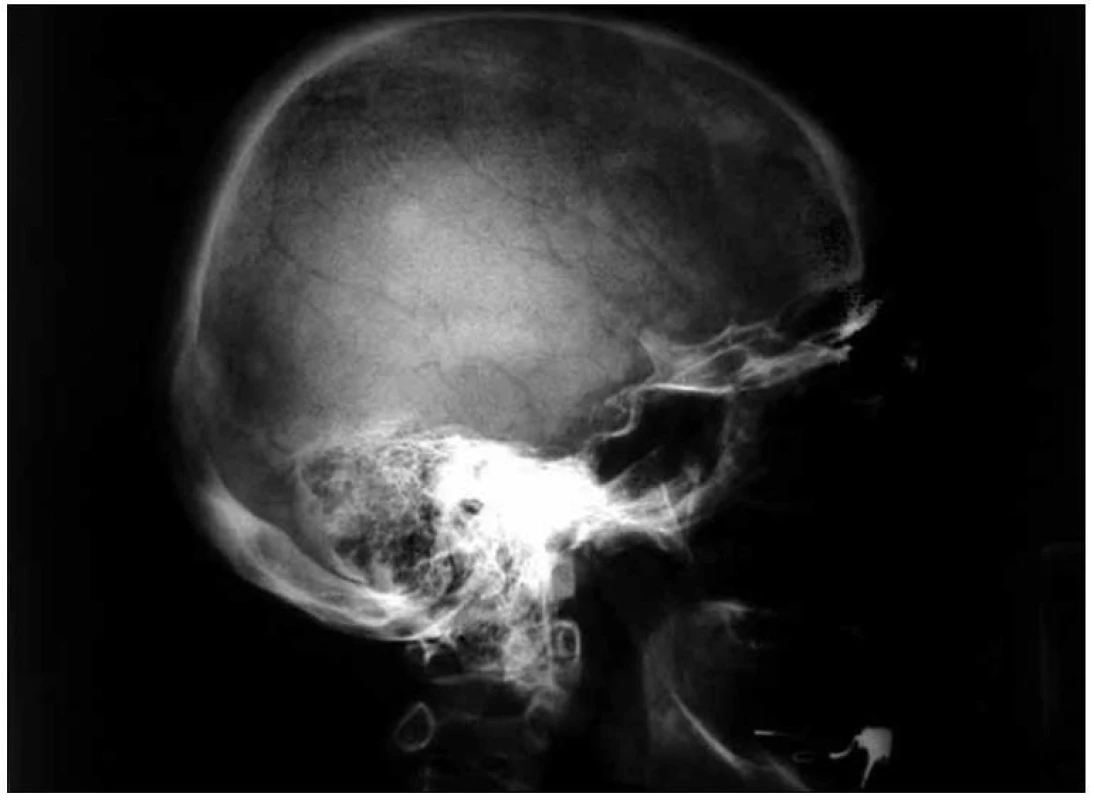
Obr. 7. Předozadní RTG snímek páteře u pacientky s osteosklerotickým mnohočetným myelomem a POEMS syndromem. 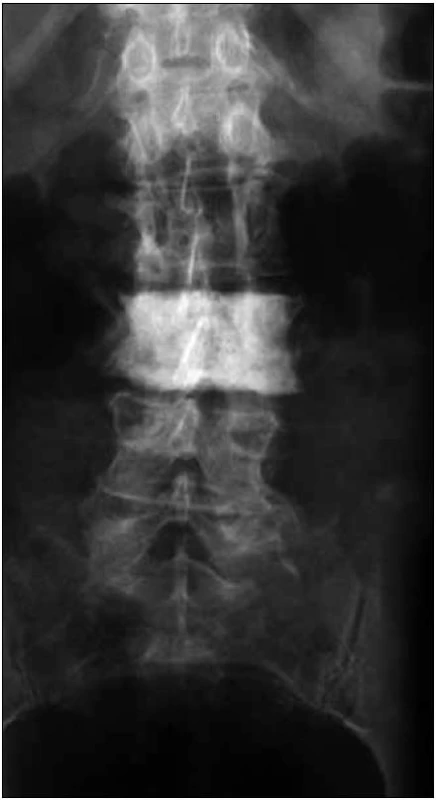
U pacientky jsme zahájili v roce 2005 chemoterapii CAD (cyklofosfamid, adriamycin a dexametazon) a tato léčba byla zakončena opakovanou (tandemovou) vysokodávkovanou chemoterapií (melfalan 100 mg/m2) s autologní transplantací krvetvorné tkáně. Tato léčba vedla k určitému poklesu monoklonálního imunoglobulinu ze 17 g/l na 11 g/l.
Vzhledem k tomu, že klinické symptomy, bolesti v osteosklerotických ložiscích a neuropatie trvaly dále, pokračovali jsme s další léčbou s cílem dosáhnout nulových hodnot monoklonálního imunoglobulinu.
V roce 2009 jsme podali chemoterapii CTD (cyklofosfamid, thalidomid a dexametazon), která byla pro nežádoucí účinky thalidomidu po 2 cyklech ukončena. Při startu CTD měla koncentraci monoklonálního imunoglobulinu 7,9 g/l, a jejím ukončení 6,0 g/l.
Od října roku 2010 jsme testovali lenalidomid 10 mg a při dobré toleranci jsme přešli na 25 mg. Podali jsme však pouze 3 cykly lenalidomidu 25 mg. Protože nedocházelo k poklesu monoklonálního imunoglobulinu (při zahájení měla 7,0 g/l, po 3 cyklech 9,2 g/l), tak jsme léčbu lenalidomidem ukončili.
Dále jsme testovali i účinek bortezomibu v redukované dávce 1,0 mg/m2 i.v. 1krát týdně celkem 3krát do měsíce. Podali jsme opět 4 cykly této léčby, ale protože jsme po ukončení 4. cyklu neviděli zásadní pokles monoklonálního imunoglobulinu, tak jsme v této léčbě nepokračovali. Nyní je pacientka bez léčby.
Když se podíváme na vývoj koncentrace monoklonálního imunoglobulinu, tak po žádné léčbě nebylo splněno kritérium parciální léčebné odpovědi, což je pokles o 50 % výchozí hodnoty. Nicméně koncentrace monoklonálního imunoglobulinu za celé sledované období výrazně poklesla, z 17,7 g/l na 7,4 g/l. Tento vývoj můžeme interpretovat buď jako spontánní vývoj nemoci, nebo jako opožděnou a pomalou reakci na podávané léčebné alternativy.
Diskuze
Thalidomid a lenalidomid patří do lékové skupiny zvané IMIDs (immunomodulatory drugs). Jejich protinádorový účinek je komplexní. Jsou známé četné molekulární mechanizmy, jak lenadomid ovlivňuje buňky. Je známo, že tyto léky zasahují do řízení imunitní odpovědi a také inhibičně ovlivňují proces angiogeneze. Z hlediska nežádoucích účinků se liší. U thalidomidu dominuje nežádoucí účinek na periferní, ale i centrální nervový systém, zatímco myelosupresivní účinek je velmi mírný až zanedbatelný. U lenalidomidu je tomu naopak, nemá výrazný negativní vliv na periferní nervový systém, zato má myelosupresivní účinek. Vzhledem k podobnému mechanizmu účinku jsme očekávali léčebný účinek lenalidomidu v podobných indikacích, jako je účinný thalidomid, a z toho jsme vycházeli při rozhodování o jeho použití.
O mechanizmu účinku a o přínosu thalidomidu a lenalidomidu pro mnohočetný myelomu bylo již hodně napsáno v české a slovenské odborné literatuře [19–25], a proto účinky těchto léků zde podrobně nerozvádíme. Díky tomu, že pacienti s mnohočetným myelomem byli vybráni jako první diagnóza pro registrační studie, mohou profitovat z této léčby.
Maligní lymfomy
V literatuře jsou však četné zprávy o účinnosti lenalidomidu u jiných diagnóz, než je mnohočetný myelom, i když pro tyto diagnózy není oficiálně registrován. V anglické literatuře se objevily již v roce 2008 první zprávy o použití lenalidomidu u maligních lymfomů. Klinické studie prokázaly, že je účinný u všech typů maligních lymfomů [26,27].
Lenalidomid byl testován u relabujících nebo refrakterních indolentních lymfomů nebo u indolentních lymfomů, které se v průběhu nemoci transformovaly v agresivní typy maligních lymfomů. V obou případech bylo u části nemocných dosaženo parciální nebo kompletní léčebné odpovědi. Účinnost byla prokázána i u agresivních lymfomů, a to jak u relabujících či refrakterních difuzních velkobuněčných B lymfomů, tak u T lymfomů. Přehled těchto zkušeností shrnuje tab. 1. Je z ní zřetelné, že lenalidomid může pomoci nemocným s maligními lymfomy, jejichž nemoc recidivuje či není citlivá na klasickou léčbu [28–39]. Lenalidomid má průnik do CNS a proto byl použit i u pacienta s maligním lymfomem mozku [40].
Tab. 1. Počet léčených odpovědí při léčbě lenalidomidem u relabujících/rezistentních maligních lymfomů. 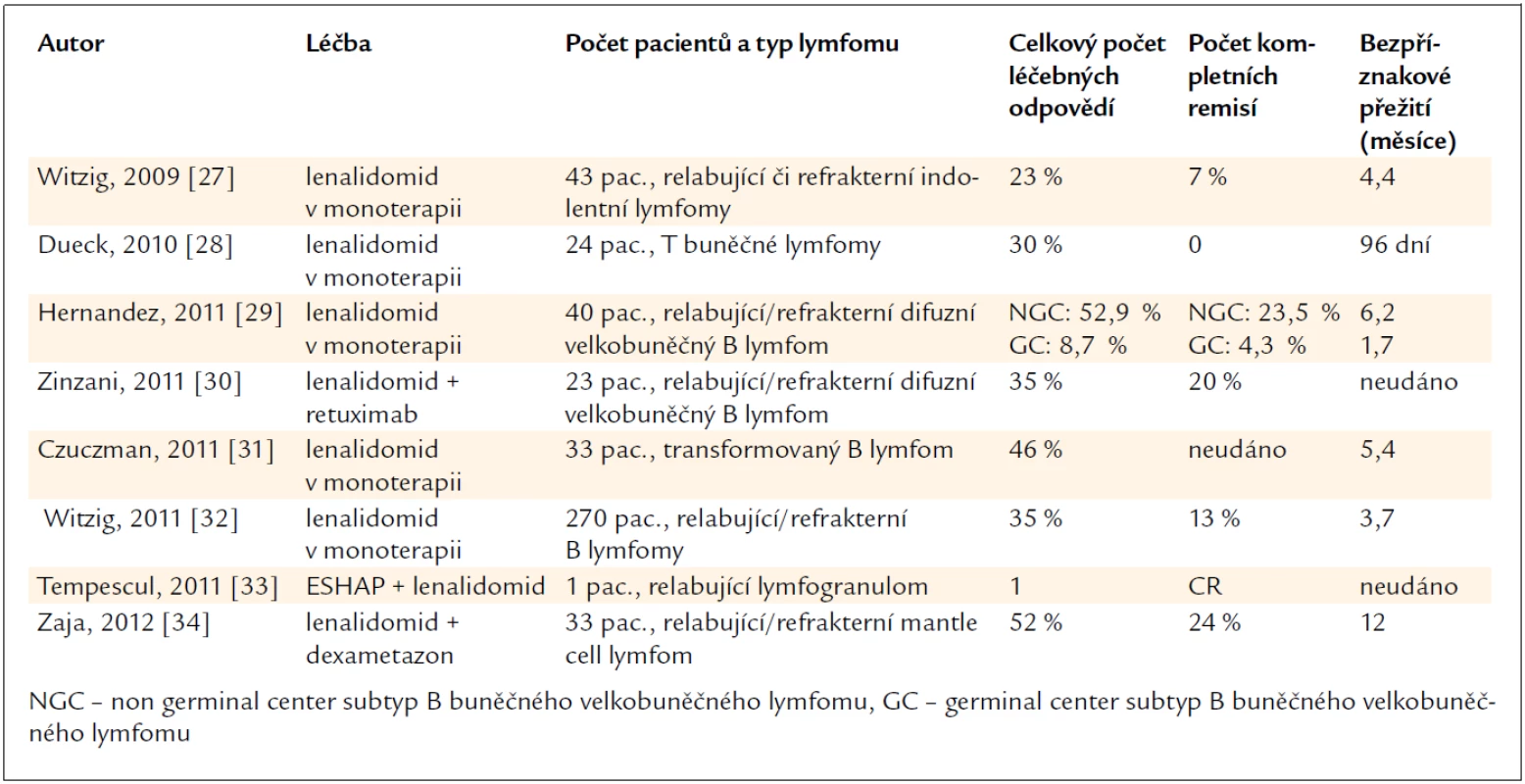
Chronická B lymfocytární leukemie
Chronická B lymfocytární leukemie (B-CLL) je další z lymfoproliferací, u níž byl použit lenalidomid. Oproti pacientům s maligními lymfomy je však nutné podávat u pacientů s chronickou lymfatickou leukemií nižší dávky lenalidomidu. U pacientů s chronickou lymfatickou leukemií byl pozorován zpočátku při zahájení léčby tzv. „tumor flare effect“ nebo dočasné vzplanutí aktivity nemoci. Tento fenomén byl u pacientů s chronickou B lymfocytární leukemií pozorován i při použití thalidomidu a je specifickým nežádoucím jevem, pozorovaným pouze u pacientů s B-CLL.
Dalším pozorovaným nežádoucím účinkem u malé části léčených pacientů s B-CLL byl „tumor lysis syndrome“ neboli „syndrom z náhlého rozpadu tumoru“.
Pacienti s chronickou B lymfocytární leukemií mívají masivně infiltrovanou kostní dřeň, a tak není překvapující, že myelosuprese je častým nežádoucím účinkem.
Proto u nemocných s B-CLL je doporučováno zpočátku podávat nižší dávky než u mnohočetného myelomu či u maligních lymfomů. U B-CLL se doporučuje začít nízkou dávkou lenalidomidu a postupně ji zvyšovat dle tolerance. V tab. 2 uvádíme přehled účinnosti lenalidomidu u B-CLL. Jak je vidět, již byly provedeny i klinické studie, v nichž byl lenalidomid podáván v rámci iniciální léčby s podstatně vyšším počtem léčebných odpovědí, než bylo popsáno u nemocných s relabující či rezistentní chorobou [41–54].
Tab. 2. Zkušenosti s lenalidomidem u pacientů s chronickou B lymfocytární leukemií. 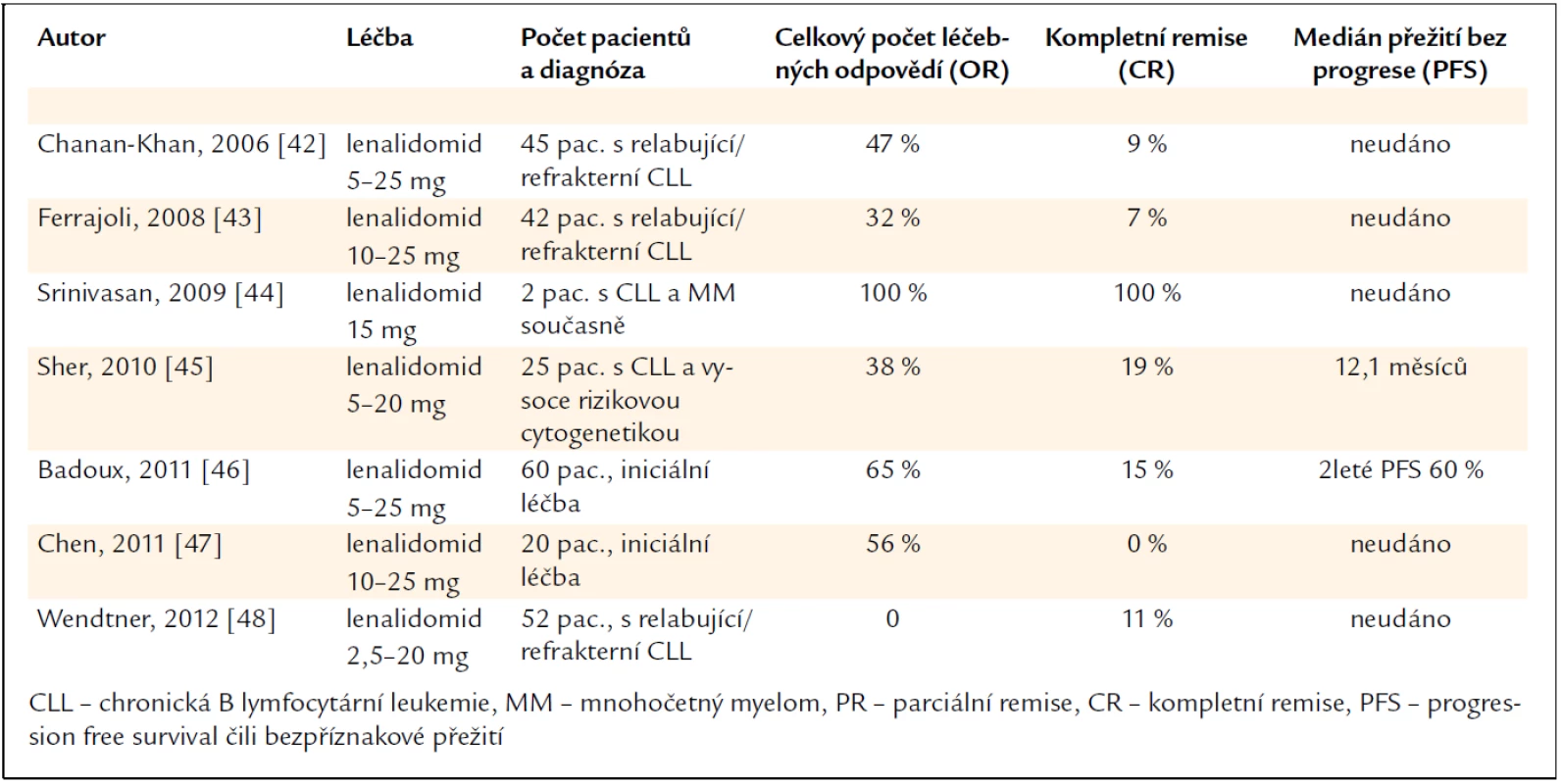
Výše uvedené informace lze shrnout, že lenalidomid je přínosem nejen pro pacienty s mnohočetným myelomem, ale také pro pacienty s dalšími lymfoproliferacemi.
Histiocytóza z Langerhansových buněk
Naše pracoviště se zaměřilo na otázku účinnosti lenalidomidu u dalších vzácných nemocí.
Prvním naším pacientem s jiným než lymfoproliferativním onemocněním byl mladý muž s vysoce agresivní generalizovanou histiocytózou z Langerhansových buněk. Histiocytóza z Langerhansových buněk mívá obvykle indolentní průběh, jak popisuje Ščudla [55]. U minority nemocných však má choroba velmi agresivní průběh vedoucí rychle ke smrti. Klasickou léčbou LCH je jednak vinblastin, kortikoidy a mertaktopurin, nověji pak 2-chlorodeoxyadenosin. U pacientů, kteří byli rezistentní na tuto léčbu, byl v literatuře popsán dobrý léčebný účinky thalidomidu.
Protože nemoc u tohoto pacienta byla vysoce agresivní a relabovala po intenzivních léčebných postupech, rozhodli jsme se pro podání ne thalidomidu, ale lenalidomidu. K upřednostnění lenalidomidu nás vedla zkušenost s lenalidomidem u mnohočetného myelomu, kdy lenalidomid je považován za účinnější než thalidomid. Průběh léčby jsme podrobně popsali a obrazově dokumentovali v předchozích publikacích [56, 57]. Důležitým pozorováním bylo, že lenadomid v dávce 25 mg nezpůsoboval žádnou hematologickou toxicitu. Vysvětlujeme si to tím, že pacienti, kteří nemají infiltrovanou kostní dřen, tolerují tento lék bez myelosuprese.
Erdheimova-Chesterova choroba
Erdheimova-Chesterova nemoc je další nemocí ze skupiny histiocytárních chorob. Je podstatně vzácnější, než je histiocytóza z Langerhansových buněk, a proto zkušenosti s léčbou jsou poměrně malé. Několik publikací popisuje léčebný efekt kladribinu a dále interferonu α. Zprávy o přínosu klasických cytostatik pro tuto diagnózu jsou velmi rozporuplné a neuvádějí dosažení dlouhodobější léčebné odpovědi. Na našem pracovišti jsme léčili v posledních 20 letech pouze 2 pacienty s touto diagnózou. Jiný náš pacient se dostal do kompletní remise po kladribinu. U tohoto popisovaného pacienta však nemoc na kladribin vůbec nereagovala. A tak jsme se rozhodli v rámci druhé linie otestovat lenalidomid.
Efekt jsme vyhodnocovali MR vyšetřením mozku a celotělovým PET-CT vyšetřením. Překvapením byly protichůdné výsledky léčby. V mozku došlo po ukončení léčby lanalidomidem k vymizení infiltrace při MR zobrazení, ale při celotělovém PET-CT vyšetření nedošlo u tohoto pacienta k regresi aktivity nemoci, tedy ke zmenšení akumulace fluorodeoxyglukózy v kostních ložiscích [58].
Vysvětlení pro tuto diskrepanci nemáme.
Mnohočetná angiomatóza
Lenalidomid má podobně jako thalidomid antiangiogenní účinky, tedy blokuje cévní novotvorbu. A tak se nabízí použít lenalidomid pro léčbu cévních neoplazií, podobně jako se již delší dobu používá thalidomid. Thalidomid používáme na našem pracovišti již mnoho let pro léčbu různých forem symptomatických angioproliferací s dobrým účinkem. V literatuře jsou četné publikace, popisující úspěšné použití thalidomidu u hemangiomů. Zatím jen několik publikací popisuje použití lenalidomidu u hemangiomů, konkrétně u střevních angiodysplazií [60,61].
Dle naší zkušenosti měla léčba lenalidomidem (10 mg/den v monoterapii) menší účinnost než léčba thalidomidem (100 mg/den v monoterapii). Nicméně oba dva léky lze kombinovat a dosáhnout tak žádoucího antiangiogenního účinku s menší intenzitou nežádoucích účinků [59].
Castlemanova choroba
Castlemanova choroba je nemoc mnoha klinických a histologických tváří. Existuje hyalinně vaskulární varianta, která bývá lokalizovaná, kdy stačí operace na vyléčení. Existují však i diseminované formy, pro které se používá termínu „multicentrické“, které mívají různé histologické typy, nejčastěji se popisuje plazmocelulární typ Castlemanovy nemoci. Plazmocyty bývají obvykle polyklonální. Nicméně Castlemanova nemoc není přesně patofyziologicky definována a někdy přechází do POEMS syndromu, což je akronym pro symptomy: Polyneuropathy, Organomegaly, Endokrinopathy, Monoclonal gammopathy, Skin changes. Tito pacienti mívají typicky osteosklerotické změny skeletu.
Castlemanova choroba je spojená s tvorbou četných cytokinů. Projevuje se jak lymfadenopatií, tak také systémovými příznaky jako maligními lymfomy, ale i vaskulitidou [62].
Léčba Castlemanovy nemoci je velmi různorodá. Z moderních léků nutno vyzvednou protilátky proti interleukinu 6, ale také klasickou chemoterapii a monoklonální protilátku antiCD20 rituximab. Podobně různorodé jsou zprávy o léčbě POEMS syndromu. Pro jeho léčbu se používají postupy shodné s léčbou mnohočetného myelomu, včetně vysokodávkované chemoterapie s autologní transplantací. Za příčinu neuropatie se považují extrémně vysoké hladiny vaskulárního endoteliálního růstového faktoru VEGF (vascular endothelial growth factor), a proto byla testována také monoklonální protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru, bevacizumab (Avastin) s protichůdnými závěry. Přínos bevacizumabu v této indikaci vyžaduje více zkušeností.
V literatuře je však i dosti zpráv z úspěšné léčbě thalidomidem a lenalidomidem u POEMS syndromu [62–79], zatímco léčba Castlemanovy nemoci lenalidomidem zatím nebyla popsána.
Na našem pracovišti jsme léčili jednoho pacienta s multicentrickou Castlemanovou chorobou, jak je výše popsáno. Předchozí cytostatické léčebné postupy byly neúčinné. Teprve léčba thalidomidem navodila remisi. Po přerušení však nemoc recidivovala, a tak bylo třeba dlouhodobé léčby thalidomidem. Jak známo, s narůstající délkou léčby thalidomidem se zvyšuje intenzita nežádoucích účinků thalidomidu, a tak jistě nikoho nepřekvapí, že po roční léčbě již nežádoucí účinky thalidomidu zásadně snižovaly kvalitu života nemocného.
Proto jsme použili lenalidomid. Pacient měl roční léčbu lenalidomidem. Dle kontrolního PET-CT po ukončení léčby zůstává nemoc v kompletní remisi a kompletní remise byla potvrzena PET-CT vyšetřením provedeném 7 měsíců od ukončení léčby [80].
POEMS syndrom (polyneuropatie, organomegalie, endokrinopatie, monoklonální gamapatie a kožní změny)
V literární databázi Medline je možné najít hodně publikací o léčbě POEMS syndromu lenalidomidem. A dle těchto zpráv je lenalidomid pro tyto nemocné přínosným lékem.
Na našem pracovišti jsme tento lék testovali také u POEMS syndromu. Pacientka s POEMS syndromem již byla dříve léčena klasickou chemoterapií, pak opakovanou vysokodávkovanou chemoterapií (melfalan 100 mg/m2). Dále byl u ní testován thalidomid. Léčba lenalidomidem probíhala pouze po 4 měsíce. Účinnost lenalidomidu jsme vyhodnocovali dle koncentrací monoklonálního imunoglobulinu, a když po 4 měsících nebylo dosaženo poklesu, byla léčba ukončena. Na neúčinnosti léčby se pravděpodobně podílely četné předchozí léčebné linie, protože jak známo, čím více předchozích léčebných linií, tím vyšší pravděpodobnost rezistentních klonů a tím menší pravděpodobnost další léčebné odpovědi. Proto by neúspěch lenalidomidu u této pacientky neměl odradit od jeho podávání, neboť v literatuře jsou četné publikace s pozitivním hodnocením léčby POEMS syndromu lenalidomidem [73–79].
Závěr pro praxi
Na našem pracovišti jsme testovali lenalidomid u 5 vzácných hematologických chorob. Prokázali jsme excelentní účinek u následujících diagnóz: histiocytóza z Langerhansových buněk, multicentrická Castlemanova choroba. Parciální léčebný efekt jsme prokázali u Erdheimovy-Chesterovy nemoci a mnohočetné angiomatózy. Pouze u nemocné s POEMS syndromem jsme nedocílili léčebného efektu, ačkoliv v literatuře je tato léčba popisována jako úspěšná. Domníváme se, že selhání účinku léčby lenalidomidem u pacientky s POEMS syndromem by mohl souviset s četnými předchozími léčebnými liniemi.
Léčba pacienta se uskutečnila za laskavé podpory firmy Celgene s. r. o.z projektu Compassionate Use Program určeného pro pacienty se vzácnými hematoonkologickymi onemocněními.
Práce byla vypracována v rámci aktivity následujících grantů: Výzkumného záměru MŠMT MSM0021622434, specifického výzkumu MUNI/A/0784/2011 a grantů IGA MZd NT11154, NT12130 a NT12215 a pak nově také „Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno)“
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 18. 6. 2012
Přijato po recenzi: 25. 7. 2012
Zdroje
1. Sčudla V, Pika T, Budíková M et al. Příspěvek k hodnocení vztahů mezi angiogenními cytokiny, vybranými biologickými parametry a prognostickými faktory u mnohočetného myelomu. Čas Lék Česk 2006; 145 : 929–935.
2. Sčudla V, Bačovský J, Indrák K et al. Výsledky léčby a změny v prognóze pacientů s mnohočetným myelomem v oblasti centrální a severní Moravy v posledních 40 letech. Vnitř Lék 2002; 48 : 707–717.
3. Sčudla V. Anémie chronických chorob. Standardy pro diagnostiku a léčbu. Vnitř Lék 2002; 48 : 422–426.
4. Minařík J, Pika T, Ba
ovský J et al. Prognostic value of hepatocyte growth factor, syndecan-1, and osteopontin in multiple myeloma and monoclonal gammopathy of undetermined significance. Scientific World Journal 2012; 2012 : 356128. Epub 2012 Apr 26.
5. Minařík J, Sčudla V, Bačovský J et al. Comparison of imaging methods in POEMS syndrome. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2012; 156 : 52–57.
6. Sčudla V, Minařík J, Pika T. Light chain deposition disease. Vnitř Lék 2012; 58 : 38–43.
7. Sčudla V, Petrová P, Minařík J et al. Analysis of the serum levels of selected biological parameters in monoclonal gammopathy of undetermined significance and different stages of multiple myeloma. Neoplasma 2011; 58 : 499–506.
8. Minařík J, Sčudla V, Tichý T et al. Induction treatment of light chain deposition disease with bortezomib: rapid hematological response with persistence of renal involvement. Leuk Lymphoma 2012; 53 : 330–331.
9. Sčudla V, Herman M, Minařík J et al. Přínos celotělové magnetické resonance pro diagnostiku monoklonální gammopatie nejistého významu a mnohočetného myelomu. VnitřLék 2011; 57 : 52–60.
10. Myslivrček M, Bačovský J, Sčudla V et al. 18F-FDG PET/CT a 99mTc-MIBI scintigrafie při hodnocení pacientů s mnohočetným myelomem a monoklonální gamapatií nejistého významu. Srovnání metod. Klin Onkol 2010; 23 : 325–331.
11. Bačovský J, Mysliveček M, Sčudla V et al. Tc-99m MIBI scintigraphy in multiple myeloma: prognostic value of different Tc-99m MIBI uptake patterns. Clin Nucl Med 2010; 35 : 667–670.
12. Sčudla V, Pika T, Budíková M et al. The relationship between some soluble osteogenic markers, angiogenic cytokines/other biological parameters and the stages of multiple myeloma evaluated according to the Durie-Salmon and International Prognostic Index stratification systems. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2009; 153 : 275–282.
13. Minařík J, Sčudla V, Ordeltová M et al. Prognostic significance of apoptotic index in multiple myeloma patients treated by conventional therapy and novel agents, thalidomide and bortezomib. Eur J Haematol 2009; 83 : 528–534.
14. Krejci M, Scudla V, Tothova E, et al. Long--term outcomes of autologous transplantation in multiple myeloma: significant survival benefit of novel drugs in post-transplantation relapse. Clin Lymphoma Myeloma. 2009; 9 (6): 436-442.
15. Beličková M, Čermák J, Dostálová Merkerová M et al. Changes Associated With Lenalidomide Treatment in the Gene Expression Profiles of Patients With Del(5q). Clin Lymphoma Myeloma Leuk 2012; 12 : 375-383.
16. Giagounidis AA, Kulasekararaj A, Germing U et al. Long-term transfusion independence in del(5q) MDS patients who discontinue lenalidomide. Leukemia 2012; 26 : 855–858.
17. Segler A, Tsimberidou AM. Lenalidomide in solid tumors. Cancer Chemother Pharmacol 2012; 69 : 1393–1406.
18. Gasent Blesa JM, Godoy MP, Esparcia MF et al. Response to Lenalidomide Therapy in a Pre-Treated Patient with Metastatic Prostate Cancer Refractory to Hormones and Chemotherapy: A Case Report. Case Rep Oncol 2012; 5 : 181–186.
19. Holánek M, Hájek R. Použití lenalidomidu pro léčbu mnohočetného myelomu. Klin Onkol 2010; 23 : 67–72.
20. Machálková K, Maisnar V. Léčba mnohočetného myelomu lenalidomidem. Klin Onkol 2009; 22 : 117–120.
21. Novotová E, Neuwirtová R, Jonášová A et al. Lenalidomid (Revlimid) v léčbě mnohočetného myelomu – první zkušenosti v České republice. Čas Lék Česk 2008; 147 : 623–626.
22. Kessler P. Profylaxe a léčbě trombembolismu v onkologii. Vnitř Lék 2009; 55 : 219–222.
23. Radocha J, Maisnar V. Nízké dávky thalidomidu u refrakterního a relaxujícího myelomu. Vnitř Lék 2007; 53 : 129–134.
24. Zbořil V. Idiopatické střevní záněty – současné léčebné možnosti. Vnitř Lék 2004; 50: (Suppl. 1): S94–S97.
25. Foldyna D, Kamelander J, Krejčí M et al. Žádoucí a nežádoucí účinky thalidomidu u pacientů s mnohočetným myelomem. Vnitř Lék 2003; 49 : 859–868.
26. Habermann TM. New developments in the management of diffuse large B-cell lymphoma. Hematology 2012; 17: (Suppl. 1): S93–S97.
27. Chanan-Khan AA, Cheson BD. Lenalidomide for the treatment of B-cell malignancies. J Clin Oncol 2008; 26 : 1544–1552.
28. Witzig TE, Wiernik PH, Moore T et al. Lenalidomide oral monotherapy produces durable responses in relapsed or refractory indolent non-Hodgkin’s lymphoma. J Clin Oncol 2009; 27 : 5404–5409.
29. Dueck G, Chua N, Prasad A et al. Interim report of a phase 2 clinical trial of lenalidomide for T-cell non-Hodgkin lymphoma. Cancer 2010; 116 : 4541–4548.
30. Hernandez Ilizaliturri FJ, Deeb G, Zinzani PL et al. Higher response to lenalidomide in relapsed/refractory difusse large B-cell lymphoma in non germinal center B-cell lie then in germinal center B-cell like phenotype. Cancer 2011; 117 : 5058–5066.
31. Zinzani PL, Pellegrini C, Gandolfi L et al. Combination of lenalidomide and rituximab in elderly patients with relapsed or refractory diffuse large B-cell lymphoma: a phase 2 trial. Clin Lymphoma Myeloma Leuk 2011; 11 : 462–466.
32. Czuczman MS, Vose JM, Witzig TE et al. The differential effect of lenalidomide monotherapy in patients with relapsed or refractory transformed non-Hodgkin lymphoma of distinct histological origin. Br J Haematol 2011; 154 : 477–481.
33. Witzig TE, Vose JM, Zinzani PL et al. An international phase II trial of single-agent lenalidomide for relapsed or refractory aggressive B-cell non-Hodgkin’s lymphoma. Ann Oncol 2011; 22 : 1622–1627.
34. Tempescul A, Ianotto JC, Eveillard JR et al. Chemotherapy regimen associated to lenalidomide induces complete isotopic remission in Hodgkin’s lymphoma relapsing after autologous stem cell transplantation. Ann Hematol 2011; 90 : 971–973.
35. Zaja F, De Luca S, Vitolo U et al. Salvage treatment with lenalidomide and dexamethasone in relapsed/refractory mantle cell lymphoma: clinical results and effects on microenvironment and neo-angiogenic biomarkers. Haematologica 2012; 97 : 416–422.
36. Habermann TM, Lossos IS, Justice G et al. Lenalidomide oral monotherapy produces a high response rate in patients with relapsed or refractory mantle cell lymphoma. Br J Haematol 2009; 145 : 344–349.
37. Musuraca G, Fattori PP, Ceccolini M et al. Prolonged 18FDG-PET negative complete remission in a heavily pretreated, elderly patient with diffuse large B cell lymphoma treated with lenalidomide, low dose dexamethasone, and colony stimulating factor. Am J Hematol 2011; 86 : 79–80.
38. Ivanov V, Tabouret E, Chuto G et al. Rituximab-lenalidomide-dexamethasone induces complete and durable remission in relapsed refractory diffuse large B-cell non-Hodgkin lymphoma. Leuk Lymphoma 2010; 51 : 1758–1760.
39. Böll B, Borchmann P, Topp MS et al. Lenalidomide in patients with refractory or multiple relapsed Hodgkin lymphoma. Br J Haematol 2010; 148 : 480–482.
40. Cox MC, Mannino G, Lionetto L et al. Lenalidomide for aggressive B-cell lymphoma involving the central nervous system. Am J Hematol 2011; 86 : 957–958.
41. Chanan-Khan AA, Chitta K, Ersing N et al. Biological effects and clinical significance of lenalidomide-induced tumour flare reaction in patients with chronic lymphocytic leukaemia: in vivo evidence of immune activation and antitumour response. Br J Haematol 2011; 155 : 457–467.
42. Andritsos LA, Johnson AJ, Lozanski G et al. Higher doses of lenalidomide are associated with unacceptable toxicity including life-threatening tumor flare in patients with chronic lymphocytic leukemia. J Clin Oncol 2008; 26 : 2519–2525.
43. Chanan-Khan A, Miller KC, Musial L et al. Clinical efficacy of lenalidomide in patients with relapsed or refractory chronic lymphocytic leukemia: results of a phase II study. J Clin Oncol 2006; 24 : 5343–5349.
44. Ferrajoli A, Lee BN, Schlette EJ et al. Lenalidomide induces complete and partial remissions in patients with relapsed and refractory chronic lymphocytic leukemia. Blood 2008; 111 : 5291–5297.
45. Srinivasan S, Schiffer CA. Concurrent B-cell chronic lymphocytic leukemia and multiple myeloma treated successfully with lenalidomide. Leuk Res 2009; 33 : 561–564.
46. Sher T, Miller KC, Lawrence D et al. Efficacy of lenalidomide in patients with chronic lymphocytic leukemia with high-risk cytogenetics. Leuk Lymphoma 2010; 51 : 85–58.
47. Badoux XC, Keating MJ, Wen S et al. Lenalidomide as initial therapy of elderly patients with chronic lymphocytic leukemia. Blood 2011; 118 : 3489–3498.
48. Chen CI, Bergsagel PL, Paul H et al. Single-agent lenalidomide in the treatment of previously untreated chronic lymphocytic leukemia. J Clin Oncol 2011; 29 : 1175–1181.
49. Wendtner CM. Lenalidomide in CLL: what is the optimal dose? Clin Adv Hematol Oncol 2011; 9 : 220–224.
50. Giannopoulos K, Mertens D, Stilgenbauer S. Treating chronic lymphocytic leukemia with thalidomide and lenalidomide. Expert Opin Pharmacother 2011; 12 : 2857–2864.
51. Pinto A, Corazzelli G, De Filippi R. Tumor flare reaction associated with lenalidomide treatment in patients with chronic lymphocytic leukemia predicts clinical response. Cancer 2012; 118 : 1738–1739.
52. Arumainathan A, Kalakonda N, Pettitt AR. Lenalidomide can be highly effective in chronic lymphocytic leukaemia despite T-cell depletion and deletion of chromosome 17p. Eur J Haematol 2011; 87 : 372–375.
53. Gentile M, Recchia AG, Vigna E et al. Lenalidomide in the treatment of chronic lymphocytic leukemia. Expert Opin Investig Drugs 2011; 20 : 273–286.
54. Awan FT, Johnson AJ, Lapalombella R et al. Thalidomide and lenalidomide as new therapeutics for the treatment of chronic lymphocytic leukemia. Leuk Lymphoma 2010; 51 : 27–38.
55. Sčudla V, Roček V, Dušek J et al. Multifokální eozinofilní granulom v dospělosti. Vnitř Lék 1987; 33 : 1078–1086.
56. Adam Z, Řehák Z, Koukalová R et al. Lenalidomid indukoval léčebnou odpověď u pacienta s agresivní multisystémovou formou histiocytózy z Langerhansových buněk (LCH), rezistentní ke 2-chlorodeoxyadenosinu a časně relabující po vysokodávkované chemoterapii BEAM s autologní transplantací kmenových hemopoetických buněk. Vnitř Lék 2012; 58 : 62–71.
57. Szturz P, Adam Z, Řehák Z et al. Lenalidomide proved effective in multisystem Langerhans cell histiocytosis. Acta Oncol 2012; 51 : 412–415.
58. Adam Z, Šprláková A, Řehák Z et al. Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxadenosinem a jejich kompletní vymizení při léčbě lenalidomidem. Popis případu a přehled literárních údajů. Klinická onkologie 2011; 24 : 367–382.
59. Adam Z, Matýšková M, Tomíška M et al. Šestileté sledování pacienta s mnohočetnou angiomatózou postihující skelet, břišní i hrudní dutinu a stěnu trávicí trubice. Hodnocení vlivu zoledronatu, interferonu alfa, thalidomidu a lenalidomidu na aktivitu této nemoci. Klinická onkologie 2012; 25 : 47–62.
60. Bowcock SJ, Patrick HE. Lenalidomide to control gastrointestinal bleeding in hereditary haemorrhagic telangiectasia: potential implications for angiodysplasias? Br J Haematol 2009; 146 : 220–222.
61. Sumrall A, Fredericks R, Berthold A et al. Lenalidomide stops progression of multifocal epitheloid hemangioendothelioma including intracranial disease. J Neurooncol 2010; 97 : 275–277.
62. Szturz P, Moulis M, Adam Z et al. Castleman disease. Klin Onkol 2011; 24 : 424–434.
63. Ramasamy K, Gandhi S, Tenant-Flowers M et al. Rituximab and thalidomide combination therapy for Castleman disease. Br J Haematol 2012; 158 : 421–423.
64. Wang X, Ye S, Xiong C et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman’s disease. Jpn J Clin Oncol 2011; 41 : 1221–1224.
65. Dispenzieri A. POEMS syndrome: 2011 update on diagnosis, risk-stratification, and management. Am J Hematol 2011; 86 : 591–601.
66. Kim SY, Lee SA, Ryoo HM et al. Thalidomide for POEMS syndrome. Ann Hematol 2006; 85 : 545–546.
67. Starkey CR, Joste NE, Lee FC. Near-total resolution of multicentric Castleman disease by prolonged treatment with thalidomide. Am J Hematol 2006; 81 : 303–304.
68. Menegato MA, Canelles MF, Tonutti E et al. Remission of nephrotic syndrome after thalidomide therapy in a patient with Castleman’s disease. Clin Nephrol 2004; 61 : 352–356.
69. Jung CP, Emmerich B, Goebel FD et al. Successful treatment of a patient with HIV-associated multicentric Castleman disease (MCD) with thalidomide. Am J Hematol 2004; 75 : 176–177.
70. Lee FC, Merchant SH. Alleviation of systemic manifestations of multicentric Castleman’s disease by thalidomide. Am J Hematol 2003; 73 : 48–53.
71. Stary G, Kohrgruber N, Herneth AM et al. Complete regression of HIV-associated multicentric Castleman disease treated with rituximab and thalidomide. AIDS 2008; 22 : 1232–1234.
72. Zhao X, Shi R, Jin X et al. Diffuse hyperpigmented plaques as cutaneous manifestation of multicentric Castleman disease and treatment with thalidomide: report of three cases. J Am Acad Dermatol 2011; 65 : 430–432.
73. Vannata B, Laurenti L, Chiusolo P et al. Efficacy of lenalidomide plus dexamethasone for POEMS syndrome relapsed after autologous peripheral stem-cell transplantation. Am J Hematol 2012; 87 : 641–642.
74. Briani C, Manara R, Lessi F et al. Pachymeningeal involvement in POEMS syndrome: dramatic cerebral MRI improvement after lenalidomide therapy. Am J Hematol 2012; 87 : 539–541.
75. Tomás JF, Giraldo P, Lecumberri R et al. POEMS syndrome with severe neurological damage clinically recovered with lenalidomide. Haematologica 2012; 97 : 320–322.
76. Suyanı E, Yağcı M, Sucak GT. Complete remission with a combination of lenalidomide, cyclophosphamide and prednisolone in a patient with incomplete POEMS syndrome. Acta Haematol 2011; 126 : 199–201.
77. Dispenzieri A, Armitage JO, Loe MJ, et al. The clinical spectrum of
Castleman‘s disease. Am J Hematol. 2012; 87 (11): 997-1002.
78. Sethi S, Tageja N, Arabi H et al. Lenalidomide therapy in a rare case of POEMS syndrome with kappa restriction. South Med J 2009; 102 : 1092–1093.
79. Dispenzieri A, Klein CJ, Mauermann ML. Lenalidomide therapy in a patient with POEMS syndrome. Blood 2007; 110 : 1075–1076.
80. Szturz P, Adam Z, Chovancová J et al. Lenalidomide: a new treatment option for Castleman disease. Leuk Lymphoma 2011;53 : 2089–2091.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo 11- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
-
Všetky články tohto čísla
- Adiponektin ve vztahu k ledvinné dysfunkci u nemocných s diabetes mellitus 2. typu – editorial
- Profylaxe tromboembolické nemoci včera, dnes a zítra – editorial
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta – editorial
- Kostní minerální denzita u nemocných s chronickým selháním ledvin při zahájení hemodialyzační léčby
- Adiponektín vo vzťahu k obličkovej dysfunkcii u chorých s diabetes mellitus 2. typu
- Je syndróm polycystických ovárií asociovaný s autoimunitnou tyreoiditídou?
- Revmatoidní artritida – nezávislý rizikový faktor kardiovaskulárních onemocnění
- Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
- Kombinovaná kinezio-flebotromboemboloprofylaxia, mechano-flebotromboemboloprofylaxia a farmako-flebotromboemboloprofylaxia vénovej tromboembólie v internej medicíne
- Účinnost lenalidomidu u vzácných krevních chorob: u histiocytózy z Langerhansových buněk, multicentrické Castlemanovy choroby, POEMS syndromu, Erdheimovy-Chesterovy choroby a angiomatózy. Popis případů a přehled literatury
- Karcinoid a jeho kardiální manifestace
- Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
- Neobvyklá příčina defektu nohy u nemocného s diabetes mellitus
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta
- Každý tep se počítá
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Koronární-subklaviální steal syndrom, komplikace po chirurgické revaskularizaci myokardu
- Metabolizmus vitaminu D a současné možnosti terapeutické aktivace receptoru pro vitamin D při chronickém onemocnění a selhání ledvin
- Myxom levé síně – nečekaná příčina dušnosti a teplot mladého pacienta
- Karcinoid a jeho kardiální manifestace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



