-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Molekulární genetika v diagnostice a léčbě chronické myeloidní leukemie
Molecular genetics in the chronic myeloid leukemia diagnostics and therapy
This overview discusses an importance of molecular diagnostics of chronic myeloid leukemia, molecular monitoring of treatment efficacy, residual disease and resistance to therapy and the role of the National reference laboratory ÚHKT in these issues. The qualitative detection based on the multiplex reverse transcriptase PCR confirms the presence of mRNA of the fusion gene BCR-ABL in the examined sample, thus a diagnosis of chronic myeloid leukemia. Characterization of the type of BCR-ABL rearrangement is also important for the subsequent monitoring based on the quantification of BCR-ABL transcripts. The quantitative determination of BCR-ABL transcripts at regular intervals monitors the kinetics of the disease during the treatment at the molecular level. A milestone in the successful management of chronic myeloid leukemia by tyrosine kinase inhibitors is the achievement of the major molecular response, which corresponds to the levels of BCR-ABL transcripts ≤ 0.1%IS. Thus, a fundamental aim is national and international harmonization of BCR-ABL transcripts quantification among laboratories. Currently, definition and monitoring of the complete molecular remission or deep molecular response rates is currently intensively studied worldwide, because of a higher number of patients achieving complete molecular response under 2nd generation TKI. The most studied and proved mechanism of the resistance to TKI therapy are mutations in the kinase domain of BCR-ABL. Sanger sequencing is the gold standard for the routine detection and characterization of BCR-ABL mutations. At present, mutation studies starting with using of the second-generation sequencing, which is expected to help in understanding of mutation development and clonal evolution under the pressure of TK inhibitors and the potential impact of this extremely sensitive technology for the prognosis.
Key words:
BCR-ABL – chronic myeloid leukemia – CMR – tyrosine kinase inhibitors – quantification – multiplex RT-PCR – mutations – real-time RT-PCR – resistance – Sanger sequencing – next generation sequencing – standardization
Autoři: K. Machová Poláková; K. Zemanová; M. Součková; A. Broučková; H. Klamová
Působiště autorů: Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
Vyšlo v časopise: Vnitř Lék 2012; 58(Suppl 2): 38-45
Kategorie: 60 let Ústavu hematologie a krevní transfuze Praha
Souhrn
Článek přehledově pojednává o významu molekulární diagnostiky chronické myeloidní leukemie, molekulárního monitorování účinnosti léčby, zbytkové nemoci a rezistence na terapii a role Národní referenční laboratoře ÚHKT v těchto oblastech vyšetřování. Kvalitativní detekce založená na multiplexové reverzně transkriptázové PCR potvrzuje přítomnost mRNA fúzního genu BCR-ABL ve vyšetřovaném vzorku, a tedy diagnózu chronické myeloidní leukemie. Charakterizace typu přestavby je rovněž významná pro následující monitorování nemoci, které probíhá na úrovni kvantifikace transkriptů BCR-ABL. Kvantitativní stanovování BCR-ABL transkriptů probíhá v pravidelných intervalech a umožňuje sledovat kinetiku nemoci v průběhu léčby na molekulární úrovni. Milníkem úspěšného managementu léčby chronické myeloidní leukemie inhibitory tyrozinových kináz je dosažení velké molekulární odpovědi, která odpovídá úrovni BCR-ABL transkriptů ≤ 0,1 %IS. Tudíž zcela zásadní je sjednocování kvantifikace BCR-ABL mezi laboratořemi, které probíhá na národní a mezinárodní úrovni. Celosvětově je v současné době intenzivně řešena otázka definice a monitorování kompletní molekulární remise, resp. míry hluboké molekulární odpovědi, jelikož s nástupem nové generace léčiv se vyšší procento pacientů dostává do molekulární remise. Nejvíce probádaným a jasně prokázaným mechanizmem rezistence na léčbu TKI jsou mutace kinázové domény v BCR-ABL. Sangerovo sekvenování je zlatým standardem pro rutinní detekci a charakterizace BCR-ABL mutací. V současnosti se do popředí zájmu dostává sekvenování 2. generace, od kterého se očekává možné objasnění vzniku mutací a klonálního vývoje pod tlakem TK inhibitorů a případné dopady této extrémně citlivé technologie na prognózu.
Klíčová slova:
BCR-ABL – chronická myeloidní leukemie – CMR – inhibitory tyrozinových kináz – kvantifikace – multiplex RT-PCR – mutace – real-time RT-PCR – rezistence – Sangerovo sekvenování – sekvenování 2. generace – standardizaceÚvod
Chronická myeloidní leukemie (CML) je díky známému mechanizmu neoplastické transformace krvetvorných kmenových buněk, která je navozena konstitutivní aktivitou chimérického proteinu BCR-ABL, velmi dobře monitorovatelnou chorobou na molekulární úrovni. Excelentním a osvědčeným markerem pro molekulární sledování je přítomnost a množství BCR-ABL transkriptů fúzního genu BCR-ABL. Detekce a určení typu přestavby BCR-ABL na úrovni mRNA jsou významné pro potvrzení diagnózy CML. Následující kvantifikace množství BCR-ABL transkriptů, která probíhá v pravidelných časových intervalech v průběhu léčby inhibitory tyrozinových kináz (TKI), odráží účinnost odpovědi na léčbu a velmi časně zaznamenává selhávání odpovědi, které je často spojené s rozvojem rezistence. Kvantifikace BCR-ABL je rovněž významná pro monitorování minimální reziduální choroby u pacientů, kteří na léčbu TKI odpovídají kompletní molekulární remisí (CMR, tj. nedetekovatelnost BCR-ABL transkriptu současnými nejcitlivějšími technikami), a u pacientů po transplantaci kostní dřeně.
Rezistence k imatinibu a druholiniovým inhibitorům dasatinibu a nilotinibu je často spjata s rozvojem mutací v kinázové doméně BCR-ABL u 40–50 % případů [1]. Mutace blokují aktivitu TKI na různých úrovních: některé mutace znemožňují vazbu TK inhibitorů ke kinázové doméně BCR-ABL, jiné způsobují změnu v konformaci proteinu na aktivní, ke které se imatinib nedokáže vázat [2–4]. V případě imatinibu bylo popsáno více než 100 typů mutací, které u pacientů navozují různou míru rezistence (mírná – střední – silná) v závislosti na jejich lokalizaci a efektu na kinázu. Mutační analýza cDNA BCR-ABL se velice rychle stala prominentní monitorovací metodou rezistence zavedenou v klinické praxi CML.
Kvalitativní detekce transkriptů fúzního genu BCR-ABL
Molekulární potvrzení diagnózy chronické myeloidní leukemie je založeno na detekci přítomnosti transkriptů fúzního genu BCR-ABL ve vzorku periferní krve nebo kostní dřeně a na určení typu přestavby. Znalost typu přestavby je důležitá pro následující kvantifikaci hladiny transkriptů BCR-ABL a zamezení falešně negativním výsledkům. Pro diagnostické účely je nejvíce rozšířena multiplex reverzně transkriptázová PCR (RT-PCR) [5], jež zachycuje expresi BCR-ABL s různými typy přestaveb (major, minor a mikro). V jednom kroku je současně amplifikována oblast cDNA specifická pro jednotlivé přestavby fúzního genu BCR-ABL a netranslokovaná oblast kontrolního genu BCR, jejíž pozitivní amplifikace slouží ke kontrole kvality vzorku. Přestože je toto vyšetření v laboratořích velice rozšířené, existují ojedinělé případy pacientů nesoucích raritní přestavby a jejich správné určení může být problematické. Proto je nutné přistoupit k alternativním postupům umožňujícím jednoznačné ověření typu přestavby. Např. při diagnostickém vyšetření fúzního genu BCR-ABL metodou dle Crosse et al [5] je v případě potvrzení proužku o délce ~ 1 000 bp v cDNA vzorku pacienta nutné rozlišit, zda se jedná o přestavbu e19a2 (926 bp), či e6a2 (1 123 bp). Po klasické elektroforetické separaci PCR produktu je určení délky málo přesné a nedostačuje k jasné identifikaci typu přestavby. Pro potvrzení/vyvrácení přestavby e19a2 lze provést PCR reakci s použitím specifických primerů, které množí úsek nesoucí přestavbu mikro (135 bp). Při této PCR je znemožněna amplifikace úseku e6a2 [6].
Kromě multiplex RT-PCR (senzitivita ~ 10–4) je možné zjišťovat typ přestavby genu BCR-ABL citlivější metodou specifické dvoukolové nested RT-PCR (senzitivita ~ 10–6). Inzerce či aberace krátkých sekvencí v místě nasedání primerů, ojedinělé vzácné zlomy či vzácné splicingové varianty však představují riziko nesprávné interpretace během rutinního vyšetřování [7]. U netypických přestaveb genu BCR-ABL, na které mohou poukázat neočekávané výsledky screeningových metod, proto hraje významnou roli metoda přímého sekvenování, která odhalí atypické místo zlomu v RT-PCR amplifikovaném transkriptu BCR-ABL [7,8].
Národní referenční laboratoř pro DNA diagnostiku ÚHKT (NRL ÚHKT) je akreditována u Českého akreditačního institutu od roku 2005 podle normy ČSN EN ISO/IEC 17 025 a od roku 2007 podle normy ČSN EN ISO 15 189 (www.cai.cz). V roce 2005 naše laboratoř zahájila organizování a provádění mezilaboratorního porovnávání zkoušek (MPZ) diagnostického vyšetření přítomnosti a určení typu přestavby fúzního genu BCR-ABL v ČR. V současnosti se MPZ pravidelně účastní 10 českých laboratoří.
Monitorování množství BCR-ABL transkriptů
Počátky kvantifikace množství mRNA BCR-ABL sahají do 90. let 20. století. Metoda byla založena na principu kompetitivní reverzně transkriptázové (RT) PCR [9–11]. ÚHKT byl prvním pracovištěm v České republice, které v roce 1994 tuto metodu ještě ve vylepšené formě zavedlo [12]. Kvantifikace BCR-ABL transkriptů měla v té době své místo především v oblasti monitorování minimální reziduální nemoci (MRN) u pacientů po transplantaci kostní dřeně. Díky pravidelnému monitorování bylo možné včas odhalit návrat onemocnění. S nástupem léčby CML imatinibem v roce 2001 získalo molekulární monitorování hladiny BCR-ABL zcela nový rozměr a zásadní místo pro úspěšný management léčby. Ve stejné době došlo také k vývoji nové instrumentace v oblasti molekulární biologie, který přinesl kvantitativní PCR v reálném čase. Tato technologie je časově a laboratorně méně náročná než původní kompetitivní PCR a brzy se rozšířila pro potřeby kvantifikace transkriptů BCR-ABL celosvětově [13–15].
V současnosti je doporučováno pravidelně monitorovat hladinu transkriptů BCR-ABL pomocí real-time RT-PCR (doporučená a nejvíce rozšířená metodika dle Beillarda et al [13]) v periferní krvi každé 3 měsíce od zahájení léčby imatinibem. V těchto pravidelných tříměsíčních intervalech by se mělo pokračovat i v případě negativity real-time RT-PCR [16]. Tento typ vyšetření nevyžaduje kostní dřeň, ale zcela postačuje periferní krev, jejíž odběr zatěžuje pacienta daleko méně než odběr kostní dřeně. Plně dostačující je objem 10 ml krve, který obsahuje potřebné množství leukocytů pro extrakci RNA [16]. Bylo prokázáno, že vysoká nebo narůstající hladina BCR-ABL odráží špatnou prognózu nebo rozvoj rezistence na léčbu, naopak trvalý pokles BCR-ABL zrcadlí citlivost k léčbě a dobrou prognózu [17].
Jelikož většina pacientů, kteří jsou léčeni imatinibem v 1. linii, dosahuje CCgR (kompletní cytogenetická remise), hlavním cílem léčby CML je dosažení velké molekulární odpovědi (MMR), a to optimálně do 18. měsíce od zahájení léčby [16]. Studie IRIS prokázala, že redukce BCR-ABL transkriptů (BCR-ABL/kontrolní gen, tj. normalizovaný počet kopií BCR-ABL) o minimálně 3 řády v porovnání se standardizovanou hladinou odvozenou od pacientů v době diagnózy bez léčby silně koreluje s pravděpodobností přežití bez progrese [18]. Tato třířádová redukce byla převedena do numerického mezinárodního měřítka (international scale – IS), odpovídá hladině ≤ 0,1 % BCR-ABL IS (obr. 1) a je označována jako MMR (Major Molecular Response). Dosažení hladiny BCR-ABL odpovídající MMR by mělo být potvrzeno v několika následujících odběrech, tj. musí se jednat o stabilní MMR. Zatím není jasné, do jaké míry je vliv fluktuace hladiny BCR-ABL transkriptů a nepostupující pokles u pacientů v CCgR závislý na míře variability měření či zda se může vyskytovat spontánně [16]. Jelikož je hladina 0,1 %IS BCR-ABL zásadní pro klinickou praxi v souvislosti s hodnocením molekulární odpovědi na léčbu, bylo zapotřebí, aby laboratoře, které toto vyšetření provádějí, měřily srovnatelně a tuto hladinu detekovaly v mezinárodním měřítku.
Obr. 1. Schematické znázornění hladin BCR-ABL trankriptů v mezinárodním měřítku. CCgR – kompletní cytogenetická remise, KD – kostní dřeň, MCR – velká cytogenetická odpověď, MMR – velká molekulární odpověď, MR – molekulární odpověď, TKI – inhibitory tyrozinových kináz. 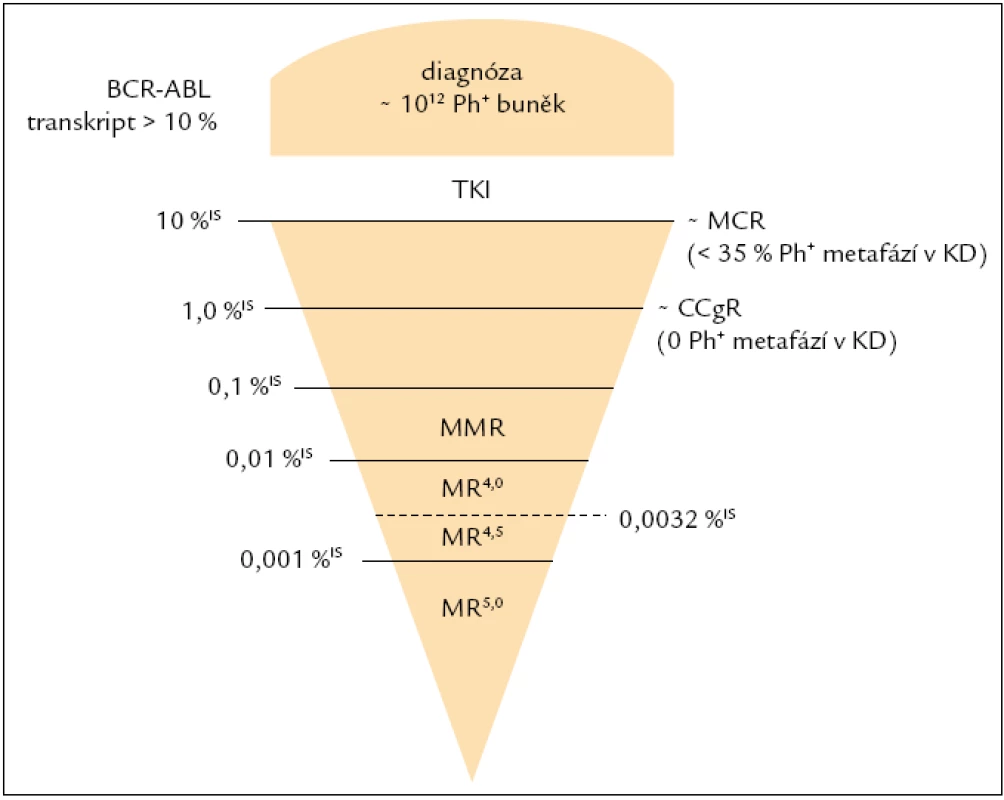
NRL ÚHKT organizuje každoroční mezilaboratorní porovnávání zkoušek pro oblast kvantitativního stanovení hladiny transkriptů BCR-ABL v ČR od roku 2007. ÚHKT vystavuje laboratořím, které úspěšně absolvují MPZ, certifikát, jehož platnost je 1 rok od data vystavení. Během posledních 5 let se podařilo vytvořit síť českých laboratoří (současný počet je 6 včetně NRL ÚHKT), které poskytují tento typ vyšetření, a navodit úzkou spolupráci mezi laboratořemi a NRL ÚHKT, která poskytuje technickou podporu a konzultace včetně praktického školení.
V rámci Evropské leukemické sítě (European Leukemia Net – ELN) vznikl projekt EUTOS for CML (European Treatment Outcome Study), který si vytyčil úkol harmonizovat molekulární monitorování hladin BCR-ABL transkriptů mezi laboratořemi/centry v Evropě. Primárními cíli tohoto projektu byly:
- standardizace metodik pro kvantifikaci BCR-ABL,
- vytvoření sítě národních referenčních laboratoří, ověření jejich metodik, certifikace, výpočet a validace přepočtových koeficientů (www.eutos.org/content/molecular_monitoring).
NRL pro DNA diagnostiku v ÚHKT byla v rámci EUTOS for CML jmenována panelem expertů ELN referenční laboratoří (RL) pro ČR v roce 2008. Přepočtový koeficient (CF), který je počítán a validován na základě výměny 25–30 vzorků CML pacientů mezi RL a testovanou laboratoří, slouží ke zvýšení srovnatelnosti výsledků mezi laboratořemi/centry tak, aby bylo možné mezi sebou porovnávat a vyhodnocovat léčebné výsledky (např. v rámci národních a mezinárodních registrů). K validaci CF mohou přistoupit laboratoře, které uspěly v MPZ, tj. prokázaly technickou způsobilost k provádění kvantitativní real-time RT-PCR transkriptů BCR-ABL. Pouze laboratoře s validovaným CF mohou vydávat výsledky množství BCR-ABL v jednotkách IS platných v rozmezí 0,01–10 %. Bylo prokázáno, že přepočtové koeficienty umožňují upravovat výsledky tak, že dochází k výraznému sjednocení hodnot mezi laboratořemi. Přepočtové koeficienty je však nutné každoročně validovat, přičemž u laboratoří s nestabilním CF je validace nutná alespoň 2krát do roka [19]. Víme, že harmonizace BCR-ABL mRNA kvantifikace založená na výše popsaném způsobu výpočtu a validace CF není optimální; (i) proces je zdlouhavý a finančně náročný; (ii) vyžaduje účast referenčních laboratoří, přičemž celý proces je otevřený pro limitovaný počet laboratoří; (iii) mnoho center čelí problému se získáváním patřičného množství vzorků pacientů pro validaci CF (n = 25–30); (iv) není zcela jasné, jak často by měly být CF revalidovány; (v) není zcela jasné, jak postupovat v případě laboratoří, které nedosahují definovaných kritérií pro provádění kvantitativní real-time RT-PCR [20]. Proto bylo nutné vyvinout referenční materiály, jež jsou kalibrovány k primárním WHO (World Health Organization) BCR-ABL standardům [21], které proces validace zefektivní, více unifikují a urychlí.
Další možností, jak výrazně snížit problémy s odchylkami měření a jak eliminovat nutnost validace přepočtových koeficientů, je používání plně automatizovaného uzavřeného systému, jako je CE-IVD Xpert BCR-ABL Monitor test (GX systém), jenž je kompatibilní s automatickým analyzátorem [22]. NRL ÚHKT je jednou ze 4 evropských EUTOS laboratoří, které participují na mezinárodním projektu, jehož cílem je porovnání měření BCR-ABLIS GX systémem a metodou real-time RT-PCR pro BCR-ABL standardizovanou v EUTOS laboratořích. Výhoda tohoto automatizovaného systému spočívá ve velké časové úspoře analýzy a nízkých nárocích na objem primárního vzorku krve. Iniciálně se připraví vzorek z 200 µl krve a spolu s dalšími reagenciemi je převeden do cartridge, která se vkládá do přístroje. Celý proces zakončený vydáním výsledku v hodnotách IS trvá méně než 2 hod. Tento systém bude mít své místo především v laboratořích či klinických pracovištích s nižším průchodem vzorků.
Význam hladiny BCR-ABL transkriptů ve 3. měsíci od zahájení léčby imatinibem
Díky standardizaci metodiky kvantifikace BCR-ABL transkriptu a dlouholetému pozorování účinku prvoliniové terapie imatinibem bylo zjištěno, že hloubka molekulární odezvy na léčbu ve 3. měsíci od jejího zahájení může představovat důležitý prognostický marker následujícího průběhu léčby IM a může být ukazatelem pro časný převod rizikové skupiny pacientů na léčbu TKI 2. generace [23,24]. Hladina BCR-ABL transkriptů ≥ 10 %IS 3 měsíce po zahájení léčby IM je pro pacienty riziková a souvisí se signifikantně horší pravděpodobností celkového přežití, přežití bez progrese a nežádoucích událostí [23,24]. Tuto skutečnost potvrzují molekulární data pacientů léčených IM v 1. linii v letech 2003–2008 zpracovaná ve 3 českých centrech, která v té době již měla standardizovanou metodiku pro kvantifikaci BCR-ABL transkriptů a měřila porovnatelně. Data ukazují, že kumulativní incidence dosažení optimální kompletní cytogenetické (CCgR) a velké molekulární odpovědi (MMR) ve 12. a 18. měsíci od zahájení léčby IM je významně spjata s hladinou BCR-ABL ≤ 10 %IS dosaženou po 3 měsících léčby [25].
Zatím neexistují data, která by ukázala, že nižší citlivost k efektu BCR-ABL inhibice ve skupině pacientů odpovídajících na IM pozvolněji (často se jedná o pacienty se suboptimální odpovědí) by mohla být překonána časným převodem na léčbu účinnějšími inhibitory 2. generace. Odlišné biologické charakteristiky těchto pozvolně, a tedy suboptimálně odpovídajících pacientů mohou být dosti heterogenní a inhibitory 2. generace mohou být jen částečně účinné [24]. Oproti této skupině pacientů by ze změny terapie na TKI 2. generace již po 3 měsících mohla profitovat vysoce riziková skupina s BCR-ABL ≥ 10 %IS, protože by docházelo k časné a efektivní eliminaci BCR-ABL pozitivních klonů [24].
Definice a standardizace kompletní molekulární remise
První data z probíhajících klinických studií založených na podávání druholiniových preparátů dasatinibu (např. DASISION) [26] a nilotinibu (např. ENESTnd) [27] v 1. linii poukazují na mnohem rychlejší dosahování molekulárních odpovědí pod hladinou MMR a významně vyšší počty pacientů s kompletní molekulární remisí v porovnání s imatinibem. V rámci klinických studií je rovněž značný zájem testovat možnost zastavení léčby TKI u pacientů, u nichž nedetekovatelná choroba na molekulární úrovni dlouhodobě přetrvává. Studie Stop Imatinib (STIM) prospektivně testovala vysazení IM u 100 CML pacientů, u kterých přetrvávala CMR po dobu více než 2 let. V této studii je CMR definována jako redukce BCR-ABL o 5 řádů odpovídající hladině BCR-ABL 0,001 %IS. Jelikož je tato definice ojedinělá a zatím neproběhla mezilaboratorní standardizace CMR, je velmi obtížné porovnat výsledky s jinými podobně založenými studiemi. Další studie ENESTcmr je randomizovaná studie, která srovnává pacienty léčené nilotinibem v dávce 400 mg 2krát denně vs pacienty léčené imatinibem s cílem zjistit frekvenci dosahování nedetekovatelného BCR-ABL u pacientů, kteří při předchozí léčbě imatinibem této odpovědi nedocílili. Bylo zjištěno, že signifikantně vyšší procento pacientů dosáhlo CMR4 a CMR4,5 do 12 měsíců od nasazení nilotinibu v porovnání s pacienty, kteří zůstali na léčbě imatinibem [28]. V roce 2012 bude zahájena mezinárodní studie EURO-SKI (STOP kinase inhibitors), která bude zahrnovat pacienty s přetrvávající CMR (≤ MR4) po léčbě IM nebo TKI 2. generace, na které byli převedeni pacienti s intolerancí k imatinibu [20]. Na základě prvních poznatků z těchto studií včetně přípravy mezinárodní studie EURO-SKI je zřejmá výrazná potřeba jednotné definice a standardizace monitorování kompletní molekulární odpovědi, která aktuálně probíhá v rámci projektu EUTOS for CML v součinnosti s klinickou studií ENEST1st a vybranými EUTOS laboratořemi, mezi kterými figuruje i RL ÚHKT.
Iniciální definice CMR byla odvozena od definice MMR (≤ 0,01 %IS BCR-ABL) jako CMR4, CMR4,5, CMR5, tj. redukce od IRIS hladiny o více než 4 řády. Tato definice je však zavádějící, jelikož kopie BCR-ABL mohou být detekovány ať již s použitím real-time RT-PCR, anebo dvoukolové PCR, tzv. nested PCR (v současné době rutinně používaná nejcitlivější metoda v řadě laboratoří). Jinými slovy, pakliže stále detekujeme BCR-ABL transkript, není vhodné používat termín kompletní molekulární remise, ale molekulární odpověď MR, jejíž hloubka je udávána řádovou redukcí od IRIS hladiny v době diagnózy: tj. MR4, MR4,5, MR5 (obr. 1). Čelíme však problému porovnatelnosti měření na těchto hladinách mezi laboratořemi. V souvislosti s definicí a porovnatelností citlivosti v případě nedetekovatelnosti molekul BCR-ABL vyvstává ještě jeden problém. Citlivost analýz byla popsána panelem expertů Europe against Cancer Group [13], avšak stanovená kritéria fungují za předpokladu použití kontrolního genu, který je nezávislý na BCR-ABL. Tuto definici tudíž nelze použít u nejvíce rozšířeného kontrolního genu ABL. Bylo proto zapotřebí vytvořit definici novou [20]:
- MR4 = buď (i) detekovatelná CML ≤ 0,01 %IS BCR-ABL, anebo (ii) nedetekovatelná CML se součtem naměřeného počtu kopií cDNA kontrolního genu ve stejném množství vzorku ≥ 10,000 ABL (≥ 24,000 GUS),
- MR4,5 = buď (i) detekovatelná CML ≤ 0,0032 %IS BCR-ABL, anebo (ii) nedetekovatelná CML se součtem naměřeného počtu kopií cDNA kontrolního genu ve stejném množství vzorku ≥ 32,000 ABL (≥ 77,000 GUS).
Tato definice je kriticky závislá na schopnostech laboratoří měřit dostatečné počty transkriptů kontrolních genů, stejně jako dosáhnout nezbytné citlivosti.
Přestože TKI 2. generace dosahují signifikantně vyššího počtu CMR v porovnání s imatinibem, nebylo prokázáno, že by docházelo k úplné eradikaci CML kmenových buněk, dokonce ani k eliminaci zralejších CD34+ CML prekurzorových buněk [29]. Je popsána řada případů, kdy došlo k relapsu onemocnění u pacientů s CMR po léčbě TKI [30–32]. Jediným kurativním přístupem současnosti stále zůstává alogenní transplantace kostní dřeně, která umožňuje eliminaci CML kmenových buněk díky efektu štěpu vůči leukemii [33]. Bohužel s alogenní transplantací je spojena vysoká frekvence komorbidit a úmrtí spjatých s onemocněními vyvolanými efekty štěpu proti hostiteli. Proto je současný výzkum CML zaměřen především na CML kmenovou buňku, odhalování a pochopení jejích patogenních signálních drah a na vývoj nových terapeutických látek, které by mohly v součinnosti s působením TKI vést ke zničení CML kmenové buňky a k úplnému vyléčení nemoci. Ruku v ruce s tímto intenzivním výzkumem a vyšším výskytem molekulárních remisí díky účinnosti TKI 2. generace postupuje i vylepšování molekulárních metodik pro spolehlivou detekci minimální reziduální nemoci. Ukazuje se, že detekce množství transkriptů BCR-ABL není pro průkaz zbytku nemoci dostačující v porovnání s účinnější detekcí založenou na kvantifikaci DNA kódující BCR-ABL (gBCR-ABL) [32]. Nicméně tento postup není v současné době aplikovatelný pro rutinní praxi, jelikož přestavba BCR-ABL na úrovni DNA je specifická pro každého pacienta a její identifikace včetně vývoje a validace individuální kvantitativní real-time PCR je laboratorně a finančně značně náročná. Na souboru 10 pacientů, kteří ztratili CMR po vysazení léčby IM, byla popsána stále detekovatelná hladina gBCR-ABL po celou dobu vysazení léčby IM, přestože nebyla prokázána pozitivita na úrovni transkriptu [32]. Detekce BCR-ABL na úrovni mRNA a současně na úrovni DNA by představovaly účinný a silný nástroj pro detailní sledování pacientů, u kterých by se na základě výsledků klinických studií mohla léčba TKI v budoucnu vysazovat. Progres v molekulárně biologických technologiích v podobě sekvenování 2. generace může výrazně usnadnit a zlevnit charakterizaci a monitoring minimální reziduální nemoci na úrovni DNA.
Vyšetřování mutací v KD BCR-ABL
Detekce přítomnosti mutací v transkriptech kinázové domény BCR-ABL je varovným signálem, jelikož: (i) odráží nestabilitu genomu, která je motorem progrese CML, (ii) pacienti rezistentní k imatinibu, kteří nesou mutace, mají vyšší riziko rozvoje mutací na TKI 2. generace. Také někdy záleží na typu detekované mutace, jelikož z popsaných případů se ví, že vůči některým typům mutací je léčba dasatinibem (V299L; T315I/A; F317/L/V/I/C) nebo nilotinibem (Y253H; E255K/V; T315I; F359V/C/I) neúčinná. Proto časná detekce mutací v KD BCR-ABL v průběhu léčby IM a určení typu mutace rozhoduje o efektivní změně terapie související s časným převedením a individualizovanou volbou TKI 2. generace.
Vyšetřování mutací v klinické praxi je zásadní pro časné odhalování rozvoje rezistence a efektivní management léčby. Panel expertů ELN doporučuje vyšetřovat mutace v určitých fázích prvoliniové léčby imatinibem [34]:
- v době diagnózy pouze v případech akcelerované fáze či blastického zvratu (u pacientů v chronické fázi nebyly zaznamenány případy s preexistujícími mutacemi v době diagnózy [35], pouze v některých případech akcelerovaných fází a blastických zvratů byly detekovány mutace, které souvisely pravděpodobně s výše zmiňovanou nestabilitou genomu způsobenou dlouhotrvající aktivitou BCR-ABL kinázy;
- při selhání léčby;
- při nárůstu hladiny BCR-ABL transkriptů vedoucímu ke ztrátě MMR;
- v jakémkoli jiném případě suboptimální odpovědi.
Je doporučeno provádět analýzu v periferní krvi. Může se vycházet ze stejného materiálu (buněčný lyzát, RNA, cDNA), který byl použit pro kvantifikaci hladiny BCR-ABL transkriptu. Odhalení mutací predikuje ve většině případů progresi onemocnění, dokonce i u pacientů s kompletní cytogenetickou remisí po léčbě IM [16,36,37]. V naší společné studii s brněnským pracovištěm Interní hematologické a onkologické kliniky LF MU a FN Brno a pod záštitou CELL (The Czech Leukemia Study Group for Life) jsme zjistili, že fluktuace hladiny BCR-ABL transkriptů na ustálené neklesající hladině ≥ 0,1 % je časným indikátorem pro detekci mutací [37], tj. i nestabilní MMR ~ 0,1 % může být spjatá s pozvolnou proliferací mutovaného klonu s mírnou nebo střední rezistencí vůči TKI. Je nutno podotknout, že pozitivní výsledek je vždy indikátorem pro změnu terapie [34,17].
Doporučení pro vyšetřování mutací v průběhu terapie TKI 2. generace nejsou ještě definitivní, jelikož jsou zapotřebí výsledky z dlouhodobějšího sledování účinků léčby. V současnosti se doporučuje u pacientů převedených na TKI 2. linie vyšetřovat mutace v případech, kdy pacienti nedosáhnou kompletní hematologické či cytogenetické odpovědi [34]. Rovněž by se mutace měly sledovat každé 3 měsíce, pokud hladiny BCR-ABL jsou ≥ 10 % nebo při výrazném nárůstu BCR-ABL nad 10 %. Obecně lze doporučit sledování „base-line“ mutace (mutace z předchozí léčby) po převedení na druholiniovou léčbu v pravidelných 3měsíčních intervalech až do jejich nedetekovatelnosti, či do redukce BCR-ABL transkriptů pod hladinu MMR.
Zlatým standardem pro analýzu mutací v KD BCR-ABL je Sangerovo sekvenování, které je nejrozšířenější metodikou. K úspěšné detekci mutací přímým sekvenováním je nutné, aby hladina celkového množství BCR-ABL transkriptů nebyla nižší než 0,1 %, tj. ve vzorku je zapotřebí minimálně 100 kopií BCR-ABL mRNA [37]. Sekvenuje se produkt kinázové domény BCR-ABL, který je získáván ve 2 amplifikačních krocích. První krok PCR je důležitý z důvodu namnožení úseku KD, který pochází pouze z fúzního genu BCR-ABL, tak aby současně nedošlo k amplifikaci úseku KD normálního genu ABL, v němž se mutace nevyskytují. Tím by docházelo ke snižování citlivosti detekce [38]. Některé laboratoře využívají kromě sekvenování ještě screeningové metody (např. DHPLC [39,40], HRM [41,42] a ASO-PCR [43,44]) poskytující ještě vyšší citlivost detekce mutací (< 10 % mutace přítomné ve vzorku) než Sangerovo sekvenování (10–20 % mutace přítomné ve vzorku). Tyto metody se v praxi využívají především pro iniciální screening mutací a selekci pouze pozitivních vzorků pro následující sekvenační analýzu, která je laboratorně a finančně poměrně náročná, nebo pro potvrzení sporných výsledků sekvenace, především u minoritně zastoupených mutovaných klonů [17,41,45].
Obdobně jako u kvantifikace transkriptů BCR-ABL i v případě detekce mutací bude nezbytně nutná standardizace metod mezi laboratořemi. Pilotní kolo evropské standardizace proběhlo v letech 2009–2010 v rámci projektu EUTOS for CML. NRL ÚHKT organizovala první ročník MPZ pro detekci mutací sekvenováním na přelomu roku 2010, kterého se zatím zúčastnila 2 česká pracoviště poskytující tento typ vyšetření.
Sekvenování 2. generace pro ultrahlubokou detekci mutací
Tato nová technologie sekvenování představuje slibný nástroj pro detekci mutací v hladinách nižších než 1 %. Ultrahluboká detekce mutací je založena na klonální amplifikaci jednotlivých molekul s jejich následným sekvenováním, které je založeno na principu pyrosekvenace, např. v případě použití technologie 454 (www.454.com). NGS představuje nástroj, který může odhalit vznik a expanzi klinicky rezistentních mutací v průběhu léčby CML. Naše laboratoř zahájila v loňském roce úzkou spolupráci na této problematice s celosvětově uznávaným italským pracovištěm v Bologni (S. Soverini, G. Marti-nelli, M. Baccarani, Department of Hematology/Oncology „L. and A. Seràgnoli“ at the University of Bologna). Naše první společná data ukazují na existenci mozaiky nízkohladinových mutací v období diagnózy CML a Ph+ ALL (akutní lymfoblastická leukemie) i v průběhu léčby TKI. Expanze klonů bude pravděpodobně záviset na míře proliferační výhody vůči TKI, která je odvislá od jednotlivých typů mutací. Díky této technologii lze dobře studovat také doprovodné mutace, jejichž přítomnost může měnit proliferační vlastnosti BCR-ABL klonu a zesílit jeho rezistenci. Výsledky také naznačují klinický význam detekce mutací v nízkých hladinách po převedení na léčbu TKI 2. linie.
Potenciální význam vysoce citlivé detekce mutací pro klinickou praxi ukazuje nedávná práce australské skupiny [46]. S použitím hmotnostní spektrofotometrie se zaměřili na hlubokou detekci panelu 38 nejvýznamnějších mutací. Autoři zjistili, že citlivá detekce mutací vyskytujících se v nízkých hladinách v době přechodu pacientů na léčbu TKI 2. generace významně predikuje jejich následnou expanzi a selhání léčby, pokud je pacient léčen TKI, vůči kterému je daný typ mutace rezistentní. Autoři zdůrazňují klinický význam, jelikož citlivá detekce identifikuje pacienty po selhání léčby imatinibem, kteří nesou biologicky signifikantní mutace, jež jsou pod hladinou detekčního limitu přímého sekvenování [46].
Budoucí data ze sekvenování 2. generace teprve ukážou, zda by ultrahluboká detekce mutací pro selekci vhodné terapie mohla být zavedena do klinické praxe. V prvé řadě je nutné, aby tento molekulárně biologický nástroj byl zvládnutý především po technické stránce a aby existovaly sofistikované přístupy pro hodnocení mutací v ultranízkých hladinách. K tomuto by měla přispět mezinárodní studie IRON fáze II ve spolupráci s evropskými laboratořemi, které disponují NGS technologií 454. Tato studie je členěna dle jednotlivých diagnóz poruch krvetvorby zahrnující i CML. V rámci CML pracovní skupiny je testován navržený postup detekce mutací v celé délce kinázové domény BCR-ABL. Cílem testování je zjistit míru reprodukovatelnosti výsledků mezi laboratořemi a validace systému, který by mohl být komerčně distribuován. NRL ÚHKT na tomto projektu aktivně spolupracuje.
Molekulární biologie – výzkum signálních drah kmenové buňky
Výzkum v oblasti molekulární biologie CML je zaměřen na kmenovou buňku a její zásadní signální dráhy, jejichž aberantní funkce přispívají k patologii nebo jsou příčinou patologie onemocnění či rezistence na stávající léčbu. V současné době již probíhají klinické studie kombinující léčbu TKI s imunomodulačními přípravky nebo preparáty, které ovlivňují CML kmenovou buňku s cílem dosáhnout přetrvávající hluboké molekulární odpovědi či kompletní remise. Nedávná in vitro data ukazují na kombinaci nilotinibu s aktivními inhibitory cílícími v kmenových buňkách na JAK a MEK kinázy, Hedgehog a mTor signální dráhy, o kterých lze v kombinaci s TKI uvažovat v budoucích klinických studiích [47–49]. Je proto nutné, aby výzkum v oblasti molekulární biologie odhalil další molekuly, faktory a regulační mechanizmy specifické pro CML kmenovou buňku a dopomohl k případnému vývoji nových terapeutik či účinných prognostických markerů pro personalizovanou medicínu.
Mgr. Kateřina Machová Poláková, Ph.D.
www.uhkt.cz
e-mail: katerina.machova@uhkt.cz
Doručeno do redakce: 30. 5. 2012
Zdroje
1. Kantarjian H, Shchiffer C, Jones D et al. Monitoring the response and course of chronic myeloid leukemia in the modern era of BCR-ABL tyrosine kinase inhibitors: practical advice on the use and interpretation of monitoring methods. Blood 2008; 111 : 1774–1780.
2. Shah NP, Nicoll JM, Nagar B et al. Multiple BCR-ABL kinase domain mutations confer polyclonal resistance to the tyrosine kinase inhibitor imatinib (STI571) in chronic phase and blast crisis chronic myeloid leukemia. Cancer Cell 2002; 2 : 117–125.
3. Branford S, Rudzki Z, Walsh S et al. High frequency of point mutations clustered within the ATP binding region of BCR/ABL in patients with CML or Ph-positive ALL who develop imatinib (STI571) resistance. Blood 2002; 99 : 3472–3475.
4. Corbin AS, La Rosée P, Stoffregen EP et al. Several BCR-ABL kinase domain mutants associated with imatinib mesylate resistance remain sensitive to imatinib. Blood 2003; 101 : 4611–4614.
5. Cross NC, Melo JV, Feng L et al. An optimized multiplex polymerase chain reaction (PCR) for detection of BCR-ABL fusion mRNAs in haematological disorders. Leukemia 1994; 8 : 186–189.
6. Součková M, Richterová R, Roszková B et al. Rozlišení mezi raritními přestavbami e6a2 a e19a2 v diagnostice fúzního genu BCR-ABL. XXVI. Olomoucké hematologické dny 24.–26. 6. 2012. Abstrakt P18/2130.
7. Jurcek T, Razga F, Jeziskova I et al. Failure of molecular diagnostics in chronic myeloid leukemia: an aberrant form of e13a2 BCR-ABL transcript causing false-negative results by standard polymerase chain reaction. Leuk Lymphoma 2010; 51 : 558–561.
8. Rohon P, Divoka M, Calabkova et al. Identification of e6a2 BCR-ABL fusion in a Philadelphia-positive CML with marked basophilia: implications for treatment strategy. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2011; 155 : 187–190.
9. Lion T, Izraeli S, Henn T et al. Monitoring of residual disease in chronic myelogenous leukemia by quantitative polymerase chain reaction. Leukemia 1992; 6 : 495–499.
10. Cross NC, Feng L, Chase A et al. Competitive polymerase chain reaction to estimate the number of BCR-ABL transcripts in chronic myeloid leukemia patients after bone marrow transplantation. Blood 1993; 82 : 1929–1936.
11. Hochhaus A, Lin F, Reiter A et al. Quantification of residual disease in chronic myelogenous leukemia patients on interferon-alpha therapy by competitive polymerase chain reaction. Blood 1996; 87 : 1549–1555.
12. Moravcova J, Lukasova M, Stary J et al. Simple competitive two-step RT-PCR assay to monitor minimal residual disease in CML patients after bone marrow transplantation. Leukemia 1998; 12 : 1303–1312.
13. Beillard E, Pallisgaard N, van der Velden VH et al. Evaluation of candidate control genes for diagnosis and residual disease detection in leukemic patients using ‚real-time‘ quantitative reverse-transcriptase polymerase chain reaction (RQ-PCR) – a Europe against cancer program. Leukemia 2003; 17 : 2474–2486.
14. Branford S, Cross NC, Hochhaus A et al. Rationale for the recommendations for harmonizing current methodology for detecting BCR-ABL transcripts in patients with chronic myeloid leukaemia. Leukemia 2006; 20 : 1925–1930.
15. Hughes T, Deininger M, Hochhaus A et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results. Blood 2006; 108 : 28–37.
16. Baccarani M, Saglio G, Goldman J et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2006; 108 : 1809–1820.
17. Jarošová M, Moravcová J, Machová Poláková K. Cytogenetika a molekulární genetika. In: Faber E, Indrák K et al (eds). Chronická myeloidní leukemie. Praha: Galén 2010 : 29–50.
18. Hughes TP, Kaeda J, Branford S et al. Frequency of major molecular responses to imatinib or interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 2003; 349 : 1421–1432.
19. Müller MC, Cross NC, Erben P et al. Harmonization of molecular monitoring of CML therapy in Europe. Leukemia 2009; 23 : 1957–1963.
20. Cross NC, White HE, Müller MC et al. Standardized definitions of molecular response in chronic myeloid leukemia. Leukemia 2012. Epub ahead of print.
21. White HE, Matejstchuk P, Rigsby P et al. Establishment of the 1st World Health Organization International Genetic Reference Panel for quantitation of BCR-ABL mRNA. Blood 2010; 116: e11–e117.
22. Cayuela JM, Macintyre E, Darlington M et al. Cartridge-based automated BCR-ABL1 mRNA quantification: solving the issues of standardization, at what cost? Haematologica 2011; 96 : 664–671.
23. Marin D, Ibrahim AR, Lucas C et al. Assessment of BCR-ABL1 transcript levels at 3 months is the only requirement for predicting outcome for patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. J Clin Oncol 2012; 30 : 232–238.
24. Hanfstein B, Müeller MC, Hehlmann R et al. Early molecular and cytogenetic response is predictive for long-term progression-free and overall survival in chronic myeloid leukemia (CML). Leukemia 2012. Epub ahead of print.
25. Klamová H, Machová Poláková K, Mužík J et al. The prognostic value of ELN-defined responses and of different BCR-ABL ratios for the outcome of patients with CML in chronic phase treated with imatinib as first line: evaluation of 5-year treatment of 458 patients from routine clinical setting. Odesláno do časopisu Haematologica k posouzení.
26. Kantarjian H, Shah NP, Hochhaus A et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. J Engl J Med 2010; 362 : 2260–2270.
27. Saglio G, Kim DW, Issaragrisil S et al. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. J Engl J Med 2010; 362 : 2251–2259.
28. Hughes TP, Lipton JH, Leber B et al. Complete molecular response (CMR) rate with nilotinib in patients (pts) with chronic myeloid leukemia in chronic phase (CML-CP) without CMR after ≥ 2 years on imatinib: preliminary results from the randomized ENESTcmr trial of nilotinib 400 mg twice daily (BID) vs. imatinib. Blood 2011; 118 : 278. Abstract 606.
29. Graham SM, Jørgensen HG, Allan E et al. Primitive, quiescent, Philadelphia-positive stem cells from patients with chronic myeloid leukemia are insensitive to STI571 in vitro. Blood 2002; 99 : 319–325.
30. Cortes J, O’Brien S, Kantarjian H. Discontinuation of imatinib therapy after achieving a molecular response. Blood 2004; 104 : 2204–2205.
31. Mahon FX, Réa D, Guilhot J et al. Discontinuation of imatinib in patients with chronic myeloid leukemia who have maintained complete molecular remission for at least 2 years: the prospective, multicenter Stop Imatinib (STIM) trial. Lancet Oncol 2010; 11 : 1029–1035.
32. Ross DM, Branford S, Seymour JF et al. Patients with chronic myeloid leukemia who maintain a complete molecular response after stopping imatinib treatment have evidence of persistent leukemia by DNA PCR. Leukemia 2010; 10 : 1719–1724.
33. Kolb HJ, Schattenberg A, Goldman JM et al. Graft-versus-leukemia effect of donor lymphocyte transfusions in marrow grafted patients. Blood 1995; 86 : 2041–2050.
34. Soverini S, Hochhaus A, Nicolini FE et al. BCR-ABL kinase domain mutation analysis in chronic myeloid leukemia patients treated with tyrosine kinase inhibitors: recommendations from an expert panel on behalf of European LeukemiaNet. Blood 2011; 118 : 1208–1215.
35. Soverini S, Poerio A, Vitale A et al. At the time of diagnosis, Ph cells from both chronic phase chronic myeloid leukemia and acute lymphoblastic leukemia patients already harbor BCR-ABL kinase domain mutations. Haematologica 2009; 94 (Suppl 2): 214. Abstract 526.
36. Khorashad JS, de Lavallade H, Apperley JF et al. Finding of kinase domain mutations in patients with chronic phase chronic myeloid leukemia responding to imatinib may identify those at high risk of disease progression. J Clin Oncol 2008; 26 : 4806–4813.
37. Machova Polakova K, Polivkova V, Rulcova J et al. Constant BCR-ABL transcript level >or=0.1% (IS) in patients with CML responding to imatinib with complete cytogenetic remission may indicate mutation analysis. Exp Hematol 2010; 38 : 20–26.
38. Branford S, Rudzki Z, Parkinson I et al. Real-time quantitative PCR analysis can be used as a primary screen to identify patients with CML treated with imatinib who have BCR-ABL kinase domain mutations. Blood 2004; 104 : 2926–2932.
39. Soverini S, Martinelli G, Amabile M et al. Denaturing-HPLC-based assay for detection of ABL mutations in chronic myeloid leukemia patients resistant to Imatinib. Clin Chem 2004; 50 : 1205–1213.
40. Packer LM, Rana S, Hayward R et al. Nilotinib and MEK inhibitors induce synthetic lethality trough paradoxical activation of RAF in drug-resistant chronic myeloid leukemia. Cancer Cell 2011; 20 : 715–727.
41. Machova Polakova K, Lopotova T, Klamova H et al. High-resolution melt curve analysis: initial screening for mutations in BCR-ABL kinase domain. Leuk Res 2008; 32 : 1236–1243.
42. Doi Y, Sasaki D, Terada C. High-resolution melting analysis for a reliable and two-step scanning of mutations in the tyrosine kinase domain of the chimerical BCR-ABL gene. Int J Hematol 2009; 90 : 37–43.
43. Roche-Lestienne C, Soenen-Cornu V, Grardel-Duflos N et al. Several types of mutations of the Abl gene can be found in chronic myeloid leukemia patients resistant to STI571, and they can pre-exist to the onset of treatment. Blood 2002; 100 : 1014–1018.
44. Gruber FX, Lamark T, Anonli A et al. Selecting and deselecting imatinib-resistant clones: observations made by longitudinal, quantitative monitoring of mutated BCR-ABL. Leukemia 2005; 19 : 2159–2165.
45. Ernst T, Erben P, Müller MC et al. Dynamics of BDCR-ABL mutated clones prior to hematologic or cytogenetic resistance to imatinib. Haematologica 2008; 93 : 186–192.
46. Parker WT, Lawrence RM, Ho M et al. Sensitive detection of BCR-ABL1 mutations in patients with chronic myeloid leukemia after imatinib resistance is predictive of outcome during subsequent therapy. J Clin Oncol 2011; 29 : 4250–4259.
47. Zhang B, Irvine D, Ho YW et al. Inhibition of chronic myeloid leukemia stem cells by the combination of the hedgehog pathway inhibitor LDE225 with nilotinib. Blood 2010; 116 : 227. Abstract 514.
48. Nair RR, Tolentino JH, Argilagos RF et al. Potentiation of Nilotinib-mediated cell death in the context of the bone marrow microenvironment requires a promiscuous JAK inhibitor in CML. Leuk Res 2012; 36 : 756–763.
49. Irving JA, O’Brien S, Lennard AL et al. Use of denaturing HPLC for detection of mutations in the BCR-ABL kinase domain in patients resistant to Imatinib. Clin Chem 2004; 50 : 1233–1237.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2012 Číslo Suppl 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Akutní myeloidní leukemie – historický vývoj a současnost léčby ve světě a v ÚHKT
- Akutní lymfoblastová leukemie: historie a současnost
- Chronická myeloidní leukemie – zásadní změna prognózy nemocných po zavedení léčby inhibitory tyrozinových kináz
- Molekulární genetika v diagnostice a léčbě chronické myeloidní leukemie
- Transplantace krvetvorných buněk a její role v léčbě chorob krvetvorby během posledních 25 let
- Prevence a léčba infekčních komplikací v hematoonkologii
- Naléhavé stavy v hematologii
- Péče o pacienty s hemofilií a jejich rodiny v ÚHKT
- 60 let Ústavu hematologie a krevní transfuze Praha
- Sledování vrozených a získaných, strukturních a funkčních změn fibrinogenu
- Myelodysplastický syndrom. Pokroky v diagnostice a léčbě během 30 let trvání registru nemocných s myelodysplastickým syndromem v ÚHKT
- Využití „label-free“ proteinových čipů pro proteomiku onkohematologických onemocnění
- Hemaferéza – vysoce účinná technika v terapii nemocných
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Naléhavé stavy v hematologii
- Hemaferéza – vysoce účinná technika v terapii nemocných
- Chronická myeloidní leukemie – zásadní změna prognózy nemocných po zavedení léčby inhibitory tyrozinových kináz
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



