-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba diabetického makulárního edému
Treatment of diabetic macular oedema
Diabetic macular oedema (DMO) is currently the main complication associated with diabetes. The percentage of patients with DMO grows alongside the increasing number of diabetes occurrences. The DMO treatment has seen major developments in the past few years. A number of new treatment technologies have emerged, which enable not only a stabilisation of macular oedema but in the case of an early detection also a decrease of retina oedema accompanied by a visual functions improvement. Laser coagulation has remained the standard DMO treatment for many years; when applying modern diagnostic testing technologies (FAG and OCT), the newest trend in DMO treatment is the use of anti-VEGF preparations, depot intravitreal corticoids and in some cases also surgical intervention in the form of pars plana vitrectomy (PPV). The DMO treatment algorithm is presented in this paper.
Key words:
diabetic macular oedema (DMO/DME) – anti-VEGF – pars plana vitrectomy (PPV) – depot corticoids – laser coagulation
Autori: J. Ernest
Pôsobisko autorov: Oční klinika 1. lékařské fakulty UK a ÚVN Praha, přednosta doc. MUDr. Jiří Pašta, CSc., FEBO
Vyšlo v časopise: Vnitř Lék 2013; 59(3): 194-200
Kategória: XIII. sympozium: Diabetes mellitus – oční komplikace Praha, 12. 10. 2012 - Přehledné referáty
Súhrn
Diabetický makulární edém (DME) je v současné době hlavním problémem diabetu. Procento pacientů s DME roste spolu se zvyšujícím se výskytem diabetu. Vývoj léčby DME prodělal v posledních letech bouřlivý rozvoj. Objevila se řada léčebných technik, které umožňují nejen stabilizaci makulárního edému, ale v případě včasného záchytu snížení edému sítnice spolu se zlepšením zrakových funkcí. Laserkoagulace zůstává po řadu let standardem léčby DME, při využití moderních diagnostických vyšetřovacích technik (FAG a OCT) nastupuje trend léčby DME pomocí anti-VEGF preparátů, depotních intravitreálních kortikoidů a v některých případech i chirurgické řešení pomocí pars plana vitrektomie (PPV). V práci je prezentován algoritmus léčby DME.
Klíčová slova:
diabetický makulární edém (DME) – anti-VEGF – pars plana vitrektomie (PPV) – depotní kortikoidy – laserkoagulaceÚvod
Se zvyšující se incidencí, dosahující v poslední dekádě téměř 25 %, se makulární edém stává hlavním problémem diabetu. Studie ukazují, že u více než 40 % pacientů s diabetem 1. typu se v průběhu života rozvine diabetický makulární edém (DME) [6,8]. Díky pokrokům v léčbě diabetu, stále se prodlužujícímu lidskému věku lze předpokládat, že v budoucích letech nadále incidence komplikací diabetu (včetně DME) poroste. Význam hledání nových cest léčby DME roste i s faktem, že na rozdíl od věkem podmíněné makulární degenerace (VPMD), kde onemocnění postihuje více lidi staršího věku, DME postihuje ve větší míře lidi v produktivním věku a léčení nabývá chroničtějšího charakteru, trvajícího často nepoměrně déle proti VPMD. I když projevy proliferativní diabetické retinopatie jsou velmi závažné pro prognózu vidění a riziko slepoty, DME významnější mírou postihuje centrální vidění. U mnohých pacientů s těžkými proliferativními projevy je centrální vidění jen minimálně postižené, zatímco DME téměř vždy těžce narušuje zrakové schopnosti pacientů, kteří jinak v ohrožení slepotou nejsou.
Klasifikace DME je stále nejednotná, v závislosti na etiologii, charakteru vzniku, lokalizaci, rozsahu. Rozdělení na ischemický a neischemický DME často naráží na problematiku diagnostiky a posouzení míry hypoxie v makule. Pro její posouzení je nezbytné zhodnocení pomocí fluorescenční angiografie (FAG) a korelace s optickou koherenční tomografií (OCT), spolu s klinickým vyšetřením v arteficiální mydriáze. Ne všechna pracoviště však standardně FAG provádějí a diagnostika typu DME se tak opírá pouze o klinické vyšetření a OCT, což je pro posouzení míry hypoxie nedostatečné. Navíc je známý fakt, že u každého DME je jistá míra hypoxie, která je obecně v pozadí téměř každého makulárního edému. Podstatnější je stanovení kritérií pro léčbu a stanovení adekvátního léčebného postupu. Podle ETDRS [4] je indikací pro léčbu nález tzv. klinicky signifikantního makulárního edému (CSME) definovaného jako:
- a) oblast retinálního ztluštění do 500 μ od centra fovey,
- b) tvrdé, žluté exsudáty do 500 μ od centra fovey ve spojení se ztluštěním fovey,
- c) retinální ztluštění v rozsahu nejméně 1 PD (papilární diametr) v jakékoliv oblasti od centra fovey.
V léčbě DME významnou a mnohdy zásadní roli hraje celková léčba diabetu. U řady pacientů výška edému a zraková ostrost a reakce na léčbu přímo koreluje s kompenzací diabetu. Kontrola celkové léčby diabetu, hypertenze a těsná kontrola lipidového metabolizmu by měla být součástí léčby oftalmologem. Výsledky studie Diabetes Control and Complications Trial prokázala při intenzivní kontrole diabetu výraznou redukci progrese retinopatie ze 79 % ve 4 letech na 53 % v 10letém sledování [7]. ETDRS studie prokázala výraznou redukci tvrdých exsudátů, jejichž výskyt je ve spojení s poklesem zrakové ostrosti a snížením kardiovaskulárních komplikací po snížení hladiny cholesterolu a lipidů v séru [7,15].
Léčba DME zaznamenala v posledních 20 letech bouřlivý vývoj. V závislosti na pokroku v diagnostice DME, především se zavedením FAG, OCT se objevily nové léčebné postupy (mikropulzní lasery, anti-VEGF, depotní kortikoidy, chirurgické techniky), které nejen umožňují stabilizaci rozvoje makulárního edému, ale v případě včasného záchytu onemocnění i redukci s návratem zrakových funkcí.
Laserkoagulace
Téměř přes 20 let byla laserkoagulace makulárního edému standardem léčby DME. Výsledky ETDRS studie prokázaly, že laserkoagulace sítnice vedla k 50% redukci těžké ztráty vízu po mřížkové laserové koagulaci makuly [4]. Další studie [2,3] prokázala u 1/3 pacientů po laserkoagulaci zlepšení o 10 písmen ETDRS. Současně však u 19 % pacientů s difuzním DME zaznamenala těžkou ztrátu vízu. Obě studie prokázaly pozitivní přínos laserové koagulace u ložiskových edémů, u difuzního DME však těžkým ztrátám vízu nezabrání. I přes fakt, že u difuzního DME je laserová koagulace minimálně účinná, zůstává laserkoagulace diabetické retinopatie a makulárního edému standardem léčby. Význam má především u ložiskových edémů nebo edémů menšího rozsahu. Stanovení indikace k léčbě by mělo vycházet z vyšetření na FAG a OCT vyšetření, která dokáží lokalizovat oblasti prosakování, hypoxie a edému. Obojí techniky mají velký význam pro sledování efektu léčby a indikaci opakování laseru (obr. 1, 2, 3 a 4). Obojí techniky mají nezastupitelné místo. FAG je kvalitativním ukazatelem stanovujícím rozsah cévního postižení. Patologickým obrazem jsou oblasti hyperfluorescence a prosakování kontrastní látky patologickou vaskulární sítí. FAG neumožňuje odlišit, zda jde o klinicky signifikantní edém, a obtížně určuje indikaci k léčbě. OCT ukazuje 3 základní patologické obrazy:
Obr. 1. FAG ložisková hyperfluorescence a prosakování kontrastní látky nad makulou před fokální laserkoagulací. 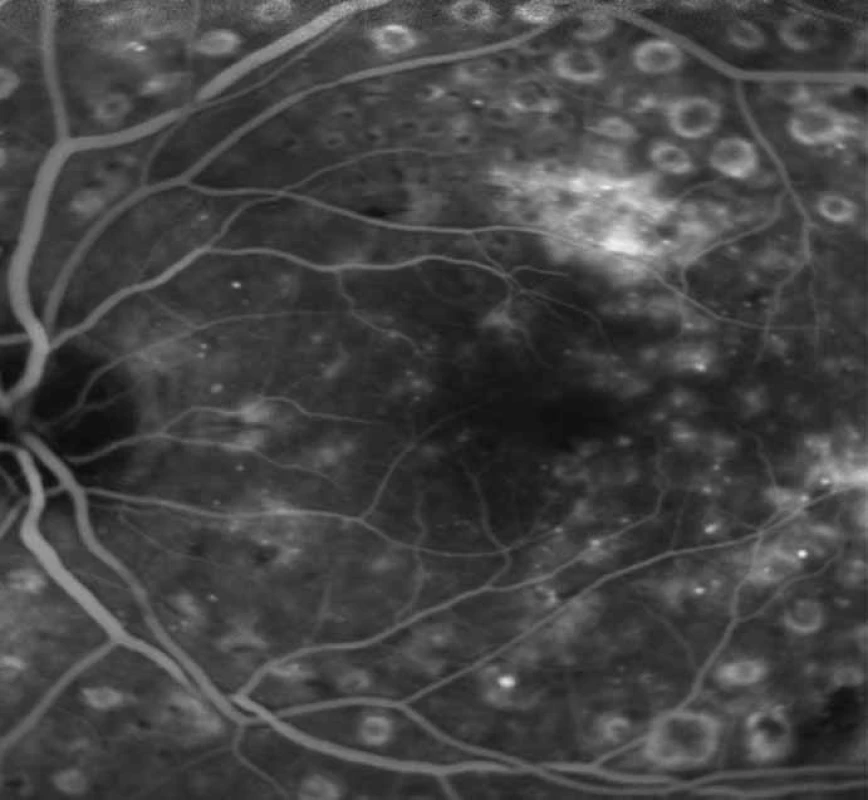
Obr. 2. OCT snímek – edém sítnice paramakulárně, korelující s prosakováním patrném na FAG. 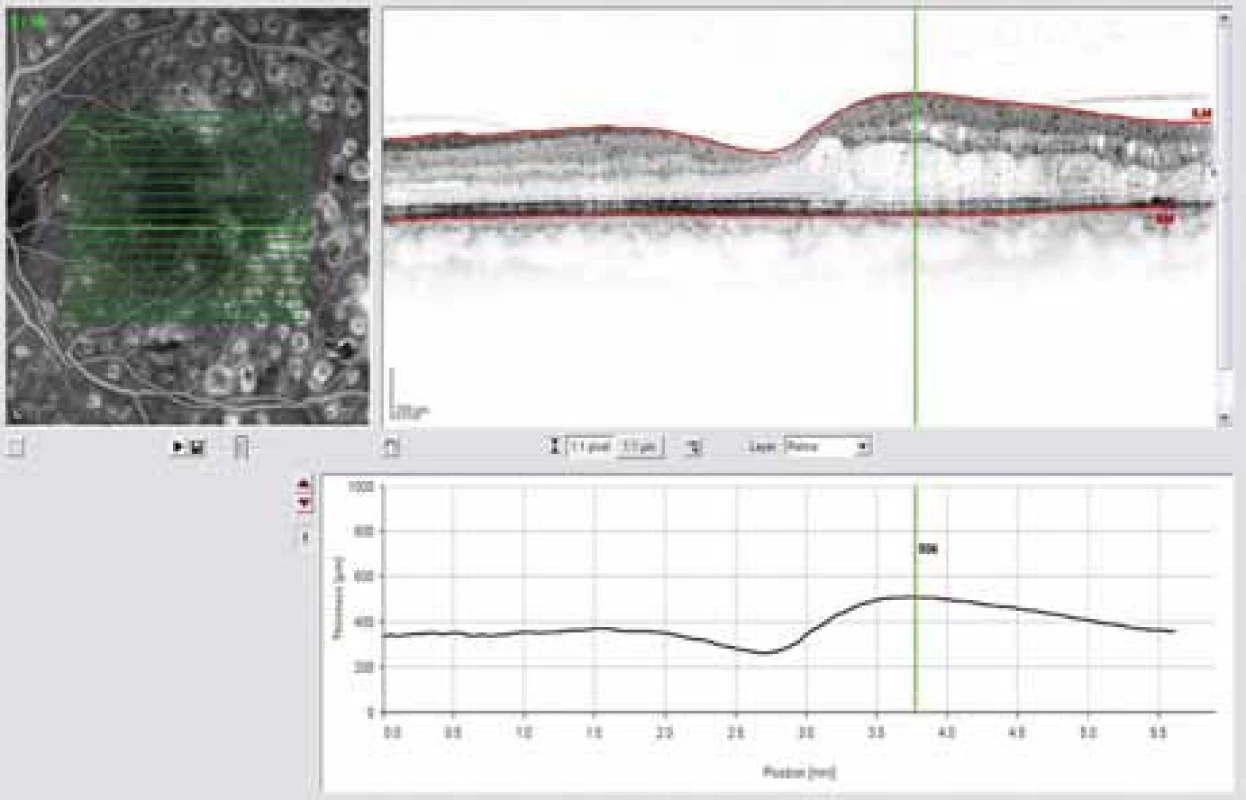
Obr. 3. FAG – ústup prosakování po fokální laserkoagulaci v místě prosakování kontrastní látky. 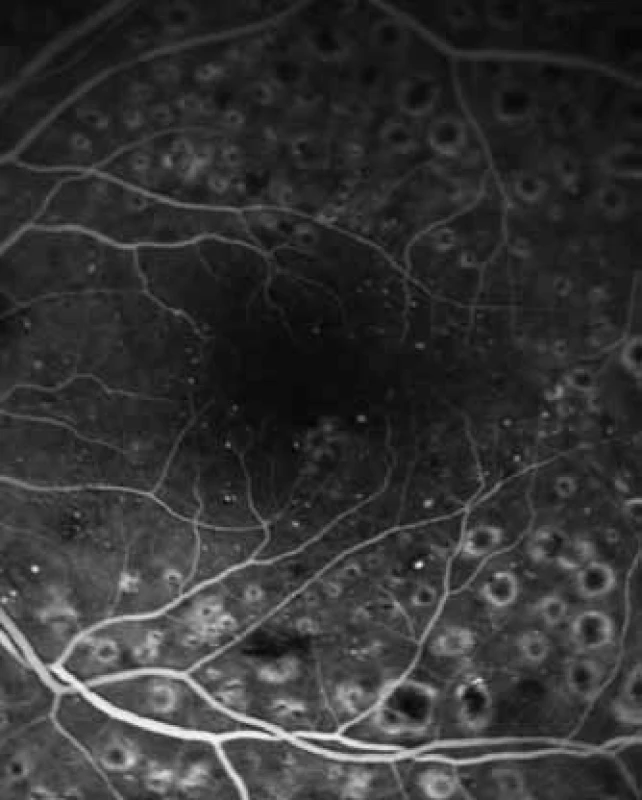
Obr. 4. OCT snímek – ústup prosáknutí sítnice po fokální laserkoagulaci. 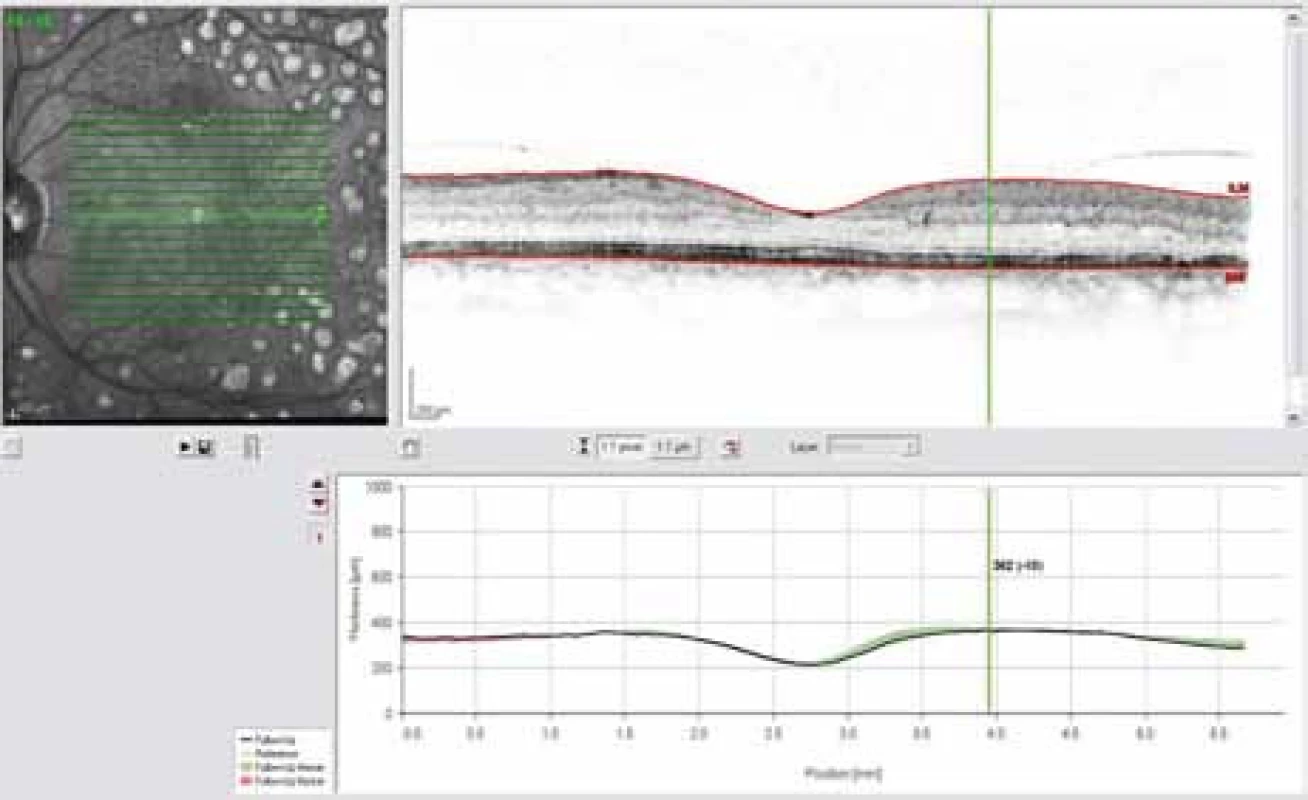
- retinální edém,
- retinální cysty,
- serózní odchlípení sítnice.
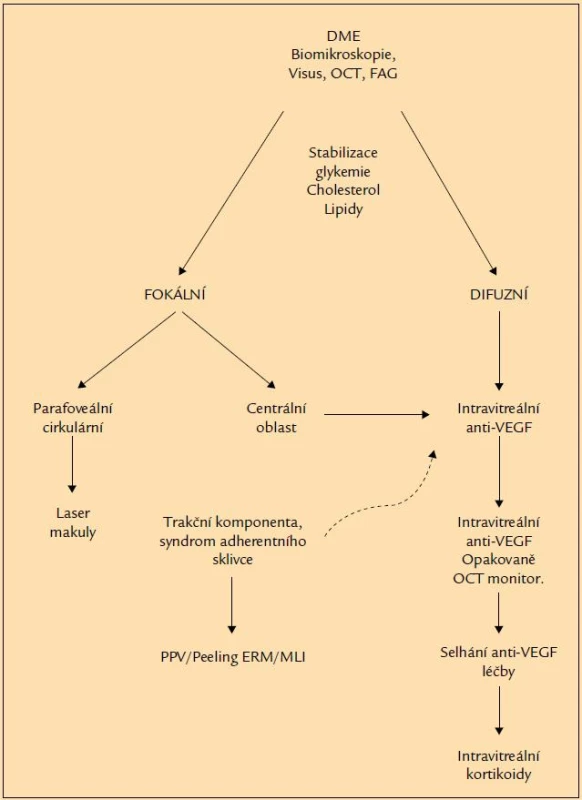
Umožňuje kvantitativní zhodnocení závažnosti edému a reakci na léčbu. Přesná hranice mezi ložiskovým edémem a difuzním edémem neexistuje. Je řada hraničních forem, kde ložisková laserová koagulace poměrně širokého, ale mělkého edému přináší efekt ve snížení edému a zlepšení zrakových funkcí. Na druhou stranu poměrně ohraničený, ale vysoký edém, reprezentovaný značným prosáknutím sítnice, cystoidní přestavbou hlavně v zevních plexiformních vrstvách, tvrdými žlutými ložisky velmi obtížně reaguje na laserkoagulaci. Při takovém obrazu je mnohdy jen velmi obtížné laserovou koagulaci provést, k vytvoření koagulační stopy je zapotřebí vyšších energií laseru, které jsou však zároveň destruktivní k citlivé neuroepitelii. Některé novější studie podporují specifická léčebné laserovací schémata podle OCT obrazů makulárního edému většího než 300 μ (tzv. TSME – tomografically significant macular edema) [16]. I když počítačový program provádějící laserkoagulaci pouze oblastí nad 300 μ má logický základ, neměla by léčba spočívat pouze ve zhodnocení výsledků počítačových vyšetření. V případě obtížněji reagujících nálezů je mnohdy i úprava glykemie, lipidového metabolizmu a kompenzace TK pomocná k posílení efektu laserkoagulace. Nové typy laserů (mikropulzní a barevné lasery) jsou šetrnější k citlivým vrstvám sítnice a rozšiřují indikační spektrum [5,17]. V současné době je laserová koagulace indikována u ložiskového DME. U difuzního DME je indikace mřížkové koagulace makuly v současné době limitovaná rozsahem, charakterem a výškou edému a má minimální naději na zlepšení zrakových funkcí. V případě difuzního DME, který je refrakterní na počáteční laserkoagulaci, je indikována jiná léčebná metoda. Přehledné schéma léčebných možností a algoritmus léčby DME je znázorněn na obr. 5.
Anti-VEGF
V posledních 10 letech se anti-VEGF léčba stala dominantní terapií u řady patologických stavů (věkem podmíněná makulární degenerace, venózní okluze, neovaskulární glaukom, diabetická proliferativní retinopatie, DME, myopická degenerace – CNV, zánětlivá onemocnění sítnice, cystoidní makulární edém a další). Argumentem pro podání anti-VEGF jsou v četných studiích prokázané vysoké hodnoty VEGF faktorů ve sklivci a sítnici u těchto patologických stavů. Řada studií potvrdila, že VEGF faktory jsou hybnou silou kaskády cytokininové reakce při rozvoji DME. VEGF zvyšuje vaskulární permeabilitu, čímž dochází k extravazálnímu prosakování tekutiny a vzniku edému. READ-2 studie prezentovala v roce 2010 výsledky intravitreální injekce ranibizumabu (Lucentis). Ve 2letém sledování prokázala podstatné snížení tloušťky sítnice spojené se zlepšení zrakové ostrosti po intravitreální injekci Lucentisu proti standardní léčbě laserkoagulací u difuzního DME [13]. Anti-VEGF léčba se prokázala být podle výsledků této studie velmi účinnou technikou (obr. 6, 7 a 8). Nedostatkem však bylo, že efekt trval poměrně krátkou dobu, asi 4–6 týdnů. K dosažení trvalého léčebného efektu jsou nezbytná opakovaná podání. Je nutné očekávat, že v průměru je zapotřebí 7–8 dávek v 1. roce léčby a 4–6 dávek ve 2. roce léčby. I přesto, že je léčba velmi nákladná, stala se v současné době pro svou vysokou účinnost lékem 1. volby (obr. 6 a 7). Anti-VEGF aplikace má minimum komplikací a vedlejších účinků, a to i ve srovnání s laserkoagulací. Dodatečné provedení laserkoagulace (kombinovaná léčba) může mít vliv na redukci nezbytného počtu anti-VEGF injekcí. Další studie RESTORE z roku 2011 potvrdila závěry výše uvedených studií a demonstrovala podstatně vyšší účinnosti intravitreální injekce Lucentisu v monoterapii proti laserkoagulaci samotné nebo v kombinaci s laserem [14]. Celkový počet nezbytných injekcí k dosažení maximálního účinku byl 7,1 vs 4,8 v kombinaci s laserkoagulací. Další studie RISE a RIDE víceméně prokazují shodné výsledky – u 1/3 pacientů zlepšení o více než 15 písmen ETDRS ve tříletém sledování po injekci Lucentisu [11]. Léčba difuzního DME, obzvláště delšího trvání než 6 měsíců, bývá velmi zdlouhavá a svízelná. Kombinovaný přístup sice nezaznamenal větší léčebný efekt ve smyslu větší redukce edému a zlepšení vízu, snížila se však potřeba opakovaných injekcí anti-VEGF injekcí. V posledních letech se pro kombinovanou léčbu využívá technika postaplikační doplňující laserkoagulace pomocí mikropulzních laserů. Tato technika má určité odlišnosti, energie laseru má být minimální k vytvoření pouze slabě viditelné stopy, stopou obvykle menší kolem 100 μ a časem 10 ms. Energie bývá do 250 mW. Má menší destruktivní charakter, menší tendenci k sekundární následné expanzi do okolní tkáně při zachování stejného terapeutického efektu [5,17]. Hlavní roli při indikaci opakovaných anti-VEGF látek nebo pro změnu léčebného schémata hraje monitoring pomocí OCT vyšetření, vyšetření zrakové ostrosti v pravidelných měsíčních intervalech. Anti--VEGF léčba se stala v současné době standardem léčby difuzního DME. Dosavadní klinické zkušenosti i výsledky randomizovaných studií ukazují, že po anti-VEGF aplikacích dochází k redukci tloušťky sítnice v makule doprovázené ve většině případů zlepšením zrakové ostrosti. V některých případech (hlavně déletrvajícího edému, cystoidní intraretinální přestavby) nemusí být nutně ústup edému sledovaný zlepšením vízu. Déletrvající edém asi více než 6 měsíců vede k trvalému narušení synaptických spojů a trvalému poškození neuroepitelie [17]. Ani anatomická úprava pak není sledována zlepšením zrakové ostrosti. Z výše uvedeného vyplývá, že indikace k anti-VEGF léčbě by měla být stanovena pokud možno co nejdříve od vzniku DME, nejpozději do 3–6 měsíců. Pozdější stadia bývají častěji rezistentní na léčbu. Difuzní diabetický makulární edém (DDME) trvající déle než 1 rok má obvykle minimální naději na trvalý funkční efekt. Léčba déletrvajících chronických edémů má často typický průběh – po iniciálních injekcích zlepšení a po vynechání pravidelné aplikace vždy opětovný nárůst edému a zhoršení vízu. Pacienti se tak dostávají do situace nepřetržitého podávání anti-VEGF látky, po které vždy nastává zlepšení a bez aplikace zhoršení vízu. V těchto případech, kdy prakticky nepřetržitě aplikujeme anti-VEGF k dosažení žádoucího efektu, se stává léčba DME velmi nákladnou. V současné době nejsou jednoznačně stanoveny maximální počty anti-VEGF aplikací. Dosud nebyla prokázaná toxicita léku ani po mnohočetných injekcích v průběhu 3 let. Nicméně stav, kdy pouze opakované nepřetržité injekce udrží zrakové funkce na přijatelné úrovni a bez ní dochází ke zhoršení, je nutné považovat za určitou formu nonresponse a je třeba zvážit alternativní léčbu (depotní kortikoidy, pars plana vitrektomie).
Obr. 6. FAG – difuzní diabetický makulární edém refrakterní na laserkoagulaci. 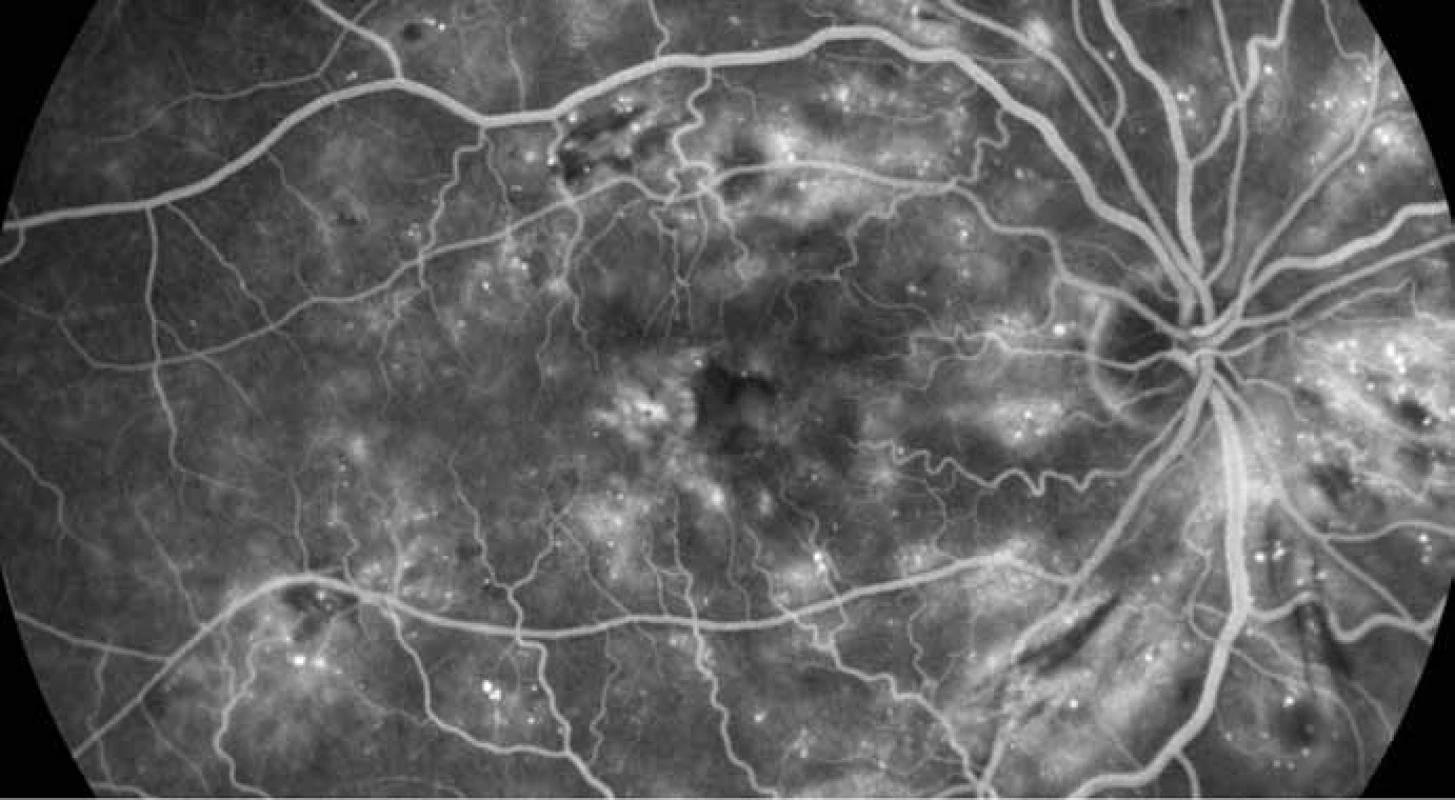
Obr. 7. OCT snímek – difuzní diabetický makulární edém před intravitreální injekcí Lucentisu. 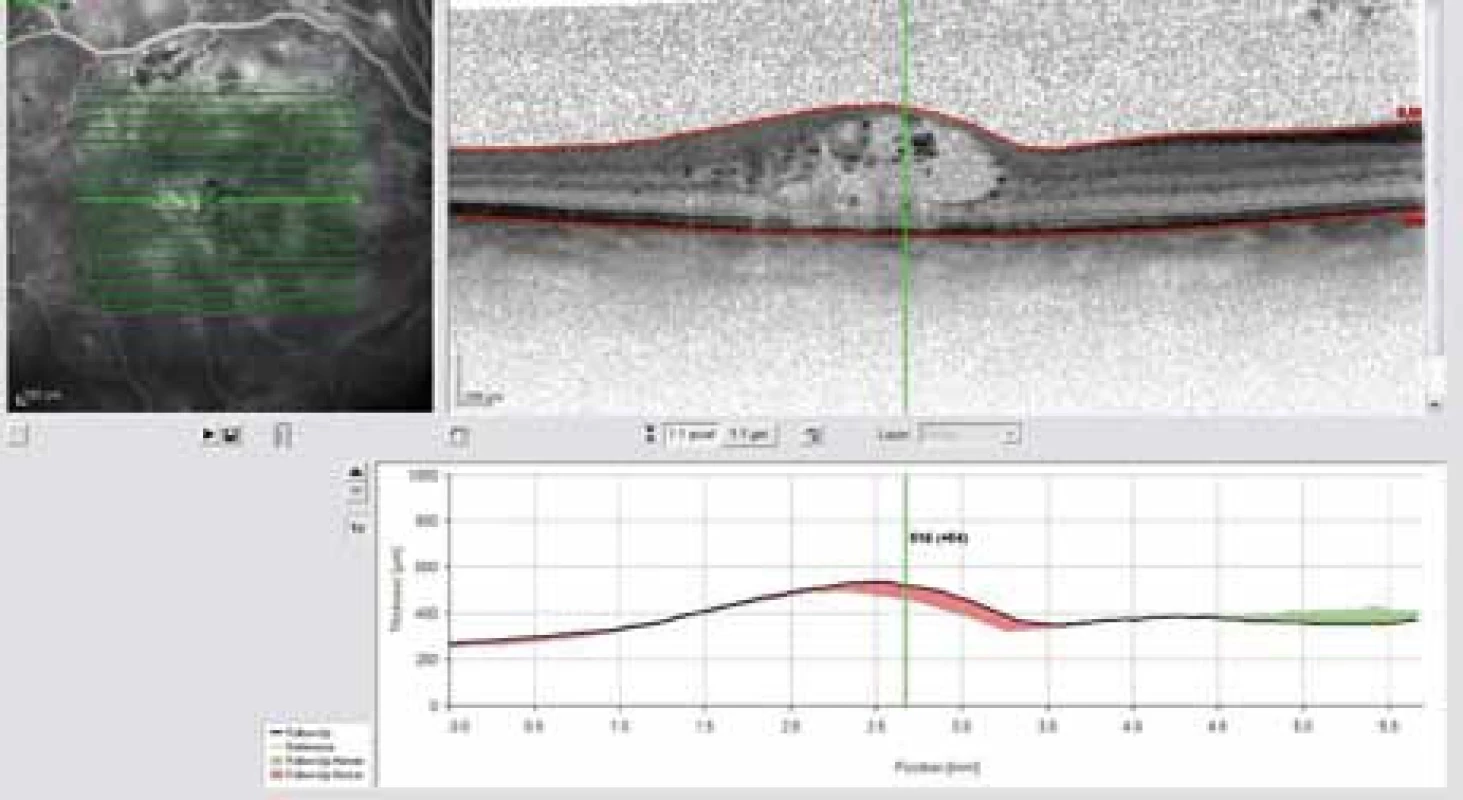
Obr. 8. OCT snímek – ústup edému sítnice v makule za 2 měsíce od injekce Lucentisu. 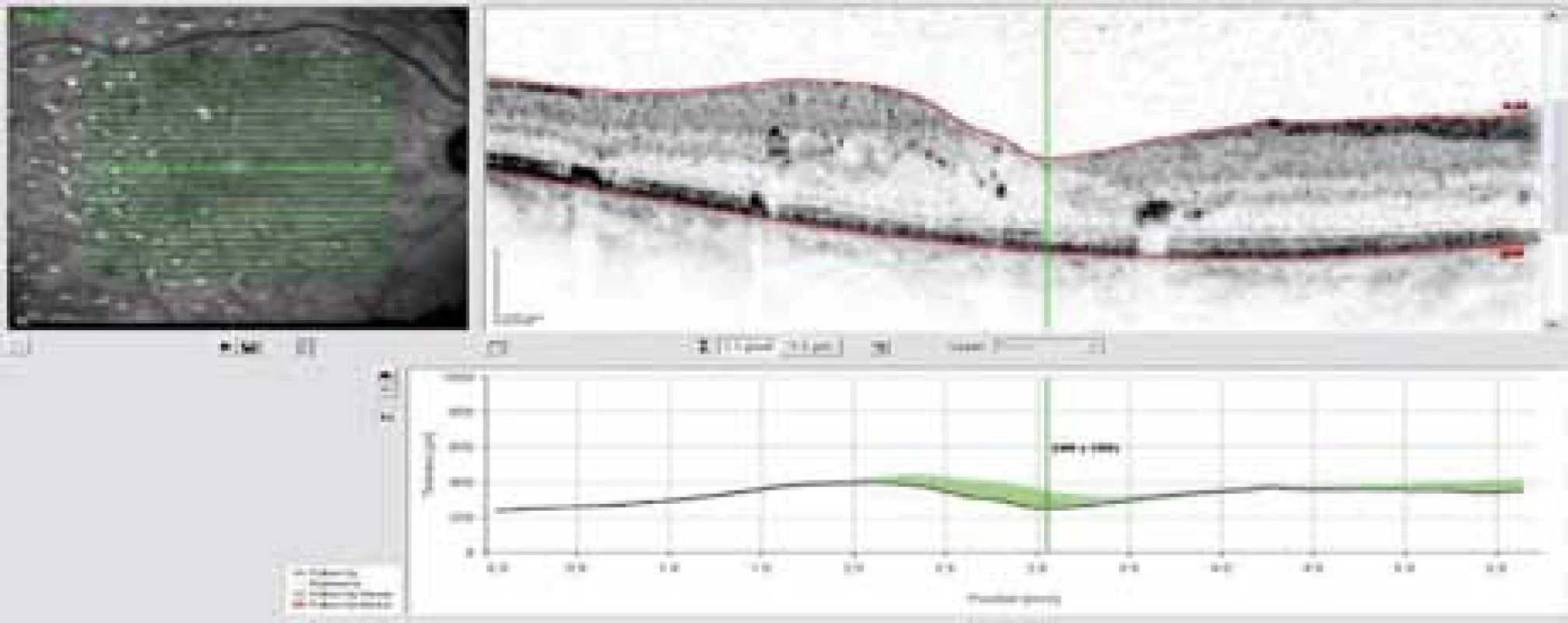
Kortikoidy
Klinické výzkumy i empirická sledování prokázaly, že intravitreální injekce triamcinolonu často působí obdobně jako anti-VEGF preparáty, tj. snížení intraretinálního edému sledované zlepšením zrakové ostrosti. Výhodou kortikoidů proti anti-VEGF je, že působí déle, některé formy 4–6 měsíců. Kortikoidy někdy působí na redukci edému i tam, kde anti-VEGF léčba selhává. Mechanizmus působení kortikoidů je odlišný proti anti-VEGF. Působí na řadu cytokininů (např. interleukin 6, interleukin 8, MCP-1), na které anti-VEGF vliv nemají. To může být i vysvětlení, proč v některých případech DME jsou anti-VEGF málo účinné nebo po počátečním mírném efektu je další aplikace bez efektu. Bohužel mají intravitreální kortikoidy řadu vedlejších účinků a komplikací. Těmi jsou kataraktogenita a elevace nitroočního tlaku (NT) po aplikaci. Zatímco rozvoj katarakty nebývá při dnešní úrovni kataraktové chirurgie problémem, elevace NT bývá často dlouhodobá a vyžaduje chronickou medikaci a v některých případech i chirurgické řešení. Procento sekundárního glaukomu vyžadujícího chronickou medikaci je poměrně vysoké, dosahuje podle některých zdrojů 30–40 % [9]. Před érou anti-VEGF byla injekce triamcinolonu k redukci DME velmi populární, ať už jako monoterapie nebo v kombinaci s laserkoagulací, ev. jakožto příprava pro snížení edému před laserovým zákrokem. Pro výše popsané komplikace je dnes použití injekce triamcinolonu při vcelku dostupné anti--VEGF léčbě metodou léčby výjimečnou. Více se dnes injekce triamcinolonu využívá spíše v rámci nitrooční chirurgie při pars plana vitrektomii (PPV) ke zviditelnění sklivce a poruch vitreoretinálního rozhraní nebo v závěru PPV obzvláště u artefakie, kde riziko kataraktogenity nehrozí. Významnější místo budou mít v budoucnu zřejmě depotní kortikoidy, které se již dnes využívají v řešení makulárního edému jiné etiologie – venózních okluzí. Depotní kortikoidy (Ozurdex – dexametazon, Iluvien – flucinolon) jsou injikovány do sklivce v depotní formě speciálním zavaděčem cestou pars plana. Kortikoid se zvolna uvolňuje během 4–6 měsíců. Komplikace jsou u těchto depotních forem minimální a preparáty vykazují vysokou účinnost. Některé studie prokazují vysokou účinnost právě u forem DME, kde předchozí léčba anti-VEGF selhává [1], tj. při nálezu intraretinálních cyst a lakun (obr. 9 a 10). Z klinické praxe a z některých observačních studií se ukazuje, že u exsudativních forem DME zase mají vyšší účinnost anti-VEGF preparáty. U kterých forem DME má ten který preparát větší účinnost proti druhému, to je stále předmětem diskuzí a není zcela jasné. Studie COMRADE sledující efekt Lucentisu proti Ozurdexu v léčbě DME, jejíž první výsledky budou prezentované v tomto roce, by měla dát odpověď na tuto otázku. I když se zdá léčba pomocí Ozurdexu velmi slibná, v České republice není tento preparát pro léčbu DME dosud registrován.
Obr. 9. OCT snímek – difuzní diabetický makulární edém refrakterní na anti-VEGF léčbu, před injekcí depotního kortikoidu – Ozurdexu. 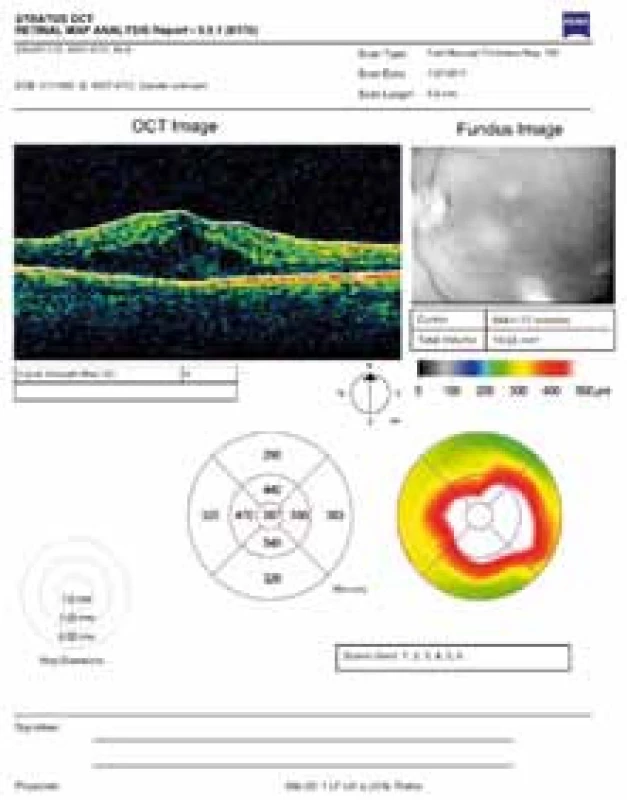
Obr. 10. OCT snímek – ústup edému sítnice za 2 měsíce po intravitreální injekci Ozurdexu. 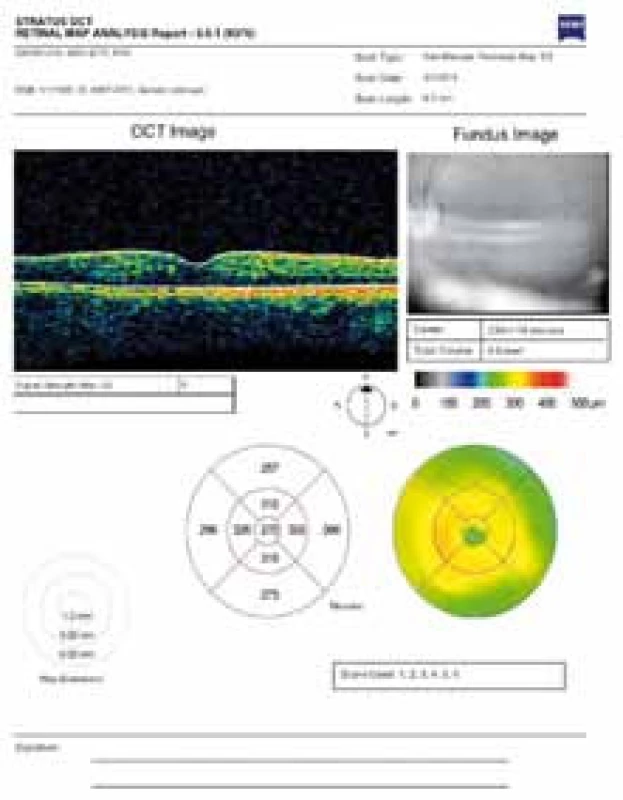
Pars plana vitrektomie – PPV
Za zvýšenou vaskulární permeabilitu u DDME bývají kromě vaskulárních příčin odpovědné i abnormality VR rozhraní, tj. vitreoretinální gliovaskulární proliferace, VR trakce, adhezivní patologický kortikální sklivec. Některé práce prokázaly ústup makulárního edému spojený se zlepšením zrakové ostrosti po spontánním odloučení kortikálního sklivce [1]. Další práce prokázaly zlepšenou retinální oxygenaci po chirurgickém odstranění sklivce a patologické membrana limitans interna – MLI [6]. Tyto nálezy iniciovaly další práce k posouzení pozitivní role PPV s peelingem nebo bez něj v léčbě DDME. DRCR-net studie zahrnující 87 pacientů s DDME a prokázanou patologií VR rozhraní prokázala snížení tloušťky sítnice po PPV s peelingem MLI v průměru o 160 μ a 50% redukci u 68 % pacientů [3]. Faktory spojené s lepším výsledkem byly hlavně horší zrakové funkce na počátku, vysoký edém sítnice, přítomnost epiretinální membrány (ERM), patologická MLI a evidence abnormalit VR rozhraní na OCT. I když riziko peroperačních a pooperačních komplikací je vyšší proti intravitreální injekci anti-VEGF nebo depotních kortikoidů, při rezistenci nebo slabé reakci nabízí PPV logickou alternativu léčby DDME (obr. 11).
Obr. 11. OCT snímek – příklad difuzního diabetického makulárního edému s patrným těsně adherentním sklivcem. Refrakterní na anti-VEGF i Ozurdex – stanovena indikace k PPV. 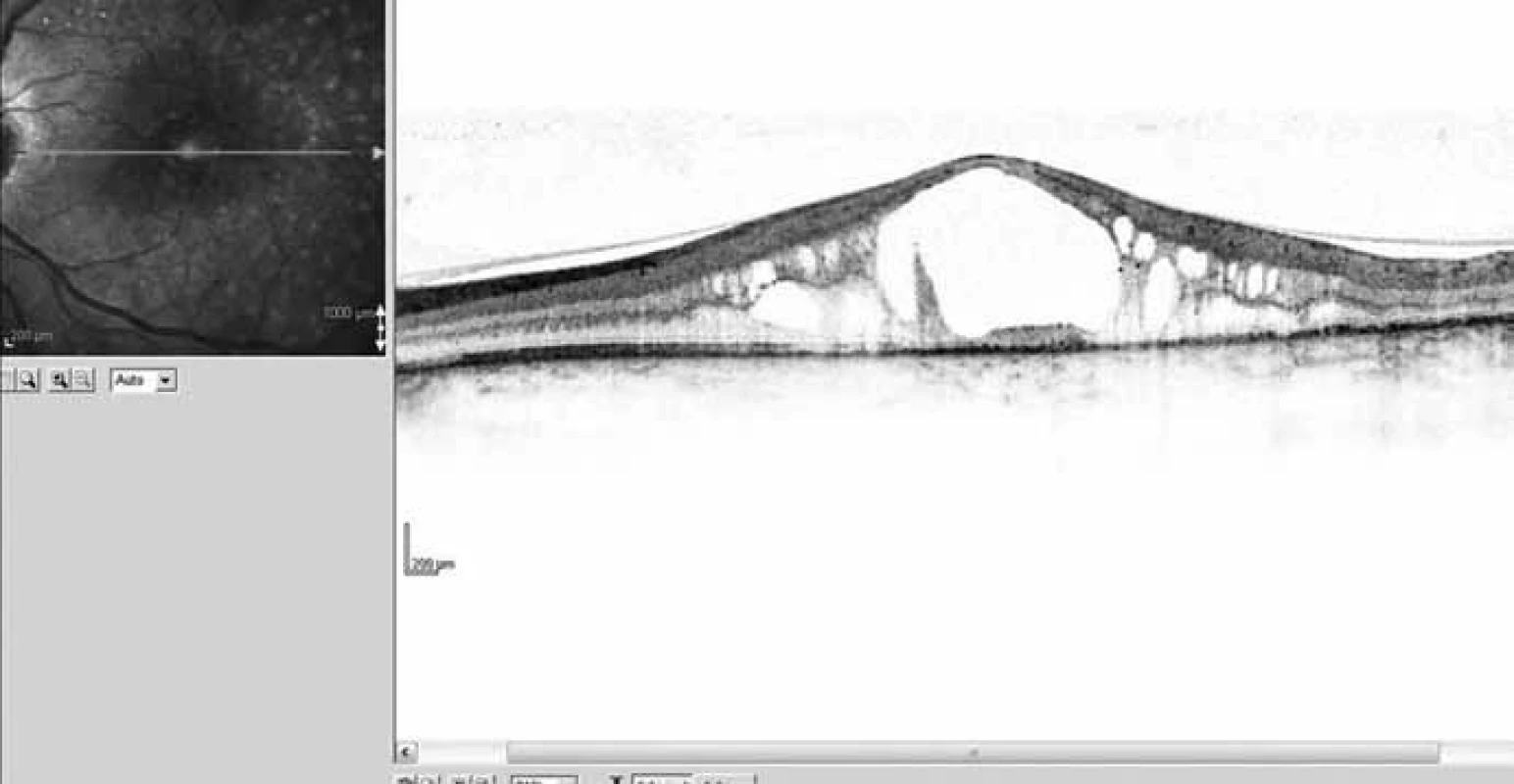
Argumenty pro PPV
- Nasrallah prokázal, že u pacientů s odchlípením zadního kortikálního sklivce (PVD) je výskyt DME výrazně menší než u pacientů s těsně adherujícím kortikálním sklivcem [10]. Spontánní odchlípení sklivce je spojeno s ústupem edému v 55 %. To ukazuje, že sklivec má pro metabolizmus sítnice významnou roli a těsně přiložený sklivec může mít pro vývoj DME nepříznivou roli. Někdy hovoříme o tzv. syndromu adherentního kortikálního sklivce. Odstraněním kortikálního sklivce odstraňujeme VR trakci.
- Odstraněním patologického sklivce nadměrně spotřebovávajícího kyslík dochází ke zlepšené oxygenaci vnitřních vrstev sítnice [8].
- Současně s odstraněním sklivce odstraňujeme i rezervoár s vyprodukovanými VEGF faktory.
- Aplikované anti-VEGF lépe a rychleji pronikají do sítnice [8].
- Normalizace sítnicové mikrocirkulace [12].
I když je peeling MLI z makulární oblasti sítnice stále předmětem diskuzí, z řady publikací a empirických pozorování je evidentní, že optimalizuje výsledky vitrektomie a prokazuje lepší výsledky proti samotné PPV bez peelingu [8]. Teprve po peelingu MLI lze s jistotou říci, že byla odstraněna veškerá patologická tkáň z povrchu sítnice.
Na základě současných poznatků lze stanovit indikace pro chirurgické řešení difuzního DME:
- Těsně adherující zadní kortikální sklivec – „syndrom kortikálního adherentního sklivce”.
- Difuzní DME refrakterního na předchozí léčbu (laser, anti-VEGF, depotní kortikoidy samotné nebo v kombinaci).
- Přítomná vitreoretinální trakce (OCT, Bscan UZ).
Závěr
Léčba DME podle typu, charakteru a délky trvání projevů vyžaduje při výběru léčebné techniky vždy individuální přístup. Všechny techniky výše popsané je možné použít jako monoterapii i ve vzájemné kombinaci podle zkušeností indikujícího vitreoretinálního odborníka. Léčba je vždy nedílnou součástí celkové léčby diabetu a doprovodných onemocnění, jako jsou hypertenze, poruchy lipidového metabolizmu a dalších. Součástí léčby je úzká spolupráce s diabetology a ev. dalšími odbornostmi. Vzhledem k nezbytnosti speciálních diagnostických a léčebných procedur by měla být soustředěna na specializovaná pracoviště zabývající se vitreoretinání problematikou.
Seznam použitých zkratek
CSME – klinicky signifikantní makulární edém
DME – diabetický makulární edém
DDME – difuzní diabetický makulární edém
ERM – epiretinální membrána
FAG – fluorescenční angiografie
MLI – membrana limitans interna
NT – nitrooční tlak
OCT – optická koherenční tomografie
PVD – odchlípení zadního kortikálního sklivce
PPV – pars plana vitrektomie
UZ - ultrazvuk
VEGF – vazoproliferativní faktor
VPMD – věkem podmíněná makulární degenerace
VR – rozhraní vitreoretinální rozhraníprim. MUDr. Jan Ernest, Ph.D.
www.uvn.cz
e-mail: ernesjan@uvn.cz
Doručeno do redakce: 27. 1. 2013
Zdroje
1. Boyer DS, Faber D, Gupta S et al. Ozurdex CHAMPLAIN Study Group. Dexamethazon intravitreal implant for treatment of diabetic macular edema in vitrectomized pacients. Retina 2011 : 4 (Epub ahead of print).
2. DRCR Network, Browning DJ, Glassman AR et al. Relationship between optical coherence tomography-measured central retinal thickness and visual acuity in diabetic macular edema. Opthalmology 2007; 114 : 525–536.
3. DRCR Network. Factors asscociated with visual acuity outcomes after vitrectomy for diabetic macular edema. Retina 2010; 30 : 1488–1495.
4. Early Treatment Diabetic Retinopathy Study Research Group. Treatment techniques and clinical quidelines for photocoagulation of diabetic macular edema. Early Treatment Diabetic Retinopathy Study Report No. 2. Opthalmology 1987; 94 : 761–774.
5. Figuera J, Khan J, Nunes N et al. Prospective randomized controlled trial comparing sub--threshold diode laser photocoagulation and conventional green laser for clinically significant macula edema. Br J Opthalmol 2009; 93 : 1341–1344.
6. Hikichi T, Fujio N, Akiba J et al. Association between the short-term natural history of diabetic macular edema and vitreomacular relationship in the II diabetes mellitus. Opthalmology 1997; 104 : 473–478.
7. Chew EY, Klein ML, Ferris FL et al. Association of elevated serum lipid levels with retinal hard exudate in diabetic retinopathy. Early Treatment Diabetic Retinopathy Study (ETDRS) Report 22. Arch Opthalmol 1996; 114 : 1079–1084.
8. Kampik A. Vitrectomy a viable option in select DME cases. Ocular surgery news 2012; 2 : 22.
9. Murphy R. Therapeutic triangulation: The DME treatment revolution. Retinal physician 2012; 4 : 54–57.
10. Nasrallah FP, Jalkh EA, Van Copenolle F et al. The role of the vitreous in diabetic macular edema. Opthalmology 1988; 95 : 1335–1339.
11. Nguyen QD, Brown DM, Marcus DM et al. Ranibizumab for diabetic macular edema: result from 2 phase III randomized trials: RISE and RIDE. Opthalmology 2012; 119 : 1064–1073.
12. Park JH, Woo SJ, Ho YJ et al. Effect of vitrectomy on microcirculation in patients with diffuse macular edema. Graefes Arch Clin Exp Opthalmol 2009; 217 : 1009–1017.
13. The READ-2 Study Group. Two-year outcomes of ranibizumab for edema of the macula in diabetes (READ-2) study. Opthalmology 2010; 117 : 2146–2151.
14. The RESTORE Study Group. Ranibizumab monoteraphy or combined with laser monotherapy for diabetic macular edema. Opthalmology 2011; 118 : 615–625.
15. UK Prospective Study Group. UKPDS38. Tight blood pressure control and risk of macrovascular and microvascular complication in type 2 diabetes mellitus. BMJ 1998; 317 : 703–713.
16.Virgil G, Manchini F, Diamastrogiovanni AF et al. Optical coherence tomography versus stereoscopic fundus photography or biomicroscophy for diagnostic macular edema. Inv. Opthalmol Vis Sci 2007; 48 : 4963–4973.
17. Vujosevic S, Bottega E, Casciano M et al. Microperimetry and fundus autofluorescence in diabetic macular edema: subthreshold micropulse diode laser versus modified early treatment diabetic retinopathy study laser photocoagulation. Retina 2010; 30 : 908–916.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Co nám přinesla největší studie v historii diabetologie?
- Změny hmotnosti a kompenzace diabetu (HbA1c) u nemocných s diabetes mellitus 2. typu po přidání exenatidu (Byetta) ke stávající léčbě ve 28 diabetologických ambulancích v ČR – studie BIBY-I (sledování 3–12 měsíců)
- Patofyziologie diabetické retinopatie
- Rizikové faktory diabetické retinopatie
- Současný stav diagnostiky a screeningu diabetické retinopatie a diabetického makulárního edému
- Přínos pars plana vitrektomie pro řešení komplikací proliferativní diabetické retinopatie
- Léčba diabetického makulárního edému
- Diabetická nefropatie/diabetické onemocnění ledvin
- Inkretinová terapie a diabetická retinopatie
- Současnost a perspektivy léčby inzulinem
- Diabetická retinopatie v Národním diabetologickém programu 2012–2022
- Problémy při sledování pacientů s diabetickou retinopatií
- Progrese diabetické retinopatie v těhotenství
- Diabetický makulární edém v posledním trimestru gravidity
- Řešení diabetického makulárního edému u diabetika 1. typu – chyby v mezioborové spolupráci
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diabetická nefropatie/diabetické onemocnění ledvin
- Léčba diabetického makulárního edému
- Progrese diabetické retinopatie v těhotenství
- Patofyziologie diabetické retinopatie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy