-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současnost a perspektivy léčby inzulinem
Present and future of insulin treatment
The main goal of modern insulin treatment is to bring diabetes control to physiological regulation as close as possible. We move from human insulin to insulin analogues which may due to their properties reduce glucose excursions (glucose variability) with hypoglycemic and hyperglycemic episodes. Besides short acting insulin analogues diminishing extension of hyperinsulinemia and postprandial hypoglycemia observed by human insulin treatment, the long-acting analogues are used to create stabilized insulin level and to prevent nocturnal hypoglycemia. Individualized insulin treatment is the basement for modern trends in diabetology.
Key words:
human insulin – insulin analogues – individualized therapy
Autoři: J. Škrha
Působiště autorů: III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Vyšlo v časopise: Vnitř Lék 2013; 59(3): 209-213
Kategorie: XIII. sympozium: Diabetes mellitus – oční komplikace Praha, 12. 10. 2012 - Přehledné referáty
Moderní léčba inzulinem není revoluce, ale evoluce. Clifton J. Bailey, 2012
Souhrn
Moderní léčba inzulinem s sebou přináší požadavek, aby se léčený diabetes co nejvíce přiblížil fyziologickým regulacím. Od lidských inzulinů se přechází na analogy, které svými vlastnostmi mají zlepšit průběh glykemií, tedy zmenšit glukózovou variabilitu s výskytem hypoglykemií a hyperglykemií. Vedle krátce působících analogů, které snižují rozsah hyperinzulinemie a současně i postprandiální hypoglykemie, je cílem dlouhodobě účinkujících analogů vytvořit vyrovnanou hladinu a zamezit rozvoji noční hypoglykemie. Individualizovaná terapie inzulinem je základem moderních směrů v diabetologii.
Klíčová slova:
humánní inzulin – inzulinové analogy – individualizovaná terapieÚvod
V roce 2012 jsme si připomněli 90. výročí od klinického zavedení inzulinu do terapie diabetu. Objev inzulinu a možnost jeho substituce u jedinců, u nichž došlo k omezení syntézy inzulinu natolik, že stav porušené homeostázy byl neslučitelný se životem, měly zásadní význam pro jejich další osud. Již první zprávy vedly k velké euforii, i když aplikace byla bolestivá a život se prakticky výrazně podroboval nemoci. Nicméně po letech nadšení se vynořily další problémy v podobě pozdních cévních komplikací. I když poznatky ukazovaly na význam kompenzace diabetu, teprve v 90. letech minulého století, tedy po 70 letech používání inzulinu, bylo potvrzeno studií DCCT, že dlouhodobá výborná kompenzace diabetu může oddálit vznik či zpomalit vývoj těchto komplikací. Intenzivní výzkum zároveň odhalil mechanizmus působení inzulinu, zčásti se začíná rozumět patogenezi diabetu a jeho komplikací, ale vynořují se další bílé a dosud nejasné oblasti. Stále nejsme spokojeni se způsobem léčby inzulinem, i když se snažíme využívat nejmodernější poznatky.
Nové poznatky o diabetu vedou v posledních letech ke stále většímu úsilí léčit onemocnění intenzivněji, aby se zabránilo rozvoji pozdních komplikací, které vyplývají z postižení cévního řečiště. Dlouhodobé prospektivní studie totiž ukazují, že intenzivnější léčba podmiňující lepší kompenzaci diabetu od počátku onemocnění je provázena menším výskytem či rozvojem diabetické mikroangiopatie a při uplatnění komplexního léčebného postupu zahrnujícího intervenci i ostatních rizikových faktorů postižení cév se promítá do sníženého vývoje či oddálení aterosklerotických změn [1,2]. Tato pozorování také potvrdila existenci metabolické paměti, která se uplatňuje od začátku onemocnění a je tudíž významně ovlivněna zvolenou terapií [3]. Dlouhodobé zvýšení glykemie vyvolává změny exprese proteinů, které se účastní tkáňových změn a které mohou přetrvávat i po zlepšení kompenzace diabetu. Je proto žádoucí, aby co nejdříve byla zjištěna porucha homeostázy glukózy, tedy i časně diagnostikován diabetes, a ihned zahájena intenzivní léčba s cílem dosáhnout normoglykemie nebo alespoň hodnot, které se normálnímu rozpětí glykemií co nejvíce blíží.
Od fyziologie k terapii
Léčba inzulinem doznala zejména v posledních dvou desítkách let řadu proměn vyplývajících z podrobnějšího poznání sekrece a působení inzulinu. Nejde jenom o rozlišení bazální a prandiální sekrece, ale i mnohem detailnější podstaty tzv. pulzní sekrece inzulinu zahrnující několik typů pulzů, které významně ovlivňují působení inzulinu v cílových tkáních. To vše se odehrává fyziologicky ve zdravém organizmu, kdežto u diabetika dochází k postižení právě těchto fyziologických mechanizmů a jejich regulací. Zavedení humánních inzulinů bylo posunem proti dříve rozšířeným inzulinům zvířecím, a to především po stránce imunologické kompatibility, nikterak se to však nepromítlo do zlepšeného efektu z hlediska zmíněných fyziologických mechanizmů sekrece inzulinu. Krátce působící humánní inzuliny (Humulin R, Actrapid, Insuman R) se totiž uplatňují u diabetika po konzumaci stravy mnohem déle, než funguje inzulin u zdravého jedince. Jejich delší působení však současně může podmiňovat hyperinzulinemii v postprandiální fázi, která ovlivňuje i periferní působení inzulinu. Fyziologicky totiž dochází postprandiálně k rychlému poklesu hladiny inzulinu v krvi, která má navíc oscilující průběh. Proto nepřekvapí, že po aplikaci krátce působícího inzulinu se může rozvinout postprandiální hypoglykemie nebo naopak hyperglykemie podle toho, v jakém poměru je dávka inzulinu vůči množství jídla a současně i k fyzické aktivitě.
Déle působící inzuliny vedou k nevyrovnané hladině inzulinu, která nejprve stoupá a po několika hodinách dosahuje vrcholu, kdežto pak postupně klesá. Tím dochází i ke zřetelnému kolísání glykemií, což může být v noci kritické, neboť se mohou vyvinout hypoglykemie. Glykemická variabilita je u diabetika 1. typu při kombinaci krátce a déle působících inzulinů značná, pacient je ohrožen opakovanými hypoglykemiemi, a to zejména v situacích, kdy dochází k nepoměru mezi dávkou inzulinu, množstvím konzumované potravy a fyzickou aktivitou [4]. Jiným nežádoucím efektem inzulinové léčby je hmotnostní přírůstek, který se dostavuje u pacientů po zahájení léčby a který je závislý na dávkách použitých inzulinů.
Vyvstává tudíž otázka, jak léčit inzulinem, aby se neuplatňovaly zmíněné nežádoucí fenomény a aby se dosáhlo požadované kompenzace? I u zdravého člověka dochází k adaptačním změnám sekrece inzulinu podle toho, jak inzulin působí v cílových tkáních. Zvyšující se inzulinová rezistence (snížená inzulinová senzitivita) vede ke zvýšení sekrece inzulinu tak, že se udrží homeostáza glukózy a glykemie zůstávají v normálním rozpětí. Dlouhodobá expozice organizmu těmto poměrům způsobí dlouho přetrvávající hyperinzulinemii, která může dále prohlubovat zhoršený efekt inzulinu v cílových tkáních. Zásadní zlepšení této situace nastává při zvýšeném energetickém výdeji, tedy při pravidelné fyzické aktivitě, která může podmínit návrat sekrece inzulinu do původního (výchozího) stavu. Na tyto fyziologické regulace je třeba pamatovat při léčbě inzulinem v souvislosti s volbou dávky a posouzení jeho účinku.
Inzulinová analoga – cesta k řešení problémů?
Výše zmíněné skutečnosti zapříčinily studium nových inzulinů, totiž inzulinových analogů, které by svými vlastnostmi mohly zlepšit glykemické profily a tudíž i snížit výskyt hypoglykemických příhod. Drobnou úpravou v molekule inzulinu se připravily analogy, které mají mírně odlišné působení v porovnání s humánními inzuliny (obr. 1). Ultrakrátce působící inzuliny (lispro, aspart, glulisin) zlepšily především průběh postprandiálních glykemií, tedy při vhodném dávkování snížily frekvenci hypoglykemií po jídle [5]. Původní představa, že se mohou aplikovat bezprostředně před jídlem nebo dokonce i po jídle, se však ukázala ne zcela vhodnou. Jejich podání 15–20 min před jídlem je zapotřebí k udržení glykemie u většiny pacientů. Na druhé straně dlouho působící analogy (glargin, detemir) byly uváděny do praxe jako bezvrcholové inzuliny, u nichž je minimalizován vzestup a následně postupný pokles hladiny typický pro NPH inzuliny a jejichž působení je prodlouženo (např. vazbou na albumin nebo rychlostí uvolňování z místa aplikace) (obr. 2). Jejich hlavním posláním je tudíž minimalizovat noční hypoglykemické příhody [5,6]. U řady pacientů tak dochází k podstatnému snížení výskytu nočních hypoglykemií v porovnání s NPH inzuliny [7]. Zkušenosti získané při léčbě některých diabetiků ale dokládají, že je třeba i u těchto inzulinů zvažovat dobu podání, neboť v některých případech teprve jejich ranní aplikace vede ke zlepšení průběhu nočních glykemií a k úbytku hypoglykemií. U některých pacientů se ukázalo, že podání inzulinových analogů nemusí vždy vést ke zřetelně lepšímu výsledku než u humánních inzulinů, nebo výjimečně že pacient měl lepší průběh glykemií při použití humánních inzulinů, i když výsledky dlouhodobé kompenzace se významně nelišily. Právě léčba inzulinovými analogy doložila, že individuální přístup k farmakoterapii diabetu je zapotřebí uplatňovat jako obecně platný princip. Znamená to, že u každého diabetika je třeba posuzovat dosažené výsledky a rozhodovat, zda jsou přijatelné nebo zda je zapotřebí zvolit jinou terapii.
Obr. 1. Schéma molekulárních změn u inzulinových analogů. 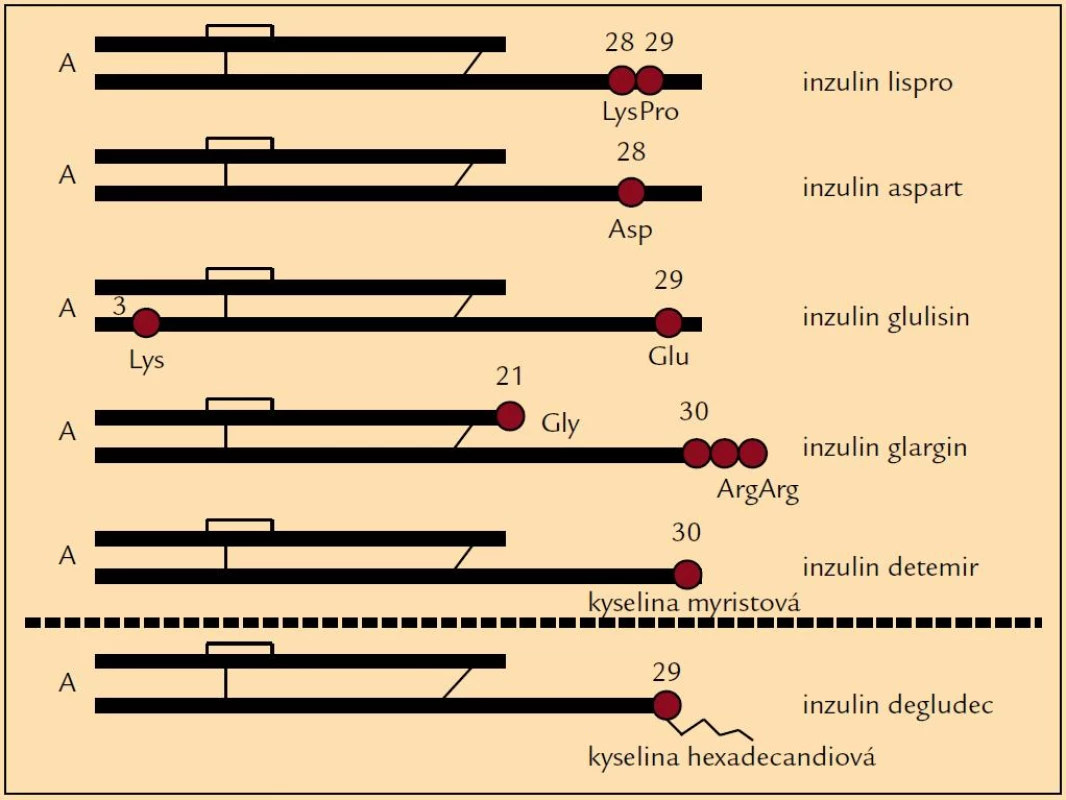
Obr. 2. Schéma hladin humánních inzulinů a inzulinových analogů po aplikaci. 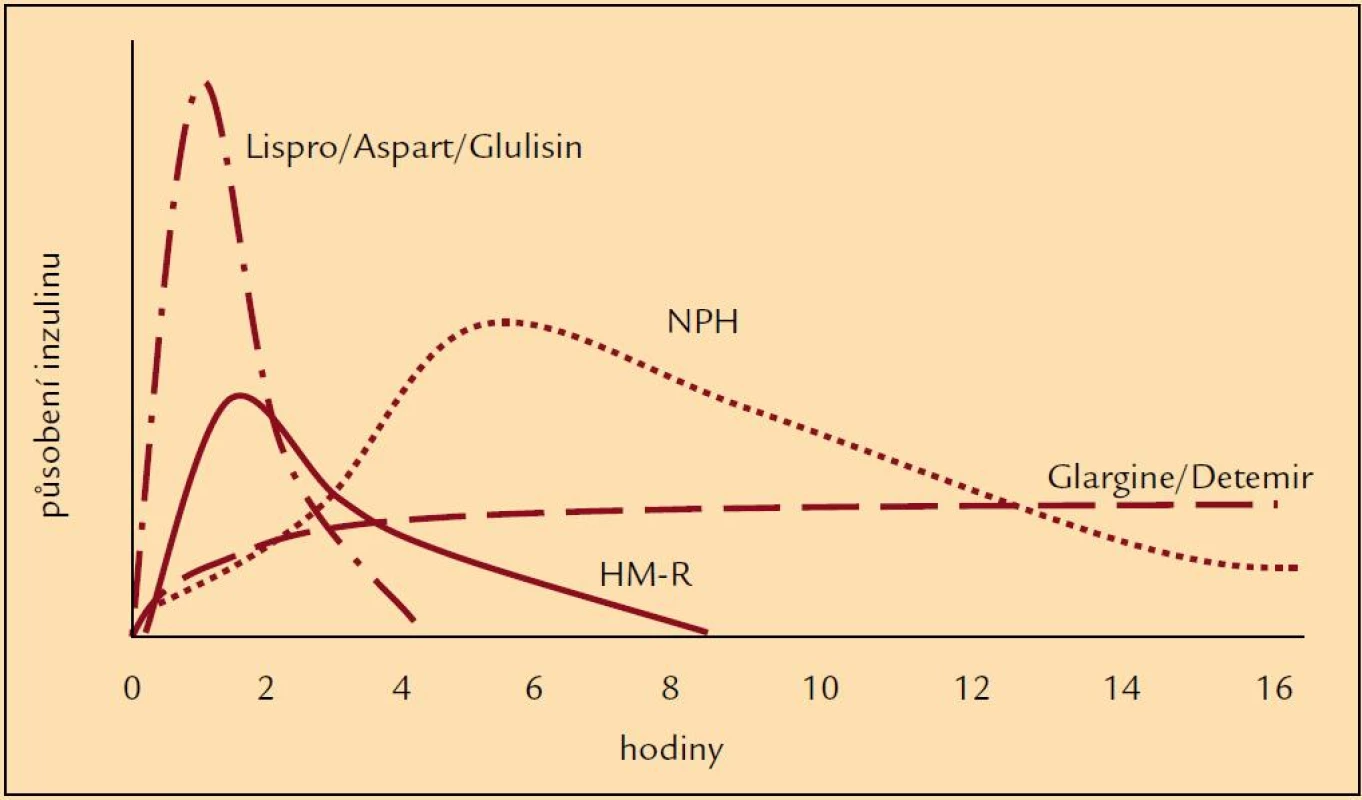
V současné době můžeme zvažovat použití jak humánních inzulinů, tak inzulinových analogů, a hodnotit, jaká volba inzulinů je pro daného pacienta nejvhodnější. U diabetika 1. typu zavádíme od počátku intenzivní léčbu, která využívá systém bazál-bolus. Tento způsob léčby vychází z fyziologické sekrece, totiž jednak z kontinuální bazální, přestože má pulzní charakter bez závislosti na příjmu potravy (tomu odpovídající volba bazálního inzulinu), jednak z prandiální sekrece inzulinu podmíněné příjmem potravy (tzv. bolusový, tedy krátce působící inzulin). I při tomto systému, který se snaží více napodobit fyziologickou sekreci, jsme stále vzdáleni od skutečné fyziologické rovnováhy. Ani v současnosti kombinace inzulinových analogů nemůže dovést organizmus do jemně regulované glukózové homeostázy, která je dosažena u zdravého jedince. Je zapotřebí zvažovat, jak intenzivní léčba inzulinem má být použita s ohledem na stáří pacienta, délku trvání diabetu, přidružené komplikace či spolupráci, resp. compliance pacienta. Vedle klasického schématu 3 dávek krátce působícího inzulinu aplikovaného před hlavními jídly s 1–2 dávkami dlouze působícího inzulinu, jimž dáváme přednost u mladších diabetiků, lze někdy s výhodou použít premixovaných inzulinů ve 2 (např. Mixtard 30, Insulin M3, Insuman Comb 25) nebo i ve 3 (např. Novomix) dávkách. Jde zejména o starší pacienty, u nichž premixované inzuliny mohou udržet kompenzaci na přijatelné hladině a přitom snížit riziko hypoglykemie [8].
U řady diabetiků s delším trváním nemoci se nedaří dosáhnout uspokojivé kompenzace, přičemž zvyšování dávek inzulinu se obvykle mine účinkem, neboť narůstá frekvence nežádoucích hypoglykemií. Následně pak často dochází k reaktivním hyperglykemiím a tedy ke vzestupu glykemické variability (většímu rozkolísání glykemií). U diabetika 2. typu s výraznou inzulinovou rezistencí může zvyšování dávek inzulinu dále zhoršovat působení inzulinu a tedy dále prohlubovat inzulinovou rezistenci. Konečně dalším projevem terapie inzulinem je již zmíněné zvyšování tělesné hmotnosti. Proto je snahou vyvinout další molekuly inzulinu, které by přinesly do terapie novou kvalitu, a to především s ohledem na zmíněné hypoglykemie a hmotnostní přírůstky.
Nové formy inzulinu a způsoby léčby
Za prvé se zkoušejí ultrakrátce působící inzuliny, u nichž k urychlenému nástupu účinku dochází vlivem enzymu hyaluronidázy, která je součástí inzulinového preparátu. Enzym působí lyticky na glykosaminoglykany obsažené v podkožní tkáni, což umožní rychlejší průnik inzulinu a tím i jeho časnější nástup účinku. Takto se nyní zkouší inzulin aspart i lispro kombinovaný s hyaluronidázou (rHuPH20), a to jak při konvenčním podání perem, tak při kontinuální infuzi inzulinovou pumpou [9]. Jinou testovanou cestou je vyhřívání místa vpichu pomocí tělíska (InsuPad) [10]. Dlouhodobé klinické zkušenosti však zatím chybějí.
Další oblastí je vývoj ultradlouze působících analogů inzulinu, které mají vytvářet ještě stabilnější a dlouhodobější hladiny než dosud používané inzuliny glargin či detemir. Sem patří inzulin degludec, u něhož úprava molekuly (chybění aminokyseliny na pozici B30 a navázání molekuly mastné kyseliny v pozici 29 B-řetězce) vede k tvorbě mnohočetných hexamerů v místě aplikace, z nichž se monomerní molekuly inzulinu uvolňují pomalu a postupně během více než 40 hod. Proto se zkoušel degludec i v podání jednou za 3 dny. To však nemusí mít příznivý efekt na compliance pacienta v porovnání s pravidelnou aplikací jednou denně, neboť pacient pak může zapomenout, který den inzulin aplikoval. Tento inzulin však umožňuje určitou flexibilitu doby aplikace, neboť se nemusí podávat rigidně ve stanovenou dobu. Hladina inzulinu je navíc ještě vyrovnanější než u předchozích dlouze působících inzulinových analogů, což se promítá do redukce hypoglykemických příhod, kterých je méně při použití degludecu než u inzulinu glargin [11,12].
Jiným ultradlouze působícím inzulinem je inzulin s označením LY2605541, který vzniká tzv. pegylací inzulinu lispro. Jde o vytvoření vazby mezi inzulinem lispro a polyetylenglykolem (PEG), přičemž vzniklý produkt se vyznačuje prodlouženou absorpcí inzulinu i sníženou clearance a tím i značně prodlouženým účinkem. Předběžné výsledky ukázaly jeho výraznější efekt v játrech v porovnání s inzulinem glargin a dále jeho působení v organizmu nebylo ovlivněno poruchou renálních funkcí. Jeho dávkování se tudíž nemusí upravovat při selhávání ledvin. Navíc byla aplikace provázena poklesem hmotnosti, což je výrazný rozdíl proti všem dosud podávaným inzulinům [13]. Jeho hladina v plazmě je vyrovnanější v porovnání s glarginem.
Uvedené novější inzuliny mohou být dalším vylepšením inzulinové léčby, což může zhodnotit až jejich delší klinické využití. Jistě bude třeba získat detailní poznatky spolu s variabilitou, resp. stabilitou glykemií u široké populace diabetiků. K tomu mohou dopomoci i nové technologie umožňující monitorování glykemií (kontinuální senzory, CGM systémy), jejichž vývoj jde též rychle kupředu [14]. Klasická aplikace inzulinu tak získává nové perspektivy.
Vedle toho se hodnotí i další trendy, např. možnosti nového podání enkapsulovaného inzulinu perorálně, který by se uvolnil až ve střevě, aby se mohl dostat do „své fyziologické oblasti“ portálního řečiště, ale zde je zapotřebí ještě počkat na výsledky klinických studií [15]. Jiná podání inzulinu se neosvědčila, při inhalační cestě je třeba poukázat na nefyziologický vstup inzulinu do organizmu a navíc v poměrně vysoké koncentraci.
Jistě další významnou oblastí je v současné době již široce používaná aplikace inzulinu inzulinovou pumpou, která dosud přinesla mnohým diabetikům výrazné zlepšení kompenzace. Příčinou je nesporně i větší přiblížení k fyziologické sekreci inzulinu v porovnání s konvenčním podáním inzulinu perem, i když ani moderní pumpy nenahrazují chybějící zmíněné různé typy pulzní sekrece inzulinu. Vývoj uzavřených systémů (propojení aplikace inzulinu pumpou s analýzou glykemií a jejich zpětným ovlivněním dávkování pumpou) probíhá velmi intenzivně a lze očekávat úspěšný posun i v této oblasti [16]. Nicméně inzulinová pumpa klade zvýšené nároky na disciplinovanost pacienta, jeho motivaci a dále i jeho spolupráci s diabetologickým týmem.
Moderní technologie umožní další zlepšení terapie inzulinem, přestože i nyní se zatím jeví jako nejlepší obnova fyziologických regulací cestou transplantace inzulin produkující tkáně, která však s sebou přináší mnohá úskalí a řadu dalších problémů a je samozřejmě velmi omezeně použitelná. To je však speciální problematika, která přesahuje rámec využití exogenního inzulinu, jak se jeví z pohledu dnešní doby.
Individualizovaný přístup jako základ moderní terapie
Nelze zapomínat, že úspěšná moderní léčba diabetu zahrnuje vedle farmakoterapie vhodná režimová (každodenní vhodnou fyzickou aktivitu) a dietní opatření včetně potřebného zajištění dobré psychiky pacienta. Bez nich ani „sebelepší“ inzuliny nemají naději na úspěch. Navíc současná terapie je léčbou individualizovanou, tedy orientovanou na pacienta, jejíž správné strukturování může přispět k úspěšným výsledkům v kompenzaci diabetu. Každý lékař vedoucí terapii diabetika se tudíž má zamýšlet nejen nad využitím nových léků, ale především volit taková opatření (farmakologická i nefarmakologická), která jsou objektivně doložitelným přínosem pro celkový stav pacienta. Nedílnou součástí úspěšné terapie je a též i zůstane přesné monitorování glykemií, které umožňuje nastavit správný režim s volbou patřičných inzulinů a jejich dávek (obr. 3). Na tomto zobrazení je patrné, že pacient měl trvale hyperglykemie a analýza monitorování vedla ke změně aplikace inzulinu z břišní stěny na končetiny. Po 3 měsících se vylepšily glykemie a glykovaný hemoglobin klesl o více než 15 mmol/mol. Jindy je možno analyzovat výskyt hypoglykemií a následně upravit dávkování inzulinu. Sebekontrola glykemií je zároveň důležitou oporou pacienta, který po správném zaškolení z ní čerpá informace potřebné pro flexibilní zacházení s inzulinem.
Obr. 3. Průběh glykemií při monitorování pomocí kontinuálního senzoru u chronicky dekompenzovaného diabetika 1. typu. 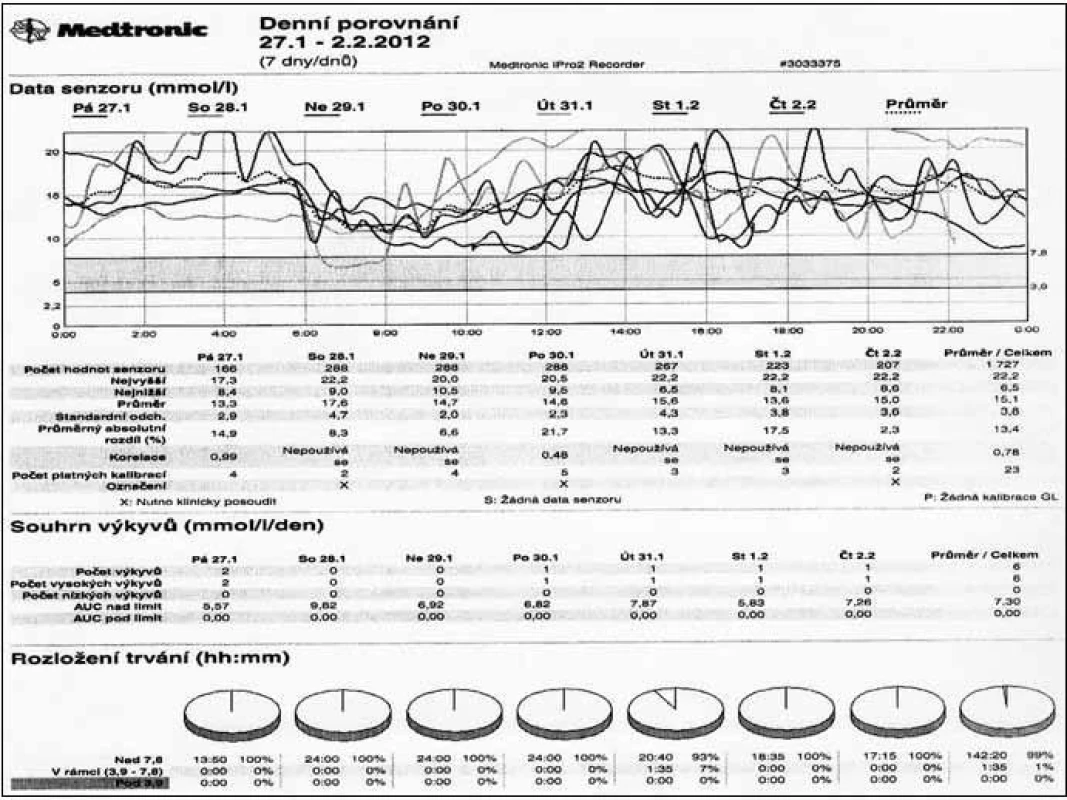
Lze předpokládat, že další cesta terapie inzulinem bude sice vycházet z poznatků studií přinášejících zcela konkrétní data v rámci medicíny založené na důkazech, ale pro daného pacienta bude volena individuální terapie, jak bylo zmíněno výše. Současné poznatky dokládají, že maximální úsilí v terapii diabetu je třeba věnovat na samotném začátku, tedy při prvním zavádění terapie, jejíž účinnost je z dlouhodobého hlediska nejvýznamnější. Právě v tomto období iniciální fáze farmakoterapie diabetu by se mělo podařit komplexním přístupem dovést stav co nejblíže k fyziologickým hodnotám glukózového metabolizmu. Proto i volba terapie inzulinem má být od počátku dostatečně intenzivní, aby i správně ovlivněná „glukózová paměť“ mohla zabránit dlouhodobým změnám.
prof. MUDr. Jan Škrha, DrSc.
www.vfn.cz
e-mail: jan.skrha@lf1.cuni.cz
Doručeno do redakce: 28. 1. 2013
Zdroje
1. Polak JF, Backlund JYC, Cleary PA et al. Progression of Carotid Artery Intima-Media Thickness During 12 Years in the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study. Diabetes 2011; 60 : 607–613.
2. White NH, Sun WJ, Cleary PA et al. Effect of Prior Intensive Therapy in Type 1 Diabetes on 10-Year Progression of Retinopathy in the DCCT/EDIC: Comparison of Adults and Adolescents. Diabetes 2010; 59 : 1244–1253.
3. Ceriello A. The emerging challenge in diabetes: The “metabolic memory”. Vascular Pharmacology 2012; 57 : 133–138.
4. Brazeau AS, Mircescu H, Desjardins K et al. Carbohydrate counting accuracy and blood glucose variability in adults with type 1 diabetes. Diabetes Research Clinical Practice 2013; 99 : 19–23.
5. Evans M, Schumm-Draeger PM, Vora J et al. A review of modern insulin analogue pharmacokinetic and pharmacodynamic profiles in type 2 diabetes: improvements and limitations. Diabetes Obesity Metabolism 2011; 13 : 677–684.
6. Donner T, Munoz M. Update on Insulin Therapy for Type 2 Diabetes. J Clin Endocrinol Metab 2012; 97 : 1405–1413.
7. Keating GM. Insulin Detemir. A Review of its Use in the Management of Diabetes Mellitus. Drugs 2012; 72 : 2255–2287.
8. Pirags V, El Damassy H, Dabrowski M et al. Low risk of severe hypoglycaemia in patients with type 2 diabetes mellitus starting insulin therapy with premixed insulin analogues BID in outpatient settings. Int J Clin Pract 2012; 66 : 1033–1041.
9. Hompesch M, Muchmore DB, Morrow L et al. Improved Postprandial Glycemic Control in Patients with Type 2 Diabetes from Subcutaneous Injection of Insulin Lispro with Hyaluronidase. Diabetes Technol Therapeut 2012; 14 : 218–224.
10. Heinemann L. New ways of insulin delivery. Int J Clin Pract 2011; 65: (Suppl. 170) :31–46.
11. Home PD, Meneghini L, Wendisch U et al. Improved health status with insulin degludec compared with insulin glargine in people with Type 1 diabetes. Diabetic Medicine 2012; 29 : 716–720.
12. Garber AJ, King AB, Del Prato S et al. Insulin degludec, an ultra-longlasting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 2 diabetes (BEGIN Basal-Bolus Type 2): a phase 3, randomised, open-label, treat-to-target non-inferiority trial. Lancet 2012; 379 : 1498–1507.
13. Bergenstal RM, Rosenstock J, Arakaki RF et al. A Randomized, Controlled Study of Once-Daily LY2605541, a Novel Long-Acting Basal Insulin, Versus Insulin Glargine in Basal Insulin-Treated Patients With Type 2 Diabetes. Diabetes Care 2012; 35 : 2140–2147.
14. Gonzales C, Maury E, Barcos I et al. Can Continuous Glucose Monitoring Systems Predict Glycemia? Diabetes Technology & Therapeutics 2012; 14 : 1030–1032.
15. Yang J, Sun H, Song C. Preparation, characterization and in vivo evaluation of pH-sensitive oral insulin-loaded poly(lactic-co-glycolicacid) nanoparticles. Diabetes Obesity & Metabolism 2012; 14 : 358–364.
16. Elleri D, Allen JM, Biagioni M et al. Evaluation of a portable ambulatory prototype for automated overnight closed-loop insulin delivery in young people with type 1 diabetes. Pediatric Diabetes 2012; 13 : 449–453.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Co nám přinesla největší studie v historii diabetologie?
- Změny hmotnosti a kompenzace diabetu (HbA1c) u nemocných s diabetes mellitus 2. typu po přidání exenatidu (Byetta) ke stávající léčbě ve 28 diabetologických ambulancích v ČR – studie BIBY-I (sledování 3–12 měsíců)
- Patofyziologie diabetické retinopatie
- Rizikové faktory diabetické retinopatie
- Současný stav diagnostiky a screeningu diabetické retinopatie a diabetického makulárního edému
- Přínos pars plana vitrektomie pro řešení komplikací proliferativní diabetické retinopatie
- Léčba diabetického makulárního edému
- Diabetická nefropatie/diabetické onemocnění ledvin
- Inkretinová terapie a diabetická retinopatie
- Současnost a perspektivy léčby inzulinem
- Diabetická retinopatie v Národním diabetologickém programu 2012–2022
- Problémy při sledování pacientů s diabetickou retinopatií
- Progrese diabetické retinopatie v těhotenství
- Diabetický makulární edém v posledním trimestru gravidity
- Řešení diabetického makulárního edému u diabetika 1. typu – chyby v mezioborové spolupráci
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diabetická nefropatie/diabetické onemocnění ledvin
- Léčba diabetického makulárního edému
- Progrese diabetické retinopatie v těhotenství
- Patofyziologie diabetické retinopatie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



