-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kteří příbuzní prvního stupně nemocných s kolorektálními neoplaziemi jsou nejvíce ohroženi
Which first - degree relatives of patients with colorectal neoplasias are at the highest risk
Background and aims:
The first-degree relatives of patients with colorectal neoplasias have higher risk of colorectal cancer than general population. The aim of our study was to identify first - degree relatives at the highest risk of colorectal neoplasia considering both their hereditary and non‑hereditary risks.Methods:
We have analysed the results of colonoscopic examinations of the first - degree relatives done within the project and we have compared them with the epidemiologic data relevant to colorectal cancer that we obtained from first-degree relatives.Results:
160 first - degree relatives (66 men, 94 women, mean age 48.2, SD ± 10.9 years) have undergone colonoscopic examination within the project, 105 (66 %) of them had no or non‑neoplastic polyps, 55 (34 %) had neoplastic lesions. In the univariate analysis the risk factors for the occurence of neoplastic lesions were: male sex (OR 2.30, 95% CI 1.18 – 4.48, p = 0.014), age over 50 years (OR 2.78, 95% CI 1.42 – 5.45, p = 0.003), sibship (OR 2.71, 95% CI 1.25 – 5.87, p = 0.012), smoking (OR 2.37, 95% CI 1.21 – 4.63, p = 0.012) and higher fat intake (OR 2.07, 95% CI 1.07 – 4.04, p = 0.032). In the multivariate analysis only the age over 50 years proved significant (OR 2.84, 95% CI 1.32 – 6.09, p = 0.007). The most of the neoplastic lesions in first - degree relatives were located in the right colon.Conclusions:
We can confirm high prevalence of neoplastic lesions among first - degree relatives. First-degree relatives at the highest risk are men over 50 years of age, siblings, smokers, who do not reduce dietary fat intake. This group of patients share both genetic and environmental risks and thus should be screened with the highest priority.Key words:
colorectal cancer – first – degree relatives – dietary habits – risk factors
Autori: I. Mikoviny Kajzrlíková 1; P. Vítek 1,2; J. Chalupa 1; Petr Dítě 2
Pôsobisko autorov: Beskydské Gastrocentrum Interního oddělení Nemocnice ve Frýdku– Místku, p. o., Frýdek– Místek, vedoucí Gastrocentra MU Dr. Petr Vítek, Ph. D. 1; Katedra interních oborů Lékařské fakulty UO Ostrava, vedoucí katedry MU Dr. Ivo Valkovský 2
Vyšlo v časopise: Vnitř Lék 2013; 59(4): 264-268
Kategória: Původní práce
Předneseno nebo publikováno ve formě posteru: Rožnovské gastroenterologické dny, Rožnov pod Radhoštěm, 2011; Konference mladých lékařů, Brno, 2011; Dny mladých internistů, Olomouc, 2011; Kongres České gastroenterologické společnosti, Brno, 2011; Národní kongres o kolorektálním karcinomu, Praha, 2011; United European Gastroenterology week, Stockholm, 2011
Súhrn
Úvod:
Příbuzní prvního stupně nemocných s kolorektálními neoplaziemi mají vyšší riziko vzniku kolorektálního karcinomu. Kolorektální karcinom má hereditární i nehereditární rizika. Cílem naší práce je analýza hereditárních i nehereditárních rizik u příbuzných prvního stupně a identifikace jedinců s nejvyšším rizikem kolorektálního karcinomu.Metody:
Analyzovali jsme výsledky kolonoskopických vyšetření příbuzných prvního stupně a srovnávali jsme je s epidemiologickými daty získanými formou dotazníku zaměřeného na nehereditární rizikové faktory kolorektálního karcinomu. Následná statistická analýza dat porovnala skupiny nemocných s nálezem neoplastické léze (adenomu nebo karcinomu) a bez nálezu neoplastické léze.Výsledky:
V rámci projektu podstoupilo kolonoskopické vyšetření 160 příbuzných prvního stupně (66 mužů, 94 žen, průměrný věk 48,2 roku, SD ± 10,9). U 55 (34 %) byly sneseny neoplastické léze, 105 (66 %) mělo kolonoskopické vyšetření bez nálezu neoplastické léze. Při bivariační statistické analýze byly jako statisticky významné rizikové faktory pro vznik neoplazie zjištěny: mužské pohlaví (OR 2,30, 95% CI 1,18 – 4,48, p = 0,014), věk nad 50 let (OR 2,78, 95% CI 1,42 – 5,45, p = 0,003), sourozenecký vztah s nemocným (OR 2,71, 95% CI 1,25 – 5,87, p = 0,012), kouření (OR 2,37, 95% CI 1,21 – 4,63, p = 0,012) a vyšší příjem tuků v potravě (OR 2,07, 95% CI 1,07 – 4,04, p = 0,032). Při následné multivariační analýze vyšel jako nezávislý signifikantní rizikový faktor pouze věk nad 50 let (OR 2,84, 95% CI 1,32 – 6,09, p = 0,007). Většina neoplastických lézí byla nalezena v pravém tračníku.Závěry:
V našem souboru potvrzujeme vysokou incidenci neoplastických lézí u příbuzných prvního stupně. K nejrizikovější skupině příbuzných prvního stupně v našem souboru patřili muži, sourozenci, kuřáci, kteří neomezují tuky v potravě. Tato skupina sdílí jak genetické, tak enviromentální rizikové faktory, a proto by měla být dispenzarizována s nejvyšší prioritou.Klíčová slova:
kolorektální karcinom – příbuzní prvního stupně – dietní návyky – rizikové faktoryÚvod
Kolorektální karcinom (KRK) je 2. nej-častější příčinou úmrtí na nádorová onemocnění v rozvinutých zemích. V České republice je nejvyšší prevalence KRK na světě. V roce 2008 byla v České republice incidence KRK 94,2/ 100 000 mužů a 61,8/ 100 000 žen [1]. Klinické studie ukazují, že kolonoskopický screening snižuje incidenci i mortalitu KRK [2].
KRK je asociován jak s nehereditárními, tak s hereditárními rizikovými faktory. Nehereditární rizikové faktory zahrnují vyšší věk, mužské pohlaví, konzumaci alkoholu, kouření, konzumaci červeného masa, nízký příjem ovoce a zeleniny, mléčných výrobků a vlákniny, sedavý životní styl, nespecifické střevní záněty a některá další onemocnění jako akromegalii, diabetes mellitus a ischemickou chorobu srdeční [3 – 10].
KRK je nejčastěji rodinně se vyskytující nádorové onemocnění. Více než 30 % má dědičný podklad, z toho pouze 5 % připadá na dědičné nádorové syndromy, jako je familiární adenomatózní polypóza a hereditární nepolypózní KRK [4]. Příbuzní prvního stupně pacientů s kolorektálními neoplaziemi (PPS), jak s KRK, tak s pokročilými adenomy, mají 4krát vyšší riziko KRK ve srovnání s běžnou populací a mají také vyšší riziko pokročilých a mnohočetných adenomů [11 – 14]. Rodinná anamnéza KRK je silným rizikovým faktorem dalšího růstu adenomů, ovšem nepotvrdil se její vliv na časná stadia KRK jako je samotná iniciace růstu adenomů [15].
Pro PPS je doporučen speciální dispenzární program zahrnující kolonoskopické vyšetření od 40 let věku nebo 10 let před diagnózou KRK u jejich nemocného příbuzného. Také dispenzární intervaly jsou u PPS kratší, nejčastěji 3 – 5 let v závislosti na endoskopickém nálezu [16]. Některé recentní studie ukazují, že riziko KRK u PPS není tak vysoké, jak se předpokládalo [17 – 19].
Cílem naší studie bylo určit prevalenci neoplastických lézí ve skupině PPS, porovnat výsledky s populací s průměrným rizikem a identifikovat PPS v nejvyšším riziku s ohledem na jejich hereditární i nehereditání rizikové faktory. Tato stratifikace by mohla pomoci optimalizovat strategii screeningu KRK v této rizikové skupině.
Metodika
Projekt Jako jedna rodina
Projekt Jako jedna rodina byl unikátní program oslovující PPS, který probíhal v nemocnici ve Frýdku - Místku v období červenec roku 2008 až srpen roku 2011. Cílem projektu bylo informovat co nejvíce PPS, poskytnout PPS správnou kolonoskopickou dispenzarizaci a určit u nich prevalenci neoplastických lézí. Projekt byl schválen lokální etickou komisí a doprovázen informační kampaní v místních médiích.
Telefonická oslovení
Pacienti s KRK nebo pokročilým adenomem (271 pacientů) hospitalizovaní nebo ambulantně ošetření v nemocnici ve Frýdku - Místku byli osloveni a požádáni o telefonní čísla svých příbuzných prvního stupně (sourozenců, rodičů, dětí). Celkem 229 pacientů souhlasilo s účastí v projektu a podepsalo informovaný souhlas. Následně bylo telefonicky osloveno 444 jejich PPS a pozváno do poradny projektu. PPS, kteří byli v době oslovení příliš mladí nebo pocházeli z jiného regionu, byli pouze telefonicky informováni a byl jim doporučen další postup.
Návštěva poradny projektu
Poradnu projektu v nemocnici ve Frýdku - Místku navštívilo 228 PPS, všichni podepsali informovaný souhlas. Formou dotazníku byly od PPS sbírány informace z osobní anamnézy zahrnující věk (< 50 vs ≥ 50), pohlaví, počet nemocných příbuzných (1 vs > 1), vztah k nemocnému příbuznému (sourozenec vs rodič/ dítě), přítomnost trávicích obtíží a epidemiologická data týkající se KRK, jako kouření (nekuřák vs exkuřák/ kuřák), příjem tuků (nízký vs vysoký), BMI (< 30 vs ≥ 30), příjem soli (nízký vs vysoký), konzumace piva (denně/ příležitostně vs nikdy), konzumace mléčných výrobků, ovoce a zeleniny a červeného masa (denně vs méně často) a stupeň vzdělání (základní a střední bez maturity vs střední s maturitou a vyšší). PPS, kteří již absolvovali kolonoskopické vyšetření, a PPS s osobní anamnézou hereditárních syndromů a nespecifických střevních zánětů nebyli do projektu zařazeni. PPS nad 40 let věku nebo o 10 let mladší než jejich nemocný příbuzný v době diagnózy nebo PPS s gastrointestinálními obtížemi bez ohledu na věk bylo doporučeno kolonoskopické vyšetření. Ze 182 indikovaných PPS jich 165 souhlasilo s vyšetřením.
Kolonoskopická vyšetření
Kolonoskopii v rámci projektu podstoupilo 165 PPS. Všechny kolonoskopie byly provedeny zkušenými endoskopisty a všichni PPS podepsali informovaný souhlas s vyšetřením. Byl zaznamenáván počet lézí, jejich velikosti a lokalizace, histologie, procento intubace céka a terminálního ilea a komplikace. U PPS s více lézemi byla do statistické analýzy zahrnuta ta s nejpokročilejší histologií. Pokročilý adenom byl definován jako adenom větší než 10 mm a/ nebo s vilózní komponentou a/ nebo s těžkou dysplazií. Pět PPS bylo ze statistické analýzy vyřazeno po kolonoskopickém vyšetření: 2 pro ztrátu resekátu, 2 pro nemožnost odběru biopsie vzhledem k antikoagulační léčbě a 1 pro nekompletní epidemiologická data.
Statistická analýza
Skupina ke statistické analýze zahrnovala 160 PPS s kompletními epidemiologickými daty a histologickým vyšetřením všech nalezených a odstraněných lézí. Statistická analýza byla provedena s použitím programu SPSS (verze 19.0). χ2 test byl použit pro určení asociace mezi dvěma dichotomními kategorickými proměnnými. Vztah rizikových faktorů a přítomnosti neoplastické léze u PPS byl popsán logistickou regresí s použitím odds ratio (OR) a 95% intervalů spolehlivosti (95% CI). Všechny statistické testy byly oboustranné, p < 0,05 bylo považováno za statisticky signifikantní.
Výsledky
Skupina 160 PPS se skládala z 66 mužů a 94 žen průměrného věku 48,2 roku (SD ± 10,9 let). Bližší charakteristika skupiny je v tab. 1.
Tab. 1. Charakteristika 160 příbuzných prvního stupně. 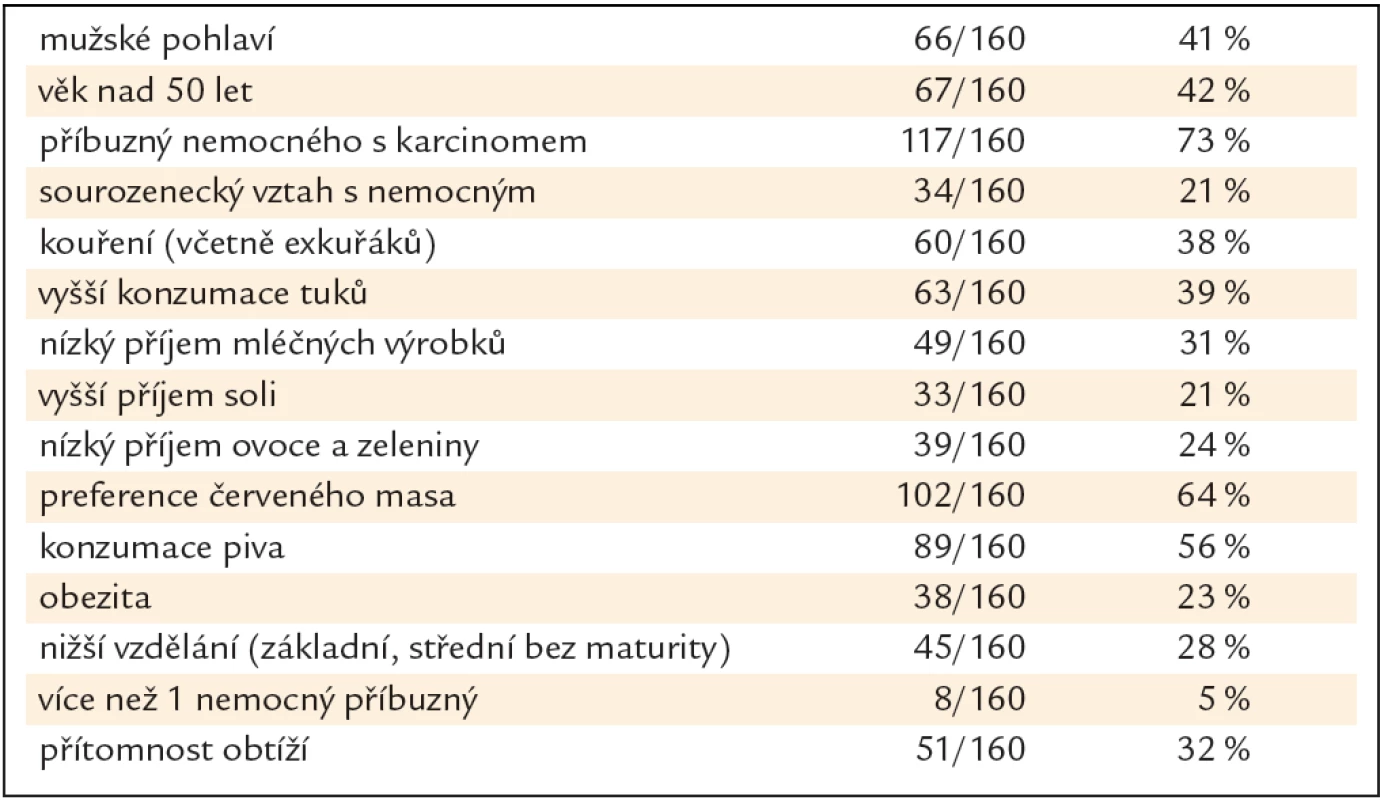
Všechna vyšetření byla provedena zkušeným endoskopistou za použití standardních kolonoskopů (Olympus CF - H180AL, CF - Q160L). Vyšetření byla provedena v bílém světle, narrow band imaging byl použit pouze k lepšímu makroskopickému zhodnocení nalezených lézí. Všichni PPS byli připraveni pomocí roztoku polyetylenglykolu. Intubace céka byla 100%, intubace terminálního ilea 78%. 155 (97 %) PPS bylo mírně sedováno midazolamem (2,5 – 5 mg i.v.), u zbylých 5 (3 %) bylo využito analgosedace propofolem. Jeden PPS s objemným neoplastickým polypem vyrůstajícím z baze apendixu byl léčen chirurgicky rozšířenou apendektomií, v resekátu byl prokázán tubulovilózní adenom s těžkou dysplazií. Zaznamenali jsme jednu komplikaci, a to krvácení 4. den po endoskopické mukózní resekci laterallyspreading tumoru transversa. Toto krvácení si vyžádalo 3denní hospitalizaci nemocného bez nutnosti krevních převodů a bylo úspěšně endoskopicky ošetřeno s použitím endoklipů.
U 55 PPS byla nalezena neoplastická léze, 105 PPS bylo bez nálezu neoplastické léze. Prevalence neoplastické léze v celé skupině byla 34,4 % (25 % u PPS < 50 let věku a 48 % u PPS ≥ 50 let věku), prevalence pokročilé neoplazie (pokročilý adenom, KRK) byla 12,5 % (6 % u PPS < 50 let věku a 21 % u PPS ≥ 50 let věku).
U 99 PPS byla nalezena léze (neoplastická i non‑neoplastická), 61 PPS mělo normální kolonoskopický nález.
Celkem bylo u 99 PPS odstraněno 208 lézí, z toho 113 non‑neoplastických, 94 adenomů a 1 karcinom (jednalo se o tzv. maligní polyp, který byl kurativně řešen endoskopicky). Histologicky šlo o hyperplastické léze v 32 %, ostatní non‑neoplastické léze v 22,5 %, tubulární adenomy s lehkou dysplazií v 41 %, tubulovilózní adenomy s lehkou dysplazií v 1,5 %, tubulární adenomy s těžkou dysplazií v 1,5 %, tubulovilózní adenomy s těžkou dysplazií v 1 % a karcinom v 0,5 %.
Celkem bylo nalezeno 146 lézí (70 %) < 5 mm, 50 (24 %) 5 – 10 mm, 7 (3 %) 11 – 19 mm a 5 (3 %) ≥ 20 mm. U 36 % lézí < 5 mm (52 z 146) se jednalo o adenomy.
Většina lézí bez ohledu na histologii byla nalezena v levém tračníku (122 z 208), neoplastické léze se nacházely predominantně proximálně od lienální flexury (59 z 95, 62 %). Byl zde signifikantně vyšší poměr neoplastických lézí v pravém tračníku (p < 0,001). Nebyl nalezen statisticky signifikantní rozdíl v prevalenci neoplastických lézí mezi PPS pacientů s KRK a PPS pacientů s pokročilým adenomem (p = 0,227).
V bivariační statistické analýze vyšly jako statisticky signifikantní rizikové faktory pro přítomnost neoplastické léze mužské pohlaví (OR 2,30, 95% CI 1,18 – 4,48, p = 0,014), věk nad 50 let (OR 2,78, 95% CI 1,42 – 5,45, p = 0,003), sourozenecký vztah s nemocným (OR 2,71, 95% CI 1,25 – 5,87, p = 0,012), kouření (OR 2,37, 95% CI 1,21 – 4,63, p = 0,012) a vyšší příjem tuků (OR 2,07, 95% CI 1,07 – 4,04, p = 0,032). Nebyla nalezena asociace s konzumací soli, piva, mléčných výrobků, ovoce a zeleniny, červeného masa, obezitou, stupněm vzdělání a přítomností obtíží (tab. 2).
Tab. 2. Rizikové faktory přítomnosti neoplastické léze – bivariační statistická analýza. 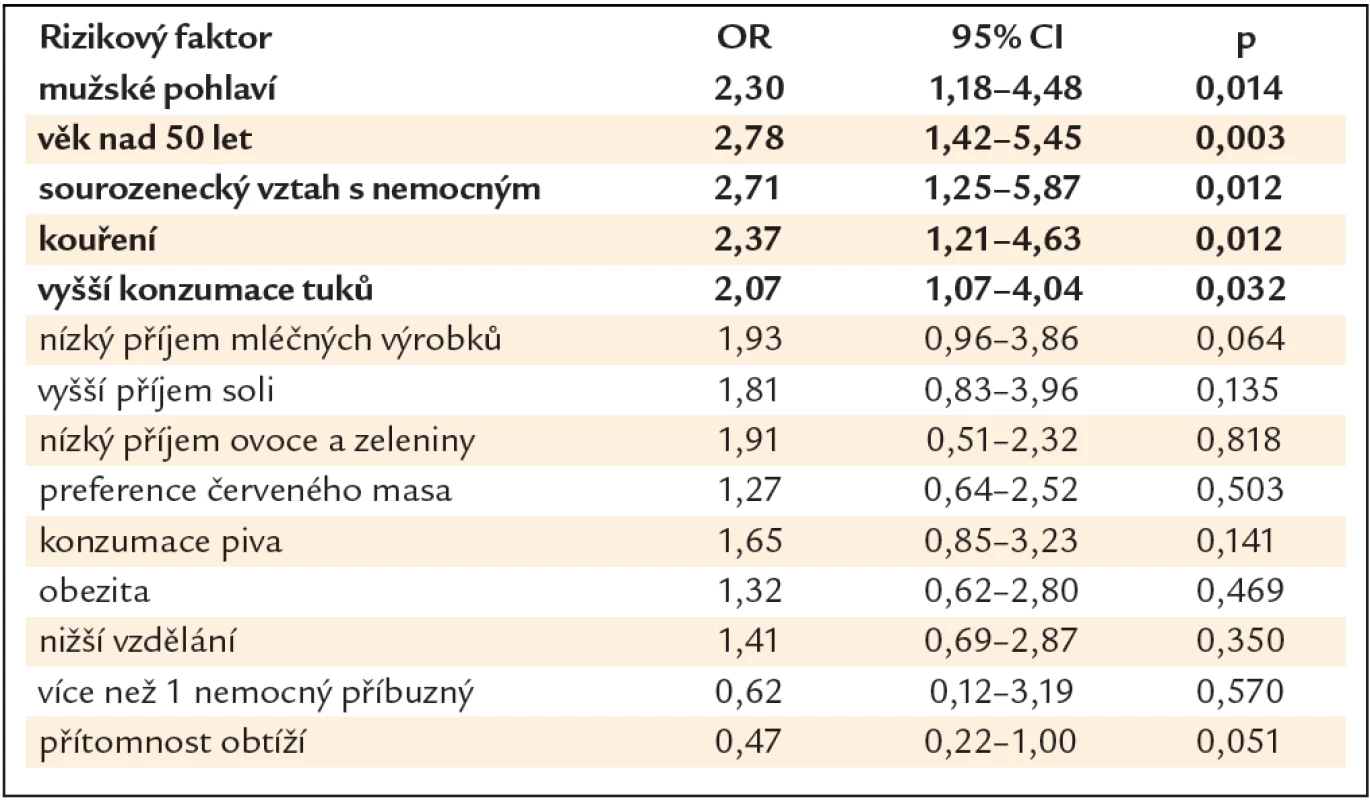
V multivariační statistické analýze byl jako signifikantní rizikový faktor prokázán pouze věk nad 50 let (OR 2,84, 95% CI 1,32 – 6,09, p = 0,007) (tab. 3).
Tab. 3. Rizikové faktory přítomnosti neoplastické léze – multivariační statistická analýza. 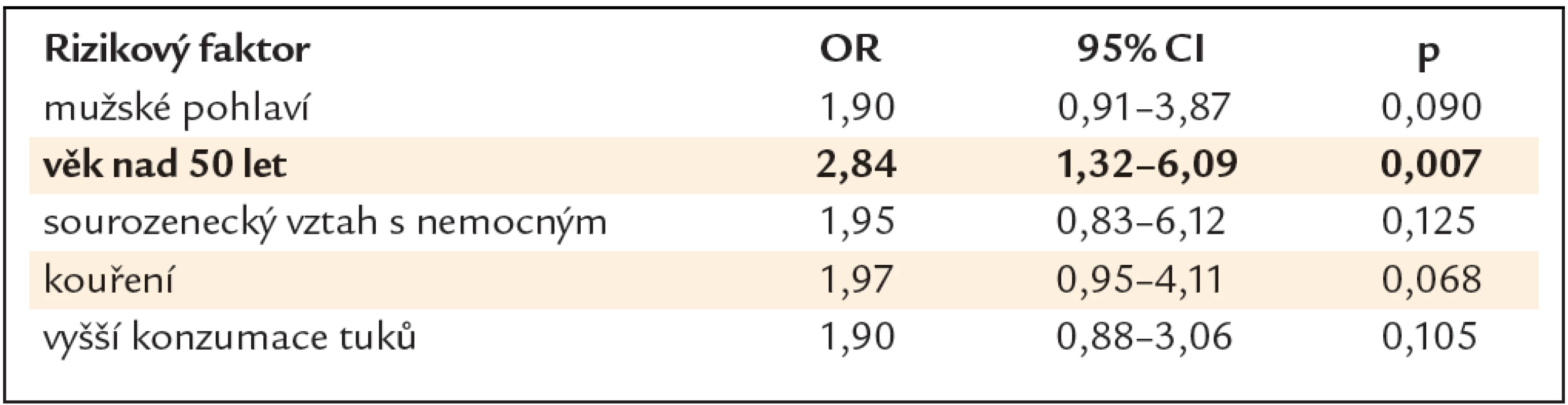
Diskuze
Naše studie byla založena na telefonickém oslovování PPS, následném pohovoru v poradně a zařazení do kolonoskopické dispenzarizace.
Na základě našich výsledků můžeme potvrdit vysokou prevalenci neoplastických lézí mezi PPS. Prevalence v celé skupině (průměrný věk 48,2 roku) čítala 34,4 %, ve skupině pod 50 let a nad 50 let včetně 25 %, resp. 48 %. Prevalence pokročilých neoplazií byla 12,5 %, ve skupině pod 50 let a nad 50 let včetně 6 %, resp. 21 %. Naše výsledky jsou podobné recentní studii Armelaa, v níž byla prevalence neoplastických lézí a pokročilých neoplazií u PPS 33,4 %, resp. 11,3 % [20]. Je však třeba zdůraznit, že PPS v této studii byli starší, průměrného věku 56,7 roku. Ve studii Lindgrena pracující s prevalencí adenomů u familiárního ne - polypózního KRK čítala prevalence u jedinců průměrného věku 50 let s jedním PPS a jedním příbuzným druhého stupně nebo 2 PPS 33 % [21]. Některé studie ukazují nižší prevalenci [17]. Bujanda popisuje prevalenci neoplastických lézí a pokročilých neoplazií 26 %, resp. 8,4 % [22].
Téma PPS ve věku 40 – 50 let je diskutováno v Mengesově studii srovnávající 228 PPS průměrného věku 44,8 roku a 220 jedinců v běžném riziku KRK průměrného věku 45,6 roku tvořících kontrolní skupinu. V této „case - control“ studii čítala prevalence neoplastických lézí mezi PPS a kontrolami ve věku 40 – 50 let 19 %, resp. 8 %. Prevalence neoplastických lézí mezi PPS a kontrolami ve věku 50 – 75 let čítala 27 – 39 %, resp. 13 – 26 % [23].
Prevalence podle věku PPS v naší studii (25 % < 50 let věku, 48 % ≥ 50 let věku) byla ve srovnání s Mengesovou studií mnohem vyšší, avšak musíme tyto výsledky považovat za specifické pro Českou republiku. Vzhledem k tomu můžeme za kontrolní skupinu považovat české jedince průměrného věku nad 50 let. Data z národního registru screeningu KRK z let 2006 – 2009 ukazují prevalenci adenomů a karcinomů v této skupině 36,2 %, což je významně méně ve srovnání s 48% prevalencí mezi PPS nad 50 let v naší studii [24].
V rámci projektu jsme nalezli a odstranili celkem 208 lézí u 99 PPS, z nich 95 neoplastických. Většina neoplastických lézí byla nalezena v pravém tračníku (59 z 95, 62 %), vzhledem k tomu můžeme v současnosti doporučit totální kolonoskopii jako jedinou adekvátní metodu pro dispenzarizaci této vysokorizikové skupiny. Ostatní studie také popisují tendenci k proximální lokalizaci lézí mezi PPS s výjimkou práce Tytherleigha, ve které bylo 71 % adenomů a 100 % karcinomů nalezeno distálně od lienální flexury [17,20,22,23].
Zatím zůstává nejasné, zda mezi PPS existuje genetická predispozice k proximální lokalizaci lézí. Genetické faktory spojené s vyšším rizikem KRK zahrnují větší počty rizikových genů s nízkou penetrancí a specifické polymorfizmy. Některé genetické varianty či polymorfizmy genů byly již asociovány se zvýšeným rizikem KRK, mezi ně patří APC – I1307K, HRAS1 - VNTR a MTHFR varianty [25,26]. V genomových studiích bylo dále zjištěno, že dispozice ke vzniku KRK může být následkem až 170 genetických variací [27].
Hlavním cílem naší studie bylo identifikovat PPS s nejvyšším rizikem KRK s ohledem jak na jejich hereditární, tak nehereditární rizikové faktory, protože tito PPS by měli být zařazeni do dispenzárního programu prioritně. Důležitá otázka ovšem je, jak mohou být hereditární rizika ovlivněna rodinnými zvyklostmi ve stravování a fyzické aktivitě [28]. Je dobře známo a dokázáno, že vyšší věk a mužské pohlaví představují rizikové faktory vzniku neoplastické léze [20,22,29]. S rizikem KRK je spojen i vyšší počet nemocných příbuzných [29]. Většina výše zmíněných studií s PPS se na dietní návyky nezaměřovala. V práci Armelaa jsou popsány jako rizikové faktory KRK vyšší BMI a kouření s OR 1,96 (95% CI 1,50 – 2,57) [20].
V projektu Jako jedna rodina jsme sbírali unikátní epidemiologická data týkající se KRK, jako věk, pohlaví, stupeň vzdělání, počet nemocných příbuzných, vztah s nemocných příbuzným, přítomnost symptomů, kouření, BMI a dietní návyky jako solení, příjem tuků, piva, mléčných výrobků, ovoce a zeleniny a červeného masa. V bivariační statistické analýze vyšly jako statisticky signifikantní rizikové faktory pro přítomnost neoplastické léze mužské pohlaví, věk nad 50 let, sourozenecký vztah s nemocným, kouření a vyšší příjem tuků. V multivariační statistické analýze byl jako signifikantní rizikový faktor prokázán pouze věk nad 50 let. Pro cíle naší studie jsou však cennější výsledky bivariační statistické analýzy, které nám definovaly charakteristické rysy PPS v nejvyšším riziku, které by nám mohly pomoci optimalizovat strategii dispenzární péče.
Naše studie má samozřejmě i své limitace. Skupina PPS byla relativně malá a výsledky specifické pro Českou republiku, kde je nejvyšší prevalence KRK na světě. Dále je třeba brát v potaz bias v zařazování PPS do studie. Je pravděpodobné, že PPS se závažnější rodinnou anamnézou KRK a větším počtem nemocných příbuzných spíše akceptovali účast v projektu i kolonoskopické vyšetření. Na druhou stranu pouze 5 % PPS v projektu mělo více než 1 nemocného příbuzného. Další limitací studie je fakt, že zde byli zařazeni PPS jak asymptomatičtí, tak ti s přítomností obtíží. Všichni PPS měli indikovanou kolonoskopii primárně v rámci projektu, ovšem 32 % z nich na přímý dotaz udávalo přítomnost trávicích obtíží nebo krve ve stolici. Přítomnost obtíží však překvapivě nebyla asociována s vyšším rizikem vzniku neoplazií.
Závěr
V naší studii jsme potvrdili vyšší prevalenci neoplastických lézí mezi PPS. PPS v nejvyšším riziku jsou muži nad 50 let věku, sourozenci, kuřáci, kteří neomezují příjem tuků. Tato skupina sdílí jak genetické, tak enviromentální rizikové faktory, a proto by měla být dispenzarizována s nejvyšší prioritou. Nebyla popsána asociace trávicích problémů a enteroragie s přítomností neoplastické léze, proto by všichni PPS měli být vyšetřeni bez ohledu na symptomy. Většina neoplastických lézí byla nalezena v pravém tračníku, vzhledem k tomu je totální kolonoskopie v současné době jedinou akceptovatelnou metodou pro dispenzarizaci.
MU Dr. Ivana Mikoviny Kajzrlíková
www.nemfm.cz
e‑mail: kajzrlikova@kolonoskopie.cz
Doručeno do redakce: 27. 12. 2012
Přijato po recenzi: 15. 2. 2013
Zdroje
1. Novotvary 2008 ČR (Cancer Incidence 2008 in the Czech Republic). ÚZIS ČR: Praha 2008.
2. Manser CN, Bachmann LM, Brunner H et al. Colonoscopy screening markedly reduces the occurrence of colon carcinomas and carcinoma‑related death: a closed cohort study. Gastrointest Endosc 2012; 76 : 110 – 117.
3. Brenner H, Altenhofen L, Hoffmeister M. Sex, age, and birth cohort effects in colorectal neoplasms: a cohort analysis. Ann Intern Med 2010; 152 : 697 – 703.
4. Winawer SJ, Schottenfeld D, Flehinger BJ. Colorectal cancer screening. J Natl Cancer Inst 1991; 83 : 243 – 253.
5. Norat T, Bingham S, Ferrari P et al. Meat, fish, and colorectal cancer risk: the European Prospective Investigation into cancer and nutrition. J Natl Cancer Inst 2005; 97 : 906 – 916.
6. Botteri E, Iodice S, Bagnardi V et al. Smoking and colorectal cancer: a meta‑analysis. JAMA 2008; 300 : 2765 – 2778.
7. Cho E, Smith - Warner SA, Ritz J et al. Alcohol intake and colorectal cancer: a pooled analysis of 8 cohort studies. Ann Intern Med 2004; 140 : 603 – 613.
8. Renehan AG, Tyson M, Egger M et al. Body‑mass index and incidence of cancer: a systematic review and meta‑analysis of prospective observational studies. Lancet 2008; 371 : 569 – 578.
9. Chan AO, Jim MH, Lam KF et al. Prevalence of colorectal neoplasm among patients with newly diagnosed coronary artery disease. JAMA 2007; 298 : 1412 – 1419.
10. Ma J, Pollak MN, Giovannucci E et al. Prospective study of colorectal cancer risk in men and plasma levels of insulin‑like growth factor (IGF) - I and IGF‑binding protein‑3. J Natl Cancer Inst 1999; 91 : 620 – 625.
11. Johns LE, Houlston RS. A systematic review and meta‑analysis of familial colorectal cancer risk. Am J Gastroenterol 2001; 96 : 2992 – 3003.
12. Neklason DW, Thorpe BL, Ferrandez A et al. Colonic adenoma risk in familial colorectal cancer – a study of six extended kindreds. Am J Gastroenterol 2008; 103 : 2577 – 2584.
13. Wark PA, Wu K, van ‚t Veer P et al. Family history of colorectal cancer: a determinant of advanced adenoma stage or adenoma multiplicity? Int J Cancer 2009; 125 : 413 – 420.
14. Cottet V, Pariente A, Nalet B et al. Colonoscopic screening of first - degree relatives of patients with large adenomas: increased risk of colorectal tumors. Gastroenterology 2007; 133 : 1086 – 1092.
15. Almendingen K, Hofstad B, Vatn MH. Does a family history of cancer increase the risk of occurrence, growth, and recurrence of colorectal adenomas? Gut 2003; 52 : 747 – 751.
16. Rex DK, Johnson DA, Anderson JC et al. American College of Gastroenterology guidelines for colorectal cancer screening 2009. Am J Gastroenterol 2009; 104 : 739 – 750.
17. Tytherleigh MG, Ng VV, Mathew LO et al. Colonoscopy for screening and follow up of patients with a family history of colorectal cancer. Colorectal Dis 2008; 10 : 506 – 511.
18. Martínez ME, Baron JA, Lieberman DA et al. A pooled analysis of advanced colorectal neoplasia diagnoses after colonoscopic polypectomy. Gastroenterology 2009; 136 : 832 – 841.
19. Martínez ME, Sampliner R, Marshall JR et al. Adenoma characteristics as risk factors for recurrence of advanced adenomas. Gastroenterology 2001; 120 : 1077 – 1083.
20. Armelao F, Paternolli C, Franceschini G et al. Colonoscopic findings in first - degree relatives of patients with colorectal cancer: a population‑based screening program. Gastrointest Endosc 2011; 73 : 527 – 534.
21. Lindgren G, Liljegren A, Jaramillo E et al. Adenoma prevalence and cancer risk in familial non‑polyposis colorectal cancer. Gut 2002; 50 : 228 – 234.
22. Bujanda L, Sarasqueta C, Zubiaurre L et al. Low adherence to colonoscopy in the screening of first – degree relatives of patients with colorectal cancer. Gut 2007; 56 : 1714 – 1718.
23. Menges M, Fischinger J, Gärtner B et al. Screening colonoscopy in 40 - to 50‑year – old first – degree relatives of patients with colorectal cancer is efficient: a controlled multicentre study. Int J Colorectal Dis 2006; 21 : 301 – 307.
24. Suchanek S, Zavoral M, Majek O et al. National colorectal cancer screening programme in the Czech republic. Gut 2010; 59: A 84.
25. Jasperson KW, Tuohy TM, Neklason DW et al. Hereditary and familial colon cancer. Gastroenterology 2010; 138 : 2044 – 2058.
26. Houlston RS, Tomlinson IP. Polymorphisms and colorectal tumor risk. Gastroenterology 2001; 121 : 282 – 301.
27. Tenesa A, Dunlop MG. New insights into the aetiology of colorectal cancer from genome – wide association studies. Nat Rev Genet 2009; 10 : 353 – 358.
28. Kerber RA, Slattery ML, Potter JD et al. Risk of colon cancer associated with a family history of cancer or colorectal polyps: the diet, activity, and reproduction in colon cancer study. Int J Cancer 1998; 78 : 157 – 160.
29. Pezzoli A, Matarese V, Rubini M et al. Colorectal cancer screening: results of a 5‑year program in asymptomatic subjects at increased risk. Dig Liver Dis 2007; 39 : 33 – 39.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Krátká baterie pro testování fyzické zdatnosti seniorů – editorial
- Dálková monitorace implantabilních přístrojů v kardiologii – editorial
- Aortální stenóza – editorial
- Aortální stenóza – editorial
- Změny hmotnosti a kompenzace diabetu (HbA1c) u nemocných s diabetes mellitus 2. typu po přidání exenatidu (Byetta) ke stávající léčbě ve 28 diabetologických ambulancích v ČR – studie BIBY‑II (sledování 24 měsíců)
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Kteří příbuzní prvního stupně nemocných s kolorektálními neoplaziemi jsou nejvíce ohroženi
- Přínos systému vzdáleného sledování v dlouhodobé péči o pacienty s implantabilními kardiovertery‑ defibrilátory
- Aortální stenóza
- Tuberkulóza v České republice. Současný stav. Diagnóza, léčba, prevence
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
- Oxidační stres u pacientů po transplantaci ledviny
- PET-CT dokumentovaný rychlý nástup léčebné odpovědi cyklofosfamidu, thalidomidu a dexametazonu u multicentrické formy Castlemanovy nemoci. Popis případu a přehled informací o léčbě
- Kazuistika získané hemofilie A
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- Využití vildagliptinu z pohledu interního lékaře
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Aortální stenóza
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



