-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
PET-CT dokumentovaný rychlý nástup léčebné odpovědi cyklofosfamidu, thalidomidu a dexametazonu u multicentrické formy Castlemanovy nemoci. Popis případu a přehled informací o léčbě
PET-CT documented fast onset of treatment response to cyclophosphamide, thalidomide and dexamethasone in patients with multicentric Castleman‘s disease. Case description and treatment information overview
Castleman‘s disease (also called angiofollicular lymph node hyperplasia) can take two forms with different prognosis: the localized form can usually be treated by a surgical intervention and has therefore a favourable prognosis. On the other hand, the multicentric form has an unfavourable prognosis and requires systemic treatment. Classic manifestations of multicentric Castleman‘s disease are multiple sites of lymphadenopathy, sometimes hepatomegaly and also splenomegaly or serous cavity effusions. Typical pathological laboratory levels measured in patients with this disease include an increased CRP level, anaemia of chronic diseases, and many patients have an increased total protein concentration, in some cases exceeding even 100g/ l. It is caused by a high concentration of polyclonal immunoglobulins. Typical clinical symptoms include fluctuating subfebrile or febrile temperatures, increased night sweats and fatigue usually related to anaemia. In some patients, the disease is manifested as vasculitis, frequently also affecting cerebral arteries, i.e. leading to cerebrovascular accidents. The aetiology of this disease is unclear; it is a polyclonal lymphocyte proliferation, often with differentiation into plasma cells. It is not a clonal malign disease; however, it can transform into a clonal lymphoproliferative disease. Even though it is not a malign disease in the histomorphological sense, the disease symptoms are so acute that systemic treatment is required. In the past, the treatment method of this disease used to be based on corticoids and cytostatics; however, such treatment was not always successful in achieving its objective, i.e. complete remission. In the past few years, an improvement of treatment results was accomplished by adding a new drug to the basic medication, i.e. to cytostatics and dexamethasone. Many publications describe the benefi t of adding a third drug from the IMiDs group (immunomodulatory drugs), such as thalidomide or lenalidomide. These drugs affect the formation of cytokines and block the angiogenesis, which in turn positively influences the speed of the treatment response. The second new drug that has helped in combination with classical treatment is the anti-CD20 antibody, rituximab. The third new drug to add this list is the monoclonal antibody against the interleukin-6 receptor, tocilizumab. This paper describes a rapid treatment response after combined treatment with cyclophosphamide 500mg/ m2 i.v. infusion 1st and 15th day in a 28 - day cycle, dexamethasone 20mg p.o. cycle day 1 – 4 and cycle day 15 – 18, and thalidomide 100mg daily. In the course of the two-month treatment, the accumulation of fl uorodeoxyglucose during the PET-CT imaging has normalized; the originally pathologically enlarged nodes have become smaller, the originally elevated CRP level has normalized and the originally signifi cantly lower haemoglobin level has risen. This is the second patient with multicentric Castleman‘s disease in the last three years who showed a rapid response to treatment with thalidomide combined with cyclophosphamide and dexamethasone. Therefore, we consider such treatment suitable for newly diagnosed patients with multicentric Castleman‘s disease.
Key words:
Castleman‘s disease – multicentric form – thalidomide – bortezomib – rituximab – tocilizumab – POEMS syndrome – vasculitis – polyclonal hypergammaglobulinemia – anaemia of chronic disease – fever of unknown origin
Autori: Z. Adam 1; P. Szturz 1; L. Křen 2; M. Krejčí 1; L. Pour 1; T. Svoboda 3; I. Hanke 3; I. Penka 3
; R. Koukalová 4; Z. Řehák 4; I. Červinková 5; T. Štorková 1; Z. Král 1; J. Mayer 1
Pôsobisko autorov: Interní hematologická a onkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Mayer, CSc. 1; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MU Dr. Josef Feit, CSc. 2; Chirurgická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Zdeněk Kala, CSc. 3; PET-CT oddělení Masarykova onkologického ústavu Brno, přednosta prim. MU Dr. Karol Bolčák 4; Klinika dětské radiologie Lékařské fakulty MU a FN Brno, pracoviště FDN, přednostka doc. MU Dr. Jarmila Skotáková, CSc. 5
Vyšlo v časopise: Vnitř Lék 2013; 59(4): 301-312
Kategória: Kazuistiky
Súhrn
Castlemanova choroba (zvaná též angiofolikulární hyperplazie lymfatických uzlin) se dělí na 2 prognosticky odlišné skupiny. Lokalizovaná forma je obvykle vyléčitelná chirurgickým zákrokem a tedy prognosticky příznivá. Multicentrická forma je prognosticky nepříznivá a vyžaduje systémovou léčbu. Klasickými projevy multicentrické formy Castlemanovy nemoci je mnohočetné postižení lymfatických uzlin (lymfadenopatie), někdy bývá hepatomegalie i splenomegalie a případně výpotky v serózních dutinách. K typickým patologickým laboratorním hodnotám u těchto pacientů patří zvýšená hodnota CRP, anémie chronických chorob a mnozí z nich mají zvýšenou koncentraci celkové bílkoviny, přesahující i 100 g/ l. Je to způsobené vysokou koncentrací polyklonálních imunoglobulinů. K typickým klinickým příznakům patří kolísavé subfebrilie či febrilie, zvýšené noční pocení, únava obvykle související s anémií. U některých pacientů se nemoc projeví vaskulitidou, často i s postižením mozkových tepen, tedy cévní mozkovou příhodou. Etiologie této nemoci není jasná, jde o polyklonální proliferaci lymfocytů často s diferenciací v plazmocyty. Nejde tedy o klonální maligní onemocnění, ale do klonálního lymfoproliferativního onemocnění nemoc může přejít. Nicméně i když nejde o maligní onemocnění v histomorfologickém slova smyslu, příznaky nemoci jsou natolik zatěžující, že vyžadují systémovou léčbu. Léčba této nemoci byla dříve založena na kortikoidech a cytostatikách, ale tato léčba nedosahovala vždy svého cíle, tedy kompletní remise nemoci. V posledních letech došlo ke zlepšení léčebných výsledků přidáním jednoho z nových léků k základním lékům, tedy k cytostatikům a k dexametazonu. Hodně publikací popisuje přínos přidání třetího léku ze skupiny IMIDS (immunomodulatory drugs), kam patří thalidomid a lenalidomid. Tyto léky ovlivňují tvorbu cytokinů a blokují angiogenezi, a to se pak pozitivně projeví v rychlosti léčebné odpovědi. Druhým novým lékem, který pomohl v kombinaci s klasickou léčbou, je antiCD20 protilátka rituximab. A třetím novým lékem je monoklonální protilátka proti receptoru pro interleukin-6, tocilizumab. V našem textu popisujeme velmi rychlou léčebnou odpověď po kombinované léčbě cyklofosfamid 500 mg/ m2 i.v. infuze 1. a 15. den v 28denním cyklu, dexametazon 20 mg p.o. 1. – 4. den a 15. – 18. den cyklu a thalidomid 100 mg denně. V průběhu dvouměsíční léčby se zcela normalizovalo vychytávání fluorodeoxyglukózy při PET-CT vyšetření, zmenšily se původně patologicky zvětšené uzliny, normalizovala původně zvýšená hodnota CRP a vzestoupila původně výrazně snížená hodnota hemoglobinu. V průběhu posledních 3 let jde o 2. pacienta s multicentrickou Castlemanovou chorobou, u kterého jsme pozorovali velmi rychlou léčebnou odpověď po léčbě kombinací thalidomidu, cyklofosfamidu a dexametazonu. Považujeme proto tuto léčbu za vhodnou pro nově diagnostikované nemocné s multicentrickou formou Castlemanovy choroby.
Klíčová slova:
Castlemanova choroba – multicentrická forma – thalidomid – bortezomib – rituximab – tocilizumab – POEMS syndrom – vaskulitida – polyklonální hypergamaglobulinemie – anémie chronických chorob – horečka nejasného původu (fever of unknown origin)Úvod – základní informace o Castlemanově chorobě
Castlemanova choroba, zvaná též angiofolikulární hyperplazie lymfatických uzlin, patří k lymfoproliferativním chorobám nejasné etiologie. Nejedná se sice o maligní klonální onemocnění, ale může se v maligní lymfoproliferaci transformovat. Castlemanova choroba se častěji vyskytuje v u nemocných s HIV infekcí, nebo s infekcí humánním herpesvirem 8 než v průměrné populaci. Může však probíhat i bez přítomnosti těchto virů.
Castlemanova choroba má z hlediska lokalizace 2 zásadně odlišné typy: lokalizovanou a multicentrickou formu.
V našem textu se zabýváme pacientem s multicentrickou chorobou. Multicentrická forma je prognosticky závažnější. Postihuje nejčastěji osoby v 5. – 6. dekádě věku.
Klinicky se nemoc projevuje subfebriliemi až febriliemi kolísavého průběhu, lymfadenopatií, může být provázena splenomegalií a hepatomegalií a také tvorbou výpotků v serózních dutinách.
K dalším znakům pak patří anémie chronických chorob, zvýšená hodnota CRP, v některých případech výrazné zvýšení polyklonálních imunoglobulinů, což vede k tomu, že hodnota celkové bílkoviny je značně zvýšena a může způsobit projevy hyperviskozity. Hypergamaglobulinemie však není přítomna u všech nemocných s touto nemocí. S Castlemanovou chorobou mohou být spojeny projevy narušené imunity, např. vaskulitida [1].
Vzhledem k velmi nízké incidenci neexistují pro tuto nemoc léčebná doporučení založená na klinických studiích. Nečetné popisy této nemoci lze najít i v českých publikacích [2 – 7].
V posledních letech se objevily četné, v dalším textu citované publikace, popisující úspěch léčby thalidomidem. Cílem našeho sdělení je informovat o našich zkušenostech s léčbou multicentrické formy Castlemanovy choroby thalidomidem, cyklofosfamidem a dexametazonem a předložit přehled informací o léčbě této nemoci.
Popis případu
Klinické příznaky a stanovení diagnózy
Pacient, narozený roku 1954, byl již po několik předchozích let sledován gastroenterology pro chronickou pankreatitidu, recidivující cholangitidy a chronickou hepatopatii. V roce 2007 byla provedena choledochoduodenoanastomóza. Opakovaná tvorba ascitu v hepatorenálním prostoru byla řešena drenážemi pod CT kontrolou. Gastroenterologové dále uvádějí steatofibrózu a cirhózu jater s portální hypertenzí. Histologicky se jednalo o granulomatózní hepatitidu nejasné etiopatogeneze s negativními sérologiemi.
V prosinci roku 2010 byl tento pacient poprvé odeslán na naše pracoviště. Důvodem k odeslání byla vysoká hodnota celkové bílkoviny (100 g/ l) a dále vysoké koncentrace polyklonálních imunoglobulinů (celkové IgG 58 g/ l), monoklonální imunoglobulin nebyl prokázán. Důležité patologické hodnoty uvádíme v tab. 1.
Tab. 1. Vývoj laboratorních parametrů souvisejících s aktivitou Castlemanovy nemoci. 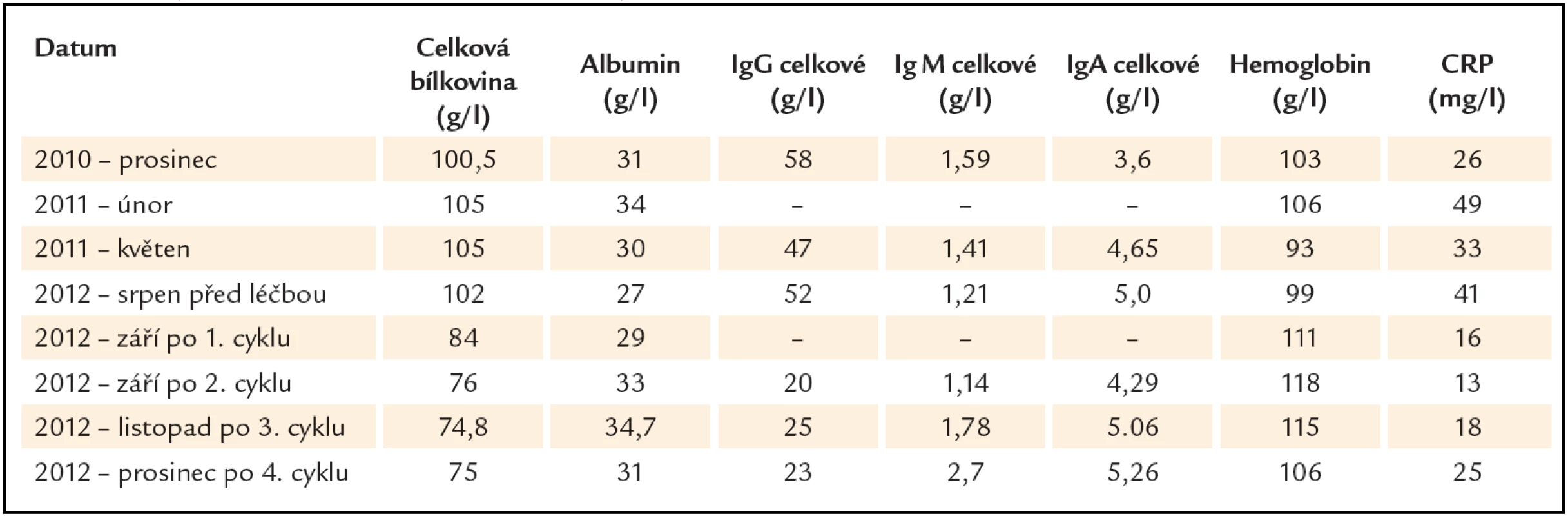
Subjektivní potíže nemocného: zvýšené hodnoty tělesné teploty (mezi 37 – 38 °C) a patologická únava a občas výrazné noční pocení.
V objektivním nálezu byly mírně zvětšené axilární uzliny (o průměru 1,5 cm) a zvětšená játra přesahující oblouk žeberní.
V rámci diferenciální diagnostiky lymfadenopatie bylo provedeno mimo jiné také PET-CT vyšetření počátkem roku 2011. Prokázalo masivní abdominální a mediastinální lymfadenopatii s patologicky zvýšenou akumulací fluorodeoxyglukózy.
První pokus o histologické stanovení diagnózy – březen roku 2011
První chirurgický výkon s cílem získat reprezentativní vzorek pro histologické vyšetření byl proveden v dubnu roku 2011. Jednalo se o exstirpaci zvětšené uzliny z axily. Výsledek histologického vyšetření však nepřinesl pojmenování nemoci. Patolog popsal histiocytózu splavů a polyklonální plazmocyty v uzlině, ale jednoznačnou diagnózu se patologovi z této exstirpované uzliny nepodařilo stanovit.
Druhý pokus o histologické stanovení diagnózy – květen roku 2011
V květnu roku 2011 byla provedena druhá operace s cílem odebrat dostatek materiálu pro stanovení diagnózy. Tentokráte se jednalo o odběr materiálu z břišní dutiny, kde na PET-CT zobrazení byly popsány patologicky zvětšené uzliny. Operující chirurg měl roli ztíženou srůsty v dutině břišní po předchozích břišních operacích, nicméně podařilo se mu odebrat několik vzorků uzlin pro histologické vyšetření. Morfologické vyšetření odebraného materiálu však opět bylo bez jednoznačného závěru. Patolog v odebrané uzlině popsal opět jen chronické zánětlivé změny.
Třetí pokus o histologické stanovení diagnózy – červen roku 2012
Dva neúspěšné pokusy o histologické stanovení názvu nemoci odradily pacienta od dalších návštěv naší ambulance, takže nyní trvalo více měsíců, než klinické příznaky nemoci (slabost, zvýšené teploty a noční pocení v rozsahu celého těla) přiměly pacienta k další návštěvě našeho pracoviště. Byla provedena další zobrazovací vyšetření, která jenom potvrdila progresi lymfadenopatie v oblasti mediastina a také v oblasti břišní dutiny.
Po diskuzi s chirurgy byla nyní zvolena mediastinální lymfadenopatie za cíl diagnostického operačního výkonu. Hrudní chirurg při celkové narkóze, selektivní intubaci a separované ventilaci po kolapsu plíce zavedl porty pro torakoskopii do hrudníku zvyklým způsobem. V hrudníku bylo minimální množství serózního výpotku a známky po předchozích zánětlivých atakách se srůsty plíce s bránicí a adhezí k hrudní stěně. V mediastinu parakardiálně nad bránicí byl vidět objemný infiltrát, který byl v perikardiálním tuku. Hrudní chirurg naťal mediastinální pleuru a postupně uvolnil infiltrát velikosti 3 × 2 cm. Ten pak odeslal k nativnímu zpracování na patologii. Pak hrudní chirurg provedl koagulaci spodiny a zavedl hrudní drén. Z tohoto vzorku se konečně podařilo získat jednoznačnou histologickou diagnózu (obr. 1, 2 a 3).
Obr. 1. Histologický obraz Castlemanovy nemoci. 1 – zesílená stěna cév hyalinem, 2 – zachovalá architektonika LU, 3 – atretický folikul. 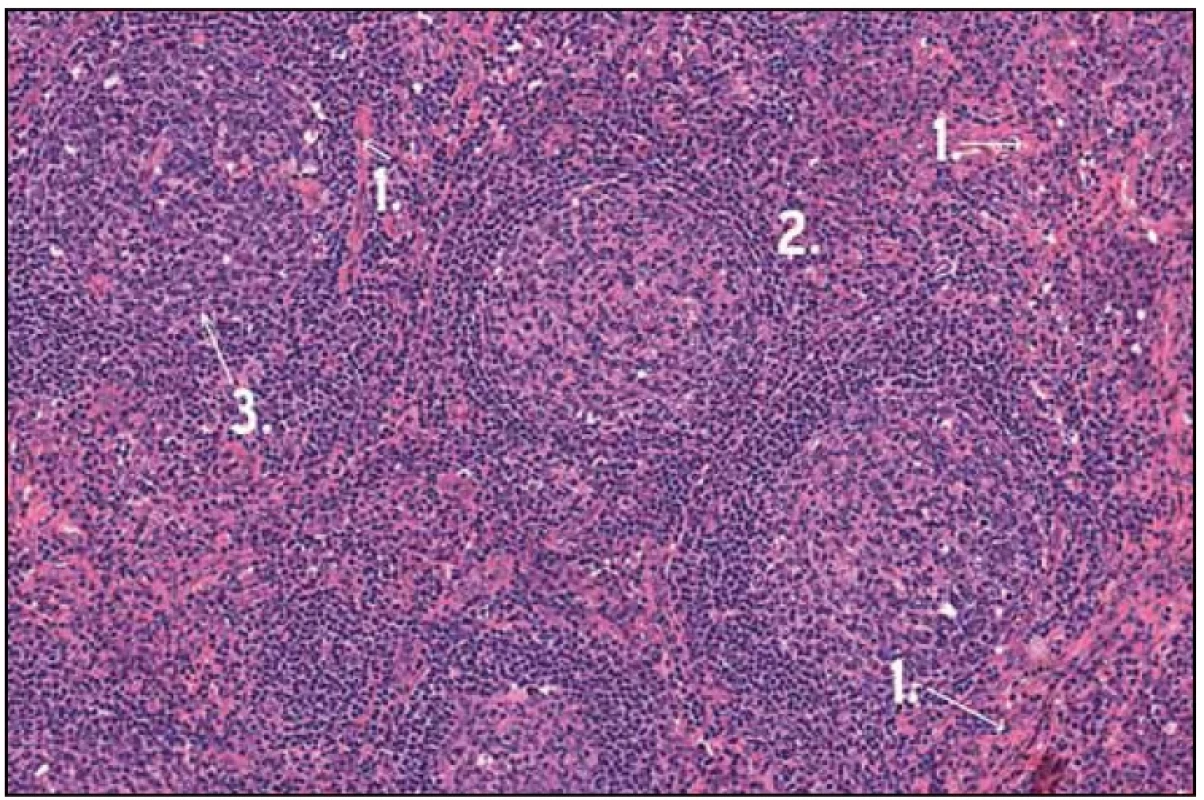
Obr. 2. Histologický obraz Castlemanovy nemoci. 1 – CD 23 (FCRII) – folikulární dendritické buňky. 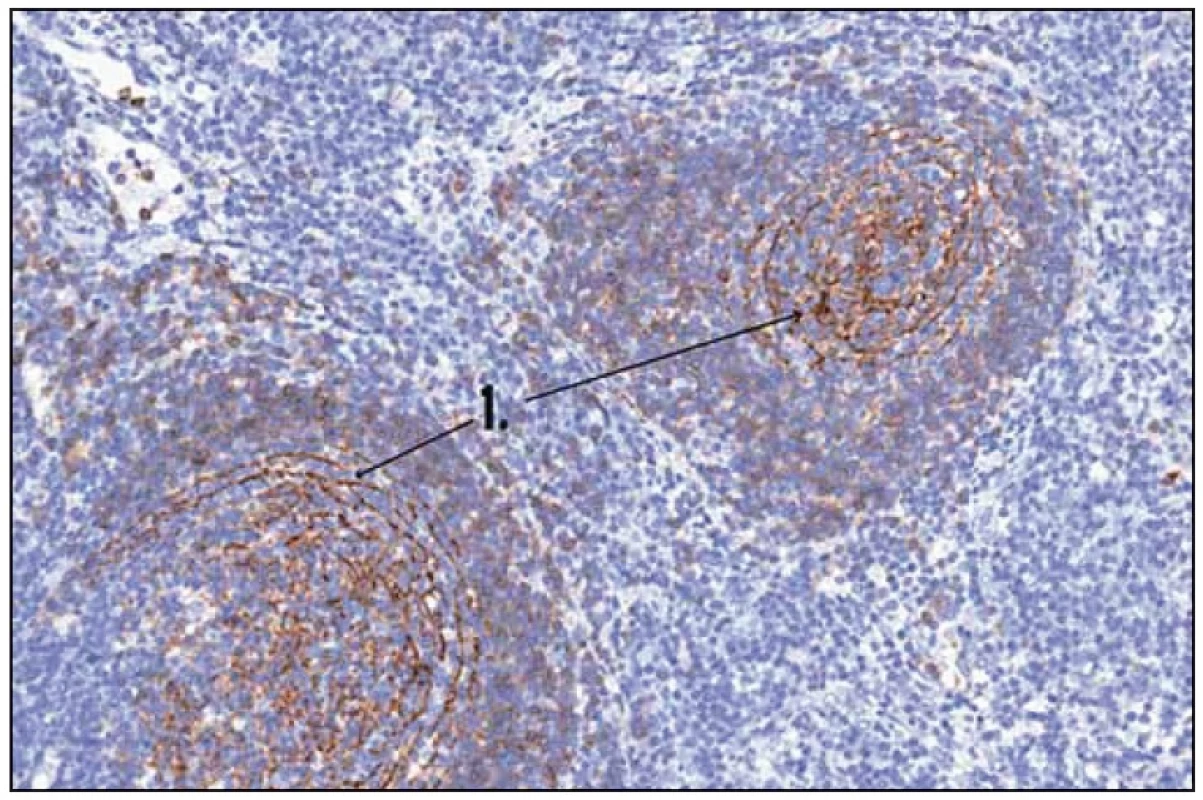
Obr. 3. Histologický obraz Castlemanovy nemoci. 1 – infiltráty plazmatických buněk, 2 – depozitum fibrinu v germinativním centru, 3 – typické pravidelné uspořádání plášťové zóny, 4 – germinativní centra bez hyalinních změn. 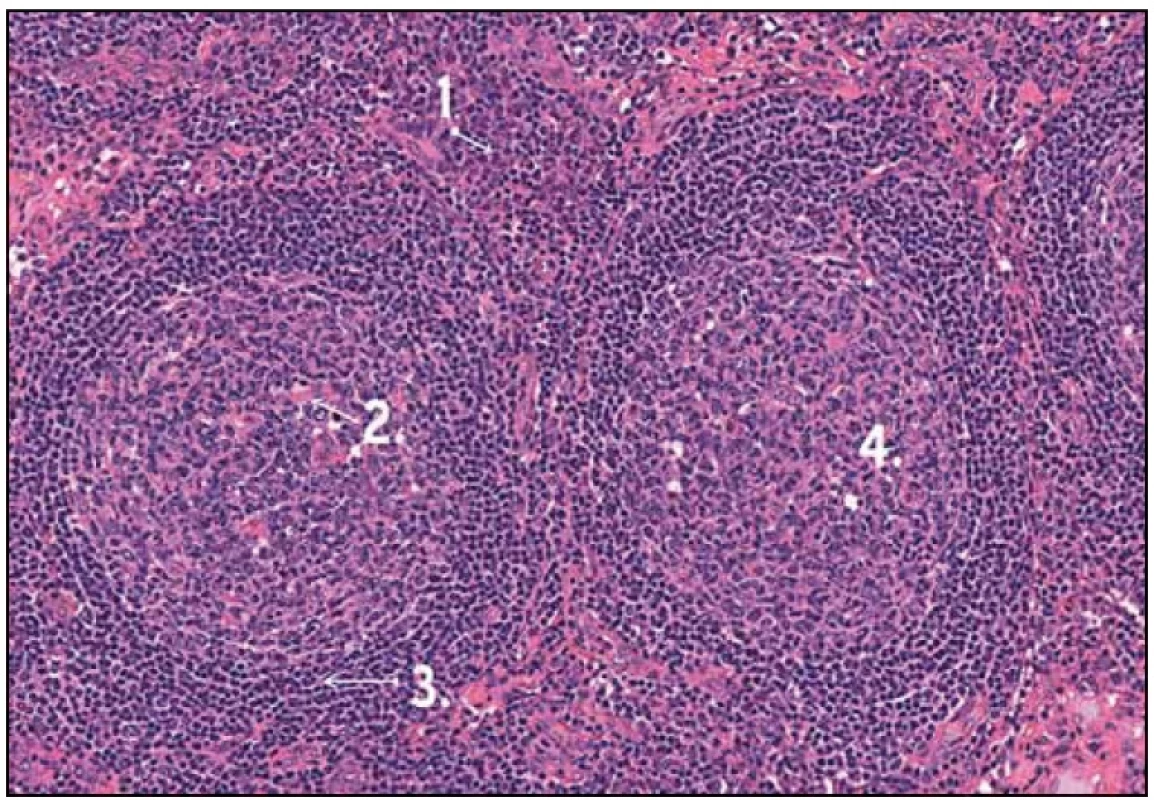
Histologické hodnocení materiálu odebraného ze zvětšených mediastinálních uzlin
Patolog popsal zachovalou architektoniku lymfatické uzliny s převážně atretickými a ojediněle hyperplastickými folikuly. Dále popsal interfolikulárně rozsáhlé plochy polyklonálních plazmatických buněk. Vzhledem k tomu, že lymfatické folikuly byly převážně atretické, konstatoval patolog, že jde o podtyp nazývaný tranzitorní, zapadající do skupiny plazmocytární varianty Castlemanovy choroby. Všechna morfologická vyšetření byla provedena patology ve FN Brno, pracoviště Bohunice.
Rozsah nemoci dle zobrazovacích vyšetření před zahájením léčby
Poslední PET-CT vyšetření před zahájením léčby bylo provedeno v březnu roku 2012. Zobrazovací specialisté popisují v oblasti hrudníku výrazně zvětšené uzliny parasternálně a dále v zadním mediastinu a v předním bráničním úhlu, kde paket uzlin dosahoval průměru 9 cm, což byla progrese ve srovnání s předchozím vyšetřením.
V dutině břišní byla zřetelně zvětšená slezina 19 × 13 cm a zvětšené lymfatické uzliny v oblasti retroperitonea, které měly 3,7 cm v průměru, periferní uzliny v axilách byly také zvětšené, ale zvětšení bylo méně nápadné než u hrudních a abdominálních uzlin.
Akumulace fluorodeoxyglukózy byla ve všech uzlinových oblastech zvýšená, SUVmax bylo mezi 2 – 3 a nejvyšší akumulace fluorodeoxyglukózy byla v oblasti uzlin v bráničním úhlu, SUVmax 4,12.
Léčba
Dne 28. srpna 2012 byla zahájena léčba Castlemanovy multicentrické choroby. Důvodem pro zahájení léčby byly výrazné klinické symptomy (zvýšené teploty, noční pocení, patologická únava). Byla aplikována chemoterapie v následujícím složení:
- cyklofosfamid 500 mg/ m2 (900 mg celkem) i.v. infuze 1. a 15. den ve 28denním cyklu,
- thalidomid (Myrin), 1 tableta obsahující100 mg denně (večer),
- dexametazon 20 mg v magistraliterpřipravené kapsli p.o. 1. – 4. den a dále 15. – 18. den ve 28denním cyklu.
Profylakticky byla současně s chechemoterapií podána následující léčba:
- omeprazol 20 mg večer po dobu léčby dexametazonem a ještě další 2 dny po ukončení léčby dexametazonem,
- nízkomolekulární heparin (Fraxiparin) s cílem snížit riziko tromboembolizmu, které vyplývá z léčby thalidomidem a dexametazonem,
- cotrimoxazol 480 mg denně, profylaxe pneumocystové pneumonie.
Druhý cyklus této léčby byl zahájen 25. září 2012. Tolerance léčby je zatím výborná, pacient neudává žádné nežádoucí účinky.
Hodnocení účinnosti léčby
Klinické a laboratorní hodnocení
Po 2 cyklech (měsících) léčby pacient uvedl, že odezněly dříve pozorované subfebrilie a vymizelo noční pocení a také ustoupila patologická únava.
Výrazné zlepšení bylo patrné z vývoje laboratorních hodnot, které ukazuje tab. 1. Poklesla hodnota CRP, poklesla hodnota celkové bílkoviny, poklesla původně vysoká hladina polyklonálních imunoglobulinů a vzestoupila hodnota hemoglobinu již po 2 cyklech a v průběhu dalších 2 cyklů se hodnoty stabilizovaly, nedostaly se však na normu, takže léčebnou odpověď pracovně hodnotíme jako parciální remisi, byť pro tuto chorobou nejsou definována kritéria léčebné odpovědi.
Pro hodnocení by bylo jistě zajímavé vyšetřit hladiny interleukinů (interleukinu 6) a vaskulárního endoteliálního růstového faktoru (VEGF) a vývoj těchto parametrů při léčbě thalidomidem. Tato vyšetření však nejsou standardně prováděna a hrazena.
CT hodnocení
Při klasickém CT hodnocení, provedeném po 2 cyklech léčby, byla popsána lehká regrese splenomegalie, částečná regrese počtu a velikosti zmnožených lymfatických uzlin, stacionární konfigurace jater.
V hrudníku byla na klasickém CT obraze popsána regrese lymfatických uzlin mediastinálně. Popisovaný rozsáhlý paket lymfatických uzlin nad bránicí před srdcem byl také v regresi početní i velikostní. V hrudníku se na zmenšení paketu však podílel i operační výkon. Vývoj nemoci při léčbě v klasickém CT obraze dokumentují obr. 4 – 9.
Obr. 4. Retroperitoneální lymfadenopatie před léčbou. 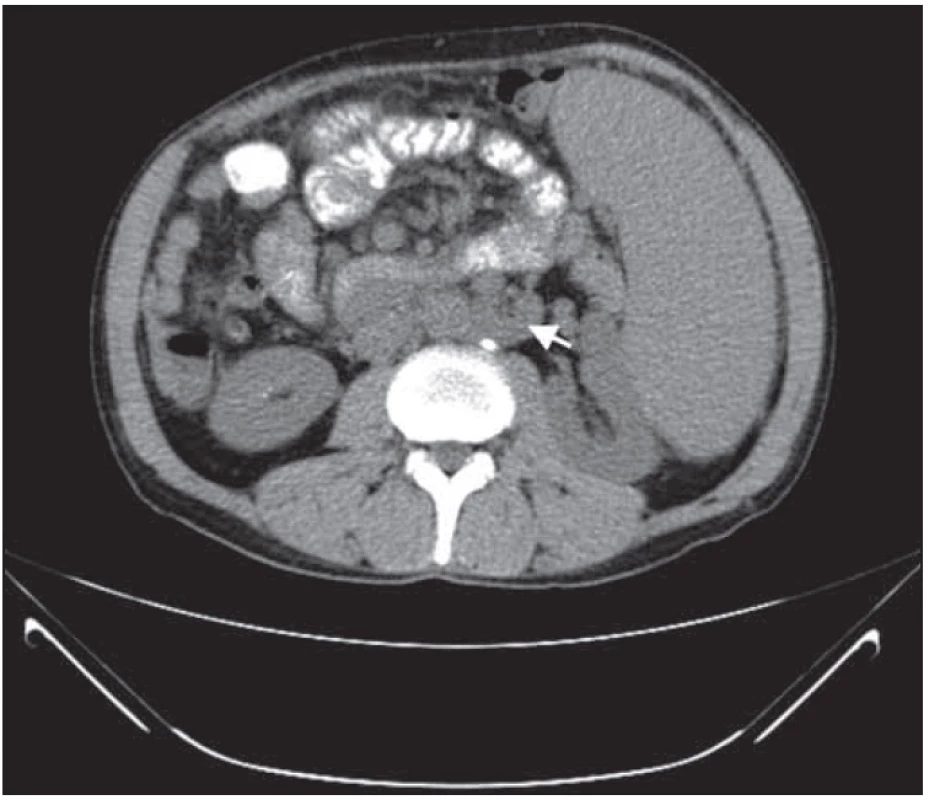
Obr. 5. Retroperitoneální lymfadenopatie po léčbě – nápadná regrese nálezu. 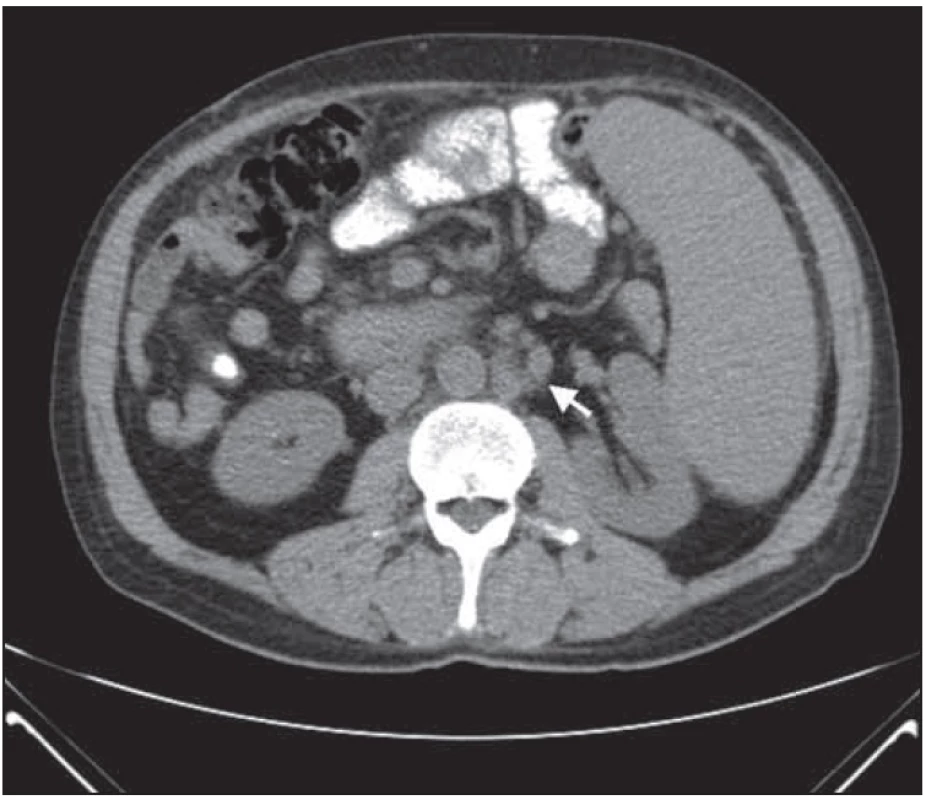
Obr. 6. Bochníkovitý útvar na stěně hrudní nitrohrudně paramediálně vpravo v úrovni mezi kostosternálním 1. a 2. skloubením před léčbou. 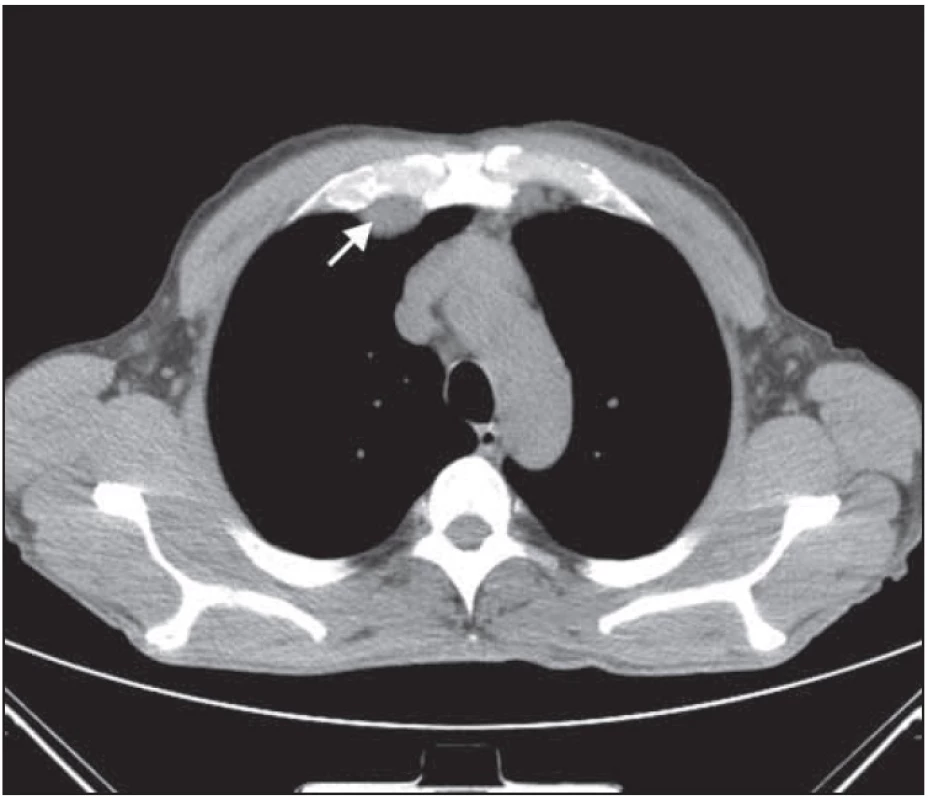
Obr. 7. Bochníkovitý útvar na stěně hrudní nitrohrudně paramediálně vpravo v úrovni mezi kostosternálním 1. a 2. skloubením po léčbě. 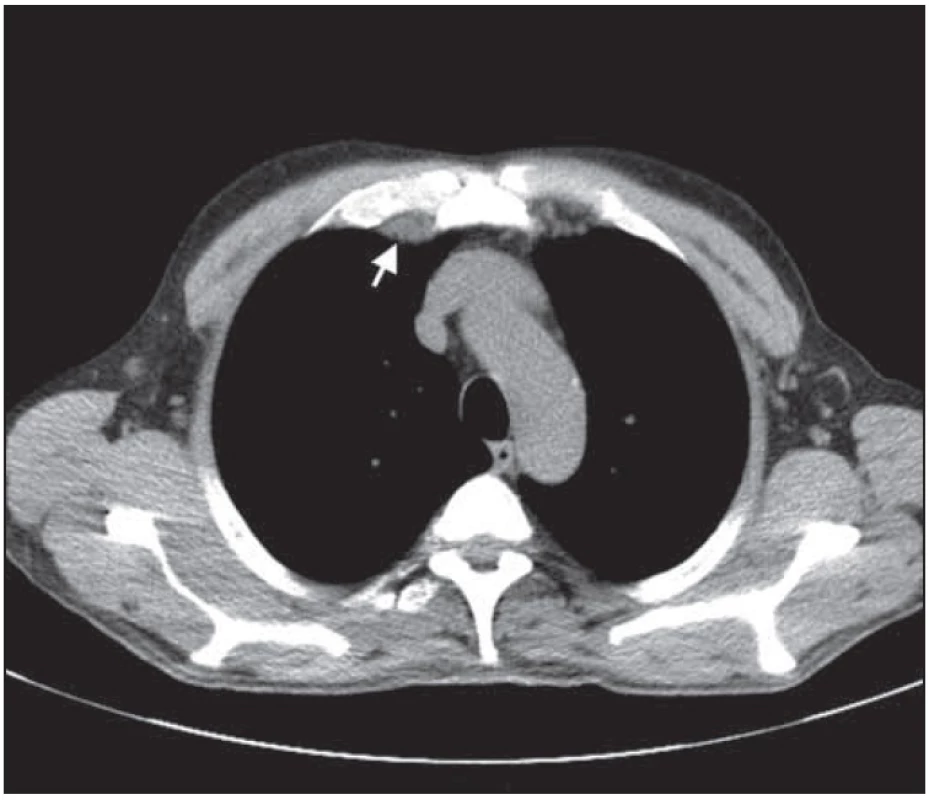
Obr. 8. Rozsáhlý paket uzlin před srdcem nad bránicí před léčbou. 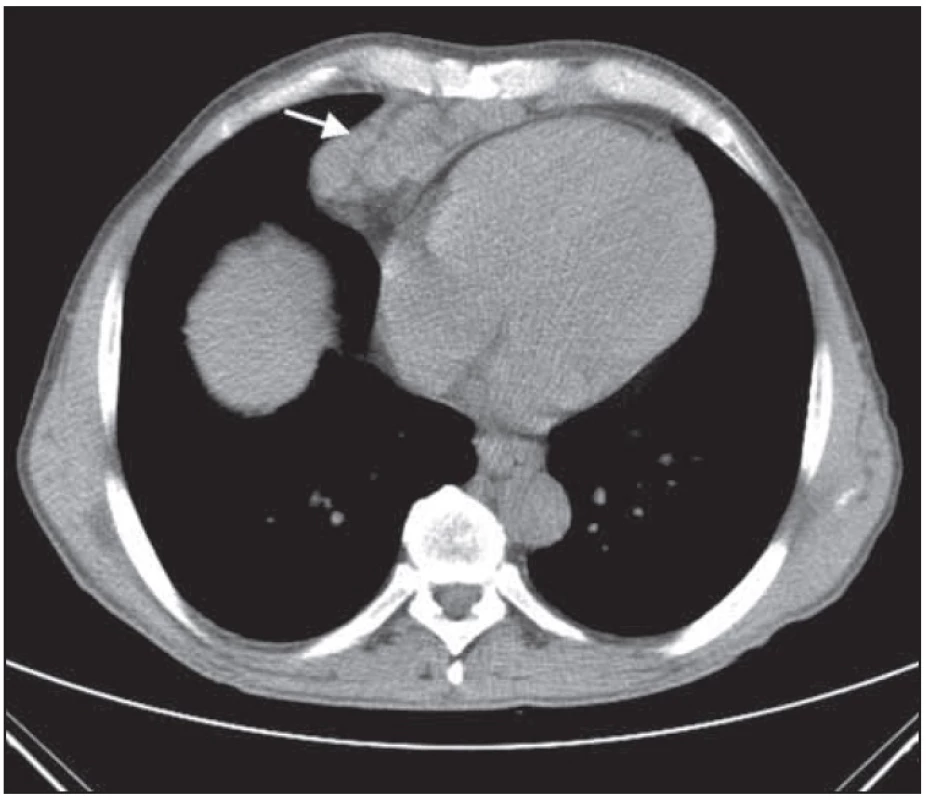
Obr. 9. Paket uzlin před srdcem nad bránicí. Nápadná regrese nálezu po léčbě. 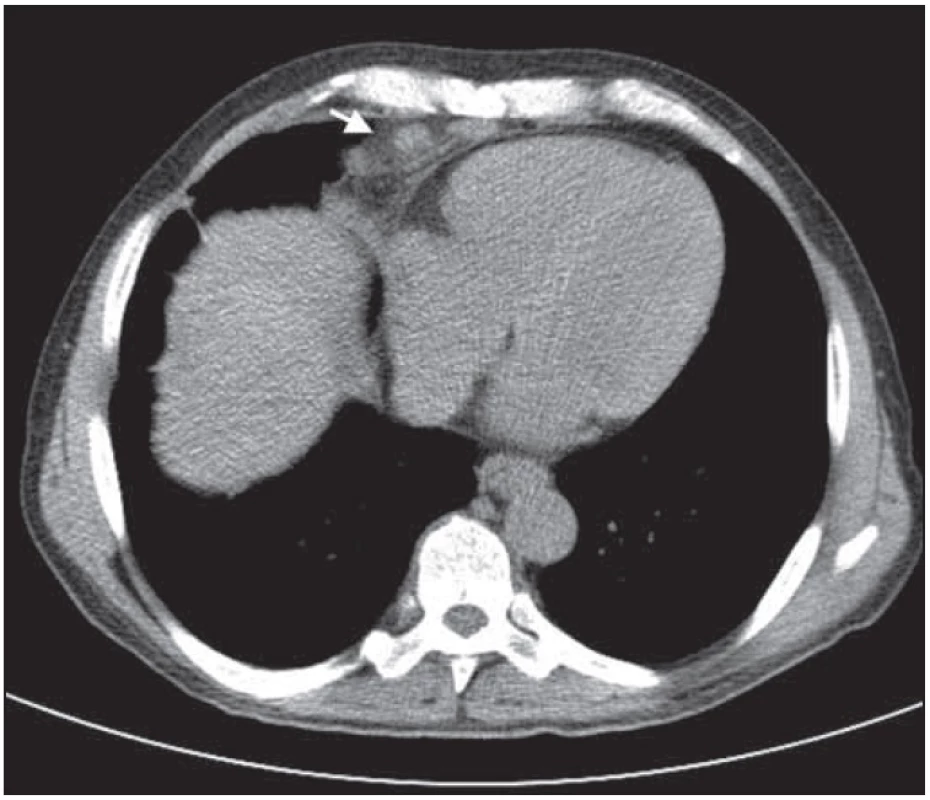
PET-CT hodnocení
Po 2. cyklu chemoterapie bylo provedeno hodnocení léčebné odpovědi metodou PET-CT vyšetření. V mediastinu stále přetrvávaly zmnožené lymfatické uzliny, místy s nepatrnou regresí. Infiltrát v mediastinu parasternálně a parakardiálně se zmenšil. Slezina zůstala o stejné velikosti beze změny. V dutině břišní bylo patrné zmenšení lymfatických uzlin.
Při PET hodnocení bylo zjištěno, že původně zvýšené vychytávání fluorodeoxyglukózy v lymfatických uzlinách se zcela normalizovalo. Zvýraznily se však heterogenity a ložiskové zvýšení aktivity v patologicky změněných játrech.
Změny ve vychytávání fluorodeoxyglukózy zachycuje tab. 2 a změny v průběhu času na PET-CT vyšetření obr. 10. Uvedená vyšetření potvrzují velmi rychlý nástup účinku zvolené léčby a tedy i vhodnost jejího pokračování.
Tab. 2. Přehled hodnot velikosti uzlinového paketu a akumulace radiofarmaka (FDG) vyjádřené semikvantitativně indexem SUV<sub>max</sub> (maximální hodnoty „standardized uptake value“) v zobrazovaném ložisku (v bráničním úhlu ventrálně vpravo) a rovněž i v nejvíce aktivním ložisku. Je patrný nárůst hodnot SUV<sub>max</sub> i velikosti mezi lednem roku 2011 a březnem roku 2012 – do doby, než byla stanovena diagnóza a zahájena léčba. Rovněž je patrný pokles hodnot SUV<sub>max</sub> (v zobrazované i nejvíce aktivní uzlině) i ve velikosti zobrazovaného paketu v říjnu roku 2012 po 3 měsících popisované léčby. 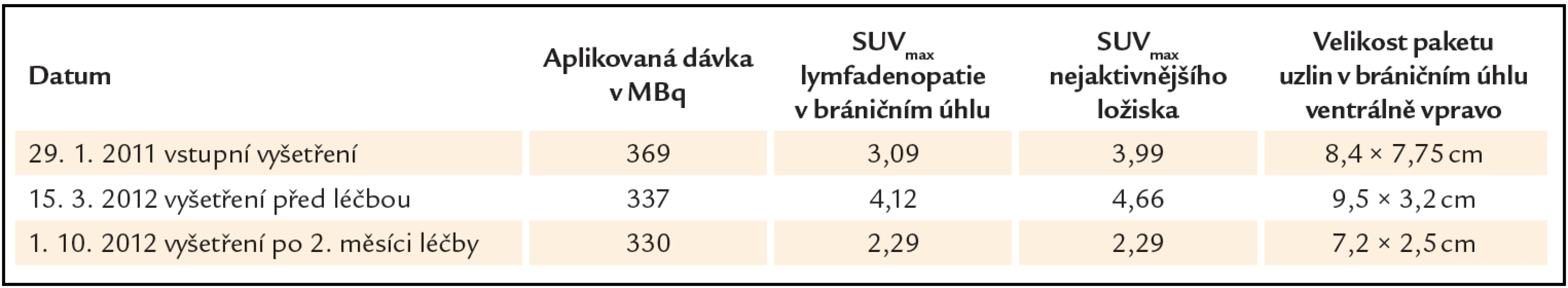
Obr. 10. PET/ CT vyšetření: obrazy CT (vlevo), PET- CT (uprostřed) a PET (vpravo) v axiálním řezu v úrovni uzlinového paketu v bráničním úhlu ventrálně vpravo. 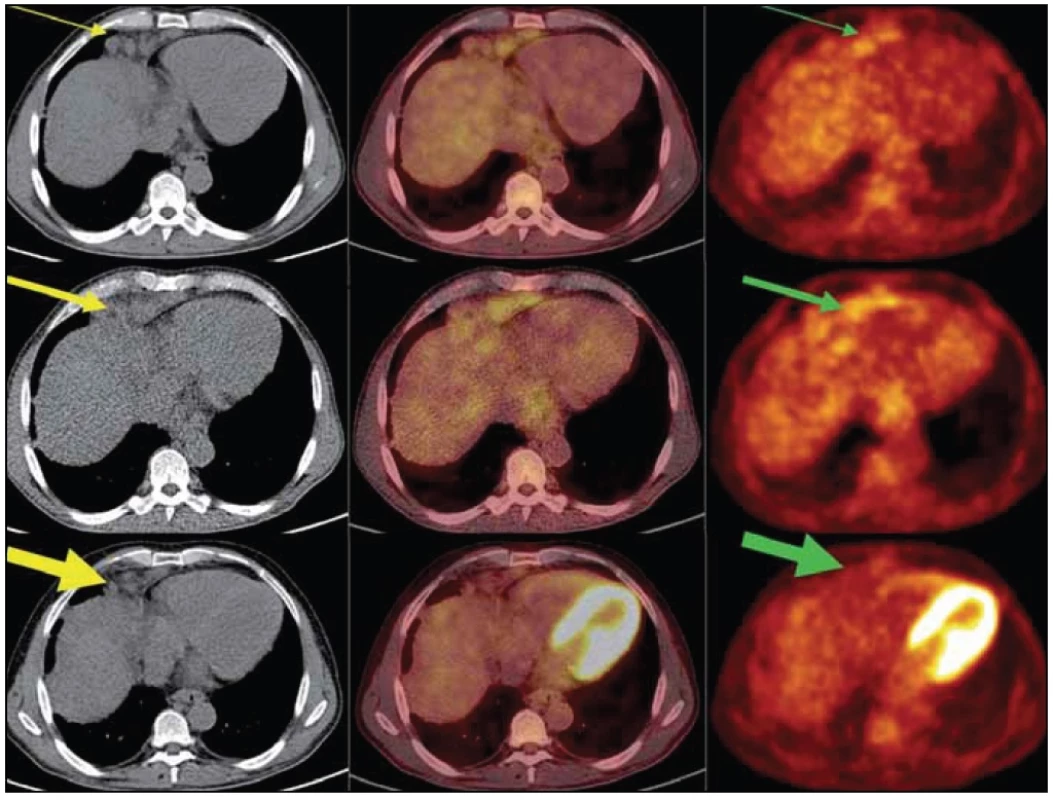
Horní trojice z vyšetření v lednu roku 2011 – uzlinový paket (žlutá šipka) se zvýšenou akumulací FDG (zelená šipka). Prostřední trojice z vyšetření v březnu roku 2012 dokumentuje velikostní progresi splývajících uzlin v LD (low dose) CT obrazu a vzestup metabolické aktivity (silné šipky). Dolní trojice z vyšetření v říjnu roku 2012 dokumentuje velikostní regresi uzlin v CT obrazu, i pokles metabolické aktivity těchto uzlin (nejsilnější šipky).Diskuze
Castlemanova choroba je vzácná a řídce diagnostikovaná nemoc, pro jejíž označení se někdy používá termínu „giant lymph node hyperplasia“ nebo zmnotaké „angiofollicular lymph node hyperplasia“, česky přeloženo angiofolikulární uzlinová hyperplazie. Castleman si této neobvyklé nozologické jednotky všiml již v 50. letech minulého století a v roce 1956 publikoval první popis [8].
Choroba nemá, alespoň zpočátku, maligní ani monoklonální charakter proliferace. V některých případech však byla popsána pozdější transformace v maligní krevní onemocnění. Sami jsme podobný průběh u jedné pacientky na našem pracovišti pozorovali; Castlemanova choroba, multicentrický plazmocelulární typ s vysokou vstupní hodnotou celkové bíkoviny přesahující 100 g/ l, se po letech transformovala v maligní lymfom, který mimo jiné způsoboval osteolýzu.
Histologické typy Castlemanovy nemoci
Castlemanova choroba je histologicky dělena na 3 typy, hyalinně-vaskulární typ, plazmocytární typ a smíšený typ.
Histologický obraz hyalinně-vaskulárního typu je charakterizován zmnožením folikulů, které bývají malé a mají regresivně transformovaná zárodečná centra se širšími plášťovými zónami. Interfolikulárně je hypervaskularita. Pláště folikulů jsou tvořeny koncentricky uspořádanými lymfocyty, připomínajícími cibulové vrstvy. Radiálně probíhající kapiláry penetrují až do germinálního centra, které často obsahuje hyalinní depozita. V interfolikulárním prostoru je patrná proliferace kapilár, četné lymfocyty a plazmatické buňky. Imunohistologické studie prokázaly polyklonální typ exprese lehkých řetězců v interfolikulárních B-lymfocytech a plazmatických buňkách.
Histologický obraz plazmocytárního typu se vyznačuje výraznějším zastoupením plazmatických buněk.
Klinické formy
Z hlediska klinické prezentace nemoci se rozlišují 2 zásadně odlišné formy:
- lokalizovaná forma a
- multifokální forma.
Charakteristika lokalizované formy
Lokalizovaná forma, jak z názvu vyplývá, postihuje jednu uzlinu či uzlinovou oblast. Tato forma obvykle nevytváří žádné systémové příznaky, na svou přítomnost upozorní jedině velikostí uzliny či paketu uzlin, který začne nemocnému dělat problémy svou expanzí a útlakem okolních struktur. U lokalizovaných forem se obvykle popisuje intraabdominální či intratorakální lokalizace. Ve skupině nemocných s lokalizovanou formou, které na našem pracovišti sledujeme, se 3krát jednalo o intraabdominální pakety, v jednom případě o paket v oblasti axily.
Lokalizovaná forma se léčí totální chirurgickou resekcí. Tento výkon má na rozdíl od lymfomů kurativní charakter. Při subtotální resekci může však dojít k recidivě. V případě neresekovatelnosti solitárního ložiska se používá radioterapie.
Lokalizovaná forma při histologickém vyšetření resekátu obvykle odpovídá hyalinně-vaskulárnímu typu Castlemanovy nemoci [9 – 12].
Charakteristika multifokální formy Multifokální forma Castlemanovy nemoci mívá na rozdíl od výše uvedené lokalizované formy postižení četných uzlinových oblastí, jak intratorakálně či intraabdominálně, tak také postižení periferních uzlinových oblastí. Na CT zobrazení se manifestuje jako měkká tkáňová masa s mírným až středním kontrastním enhancementem.
Multifokální forma může být také provázena splenomegalií a hepatomegalií a u některých pacientů bývá přítomen ascites nebo pleurální výpotek. Na rozdíl od lokalizované formy bývá multifokální forma provázena systémovými příznaky, podobnými, jako někdy provází non hodgkinské lymfomy či Hodgkinův lymfom.
První návštěva nemocných s Castlemanovou chorobou u lékaře může být z důvodu undulujících febrilií či subfebrilií, splňujících kritéria horečky nejasného původu, nebo pro úbytek hmotnosti, případně pro patologickou únavu. U pacientů s vysokou koncentrací imunoglobulinů může být důvodem první návštěvy u lékaře hyperviskozita, projevující se epistaxí, únavou, poruchou zraku. Jiné pacienty s touto nemocí přivede poprvé k lékaři projev vaskulitidy, včetně vaskulitidy mozkových tepen projevujících se jako cévní mozkové příhody. U n kterých pacientů byly popsány i známky intersticiálního postižení plic [13,14].
Laboratorní projevy
U pacientů s multifokální formou Castlemanovy nemoci bývá anémie chronických chorob, zvýšená hodnota CRP, zvýšená sedimentace.
V některých případech multifokální formy jsou extrémně zvýšené koncentrace imunoglobulinů, které jsou polyklonální (obvykle u plazmocytárního typu). Někteří pacienti s multifokální formou však mívají normální koncentrace imunoglobulinů. V jiných případech byla popsána granulocytóza.
Pokud je vyšetřena kostní dřen, může být nalezen zvýšený počet polyklonálních plazmocytů [15,16].
Multifokální forma může nabývat 3 histologických variant, častý je plazmocytární typ anebo typ smíšený, výjimečný je typ hyalinně-vaskulární.
Plazmocytární varianta je více agresivní proti okolním tkáním, do nichž může prorůstat.
Z hlediska výskytu v populaci jde o nemoc středního věku, tedy osob v 5. či 6. dekádě života.
U popisovaného pacienta se jednalo tedy o generalizované postižení uzlin břišní a hrudní dutiny a hepatosplenomegalii a velmi pravděpodobně s nemocí souvisel i opakovaně se tvořící ascites. Z laboratorních nálezů byla u našeho pacienta před zahájením léčby opakovaně potvrzena anémie, odpovídající anémii chronických chorob, zvýšená sedimentace i hodnota CRP, polyklonální zmnožení imunoglobulinů, což se projevilo zvýšením celkové bílkoviny na hodnotu 105 g/ l.
Stanovení diagnózy
V případě unicentrické formy Castlemanovy nemoci vedou ke stanovení diagnózy příznaky z lokální expanze. V případě multicentrické formy pacienti spíše přicházejí s celkovými příznaky, které často odpovídají kritériím horečky nejasného původu. Termín „horečka nejasného původu“ (anglicky fever of unknown origin – FUO) byl vytvořen jako označení situace, kdy je díky časovému kritériu velmi nepravděpodobné, že by příčinou teploty byla jen banální viróza či jiné tzv. self-limiting infekce, neboli infekce, které samy odezní do 3 týdnů. U pacientů, kteří splňují kritéria horečky nejasného původu (tab. 3), je chybou, když se lékař spokojí s podáním antibiotika a nezahájí pátrání po příčině. Pokud pacient splňuje diagnózu febrilií nebo subfebrilií nejasného původu, je nutné okamžité zahájit vyšetřování. Vzhledem k tomu, že existuje velmi vysoký počet možných příčin, doporučuje se postupovat podle publikovaných doporučení pro vyšetřování těchto stavů [17 – 20].
Tab. 3. Kritéria horečky nejasného původu (fever of unknown origin – FUO), která jsou indikací k dalšímu vyšetřování [18]. ![Kritéria horečky nejasného původu (fever of unknown origin – FUO), která jsou indikací k dalšímu vyšetřování [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/848aecdcac10154bc50ea48fb4ced902.png)
Velkým přínosem pro objasňování těchto stavů je vyšetření PET-CT, jak dokumentuje citovaná literatura [21 – 24] a jak potvrzuje i tento případ.
Vyšetření rozsahu choroby
V současnosti je nejvýhodnější metodou pro vyšetření rozsahu i hodnocení léčebné odpovědi PET-CT vyšetření, jak dokumentují četné publikace. PET-CT má potenciál znázornit velikost uzlin, charakterizovat agresivitu nemoci podle míry akumulace fluorodeoxyglukózy v uzlinách a dále informovat o případné hepatomegalii, splenomegalii či o vznikajícím duplicitním tumoru [25 – 28].
I u našeho pacienta PET-CT vyšetření informovalo o rozsahu nemoci před léčbou a pokles akumulace fluorodeoxyglukózy signalizoval výrazný pokles aktivity, což korelovalo se zvýšením hodnoty hemoglobinu, poklesem hodnoty CRP.
Průběh nemoci
Multicentrická forma je agresivnější než lokalizovaná. Medián přežití nebyl publikován. Z popisu případů je však zřetelné, že u většiny nemocných má choroba dlouholetý průběh. Pacienty sice rychle nezabíjí, ale výrazně zhoršuje kvalitu jejich života. Projevy vaskulitidy jsou vysloveně invalidizující (cévní mozkové příhody) a komplikují další léčbu i ošetřování. Vzhledem k narušení imunity se u těchto nemocných ve srovnání s průměrnou populací zvyšuje výskyt dalších maligních chorob.
Literatura uvádí následující možné spontánní vývoje této nemoci [29 – 34]:
- opakované relapsy a remise,
- stabilní perzistující choroba,
- progredující fatální choroba,
- transformace v maligní lymfom.
Souběh s POEMS syndromem
Histologicky i klinicky se může překrývat průběh multicentrické formy Castlemanovy nemoci s osteosklerotickým myelomem a s POEMS syndromem (což je akronym pro Polyneuropathy, Organomegaly, Endocrinopathy, Monoclonal gammopathy, Skin changes), jak vyplývá z citované literatury. Poměrně často se v těchto případech objevují popisy komplikujících cévních mozkových příhod, které pravděpodobně souvisejí s vaskulitidou [35 – 43]. Etiopatogezene a tedy souvislosti Castlemanovy choroby s POEMS syndromem čekají na objasnění.
Léčba
Léčba této nemoci byla rozebrána v několik posledních českých publikacích a v několika zahraničních přehledech, proto jenom stručně. V dalším textu připomeneme jenom základní kameny léčby a nebudeme rozvádět, jak se liší léčba v případě souběhu HIV infekce a Castlemanovy nemoci. Přehled léčby Castlemanovy nemoci kombinované s HIV infekcí uvádí Szturz [44].
Klasická chemoterapie
U multifokálního typu Castlemanovy nemoci byla použita klasická chemoterapie v podobných kombinacích jako u maligních lymfomů. Léčba založená na pouhé kombinaci cytostatik nevedla ve všech případech k dlouhodobému ústupu nemoci. Přehled všech publikovaných zkušeností s klasickou chemoterapií uvádí např. [36,37].
AntiCD20 protilátka, rituximab
Z nových dostupných léků se u pacientů s Castlemanovou chorobou osvědčila monoklonální protilátka antiCD20, rituximab. Obvykle se používá v kombinaci s chemoterapií, podobně jako je tomu u maligních B lymfomů. Kombinovaná chemoterapie s kortikoidy s rituximabem představuje jednu z účinných léčebných možností, jejíž úspěch je doložen četnými publikacemi [29,30,46 – 54].
Bortezomib
Úspěchy bortezomibu u mnohočetného myelomu vedly k testování bortezomibu u plazmocelulární varianty Castlemanovy nemoci. A podle 3 publikací, které popisují tuto léčbu, bylo podání bortezomibu spojeno s dosažením kompletní remise. Bortezomib je tedy po rituximabu druhým novým účinným lékem pro tyto nemocné [37,55 – 57].
Thalidomid
U plazmocelulární malignity, mnohočetného myelomu, se v posledních 10 letech dostal do rutinní terapie thalidomid. Jeho přidání k běžné chemoterapii zvýšilo u mnohočetného myelomu počet léčebných odpovědí. A je tedy pochopitelné, že thalidomid byl podáván i pacientům s plazmocelulární či smíšenou variantou Castlemanovy nemoci. V posledních letech se objevily četné publikace popisující dlouhodobé remise multicentrické formy Castlemanovy nemoci po léčbě založené na thalidomidu. Thalidomid moduluje tvorbu cytokinů, což je pro jeho léčebný účinek u této nemoci jedním z velmi zásadních účinků. Kombinovanou léčbu s thalidomidem jsme před časem podali s úspěchem jinému našemu pacientovi. Vzhledem k tomu, že v našem předchozím případně nepřinesla kombinovaná léčba R – CHOP léčebný efekt, zatímco léčba obsahující thalidomid vedla k okamžité odpovědi, zvolili jsme v tomto dalším případě iniciální léčbu thalidomidem.
Thalidomid snižuje produkci interleukinu 6 a má rovněž antiangiogenní vlastnosti. Výhoda podávání thalidomidu spočívá v dobrém bezpečnostním profilu léku, absenci významné myelotoxicity, a to i při několikaletém multicentpodávání, jak dokládá případ pacienta s Crohnovou chorobou, který toleroval tento lék po dobu 5 let při zachování dobré terapeutické účinnosti [58]. Limitující však může být rozvoj periferní neuropatie. Vynikající účinky thalidomidu jsou doloženy několika kazuistikami. U jedné pacientky došlo ke kompletní remisi cytopenie, ascitu a perikardiálního výpotku po dobu 40 měsíců na monoterapii thalidomidem, přetrvávala pouze lymfadenopatie (iniciální dávka 300 mg byla redukována na 200 mg pro rozvoj mírné periferní neuropatie). Po tuto dobu byla pacientka asymptomatická, začala opět pracovat, aniž by ji neuropatie limitovala [59,60]. Zlepšení klinického i laboratorního stavu s regresí lymfadenomegalie a hepatosplenomegalie došlo dále u pacientky s POEMS syndromem (polyneuropatie, organomegalie, endokrinopatie, monoklonální gamapatie, kožní změny) asociovaným s hyalinně-vaskulární formou multicentrické Castlemanovy choroby, u které byla popsána 20měsíční léčba 200 mg thalidomidu denně doplněná v prvních 8 měsících o dexametazon [61]. Podobně zareagoval na kombinační podání bortezomibu s thalidomidem (100 mg denně, celkem 24 týdnů) muž, u něhož byl POEMS syndrom sdružen se smíšenou variantou multicentrické Castlemanovy choroby. Důležité bylo zjištění, že 2 roky po ukončení léčby zůstává stav pacienta stabilní [62].
Thalidomidem bylo dosaženo remise nefrotického syndromu v jednom případě multicentrické Castlemanovy choroby [63] a úspěch byl zaznamenán i u pacientky s multicentrickou Castlemanovou chorobou asociovanou s paraneoplastickým pemfigem [64]. Přesvědčivé výsledky byly dále doloženy u 3 pacientek s multicentrickou Castlemanovou chorobou asociovanou s difuzními hyperpigmentovanými kožními plaky. Léčba u první ženy sestávala z kombinace prednisonu a thalidomidu (150 mg denně, později udržovací dávka 50 mg), druhá pacientka užívala thalidomid ve stejném dávkování bez konkomitantní kortikoterapie a třetí ženě byla zpočátku podána indukční fáze s kortikoidy a cyklofosfamidem a následně se snížením dávek prednisonu se léčba rozšířila o thalidomid opět ve výše zmíněném dávkovacím režimu [65].
Efekt thalidomidu byl zdokumentován také u HIV pozitivních pacientů. Stary et al dosáhli kombinovaným režimem s thalidomidem (200 mg denně, později přechod na 100 mg) a rituximabem kompletní klinické a radiologické remise plazmocelulární multicentrické Castlemanovy choroby u HIV a HHV – 8 pozitivního muže [66]. U jednoho HIV a HHV – 8 pozitivního muže s Kaposiho sarkomem došlo ke zlepšení celkového stavu, zvýšení počtu destiček a negativnímu restagingovému vyšetření z kostní dřeně po 38 týdnech léčby s 200 mg thalidomidu denně, která byla na začátku doplněna o etoposid [67]. V dosud největší retrospektivní analýze 11 dominantně HIV a HHV - 8 pozitivních pacientů s multicentrickou Castlemanovou chorobou bylo dosaženo kombinací rituximabu s thalidomidem (100 mg denně) 91 % kompletních remisí s 2letou dobou bez progrese choroby u 60 % sledovaných [68].
Protilátka proti interleukinu 6, tocilizumab
U pacientů s multicentrickou formou Castlemanovy choroby byla prokázána zvýšená hladina interleukinu 6. Toto zjištění vedlo k testování blokády účinku interleukinu 6. Pro tento účel byla použita monoklonální protilátka proti receptoru pro interleukin 6, zvané tocilizumab.
A jak je zřetelné z citovaných publikací, tocilizumab aplikovaný pacientům v Castlemanovou chorobou vedl k remisi nemoci [69 – 75].
Naše zkušenosti s léčbou multicentrické Castlemanovy choroby
Na našem pracovišti jsme v posledních 2 letech léčili 2 pacienty s multicentpodávání rickou formou Castlemanovy nemoci. První pacient měl mimo klasických příznaků také vaskulitidu a zřejmě s ní související ischemickou cévní mozkovou příhodu. Léčbou prvé volby byla u tohoto pacienta chemoterapie R – CHOP, tedy rituximab, a dále kombinace cytostatik, cyklofosfamidu, adriamycinu, vinkristinu a prednisonu. Tato léčba však nevedla k ústupu aktivity nemoci, ačkoliv v literatuře se nacházejí pozitivní zprávy o léčbě rituximabem v kombinaci s chemoterapií. Jako léčbu druhé volby dostal tento pacient kombinaci thalidomidu s cyklofosfamidem a dexametazonem. Tato léčba vedla k remisi nemoci. Po přerušení léčby však došlo k recidivě nemoci. Tato byla zvládnuta lenalidomidem. Tč. je tento pacient 10 měsíců od ukončení lenalidomidu v kompletní remisi. Podrobně je tato zkušenost popsána v samostatné publikaci [44].
Běžné je, že každý člověk vychází při své práci ze zkušeností, které v průběhu života získá. A tak když jsme měli zahájit léčbu druhého pacienta s multicentrickou Castlemanovou chorobou, tak jsme stáli před volbou: podat rituximab v kombinaci s chemoterapií (např. schéma R – CHOP), nebo podat chemoterapii založenou na thalidomidu, tedy např. kombinaci cyklofosfamidu thalidomidu a dexametazonu.
Na základě předchozí naší zkušenosti [44] a publikovaných pozitivních výsledků s léčbou thalidomidem jsme zvolili thalidomid pro iniciální léčbu.
A protože každý lékař musí pečlivě vyhodnocovat přínos a nežádoucí účinky léčby, kterou podá, a pokračovat pouze tehdy, pokud přínos převažuje nad nežádoucími účinky, provedli jsme po 2 cyklech této léčby vyhodnocení efektu.
Výsledek byl velmi překvapující. Po 2 cyklech došlo k výraznému vzestupu hemoglobinu téměř na normální hodnoty, k poklesu hodnoty celkové bílkoviny na normální hodnoty, poklesu koncentrace původně zvýšených polyklonálních imunoglobulinů typu IgG. Dále podle CT i PET-CT vyšetření došlo k normalizaci akumulace fl uorodeoxyglukózy a ke zmenšení lymfadenopatie.
Léčba kombinací thalidomid, cyklofosfamid a dexametazon vedla i u našeho druhého pacienta s multicentrickou Castlemanovou chorobou k rychlé léčebné odpovědi.
Obecný problém špatné dostupnosti léků pro raritní choroby
V době, kdy jsem po ukončení studia nastoupil jako lékař na interní oddělení, jsme měli k dispozici určité limitované množství léků, které jsme používali podle svého nejlepšího vědomí a svědomí. Použití léku jsme zvažovali pouze na základě znalosti nemoci a znalosti léku a jeho vlastností a vše kontrolovalo bdělé oko našeho primáře. V té době nebylo použití léku omezováno dalšími nařízeními, která by limitovala použití léku jen pro určitou chorobu či stadium choroby. V dnešní době je použití léků obestaveno kvantem administrativních předpisů, použití existujících léků často limitováno pro určité choroby, pro něž byla indikace ověřena klinickými studiemi a pacienti s vzácnými chorobami jsou diskriminováni, protože se běžně neprovádí ověření účinnosti nových léků u vzácných chorob, takže registrace pro vzácné choroby u nových léků obecně chybí. Takže léčba těchto nemocných odvisí od toho, zda revizní lékaři povolí či nepovolí použít nový účinný lék pro nemocné se vzácnými chorobami, k nimž Castlemanova choroba bezesporu patří. Podrobně tento problém popisuje Klener [76].
Závěry pro praxi
- Multicentrická Castlemanova choroba vyžaduje účinnou medikamentózní léčbu.
- Z dostupných léčebných postupů senabízí léčba monoklonální protilátkou antiCD20 neboli rituximabemv kombinaci s chemoterapií, nebo aplikace thalidomidu v kombinaci s dalšími léky, případně léčba monoklonální protilátkou proti receptoru interleukinu 6 (tocilizumab).
- Z hlediska nákladů souvisejících s léčbou je zřejmě nejvýhodnější léčba thalidomidem, cyklofosfamidem a dexametazonem.
Tato práce byla podpořena granty IGA Ministerstva zdravotnictví NT12215, NT12130 a NT13190, ale také MUNI/ A/ 0723/ 2012 i „Institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR Masarykovu onkologickému ústavu“.
prof. MUDr. Zdeněk Adam, CSc.
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 31. 10. 2012
Přijato po recenzi: 6. 2. 2013
Zdroje
1. Cronin DM, Warnke RA. Castleman disease: an update on classification and the spectrum of associated lesions. Adv Anat Pathol 2009; 16 : 236 – 246.
2. Szturz P, Moulis M, Adam Z et al. Castlemanova choroba. Klin Onkol 2011; 24 : 424 – 434.
3. Vodička J, Špidlen V, Mukenšnabl P et al. Vzácnější tumory pleurální dutiny. Rozhl Chir 2003; 82 : 88 – 94.
4. Chvojka J. Angiografi cký obraz retroperitoneální formy Castlemanovy nemoci. Česk Radiol 1984; 38 : 55 – 60.
5. Mildeová E, Lichtenberg J, Melínová L et al. Angiofollicularní hyperplasie lymfatických uzlin. Lek 1979; 81 : 82 – 86.
6. Mildeová E, Lichtenberg J. Angiofollicularní hyperplasie lymfatických uzlin. Česk Patol 1978; 14 : 160 – 165.
7. Majerčáková D. Castlemanova choroba. Vnitř Lék 2012; 58 : 216 – 220.
8. Castleman B, Iverson L, Menendez VP. Localized mediastinal lymphnode hyperplasia resembling thymoma. Cancer 1956; 9 : 822 – 830.
9. Keller AR, Hochholzer L, Castleman B. Hyaline-Vascular and plasmacell types of giant lymph node hyperplasia of the mediastinum and other locations. Cancer 1972; 29 : 670 – 683.
10. Phatak PD, Janas JS, Sham RL. Disorders that resemble lymphoma. Amer J Hematol 1997; 68 : 63 – 68.
11. Schwartz A, Eid A, Sasson T et al. Pelvic giant lymph node hyperplasia (Castleman’s disease): A surgical and radiological approach. Eur J Surg 1996; 162 : 993 – 996.
12. Chronowski GM, Ha CS, Wilder RB et al. Treatment of unicentric and multicentric Castleman disease and the role of radiotherapy. Cancer 2001; 92 : 670 – 676.
13. Wolf M, Van Offel JF, Van de Velde A et al. Multicentric plasmacell variant Castleman‘s disease presenting with cutaneous vasculitis and pulmonary parenchymal involvement in a patient with ankylosing spondylitis: case report and review of the literature. Acta Clin Belg 2011; 66 : 305 – 310.
14. Herrada J, Cabanillas F, Rice L et al. The clinical behavior of localized and multicentric Castleman disease. Ann Intern Med 1998; 128 : 657 – 662.
15. Dispenzieri A, Gertz MA. Treatment of Castleman‘ s disease. Curr Treat Options Oncol 2005; 6 : 255 – 266.
16. Roca B. Castleman‘s Disease. A Review. AIDS Rev 2009; 11 : 3 – 7.
17. Krivanová A, Adam Z, Mayer J et al. Horečka nejasného původu (Fever of unknown origin), etiologie a diagnostický algoritmus. Vnitř Lék 2007; 53 : 169 – 178
18. Knockaert DC, Vanderschueren S, Blockmans D. Fever of unknown origin inadults: 40 years on. J Intern Med 2003; 253 : 263 – 275.
19. Hayakawa K, Ramasamy B, Chandrasekar PH. Fever of unknown origin: an evidence-based review. Am J Med Sci 2012; 344 : 307 – 316.
20. Chow A, Robinson JL. Fever of unknown origin in children: a systematic review. World J Pediatr 2011; 7 : 5 – 10.
21. Williams J, Bellamy R. Fever of unknown origin. Clin Med. 2008; 8 : 526 – 530.
22. Dong MJ, Zhao K, Liu ZF et al. A meta-analysis of the value of fl uorodeoxyglucose-PET/ PET-CT in the evaluation of fever of unknown origin. Eur J Radiol 2011; 80 : 834 – 844.
23. Gratz S, Kemke B, Kaiser W et al. Diagnosis of fever of unknown origin (FUO). Positron emission tomography/ computed tomograph (PET-CT)]. Dtsch Med Wochenschr 2009; 134 2120 – 2124.
24. Blockmans D, Knockaert D, Maes A et al.. Clinical value of [(18)F]fluoro-deoxyglucose positron emission tomography for patients with fever of unknown origin. Clin Infect Dis 2000; 32 : 191 – 196.
25. Barker R, Kazmi F, Bower M. Imaging in multicentric Castleman‘s disease. J HIV Ther 2008; 13 : 72 – 74.
26. Ramos CD, Massumoto CM, Rosa MF et al. Focal bone marrow involvement in multicentric castleman disease demonstrated by FDG PET/ CT. Clin Nucl Med 2007; 32 : 295 – 296.
27. Miltenyi Z, Toth J, Gonda A et al. Successful immunomodulatory therapy in castleman disease with paraneoplastic pemphigus vulgaris. Pathol Oncol Res 2009; 15 : 375 – 381.
28. Akosman C, Selcuk NA, Ordu C et al. Unicentric mixed variant Castleman disease associated with Hashimoto disease: the role of PET/ CT in staging and evaluating response to the treatment. Cancer Imaging 2011; 11 : 52–55.
29. Gérard L, Michot JM, Burcheri S et al. Rituximab decreases the risk of lymphoma in patients with HIV-associated multicentric Castleman disease. Blood 2012; 119 : 2228 – 2233. 30. Hoffmann C, Schmid H, Müller M et al. Improved outcome with rituximab in patients with HIV-associated multicentric Castleman disease. Blood 2011; 118 : 3499 – 3503.
31. Ye B, Gao SG, Li W et al. Retrospective study of unicentric and multicentric Castleman‘s disease: a report of 52 patients. Med Oncol 2010; 27 : 1171 – 1178.
32. Dong Y, Na J, Lv J et al. Clinical and laboratory characterization of a large cohort of patients with Castleman disease retrospectively collected from a single center. Leuk Lymphoma 2009; 50 : 1308 – 1317.
33. Han B, Yang Z, Yang T et al. Diagnostic splenectomy in patients with fever of unknown origin and splenomegaly. Acta Haematol 2008; 119 : 83 – 88.
34. Curciarello J, Castellletto R, Barbero R et al. Hepatis sinusoidal dilatation associated to giant lymph node hyperplasia (Castleman’s). J Clin Gastroenterol 1998; 27 : 76 – 78.
35. Dispenzieri A. POEMS syndrome: 2011 update on diagnosis, risk-stratifi cation, and management. Am J Hematol 2011; 86 : 591 – 601.
36. Ruwan KP, Parakramawansha C, Wijeweera I et al. A case of POEMS syndrome with mixed hyaline vascular and plasmacell type Castleman‘ s disease. Ceylon Med J 2009; 54 : 68 – 69.
37. Sobas MA, Alonso Vence N, Diaz Arias J et al. Efficacy of bortezomib in refractory form of multicentric Castleman disease associated to OEMS syndrome (MCD - POEMS variant). Ann Hematol 2010; 89 : 217 – 219.
38. Misri R, Kharkar V, Dandale A et al. Multiple capillary hemangiomas: a distinctive lesion of multicentric Castleman‘s disease and POEMS syndrome. Indian J Dermatol Venereol Leprol 2008; 74 : 364 – 366.
39. Dispenzieri A. Castleman disease. Cancer Treat Res 2008; 142 : 293 – 330. 40. Garcia T, Dafer R, Hocker S et al Recurrent strokes in two patients with POEMS syndrome and Castleman‘s disease. J Stroke Cerebrovasc Dis 2007; 16 : 278 – 284.
41. Owens CL, Weir EG, Ali SZ. Cytopathologic findings in “POEMS” syndrome associated with Castleman disease. Diagn Cytopathol 2007; 35 : 512 – 515.
42. Eisenbarth SC, Colegio OR, Iyer A et al. Images in neuro-oncology: a case of POEMS (Polyneuropathy, Organomegaly, Endocrinopathy, Monoclonal protein and Skin changes) in a patient with multicentric Castleman‘s disease. J Neurooncol 2007; 81 : 163 – 165.
43. Huang J, Wang L, Zhou W et al. Hyaline vascular Castleman disease associated with POEMS syndrome and cerebral infarction. Ann Hematol 2007; 86 : 59 – 61.
44. Szturz P, Adam Z, Moulis M et al. Naše zkušenosti s léčbou multicentrické Castlemanovy choroby s projevy vaskulitidy, popis případu a přehled literatury. Vnitř Lék 2012; 58 : 679 – 691.
45. Mylona EE, Baraboutis IG, Lekakis LJ et al. Mutlicentric castleman diseas in HIV infections A systematic review of the literature. AIDS Rev 2008; 10 : 25 – 35.
46. Peker D, Martinez AE, Schwartz MA et al Complete remission in 4 patients with human herpesvirus 8-associated multicentric Castleman disease using rituximab and liposomal doxorubicin, a novel chemotherapy combination. Clin Adv Hematol Oncol 2012; 10 : 204 – 206.
47. Baek HJ, Kook H, Han DK et al. Unicentric Castleman disease relapsed after rituximab - CHOP chemotherapy or radiation therapy in an adolescent. J Pediatr Hematol Oncol 2012; 34: e206 – e208.
48. Reid E, Nooka A, Blackmon J et al. Clinical use of rituximab in patients with HIV related lymphoma and Multicentric Castleman‘s disease. Curr Drug Deliv 2012; 9 : 41 – 51.
49. Ibrahim K, Maghfoor I, Elghazaly A et al. Successful treatment of steroid–refractory autoimmune thrombocytopenia associated with Castleman disease with anti-CD–20 antibody
(rituximab). Hematol Oncol Stem Cell Ther 2011; 4 : 100 – 102.
50. Lee JP, Kim DK, Oh DY et al. Successfully treated multicentric Castleman‘s disease with renal thrombotic microangiopathy using rituximab and corticosteroid. Clin Nephrol 2011; 75 : 165 – 170.
51. Bandera B, Ainsworth C, Shikle J et al. Treatment of unicentric Castleman disease with neoadjuvant rituximab. Chest 2010; 138 : 1239 – 1241.
52. Mian H, Leber B. Mixed variant multicentric Castleman disease treated with rituximab: case report. J Pediatr Hematol Oncol 2010; 32 : 622.
53. Bestawros A, Michel R, Séguin C et al Multicentric Castleman‘s disease treated with combination chemotherapy and rituximab in four HIV - positive men: a case series. Am J Hematol 2008; 83 : 508 – 511.
54. Casquero A, Barroso A, Fernández Guerrero ML et al Use of rituximab as a salvage therapy for HIV-associated multicentric Castleman disease. Ann Hematol 2006; 85 : 185 – 187.
55. Sbenghe MM, Besa E, Mahipal A et al. HHV - 8-associated multicentric Castleman‘s disease in HIV - negative patient: a novel therapy for an orphan disease. Oncologist 2012; 17 : 145 – 146.
56. Yuan ZG, Dun XY, Li YH et al. Treatment of multicentric Castleman‘s Disease accompanying multiple myeloma with bortezomib: a case report. J Hematol Oncol 2009; 2 : 19.
57. Hess G, Wagner V, Kreft A et al. Effects of bortezomib on proinfl amatory cytokine levels and transfusion dependency in patient with multicentric Castleman disease. Brit J Haematol 2006; 134 : 602 – 605.
58. Fishman SJ, Feins NR, D’Amato RJ et al. Long-term remission of Crohn’s disease treated with thalidomide: a seminal case report. Angiogenesis 1999; 3 : 201 – 204.
59. Lee FC, Merchant SH. Alleviation of systemic manifestations of multicentric Castleman‘s disease by thalidomide. Am J Hematol 2003; 73 : 48 – 53.
60. Starkey CR, Joste NE, Lee FC. Near – total resolution of multicentric Castleman disease by prolonged treatment with thalidomide. Am J Hematol 2006; 81 : 303 – 304.
61. Kim SY, Lee SA, Ryoo HM et al. Thalidomide for POEMS syndrome. Ann Hematol 2006; 85 : 545 – 546.
62. Wang X, Ye S, Xiong C et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman‘s disease. Jpn J Clin Oncol 2011; 41 : 1221 – 1214.
63. Menegato MA, Canelles MF, Tonutti E et al. Remission of nephrotic syndrome after thalidomide therapy in a patient with Castleman‘s disease. Clin Nephrol. 2004; 61 : 352 – 356.
64. Miltenyi Z, Toth J, Gonda A et al. Successful immunomodulatory therapy in Castleman disease with paraneoplastic pemphigus vulgaris. Pathol Oncol Res 2009; 15 : 375 – 381.
65. Zhao X, Shi R, Jin X et al. Diffuse hyperpigmented plaques as cutaneous manifestation of multicentric Castleman disease and treatment with thalidomide: report of three cases. J Am Acad Dermatol. 2011; 65 : 430 – 432.
66. Stary G, Kohrgruber N, Herneth AM et al. Complete regression of HIV-associated multicentric Castleman disease treated with rituximab and thalidomide. AIDS 2008; 22 : 1232 – 1234.
67. Jung CP, Emmerich B, Goebel FD et al. Successful treatment of a patient with HIV-associated multicentric Castleman disease (MCD) with thalidomide. Am J Hematol 2004; 75 : 176 – 177.
68. Ramasamy K, Gandhi S, Tenant – Flowers M et al Rituximab and thalidomide combination therapy for Castleman disease. Br J Haematol 2012; 158 : 421 – 423.
69. Schumacher A, Jacomella V, Stüssi G et al. Castleman‘s disease and arterial thrombosis: reresult of excessively elevated interleukin-6 plasma level? Vasa 2012; 41 : 145 – 148.
70. Galeotti C, Boucheron A, Guillaume S et al. Sustained remission of multicentric Castleman disease in children treated with tocilizumab, an anti-interleukin-6 receptor antibody. Mol Cancer Ther 2012; 11 : 1623 – 1626.
71. Yuzuriha A, Saitoh T, Koiso H et al. Successful treatment of autoimmune hemolytic anemia associated with multicentric Castleman disease by anti-interleukin-6 receptor antibody (tocilizumab) therapy. Acta Haematol 2011; 126 : 147 – 150.
72. Higuchi T, Nakanishi T, Takada K et al. A case of multicentric Castleman‘s disease having lung lesion successfully treated with humanized anti-interleukin-6 receptor antibody, tocilizumab. J Korean Med Sci 2010; 25 : 1364 – 1367.
73. Arita Y, Sakata Y, Sudo T et al. The efficacy of tocilizumab in a patient with pulmonary arterial hypertension associated with Castleman‘ s disease. Heart Vessels 2010; 25 : 444 – 447.
74. Song SN, Tomosugi N, Kawabata H et al. Down – regulation of hepcidin resulting from long-term treatment with an anti-IL-6 receptor antibody (tocilizumab) improves anemia of inflammation in multicentric Castleman disease. Blood 2010; 116 : 3627 – 3634.
75. Nishimoto N, Terao K, Mima T et al. Mechanisms and pathologic signifi cances in increase in serum interleukin-6 (IL-6) and soluble IL-6 result ceptor after administration of an anti-IL-6 receptor after administration of an anti-IL-6 receptor antibody, tocilizumab, in patients with rheumatoid arthritis and Castleman disease. Blood 2008; 112 : 3959 – 3964.
76. Klener P. Orphan drugs a jejich využití v onkologii. Farmakoterapie 2012; 3 : 361 – 364.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Krátká baterie pro testování fyzické zdatnosti seniorů – editorial
- Dálková monitorace implantabilních přístrojů v kardiologii – editorial
- Aortální stenóza – editorial
- Aortální stenóza – editorial
- Změny hmotnosti a kompenzace diabetu (HbA1c) u nemocných s diabetes mellitus 2. typu po přidání exenatidu (Byetta) ke stávající léčbě ve 28 diabetologických ambulancích v ČR – studie BIBY‑II (sledování 24 měsíců)
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Kteří příbuzní prvního stupně nemocných s kolorektálními neoplaziemi jsou nejvíce ohroženi
- Přínos systému vzdáleného sledování v dlouhodobé péči o pacienty s implantabilními kardiovertery‑ defibrilátory
- Aortální stenóza
- Tuberkulóza v České republice. Současný stav. Diagnóza, léčba, prevence
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
- Oxidační stres u pacientů po transplantaci ledviny
- PET-CT dokumentovaný rychlý nástup léčebné odpovědi cyklofosfamidu, thalidomidu a dexametazonu u multicentrické formy Castlemanovy nemoci. Popis případu a přehled informací o léčbě
- Kazuistika získané hemofilie A
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- Využití vildagliptinu z pohledu interního lékaře
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Aortální stenóza
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



