-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chronická obstrukční plicní nemoc pohledem nových doporučení – souhrn aktuálního fenotypově zaměřeného standardu České pneumologické a ftizeologické společnosti pro internisty
Chronic obstructive pulmonary disease in the light of new guidelines – brief summary of phenotypically oriented guidelines for non‑pulmonary physicans
Introduction:
COPD is a global health and social problem. Morbidity and mortality increases in the Czech Republic. There are currently several global statements and strategies.Methods:
The Czech Pneumological and Phthisiological Society (CPFS) at the end of 2011 mandated the Section of bronchial obstruction in drafting national guidelines concerning the stable COPD. Subsequently, this document was discussed during the National Consensus Conference (COPD forum) in November 2012 and presented at series of local workshops and national conferences. National guidelines has been subject to a review and eventually posted on the website for another round of comments.Diagnosis:
A modern approach to COPD is a view of the patient through the pulmonary function, symptoms, exacerbation rates and the presence of specific phenotypes. CPFS identified six clinically relevant phenotypes: frequent exacerbators, COPD and asthma overlap, COPD and bronchiectasis overlap, emphysematic phenotype, bronchitic phenotype and phenotype of pulmonary cachexia.Treatement:
Treatment recommendations can be divided into four elementary steps: the first step is the Elimination of all risks factors. The second one is the Standard therapy including in particular inhaled bronchodilators, pulmonary rehabilitation, and treatment of severe comorbidities. The third step is the Targeted therapy centered on clinical phenotypes of COPD. The final fourth step is the treatment of respiratory insufficiency and palliative care of the terminal COPD.Conclusion:
The optimal treatment of COPD requires a personalized approach to the patient.Key words:
COPD phenotypes – personalized medicine – national guidelines
Autori: V. Koblížek 1; J. Chlumský 2; V. Zindr 3; K. Neumannová 4,5; J. Zatloukal 4; V. Sedlák 1; J. Kociánová 6; J. Zatloukal 7; B. Novotná 1
Pôsobisko autorov: Plicní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta doc. MU Dr. František Salajka, CSc. 2 Pneumologická klinika 1. lékařské fakulty UK a Thomayerovy nemocnice Praha, přednosta prof. MU Dr. Jiří Homolka, DrSc. 3 Plicní ordinace Karlovy Vary4 1
Vyšlo v časopise: Vnitř Lék 2013; 59(6): 505-514
Kategória: Doporučené postupy
Súhrn
Úvod:
CHOPN představuje celosvětový zdravotně‑sociální problém. Morbidita a mortalita roste i v České republice. V současnosti existuje několik mezinárodních návodů a strategií.Metodika:
Česká pneumologická a ftizeologická společnost (ČPFS) na konci roku 2011 pověřila Sekci bronchiálních obstrukcí vypracováním návrhu národních doporučení týkajících se stabilní fáze CHOPN. Následně vznikl dokument diskutovaný během Národní konsenzuální konference (CHOPN fórum) v listopadu roku 2012 a prezentovaný na sérii lokálních seminářů a celostátních konferencí. Poté bylo doporučení podrobeno recenznímu řízení a nakonec vyvěšeno na webové stránky k dalšímu kolu připomínek.Diagnóza:
Základem moderního přístupu k CHOPN je pohled na pacienta přes plicní funkce, symptomy, výskyt exacerbací a přítomnost fenotypů. ČPFS konsenzuálně identifikovala 6 klinicky relevantních fenotypů: frekventní exacerbátor, CHOPN + AB overlap, CHOPN + bronchiektázie overlap, emfyzematický a bronchitický fenotyp a fenotyp plicní kachexie.Léčba:
Léčebná doporučení byla rozdělena do 4 základních kroků. Prvním krokem je eliminace všech inhalačních rizik. Standardní terapie, zahrnující zejména inhalační bronchodilatancia, pulmonální rehabilitaci a léčbu závažných komorbidit, je krokem číslo dva. Třetí krok představuje cílená fenotypická léčba zaměřená na specifické typy postižení. Jako poslední, čtvrtý krok byla určena terapie respirační nedostatečnosti a péče o terminální CHOPN.Závěr:
Optimální terapie CHOPN vyžaduje snahu o personalizovaný přístup k nemocným.Klíčová slova:
fenotypy CHOPN – personalizovaná medicína – národní doporučeníÚvod
Chronická obstrukční plicní nemoc (CHOPN) postihuje nejméně 5 % populace Evropské unie [1 – 3]. České odhady prevalence z konce minulého století (1996) hovoří o přibližně 7 % nemocných [4]. Přesnější data ze současnosti ukazují 16 000 v ČR hospitalizovaných osob a přibližně 2 500 zemřelých z důvodu CHOPN [5,6]. Z výše uvedeného je zřejmé, že i v České republice představuje CHOPN reálný a závažný problém. Aktuálně existuje několik zahraničních léčebných návodů a doporučení. Tyto dokumenty však zcela neodpovídají požadavkům a reálným možnostem českého zdravotního systému [7 – 11]. Díky aktivitě Sekce bronchiálních obstrukcí České pneumologické a ftizeologické společnosti (ČPFS) vznikl v roce 2012 koncept národního standardu péče o nemocné se stabilní fází CHOPN. V listopadu roku 2012 byl předložen odborné pneumologické veřejnosti na Konsenzuální konferenci a na desítkách regionálních seminářů. Na základě poznatků z těchto akcí byl koncept dotvořen a na počátku roku 2013 vyvěšen na webové stránky ČPFS k dalšímu kolu připomínek členů odborné společnosti. Nakonec byl celý národní dokument prezentován kolegům ze zahraničí a finálně upraven. Po zapracování všech připomínek byla v květnu roku 2013 vytvořena definitivní verze tohoto dokumentu, jehož hlavním rysem je důraz na cílenou individualizovanou péči adekvátní symptomům a fenotypu každého nemocného, přihlížející k závažným komorbiditám a k současně podávané medikaci [12].
Popis pojmu CHOPN
Chronická obstrukční plicní nemoc (CHOPN) je léčitelným, preventabilním a klinicky heterogenním syndromem s dominujícími plicními projevy a s různě vyjádřeným mimoplicním postižením. Plicní komponenta je spojena s ne zcela reverzibilní limitací průtoku vzduchu při výdechu. Limitace průtoku vzduchu je vyvolána zúžením průsvitu průdušek a průdušinek, vznikajícím postupně v důsledku chronického, primárně neinfekčního zánětu dýchacích cest a plicního parenchymu. Jedná se o vystupňovanou a prolongovanou zánětlivou reakci geneticky predisponovaného organizmu na dlouhodobou inhalační expozici škodlivým částicím a plynům. Mimoplicní postižení nacházíme zejména v kardiovaskulárním a muskuloskeletálním systému. CHOPN lze navíc považovat za prekancerózu [8].
Patofyziologie
Důsledkem CHOPN je celé spektrum morfologických změn dýchacích cest, plicního parenchymu a plicních cév. Nejdůležitější se zdá poškození alveolů a úbytek elastických vláken, zvyšující poddajnost plicní tkáně a snižující její elastický retrakční tlak. Elastické vlastnosti plic a hrudní stěny, odpor a případný kolaps periferních dýchacích cest určují nejen rychlost proudění vydechovaného vzduchu, ale i velikost důležitých plicních objemů. Pro nemocné s CHOPN je typická interindividuálně variabilní tendence k progresivnímu zhoršování především dynamických ventilačních parametrů a zvyšování plicní hyperinflace.
Rizikové faktory
Nejdůležitějším rizikovým faktorem (70 – 80 % onemocnění) zůstává kouření cigaret – kuřáci s CHOPN navíc mívají těžší symptomy, výraznější mortalitu a rychlejší pokles plicních funkcí v porovnání s CHOPN trpícími nekuřáky. Kromě aktivního kouření jsou rizikové: pasivní kouření, kouření marihuany, doutníků, dýmky, inhalace škodlivých exhalací a zplodin z dopravy či ze spalování fosilních paliv a biomasy, nízká porodní hmotnost, recidivující respirační infekce v dětském věku. Rozhodující je individuální interakce mezi genetickými + epigenetickými faktory a vlivy prostředí [13 – 15].
Klinický průběh a relevantní fenotypy
Nejčastějším klinickým projevem CHOPN je dušnost. Nejprve vzniká při velkém fyzickém zatížení, poté během běžných denních aktivit a nakonec v klidu [16,17]. Druhým projevem je únava a třetím kašel [18]. Kašel má u většiny nemocných produktivní charakter – hovoříme o tzv. bronchitickém fenotypu CHOPN [19]. Naopak nemocné s celoživotní nepřítomností chronické expektorace označujeme jako emfyzematiky – jedná se téměř výhradně o osoby s predominancí plicního emfyzému [20,21]. Někteří nemocní s CHOPN současně trpí bronchiektáziemi, hovoříme o fenotypu CHOPN s bronchiektaziemi [22,23]. Relativně stabilní průběh CHOPN bývá u menší části nemocných intermitentně přerušován atakami akutního zhoršování překračujícími obvyklou mezidenní symptomovou variabilitu, trvajícími 3 dny a vedoucími k nutnosti léčby antibiotiky a/ nebo systémovými kortikoidy – tzv. akutními exacerbacemi (AE). Pacienty s výskytem 2 epizod AE/ posledních 12 měsíců obvykle nazýváme frekventními exacerbátory [24 – 26]. Někteří nemocní s CHOPN mají v průběhu onemocnění značnou tendenci k poklesu tělesné hmotnosti (BMI < 21), zejména netukové tkáně (pokles fat free mass indexu – FFMI < 16 kg/ m2 u mužů,< 15 kg/ m2 u žen). U těchto subjektů (po vyloučení jiných příčin) hovoříme o přítomnosti fenotypu tzv. plicní kachexie [20,27]. Důležitým fenotypem je překryvný fenotyp CHOPN s bronchiálním astmatem charakterizovaný přítomností 2 hlavních či 1 hlavního a nejméně 2 vedlejších kritérií ukazujících na víceméně trvalou kombinaci rysů typických pro obě diagnózy [21,28,29]. Přehled všech 6 základních fenotypů CHOPN přináší obr. 1. Závažné formy CHOPN směřují, většinou po mnoha letech, k rozvoji chronické respirační nedostatečnosti spojené se vznikem plicní hypertenze vedoucí k přetížení a posléze selhání pravého srdce. S CHOPN se často vyskytují další choroby neboli komorbidity: plicní karcinom, embolizace do plicní cirkulace, pneumonie, ischemická choroba srdeční, kardiální selhávání, afektivní poruchy, osteoporóza, anémie a vředová choroba – obr. 2 [8,30 – 32]. Pro osoby s konečnou fází choroby užíváme pojem terminální CHOPN [33,34].
Obr. 1. Přehled základních klinických projevů šesti fenotypů chronické obstrukční plicní nemoci (podrobněji viz text a obr. 4). 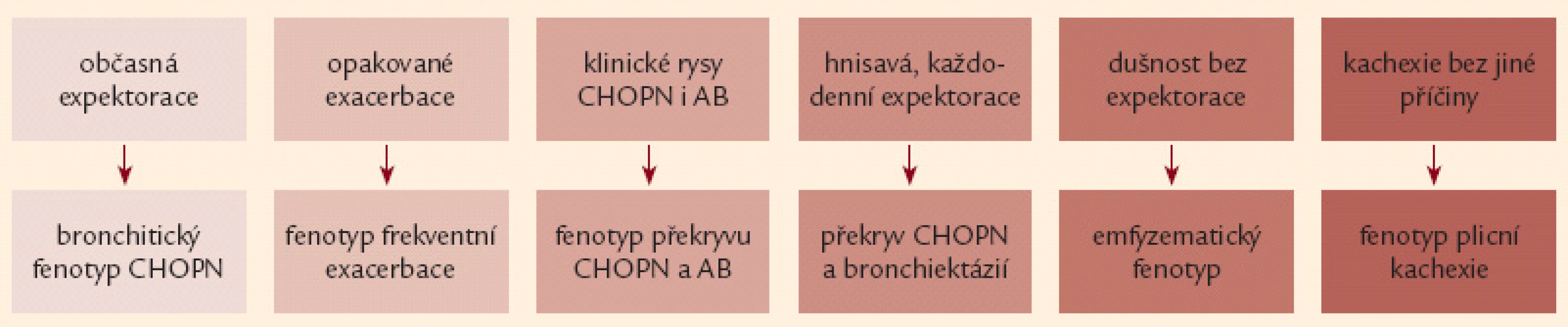
Obr. 2. Časté a klinicky významné komorbidity nemocných s chronickou obstrukční plicní nemocí. 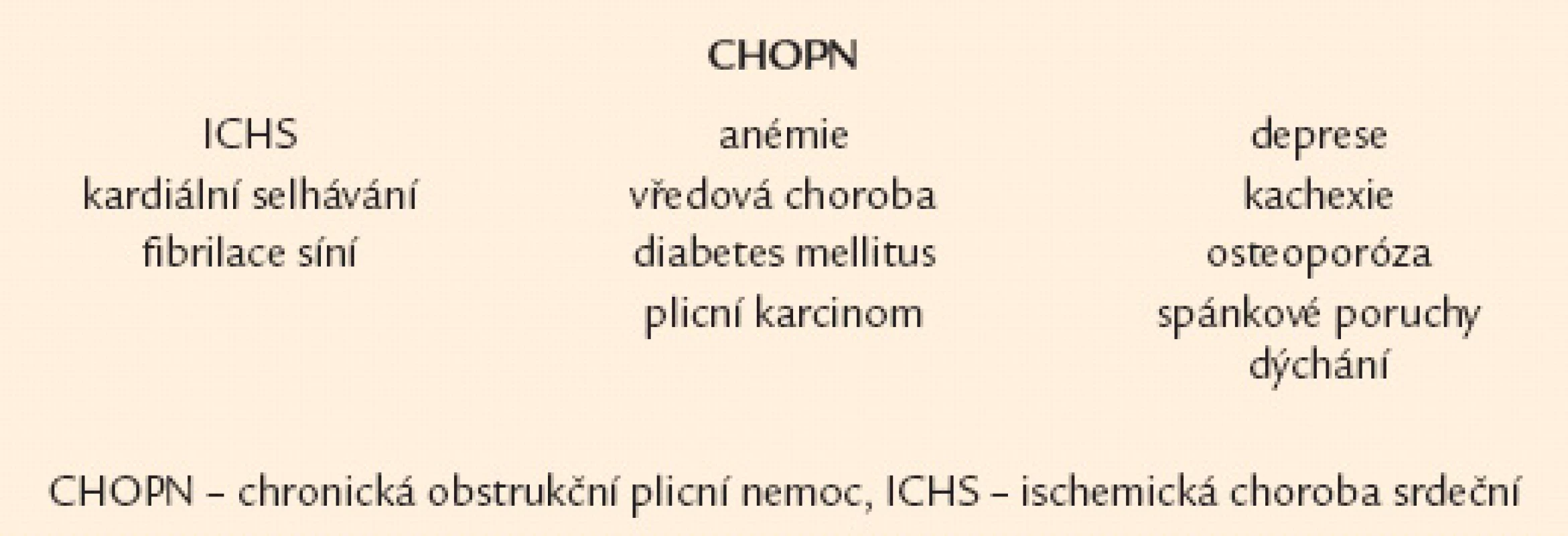
Diagnostika CHOPN
Základem moderního přístupu k CHOPN je pohled na pacienta pomocí sledování plicních funkcí, symptomů, výskytu akutních exacerbací a klinického fenotypu. Správnost diagnózy je třeba ověřit pomocí funkčního vyšetření plic, kdy je k průkazu přítomnosti bronchiální obstrukce nezbytné provést spirometrické vyšetření po podání inhalačních bronchodilatancií (salbutamol nebo ipratropium). Spirometrické vyšetření je doporučováno u všech symptomatických jedinců, zvláště u osob v dlouhodobém inhalačním riziku, případně subjektů s pozitivní rodinnou anamnézou [7]. Základním funkčním kritériem CHOPN je přítomnost limitace výdechového proudění vzduchu. Tato expirační limitace je definována doporučeními Evropské respirační společnosti jako FEV1/ VCmax pod dolní limit normálních hodnot (LLN) [14,35].
Klasifikace
Vzhledem ke komplexní povaze CHOPN je kromě zjištění hodnoty post‑BDT FEV1 doporučováno systematické sledování symptomů (pomocí škály CAT nebo dušnosti dle modifikovaného MRC skóre – tab. 1) a výskytu akutních exacerbací (AE) [36]. Pomocí těchto parametrů lze snadno každého nemocného zařadit do 1 ze 4 kategorií označených písmeny A, B, C a D – obr. 3. Kategorie A se vyskytuje zejména v počátečních fázích onemocnění a může být dobře sledována praktickými lékaři. Obzvláště velkou pozornost je třeba věnovat kategorii B – osoby s méně výrazným poklesem plicních funkční, avšak s výrazným mortalitním rizikem (hlavně díky kardiovaskulárním a maligním příčinám) – a zejména kategorii D. Subjekty z posledně jmenované kategorie CHOPN jsou extrémně ohroženy vysokou respirační a kardiovaskulární morbiditou a mortalitou, jejich sledování a terapie musí být po všech stránkách maximální. Pacienty v kategorii C můžeme zachytit zejména v běžné neselektované populaci, naopak mezi symptomatickými pacienty ve specializované péči pneumologa se s touto kategorií téměř nesetkáváme [37 – 39].
Tab. 1. Popis dušnosti dle mMRC (volně dle Fletchera 1952 a [11]). ![Popis dušnosti dle mMRC (volně dle Fletchera 1952 a [11]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cf90282f26fee81d53ea468cdb2a8d4d.png)
Obr. 3. Klasifikace CHOPN dle Doporučení ČPFS [8]. Kategorie CHOPN převzaty s korekcí* z aktuální verze GOLD (2013) [8] – při nesouladu kritérií na stejné ose (např. na ose y – při těžké obstrukci a nulových exacerbacích) vždy rozhoduje horší kritérium (tzn. v našem případě těžká bronchiální obstrukce). Specialista bude klasifi kace CHOPN používat v následujícím tvaru: tíže obstrukce dle post-BDT FEV<sub>1</sub> (1–4)/celková kategorie onemocnění (A–D). V praxi např. 2/D, resp. 4/D. post-BDT FEV<sub>1</sub> – hodnota usilovně vydechnutého objemu za 1. s po inhalaci bronchodilatačního léku (salbutamolu nebo ipratropia), CAT – test ohodnocení CHOPN, CHOPN – chronická obstrukční plicní nemoc, GOLD – Světová strategie diagnostiky, léčby a prevence CHOPN, mMRC – modifi kovaná škála dušnosti dle Medical Research Council ![Klasifikace CHOPN dle Doporučení ČPFS [8].
Kategorie CHOPN převzaty s korekcí* z aktuální verze GOLD (2013) [8] – při nesouladu kritérií na stejné ose (např. na ose y – při těžké obstrukci a nulových exacerbacích) vždy rozhoduje horší kritérium (tzn. v našem případě těžká bronchiální obstrukce). Specialista bude klasifi kace CHOPN používat v následujícím tvaru: tíže obstrukce dle post-BDT FEV<sub>1</sub> (1–4)/celková kategorie onemocnění (A–D). V praxi např. 2/D, resp. 4/D.
post-BDT FEV<sub>1</sub> – hodnota usilovně vydechnutého objemu za 1. s po inhalaci bronchodilatačního léku (salbutamolu nebo ipratropia), CAT – test ohodnocení CHOPN, CHOPN – chronická obstrukční plicní nemoc, GOLD – Světová strategie diagnostiky, léčby a prevence CHOPN, mMRC – modifi kovaná škála dušnosti dle Medical Research Council](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ba0c983b5807a433f300a6277b1a65bf.jpg)
Popis onemocnění
Iniciálně je doporučeno popsat každý konkrétní případ CHOPN jako stupeň bronchiální obstrukce (1. – 4. stupeň dle post‑BDT FEV1) a kategorii (A – D) onemocnění (obr. 3). Do jednotlivých kategorií by měli být nemocní zařazováni pouze ve stabilní fázi onemocnění. Syndrom CHOPN zahrnuje různé klinické formy neboli fenotypy [36]. Každý z fenotypů nabízí specifické léčebné možnosti. Kromě základní klasifikace CHOPN je proto vhodné, zejména pro osoby s kategoriemi B a D, pátrat po fenotypu konkrétního pacienta a po přítomnosti respirační insuficience, zjistit rizikové faktory a všechny relevantní komorbidity – obr. 2 a 4 [30]. Za terminálního lze považovat pacienta trpícího CHOPN ve chvíli, kdy do konce předpokládané délky jeho života zbývá 6 měsíců, a to za splnění dalších předpokladů: klidová dušnost špatně odpovídající na farmakoterapii vedoucí k dennímu režimu postel + křeslo, postupná klinická progrese onemocnění a přítomnost hypoxemie. Závěrečnou fázi terminálního CHOPN pak nazýváme end‑of‑life neboli poslední týdny, dny, hodiny života – obr. 5 [33,34].
Obr. 4. Kritéria pro detailní rozlišení mezi jednotlivými fenotypy chronické obstrukční plicní nemoci. 
Obr. 5. Schéma ukazující vztah respirační nedostatečnosti, terminální fáze chronické obstrukční nemoci a „end-stage“ CHOPN. Rychlost progrese je interindividuálně rozdílná. Někteří nemocní se nikdy nedostanou do terminální (resp. „end stage“ fáze CHOPN) – pacient A. Na druhou stranu existují pacienti s rychlým rozvojem terminálního onemocnění – pacient B. 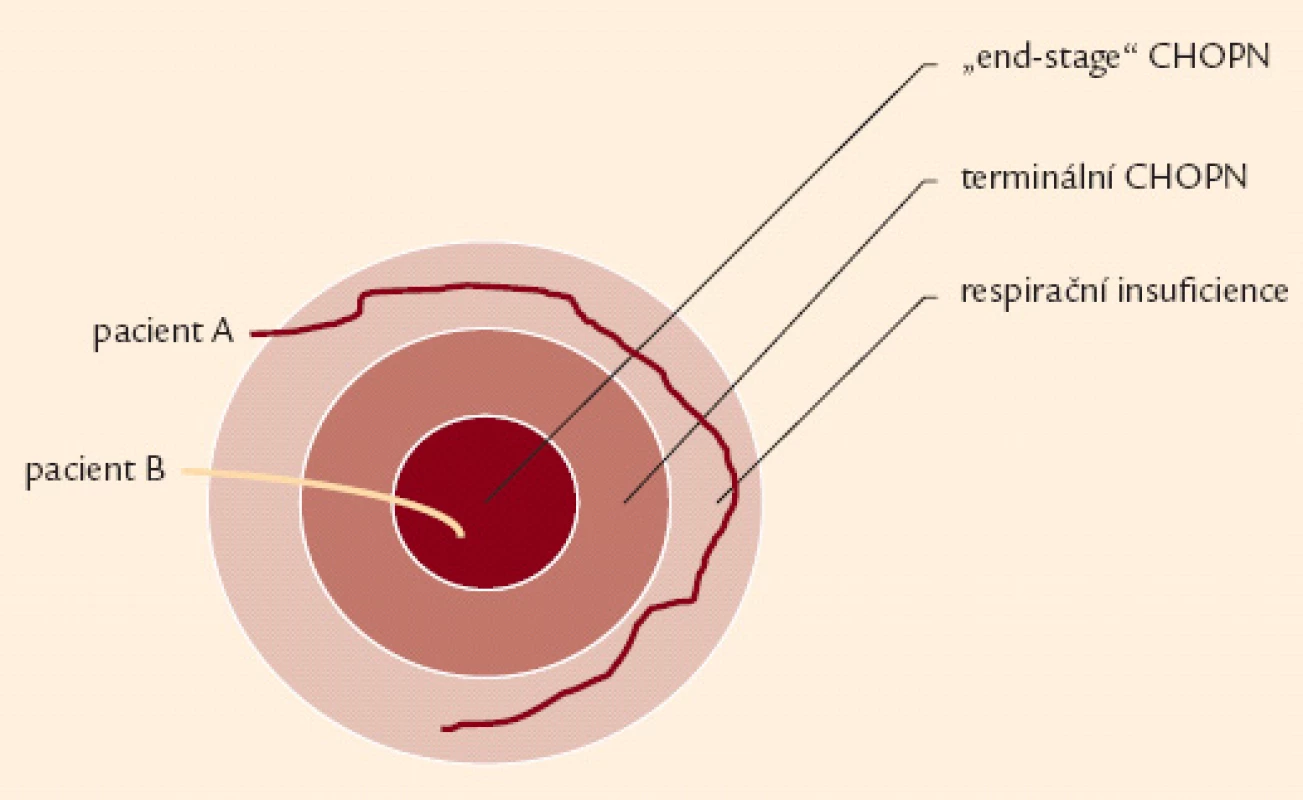
Strategie léčby CHOPN
Základem terapie a podmínkou jejího úspěchu je eliminace vyvolávajících inhalačních rizik. Komplexní léčebná intervence u nemocných s CHOPN využívá celé řady farmakologických a nefarmakologických postupů. Léčba nemocných s CHOPN se obecně řídí kategorií (A–D) a fenotypem (fenotypy) onemocnění s přihlédnutím k (ne)přítomnosti respirační nedostatečnosti. Léčebná doporučení lze rozdělit do 4 kroků (obr. 6).
Obr. 6. Čtyřstupňové schéma terapie CHOPN – základní verze. Poznámka: 1. krok a 2. krok je určen všem nemocným se symptomy, může je indikovat i praktický lékař. Naopak 3. a 4. krok jsou vázány na detailní znalosti laboratorních, funkčních a zobrazovacích vyšetření plic a měly by být v rukou specialistů (pneumologů). 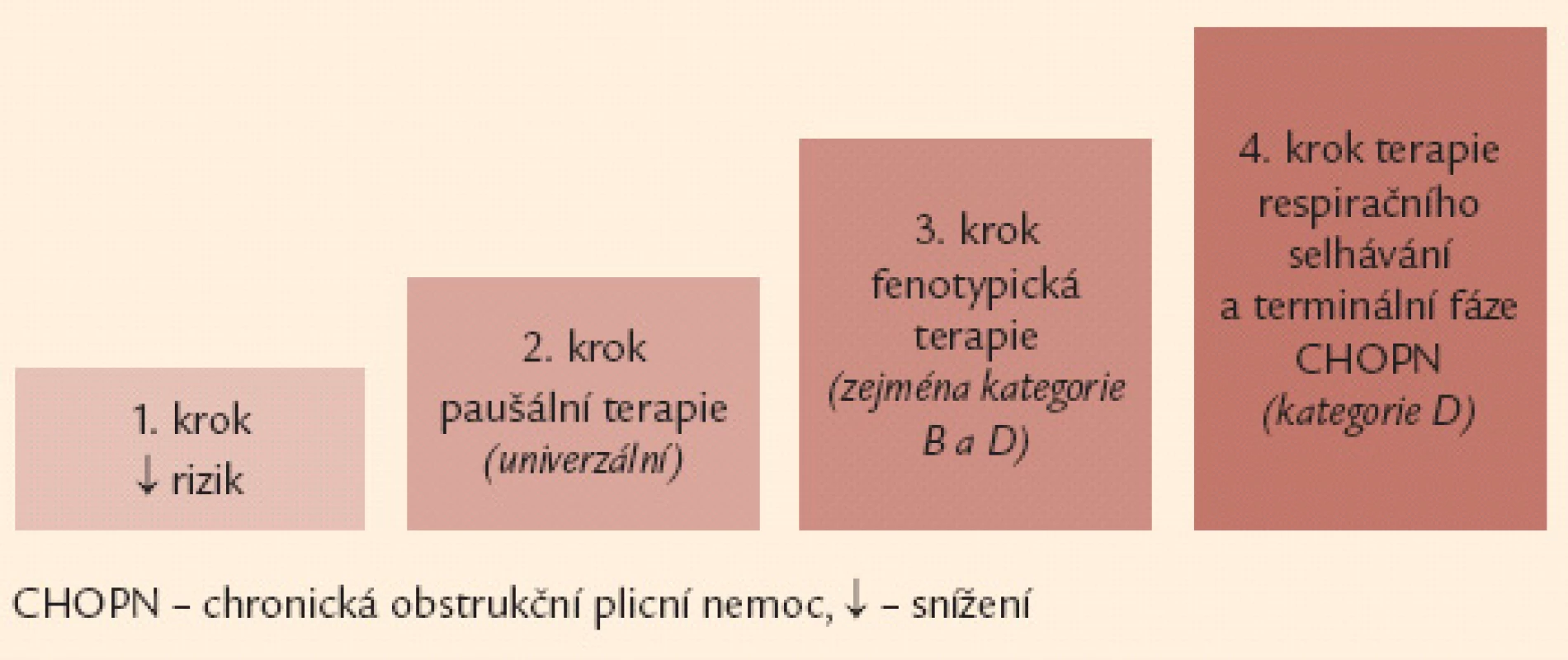
Eliminace rizik – krok 1
Ukončení rizikové expozice (např. kouření cigaret) přináší největší naději na příznivé ovlivnění přirozeně nepříznivého vývoje CHOPN [10,11,40,41]. Na druhou stranu bylo prokázáno, že pokračování v rizikové expozici významně urychluje vývoj nemoci, a to nezávisle na její vstupní tíži [41,42]. Víme, že protikuřácké intervence mají svůj význam i u nemocných s těžkými formami CHOPN – obr. 7 [40].
Obr. 7. Čtyřstupňové schéma terapie CHOPN – rozšířená verze. ATB – antibiotika, BVR – bronchoskopická volum-redukce, DDOT – dlouhodobá domácí oxygenoterapie, LuTx – plicní transplantace, LVRS – chirurgická volum-redukce, NIV – neinvazivní ventilační podpora, RHB – plicní rehabilitace 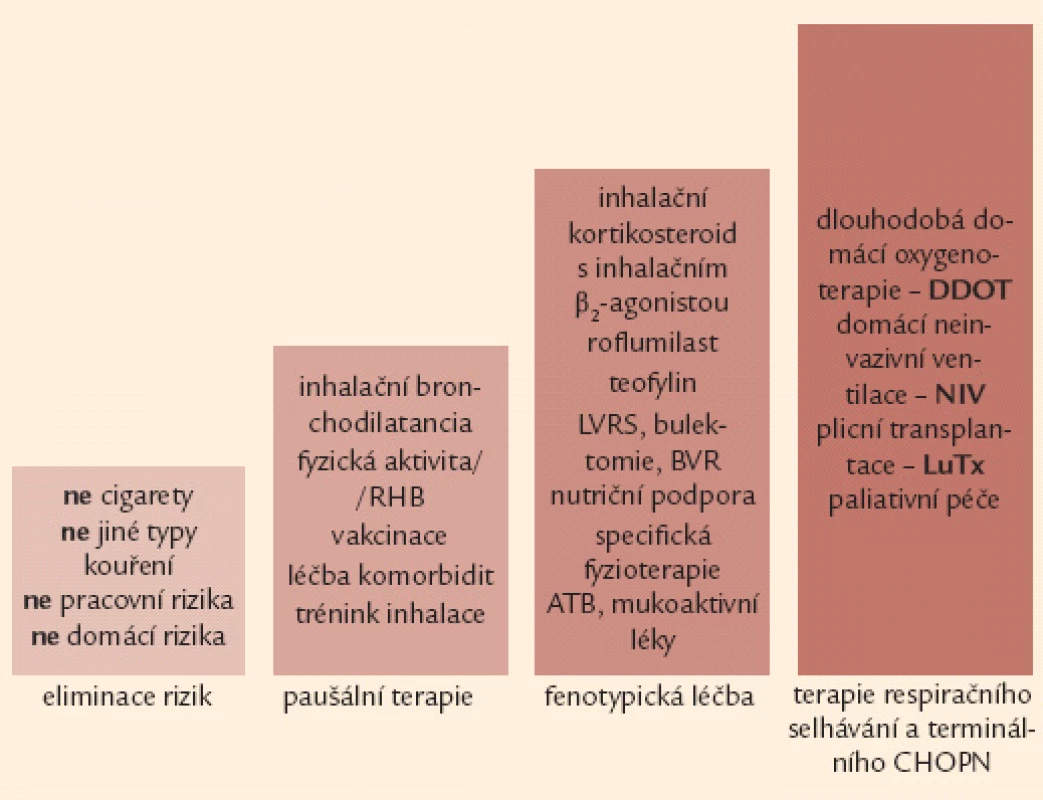
Paušální léčba – krok 2
Paušální léčba je léčba indikovaná pro všechny nemocné bez rozdílu fenotypu. Zahrnuje farmakologické (převážně inhalační medikace + očkování) i nefarmakologické (pohybová aktivita, pulmonální rehabilitace, edukace a trénink inhalačních technik) postupy (obr. 6 a 7). Nedílnou součástí paušální léčby jsou farmakologické intervence zaměřené na klinicky důležité komorbidity (obr. 2).
Paušální farmakologická léčba
Základem farmakologické paušální léčby stabilní CHOPN jsou inhalační bronchodilatancia vedoucí k symptomatické úlevě zaměřené proti pocitu dušnosti, omezené toleranci zátěže a zhoršené kvalitě života. Většina těchto léků redukuje výskyt akutních exacerbací. Příznivé ovlivnění deklinace funkce plic, zástava progrese onemocnění a prodloužení života zatím nebylo u těchto léků nezpochybnitelně prokázáno, i když je velmi pravděpodobné [10,43 – 45]. U všech CHOPN pacientů je nezbytná opakovaná a kontrola správnosti inhalační techniky, u více než 50 % z nich je totiž inhalace chybná a málo efektivní [46]. Kombinace obou typů (β2 - agonisté a inhalační anticholinergika) bronchodilatancií (ve formě dlouhodobě či krátkodobě působících preparátů) přináší výraznější benefit než prosté zvyšování dávek jednoho typu léku [47 – 49]. Krátkodobě působící inhalační medikace je určena jako úlevová léčba, případně hlavní medikace u oligosymptomatických (kategorie A) osob bez rizika exacerbací. K udržovací léčbě je nutné používání inhalačních dlouhodobě působících farmak, jako např. tiotropia, glykopyrronia, aklidinia, indakaterolu, salmeterolu či formoterolu [43,44,50 – 59]. Další komponentou paušální léčby je vakcinace. Jako nepostradatelné se jeví očkování všech nemocných s CHOPN proti chřipce – každý rok od září do prosince před pravidelným nástupem celoevropské epidemie. Existují i doporučení (méně ověřená) pro očkování pneumokokovou vakcínou (1krát za 5 – 10 let) a proti černému kašli (u osob v kontaktu s dětmi) [60,61].
Paušální nefarmakologická léčba
Základním kamenem paušální nefarmakologické terapie je pulmonální rehabilitace, jejíž součástí je edukace, léčebná rehabilitace, ergoterapie (zejména nácvik běžných aktivit denního života), nutriční a psychosociální pomoc [10,11,62]. Léčebná rehabilitace zahrnuje pravidelnou pohybovou aktivitu a techniky respirační fyzioterapie. Pro méně závažné případy představuje alternativu sofistikovaného rehabilitačního programu pravidelná fyzická aktivita (obecně 45 – 60 min aerobní zátěže/ obden). Techniky respirační fyzioterapie jsou zaměřené na reedukaci dechového stereotypu, zvýšení rozvíjení hrudníku, usnadnění expektorace, zahrnují cílené cvičení respiračních svalů a posilovací trénink horních i dolních končetin. Komplexní pulmonální rehabilitace bude řešena samostatným národním doporučeným postupem ČPFS.
Kromě terapie samotné CHOPN musíme u všech pacientů myslet na efektivní léčebnou intervenci relevantních komorbidit, která se v podstatě neliší (včetně využívání β‑blokátorů) od léčby těchto chorob u osob bez přítomnosti CHOPN (obr. 2) [8].
Fenotypicky cílená léčba – krok 3
U pacientů s již vyhraněným fenotypem CHOPN bychom měli kromě paušální medikace systematicky zvážit reálné možnosti fenotypicky zaměřené terapie. Jedná se většinou o nemocné v kategoriích B a D. Fenotypy se u jednoho pacienta mohou různě kombinovat (např. kachexie a plicní emfyzém, resp. chronická bronchitida a časté exacerbace), případně vyvíjet v čase. Na druhou stranu se, zejména v počátečních fázích CHOPN, setkáváme s nemocnými bez jasně vyhraněného fenotypu (zejména v kategorii A) – u těchto osob naše léčebné působení bude obsahovat jen eliminaci rizik a paušální léčbu.
Pro nemocné s frekvenčním výskytem akutních exacerbací (bezpodmínečně při post‑BDT FEV1 60 % n.h., pravděpodobně efektivní i u méně výrazné obstrukce) je vhodné do léčby zahrnout inhalační kombinační léčbu dlouhodobým β2 - agonistou s inhalačním kortikosteroidem (LABA + IKS) [9,26,44,45,63].
Druhým fenotypem s prokazatelným přínosem kombinační léčby (LABA + IKS) je překryv CHOPN s bronchiálním astmatem – kombinace LABA + IKS je zde léčbou 1. volby. Léčebné doporučení pro tento klinický fenotyp pak jako další léčbu následně doporučuje inhalační „trojkombinaci“ IKS + LABA + LAMA (LAMA – dlouhodobě působící inhalační anticholinergikum). Následně může být farmakoterapie tohoto fenotypu doplněna i o perorálně podávané antileukotrieny (např. montelukast) [9,64 – 66].
U pacientů se současnou přítomností bronchitického fenotypu spolu s fenotypem frekventních exacerbací se v případě poklesu FEV1 pod 50 % n.h. ukazuje jako jasně benefitní perorální léčba roflumilastem – selektivním inhibitorem fosfodiesterázy 4. Roflumilast redukuje výskyt středních a těžkých exacerbací a současně (výhradně pomocí svého protizánětlivého působení) zlepšuje funkční parametry – zejména FEV1 [67,68].
Mladší (obvykle ≤ 50 let) nemocní trpící emfyzémovým fenotypem s FEV1 mezi 30 a 60 % náležitých hodnot a prokazatelně bez aktivního nikotinizmu s těžkou formou (sérová koncentrace 0,5 g/ l) deficitu proteinázového inhibitoru α1 antitrypsinu podmíněnou homozygotní mutací Pi*ZZ, případně Pi*null (odhadem 1 % evropských nemocných s CHOPN), by měli být léčeni pravidelnou (intravenózně) substituční léčbou a1 antitrypsinem [69,70].
Terapie emfyzematických nemocných s přítomností velkých bul (zejména pokud souhrnný rozsah bulózního postižení dosahuje 1/ 3 objemu postiženého hemitoraxu a případně se chová expanzivně a vede ke zhoršování symptomů) je možná pomocí provedení resekce těchto bul – tzv. bulektomie [71,72].
Pacienti s heterogenním typem plicního emfyzému postihujícího apikální partie plic a s preferenčně nízkou tolerancí zátěže mohou být indikováni k provedení tzv. plicní volum ‑ redukující operace (LVRS), a to zejména v přítomnosti plicní hyperinflace RV 150 – 200 % n.h., těžkých symptomů dušnosti (mMRC 3 – 4) a nízké tolerance zátěže [72 – 74]. Pacientům s dominující heterogenní formou plicního emfyzému, kteří nejsou schopni a/ nebo ochotni podstoupit výše zmíněné chirurgické (LRVS) metody léčby existuje alternativa v podobě bronchoskopické volum-redukce – tzv. BVR [75,76].
U nemocných s fenotypem plicní kachexie je indikována nutriční podpora v kombinaci s rehabilitační péčí (zejména silový trénink). Typ a složení nutriční podpory je nutričním specialistou spočítáno na základě zhodnocení energetických potřeb pacienta, reziduálního perorálního příjmu a možnosti perorálního nebo enterálního podání výživy. Parenterální výživa je vyhrazena pro pacienty s intolerancí nazogastrické nebo nazojejunální sondy a nemožností přijímat sipping [77,78].
Terapie antibiotiky (ATB) může přinášet pozitivní efekt u 3 fenotypů: u nemocných s nadměrnou produkcí hlenu – bronchitický fenotyp, u osob s častými exacerbacemi a také u fenotypu CHOPN s bronchiektáziemi. Doporučovány jsou makrolidy – azitromycin či klaritromycin – a respirační chinolony – moxifloxacin [79 – 87].
Dlouhodobou aplikaci mukoaktivní medikace lze zvážit zejména pro symptomatické osoby s bronchitickým fenotypem a fenotypem překryvu CHOPN a bronchiektázií. Sumarizující doporučení týkající se fenotypicky cílené léčby CHOPN uvádí obr. 8 [88,89].
Obr. 8. Souhrnná léčebná doporučení pro jednotlivé vyhraněné fenotypy CHOPN. A1AT – α-1 antitrypsin, AB – bronchiální astma, ATB – antibio tika, BVR – bronchoskopická volumredukce, IKS – inhalační kortikosteroidy, LABA – inhalační β<sub>2</sub>- agonisté s dlouhodobým účinkem, LAMA – inhalační anticholinergika s dlouhodobým účinkem, LVRS – plicní volum redukující operace, NAC – N- acetylcystein, PDE4 – fosfodiesteráza 4, NaCl – natrium chloratum 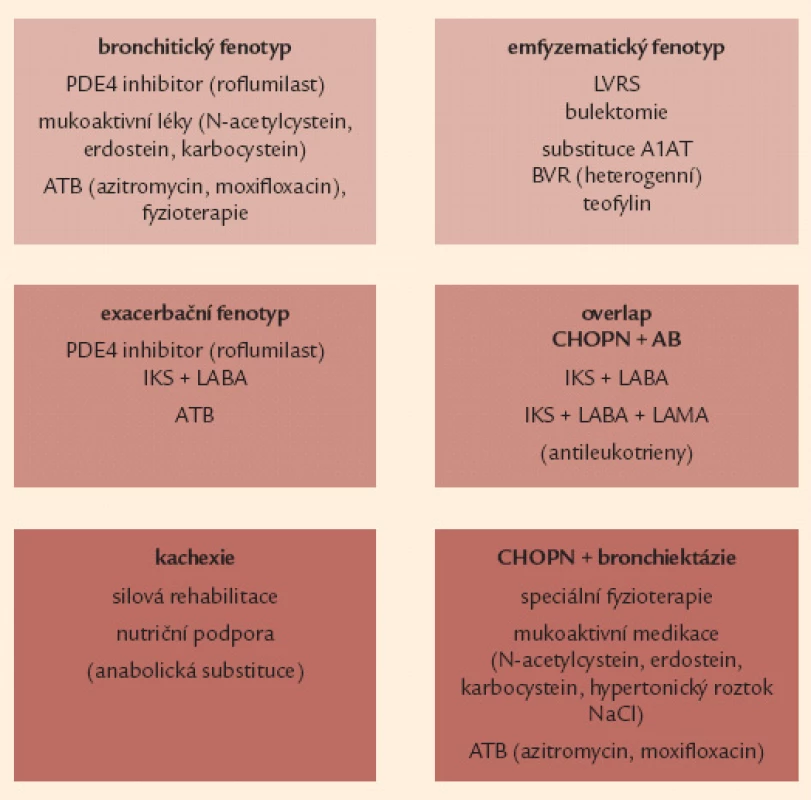
Léčba respirační nedostatečnosti a péče o terminální CHOPN – krok 4
V rámci moderní personalizované medicíny disponujeme řadou efektivních léčebných intervencí cílených na pacienty s chronickou hypoxemií, případně hypoxemií + hyperkapnií (kyslíková léčba, domácí neinvazivní ventilační podpora, plicní transplantace). Specifické terapeutické návody existují i pro případ další progrese onemocnění do terminální fáze CHOPN – metody paliativní péče (obr. 7).
Kyslíková terapie osob s CHOPN se řídí tíží onemocnění a má zhruba 3 hlavní indikace:
- A) Vůbec nejčastěji podáváme kyslík nemocným jako domácí dlouhodobou (≥ 16 hod/ den) kyslíkovou léčbu (neboli DDOT), a to u osob s chronickou respirační nedostatečností. Mezi hlavní indikační kritéria DDOT (kromě absence aktivního nikotinizmu, dobré spolupráce a maximální konzervativní léčby úměrné rozsahu a typu onemocnění) patří výsledky arteriálních krevních plynů: jasná indikace je při PaO2 pod 7,3 kPa při absenci progresivní hyperkapnie, další indikace pak případně při PaO2 7,3 – 8,0 kPa, a to v přítomnosti jasných klinických, EKG nebo sonografických známek plicní hypertenze, polyglobulie, výrazných nočních desaturací souvisejících s CHOPN či těžké přinámahové desaturace a opět při absenci, kyslíkovou substitucí vyvolané, progresivní hyperkapnie. Téma DDOT je v ČR zpracováno ve formě samostatného národního doporučení [90].
- B) Kyslíková léčba během pulmonální rehabilitace. Zde byl prokázán benefit na redukci dynamické plicní hyperinflace vedoucí ke zlepšení výkonu během rehabilitace, což se odráží ve větším přínosu aerobního tréninku na symptomy a kvalitu života [91].
- C) Kyslíková substituční léčba osob cestujících v letadle je poslední indikací léčebného použití kyslíku u osob se stabilní fází CHOPN. O kyslíkové léčbě uvažujeme u všech osob s klidovou SpO2< 92 % nebo s SpO2 < 84 % při 6minutovém testu chůzí [92].
Použití dlouhodobé domácí neinvazivní ventilační podpory (NIV) je metodou volby u pacientů se stabilní CHOPN s chronickým hyperkapnickým respiračním selháváním, tedy nejčastěji u pacientů kategorie 4/ D. Použití vysokých inspiračních tlaků, tzv. high‑intensity NIV (HI ‑ NIV), prokázalo klinický benefit. HI ‑ NIV je nastavena pacientům během několikadenního pobytu v nemocnici ve stabilní fázi CHOPN. Cílem léčby HI ‑ NIV je dosáhnout adekvátní alveolární ventilace použitím vysokých inspiračních tlaků (vrcholový inspirační tlak 25 – 30 cm H2O) a mandatorní dechovou frekvencí rovnající se spontánní dechové frekvenci pacienta (u nemocných s CHOPN okolo 20 – 25 dechů/ min). HI ‑ NIV prokazatelně u pacientů s CHOPN zlepšuje parciální tlak oxidu uhličitého v arteriální krvi, snižuje pokles plicních funkcí, zlepšuje schopnost cvičební kapacity a kvalitu života a snižuje četnost hospitalizací pro exacerbaci hyperkapického respiračního selhávání [93 – 95].
Transplantace plic je indikována pro pacienty s vysokým BODE skóre (tab. 2). Nemocné s BODE 5 začínáme sledovat a k transplantačnímu výkonu indikujeme pacienty s BODE 7 – 10, pokud současně splňují jeden a více z následujících bodů: FEV1 20 % n.h.a/ nebo TLCO 20 % n.h., homogenní typ emfyzému, anamnézu závažné akutní exacerbace s hyperkapnií (s PaCO2 ≥ 6,6 kPa) a plicní hypertenzi s plicním srdcem [71,72].
Tab. 2. Klasický BODE index [16]. ![Klasický BODE index [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/97666d391a432dd1848ee53187c8df47.png)
Léčba terminální fáze CHOPN
Preterminální/ terminální fáze CHOPN bývá spojena s opakovanými atakami akutního zhoršování chronické respirační nedostatečnosti, se selháváním pravého srdce, s plicní infekcí a s dekompenzací řady závažných interních komorbidit. Nemocné s terminálním CHOPN lze identifikovat podobně jako nemocné odeslané k transplantaci (BODE 7 – 10). Jedná se tedy o podobné pacienty – hlavní rozdíl spočívá v přítomnosti kontraindikací plicní transplantace ve skupině osob indikovaných „jen“ k paliativní terapii. Tyto situace často vedou k okamžiku, kdy je nutné stanovit individuální limity další péče. Stanovení limitů se provádí po konsenzuální domluvě všech zdravotníků pečujících o daného nemocného s následným souhlasem rodiny a případně (je‑li toho objektivně schopen) i se souhlasem pacienta. Limity péče jsou celosvětově označovány jako:
- A) DNR/ DNI – neboli neresuscitovat a/ nebo neintubovat,
- B) NIVmax – neinvazivní ventilace stanovena jako maximální strop ventilační podpory,
- C) nerozšiřování a zastavení současně podávané péče – jde o nerozšiřování medikace a dalších stávajících léčebných postupů (např. nepodání další transfuze, nepodávání další katecholaminové podpory, nezajištění eliminačních metod, absence další nutriční podpory, neprovádění chirurgických intervencí) a
- D) deeskalace neboli odnětí současně podávané péče – pokles FiO2 na 21 %, zastavení katecholaminové podpory, odstranění nutriční podpory, vypnutí ventilátoru.
Důležitou součástí péče o terminální stadia CHOPN je v dokumentaci jasně zdůvodněné podávání opiátů v orální, transdermální či parenterální formě. Hlavní indikace opiátů u nemocných s CHOPN představuje: sedace, útlum bolesti (např. z kompresivních fraktur páteře) a inhibice pocitu těžké dušnosti. V této fázi onemocnění je doporučováno rovněž podávání benzodiazepinů. Léčba nezvladatelné dušnosti může být podpořena inhalační léčbou furosemidem a dalšími nefarmakologickými postupy – např. ochlazováním obličeje.
Závěr
Optimální léčba nemocných s CHOPN vyžaduje individualizovaný a multidisciplinární přístup zaměřený na symptomy, potřeby a přání pacienta. Musí zohledňovat osobní, sociální a kulturní faktory (tzv. personalizovaná medicína). Měla by pokrývat všechny aspekty a systémové dopady tohoto multiorgánového syndromu. K jejímu naplnění je třeba do integrovaného systému péče zahrnout kromě pacienta nejen ošetřujícího pneumologa či zdravotnická zařízení, ale i rodinu nemocného, jeho praktického lékaře, fyzioterapeuta, psychologa a nutricionistu. Hlavními složkami terapie jsou eliminace rizikových faktorů, paušální terapie zaměřená na redukci symptomů a dopadů onemocnění spolu s intervencí klinicky relevantních komorbidit a cílená fenotypická léčba s případnou terapií respiračního selhávání. Nezbytným předpokladem je partnerský vztah pacienta a lékaře a nikdy nekončící edukace a trénink. Pokud onemocnění dospěje do terminální fáze, je na místě ještě více prohloubit partnerský vztah a včas rozhodnout o limitech další péče.
MU Dr. Vladimír Koblížek, Ph.D.
www.fnhk.cz
e‑mail: vladimir.koblizek@fnhk.cz
Doručeno do redakce: 7. 5. 2013
Zdroje
1. Atsou K, Chouaid C, Hejblum G. Variability of the chronic obstructive pulmonary disease key epidemilogical data in Europe: systematic review. BMC Med 2011; 9 : 7.
2. Pauwels RA, Rabe KF. Burden and clinical features of chronic obstructive pulmonary disease (COPD). Lancet 2004; 364 : 613 – 620.
3. Lamprecht B, Mahringer A, Soriano JB et al. Is spirometry properly used to diagnose COPD? Results from the BOLD study in Salzburg, Austria: a population‑based analytical study. Prim Care Respir J 2013; 22 : 195 – 200.
4. Malý M, Zvolský M, Rozborilová E et al. Respiratory Mortality in Czech and Slovak Republics in the year 2011. Stud Pneumol Phtiseol 2013; 79. In press.
5. Vondra V. Úmrtnost na CHOPN v letech 1996 – 2005 se zdvojnásobila. Stud Pneumol Phtiseol 2007; 73 : 75.
6. Institute of Medical Information Services. Tuberculosis and respiratory diseases 2011. 2012 Nov [cited 2013 Mar 2]. Available from: http:/ / www.uzis.cz/ katalog/ zdravotnicka ‑ statistika/ tuberkuloza ‑ respiracni ‑ nemoci.
7. Qaseem A, Wilt TJ, Weinberger SE et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update for the ACP, ACCP, ATS and ERS. Ann Intern Med 2011; 155 : 179 – 191.
8. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Updated 2013. 2013 Feb [cited 2013 Mar 2]. Available from: http:/ / www.goldcopd.org/ uploads/ users/ /files/ GOLD_Report_2013_Feb20.pdf.
9. Miravitlles M, Soler ‑ Cataluña JJ, Calle M et al. Spanish COPD Guidelines (GesEPOC): pharmacological treatment of stable COPD. Spanish Society of Pulmonology and Thoracic Surgery. Arch Bronconeumol 2012; 48 : 247 – 257.
10. National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease (updated) Clinical guidelines CG101. 2013 Mar [cited 2013 Apr 2]. Available from: http:/ / www.nice.org.uk/ CG101.
11. Celli BR. Update on the management of COPD. Chest 2008; 133 : 1451 – 1462.
12. Česká pneumologická a ftizeologická společnost. Doporučený postup pro diagnostiku a léčbu CHOPN. 2013 Feb [cited 2013 May 4]. Available from: http:/ / www.pneumologie.cz/ aktualne/ doc/ Standard%20verze%2021.1.pdf.
13. Hooper R, Burney P, Vollmer WM et al. Risk factors for COPD spirometrically defined from the lower limit of normal in the BOLD project. Eur Respir J 2012; 39 : 1343 – 1353.
14. Lamprecht B, McBurnie MA, Vollmer WM et al. COPD in never smokers: results from the population‑based burden of obstructive lung disease study. Chest 2011; 139 : 752 – 763.
15. Cho MH, Castaldi PJ, Wan ES et al. A genome ‑ wide association study of COPD identifies a susceptibility locus on chromosome 19q13. Hum Mol Genet 2012; 21 : 947 – 957.
16. Celli BR, Cote CG, Marin JM et al. The body‑mass index, airflow obstruction, dyspnea and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med 2004; 350 : 1005 – 1012.
17. O’Donnell DE, Flüge T, Gerken F et al. Effects of tiotropium on lung hyperinflation, dyspnoea and exercise tolerance in COPD. Eur Respir J 2004; 23 : 832 – 840.
18. Stridsman C, Lindberg A, Skär L. Fatigue in chronic obstructive pulmonary disease: a qualitative study of people’s experiences. Scand J Caring Sci 2013. In press.
19. Koblizek V, Tomsova M, Cermakova E et al. Impairment of nasal mucociliary clearance in former smokers with stable chronic obstructive pulmonary disease relates to the presence of a chronic bronchitis phenotype. Rhinology 2011; 49 : 397 – 406.
20. Bakke PS, Ronmark E, Eagan T et al. Recommendations for epidemiological studies on COPD. Eur Respir J 2011; 38 : 1261 – 1277.
21. Miravitlles M, Calle M, Soler ‑ Cataluña JJ. Clinical phenotypes of COPD. Identification, definition and implications for quidelines. Arch Bronconeumol 2012; 48 : 86 – 98.
22. Floto RA, Haworth CS. Bronchiectasis. European Respiratory Monograph. Sheffield: European Respiratory Society 2011.
23. Pasteur MC, Bilton D, Hill AT et al. British Thoracic Society guideline for non‑CF bronchiectasis. Thorax 2010; 65 (Suppl 1): i1 – i59.
24. Aaron SD, Donaldson GC, Whitmore GA et al. Time course and pattern of COPD exacerbation onset. Thorax 2012; 67 : 238 – 243.
25. George C, Zermansky W, Hurst JR. Frequent exacerbations in chronic obstructive pulmonary disease. BMJ 2011; 342: d1434.
26. Hurst JR. Exacerbation phenotyping in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2011; 184 : 625 – 626.
27. Sanchez FF, Faganello MM, Tanni SE et al. Anthropometric midarm measurements can detect systemic fat‑free mass depletion in patients with chronic obstructive pulmonary disease. Braz J Med Biol Res 2011; 44 : 453 – 459.
28. Schleich FN, Seidel L, Sele J et al. Exhaled nitric oxide tresholds associated with a sputum eosinophil count ≥ 3% in a cohort of unselected patients with asthma. Thorax 2010; 65 : 1039 – 1044.
29. Izquierdo ‑ Alonso JL, Rodriguez ‑ Gonzálezmoro JM, de Lucas ‑ Ramos P et al. Prevalence and characteristics of three clinical phenotypes of chronic obstructive pulmonary disease (COPD). Respir Med 2013; 107 : 724 – 731.
30. Vanfleteren LE, Spruit MA, Groenen M et al.Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013; 187 : 728 – 735.
31. Clarenbach CF, Thurnheer R, Kohler M et al. Vascular dysfunction in chronic obstructive pulmonary disease: current evidence and perspectives. Expert Rev Respir Med 2012; 6 : 37 – 43.
32. Sode B, Dahl M, Nordestgaar BG. Myocardial infarction and other co ‑ morbidities in patients with chronic obstructive pulmonary disease: a Danish nationwide study of 7.4 million individuals. Eur Heart J 2011; 32 : 2365 – 2375.
33. Nava S, Sturani C, Hartl S et al. End‑of‑life decision – making in respiratory intermediate care units: a European survey. ERS TASK FORCE. Eur Respir J 2007; 30 : 156 – 164.
34. Lanken PN, Terry PB, DeLisser HM et al. An official American Thoracic Society clinical policy statement: palliative care for patients with respiratory diseases and critical illnesses. Am J Respir Crit Care Med 2008; 177 : 912 – 927.
35. Pellegrino R, Viegi G, Brusasco V et al. Interpretative strategies for lung function tests. Eur Respir J 2005; 26 : 948 – 968.
36. Gonem S, Raj V, Wardlaw J et al. Phenotyping airways disease: an A to E approach. Clin Exper Allergy 2012; 42 : 1664 – 1683.
37. Jones P, Adamek L, Nadeau G et al. Comparisons of health status scores with MRC grades in a primary care COPD population: implications for the new GOLD 2011 classification. Eur Respir J 2012. In press.
38. Han M, Dransfield M, Curran ‑ Everett D et al. Characteristics of GOLD 2011 grading system in the COPDGene cohort. In: European Respiratory Society Annual Congress Vienna 2012 1 – 5 Sep. Eur Respir J 2012; 40 (Suppl 56): 1646.
39. Lange P, Marott JL, Vestbo J et al. Prediction of the clinical course of chronic obstructive pulmonary disease, using the new GOLD classification: a study of the general population. Am J Respir Crit Care Med 2012; 186 : 975 – 981.
40. Anthoniesen NR, Skeans MA, Wise RA et al. The effects of a smoking cessation intervention on 14.5‑year mortality: a randomized clinical trial. Ann Intern Med 2005; 142 : 233 – 239.
41. Lee PN, Fry JS. Systematic review of the evidence relating FEV1 decline to giving up smoking. BMC Med 2010; 8 : 84.
42. Vestbo J, Edwards LD, Scanlon PD et al. Changes in forced expiratory volume in 1 second over time in COPD. N Engl J Med 2011; 365 : 1184 – 1192.
43. Decramer M, Celli BR, Kesten S et al. Effect of tiotropium on outcomes in patients with moderate chronic obstructive pulmonary disease (UPLIFT) a prespecified subgroup analysis of a randomised controlled trial. Lancet 2009; 374 : 1171 – 1178.
44. Celli BR, Thomas NE, Anderson JA et al. Effect of pharmacotherapy on the rate of decline of lung function in chronic obstructive pulmonary disease: results from the TORCH study. Am J Respir Crit Care Med 2008; 178 : 332 – 338.
45. Jenkins CR, Jones PW, Calverley PM et al. Efficacy of salmeterol/ fluticasone propionate by GOLD stage of chronic obstructive pulmonary disease: analysis from the randomised, placebo ‑ controlled TORCH study. Respir Res 2009; 10 : 59.
46. Laube BL, Janssens HM, Jongh FH et al. What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J2011; 37 : 1308 – 1331.
47. Mahler DA, D’Urzo A, Bateman ED et al. Concurrent use of indacaterol plus tiotropium in patients with COPD provides superior bronchodilatation compared with tiotropium alone: a randomised, double‑blind comparison. Thorax 2012; 67 : 781 – 788.
48. Tashkin DP, Fabbri LM. Long‑acting beta‑agonist in the management of chronic obstructive pulmonary disease: current and future agents. Respir Res 2010; 11 : 149.
49. Wedzicha JA, Decramer M, Ficker JH et al. Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 compared with glycopyrronium and tiotropium (SPARK): a randomised, double‑blind, parallel ‑ group study. Lancet 2013. In press.
50. Vogelmeier C, Hederer B, Glaab T et al. Tiotropium versus salmeterol for the prevention of exacerbation of COPD. N Engl J Med 2011; 364 : 1093 – 1103.
51. Calverley PM, Anderson JA, Celli BR et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356 : 775 – 789.
52. Donohue JF, Fogarty LM, Lotvall J et al. Once ‑ daily bronchodilators for chronic obstructive pulmonary disease: indacaterol versus tiotropium. Am J Respir Crit Care Med 2010; 182 : 155 – 162.
53. Kornmann O, Dahl R, Centanni S et al. Once ‑ daily indacaterol versus twice ‑ daily salmeterol for COPD: a placebo ‑ controlled comparison. Eur Respir J 2011; 37 : 273 – 279.
54. Welte T, Miravitlles M, Hernandez P et al. Efficacy and tolerability of budesonide/ formoterol addend to tiotropium in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180 : 741 – 750.
55. Singh S, Loke YK, Enright PL et al. Mortality associated with tiotropium mist inhaler in patients with chronic obstructive pulmonary disease: systematic review and meta‑analysis of randomised controlled trials. BMJ 2011; 342: d3215.
56. Michele TM, Pinheiro S, Iyasu S. The safety of tiotropium the FDA’s conclusions. N Engl J Med 2010; 363 : 1097 – 1099.
57. Kesten S, Casaburi R, Kukafka D et al. Improvement in self ‑ reported exercise participation with combination of tiotropium and and rehabilitative exercise training in COPD patients. Int J Chron Obstr Pulmon Dis 2008; 3 : 127 – 136.
58. Calverley PM, Stockley RA, Seemungal TA et al. Reported pneumonia in patients with COPD: findings from the INSPIRE study. Chest 2011; 139 : 505 – 512.
59. Ferguson GT, Calverley PM, Anderson JA et al. Prevalence and progression of osteoporosis in patients with COPD: results from the TORCH study. Chest 2009; 136 : 1456 – 1465.
60. Centers for disease control and prevention. Prevention and control of seasonal influenza vaccines. Recommendations of the Advisory Committee on Immunization Practice (ACIP). MMWR Morb Mortal Wkly Rep 2009; 58 : 1 – 52.
61. Centers for disease control and prevention. Recommended adult immunization schedule. United States 2010. MMWR Morb Mortal Wkly Rep 2011; 60 : 1 – 4.
62. Hodgkin JE, Celli BR, Connors GL. Pulmonary rehabilitation. Guidelines to success. St. Louis, Missouri: Mosby Elsevier 2009.
63. Stone RA, Lowe D, Potter JM et al. Managing patients with COPD exacerbation: does age matter? Age Ageing 2012; 41 : 461 – 468.
64. Kerstjens H, Engel M, Dahl R et al. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med 2012; 367 : 1198 – 1207.
65. Thomsen M, Nordestgaard BG, Sethi AA et al. 2‑adrenergic receptor polymorphisms, asthma and COPD: two large population‑based studies. Eur Respir J 2012; 39 : 558 – 566.
66. Rossi A, Kristufek P, Levine BE et al. Comparison of the efficacy, tolerability, and safety of formoterol dry powder and oral, slow ‑ release theophylline in the treatment of COPD. Chest 2002; 121 : 1058 – 1069.
67. Grootendorst DC, Gauw SA, Verhoosel RM et al. Reduction in sputum neutrophil and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD. Thorax 2007; 62 : 1081 – 1087.
68. Rabe KF. Roflumilast for the treatment of chronic obstructive pulmonary disease. Expert Rev Resp Med 2010; 4 : 543 – 555.
69. Wood A, Stockley R. Alpha one antitrypsin deficiency: from gene to treatment. Respiration 2007; 74 : 481 – 492.
70. Wood A, Tan S, Stockley R. Chronic obstructive pulmonary disease: towards pharmacogenetics. Genome Med 2009; 1 : 112.
71. Benditt JO. Surgical options for patients with COPD: sorting out the choices. Respir Care 2006; 51 : 173 – 182.
72. Martinez FJ, Chang AC, Chan KM. Surgical Therapy for COPD. In: Rennard SI, Rodríguez ‑ Roisin S, Huchon G et al (eds). Clinical Management of Chronic Obstructive Pulmonary Disease. New York: Informa, Healthcare 2008 : 435 – 474.
73. Criner GJ, Cordova F, Sternberg AL et al. The National Emphysema Treatment Trial (NETT): Part I: Lessons learned about emphysema. Am J Respir Crit Care Med 2011; 184 : 763 – 770.
74. Criner GJ, Cordova F, Sternberg AL et al. The National Emphysema Treatment Trial (NETT) Part II: Lessons learned about lung volume reduction surgery. Am J Respir Crit Care Med 2011; 184 : 881 – 893.
75. Herth F, Noppen M, Valipour A et al. Efficacy predictors of lung volumereduction with Zephyr valves in a Europeancohort. Eur Respir J 2012; 39 : 1334 – 1342.
76. Herth F, Eberhardt R, Gompelmann D et al. Radiological and clinical outcomes of using ChartisTM to plan endobronchial valve treatment. Eur Respir J 2013; 41 : 302 – 308.
77. Anker S, John M, Pedersen P et al. ESPEN Guidelines on Enteral Nutrition: Cardiology and pulmonology. Clin Nutr 2006; 25 : 311 – 318.
78. Anker S, Laviano A, Filippatos G et al. ESPEN Guidelines on Parenteral Nutrition: on cardiology and pneumology. Clin Nutr 2009; 28 : 455 – 460.
79. Elborn S, Tunney MM. Macrolide and bronchiectasis. Clinical benefit with a resistance price. JAMA 2013; 309 : 1295 – 1296.
80. Pannu KD. Azithromycin 250 mg daily reduces exacerbation frequency and improves quality of life in selected COPD patients. Thorax 2012; 67 : 391.
81. Peters J, Anzueto A. Azithromycin once daily for 1 year reduced acute COPD exacerbations. Ann Intern Med 2012; 156: JC1 – JC10.
82. Pomares X, Montón C, Espasa M et al. Long‑term azithromycin therapy in patients with severe COPD and repeated exacerbations. Int J Chron Obstr Pulmon Dis 2011; 6 : 449 – 456.
83. Albert RK, Connett J, Bailey WC. Azithromycin for prevention of exacerbations of COPD. N Engl J Med 2011; 365 : 689 – 698.
84. Uzun S, Djamin RS, Kluytmans J et al. Influence of macrolide maintenance therapy and bacterial colonisation on exacerbation frequency and progression of COPD (COLUMBUS): study protocol for a randomised controlled trial. Trials 2012; 13 : 82.
85. Altenburg J, de Graaff CS, Stienstra Y et al. Effect of azitromycin maintenance treatment on infectious exacerbations among patients with non‑cystic fibrosis bronchiectasis. The BAT randomized controlled trial. JAMA 2013; 309 : 1251 – 1259.
86. Sethi S, Jones PW, Theron MS et al. Pulsed moxifloxacin for the prevention of exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Respir Res 2010; 11 : 10.
87. Hobbs K, Brown D. Consider adding this drug to fight COPD that‘s severe. J Fam Pract 2012; 61 : 414 – 416.
88. Decramer M, Janssens W. Mucoactive therapy in COPD. Eur Respir Rev 2010; 19 : 134 – 140.
89. Moretti M, Bottrighi P, Dallari R et al. The effect of long‑term treatment with erdosteine on chronic obstructive pulmonary disease: the EQUALIFE Study. Drugs Exp Clin Res 2004; 30 : 143 – 152.
90. Czech Pneumological and Phthisiological Society. Guidelines for indication of home long term oxygen therapy 2013. 2013 Apr [cited 2013 Apr 17]. Available from: http:/ / www.pneumologie.cz/ odborne/ doc/ Standard%20DDOT ‑ %20final.pdf.
91. Somfay A, Porszasz J, Lee SM et al. Dose‑response effect of oxygen on hyperinflation and exercise endurance in nonhypoxaemic COPD patients. Eur Respir J 2001; 18 : 77 – 84.
92. Edvardsen A, AkerØ´ A, Christensen CC et al.Air travel and COPD: A new algorithm for pre‑flight evaluation. Thorax 2012; 67 : 964 – 969.
93. Dreher M, Storre JH, Schmoor C et al. High intensity versus low ‑ intensity non‑invasive ventilation in patients with stable hypercapnic COPD: a randomised crossover trial. Thorax 2010; 65 : 303 – 308.
94. Duiverman ML, Wempe JB, Bladder G et al. Nocturnal non‑invasive ventilation in addition to rehabilitation in hypercapnic patients with COPD. Thorax 2008; 63 : 1052 – 1057.
95. Duiverman ML, Wempe JB, Bladder G et al. Two‑year home‑based nocturnal non‑invasive ventilation added to rehabilitation in chronic obstructive pulmonary disease patients: a randomized controlled trial. Respir Res 2011; 12 : 112.
96. Au DH, Curtis JR. Providing Palliative and End‑of ‑ Life Care for Patients with COPD. In: Rennard SI, Rodríguez ‑ Roisin S, Huchon G et al (eds). Clinical Management of Chronic Obstructive Pulmonary Disease. New York: Informa, Healthcare 2008 : 515 – 529.
97. Kamal AH, Maguire JM, Wheeler JL et al. Dyspnea review for the palliative care professional: treatment goals and therapeutic options. J Palliat Med 2012; 15 : 106 – 114.
98. Uronis HE, Currow DC, Abernethy AP. Palliative management of refractory dyspnea in COPD. Int J Chron Obstr Pulmon Dis 2006; 1 : 289 – 304.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2013 Číslo 6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Významné životní jubileum prof. MU Dr. Karla Horkého, DrSc.
- Národní Program Komplexní Interní Péče (NPKIP). Interna jako páteřní obor zdravotního systému ČR
- Počátky České kardiologické společnosti a české kardiologie
- Moderní trendy v inzulinoterapii
- Vplyv tuhosti aorty na centrálnu hemodynamiku a na kardiovaskulárny systém
- Lipidy a veľkosť lipoproteínových častíc u pacientov s novozisteným a doposiaľ neliečeným diabetes mellitus 2. typu
- Metabolický syndróm a prediabetické stavy
- Rezistentná hypertenzia v staršom veku
- Epigenetická cytostatika a jejich role v protinádorové léčbě
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diferenciálna diagnóza a liečba hyponatriémie
- Adherence a perzistence se zaměřením na léčbu hypertenzních pacientů
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Hypertenze u pacientů s polycystickými ledvinami – incidence, patogeneze, prognóza, terapie
- Primární hyperaldosteronizmus: častá forma sekundární hypertenze s vyšším kardiovaskulárním rizikem
- Chronická obstrukční plicní nemoc pohledem nových doporučení – souhrn aktuálního fenotypově zaměřeného standardu České pneumologické a ftizeologické společnosti pro internisty
- Účinnost léčby anagrelidem u nemocných s Ph‑ negativními myeloproliferativními chorobami: ovlivnění výskytu trombózy ve výstupech Registru pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® ke konci roku 2012
- Recept na individualizaci antikoagulační léčby
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciálna diagnóza a liečba hyponatriémie
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



