-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba bortezomibem u pacientů s onemocněním z depozice lehkých řetězců imunoglobulinu
Bortezomib-based therapy in patients with light chain deposition disease
Light chain deposition disease (LCDD) is a rare systemic condition caused by monoclonal proliferation of terminally differentiated B-lymphocytes with production of free light chains and their deposition in kidneys or other organs. The aim of our study is to show the pitfalls of the diagnostics, and to demonstrate the effect of bortezomib-based therapy on a series of 4 patients with LCDD, from the point of hematological and organ therapeutic response. We include that bortezomib based treatment provides rapid and effective hematological response. It is, however, often accompanied by adverse events, especially within intensive treatment schedules. The most serious adverse effects includes peripheral neuropathy, which might be dose or treatment-limiting. Less intensive regimens („bortezomib weekly“) suggest an alternative with expectation of lower incidence of adverse effects. Autologous stem cell transplantation is a recommended and relatively safe approach in convenient candidates. Organ response is significantly delayed after hematological response, and organ damage by light chain deposits might not be fully reversible.
Key words:
autologous stem cell transplantation – bortezomib – hematological treatment response – light chain deposition disease – organ treatment response
Autoři: Jiří Minařík 1; Tomáš Tichý 2; Tomáš Pika 1; Jaroslav Bačovský 1; Dagmar Adamová 3; Karel Srovnalík 4; Karel Krejčí 1; Josef Zadražil 1; Vlastimil Ščudla 1
Působiště autorů: III. interní klinika – nefrologická, revmatologická, endokrinologická LF UP a FN Olomouc, přednosta prof. MUDr. Josef Zadražil, CSc. 1; Ústav klinické a molekulární patologie LF UP a FN Olomouc, přednosta prof. MUDr. Zdeněk Kolář, CSc. 2; Hematologicko-transfuzní oddělení Slezské nemocnice Opava, primářka MUDr. Dagmar Adamová 3; Hematologické a transfuzní oddělení Nemocnice Vsetín, primář MUDr. Karel Srovnalík 4
Vyšlo v časopise: Vnitř Lék 2014; 60(10): 821-826
Kategorie: Původní práce
Souhrn
Onemocnění z depozice lehkých řetězců (light chain deposition disease – LCDD) patří mezi vzácná systémová onemocnění způsobená monoklonální proliferací terminálně diferencovaných B-lymfocytů s produkcí volných lehkých řetězců imunoglobulinu a jejich ukládáním především v ledvinách či v dalších tkáních. Náplní sdělení je poukázat na úskalí diagnostiky této klinické jednotky a na příkladu série 4 nemocných s LCDD předložit důkazy o vysoké účinnosti léčby s bortezomibem z pohledu hematologické i orgánové terapeutické odezvy. Z našeho hodnocení vyplývá, že léčba bortezomibem je u LCDD velmi rychlá a účinná, bývá však při intenzivním dávkovacím schématu doprovázena řadou nežádoucích účinků. Z nich je nejzávažnější periferní neuropatie, ohrožující i případné setrvání nemocného v léčbě. Méně intenzivní režimy (tzv. bortezomib weekly) představují alternativu s nižším výskytem nežádoucích účinků. Vysokodávkovaná chemoterapie s podporou autologní transplantace krvetvorných buněk je u vhodných kandidátů doporučeným a relativně bezpečným postupem. Orgánová léčebná odezva se významně opožďuje za hematologickou odezvou a zůstává otázkou, zdali je postižení tkání depozity lehkých řetězců plně reverzibilní.
Klíčová slova:
autologní transplantace krvetvorných buněk – bortezomib – hematologická léčebná odezva – onemocnění z depozice lehkých řetězců – orgánová léčebná odezvaÚvod
Onemocnění z depozice lehkých řetězců (light chain deposition disease – LCDD) je vzácná klinická jednotka patřící do skupiny monoklonálních gamapatií. Je obvykle charakterizována nadměrnou tvorbou volných lehkých řetězců imunoglobulinu a jejich ukládáním v parenchymatózních orgánech [1]. Na rozdíl od mnohočetného myelomu má odlišnou anatomickou distribuci depozit, charakter depozit (nefibrilární a bez afinity ke konžské červeni) pak LCDD odlišuje od primární systémové AL-amyloidózy, se kterou může být v počátcích onemocnění zaměněno [2].
Nejčastěji bývají onemocněním postiženy ledviny, může však postihnout též játra, srdce či jiné orgány. Ukládání volných lehkých řetězců v orgánech vede k postupnému zhoršování až ztrátě jejich funkce, vedoucí k ledvinnému, srdečnímu či jaternímu selhání, odpovědnému za nepříznivou prognózu nemocných s LCDD [1].
Léčba LCDD je obdobná jako u mnohočetného myelomu (MM) a spočívá v chemoterapeutickém ovlivnění základního procesu, kterým je klonální proliferace plazmatických buněk v kostní dřeni. Na rozdíl od MM je účinnost tzv. konvenčních chemoterapeutických režimů u LCDD podstatně nižší a léčba bývá častěji provázena nežádoucími účinky [3]. K ovlivnění prognózy u vhodných nemocných významně přispívá podání vysokodávkované chemoterapie s podporou autologní transplantace krvetvorných buněk (HD-ASCT), je však často ovlivněno horší tolerancí vysokodávkovaných režimů. Kromě toho dle některých studií přetrvává i po tomto léčebném postupu dlouhodobě postižení ledvinných funkcí bez významného zlepšení [4,5].
Navzdory četným randomizovaným studiím u mnohočetného myelomu byl dosud jen v omezené míře zkoumán vliv nových biologických působků (tj. talidomidu, lenalidomidu a bortezomibu) na LCDD. Cílem předložené práce je zhodnocení účinku indukční léčby bortezomibem u 4 nemocných s LCDD léčených na našem pracovišti v období let 2010–2012.
Soubor nemocných
V letech 2010–2012 byli na III. interní klinice – nefrologické, revmatologické a endokrinologické FN Olomouc vyšetřeni celkem 4 nemocní (3 muži, 1 žena, věk 34, 47, 50 a 56 let) pro monoklonální gamapatii spojenou s renální nedostatečností. Všichni nemocní měli zvýšenou hladinu sérového kreatininu (111–445 µmol/l), nefrotickou proteinurii (2,14–11,44 g/24 hod), v močovém sedimentu různý stupeň glomerulární erytrocyturie (28–177 ery/µl), vyšší hladinu NT-proBNP (1 194–5 518 ng/l) a normocytární anémii (Hb 85–115 g/l).
Pouze u jednoho nemocného byla zachycena přítomnost celé molekuly monoklonálního imunoglobulinu (IgG lambda, 11,6 g/l); tento nemocný měl současně jako jediný dominantní lehký řetězec lambda (535 mg/l). Všichni ostatní nemocní měli dominantní podíl volných lehkých řetězců kappa (614–2 215 mg/l), které jsou u LCDD popisovány častěji (na rozdíl od AL-amyloidózy vyznačující se především depozicí lehkých řetězců lambda).
U 2 nemocných byla LCDD prokázána společně s mnohočetným myelomem (infiltrace kostní dřeně myelomovými plazmocyty 20–30 %, přítomnost osteolytického postižení), jeden z nich pak měl histologicky prokázánu i systémovou AL-amyloidózu. U zbylých 2 nemocných se jednalo o samostatný výskyt LCDD bez asociace s další formou monoklonální gamapatie.
Diagnóza onemocnění byla u všech jedinců potvrzena histologicky z bioptického vzorku ledviny, s charakteristickým nálezem mezangiální proliferace, intersticiální fibrózy s tubulární atrofií a pozitivní imunofluorescencí dominantního lehkého řetězce (3krát kappa, 1krát lambda), a s výjimkou jednoho nemocného (který měl současně též mnohočetný myelom a AL-amyloidózu) též s negativitou barvení konžskou červení. Charakteristický histologický obraz postižení ledvin onemocněním z depozice lehkých řetězců ukazuje obr.
Obr. 1. Charakteristický histologický nález biopsie ledvin u onemocnění z depozice lehkých řetězců 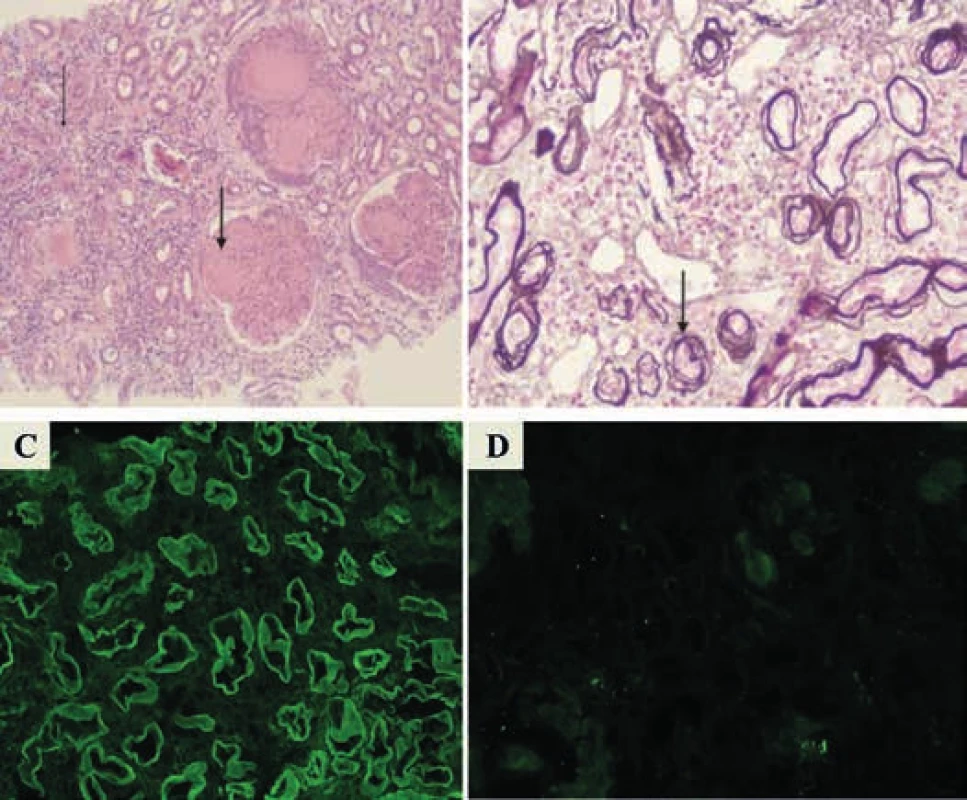
V barvení hematoxylin-eozinem (A) jsou šipkami zaznačeny atrofie tubulů a nodulární skleróza u nemoci z depozice lehkých řetězců (LCDD). Barvení bazálních membrán dle Jonese (B) ukazuje tzv. „reduplikaci membrán“. Charakteristická je imunofluorescence, vykazující pozitivitu kappa (C) a negativitu lambda (D) lehkých řetězců podél bazálních membrán tubulů i glomerulů U 3 nemocných dominovaly v popředí klinického obrazu otoky dolních končetin a obtížně kontrolovatelná hypertenze.
Léčba
Všichni nemocní byli v rámci indukční léčby zajištěni režimem se začleněním bortezomibu. U 3 nemocných se jednalo o kombinační režim VD (bortezomib a dexametazon), u jednoho nemocného jsme přistoupili po 2 cyklech režimu CTD (cyklofosfamid, talidomid, dexametazon) k změně talidomidu za bortezomib v režimu CVD (cyklofosfamid, bortezomib, dexametazon).
Dva nemocní ukončili bortezomibový režim předčasně z důvodu toxicity (periferní neuropatie 2. stupně interferující s denními činnostmi) po 2, resp. 5 cyklech léčby. Jeden nemocný i přes zřejmý efekt terapie v průběhu léčby zemřel ve spádovém nemocničním zařízení na komplikující infekční onemocnění s ukončenými 7 cykly chemoterapie. Všichni tito jedinci užívali bortezomib ve schématu 1,3 mg/m2 v den 1, 4, 8 a 15 v 28denním cyklu, dexametazon ve 2 pulzech 40 mg v den 1–4 a 15–18, pacient léčený režimem CVD užíval denní perorální dávku cyklofosfamidu 50 mg, vše ve zvyklém profylaktickém zajištění dle protokolů České myelomové skupiny [6]. Poslední nemocný měl s ohledem na předchozí zkušenost se závažnou neurologickou toxicitou podáván bortezomib pouze v týdenní modifikaci 1,3 mg/m2 (tzv. režim bortezomib weekly).
U 2 nemocných bylo po indukčním režimu přistoupeno ke sběru periferních kmenových buněk s následnou podporou autologní transplantace krvetvorných buněk.
Výsledky
Jeden z nemocných v průběhu léčby podlehl akutnímu epidemickému respiračnímu onemocnění, po 8 měsících od zahájení systémové chemoterapie. Onemocnění v této době bylo ve velmi dobré parciální remisi, nehematologickou léčebnou odezvu s ohledem na krátký časový interval nebylo možné stanovit (nemocný ještě neukončil léčbu, přesto vykazovaly výsledky sérových hladin dusíkatých katabolitů a proteinurie setrvalý trend k pozvolnému poklesu).
Hematologická léčebná odezva byla u všech nemocných velmi rychlá. Během 2 cyklů léčby bortezomibem došlo k významnému poklesu sérových hladin volných lehkých řetězců pod 10 % vstupní hodnoty. Došlo také k významnému poklesu proteinurie – u 2 nemocných k normalizaci hladin bílkoviny v moči (< 0,15 g/24 hod) a u jednoho nemocného s významným vstupním postižením ledvin k poklesu na < 30 % vstupní hodnoty (11,44–3,75 g/24 hod) s vymizením monoklonální komponenty v moči včetně imunofixačního vyšetření.
Poměrně záhy (během 4 měsíců) došlo též u 2 nemocných k normalizaci krevního tlaku s možností snížení antihypertenzní terapie a také k ústupu otoků dolních končetin. U jednoho nemocného se otoky podstatně zmenšily, v různé míře ale přetrvávají i 2 roky po ukončení léčby, rovněž krevní tlak zůstává v pásmu mírné hypertenze (do 160/90 mm Hg) i přes intenzivní antihypertenzní léčbu.
V průběhu terapie se začaly u všech nemocných postupně normalizovat hodnoty krevního obrazu, byť s určitou (několikaměsíční) časovou prodlevou, do 2 let se hladina hemoglobinu upravila u všech hodnotitelných nemocných. Podstatně pomalejší léčebnou odezvu zaznamenaly parametry orgánového postižení ledvin. V průběhu prvních 2 cyklů došlo u všech nemocných k mírnému poklesu sérové hladiny kreatininu, v dalším sledování nicméně přetrvávaly hodnoty dusíkatých katabolitů na stejné úrovni (Kr 110–250 µmol/l). Teprve po > 12–20 měsících od ukončení chemoterapie je zřejmý trend ke spontánnímu poklesu sérového kreatininu a u jednoho nemocného bylo dosaženo úplné úpravy sérových hladin kreatininu, zatím ale i nadále s jistým snížením glomerulární filtrace (GF MDRD 1,04 ml/s).
Prakticky všichni nemocní užívající bortezomib v intenzivním neredukovaném schématu zaznamenali nežádoucí účinky spjaté s léčebným protokolem. U všech došlo ke klinickým projevům periferní neuropatie (stupeň 2–3 dle National Cancer Institute – NCI), u 2 z nich bylo nutné léčbu ukončit po 2. resp. po 5. cyklu z důvodu progredující neuropatie. Jeden z nemocných prodělal v průběhu léčby opakované respirační infekce (zánět průdušek, zápal plic), jak virového, tak i bakteriálního původu. U jednoho z nemocných vznikl v průběhu léčby protrahovaný neinfekční průjem (afebrilní, s negativním screeningem infekčních onemocnění), a navíc též týden trvající epizoda škytavky nereagující na konvenční léčebné postupy (zřejmě ve vztahu k pulzům steroidů, s vymizením po jejich ukončení). Poslední pacient, který byl léčen v šetrnější „nízkodávkové“ modifikaci režimu VD (bortezomib podáván 1krát týdně), nezaznamenal v průběhu léčby žádnou významnější nežádoucí událost. Léčebný efekt na sérovou hladinu volných lehkých řetězců, proteinurii, kreatinemii a hemoglobin ukazuje graf (A,B,C,D).
Graf 1. Účinnost léčby bortezomibem na stěžejní ukazatele onemocnění z depozice lehkých řetězců imunoglobulinu 
Po léčbě onemocnění z depozice lehkých řetězců imunoglobulinu (LCDD) došlo k rapidní hematologické odezvě s rychlým a významným poklesem sérové hladiny volných lehkých řetězců (A) i proteinurie (B). Orgánová léčebná odezva se za hematologickou odezvou podstatně opožďovala a pouze u jednoho nemocného dosáhla v časovém odstupu normálních hladin sérového kreatininu (C). Obdobně v případě hemoglobinu došlo k velmi pozvolnému, ale setrvalému nárůstu a teprve po mnoha měsících od ukončení léčby se hladina hemoglobinu u 2 nemocných zcela upravila (D). FLC – volné lehké řetězce imunoglobulinu v séru Diskuse
Diagnóza onemocnění z depozice lehkých řetězců bývá zřídkakdy odhalena při prvním kontaktu nemocného se zdravotnickým pracovištěm. Mnohem častěji jsou nemocní vyšetřováni a léčeni pro přidružené příznaky, jako refrakterní hypertenze, nefrotický syndrom či renální insuficience, která bývá vztažena k vaskulární nefroskleróze či jiné potenciální a pravděpodobnější příčině. Přetrvávání komplikací či případný záchyt monoklonální komponenty v séru nebo v moči nemocného by ale mělo vést k důkladnějšímu vyšetření. Zejména neodpovídající zvýšená hladina sérového kreatininu s proteinurií a hematurií předpokládá důslednou diagnostiku včetně histologického ověření vzorku z ledviny. Přestože vlastní diagnóza spočívá plně na erudici zkušeného histopatologa, mnohé může napovědět přítomnost zvýšené hladiny volných lehkých řetězců imunoglobulinu v séru, předpokládající některou z forem monoklonálních gamapatií.
Histologický obraz LCDD bývá obdobný jako u diabetické nefrosklerózy, s charakteristickou nodulární glomerulosklerózou (na rozdíl od diabetické s pravidelnou distribucí nodulů v glomerulu, bez hyalinózy) s proliferací mezangia, ztluštěním bazálních membrán a tubulární atrofií [1,2,5]. Významným vyšetřením podporující diagnózu LCDD je imunofluorescenční nález lineární fluorescence podél bazálních membrán. V elektronovém mikroskopu jsou pak zřetelná jemná nebo hrubá granulární depozita podél endotelu tubulů, jevící afinitu k strukturálně zachovalé bazální membráně, někdy s náhodně orientovanými fibrilami o tloušťce 15–25 nm [6,7]. V glomerulech je nalézán nefibrilární elektrondenzní obsah podél bazálních membrán a v mezangiálních kličkách. Někdy bývají depozita i v Bowmanově pouzdru a malých arteriolách mezi myocyty [2]. Charakteristický histologický obraz LCDD s barvením hematoxylinem-eozinem, zobrazením membrán dle Jonese a typické imunofluorescence kappa lehkých řetězců s negativitou lehkých řetězců lambda demonstruje obr. Obvyklým postupem po odběru histologického vzorku z ledviny je jeho fixace. U LCDD má i nativní vzorek obdobnou výtěžnost, přesto především z důvodu dalšího zpracování a uchování vzorku je jeho fixace vhodná [8]. Nejjednodušším doporučovaným postupem je použití roztoku formaldehydu, který následně umožní všechna rutinní histologická barvení včetně většiny imunohistologických metod [9]. V případě potřeby může být část vzorku transferována do jiného činidla i pro potřeby elektronové mikroskopie s pouze malým dopadem na kvalitu zobrazení.
Postižení ledvin s přítomností volných lehkých řetězců může být také projevem mnohočetného myelomu, u nějž je ale diagnostika obvykle snazší, nebo též systémové AL-amyloidózy, s níž může být klinický obraz i morfologický nález na ledvinách snadno zaměněn. Kromě rozdílu v barvitelnosti konžskou červení (AL-amyloidóza se barví, zatímco LCDD nikoli) jsou na rozdíl od systémové amyloidózy depozita lehkých řetězců u LCDD neorganizovaná, granulární, podél bazálních membrán. AL-amyloidóza tvoří organizovaná depozita s přítomností fibril. Důvod je především v odlišné patogenezi, která u amyloidózy spočívá v postupném prodlužování pseudokrystalické formy, zatímco u LCDD jde o jednorázovou precipitaci abnormálních lehkých řetězců imunoglobulinu s indukcí akumulace extracelulární matrix [1,2,11]. Ta je následně zodpovědná za ztlušťování tubulární bazální membrány, nodulární glomerulosklerózu a intersticiální fibrózu.
Vlastní léčba LCDD není dosud uspokojivě rozřešena. Jak již bylo zmíněno, vzhledem k původu lehkých řetězců v patologicky změněných plazmatických buňkách kostní dřeně vycházejí léčebná schémata z obdobných protokolů pro mnohočetný myelom. Na rozdíl od MM je však LCDD mnohem vzácnější a nejsou tak k dispozici průkazné důkazy na dostatečných souborech nemocných, které by opravňovaly k užití určitých schémat. Příkladem může být i zmiňovaný nedostatečný efekt konvenční chemoterapie, byť je zacílena na obdobnou klonální populaci plazmocytů. Navíc jsou nemocní s LCDD, obdobně jako pacienti se systémovou AL-amyloidózou „křehcí“ a mnohem náchylnější k nežádoucím účinkům intenzivních chemoterapeutických postupů. Díky rychlému účinku bortezomibu a jeho významnému efektu u MM včetně nemocných s renálním selháním se objevila v současné odborné literatuře řada prací poukazující na účinnost bortezomibu také u LCDD. Jeho efektivita však byla ověřena pouze na malých souborech, případně ve formě kazuistických sdělení [11–16]. Rovněž námi předložený soubor dokazuje výjimečný efekt režimu VD, kdy prakticky během 2 cyklů chemoterapie došlo u všech nemocných k podstatnému snížení sérových hladin volných lehkých řetězců imunoglobulinu a tedy k rychlé a hluboké hematologické odezvě (graf). Na druhou stranu i tito nemocní zaznamenali řadu nežádoucích účinků, spojených především s neurotoxicitou bortezomibu. Absence periferní neuropatie u nemocného s rozvolněným schématem aplikace bortezomibu (tzv. bortezomib weekly) naznačuje možnou cestu ke snížení nežádoucích účinků léčby při zachování účinnosti léčebného protokolu. V souhlasu s ostatními ojedinělými zprávami, i v našem malém souboru došlo v krátké době k příznivému ovlivnění sérové hladiny dusíkatých katabolitů, přesto ale zůstaly hladiny významně nad horní hranicí normálního rozmezí a teprve při delším časovém odstupu došlo k jejich dalšímu postupnému poklesu, jak jsme předpokládali v předchozích sděleních s kratší dobou sledování nemocných [17,18]. Přetrvávání postižení ledvin i po dosažení signifikantní léčebné odezvy připouští možný patogenetický vliv dalších procesů (jako je proliferace extracelulární matrix a intersticiální fibróza), které jsou zpočátku indukovány depozicí lehkých řetězců, následně se ale stávají na tomto prvotním poškození nezávislé.
Popisovaná časná rekurence proteinurie po ukončení léčby bortezomibem [12] pak naznačuje potřebu prodlouženého podávání léčby k zamezení opětovného návratu onemocnění. Dva z našich nemocných byli po ukončení indukční léčby zajištěni též autologní transplantací kostní dřeně. Průběh vlastní transplantace byl u obou příznivý, bez významnějších komplikací i přes očekávání horší tolerance léčby. K hodnocení léčebné odezvy na HD-ASCT u těchto jedinců je zatím příliš brzy, neboť k vlastnímu výkonu byli přijati s onemocněním, které již bylo po předchozí indukční léčbě bortezomibovým režimem v uspokojivé hematologické remisi, a zatím jsou v potransplantační fázi sledováni poměrně krátkou dobu (10, resp. 12 měsíců). V potransplantačním období došlo k další úpravě sérových hladin dusíkatých katabolitů a u jednoho z nemocných též k úplné normalizaci sérového kreatininu, byť s přetrváváním mírně snížené glomerulární filtrace.
Naše hodnocení patří k celosvětově pilotním pracím hodnotícím indukční léčbu bortezomibem u nemocných s LCDD. Přes malý počet pacientů a různou klinickou manifestaci byli všichni léčeni obdobným terapeutickým režimem s obdobnými výsledky. Cílem bylo poukázat na úskalí diagnostiky této vzácné jednotky a současně zohlednit současné terapeutické možnosti i případné nežádoucí účinky s použitím jednoho z nových působků s biologickým mechanizmem účinku, bortezomibu.
Závěr
Z předložené práce vyplývá, že léčba bortezomibem je rychlá, efektivní a vede k hluboké hematologické remisi, je však nutno použít méně intenzivní režimy a pokud možno léčit dostatečně dlouho k zajištění dlouhodobé léčebné odezvy. Rizika vyplývající z bortezomibového režimu zahrnují především vznik či prohloubení periferní neuropatie a případně zažívací diskomfort. Orgánová léčebná odezva se významně opožďuje za hematologickou odezvou a zůstává i nadále otázkou, zdali je postižení tkání depozity lehkých řetězců plně reverzibilní.
Sdělení bylo zpracováno za podpory grantů: IGA MZ CR NT14393, NT14400, NT 12451–5 a NT 12215–4.
MUDr. et Mgr. Jiří Minařík, Ph.D.
abretina@email.cz
Hemato-onkologická klinika LF UP a FN, Olomouc
www.fnol.cz
Doručeno do redakce 2. 5. 2014
Přijato po recenzi 23. 6. 2014
Zdroje
1. Solomon A, Weiss DT, Herrera GA. Light chain deposition disease In: Mehta J, Singhal S (ed.) Myeloma. 507–518. Martin Dunitz: London 2002. ISBN 9781901865509
2. Ronco P, Plaisier E, Mougenot B et al. Immunoglobulin light (heavy)-chain deposition disease: from molecular medicine to pathology-driven therapy. Clin J Am Soc Nephrol 2006; 1(6): 1342–1350.
3. Heilman HR, Velosa JA, Holley KE et al. Long term follow-up and response to chemotherapy in patients with light chain deposition disease. Am J Kidney Dis 1992; 20(1): 34–41.
4. Hassoun H, Flombaun C, D’Agati VD et al. High-dose melphalan and auto-SCT in patients with monoclonal Ig deposition disease. Bone Marrow Transplant 2008; 42(6): 405–412.
5. Weichman K, Dember LM, Prokaeva T et al. Clinical and molecular characteristics of patients with non-amyloid light chain deposition disorders, and outcome following treatment with high dose melphalan and autologous stem cell transplantation. Bone Marrow Transplant 2006; 38(5): 339–343.
6. Iskandar SS, Falk RJ, Jenette JC. Clinical and pathologic features of fibrillary glomerulonephritis. Kidney Int 1992; 42(6): 1401–1407.
7. Sundaram S, Mainali R, Norfolk ER et al. Fibrillary Glomerulopathy Secondary to Light Chain Deposition Disease in a Patient with Monoclonal Gammopathy. Ann Clin Lab Sci 2007; 37(4): 370–374.
8. Kaplan B, Martin BM, Livneh A et al. Biochemical subtyping of amyloid in formalin-fixed tissue samples confirms and supplements immunohistologic data. Am J Clin Pathol 2004; 121(6): 794–800.
9. Howie AJ. Handbook of Renal Biopsy Pathology. 2nd ed. Springer: Berlin 2007. ISBN 9780387746043.
10. Hájek R, Adam Z, Ščudla V et al (Česká myelomová skupina). Diagnostika a léčba mnohočetného myelomu. Transf Hematol Dnes 2012; 18(Suppl 1): 1S-89S.
11. Ščudla V, Tichý T, Minařík J et al. Onemocnění z depozice lehkých řetězců imunoglobulinu (light chain deposition disease). Klin Biochem Metab 2012; 20(41): 52–58.
12. Kastritis E, Migkou M, Gavriatopoulou M et al. Treatment of light chain deposition disease with bortezomib and dexamethasone. Haematologica 2008; 94(2): 300–302.
13. Kaposztas Z, Kahan BD, Katz SM et al. Bortezomib successfully reverses early recurrence of light-chain deposition disease in a renal allograft: a case report. Transplant Proc 2009; 41(10): 4407–4410.
14. Gasparetto C, Sanchorawala V, Snyder RM et al. Use of melphalan (M)/dexamethasone (D)/bortezomib in AL amyloidosis. J Clin Oncol 2010; 28(Suppl): 579S. Abstr 8024.
15. Gharwan H, Truica C. Bortezomib-based chemotherapy for light chain deposition disease presenting as acute renal failure. Med Oncol 2012; 29(2): 1197–1201.
16. Adam Z, Nedbálková M, Krejčí M et al. Více než 10 let trvání kompletní remise monoklonální gamapatie nejistého významu a vymizení nefrotického syndromu vzniklého na podkladě light chain deposition disease po léčbě vinkristinem, adriamycinem a vysokými dávkami dexametazonu (VAD). Vnitř Lék 2010; 56(3): 240–246.
17. Minarik J, Scudla V, Tichy T et al. Induction treatment of light chain deposition disease with bortezomib: rapid hematological response with persistence of renal involvement. Leuk Lymphoma 2012; 53(2): 330–331.
18. Ščudla V, Minařík J, Pika T Nemoc z ukládání lehkých řetězců imunoglobulinu (light chain deposition disease). Vnitř Lék 2012; 58(1): 38–41.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 10- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let – editorial
- Czech TAVI Registry. Potrebujeme registre? – editorial
- Léčba obezity u osob s diabetem 2. typu – editorial
- Léčba bortezomibem u pacientů s onemocněním z depozice lehkých řetězců imunoglobulinu
- Infekční endokarditidy v okrese Tábor v letech 2009–2013
- Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let
- Uživatelské výstupy z národního registru katetrových implantací aortální chlopně (Czech TAVI Registry): možnosti analytických výstupů založených na databázovém systému TrialDB2
- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Plicní hypertenze – patofyziologické mechanizmy
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Asociace aterotrombózy a trombofilie – genetické aspekty
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Dna a kardiovaskulární riziko
- Jak se mění možnosti léčby obézních diabetiků 2. typu
- Aktualizované stanovisko České společnosti pro hypertenzi k provádění renálních denervací u rezistentní hypertenze
- Jiří Gallo. Osteoartróza. Průvodce pro každodenní praxi.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Terapeutické monitorování vankomycinu v rutinní klinické praxi
- Optimální způsob podání vysokodávkového i.v. furosemidu – kontinuálně nebo bolusově?
- Monoklonální gamapatie nejistého významu a asymptomatický mnohočetný myelom z pohledu roku 2014
- Dna a kardiovaskulární riziko
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



