-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Embolizační ischemické cévní mozkové příhody
Embolic ischemic strokes
Treatment of acute phase of ischemic stroke is aimed to limit the amount of damage using reperfusion strategy and subsequently administration of treatment providing pharmacological secondary prevention of recurrence. The early aetiology diagnosis of stroke is crucial for effective secondary prevention as the highest risk of recurrence is within few weeks after stroke. Exclusion of cardiac and vascular source of embolism by imaging methods is an important part in management of patients with ischemic stroke. These embolic sources are categorized as high risk and states are associated with moderate or unclear risk.
Key words:
acute phase of ischemic stroke – cause of ischemic stroke – reperfusion strategy – secondary prevention of recurrence – vascular and cardiac source of embolism
Autoři: Martin Hutyra 1; Daniel Šaňák 2
Působiště autorů: I. interní klinika – kardiologická LF UP a FN Olomouc, přednosta prof. MUDr. Miloš Táborský, CSc., FESC, MBA 1; Neurologická klinika LF UP a FN Olomouc, přednosta prof. MUDr. Petr Kaňovský, CSc. 2
Vyšlo v časopise: Vnitř Lék 2014; 60(12): 1040-1049
Kategorie: 70. narozeniny prof. MUDr. Michaela Aschermanna, DrSc., FESC, FACC
Souhrn
Terapie akutní fáze ischemické cévní mozkové příhody (CMP) je zaměřena jednak bezprostředně na omezení rozsahu poškození pomocí co možná nejčasněji zahájené reperfuzní strategie a dále nastavení léčby zajišťující farmakologickou sekundární prevenci recidivy onemocnění. Klíčový předpoklad správné a efektivní sekundární prevence představuje včasné stanovení příčiny ischemického iktu, protože riziko recidivy iktu je nejvyšší v prvních týdnech po prodělané CMP. Nedílnou součástí managementu pacienta s ischemickým iktem je tedy vyloučení potenciálních kardiálních a cévních zdrojů embolizace do mozkové cirkulace pomocí zobrazovacích metod. Tyto embolizační zdroje jsou kategorizovány na vysoce rizikové stavy a stavy spojené se středním nebo nejasným rizikem.
Klíčová slova:
akutní fáze ischemické cévní mozkové příhody – kardiální a cévní zdroje embolizace – příčina ioschemického iktu – reperfuzní strategie – sekundární prevence recidivy onemocněníÚvod
Klíčový předpoklad správné a efektivní sekundární prevence představuje včasné stanovení příčiny ischemického iktu, neboť riziko recidivy iktu je nejvyšší v prvních týdnech po prodělané cévní mozkové příhodě (CMP).
Terapie akutní fáze ischemické cévní mozkové příhody je zaměřena jednak bezprostředně na omezení rozsahu poškození pomocí co možná nejčasněji zahájené reperfuzní strategie, a dále nastavení léčby zajišťující farmakologickou sekundární prevenci recidivy onemocnění. Nedílnou součástí managementu pacienta s ischemickým iktem je vyloučení potenciálních kardiálních a cévních zdrojů embolizace do mozkové cirkulace [1,2]. Dostupná data z literární evidence publikované na toto téma umožňují alespoň základní kategorizaci možných embolizačních zdrojů na vysoce rizikové stavy a stavy spojené se středním nebo nejasným rizikem (tab. 1) [3,4].
Tab. 1. Embolizační příčiny iktu 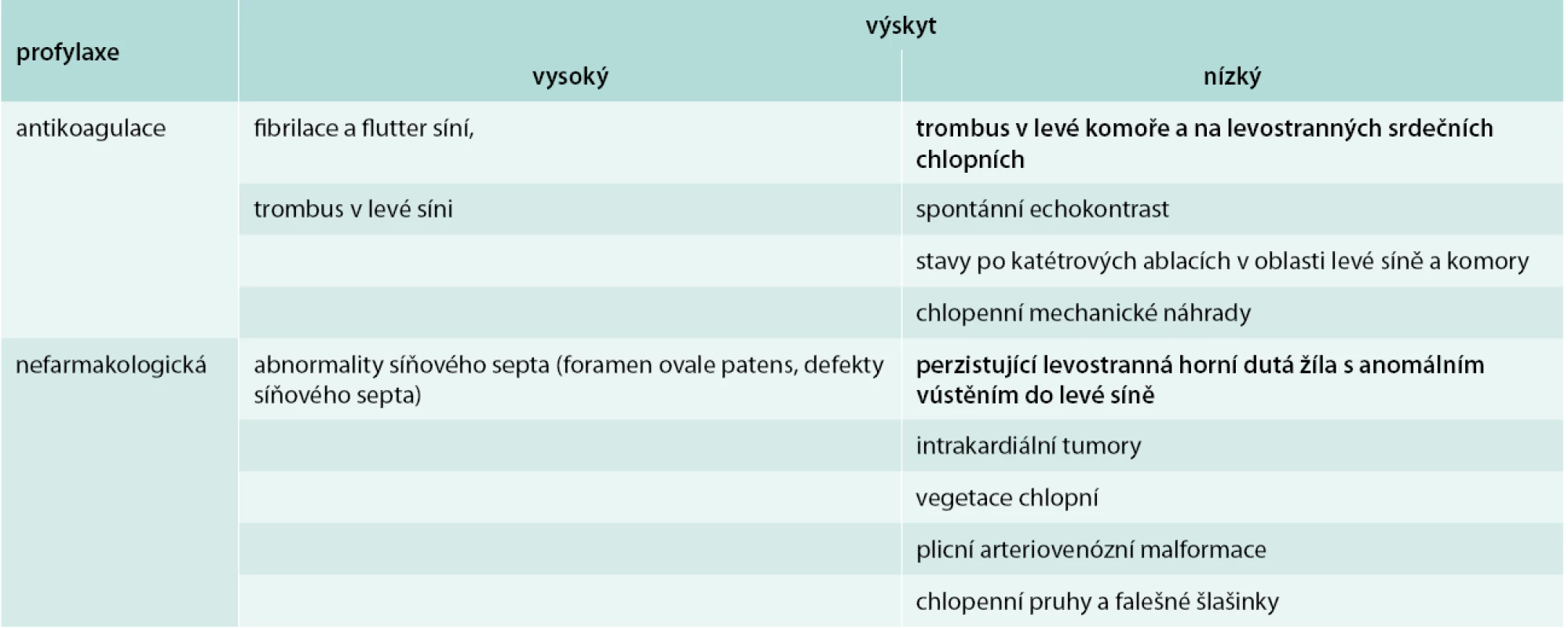
Trombus v levé síni
(výskyt: vysoký, rizikovost: vysoká, profylaxe: farmakologická)
Fibrilace síní (FiS) je nejfrekventnější porucha srdečního rytmu s exponenciálně se zvyšujícím výskytem ve starších věkových kategoriích a u jedinců s organickým srdečním onemocněním (obr. 1). Prevalence fibrilace síní v neselektovaném populačním vzorku se odhaduje v širokém rozmezí 1–6 % a exponenciálně narůstá s věkem. V 7. decéniu fibrilace síní postihuje 5 % populace a ve věku nad 80 let 10 % populace. Více než 2/3 nemocných jsou distribuovány ve věkovém rozmezí 65–85 let a medián věku nemocných s FiS je 75 let. Fibrilace síní častěji postihuje muže než ženy, nicméně muži tvoří asi 1/2 všech nemocných s fibrilací síní v důsledku jejich kratší průměrné délky života. Flutter síní je síňová arytmie s věkově závislou incidencí, která kolísá od 0,005 % u jedinců mladších 50 let do 0,59 % u subjektů nad 80 let. Tato arytmie je 2,5krát častější u mužů než u žen a vyskytuje se častěji u jedinců s organickým srdečním onemocněním a chronickou obstrukční plicní nemocí. Je důležité zdůraznit, že paroxyzmální a permanentní formy fibrilace, resp. flutteru síní mají z hlediska rizikovosti ve vztahu k formaci trombu v levé aurikule a levé síni, a tedy ke klinickým tromboembolickým komplikacím velmi podobný potenciál.
Obr. 1. EKG obraz fibrilace síní 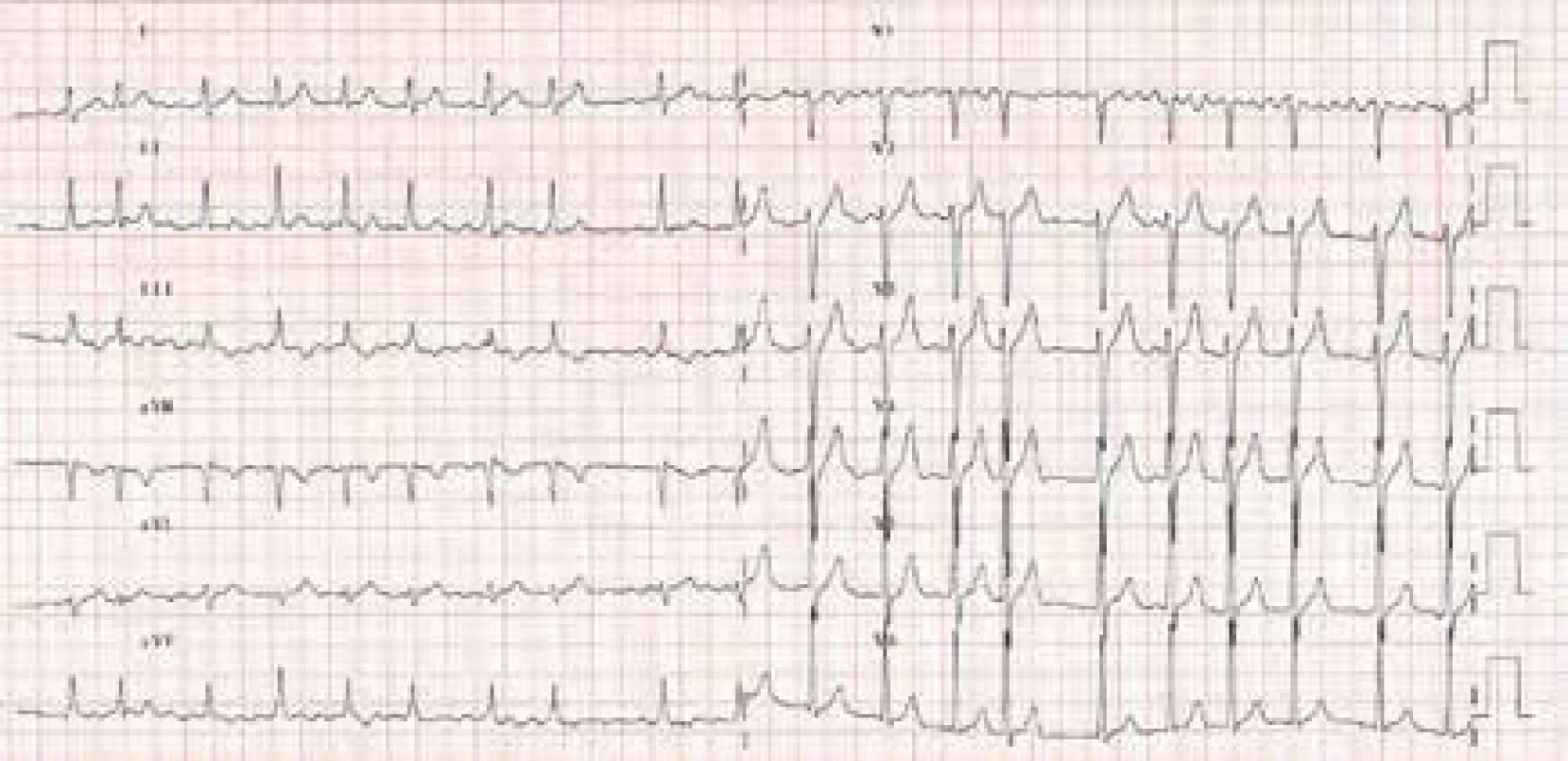
Vztah mezi fibrilací síní a rizikem ischemických cévních mozkových příhod, které představují přibližně 85 % všech tromboembolických komplikací fibrilace síní, je jednoznačně prokázaný již dlouhou dobu. Fibrilace síní je považována za příčinu 16 % všech ischemických cévních mozkových příhod a u 10 % (tedy více než 2/3) takto symptomatických jedinců je nalézán trombus v levé síni. Fibrilace síní, ať permanentní nebo paroxyzmální, je příčinou téměř 80 % všech kardioembolizačních CMP. FiS je sdružena s 5krát vyšším rizikem vzniku CMP, s 2krát vyšším rizikem úmrtí (pro CMP a srdeční selhání) a se zvýšeným rizikem vaskulárního kognitivního deficitu (pro CMP a postižení malých tepen) ve srovnání se zdravými kontrolami. Ischemické ikty způsobené FiS jsou sdruženy s těžším neurologickým postižením a častěji končí fatálně ve srovnání s jinými příčinami iktu. Důvodem jsou častější uzávěry hlavních mozkových tepen a fakt, že pacienti s iktem způsobeným FiS jsou starší a mají další významné komorbidity. Riziko vzniku CMP u pacientů s FiS progresivně narůstá s věkem a pohybuje se mezi 1–5 % u osob věku 50–59 let, zatímco u osob nad 80 let je to již 23–25 %. Roční riziko vzniku iktu u pacientů se samotnou FiS se pohybuje okolo 2 %, zatímco v případě přítomnosti dalších rizikových faktorů je to více než 10 %. Největším rizikovým faktorem je předchozí CMP/TIA (relativní riziko – RR 2,5), vyšší věk (RR 1,4 a zvyšující se o 1,3–1,6 o dekádu), hypertenze (RR 1,9), systolický TK > 160 mm Hg (RR 1,4) a diabetes (RR 1,7).
Roční výskyt tromboembolických komplikací u pacientů s fibrilací síní bez profylaxe tromboembolických příhod je průměrně 6 % (rozsah 2,9–12,3 %/rok). Metaanalýza výsledků studií zaměřených na redukci rizika výskytu ischemických iktů pomocí antikoagulační léčby prokázala 62% snížení relativního rizika tromboembolických příhod s redukcí absolutního rizika o 2,7 % u primární prevence a o 8,4 % u sekundární prevence. Počet nemocných, které je nutné léčit k prevenci jedné tromboembolické příhody po korekci na výskyt mozkových krvácení, je 37 %. V klinické praxi se závažnější krvácení po warfarinu vyskytuje u 3–5 % léčených s roční incidencí 0,4 % za 1 rok.
K rozhodnutí o zahájení, typu, intenzitě profylaxe nebo léčby tromboembolických komplikací fibrilace nebo flutteru síní je nutné zvážení poměru riziko/benefit nasazené terapie. Je nutné zhodnocení rizikovosti samotné arytmie z hlediska rozvoje tromboembolických komplikací, náchylnosti pacienta ke krvácivým komplikacím a zejména jeho předpokládané spolupráci a kompliance k léčbě. Aby toto rozhodnutí nebylo pouze intuitivní, máme k dispozici skórovací systémy, které pomohou kvantifikovat riziko tromboembolických a tendenci ke krvácivým komplikacím. CHA2DS2VASc skóre (tab. 2) je jednoduchým dobře zavedeným systémem umožňujícím odhad rizika tromboembolických komplikací u pacientů s fibrilací síní. Jednotlivá akronyma označují bodovou váhu rizikového faktoru, které se sčítají do výsledného odhadu rizika tromboembolizmu.
Tab. 2. Odhad rizika tromboembolických komplikací pomocí CHA2DS2-VASc skóre 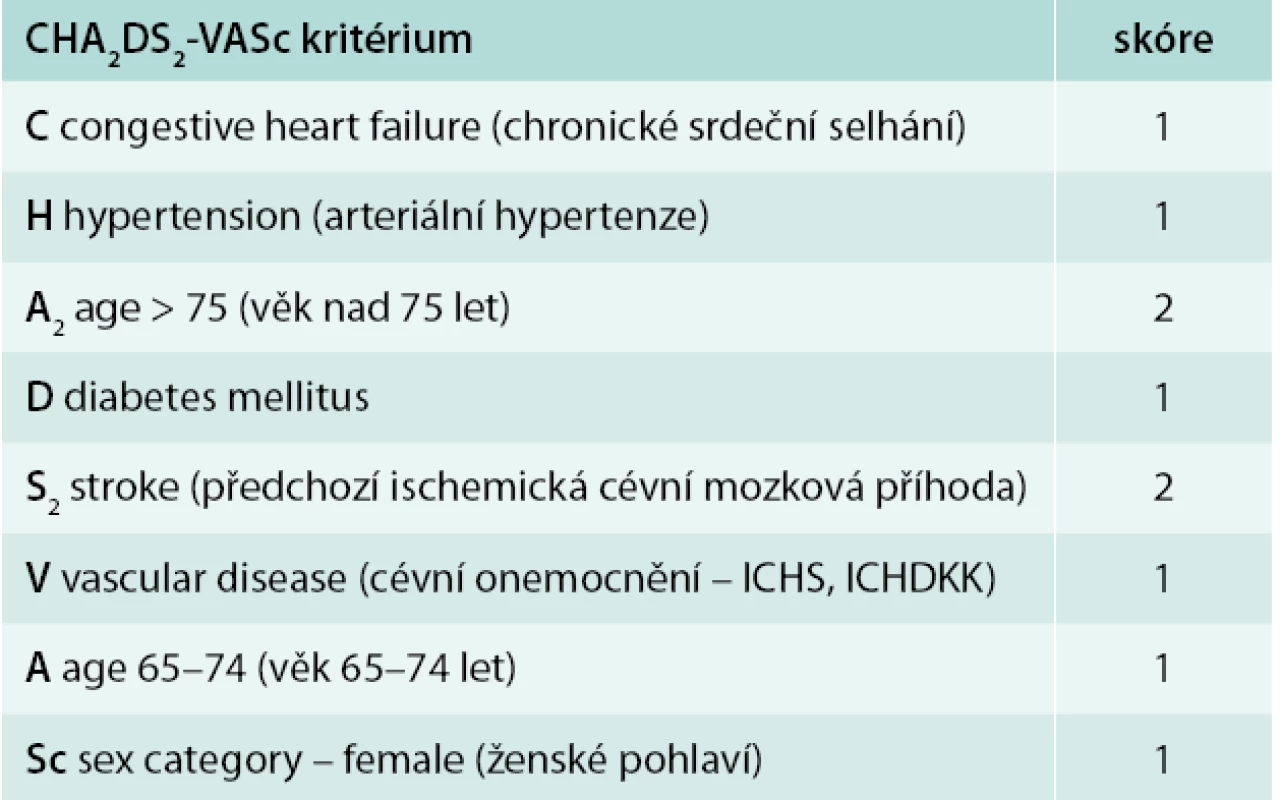
Pro pacienty s CHA2DS2VASc skóre ≥ 2 je jednoznačně při absenci kontraindikací preferována antikoagulační léčba. Pacienti se skóre 1 profitují z antikoagulační léčby a pouze u skupiny jedinců se skóre 0 preferujeme nepodání antitrombotické profylaxe. Nedílnou součástí indikace a typu profylaxe tromboembolické příhody je zvážení kompliance pacienta a rizika krvácivých komplikací, které mohou v budoucnosti nastat.
Přibližně u 20 % pacientů s nutností použití antikoagulační terapie je tato léčba relativně kontraindikována, zejména z důvodu nepřiměřeně vysokého rizika krvácivých komplikací (např. 0,5% riziko mozkové hemoragie) nebo pro jejich předpokládanou špatnou komplianci. Z výsledků registrů vyplývá, že až 1/2 pacientů, zejména s vyšším, a tedy z hlediska predikce ischemických příhod rizikovějším CHADS2 skóre, nejsou z různých důvodů léčeni antikoagulancii. Navíc standardem antikoagulační terapie je v současnosti warfarin s relativně velmi úzkým terapeutickým oknem v rozmezí INR (international normalized ratio) 2–3. Bohužel hodnoty INR > 3 (a zejména > 5) jsou spojeny s exponenciálním nárůstem rizika závažných krvácivých komplikací, v krajním případě s možným vitálním ohrožením pacienta.
Transezofageální echokardiografie (TEE) představuje v porovnání s transtorakálním způsobem vyšetření zobrazovací metodu s vysokou senzitivitou ve vztahu k vyloučení kardioembolizačních příčin ischemického iktu. Vedle trombu v levé síni (obr. 2) a aurikule, k jehož vyloučení je TEE metodou zlatého standardu, řadíme k dalším strukturálním abnormalitám s nezávislým prediktivním vztahem k riziku systémové embolizace při fibrilací síní také systolickou dysfunkci levé komory (EF LK < 35 %), spontánní echokontrast v levostranných srdečních oddílech, redukovanou výdejovou rychlost levé aurikuly (< 20 cm/s) (obr. 3), komplexní aterosklerotické změny ascendentní aorty a kalcifikace levostranných srdečních chlopní.
Obr. 2. Trombus v oušku levé síně 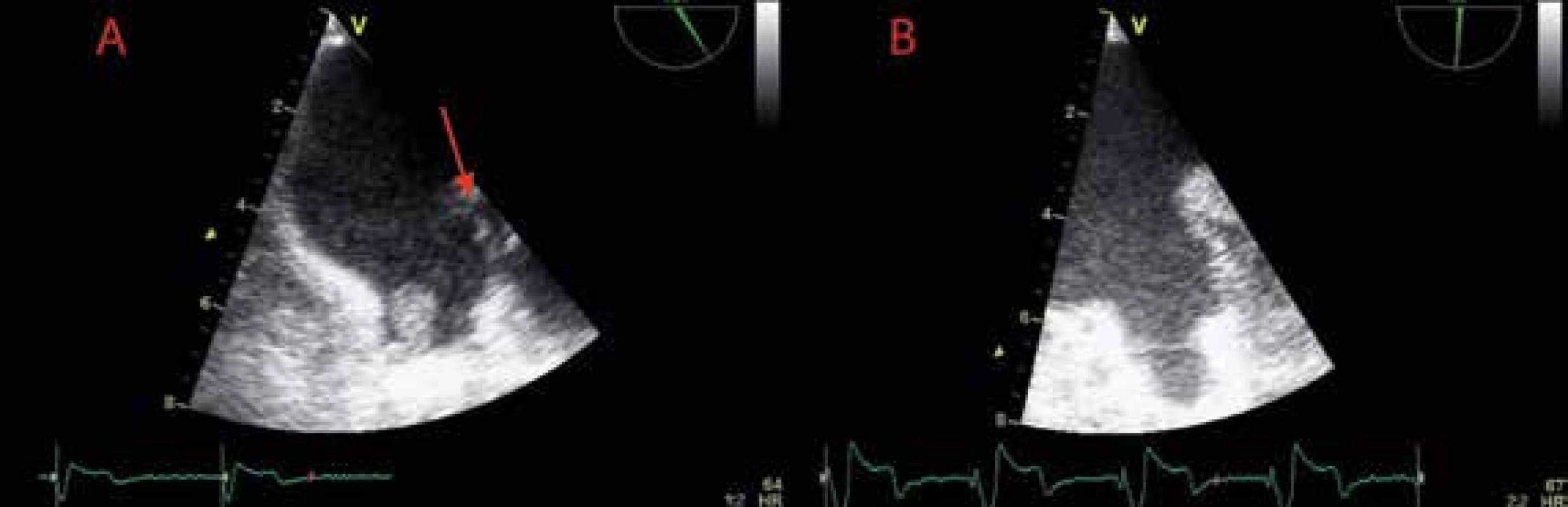
A Trombus v oušku levé síně těsně po zahájení antikoagulační terapie B Rezoluce trombu v oušku levé síně při antikoagulační terapii s reziduálním spontánním echokontrastem v levé síni vycházejícím z levé aurikuly Obr. 3. Redukované a kolísající (10–30 cm/s) výdejové rychlosti levé aurikuly při fibrilaci síní 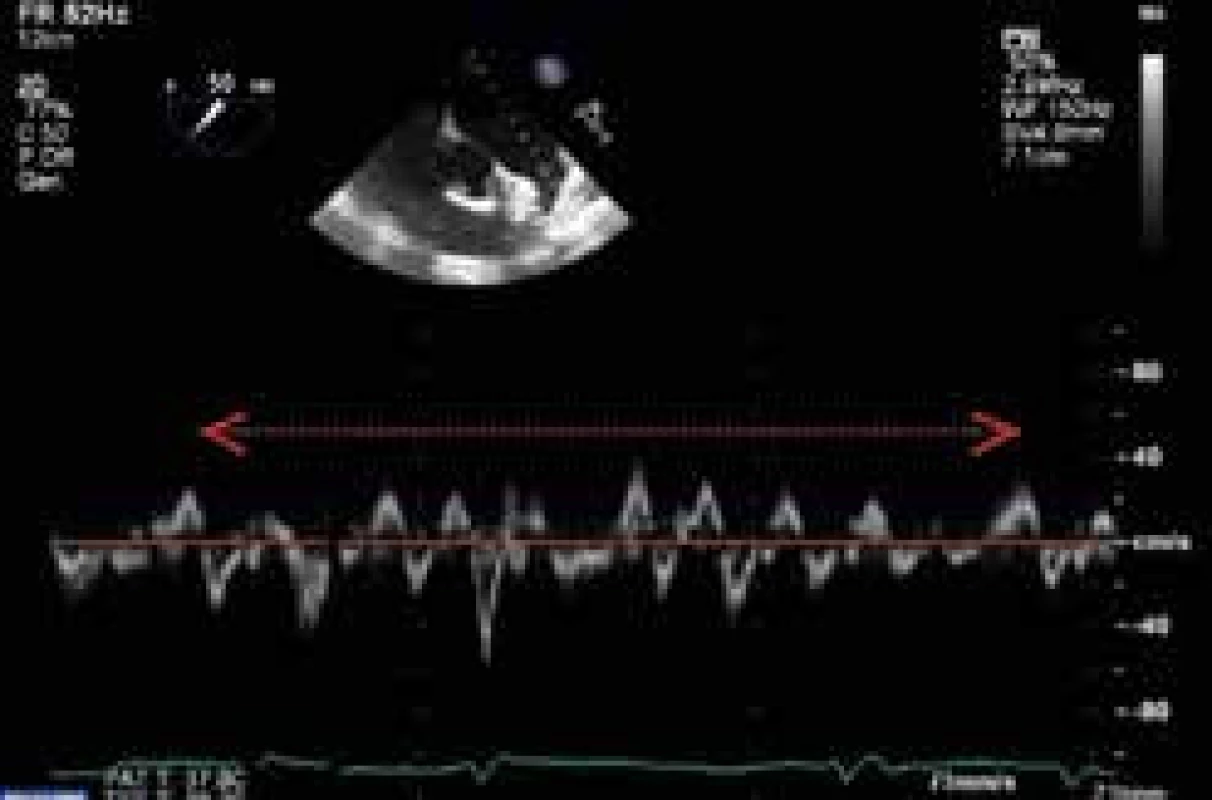
Vzhledem k faktu, že nejčastějším místem vzniku trombu je při vzniku fibrilace síní ouško levé síně (90 % síňových trombů), nepřekvapuje, že byly vyvinuty operační techniky odstraňující levou aurikulu při jiné operaci srdce. Dále byly vyvinuty okluzní systémy levé aurikuly, které endovaskulární technikou umožňují uzavření této struktury. Mechanické okluzní systémy je možné indikovat u pacientů s nevalvulární fibrilací síní ve vysokém riziku tromboembolických komplikací a kontraindikací antikoagulační terapie, u kterých by tato alternativa měla být minimálně stejně efektní v porovnání s warfarinem [5–16].
Tromby v levé komoře a na levostranných srdečních chlopních
(výskyt: nízký, rizikovost: vysoká, profylaxe: farmakologická a operační)
Ruptura volné stěny levé komory představuje mechanickou komplikaci akutního infarktu myokardu s dramatickou prognózou a vyskytuje se přibližně u 1–6 % všech případů akutních infarktů myokardu (IM). Udává se, že je příčinou úmrtí u 7–20 % fatálních IM. Vzhledem k faktu, že většina uvedených údajů pochází z doby, v níž byla léčba akutního IM převážně farmakologická, lze předpokládat celkově nižší výskyt této mechanické komplikace IM. Ačkoliv klinický obraz je většinou velmi dramatický, v některých případech nedojde k vývoji akutní srdeční tamponády a ruptura srdeční stěny je kryta okolním perikardem, částečně jizevnatou tkání nebo trombem a výsledkem je vytvoření pseudoaneuryzmatu komunikujícího s dutinou levé srdeční komory. Stěna pseudoaneuryzmatu tedy není na rozdíl od pravého aneuryzmatu tvořena myokardem nebo jizvou, ale okolními tkáněmi. Jedná se o velmi vzácnou komplikaci, jejíž výskyt je uváděn přibližně 0,2 % mezi všemi pacienty s AIM. Nejčastější formou klinické manifestace pseudoaneuryzmatu jsou příznaky srdečního selhání (36 %), dále bolesti na hrudi (30 %) a námahová dušnost (20 %). Náhlá smrt je prvním symptomem asi ve 3 % případů a pouze asi 12 % pacientů je v době diagnózy asymptomatických. Mezi vzácnější klinické projevy patří srdeční arytmie nebo cévní mozková příhoda při systémové embolizaci. Většina pacientů je přijímána k hospitalizaci během 3–80 dnů po předcházejícím akutním infarktu myokardu. Riziko ruptury již diagnostikovaného pseudoaneuryzmatu přesahuje 45 %, přičemž mortalita jedinců indikovaných k operačnímu řešení nepřesahuje 10 % v porovnání se 48% mortalitou léčených konzervativně. U 1–2,5 % pacientů s akutním infarktem dochází k systémové embolizaci do mozkové cirkulace v důsledku formace trombu (obr. 4) během 1 měsíce, přičemž u 1/2 pacientů k této komplikaci dochází v prvních 5 dnech a riziko roste v závislosti na míře regionální a globální systolické dysfunkce levé komory.
Obr. 4. Trombus v dutině levé komory 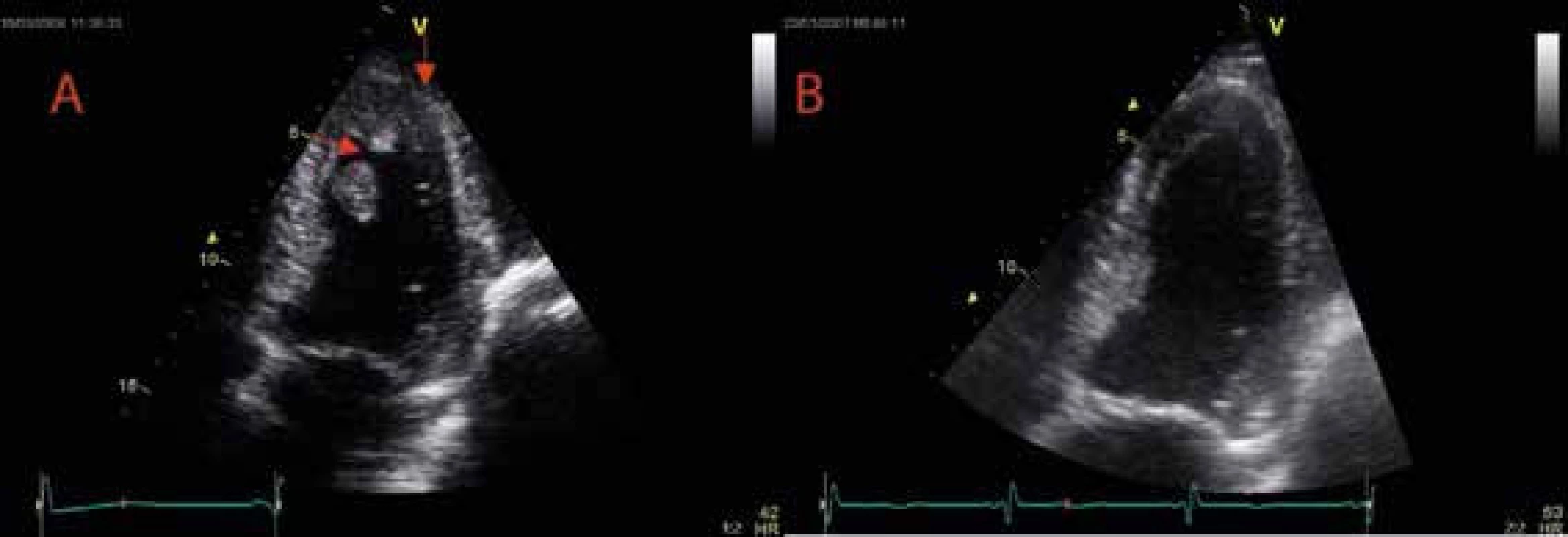
A Trombus v dutině levé komory před antikoagulační terapií. B Kompletní rezoluce trombu po ukončení antikoagulační terapie u pacienta po kardioembolizační cévní mozkové příhodě komplikující akutní infarkt myokardu přední stěny. V apikální 4dutinové projekci je patrný mobilní trombus apikoseptálně a menší trombus apikálně (šipky). Při antikoagulační terapii dochází ke kompletní rezoluci obou trombů. Termínem aneuryzma levé komory srdeční (LK) je popisováno dyskinetické vyklenutí LK s širokým vstupním kanálem, jehož stěna je tvořena endokardem, myokardem a epikardem, na rozdíl od pseudoaneuryzmatu, které vzniká v důsledku perikardem a nástěnným trombem kryté ruptury volné stěny LK s následnou perikarditidou (obr. 5 a obr. 6).
Obr. 5. Parciálně trombotizované pseudoaneuryzma posterolaterální stěny levé komory – echokardiografie 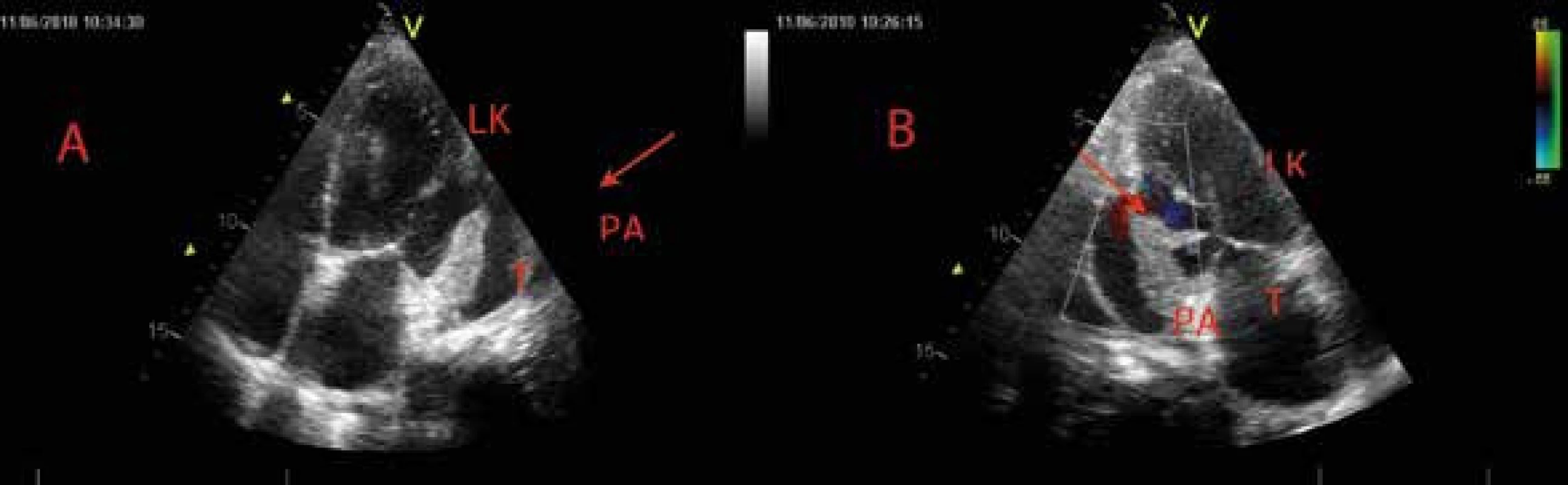
A V apikální 4dutinové projekci je patrná ruptura stěny LK na hranici bazálního a středního segmentu anterolaterální stěny. Trhlina označená šipkou směřuje do pseudoaneuryzmatu se suspektním trombem (hyperechogenní apozice na stěně bazálního segmentu LK v porovnání s jinou echogenitou stěny apikolaterálního segmentu). B V apikální 2dutinové projekci je v barevném dopplerovském mapování patrný pulzující tok. LK – levá komora PA – pseudoaneuryzma T – trombus Obr. 6. Parciálně trombotizované pseudoaneuryzma posterolaterální stěny levé komory – magnetická rezonance srdce 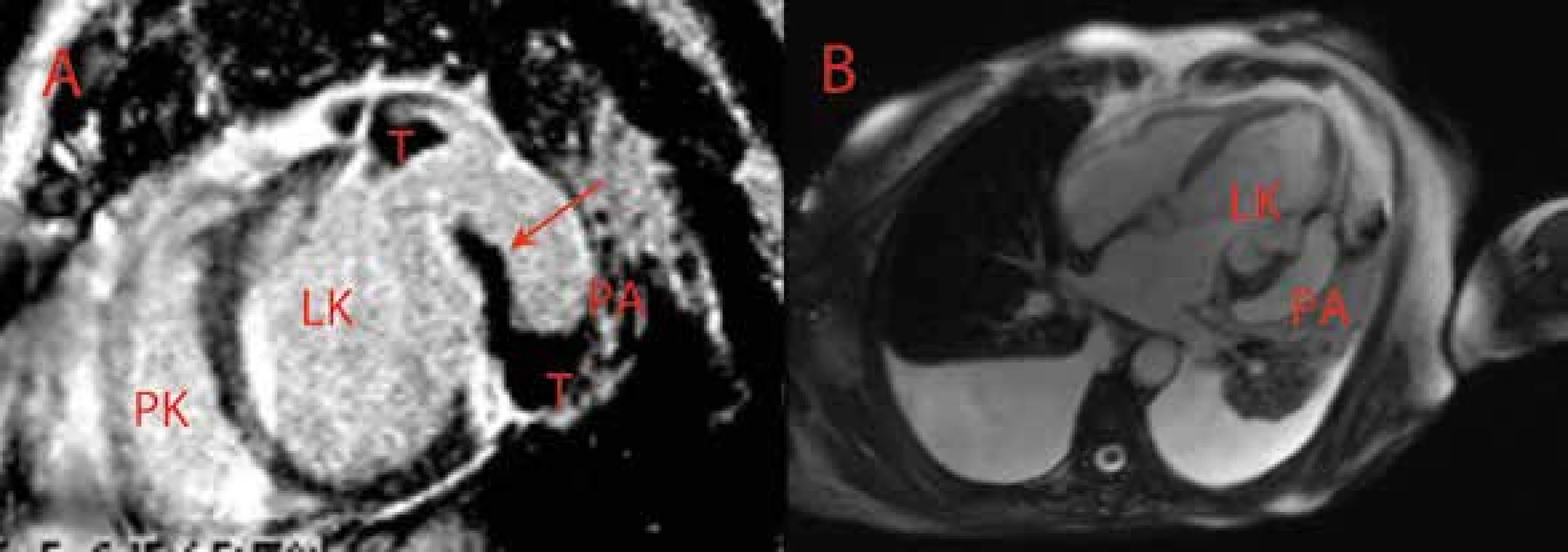
A Projekce na horizontální dlouhou osu LK B Projekce na krátkou osu LK V projekci v rekonstruované sekvenci PSIR-TrueFisp 2D s použitím kontrastní látky (Gadovist) je šipkou označená dyskontinuita stěny – ruptura v rozsahu asi 10 mm – lokalizovaná posterolaterálně s rozvojem pseudoaneuryzmatu. V kinetických sekvencích je patrná dyskineza ztenčené posterolaterální stěny. Dále je evidentní transmurální postkontrastní sycení (fenomén delayed enhancement) v celém rozsahu posterolaterální a posterobazální stěny odpovídající jizvě a uvnitř pseudoaneuryzmatu je evidentní trombus. V perikardiálním vaku je přítomno minimální množství tekutiny a oboustranně jsou patrné fluidotoraxy. LK – levá komora PA – pseudoaneuryzma PK – pravá komora T – trombus Akinetické nebo těžce hypokinetické segmenty LK bez vstupního krčku se vyskytují relativně velmi často po prodělaném IM nebo v případě kardiomyopatií a jsou popisovány jako regionální poruchy kinetiky s následným rozvojem systolické dysfunkce LK. Pacienti se systolickou dysfunkcí levé komory jsou ve zvýšeném riziku formace trombu v dutině levé komory. Na základě výsledku metaanalýzy lze předpokládat výskyt CMP u 1,8 % nemocných během 1 roku a u 4,7 % během 5 let. Relativní riziko výskytu CMP je u jedinců s chronickým srdečním selháním zvýšeno 2–3krát a srdeční selhání je prediktorem nepříznivého průběhu hospitalizace pro CMP. Klinicky silentní mozkové embolizace se vyskytují až u 40 % jedinců s chronickým srdečním selháním. Retrospektivní studie Fustera prokázala 18% výskyt tromboembolických příhod u jedinců s dilatační kardiomyopatií, kteří nebyli antikoagulováni, v porovnání s nulovým výskytem u jedinců léčených antikoagulancii. Jiná prospektivní studie prokázala pouze 3% výskyt klinické příhody arteriální embolizace u skupiny 264 čekatelů srdeční transplantace s ejekční frakcí levé komory < 20 % během průměrné doby sledování 1 roku. Výskyt komorového trombu diagnostikovaného pomocí zobrazení magnetickou rezonancí je podle výsledku recentní studie u neselektované populace pacientů s ischemickou kardiomyopatií a systolickou dysfunkcí (EF LK < 50 %) 7 %. Trombus v levé komoře se vyskytuje zejména u jedinců se závažnějším postižením systolické funkce levé komory (EF LK < 30 %) a po předchozím prodělaném infarktu myokardu. Předchozí ischemická cévní mozková příhoda je u této populace udávána ve 12 %. Specifickými skupinami onemocnění srdce se zvýšeným rizikem formace trombu jsou tzv. non-companion kardiomyopatie, restriktivní kardiomyopatie a Löfflerova endokarditida.
Základní diagnostickou metodou je echokardiografie, pomocí které je ve většině případů pseudoaneuryzmat levé komory detekována perikardiální separace > 5 mm, vzácněji je možné přímo vizualizovat trhlinu ve volné stěně LK. Definitivní potvrzení diagnózy přinese výpočetní tomografie nebo kontrastní magnetická rezonance srdce.
Při zobrazení aneuryzmatu je v kinematických sekvencích v 2rozměrném zobrazení patrný objemný vakovitý dyskinetický útvar lokalizovaný v oblasti předchozího prodělaného infarktu myokardu s širokým vstupním kanálem a v případě optimální vyšetřitelnosti i s nasedajícím hyperechogenním trombem. Kontrastní magnetická rezonance srdce přinese většinou jednoznačný výsledek v podobě morfologického zobrazení aneuryzmatického vaku. Dále je evidentní lokalizace a rozsah tzv. postkontrastního sycení myokardu (fenomén delayed enhancement – korelát přímého zobrazení neviabilní tkáně myokardu – jizvy) většinou v celém rozsahu stěny aneuryzmatu.
Regionální poruchy kinetiky a hodnocení globální systolické funkce LK jsou většinou dosažitelné z klasického 2rozměrného zobrazení transtorakální echokardiografie, pomocí které lze v ideálním případě zobrazit i trombus. Pokud není vyšetřitelnost dutiny levé komory optimální, lze použít echokontrastní látky s průnikem přes plicní řečiště do dutin levostranných srdečních oddílů, pomocí které dosáhneme opacifikace zobrazených dutin. Tato metoda přináší jednoznačně přesnější výsledky v porovnání s nativní echokardiografií z hlediska predikce přítomnosti trombu v dutině levé komory.
V případě průkazu trombu v dutině levé komory u jednotlivých specifických onemocnění je samozřejmě indikována antikoagulační terapie s terapeutickým cílem INR 2–3 s pravidelnými kontrolami úrovně antikoagulace a stavu intrakavitálního trombu. Neexistuje jednoznačný konsenzus ohledně trvání antikoagulační terapie, která by měla pokračovat minimálně do kompletní rezoluce trombu, optimálně do regrese základního srdečního onemocnění, které predisponuje k formaci trombu. Antikoagulační terapie není indikována u jedinců se systolickou dysfunkcí levé komory bez současného průkazu komorového trombu nebo fibrilace síní. Optimální je samozřejmě kauzální léčba základního onemocnění komory, např. revaskularizace myokardu u ischemické kardiomyopatie s průkazem viability myokardu nebo biologická léčba Löfflerovy endokarditidy. Chirurgická terapie je indikována u pseudoaneuryzmat LK s adekvátním ovlivněním prognózy pacienta [17–19].
Paradoxní embolie přes abnormality síňového septa
(výskyt: nízký, rizikovost: pravděpodobně nízká, profylaxe: nefarmakologická)
Patentní foramen ovale (PFO), je fyziologická varianta charakterizovaná přítomností minimálního zkratového toku mezi laminami síňového septa s výskytem u 17–27 % neselektované populace s postupným poklesem prevalence ve vyšších věkových kategoriích (obr. 7). Jedná se o drobný kanál variabilního tvaru, který je lokalizován mezi laminami síňového septa primum a secundum. Tato remnantní struktura v embryonálním životě umožňovala extrapulmonální průtok arteriální krve z v. cava inferior přímo do levostranných srdečních oddílů a následně do systémového oběhu. Z funkčního hlediska je PFO za normální situace neprůchodné nebo je provázeno většinou hemodynamicky nevýznamným levo-pravým zkratovým tokem, který nemusí být konstantní. V určitých situacích je tok přes PFO bidirekční, přičemž za předpokladu trvalého (prekapilární formy plicní hypertenze) nebo přechodného (Valsalvův manévr nebo kašel) zvýšení tlaku v pravé síni dochází ke zvýraznění pravo-levé zkratové složky. Na základě výsledků autoptických analýz a echokardiografických studií se PFO vyskytuje až u 27 % obecné populace.
Obr. 7. Patentní foramen ovale 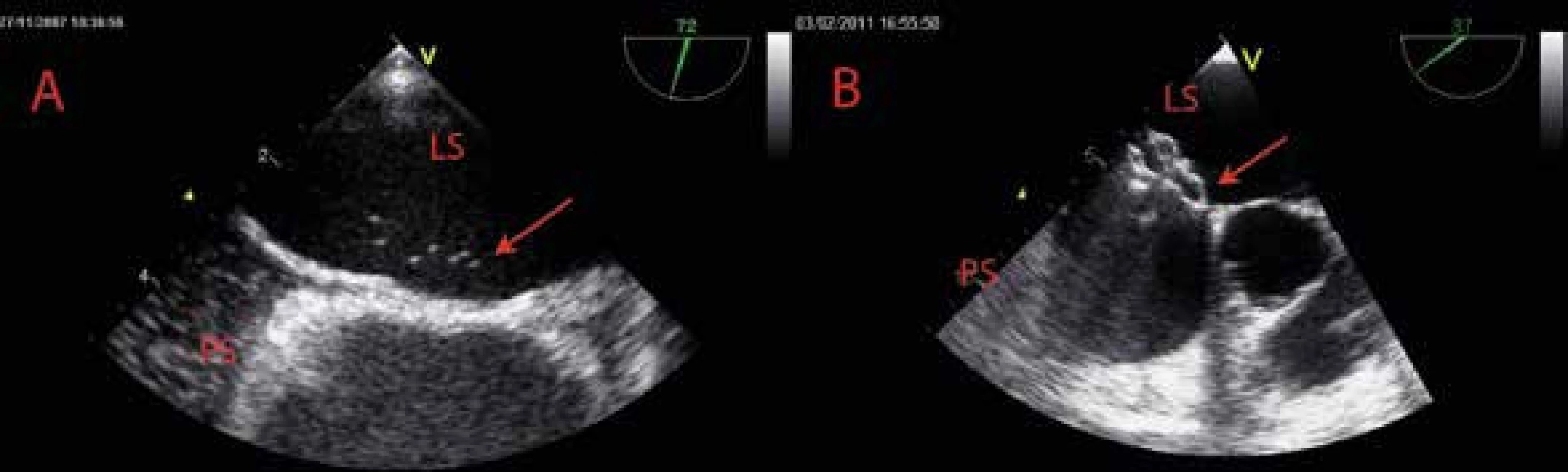
A Patentní foramen ovale s minimálním průnikem 7 mikrobublin echokontrastní látky (šipka) z pravé síně (PS) do levé síně (LS) B TEE-kontrola katetrizačně provedeného uzávěru patentního foramen ovale pomocí Amplatzerova okludéru (šipka) – trakční manévr k ověření stability polohy okludéru na síňovém septu LS – levá síň PS – pravá síň U jedinců s nově diagnostikovanou ischemickou cévní mozkovou příhodou (CMP) je tzv. kryptogenní etiologie (diagnóza per exclusionem bez identifikovatelné intrakardiální trombózy nebo arteriálního zdroje embolizace a bez nálezu onemocnění intrakraniálních mozkových tepen) nalezena až u 50 % pacientů mladších 55 let a zhruba 25 % jedinců s CMP ve všech věkových kategoriích. V dostupné literatuře existuje poměrně rozsáhlá evidence prokazující asociaci kryptogenní CMP s nálezem PFO (OR 3,1) nebo aneuryzmatu síňového septa (OR 6,1) jak v populaci mladších, tak i u starších jedinců. Závěry na toto téma publikovaných observačních studií nejsou zcela jednoznačné. Výše uvedené výsledky však naznačují kauzální vztah mezi vznikem kryptogenní rekurentní CMP a přítomností, morfologií PFO a rozsahem pravo-levého zkratu, zvláště u mladších jedinců mladších 55 let. Základním patogenetickým mechanizmem je paradoxní embolizace z žilního systému přes kanál PFO, jehož morfologie představuje jednu ze zásadních determinant rizika vzniku této ischemické komplikace. Další možností vzniku embolizace do mozkové cirkulace je in situ trombóza přímo v kanále PFO v důsledku krevní stázy nebo hyperkoagulačního stavu. Zásadním předpokladem pro vznik paradoxní embolizace je trvalé nebo přechodné zvýšení tlaku v pravé síni, které umožní transfer trombotických hmot přes PFO. U jedinců s akutní plicní embolií je riziko paradoxní embolizace přes PFO vyšší jednak z důvodu velmi pravděpodobné přítomnosti zdroje embolizace v žilním systému, navíc lze předpokládat, zejména u rozsáhlejších plicních embolií, vznik plicní hypertenze usnadňující průnik tranzientních původně žilních trombů přes PFO do velkého oběhu. Výskyt PFO s pravo-levým zkratem je popisován u 35 % jedinců s akutní plicní embolií. Skupina s prokázaným pravo-levým zkratovým tokem má prokazatelně dvojnásobné riziko hospitalizační mortality (33 % vs 14 %) a více než 5násobně zvýšené riziko ischemické cévní mozkové příhody (13 % vs 2,2 %) [7]. Patentní foramen ovale s bidirekčním tokem je u pacientů spojen navíc s rizikem klinicky silentních mozkových infarktů prokázaných magnetickou rezonancí mozku (33 % vs 2,2 %), které mohou být potenciálně invalidizující a mohou představovat závažný socioekonomický problém. Z hlediska rizika vzniku mozkové ischemie a neurologických symptomů je nutné si uvědomit, že již embolus o velikosti několika milimetrů v adekvátní lokalizaci perfundující důležitou oblast mozku může být spojen s rozvojem závažného neurologického deficitu. Dále je nutné zdůraznění faktu, že klinická manifestace paradoxní embolizace se netýká výhradně oblasti centrálního nervového systému, ale jsou samozřejmě možné embolizace do koronárních a periferních systémových tepen.
Defekt síňového septa je nejčastější vrozenou srdeční vadou (obr. 8), která se klinicky manifestuje nezřídka až v pokročilé dospělosti paradoxní embolizací do mozkové cirkulace. Nejčastější variantou je defekt síňového septa typu secundum, který je lokalizovaný v centrální části septa a tvoří přibližně 3/4 všech defektů síňového septa. Ostatní varianty (defekty sinus versus superior a zejména inferior) jsou méně časté, nicméně je na ně nutné myslet a v případě nedostatečné vizualizace defektu je obligátní použití echokontrastní látky s průkazem rychlého průniku echokontrastní látky do levostranných srdečních oddílů.
Obr. 8. Defekt sinus versus superior s anomálním vústěním pravostranných plicních žil do horní duté žíly (hvězdy) v TEE zobrazení 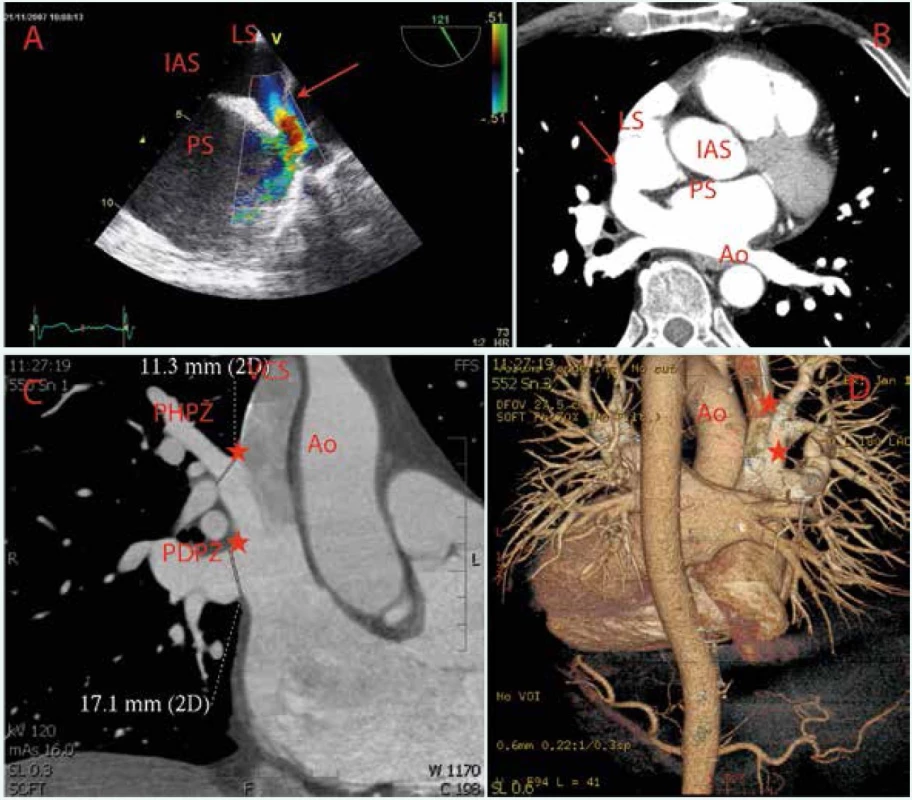
A Barevné kódování toku B CT-vyšetření se zamřením na síňové septum C Plicní žíly D Volum renderingové rekonstrukce LS – levá síň PS – pravá síň IAS – interatriální septum VCS – v. cava superior PHPŽ – levá horní plicní žíla PDPŽ – pravá dolní plicní žíla Jako metoda zlatého standardu je v současnosti považována transezofageální echokardiografie s použitím kontrastní látky (mechanicky agitovaný fyziologický roztok nebo koloid) a jejím opakovaným podáním během vyšetření v klidu a po provokačních mechanizmech. Z hlediska samotné procedury je nutné pečlivé zobrazení samotného kanálu PFO při průniku echokontrastní látky přes pravostranné srdeční oddíly s možností detekce i minimálního průniku mikrobublin echokontrastní látky přes kanál do levé síně. Kromě samotné přítomnosti PFO, charakteru toku a diagnostiky přítomnosti pravo-levé složky bidirekčního toku umožňuje toto vyšetření zkrat posoudit semikvantitativně, přičemž průnik více než 20 (25) mikrobublin echokontrastní látky do levé síně naznačuje relativně velký pravo-levý zkrat.
Otázka optimálního časování indikace katetrizačního uzávěru PFO není v současnosti jednoznačně vyřešena. Rutinní uzávěr PFO po předchozí kryptogenní ischemické CMP u mladších jedinců nelze doporučit. Na základě výsledku publikovaných studií není tato procedura jednoznačně spojena s redukcí výskytu recidiv embolizačních příhod v porovnání s farmakologickou profylaxí (antikoagulační nebo antiagregační terapie). Dostupná epidemiologická data podporují indikaci uzávěru pomocí septálního okludéru u jedinců s recidivujícím prokazatelně kryptogenním ischemickým iktem se suspektní paradoxně embolizační etiologií, zvláště je-li přítomno onemocnění zvyšující tlaky v pravé síni (např. plicní embolie) nebo je-li prokázaná hluboká flebotrombóza. Za recidivu lze považovat také výskyt předchozích klinicky silentně proběhlých mozkových infarktů s typickým nálezem na magnetické rezonanci mozku. Pokud nelze předpokládat elevaci tlaků v pravostranných srdečních oddílech, lze indikaci zvážit také u mladších pacientů (< 55 let) se současně přítomným ASA a velkým pravo-levým zkratem (> 20 bublin v levé síni po provokačních manévrech). Katetrizační nebo chirurgický uzávěr defektu síňového septa je indikován v případě hemodynamicky významného levo-pravého zkratu (Qp/Qs > 1,5), dilatace pravé komory, plicní hypertenze, při velikosti defektu > 10 mm. Proběhlá ischemická cévní mozková příhoda s předpokladem paradoxní embolie je také důvodem k uzávěru defektu.
Indikace specifické farmakoterapie PFO (antikoagulační nebo antiagregační terapie) jako profylaxe recidivy ischemické cévní mozkové příhody není také jednoznačně stanovena. Jako racionální se jeví uvedené léky podávat dle standardních zvyklostí léčby a profylaxe recidivy ischemického iktu zejména v případě současně prokázané hluboké žilní trombózy nebo aneuryzmatu síňového septa [20,21].
Paradoxní embolie přes perzistující levostrannou horní dutou žílu
(výskyt: nízký, rizikovost: vysoká, profylaxe: nefarmakologická)
Perzistující levostranná horní dutá žíla (PLSVC) je nejčastější hrudní cévní anomálií s odhadovanou prevalencí 0,3 % v neselektované populaci, která se vyskytuje u 4–10 % nositelů vrozené srdeční vady. Ve více než 90 % případů PLSVC ústí do pravé síně přes koronární sinus. Tato forma není asociována se zvýšeným rizikem systémových embolizačních komplikací. Vzácněji (< 10 %) PLSVC ústí do levé síně přes tzv. nezastřešený koronární sinus, přímo nebo přes některou z plicních žil. Tato forma je charakteristická přítomností pravo-levého zkratu asociovaného s rizikem tromboembolických nebo septických embolizací do systémového oběhu. Předpokládaným patogenetickým mechanizmem je paradoxní embolizace při pravo-levém zkratu s možným zdrojem embolizace v hlubokém nebo povrchovém žilním systému levé horní končetiny.
Jako základní diagnostická zobrazovací metoda by měla být použita kontrastní transtorakální a jícnová echokardiografie (obr. 9) s obligátním podáním echokontrastní látky (agitovaný fyziologický nebo koloidní roztok) do žilního systému levé končetiny. Aplikace kontrastní látky by měla optimálně být provedena opakovaně a při různých polohách levé horní končetiny (elevovaná/při těle) a těla (na zádech/boku) k vyloučení polohové závislosti průtoku přes potenciální pravo-levý zkrat. Je nutné zdůraznit, že podání echokontrastní látky do žil pravé horní končetiny je pro potvrzení nebo vyloučení diagnózy PLSVC naprosto nedostačené a zejména u mladších jedinců s příznaky recidivující mozkové ischemie bez jiné jednoznačné příčiny je nutné na tuto vrozenou abnormitu pomýšlet. Potvrzující zobrazovací metodou je CT angiografie nebo přímo venografie (obr. 10).
Obr. 9. Kontrastní echokardiografie 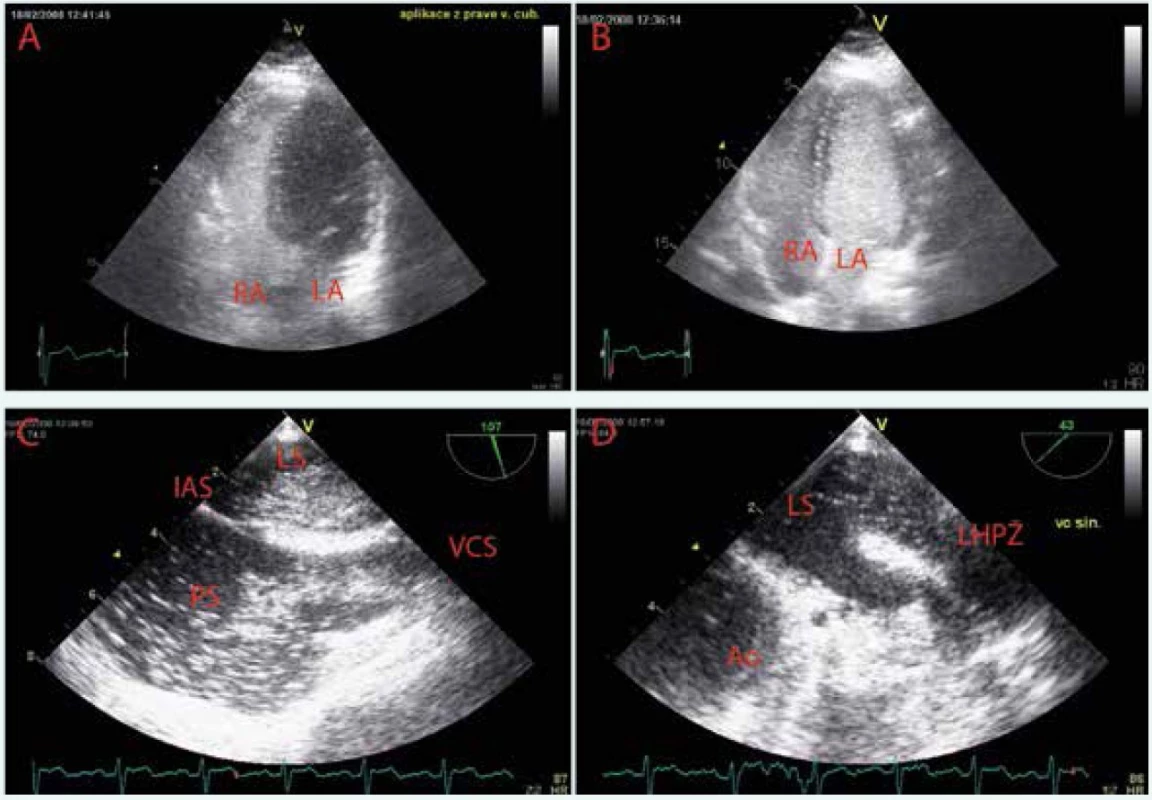
A Po aplikaci echokontrastní látky do pravé kubitální žíly je patrná normální sekvence opacifikace pravostranných srdečních oddílů bez průniku mikrobublin doleva. B, C V apikální čtyřdutinové projekci a midezofageální bikavální projekci po aplikaci echokontrastní látky do levé kubitální žíly je zřetelná prakticky synchronní opacifikace pravostranných a levostranných srdečních oddílů. Dále není patrný dilatovaný koronární sinus, který není naplněný echokontrastem. D Jícnová kontrastní echokardiografie s přímým zobrazením lokalizace průniku mikrobublin echokontrastní látky přes levou horní plicní žílu do levé síně. LS – levá síň PS – pravá síň IAS – interatriální septum VCS – v. cava superior Ao – aortální chlopeň LHPŽ – levá horná plicní žíla Obr. 10. Výpočetní tomografie (CT) hrudníku 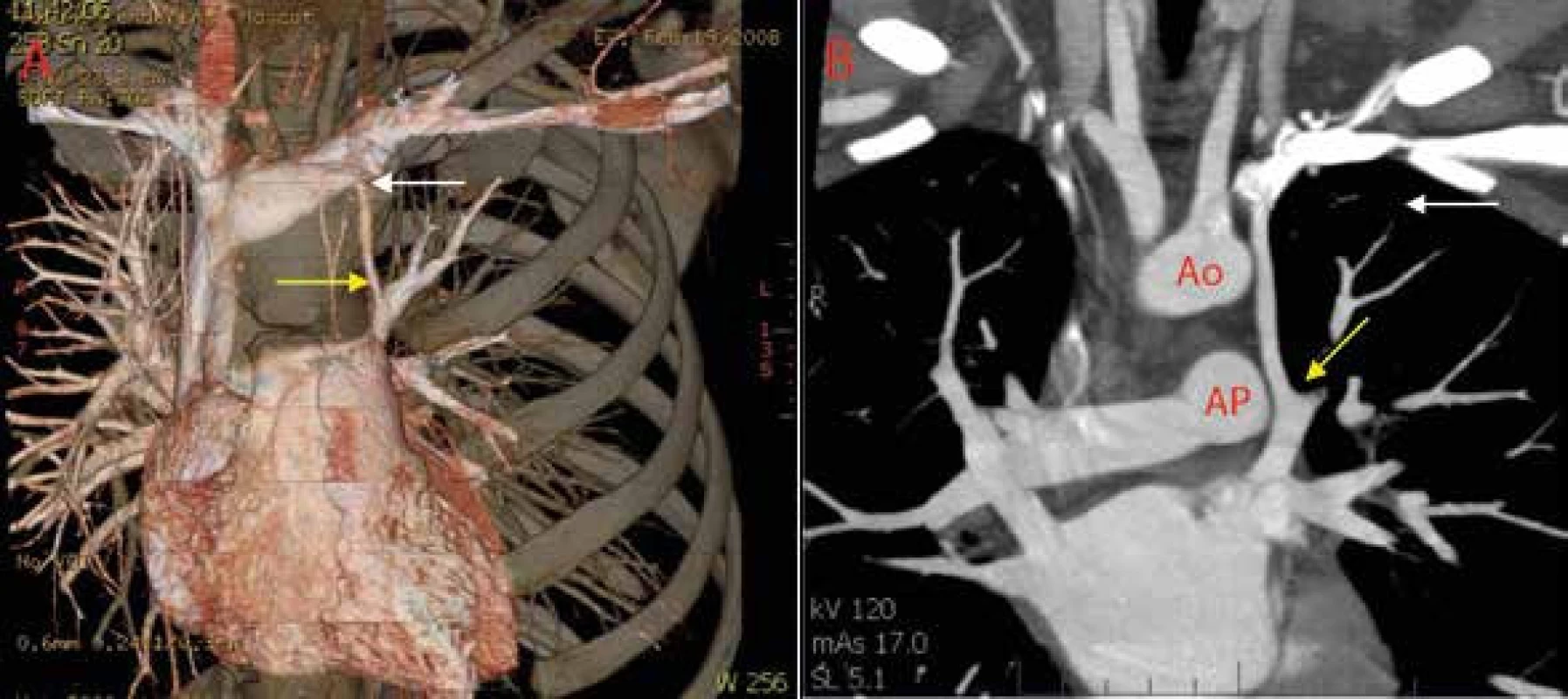
A Volum renderingové rekonstrukce B Dvojrozměrný obraz se zobrazením odstupu PLSVC z v. brachiocephalica (bílá šipka) a vústění do levé horní plicní žíly (žlutá šipka), která vede přímo do levé síně. Ao – aorta AP – a. pulmonalis V případě nálezu symptomatické PLSVC s abnormálním vústěním do levé síně je nutné provedení katetrizačního uzávěru pomocí okluze PLSVC nebo embolizaci coilem. Pokud endovaskulární techniky nejsou možné, lze v krajním případě uvažovat o indikaci chirurgické torakoskopické ligace PLSVC. Do definitivního vyloučení a uzávěru této cévní abnormality je nutné antikoagulační terapií léčit potenciální trombózu žil levé horní končetiny, která by mohla představovat zdroj paradoxní embolizace [22].
Podpořeno grantovými projekty Interní grantové agentury Ministerstva zdravotnictví České republiky NT 11046–6/2010 a NT14288–3/2013.
doc. MUDr. Martin Hutyra, Ph.D.
martinhutyra@seznam.cz
I. interní klinika – kardiologická LF UP a FN, Olomouc
www.fnol.cz
Doručeno do redakce 1. 10. 2014
Přijato po recenzi 23. 10. 2014
Zdroje
1. Kral M, Herzig R, Sanak D et al. Prevention of cardioemboligenic stroke in the Olomouc region of the Czech Republic. J Neurol Sci 2009; 285(Suppl 1): S160.
2. Král M, Šaňák D, Veverka T et al. Troponin T in acute ischemic stroke. Am J Cardiol 2013; 112(1): 117–121.
3. Doufekias E, Segal AZ, Kizer JR. Cardiogenic and Aortogenic Brain Embolism. J Am Coll Cardiol 2008; 51(11): 1049–1059.
4. Pepi M, Evangelista A, Nihoyannopoulos P et al. Recommendations for echocardiography use in the diagnosis and management of cardiac sources of embolism: European Association of Echocardiography (EAE) (a registered branch of the ESC. Eur J Echocardiogr 2010; 11(6): 461–464.
5. Kimura K, Minematsu K, Yamaguchi T. Atrial fibrillation as a predictive factor for severe stroke and early death in 15,831 patients with acute ischaemic stroke. J Neurol Neurosurg Psychiatry 2005; 76(5): 679–983.
6. Hylec EM, Go AS, Chang Y et al. Effect of intensity of oral anticoagulation on stroke severity and mortality in atrial fibrillation. N Engl J Med 2003; 349(11): 1019–1026.
7. O’Donnell M, Oczkowski W, Fang J et al. Preadmission antithrombotic treatment and stroke severity in patients with atrial fibrillation and acute ischaemic stroke: an observational study. Lancet Neurol 2006; 5(9): 749–754.
8. Arsava EM, Ballabio E, Benner T et al. The Causative Classification of Stroke system: an international reliability and optimization study. Neurology 2010; 75(14): 1277–1284.
9. Friberg J, Scharling H, Gadsboll N et al. Comparison of the impact of atrial fibrillation on the risk of stroke and cardiovascular death in women versus men (The Copenhagen City Heart Study). Am J Cardiol 2004; 94(7): 889–894.
10. Miyasaka Y, Barnes ME, Bailey KR et al. Mortality trends in patients diagnosed with first atrial fibrillation: a 21-year community-based study. J Am Coll Cardiol 2007; 49(9): 986–992.
11. Conen D, Chae CU, Glynn RJ et al. Risk of death and cardiovascular events in initially healthy women with new-onset atrial fibrillation. JAMA 2011; 305(20): 2080–2087.
12. Šaňák D, Herzig R, Král M et al. Is atrial fibrillation associated with poor outcome after thrombolysis? J Neurol 2010; 257(6): 999–1003.
13. Potpara TS, Polovina MM, Licina MM et al. Reliable identification of “truly low” thromboembolic risk in patients initially diagnosed with “lone” atrial fibrillation: the Belgrade atrial fibrillation study. Circ Arrhythm Electrophysiol 2012; 5(2): 319–326.
14. Potpara TS, Stankovic GR, Beleslin BD et al. A 12-year follow-up study of patients with newly diagnosed alone atrial fibrillation – implications of arrhythmia progression on prognosis: the Belgrade Atrial Fibrillation study. Chest 2012; 141(2): 339–347.
15. Stroke Risk in Atrial Fibrillation Working Group. Stroke Risk in Atrial Fibrillation Working Group. Independent predictors of stroke in patients with atrial fibrillation: a systematic review. Neurology 2007; 69(6): 546–554.
16. Camm J, Lip GYH, Atar D et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012; 33(21): 2719–2747.
17. Fuster V, Gersh BJ, Giuliani ER et al. The natural history of idiopathic dilated cardiomyopathy. Am J Cardiol 1981; 47(3): 525–531.
18. Hutyra M, Skala T, Marek D, et al. Acute severe mitral regurgitation with cardiogenic shock caused by two-step complete anterior papillary muscle rupture during acute myocardial infarction. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2006; 150(2): 293–297.
19. Hutyra M, Skála T, Kamínek M et al. Význam stanovení viability myokardu před revaskularizací u pacientů s ischemickou kardiomyopatií a systolickou dysfunkcí levé komory srdeční. Vnitř Lék 2008; 54(4): 395–401.
20. Meier B, Kalesan B, Mattle HP et al. Percutaneous closure of patent foramen ovale in cryptogenic embolism. N Engl J Med 2013; 368(12): 1083–1091.
21. Carroll JD, Saver JL, Thaler DE. Closure of Patent Foramen Ovale versus Medical Therapy after Cryptogenic Stroke. N Engl J Med 2013; 368(2): 1092–1100.
22. Hutyra M, Skála T, Šanák D et al. Persistent left superior vena cava connected through the left upper pulmonary vein to the left atrium: an unusual pathway for paradoxical embolization and a rare cause of recurrent transient ischaemic attack. Eur J Echocardiogr 2010; 11(9): E35. Dostupné z DOI: <<http://dx.doi.org/10.1093/ejechocard/jeq079>>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 12- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
-
Orientační běh od intervence k prevenci.
Prof. MUDr. Michael Aschermann slaví významné životní jubileum - Životní jubileum prof. MUDr. Michaela Aschermanna, DrSc., FESC, FACC
- Antikoagulační léčba v sekundární prevenci koronárních příhod
-
Anémie a nedostatek železa v interní praxi:
od gastroenterologie ke kardiologii a ještě dál - Embolizační ischemické cévní mozkové příhody
- Minulost a současnost problematiky plicní cirkulace ve Všeobecné fakultní nemocnici v Praze
- Katetrizační ablace fokálně spouštěné fibrilace komor u pacientů se strukturálním postižením srdce
- Současné postavení intravaskulární ultrasonografie v intervenční kardiologii
- Obezita a srdce
- Karotický stenting – vývoj, trendy a inovace
- Mají natriuretické peptidy novou šanci v léčbě srdečního selhání?
-
Renální denervace u pacientů s rezistentní hypertenzí:
je možné ji ještě resuscitovat? - Moderní léčba akutních iktů: příklad multidisciplinární spolupráce
- Katetrizační metoda léčby chronické mitrální regurgitace pomocí mitrální svorky (MitraClip)
- IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (studie IMPROVE-IT)
- Pomůže nám nový SGLT2 inhibitor empagliflozin snížit riziko hypoglykemie?
-
Orientační běh od intervence k prevenci.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Katetrizační metoda léčby chronické mitrální regurgitace pomocí mitrální svorky (MitraClip)
-
Anémie a nedostatek železa v interní praxi:
od gastroenterologie ke kardiologii a ještě dál - Embolizační ischemické cévní mozkové příhody
- Obezita a srdce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



