-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Near-infrared spectroscopy (NIRS), nová technika intrakoronárního zobrazení nestabilního koronárního plátu
Near-infrared spectroscopy (NIRS), new intracoronary imaging technique of unstable coronary plaque
Acute coronary syndrome may develop in the background of hemodynamically non-significant coronary artery disease. It may be caused by the presence of „vulnerable plaque“, which is characterized by the lipid rich core and thin fibrous cap content. NIRS – near infrared spectroscopy – is a morphological imaging method allowing determining atherosclerotic plaque cholesterol burden. Information about the chemical composition may contribute to „high risk” plaque early identification and subsequent optimal interventional strategy. The first experience with the clinical implementation of this novel method is demonstrated in a case report.
Key words:
acute coronary syndrome – chemogram – intravascular imaging – NIRS – vulnerable plaque
Autoři: Tomáš Ondrúš; Jan Kaňovský; Martin Poloczek; Roman Miklík; Otakar Boček; Petr Jeřábek; Petr Kala
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC
Vyšlo v časopise: Vnitř Lék 2014; 60(5-6): 531-534
Kategorie: Kazuistika
Souhrn
Akutní koronární syndromy mohou vznikat i v terénu hemodynamicky nevýznamného aterosklerotického postižení koronárních tepen. Příčinou jsou tzv. vulnerabilní pláty charakterizované přítomností velkého lipidového jádra a tenké vazivové čepičky. NIRS – near infrared spectroscopy – neboli „blízká červená spektroskopie“ je morfologická zobrazovací metoda umožňující stanovit obsah cholesterolových částic v aterosklerotickém plátu. Informace o chemickém složení může přispět k časné identifikaci rizikových plátů a volbě optimální intervenční strategie. První zkušenosti s využitím této metody v praxi názorně demonstrujeme na kazuistickém případu.
Klíčová slova:
akutní koronární syndrom – chemogram – intravaskulární zobrazování – NIRS – vulnerabilní plátÚvod
Akutní koronární syndromy (AKS) jsou jednou z vedoucích příčin úmrtí v západním světě [1]. Společným patofyziologickým podkladem téměř všech AKS je ruptura, eroze nebo fisura aterosklerotického (AS) plátu provázená intrakoronární trombózou, stupeň preexistující stenózy pak determinuje rozsah okluze či progrese AS plátu. Vedle hemodynamicky neboli funkčně významného koronárního postižení [2,3] jsou pro pacienty rizikové také tzv. vulnerabilní pláty charakterizované přítomností velkého lipidového jádra (tzv. lipid-core plaque – LCP) pokrytého tenkou fibrózní čepičkou (arbitrálně s tloušťkou < 65 µm) a množstvím zánětlivých elementů – makrofágů a neutrofilů [4,5]. Možnost tyto léze včas identifikovat tedy může být významným klinickým přínosem v péči o pacienty s koronární aterosklerózou.
Near-infrared spectroscopy
Near-infrared spectroscopy (NIRS), která se v technických oborech překládá jako blízká infračervená spektroskopie, je technologie využívající elektromagnetické záření o vlnové délce 800–2 500 nm spadající do oblasti infračerveného (IR) světla ke stanovení chemického složení různých substancí.
První pokusy detekovat AS pláty metodou NIRS uskutečnili Cassis a Lodder již v roce 1993 [6]. Moreno et al, 2002, [7] na vzorcích aorty odebraných post mortem ukázali, že NIRS dokáže identifikovat vulnerabilní pláty s dostatečnou citlivostí vůči histologii (senzitivita a specificita 90 %, resp. 93 %), podobný výsledek přinesl i výzkum Gardnera et al, 2008, [8], kteří studovali 212 posmrtně odebraných vzorků koronárních tepen za podmínek simulujících srdeční katetrizaci. Studie SPECTACL z roku 2009 ukázala dobrou korelaci prvního intrakoronárního použití této metody in vivo se vzorky z autopsií [9].
Vyšetření může být prováděno jak radiálním, tak femorálním přístupem. Po intrakoronárním vodiči (0,014“) je distálně od místa léze zaveden speciální katétr s laserovým snímačem na konci. Řídící motor následně provádí automatický zpětný posun katétru, tzv. pullback proximálním směrem rychlostí 0,5 mm/s, přičemž optický snímač rotuje kolem své osy uvnitř pevného pouzdra frekvencí 240 otáček/min. Vysílané záření je strukturami cévní stěny různě absorbováno a odráženo, na základě spektra odraženého světla je počítačem odvozeno chemické složení příslušné struktury. Zařízení je schopno provést přibližně 8 000 chemických měření na 100 mm skenované tepny, matematický algoritmus pak počítá pravděpodobnost přítomnosti lipidového jádra v každém místě tepny. Okamžitě po skončení „pullbacku“ jsou data zobrazena v dvourozměrném (2D) obrazu tepny nazývaném chemogram. Osa „x“ znázorňuje milimetry „pullbacku“, osa „y“ pak stupeň rotace. Barevná škála od červené ke žluté reprezentuje vzrůstající pravděpodobnost přítomnosti cholesterolových částic (obr. 1). Kvantitativní hodnocení obsahu lipidů ve stěně tepny popisuje tzv. lipid core burden index (LCBI), definovaný relativním množstvím tukových částic nad 0,6. Index dosahuje hodnot od 0 do 1 000 a platí, že čím vyšší LCBI, tím větší množství tukových částic je přítomno v AS plátu.
Obr. 1. Chemogram, žlutá šipka ukazuje přítomnost lipidových částic 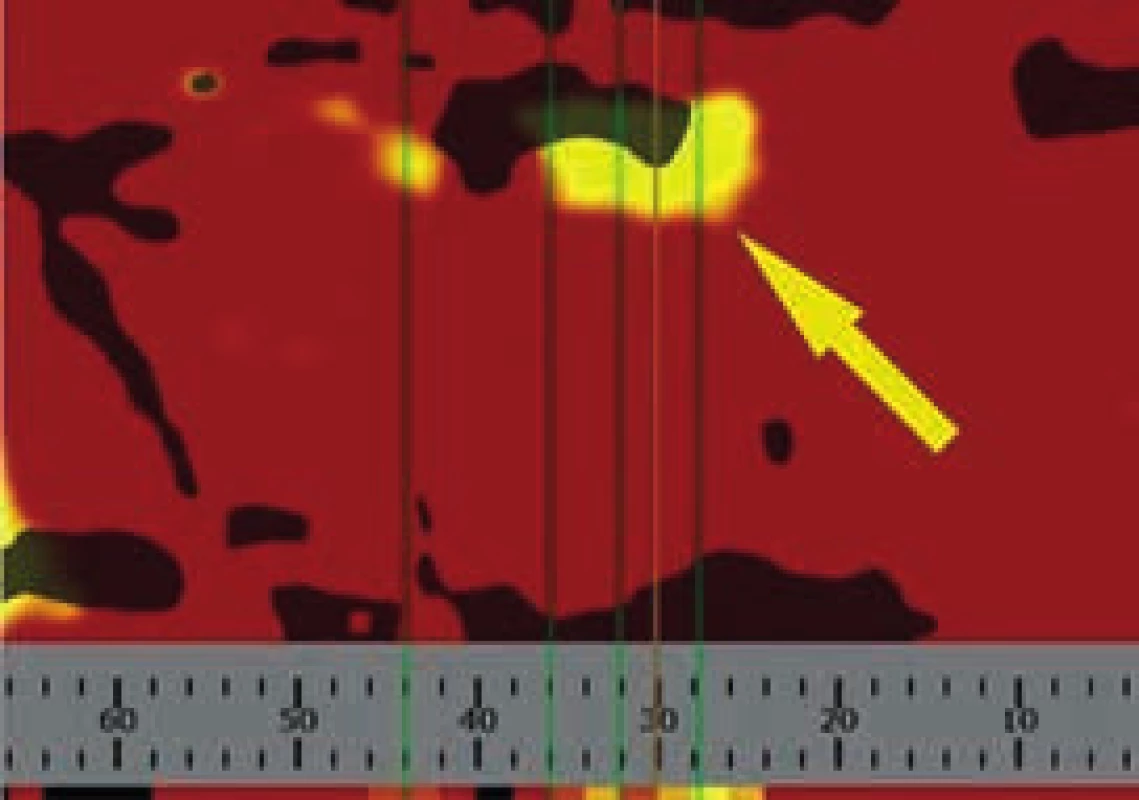
Použitím kombinace intrakoronárních metod IVUS (intravaskulární ultrasonografii – intravascular ultrasound) + NIRS (obr. 2) se výkon prodlouží o 10–15 min a farmakoterapie (nefrakcionovaný nebo frakcionovaný heparin) se neliší od medikace běžně podávané při koronární intervenci.
Obr. 2. Konzole integrující metody NIRS + IVUS (ilustrační obrázek) 
Kazuistika
Muž, 42 let, kuřák, bez dalších rizikových faktorů ischemické choroby srdeční (ICHS) byl přivezen na příjmovou ambulanci spádové nemocnice pro svíravé bolesti na hrudníku s iradiací do obou horních končetin. Ačkoli na vstupním EKG nebyly přítomny známky akutní myokardiální ischemie, na kontrolním záznamu pořízeném s odstupem několika hodin byla patrná negativizace T vln ve svodech V4–V6 a diagnóza akutního infarktu myokardu přední stěny bez elevací ST úseku (NSTEMI PS) byla potvrzena zvýšenou hladinou troponinu T (0,110 µg/l, cut-off = 0,014 µg/l). Po aplikaci akutní medikace 5 000 IU nefrakcionovaného heparinu, sytící dávky 600 mg klopidogrelu a 500 mg kyseliny acetylsalicylové byl pacient převezen na koronární jednotku naší kliniky. Při akutní koronarografii bylo nalezeno významné onemocnění jedné tepny: 90% tubulární stenóza proximálního úseku ramus interventricularis anterior (RIA), obr. 3. S cílem posouzení složení klinicky nestabilního koronárního plátu a rizika intervenční revaskularizace pomocí koronární intervence (PCI), bylo provedeno detailnější zobrazení stenotického úseku systémem (TVC Imaging SystemTM, Infraredx, Burlington, USA) integrujícím metodu NIRS a intravaskulární ultrasonografii (intravascular ultrasound – IVUS), obr. 4. Červená šipka ukazuje na excentricky uložený, ulcerovaný aterosklerotický plát s obsahem tukového jádra, tzv. lipid-core plaque (LCP), žlutá šipka ukazuje na přítomnost tukových částic vykreslující se na obvodovém i plošném chemogramu (obr. 1) žlutou barvou. LCBI 74 značí relativně nižší riziko obsahu lipidů v cévní stěně a zároveň i nižší potenciální riziko periprocedurálního infarktu myokardu. Výsledky IVUS/NIRS v tomto případě neměly vliv na zvolenou léčebnou strategii, v případě vysoké hodnoty LCBI bychom zvážili preventivní podání blokátorů glykoproteinových receptorů destiček IIb/IIIa. V případě vícečetných lipidových plátů bychom odpovídajícím způsobem zvolili i délku stentu k bezpečnému pokrytí celého postiženého úseku tepny. Dosažení angiograficky optimálního výsledku PCI s implantací lékového (drug-eluting) stentu 2. generace krytého zotarolimem (obr. 5) bylo potvrzeno kontrolním NIRS + IVUS vyšetřením (obr. 6). Zde je patrná dostatečná expanze stentu s dobrou apozicí jeho strutů k cévní stěně a současně došlo i k vymizení LCP signálu na obvodovém i plošném chemogramu (obr. 7). Echokardiografické vyšetření ukazuje zachovalou systolickou funkci levé komory s 65% ejekční frakcí bez lokálních poruch kinetiky, pacient byl následně po celou dobu hospitalizace hemodynamicky stabilní a 5. den od přijetí byl propuštěn do ambulantní péče.
Obr. 3. Angiograficky významná stenóza proximální RIA 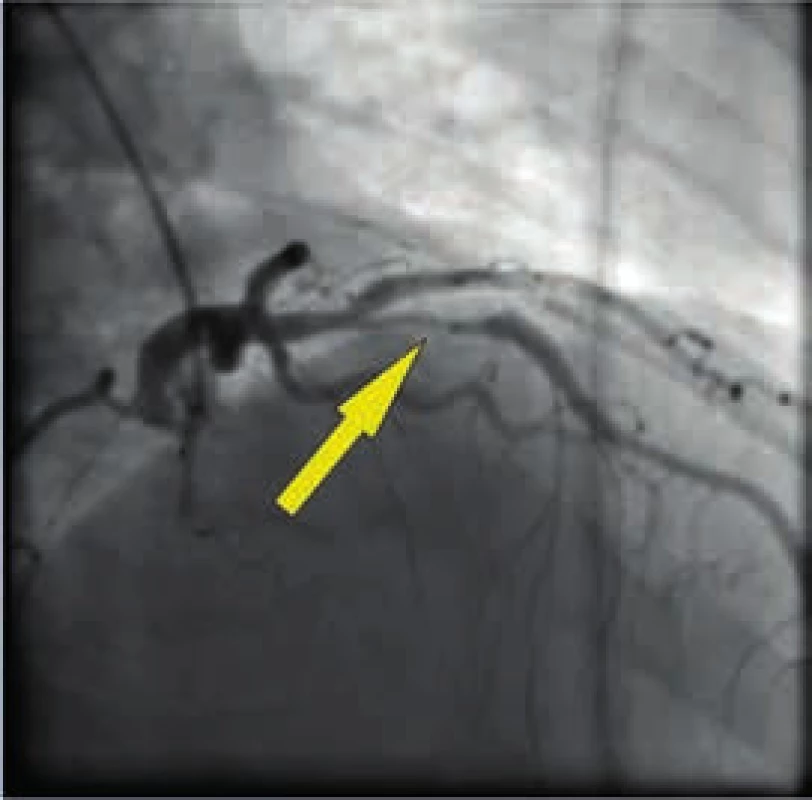
Obr. 4. Aterosklerotický plát s přítomností tukového jádra – LCP 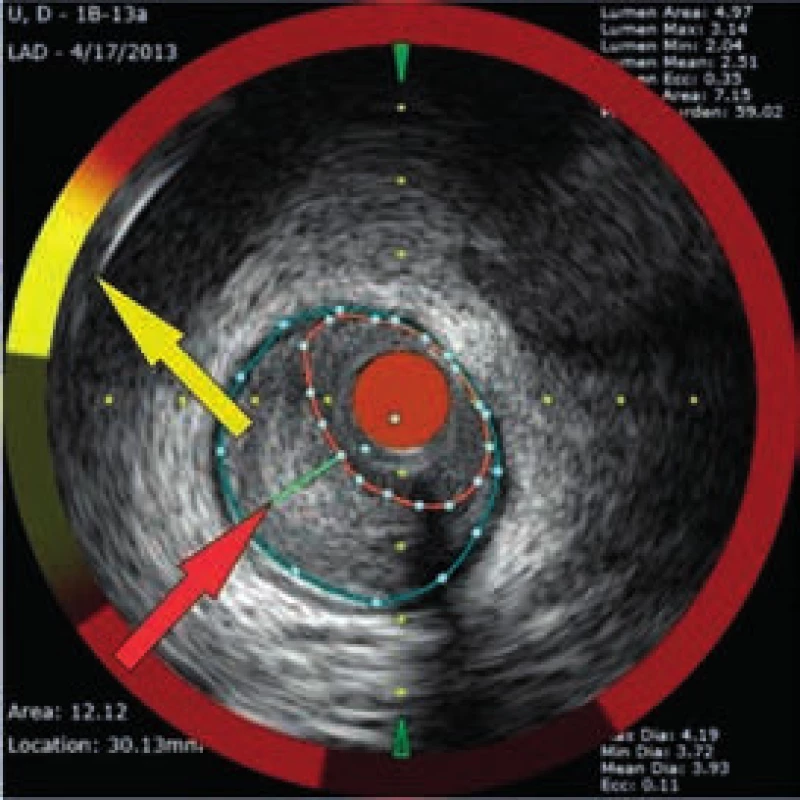
Obr. 5. Angiograficky optimální výsledek revaskularizace 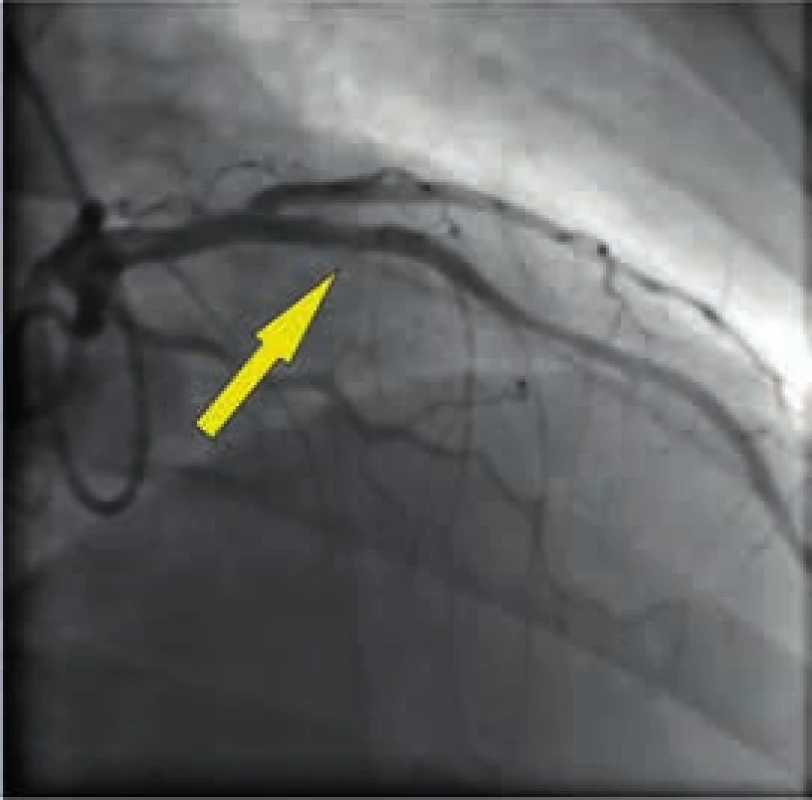
Obr. 6. NIRS + IVUS po implantaci lékového stentu 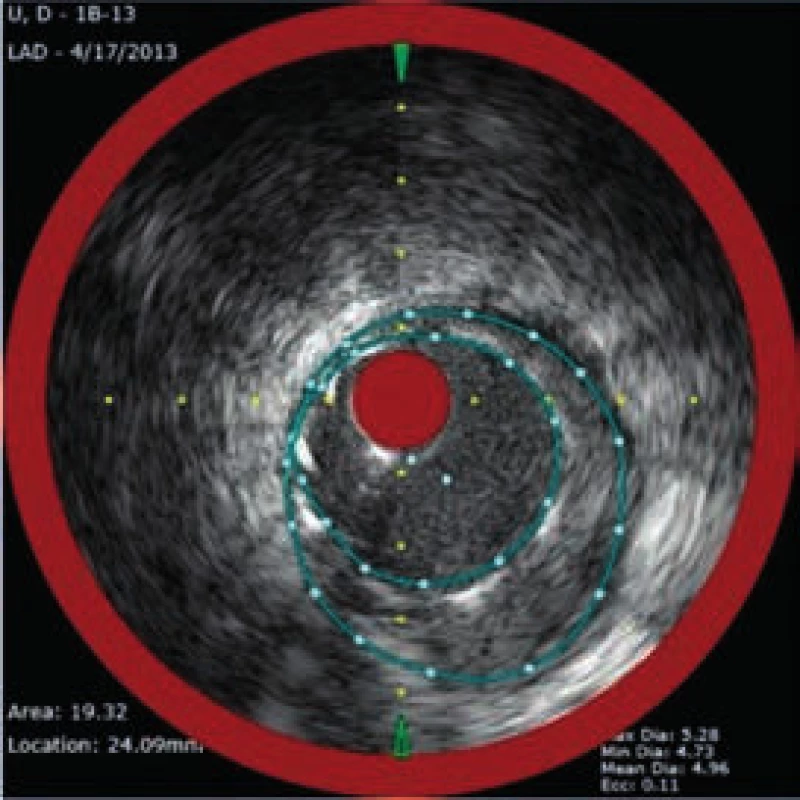
Obr. 7. Plošný chemogram po revaskularizaci 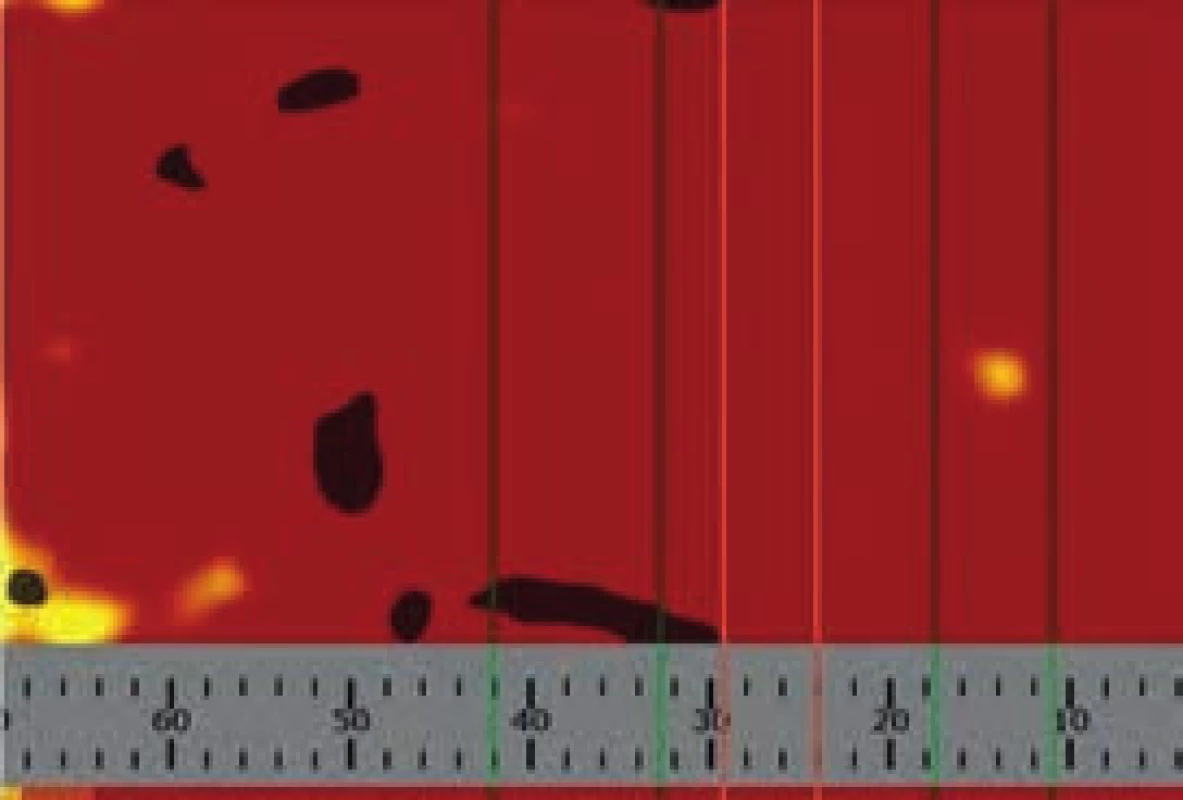
Diskuse
Na rozdíl od koronární angiografie, je IVUS schopna s relativně dostatečnou přesností a citlivostí (rozlišení 100 µm) zobrazit základní morfologické charakteristiky léze. NIRS poskytuje navíc informaci o jejím chemickém složení a přítomnosti tukového jádra, které je známkou vulnerability plátu s možnou predikcí jeho rychlejší progrese, rizika ruptury či distální embolizace během intervence [10–12]. Citlivost této metody je srovnatelná s histopatologickými nálezy [8]. Otázkou zůstává dostatečnost korelace IVUS a NIRS a klinický význam jejich kombinovaného použití.
Po PCI byl patrný výrazný pokles až úplné vymizení LCP signálu na příslušném chemogramu (obr. 8). V současnosti není zřejmé jednoznačné vysvětlení tohoto jevu, předpokládá se uplatnění některé z následujících možností nebo jejich kombinace [13,14]:
- mechanické vtlačení tukových částic do lumina
- longitudinální či laterální redistribuce tukových částic uvnitř arteriální stěny
- zvýšený průtok krve mezi katétrem a arteriální stěnou
- zeslabení NIRS signálu přítomností kovového stentu.
Závěr
Znalost přesné morfologie nestabilního koronárního plátu může být v některých případech nápomocna ke stanovení optimální léčebné strategie. V našem kazuistickém sdělení jsme ukázali praktické využití nové technologie kombinující IVUS a NIRS, která však v tomto konkrétním případě nevedla ke změně naší strategie. Přestože se jednalo o mladého muže s akutním infarktem myokardu, hodnota indexu lipidového jádra byla nízká. Eventuální klinický přínos kombinace IVUS a NIRS musí být prokázán v dalších studiích.
Práce byla vytvořena s podporou MZ ČR – RVO FN Brno, 65269705.
MUDr. Petr Kala, Ph.D., FESC, FSCAI
kalapetr7@gmail.com
Interní kardiologická klinika LF MU a FN Brno, Brno
www.fnbrno.cz
Doručeno do redakce: 13. 11. 2014
Přijato po recenzi: 28. 3. 2014
Zdroje
1. Go AS, Mozaffarian D, Roger VL et al. Heart disease and stroke statistics – 2013 update: a report from the American Heart Association. Circulation 2013; 127(1): e6-e245.
2. Pijls NH, van Schaardenburgh P, Manoharan G et al. Percutaneous coronary intervention of functionally nonsignificant stenosis: 5-year follow-up of the DEFER Study. J Am Coll Cardiol 2007; 49(21): 2105–2111.
3. Tonino PAL, De Bruyne B, Pijls NH et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. N Engl J Med 2009; 360(3): 213–224.
4. Falk E, Shah PK, Fuster V. Coronary plaque disruption. Circulation 1995; 92(3): 657–671.
5. Buja LM, Willerson JT. Role of inflammation in coronary plaque disruption. Circulation 1994; 89(1): 503–505.
6. Cassis LA, Lodder RA. Near-IR imaging of atheromas in living arterial tissue. Anal Chem 1993; 65(9): 1247–1256.
7. Moreno PR, Lodder RA, Purushothaman KR et al. Detection of lipid pool, thin fibrous cap, and inflammatory cells in human aortic atherosclerotic plaques by near-infrared spectroscopy. Circulation 2002; 105(8): 923–927.
8. Gardner CM, Tan H, Hull EL et al. Detection of lipid core coronary plaques in autopsy specimens with a novel catheter-based near-infrared spectroscopy system. JACC Cardiovasc Imaging 2008; 1(5): 638–648.
9. Waxman S, Dixon SR, L’Allier P et al. In vivo validation of a catheter-based near-infrared spectroscopy system for detection of lipid core coronary plaques: initial results of the SPECTACL study. JACC Cardiovasc Imaging 2009; 2(7): 858–868.
10. Hong YJ, Mintz GS, Kim SW et al. Impact of plaque composition on cardiac troponin elevation after percutaneous coronary intervention: an ultrasound analysis. JACC Cardiovasc Imaging 2009; 2(4): 458–468.
11. Kolodgie FD, Burke AP, Farb A et al. The thin-cap fibroatheroma: a type of vulnerable plaque: the major precursor lesion to acute coronary syndromes. Curr Opin Cardiol 2001; 16(5): 285–292.
12. Goldstein JA, Grines C, Fischell T et al. Coronary embolization following balloon dilation of lipid-core plaques. JACC Cardiovasc Imaging 2009; 2(12): 1420–1424.
13. Madder RD, Steinberg DH, Anderson RD. Multimodality direct coronary imaging with combined near-infrared spectroscopy and intravascular ultrasound: initial US experience. Catheter Cardiovasc Interv. 2013; 81(3): 551–557.
14. Virmani R, Kolodgie FD, Burke AP et al. Lessons from sudden coronary death: a comprehensive morphological classification scheme for atherosclerotic lesions. Arterioscler Thromb Vasc Biol 2000; 20(5): 1262–1275.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 5-6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Erdheimova-Chesterova choroba – poddiagnostikovaná zriedkavá choroba? – editorial
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – editorial
- Přínos natriuretických peptidů v současné klinické praxi – editorial
- Sentinelová biopsie, stručný nástin problematiky – editorial
- Časování chirurgické a endoskopické terapie akutní biliární pankreatitidy v podmínkách terciární nemocnice v České republice
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – naše zkušenosti za posledních 15 let
- Význam EKG u pacientov s resynchronizačnou liečbou
- Srdcové zlyhávanie – dá sa liečiť ovplyvnením kardiálneho metabolizmu?
- Difuzní idiopatická skeletární hyperostóza
- Proč a jak působí inzulinové přípravky na hmotnost
- Význam chuti v udržení homeostázy organizmu a patologický dopad vyrušení orocefalických reflexů ve vazbě na sladkou chuť v následku konzumace nekalorických sladidel
- Životní styl a riziko civilizačních nemocí
- Management chronických onemocnění v mezinárodním srovnání
- Rizikové faktory a prediktory progrese Barrettova jícnu do adenokarcinomu
- Přínos natriuretických peptidů v současné klinické praxi
- Sentinelová uzlina pri malígnom melanóme
- Manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- PET-CT dokumentovaná kompletní 4letá remise Erdheimovy-Chesterovy nemoci po léčbě kladribinem
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Extraadrenálny paraganglióm
- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Ruptura jater s hemoperitoneem jako vzácná komplikace kardiopulmonální resuscitace u mladé pacientky s akutním infarktem myokardu
- Near-infrared spectroscopy (NIRS), nová technika intrakoronárního zobrazení nestabilního koronárního plátu
- Význam stanovení natriuretických peptidů a prokalcitoninu u akutního srdečního selhání
- XVII International Congress on Nutrition and Metabolism in Renal Disease
- Rozlúčka s profesorom Ďurišom, nestorom Slovenskej internej medicíny
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Difuzní idiopatická skeletární hyperostóza
- Sentinelová uzlina pri malígnom melanóme
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



