-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sentinelová uzlina pri malígnom melanóme
Sentinel lymph node in malignant melanoma
Melanoma is highly malignant tumor which arises through malignant transformation of melanocytes. Surgical treatment of primary cutaneous melanoma including radical excision and intervention in regional lymphatic drainage is irreplaceable. Sentinel node biopsy is a recognized method of defining the stage of disease. Performance of sentinel node biopsy in patients in clinical stage Ib and II may reveal clinically occult nodal disease and thereby help identify a group of patients with occult stage III disease who may thereafter undergo complete lymphadenectomy and systemic treatment. Sentinel node biopsy is beneficial in treatment of melanoma, but the therapeutic value of sentinel node biopsy is still not completely clear and remains disputable.
Key words:
melanoma – sentinel lymph node – sentinel node biopsy
Autoři: Eva Rovenská
Působiště autorů: Klinika chirurgickej onkológie Slovenskej zdravotníckej univerzity a Národného onkologického ústavu Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Pechan, CSc.
Vyšlo v časopise: Vnitř Lék 2014; 60(5-6): 484-489
Kategorie: Přehledný referát
Souhrn
Malígny melanóm je nádor s vysokým zhubným potenciálom, ktorý vzniká malígnou transformáciou melanocytov. V liečbe primárneho kožného malígneho melanómu je nezastupiteľná chirurgická liečba spočívajúca v radikálnej excízii primárnej kožnej lézie a v riešení spádovej lymfatickej drenáže. Biopsia sentinelovej uzliny je uznanou metódou určenia štádia, ktorá u pacientov s klinickým štádiom Ib alebo II odhaľuje klinicky okultné nodálne metastázy, čím identifikuje skupinu pacientov s okultným štádiom III melanómu, ktorí sa tak stávajú kandidátmi pre následnú kompletnú disekciu spádových lymfatických uzlín a pre adjuvantnú systémovú liečbu. Biopsia sentinelovej uzliny je prínosom v liečbe malígneho melanómu, avšak jej jednoznačný terapeutický význam je zatiaľ nedoriešený a ostáva naďalej predmetom diskusie.
Kľúčové slová:
biopsia sentinelovej uzliny – malígny melanóm – sentinelová lymfatická uzlinaÚvod
Malígny melanóm (MM) je nádor s vysokým zhubným potenciálom, ktorý vzniká malígnou transformáciou melanocytov. Tento tumor môže vzniknúť na akomkoľvek mieste kože, vzácnejšie primárne vzniká na slizniciach alebo v oku [1]. Incidencia MM každoročne celosvetovo stále rastie. V Európe je incidencia MM < 10–20/100 000 obyvateľov, v USA 20–30/100 000 a v Austrálii je najvyššia, a to 50–60/100 000 obyvateľov [2]. Vyššie riziko vzniku MM sa pozoruje u pacientov s veľkým počtom melanocytárnych névov, veľkými kongenitálnymi névami a dysplastickými névami. MM sa zriedkavo vyskytuje aj familiárne a podlieha v týchto prípadoch väčšinou polygénnej dedičnosti. Približne 5–10 % MM vzniká u pacientov, ktorí majú medzi priamymi príbuznými aspoň 1 alebo 2 jedincov podobne postihnutých [1,2].
Molekulárne štúdie dokázali genetickú heterogenitu MM, pričom určité mutácie sú spojené s rôznymi anatomickými lokalitami a rôznou expozíciou voči slnečnému žiareniu. MM vznikajúci u pacientov s intermitentnou slnečnou expozíciou je často lokalizovaný na trupe a končatinách a často nesie BRAF mutáciu. MM u pacientov s chronickou slnečnou expozíciou je často lokalizovaný v oblasti hlavy a krku a stredne často nesie NRAS mutácie. MM u pacientov bez zrejmej slnečnej expozície je väčšinou lokalizovaný akrálne a na slizniciach a zriedkavo nesie CKIT mutácie [2].
Klinické a histopatologické vlastnosti MM určujúce prognózu ochorenia sa študujú viac ako štyri desaťročia. Potvrdenými faktormi spojenými so zlou prognózou prežívania sú hrúbka tumoru (s horšou prognózou v hrubších léziach), prítomnosť ulcerácie v histopatologickom vyšetrení, vysoký mitotický index, anatomická lokalita lézie (lézie trupu a tváre majú horšiu prognózu ako lézie na končatinách), mužské pohlavie a vek (so zhoršením prognózy u starších pacientov) [3].
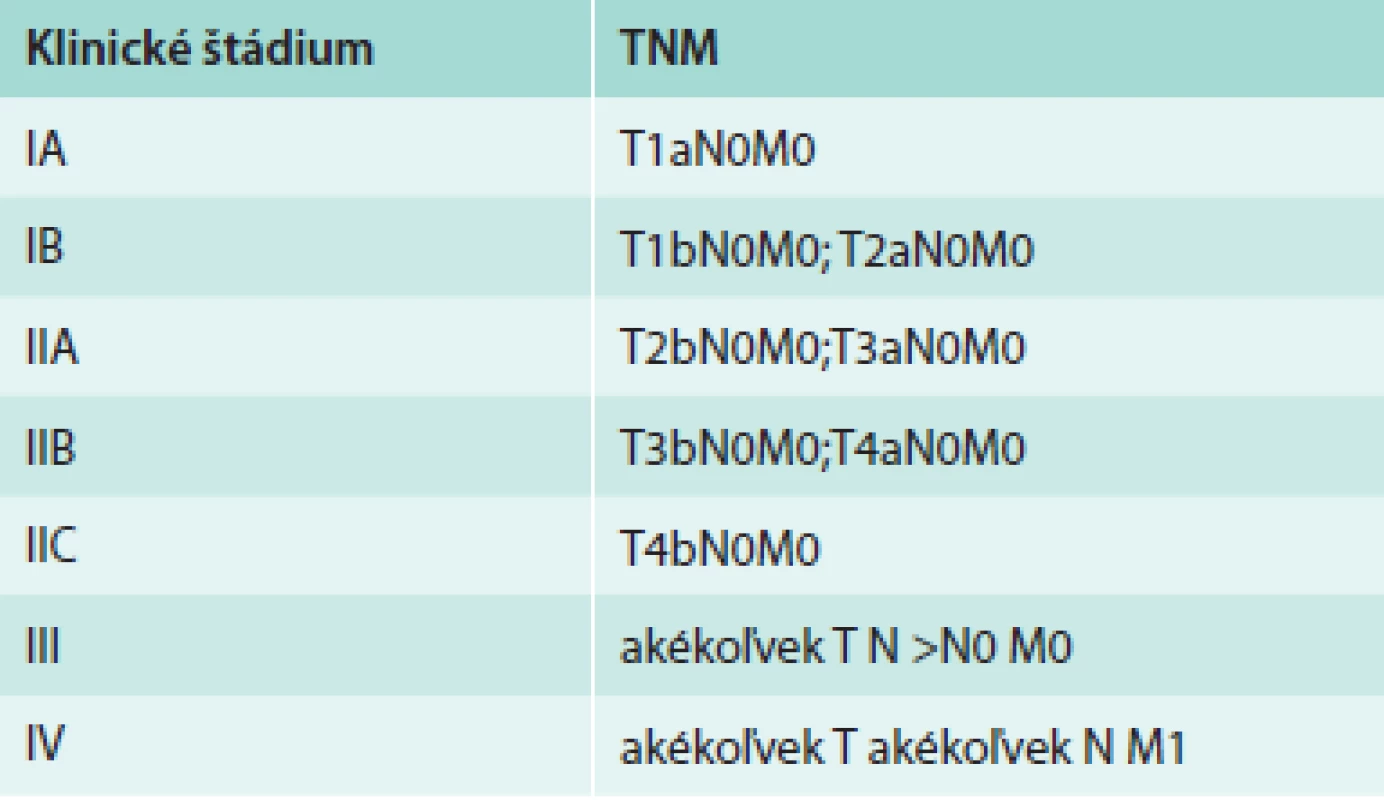
TNM klasifikačný systém vytvorený American Joint Committee on Cancer (AJCC) sa používa na popis rozsahu primárneho tumoru (T), stavu regionálnych lymfatických uzlín (N) a vzdialených metastáz (M). Posledná verzia klasifikačného systému (7. edícia AJCC z roku 2009) pre MM je uvedená v tab. 1 [4].
Tab. 1. TNM klasifikačný systém pre MM 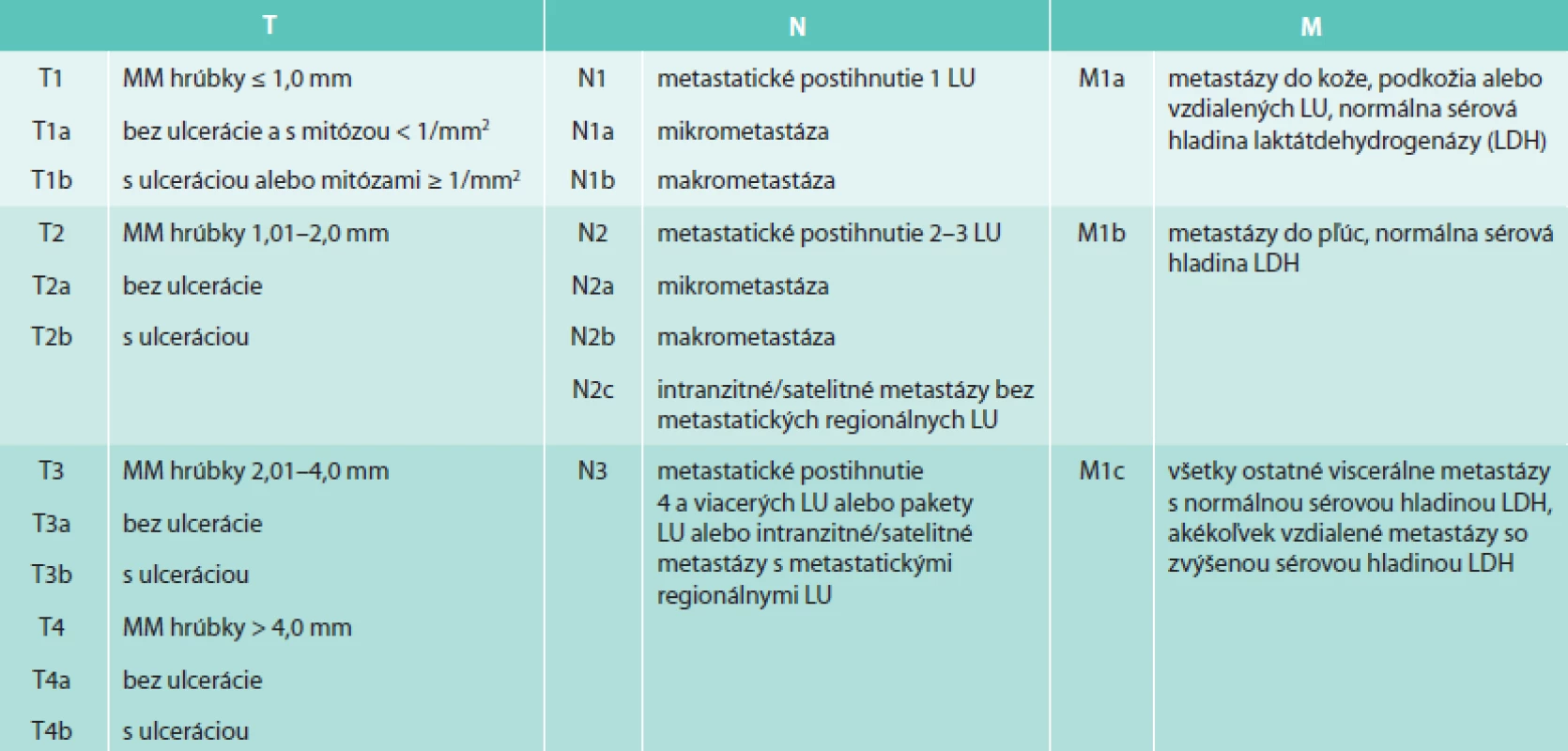
LU – lymfatická uzlina Podľa rozsahu ochorenia sú pacienti zaradení do jednotlivých štádií, ktoré sa výrazne líšia v prognóze ochorenia. Klasifikácia jednotlivých klinických štádií MM na podklade TNM klasifikácie je uvedená v tab. 2 [4]. Analýzou údajov z databázy AJCC, v ktorej bolo zaradených 30 946 pacientov v štádiách I, II, a III a 7 972 v štádiu IV, sa zistili výrazné rozdiely v celkovom prežívaní. Pre pacientov v štádiu IA bolo 10-ročné prežívanie 93 %, zatiaľ čo v štádiu IIC len 39 %. 5-ročné prežívanie pre pacientov v štádiu IIIA bolo 78 %, v štádiu IIIB 59 % a v štádiu IIIC 40 %. Pre pacientov v štádiu IV bolo 1-ročné prežívanie 62 % pre M1a, 53 % pre M1b a 33 % pre M1c [4].
Histopatologické hodnotenie malígneho melanómu
Pri histopatologickom hodnotení MM sa štandardne určuje hrúbka nádoru podľa Breslowa a hĺbka invázie nádorových buniek podľa Clarka. Clarkova hĺbka invázie sa v 6. edícii klasifikácie AJCC používala na klasifikáciu T1 tumoru [5]. V 7. edícii klasifikácie AJCC bola už Clarkova hĺbka invázie v klasifikácii T1 tumoru nahradená mitotickým indexom, ktorý je prognosticky silnejším parametrom. Clarkova hĺbka invázie sa v súčasnosti používa na klasifikáciu T1 tumoru len v prípade, keď nie je možné určiť mitotický index [4,6].
Hrúbka nádoru podľa Breslowa sa určuje kalibrovaným okulárnym mikrometrom od horného okraja stratum granulosum epidermis vertikálne k nádoru alebo najhlbšie uloženej nádorovej bunke v kóriu alebo v podkoží [1]. Čím väčšia hodnota Breslowa, tým horšia je prognóza ochorenia [4]. Podľa hrúbky podľa Breslowa sa MM tiež rozdeľuje na tenký MM s hrúbkou < 1 mm, intermediárny MM s hrúbkou 1–4 mm a hrubý MM, ktorý má hrúbku > 4 mm [7].
Hĺbka invázie buniek MM podľa Clarka rozlišuje 5 úrovní hĺbky invázie, pričom čím hlbšie nádor prerastá, tým je prognóza horšia. Pri hĺbke invázie Clark I sú nádorové bunky lokalizované len intraepidermálne. Clark II je charakterizovaný inváziou nádorových buniek do hornej časti stratum papillare. Pri hĺbke invázie Clark III nádorové bunky vypĺňajú celé stratum papillare. Šírenie nádorových buniek do stratum reticulare je definované ako Clark IV a pri hĺbke invázie Clark V prenikajú nádorové bunky až do podkožného tuku [1].
Úloha chirurgie
Chirurgická liečba je nosným pilierom v liečbe primárneho kožného MM [8,9]. Adekvátna chirurgická excízia s dostatočným resekčným okrajom je zásadná, pretože pacienti po vzniku lokoregionálnej rekurencie ochorenia majú podstatne horšiu prognózu prežívania [10]. Smernica National Comprehensive Cancer Network (NCCN) odporúča šírku bezpečnostného okraja v závislosti od hrúbky tumoru, ako je uvedené v tab. 3 [9]. Na hĺbku excízie zatiaľ neexistuje jednoznačný konsenzus a tejto problematike sa zatiaľ nevenujú žiadne prospektívne randomizované štúdie. Prospektívne štúdie, ktoré sa venovali šírke excízie, nezahŕňali jej hĺbku. Prevláda všeobecná chirurgická prax vykonávania excízie po svalovú fasciu bez jej resekcie [11,12]. Grotz vo svojej retrospektívnej štúdii hodnotil vplyv resekcie svalovej fascie na vznik lokoregionálnej rekurencie a celkového prežívania u pacientov s primárnym MM hrúbky rovnajúcej sa alebo väčšej ako 1 mm lokalizovanom na trupe a končatinách. Z celkového súboru 964 pacientov podstúpilo 278 resekciu svalovej fascie a u 686 pacientov bola vykonaná excízia primárnej lézie bez resekcie svalovej fascie. Analýzou výsledkov sa nezistil prínos resekcie svalovej fascie pre celkové prežívanie a lokálnu rekurenciu. Prekvapivým zistením bola skutočnosť, že resekcia svalovej fascie je v porovnaní s ponechanou svalovou fasciou spojená s 2,5-krát väčším rizikom vzniku intranzitnej a nodálnej rekurencie [10]. Tento záver podporuje zistenie Olsenovej z roku 1964 pred érou biopsie sentinelovej uzliny (sentinel node biopsy – SLNB), ktorá pozorovala vo svojom súbore pacientov vznik nodálnej rekurencie u 45 % pacientov po resekcii svalovej fascie, zatiaľ čo v skupine pacientov so zachovaním svalovej fascie sa nodálna rekurencia objavila len u 14 % pacientov. Zaujímavým zistením bolo tiež pozorovanie, že resekcia svalovej fascie nemala vplyv na lokálnu rekurenciu. Olsenová vo svojej práci na základe týchto výsledkov pripisuje svalovej fascii určitú bariérovú funkciu v lymfatickej komunikácii intradermálnych a hlbokých subfasciálnych lymfatických ciev, ktorá po jej narušení zvyšuje riziko vzniku nodálnej ale nie lokálnej rekurenci [10,13]. Grotz záveruje výsledky svojej štúdie s odporúčaním zachovania svalovej fascie u malígnych melanómov na trupe a končatinách [10].
Tab. 3. Odporúčania NCCN pre bezpečnostný okraj pri excízii MM 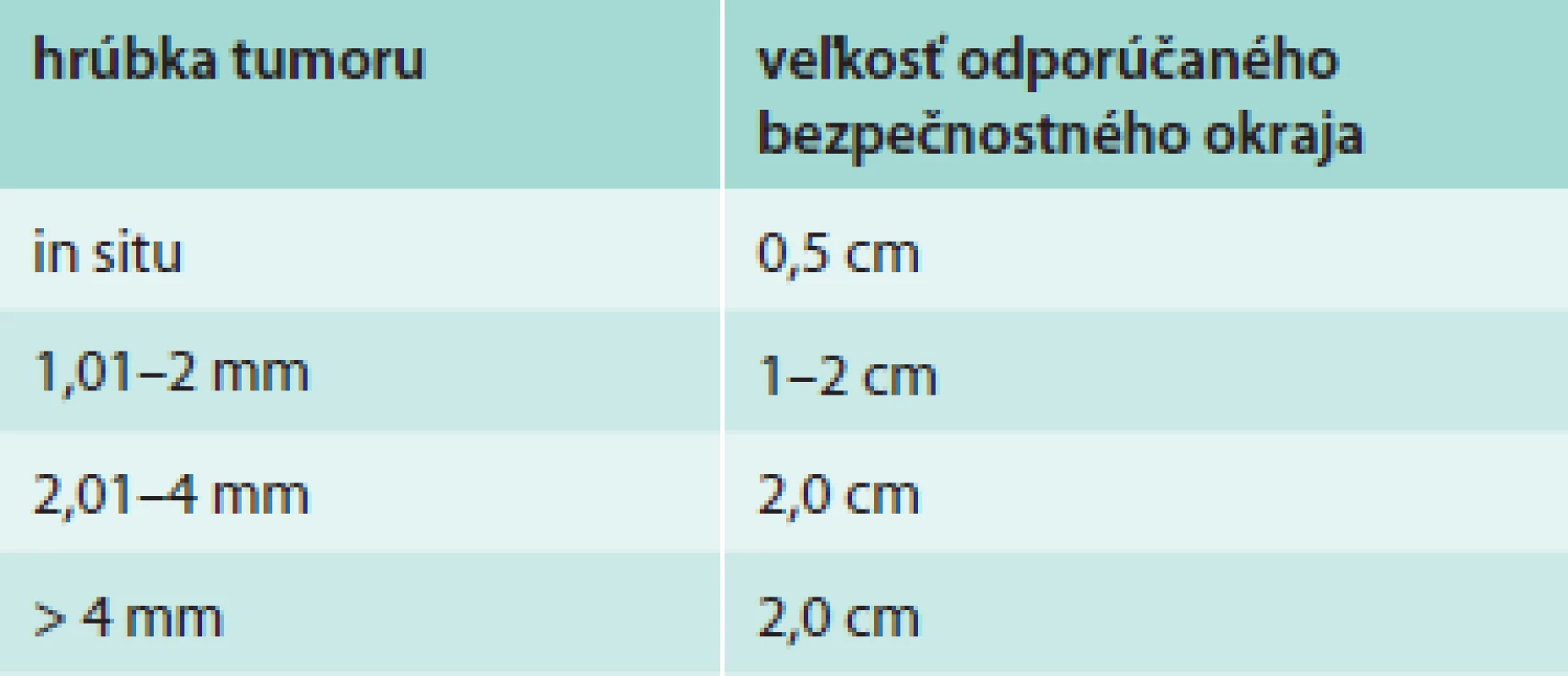
Ďalšiu nezastupiteľnú úlohu zohráva chirurgická liečba pri riešení spádovej lymfatickej drenáže. Za posledné desaťročie nastal významný posun od primárnej extenzívnej kompletnej disekcie spádových lymfatických uzlín (LU) ku menej agresívnej diagnostike a liečbe [14]. Kompletná disekcia spádových LU vychádzala z pozorovania, že väčšina primárnych kožných MM metastázuje prvotne cez intradermálne lymfatické cievy do spádových LU. Preventívna kompletná lymfadenektómia preukázala metastatické postihnutie spádových LU len u 20 % operovaných pacientov, teda pre 80 % pacientov nemala klinický prínos a vystavovala ich možnej operačnej morbidite [15]. Vzhľadom k uvedeným skúsenostiam sa na špecializovaných pracoviskách začalo používať duálne lymfatické mapovanie patentovou modrou a rádioizotopom s následnou SLNB [16]. Táto metóda je založená na pozorovaniach a skúsenostiach Mortona et al, z ktorých vyplýva, že sentinelová LU je prvá LU alebo skupina uzlín, do ktorých sa drénuje lymfa z oblasti postihnutia kože MM [17]. Predpokladá sa, že ak sa z MM uvoľnia metastatické bunky, tak sa uchytia práve v sentinelovej LU a až následne sa rozšíria aj do ďalších distálnejších regionálnych LU. Hematogénne šírenie nie je vylúčené, ale pomerne nízka frekvencia vzdialených metastáz u pacientov s tumor-negatívnou sentinelovou LU naznačuje, že táto cesta metastázovania je v počiatočných štádiách ochorenia menej častá [18].
Biopsia sentinelovej uzliny
Termín je vytvorený z anglického slova sentinel‚ (predsunutá) hliadka, stráž`, ktoré je prevzaté z francúzštiny (sentinelle) a pochádza z taliančiny (sentinella) s rovnakým významom [19]. V dnešnom medicínskom vnímaní ako sentinelovú LU označujeme tú uzlinu alebo skupinu uzlín, ktoré by nádorové bunky pri svojej migrácii nemali obísť, a preto sú najpravdepodobnejšie postihnuté metastázami, pričom sa nemusí jednať o uzliny, ktoré sa nachádzajú k tumoru anatomicky najbližšie [20]. Exstirpáciu týchto uzlín po ich identifikácii lymfoscintigraficky a vitálnou modrou označujeme ako SLNB [21]. SLNB je odporúčanou metódou na určenie štádia ochorenia a indikuje sa u pacientov s MM klasifikovaným ako T1b, T2, T3, T4 a bez klinických alebo rádiologických známok metastatického postihnutia regionálnych LU [22].
SLNB sa vykonáva buď súčasne s excíziou primárneho tumoru, ak je klinická diagnóza MM dostatočne jednoznačná, alebo sekvenčne po prvotnej excízii suspektnej lézie, ktorá bola po histologickom vyšetrení diagnostikovaná ako MM spĺňajúci indikačné kritéria pre SLNB. V druhom prípade sa podľa zhodnotenia resekčných okrajov v histopatologickom vyšetrení spolu so SLNB väčšinou vykonáva aj radikalizácia jazvy po excízii tumoru, keďže pri takomto postupe je bezpečnostný okraj prvotne excidovanej lézie zriedkavo dostatočný [1,23]. Niekoľko štúdii sa zaoberalo otázkou, či sa pri SLNB v prípade, že sa vykonáva až po excízii tumoru, detegujú a exstirpujú správne sentinelové LU. Nemecká štúdia Gauwerky et al nezistila štatisticky významný rozdiel v bezchorobnom prežívaní, miere progresie a celkovom prežívaní u pacientov s excíziou primárneho tumoru a SLNB vykonaných súčasne v porovnaní s pacientmi s excíziou primárneho tumoru a SLNB vykonaných v dvoch dobách [23]. Ďalšie štúdie rovnako potvrdili spoľahlivosť SLNB po predchádzajúcej excízii primárneho tumoru, pokiaľ sa jednalo o excíziu s primárnou sutúrou bez vykonania plastiky rotačným lalokom na prekrytie vzniknutého defektu [24,25].
Pred plánovanou operáciou sa najprv na pracovisku nukleárnej medicíny aplikuje rádiokoloid a následne sa vykonáva predoperačná lymfoscintigrafia. Lymfoscintigrafia je jediná metóda, ktorá presne určí, do akých spádových povodí lymfa odteká. U MM lokalizovaného na trupe pritom môže dôjsť k odhaleniu aj nečakanej spádovej oblasti, inej ako anatomicky očakávanej, a taktiež nie je zriedkavý ani odtok do dvoch a viacerých spádových lymfatických oblastí [1,20]. Dôležitosť predoperačnej lymfoscintigrafie spočíva tiež v odhalení intranzitných LU, ktoré sa nachádzajú v priebehu lymfatických ciev medzi primárnym nádorom a spádovou lymfatickou oblasťou a sú prítomné približne u 5–10 % pacientov [1]. Štúdia Chakera et al v ktorej bolo 10 rokov sledovaných 911 pacientov s MM, zistila zvýšenú rekurenciu MM v skupine pacientov s intranzitnými LU v porovnaní s ostatnými pacientmi [26]. V španielskej štúdii boli lymfoscintigraficky identifikované intranzitné LU u 80 z 900 pacientov a histopatologickým vyšetrením boli identifikované metastatické depozity v intranzitných LU u 15 pacientov, čo potvrdzuje dôležitosť identifikácie a exstirpácie intranzitných LU [27]. Na záver lymfoscintigrafického vyšetrenia sa na koži pacienta orientačne zakreslí poloha sentinelových LU. Ďalšie kroky vo vykonaní SLNB už prebiehajú na operačnom sále, kde sa najprv v úvode operácie aplikuje vitálne farbivo a pomocou ručnej gama-sondy sa v miestach označených v predoperačnej lymfoscintigrafii premeria aktuálna aktivita rádionuklidu. Po potvrdení zvýšenej aktivity v suspektných miestach uloženia sentinelových LU sa pristupuje k samotnej exstirpácii sentinelových LU. Po preparácii, pri ktorej sa v ideálnom prípade zafarbí prívodná lymfatická cesta, sa znovu gama-sondou pred samotnou exstirpáciou suspektnej sentinelovej LU, ktorá môže byť modro nafarbená, meria počet impulzov. Pri potvrdení aktívnej uzliny je táto exstirpovaná a zhodnotenie počtu impulzov sa gama sondou vykoná ešte raz už mimo tela pacienta [1,20].
Histopatologické hodnotenie sentinelovej LU
Sentinelové LU sú vyšetrované metódami klasickej histológie farbením hematoxylín-eozínom a imunohistochemicky pomocou S 100, HMB-45 a Melan-A protilátok [28]. Väčšina štúdií neodporúča peroperačné vyšetrenie uzlín zo zmrazeného rezu, hoci by sa tým predišlo operácii v ďalšom sedení v prípade potreby kompletnej lymfadenektómie pri peroperačne dokázanom metastatickom postihnutí sentinelových LU. Dôvodom neodporúčania peroperačnej analýzy sentinelových LU je nízka senzitivita vyšetrenia a tým pomerne vysoké percento falošne negatívnych nálezov [29,30]. Imunohistochemické vyšetrenie sentinelovej LU zvyšuje senzitivitu detekcie metastatického postihnutia najmä v prípade malých ložísk typu izolovaných nádorových buniek, ktoré pri bežnom farbení hematoxylínom-eozínom môžu byť ťažko odlíšiteľné od makrofágov. Protilátka proti S 100 proteínu ma vysokú senzitivitu pri detekcii melanómových buniek, ale v LU môžu byť prítomné aj falošne pozitívne nenádorové bunky, ako sú napr. reaktívne dendritické bunky, bunky nervových obalov, alebo névové bunky v nodálnom néve [31]. Protilátka HMB-45 vykazuje síce nižšiu senzitivitu detekcie melanómových buniek, ale umožňuje odlíšiť metastázu MM od benígnych névových elementov [1].
Okrem identifikácie metastázy v sentinelovej LU je dôležité určiť aj mikromorfometrické parametre depozitov, teda ich veľkosť, mikroanatomickú lokalizáciu v uzline, maximálnu hĺbku penetrácie (meranej od vnútorného okraja púzdra uzliny po najhlbšie uloženú tumorovú bunku v sentinelovej LU) a percento postihnutia krájanej plochy uzliny [32–34].
V súčasnosti sa skúma aj význam reverznej transkripčnej polymerázovej reťazovej reakcie (RT-PCR) pre detekciu metastáz MM v sentinelových LU [32]. Touto metódou je možné identifikovať aj jedinú malígnu bunku medzi miliónom nenádorových buniek. Pri RT-PCR sa využíva skutočnosť, že metastatické nádorové bunky exprimujú markery, ktoré sú špecifické pre pôvodné tkanivo, z ktorého pochádzajú, prípadne markery špecifické pre nádor. Expresia tejto tkanivovej špecifickej mRNA v mieste, v ktorom sa jej transkript normálne nenachádza, je známkou nádorového postihnutia [20]. Najčastejšie sa používa mRNA pre tyrozinázu, MAGE-3, MART-1 alebo gp100 [35,36]. Nevýhodou metódy je falošná pozitivita, keďže pozitívnu reakciu môžu vykazovať aj benígne névové bunky, ktoré bývajú niekedy prítomné v púzdre LU a exprimujú tyrozinázu. Za účelom eliminácie falošnej pozitivity sa RT-PCR začala vykonávať pre viaceré markery súčasne. Pri súčasnom používaní dvoch alebo viacerých melanómových markerov sa špecificita metódy podstatne zvyšuje [22]. Mikrometastatická choroba, ktorú nezachytí klasické histopatologické vyšetrenie, ale dokáže sa molekulárnou metódou, je klinicky relevantnou chorobou [37]. RT-PCR je vysoko senzitívna metóda na detekciu metastáz v sentinelových LU a je spoľahlivým prediktorom rekurencie ochorenia [38].
Klasifikácia metastatického postihnutia LU
V klinickej praxi sa pre popis rozsahu metastatického postihnutia LU pri MM používa rozdelenie podľa 7. edície AJCC klasifikácie z roku 2009, ktorá v N klasifikácii rozlišuje mikrometastázy, makrometastázy, satelitné metastázy a intranzitné metastázy [4] (tab. 1). Mikrometastázy sú definované ako klinicky okultné metastázy v sentinelových LU dokázané farbením hematoxylín-eozínom alebo imunohistochemicky bez bližšieho určenia minimálneho alebo maximálneho veľkostného prahu [7]. Makrometastázy sú klinicky zjavné metastázy potvrdené histopatologickým vyšetrením po lymfadenektómii postihnutej regionálnej oblasti. Metastázy vzdialené do 2 cm od primárneho tumoru sa nazývajú satelitné metastázy a metastázy lokalizované v oblasti od 2 cm od miesta primárneho tumoru po spádovú lymfatickú oblasť sa označujú ako intranzitné metastázy [2,7].
Na vyhodnotenie SLNB ako pozitívnej (klinické štádium III) teda postačuje aj imunohistochemický dôkaz jedinej tumoróznej bunky bez súčasného dôkazu farbením hematoxylín-eozínom [4,39]. Samotný imunohistochemický dôkaz je akceptovaný pri pozitivite aspoň jedného pre MM špecifického markera (HMB-45, Melan-A/MART 1) a ak súčasne majú bunky malígne morfologické charakteristiky, ktoré sú pozorovateľné v imunohistochemicky nafarbenom tkanive [4,40].
Záver
SLNB je v súčasnosti štandardnou súčasťou chirurgickej liečby MM a uznanou metódou určenia štádia, ktorá u pacientov s klinickým štádiom Ib alebo II odhaľuje klinicky okultné nodálne metastázy, čím identifikuje skupinu pacientov s okultným štádiom III MM, ktorí sa tak stávajú kandidátmi pre následnú kompletnú disekciu spádových LU a pre adjuvantnú systémovú liečbu [3,41,42].
Stav sentinelových LU je potvrdeným prognostickým faktorom [15]. Výsledky štúdie Balcha et al, 2010, preukázali, že pacienti s klinickým štádiom III majú významnú heterogenitu prognózy, pričom prežívanie pacientov s nodálnymi mikrometastázami bolo výrazne lepšie ako u pacientov s nodálnymi makrometastázami. Celkové 5-ročné prežívanie u pacientov s mikrometastázami bolo 67%, pričom percento prežívania záviselo od počtu metastaticky postihnutých LU. Pri postihnutí 1 LU bolo 5-ročné prežívanie 71%, zatiaľ čo pri postihnutí 4 a viacerých LU sa 5-ročné prežívanie podstatne znížilo na 36%. Celkové prežívanie pacientov s nodálnymi makrometastázami bolo 43% a taktiež bolo nižšie u pacientov s viacnásobným postihnutím LU [43].
Štúdia Multicenter Selective Lymphadenectomy Trial-I (MSLT-I) porovnávala skupinu pacientov, ktorí podstúpili radikálnu excíziu primárneho tumoru so súčasnou SLNB a skupinu pacientov, ktorí podstúpili len radikálnu excíziu primárneho tumoru s následným sledovaním až do vzniku klinicky zjavných nodálnych metastáz s následnou lymfadenektómiou. V štúdii nebol síce dokázaný rozdiel v celkovom prežívaní sentinelovej a observačnej skupiny, ale bolo preukázané zlepšenie prežívania bez choroby v sentinelovej skupine [15,22]. Táto skutočnosť bola preukázaná v kohortách pacientov s MM hrúbky 1,2–3,5 mm a > 3,5 mm. V tejto štúdii bolo príliš málo prípadov lézii tenších ako 1,2 mm postačujúcich pre preukaznú analýzu bezchorobného prežívania. U pacientov s hrúbkou MM 1,2–3,5 mm bolo 5-ročné bezchorobné prežívanie 78,0 ± 1,6 % v sentinelovej skupine vs 72,7 ± 2,0 % v observačnej skupine (p = 0,0074). V skupine pacientov s hrúbkou MM > 3,5 mm bolo bezchorobné prežívanie 56,0 ± 3,0 % v sentinelovej skupine vs 43,5 ± 4,7 % v observačnej skupine (p = 0,0358) [15].
MSLT-I štúdia ďalej preukázala, že vykonanie SLNB je tiež v korelácii s prežívaním špecifickým pre MM, ale len v podskupine pacientov s pozitivitou LU pri MM hrúbky 1,2–3,5 mm. Pacienti v skupine podrobenej SLNB mali lepšie 5-ročné pre MM špecifické prežívanie ako pacienti v observačnej skupine [69,6 ± 4,4 % v sentinelovej skupine vs 56,5 ± 5,5 % v observačnej skupine, (p = 0,004)] [15,22].
Vykonanie SLNB s následnou ihneď vykonanou kompletnou lymfadenektómiou pri pozitivite sentinelových LU prispieva taktiež k eliminácii úzkosti pacientov z očakávania možného vzniku nodálnych metastáz, ak sú pacienti prvotne len klinicky sledovaní. MSLT-I štúdia tiež zistila, že po kompletnej lymfadenektómii sú frekvencia výskytu a stupeň závažnosti lymfedému väčšie, ak bola lymfadenektómia vykonaná až neskôr pri klinickom prejavení sa metastázovania do LU v porovnaní so včasnou lymfadenektómiou vykonanou ihneď po zistení pozitívneho nálezu v sentinelových LU [7,15].
V súčasnosti je kompletná lymfadenektómia štandardne odporúčaná u pacientov s metastatickým postihnutím sentinelových LU [7]. Predmetom ďalšieho skúmania je otázka, či odstránenie nesentinelových LU u pacientov, ktorí mali odstránenú pozitívnu sentinelovú LU, prináša terapeutický úžitok, keďže väčšina pacientov s pozitívnou sentinelovou LU nemá v čase kompletnej lymfadenektómie postihnutie nesentinelových LU. Štúdia Multicenter Selective Lymphadenectomy Trial-II (MSLT-II), ktorej výsledky nie sú zatiaľ známe, má za úlohu vyhodnotiť, či kompletná lymfadenektómia vykonaná po pozitívnej SLNB zlepšuje prežívanie [7,15]. Táto štúdia porovnáva rameno pacientov, ktorí sa podrobili SLNB s následnou kompletnou lymfadenektómiou a rameno pacientov, u ktorých bola vykonaná SLNB s histopatologickým alebo molekulárnym dôkazom metastáz a následne sú sledovaní pomocou ultrasonografie. Pri potvrdení hypotézy, že pri väčšine pacientov s metastatickým postihnutím sentinelových LU by bolo možné ustúpiť od kompletnej lymfadenektómie, by sa vykonaniu SLNB pripísal nielen diagnostický, ale aj terapeutický efekt [15].
MUDr. Eva Rovenská
rovenska@yahoo.com
Národný onkologický ústav, Bratislava
www.nou.sk
Doručeno do redakce: 21. 2. 2014
Přijato po recenzi: 21. 3. 2014
Zdroje
1. Krajsová I. Melanom. Maxdorf: Praha 2006. ISBN 80–7345–096–8.
2. Garbe C, Peris K, Hauschild A et al. Diagnosis and treatment of melanoma. European consensus-based interdisciplinary guideline-update 2012. Eur J Cancer 2012; 48(15): 2375–2390.
3. Mervic L. Prognostic factors in patients with localized primary cutaneous melanoma. Acta dermatovenerol Alp Panonica Adriat 2012; 21(2): 27–31.
4. Balch CM, Gershenwald JE, Soong SJ et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009; 27(36): 6199–6206.
5. Balch CM, Buzaid AC, Soong SJ et al. Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma. J Clin Oncol 2001; 19(16): 3635–3648.
6. Sekula-Gibbs SA, Shearer MA Sentinel node biopsy should be offered in thin melanoma with mitotic rate greater than one. Dermatol Surg 2011; 37(8): 1080–1088.
7. Wong SL, Balch CM, Hurley P et al. Sentinel lymph node biopsy for melanoma: American society of clinical oncology and society of surgical oncology joint clinical practice guideline. J Clin Oncol 2012; 30(23): 2912–2918.
8. Mocellin S, Pasquali S, Nitti D. The impact of surgery on survival of patients with cutaneous melanoma. Revisiting the role of primary tumor excision margins. Ann Surg 2011; 253(2): 238–243.
9. Anderson KC, Alsina M, Bensinger W. Multiple myeloma, version 1.2013. J Natl Compr Canc Netw 2013; 11(1): 11–17.
10. Grotz TE, Glorioso JM, Pockaj BA et al. Preservation of the deep muscular fascia and locoregional control in melanoma. Surgery 2013; 153(4): 535–541.
11. Benca J, Rovenská E, Karaba M. Chirurgická terapia malígneho melanómu. Onkológia 2013; 8(3): 156–158.
12. Grotz TE, Markovic SN, Erickson LA et al. Mayo clinic consensus recommendations for the depth of excision in primary cutaneous melanoma. Mayo Clin Proc 2011; 86(6): 522–528.
13. Olsen G. Removal of fascia – cause of more frequent metastases of malignant melanomas of the skin to regional lymph nodes? Cancer 1964; 17 : 1159–1164.
14. Hlavatá Z. Čaká nás „nová éra” v malígnom melanóme? Onkológia 2011; 6(5): 282–285.
15. Morton DL. Overview and update of the phase III Multicenter Selective Lymphadenectomy Trials (MSLT-I and MSLT-II) in melanoma. Clin Exp Metastasis 2012; 29(7): 699–706.
16. Morton DL, Thompson JF, Essner R et al. Validation of the accuracy of intraoperative lymphatic mapping and sentinel lymphadenectomy for early-stage melanoma: a multicenter trial. Ann Surg 1999; 230(4): 453–463.
17. Morton DL, Wen DR, Wong JH et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992; 127(4): 392–399.
18. Balch CM, Morton DL, Gershenwald JE et al. Sentinel node biopsy and standard of care for melanoma. J Am Acad Dermatol 2009; 60(5): 872–875.
19. Šimša J et al. Sentinelová uzlina. Lymfadenektomie u solidních nádorů. Maxdorf: Praha 2010. ISBN 978–80–7345–213–1.
20. Fait V, Chrenko V, Gatěk J et al. Biopsie sentinelové uzliny u kožních nádorů. In: Neoral Č, Bohanes T et al. Biopsie sentinelové uzliny. Galén: Praha 2012. ISBN 978–80–7262–882–7.
21. Baldwin BT, Cherpelis BS, Sondak V et al. Sentinel lymph node biopsy in melanoma: facts and controversies. Clin Dermatol 2010; 28(3): 319–323.
22. Stebbins WG, Garibyan L, Sober AJ. Sentinel lymph node biopsy and melanoma: 2010 update Part II. J Am Acad Dermatol 2010; 62(5): 737–748.
23. Gauwerky KJ, Kunte C, Geimer T et al. The outcome of patients with melanoma is not associated with the time point of lymphatic mapping with respect to excisional biopsy of the primary tumor. Dermatology 2010; 220(4): 355–362.
24. Karakousis CP, Grigoropoulos P. Sentinel node biopsy before and after wide excision of the primary melanoma. Ann Surg Oncol 1999; 6(8): 785–789.
25. McCready DR, Ghazarian DM, Hershkop MS et al. Sentinel lymph-node biopsy after previous wide local excision for melanoma. Can J Surg 2001; 44(6): 432–434.
26. Chakera AH, Hansen LB, Lock-Andersen J et al. In-transit sentinel nodes must be found: implication from a 10-year follow-up study in melanoma. Melanoma Res 2008; 18(5): 359–364.
27. Ortín-Pérez J, Vidal-Sicart S, Doménech B et al. In-transit sentinel lymph nodes in malignant melanoma. What is their importance? Rev Esp Med Nucl 2008; 27(6): 424–429.
28. Lens M. Sentinel lymph node biopsy in melanoma patients. J Eur Acad Dermatol Venereol 2010; 24(9): 1005–1012.
29. Badgwell BD, Pierce C, Broadwater JR et al. Intraoperative sentinel lymph node analysis in melanoma. J Surg Oncol 2011; 103(1): 1–5.
30. Koopal SA, Tiebosch AT, Albertus Piers D et al. Frozen section analysis of sentinel lymph nodes in melanoma patients. Cancer 2000; 89(8): 1720–1725.
31. Starz H. Pathology of the sentinel lymph node in melanoma. Semin Oncol 2004; 31(3): 357–362.
32. Scolyer RA, Murali R, McCarthy SW et al. Pathologic examination of sentinel lymph nodes from melanoma patients. Semin Diagn Pathol 2008; 25(2): 100–111.
33. Scolyer RA, Murali R, Satzger I et al. The detection and significance of melanoma micrometastases in sentinel nodes. Surg Oncol 2008; 17(3): 165–174.
34. Bogenrieder T, van Dijk MR, Blokx WAM et al. No non-sentinel node involvement in melanoma patients with limited Breslow thickness and low sentinel node tumour load. Histopathology 2011; 59(2): 318–326.
35. Cook MG, Green MA, Anderson B et al. The development of optimal pathological assessment of sentinel lymph nodes for melanoma. J Pathol 2003; 200(3): 314–319.
36. Stebbins WG, Garibyan L, Sober AJ. Sentinel lymph node biopsy and melanoma: 2010 update Part I. J Am Acad Dermatol 2010; 62(5): 723–734.
37. Shivers S, Jakub J, Pendas S et al. Molecular staging for patients with malignant melanoma. Expert Rev Anticancer Ther 2007; 7(11): 1665–1674.
38. Romanini A, Manca G, Pellegrino D et al. Molecular staging of the sentinel lymph node in melanoma patients: correlation with clinical outcome. Ann Oncol 2005; 16(11): 1832–1840.
39. Garbe C, Eigentler TK, Bauer J et al. Histopathological diagnostics of malignant melanoma in accordance with the recent AJCC classification 2009: review of the literature and recommendations for general practice. J Dtsch Dermatol Ges 2011; 9(9): 690–699.
40. Piris A, Mihm jr. MC, Duncan LM. AJCC melanoma staging update: impact on dermatopathology practice and patient management. J Cutan Pathol 2011; 38(5): 394–400.
41. Johnson T, Sondak VK, Bichakjian CK et al. The role of sentinel lymph node biopsy for melanoma: Evidence assessment. J Am Acad Dermatol 2006; 54(1): 19–27.
42. Gershenwald JE, Soong SJ, Balch CM. 2010 TNM staging system for cutaneous melanoma ...and beyond. Ann Surg Oncol 2010; 17(6): 1475–1477.
43. Balch CM, Gershenwald JE, Soong SJ et al. Multivariate analysis of prognostic factors among 2313 patients with stage III melanoma: comparison of nodal micrometastases versus macrometastases. J Clin Oncol 2010; 28(14): 2452–2459.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo 5-6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Erdheimova-Chesterova choroba – poddiagnostikovaná zriedkavá choroba? – editorial
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – editorial
- Přínos natriuretických peptidů v současné klinické praxi – editorial
- Sentinelová biopsie, stručný nástin problematiky – editorial
- Časování chirurgické a endoskopické terapie akutní biliární pankreatitidy v podmínkách terciární nemocnice v České republice
- Necílená biopsie pleury v diagnostice maligního pleurálního výpotku – naše zkušenosti za posledních 15 let
- Význam EKG u pacientov s resynchronizačnou liečbou
- Srdcové zlyhávanie – dá sa liečiť ovplyvnením kardiálneho metabolizmu?
- Difuzní idiopatická skeletární hyperostóza
- Proč a jak působí inzulinové přípravky na hmotnost
- Význam chuti v udržení homeostázy organizmu a patologický dopad vyrušení orocefalických reflexů ve vazbě na sladkou chuť v následku konzumace nekalorických sladidel
- Životní styl a riziko civilizačních nemocí
- Management chronických onemocnění v mezinárodním srovnání
- Rizikové faktory a prediktory progrese Barrettova jícnu do adenokarcinomu
- Přínos natriuretických peptidů v současné klinické praxi
- Sentinelová uzlina pri malígnom melanóme
- Manažment angioedému. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory (2013)
- PET-CT dokumentovaná kompletní 4letá remise Erdheimovy-Chesterovy nemoci po léčbě kladribinem
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Extraadrenálny paraganglióm
- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Ruptura jater s hemoperitoneem jako vzácná komplikace kardiopulmonální resuscitace u mladé pacientky s akutním infarktem myokardu
- Near-infrared spectroscopy (NIRS), nová technika intrakoronárního zobrazení nestabilního koronárního plátu
- Význam stanovení natriuretických peptidů a prokalcitoninu u akutního srdečního selhání
- XVII International Congress on Nutrition and Metabolism in Renal Disease
- Rozlúčka s profesorom Ďurišom, nestorom Slovenskej internej medicíny
- Z odborné literatury
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Stillova nemoc dospělých – obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie
- Purple urine bag syndrome – raritní, ale nepřehlédnutelný příznak močové infekce
- Difuzní idiopatická skeletární hyperostóza
- Sentinelová uzlina pri malígnom melanóme
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy