-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné možnosti léčby hyponatremie
Current options of treatment of hyponatremia
During the past 50 years the molecular mechanisms of renal reabsorption of sodium and water have been described and molecules specifically interfering with these mechanisms have been developed (diuretics, vasopressin receptor antagonists). Chronic hyponatremia is caused by relative excess of free water, it occurs within a broad spectrum of diseases associated with hypervolemia (heart failure, liver cirrhosis), normovolemia and hypovolemia and it is a negative prognostic factor for patients with chronic heart failure and cirrhotic ascites. Vaptans (vasopressin antagonists, vasopressin V2-receptor inhibitors) reduce reabsorption of water in the distal nephron, they increase free water excretion and normalize serum concentrations of sodium in normovolemic and hypervolemic conditions associated with hyponatremia. Hyponatremia can be corrected (depending on cause, severity and speed of development) through the reduction of fluid intake, administration of a hypertonic solution NaCl, diuretics, oral administration of urea and by vaptans. The role of vaptans in the treatment of hyponatremia should be defined even better, in Europe vaptans can be used to treat the syndrome of inadequate antidiuretic hormone secretion (SIADH).
Key words:
hyponatremia – liver cirrhosis – heart failure – syndrome of inadequate secretion ADH – tolvaptan – vasopressin
Autoři: Vladimír Tesař
Působiště autorů: Klinika nefrologie 1. LF UK a VFN v Praze
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 6): 97-101
Kategorie: Přehledné referáty
Souhrn
V posledních 50 letech byly poznány molekulární mechanizmy renální resorpce sodíku a vody a byly vyvinuty molekuly, které s těmito mechanizmy specificky interferují (diuretika, antagonisté receptorů pro vazopresin). Chronická hyponatremie je způsobena relativním nadbytkem volné vody, vyskytuje se u širokého spektra chorob spojených s hypervolemií (srdeční selhání, jaterní cirhóza), normovolemií i hypovolemií a je u pacientů s chronickým srdečním selháním a ascitickou jaterní cirhózou negativním prognostickým faktorem. Vaptany (antagonisté vazopresinu, inhibitory V2 receptoru pro vazopresin) snižují zpětnou resorpci vody v distálním nefronu, zvyšují vylučování volné vody a u normovolemických a hypervolemických stavů spojených s hyponatremií normalizují sérové koncentrace sodíku. Hyponatremii lze (dle příčiny, závažnosti a rychlosti vývoje) korigovat omezením příjmu tekutin, podáním hypertonického roztoku NaCl, diuretiky, perorálním podáním urey a vaptany. Místo vaptanů v léčbě hyponatremie je třeba ještě lépe definovat, v Evropě je možné jejich použití u syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH).
Klíčová slova:
hyponatremie – jaterní cirhóza – srdeční selhání – syndrom nepřiměřené sekrece ADH – tolvaptan – vazopresinHistorický úvod
Rutinní měření sérového sodíku pomocí plamenné fotometrie bylo do klinické medicíny zavedeno teprve v druhé polovině 40. let 20. století [1]. V průběhu 50.–80. let minulého století byly pomocí mikropunkčních a mikroperfuzních studií definovány mechanizmy renální resorpce sodíku a vody [2] a faktory, které resorpci sodíku a vody regulují [3]. Molekulární charakteristika transportních systémů pro ionty, vodu a další anorganické a organické molekuly se rozšířila teprve od začátku 90. let 20. století. V současné době máme velmi přesnou představu, jakým způsobem probíhá v různých částech nefronu zpětná resorpce sodíku [4]. Mechanizmus regulace glomerulární filtrace v závislosti na množství sodíku dodaného k macula densa v distálním nefronu (tzv. tubuloglomerulární zpětná vazba) byl sice popsán již před více než 70 lety [5], ale praktické využití tohoto mechanizmu v terapii onemocnění ledvin je spojeno teprve s inhibitory kontransportu sodíku a glukózy v proximálním tubulu (sodium/glucose cotransporter – SGLT2).
Hyponatremie souvisí obvykle s neadekvátně vysokou zpětnou resorpcí vody v distálním nefronu. Význam zadního laloku hypofýzy pro regulace zpětné resorpce vody byl objeven již v 2. dekádě 20. století a vazopresin (antidiuretický hormon) byl popsán v 50. letech 20. století [6]. Zásadním průlomem pro pochopení mechanizmů zpětné resorpce vody v ledvinách byl ale teprve objev vodních kanálů – aquaporinů [7].
Regulace zpětné resorpce vody v ledvinách
Vazopresin (antidiuretický hormon – ADH) je uvolňován z hypofýzy po stimulaci osmoreceptoru v zadním laloku hypofýzy. Vazopresin snižuje prostřednictvím svého V2 receptoru exkreci volné vody, neovlivňuje ale exkreci osmoticky aktivních látek [8]. Citlivost hypofyzárního osmoreceptoru závisí také na volumovém stavu. Plazmatická osmolalita, při které dochází k aktivaci osmoreceptoru, se při hypovolemii snižuje.
V2 receptory jsou lokalizovány v distálním nefronu na krevním pólu tubulární buňky. Jejich aktivace vazopresinem zvyšuje expresi vodního kanálu aquaporinu 2 na luminální membráně tubulární buňky, a tím zvyšuje zpětnou resorpci vody tubulem. Tento proces vyžaduje aktivaci kaskády intracelulárních mechanizmů (např. cAMP, proteinkinázy A aj), které by se v budoucnu mohly také stát cílem terapeutických intervencí.
Porucha sekrece vazopresinu je příčinou centrálního diabetes insipidus, nefrogenní diabetes insipidus může být důsledkem mutace V2 receptoru nebo aquaporinu 2.
V tomto přehledu se ale dále budu zabývat pouze stavy, které jsou spojeny se zvýšenou zpětnou resorpcí vody v tubulech a jsou obvykle provázeny různě závažnou hyponatremií.
Hyponatremie
Hyponatremie je pokles plazmatické koncentrace sodíku < 135 mmol/l. Hyponatremie se obvykle dělí podle závažnosti na lehkou (130–134 mmol/l), středně těžkou (125–129 mmol/l) a těžkou (< 125 mmol/l) [9]. Hyponatremie, která se vyvinula během méně než 48 hod, je označována jako akutní hyponatremie, hyponatremii trvající déle než 48 hod nebo o jejíž délce nevíme, pokládáme za chronickou hyponatremii. Hyponatremie může být asymptomatická, nebo může mít středně závažné (nauzea bez zvracení, zmatenost, bolesti hlavy) až velmi závažné klinické symptomy (zvracení, křeče, kóma a poruchy dechu a srdečního oběhu). Hyponatremie je často jen jedním z projevů celkové těžkého stavu pacienta a zejména u lehčích forem hyponatremie je nutno vzít v úvahu, že přítomné klinické projevy nemusí být (jen) důsledkem hyponatremie.
U pacientů s nízkou sérovou koncentrací sodíku je vždy nutno vyloučit pseudohyponatremii, která je způsobena zvýšenou solidní frakcí séra (např. při hypertriglyceridemii, monoklonální gamapatii, nebo po podání intravenózních imunoglobulinů). U pacientů s významnou hyperglykemií je nutno výpočtem korigovat měřenou natremii, skutečná natremie je významně vyšší.
V diferenciální diagnostice hyponatremie (tab. 1) je třeba nejdříve vyloučit nehypotonickou hyponatremii, která je obvykle způsobena přítomností osmoticky aktivních solutů (hyperglykemie, podání manitolu, hyperosmolárních kontrastních látek a dále může být přítomna u pacientů s vysokou koncentrací urey v séru – při renálním selhání nebo při zvýšeném katabolizmu). U pacientů s osmolalitou séra < 275 mmol/l jde vždy o hypotonickou hyponatremii [9].
Tab. 1. Klasifikace hyponatremie dle osmolality plazmy. 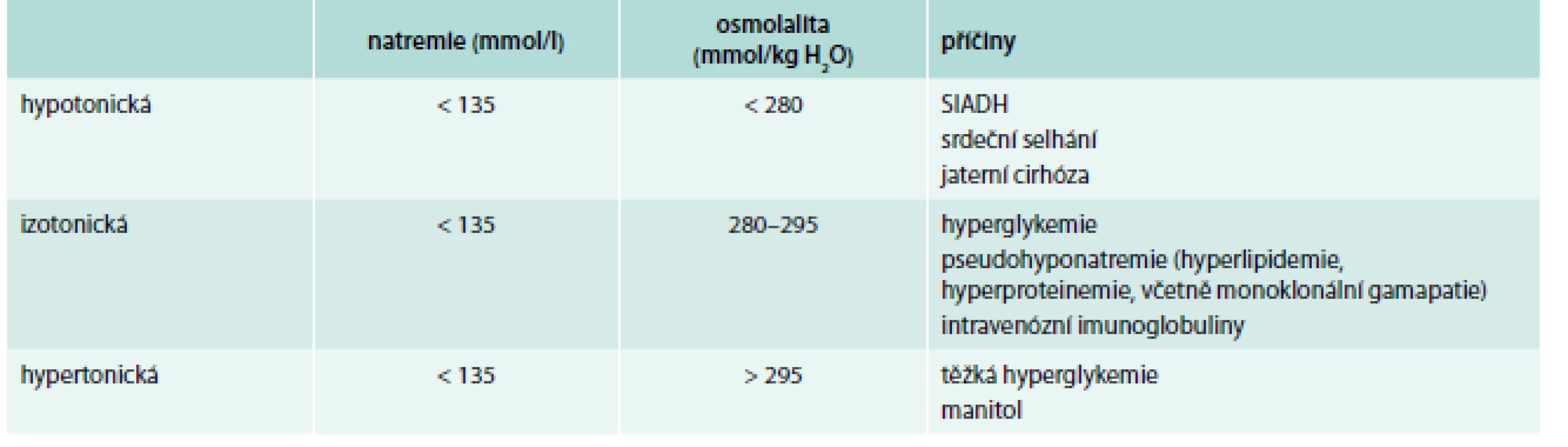
Upraveno podle [9,26] U pacientů s hypotonickou hyponatremií je pak třeba především rozhodnout, zda jde o hyponatremii akutní nebo chronickou a posoudit tíži klinických symptomů spojených s hyponatremií. Akutní hyponatremie se vyskytuje v pooperačním období, někdy může vzniknout v souvislosti s přípravou na koloskopii. Z léků může akutní hyponatremii vyvolat léčba diuretiky, intravenózním cyklofosfamidem, oxytocinem a deriváty vazopresinu (např. terlipresinem nebo desmopresinem) a také některými deriváty amfetaminu.
Vyšetření osmolality moči (ve vzorku moči) nám umožní rozlišit primárně vysoký příjem volné vody (osmolalita moči < 100 mmol/l), např. u primární polydipsie, pijáků piva nebo jiných tekutin s nízkým obsahem osmoticky aktivních látek. U pacientů s osmolalitou moči > 100 mmol/l, je nutno doplnit vyšetření sodíku v moči (vzorku moči).
Koncentrace sodíku v moči < 30 mmol/l je obvykle vyvolána nízkým efektivním arteriálním krevním objemem, buď u hypervolemických pacientů se srdečním selháním, ascitickou jaterní cirhózou nebo nefrotickým syndromem, nebo u hypovolemických pacientů (např. při průjmech, teplotách, ztrátách tekutin do třetího prostoru, či neadekvátní diuretické léčbě v předchozím období).
Pokud je koncentrace sodíku v moči > 30 mmol/l, je nutno vyloučit chronické onemocnění ledvin nebo aktuálně probíhající neadekvátní léčbu diuretiky a u zbylých pacientů opět posoudit volumový stav. U pacientů se sníženým objemem extracelulární tekutiny může být příčinou zvracení, průjem, renální tubulární ztráty (salt-losing nephropathy), nebo syndrom cerebrálně podmíněných ztrát soli (cerebral salt wasting). Vždy je také třeba myslet na nepřiznaný abúzus diuretik. U pacientů se zvýšeným objemem extracelulární tekutiny by mohlo jít (po vyloučení abúzu diuretik, hypotyreózy a adrenální insuficience) o syndrom nepřiměřené sekrece antidiuretického hormonu (syndrome of inappropriate antidiuretic hormone/SIADH – nebo také nověji o syndrom nepřiměřené antidiurézy – syndrome of inappropriate antidiuresis/SIAD).
SIADH může být vyvolán paraneoplastickou produkcí vazopresinu některými tumory (např. malobuněčným karcinomem plic), dále se může vyskytnout u některých plicních infekcí, infekcí a jiných onemocnění centrálního nervového systému, vždy je ale nutné vyloučit možnou lékovou etiologii (antidepresiva, antiepileptika, antipsychotika; některá cytostatika – vinca alkaloidy, ifosfamid, cyklofosfamid, melfalan, metotrexát, či deriváty platiny; analoga vazopresinu a některé další léky).
Chronická hyponatremie je u pacientů s chronickým srdečním selháním [10] i jaterní cirhózou [11] významným negativním prognostickým faktorem a prediktorem mortality. Naopak korekce hyponatremie zlepšuje u pacientů s ascitickou jaterní cirhózou kognitivní funkce [12].
Léčba hyponatremie
K léčbě hyponatremie je třeba přistupovat různě v závislosti na tom, zda jde o akutní či chronickou hyponatremii, jaká je její tíže, jak závažné jsou její symptomy a jaký je objem extracelulární tekutiny (tab. 2) [9,13].
Tab. 2. Možnosti léčby hyponatremie. 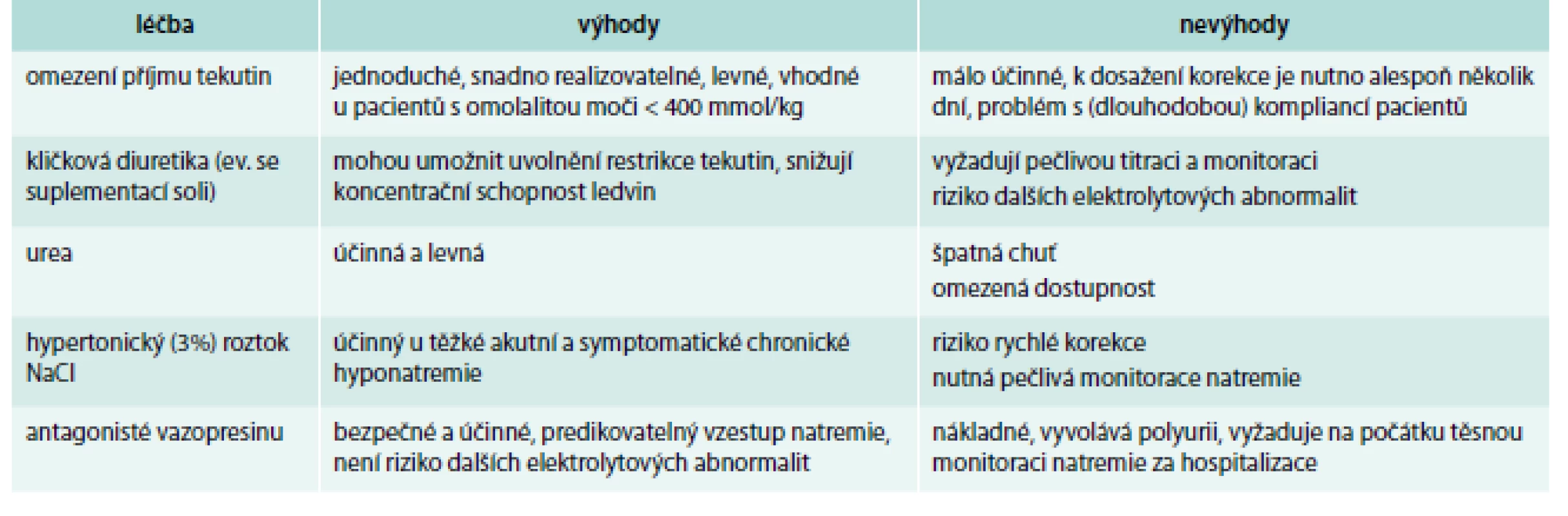
Upraveno podle [9,13,26] U hyponatremie s těžkými klinickými symptomy (akutní i chronické) zahajujeme léčbu podáním 150 ml 3% NaCl během 20 min s následnou kontrolou natremie. Stejnou infuzi je možno ještě jednou opakovat, pokud není dosaženo vzestupu natremie o 5 mmol/l. Po dosažení vzestupu sérového natria o 5 mmol/l není další podávání 3% NaCl vhodné a pokud infuze ještě kape, je třeba ji zastavit. Natremie nemá stoupnout během prvních 24 hod o více než 10 mmol/l, další dny o více než 8 mmol/l/den. Sérové natrium je zpočátku vhodné kontrolovat každých 6–12 hod, další dny alespoň 1krát denně.
Hyponatremii se středně závažnými symptomy lze také léčit jednorázovým podáním 150 ml 3% NaCl během 20 min a i pro ni platí stejná pravidla týkající se vzestupu natremie v prvních 24 hod a dalších dnech léčby.
U chronické hyponatremie bez těžkých nebo středně těžkých klinických projevů se v léčbě omezujeme pouze na případnou (u středně těžké a těžké hyponatremie) restrikci tekutin a omezení přívodu hypotonických roztoků a dále se snažíme zjistit příčinu hyponatremie. Restrikce tekutin je zvláště důležitá zejména u pacientů s hypervolemií.
Akutní asymptomatickou nebo jen mírně symptomatickou hyponatremii léčíme zejména restrikcí tekutin a vyřazením všech faktorů, které mohly přispět k jejímu rozvoji (např. zastavením podávání hypotonických roztoků). Pokud je akutní pokles natremie výraznější (< 125 mmol/l), lze i v těchto případech zvážit jednorázové podání infuze 150 ml 3% NaCl.
U pacientů se SIADH má rovněž zásadní význam restrikce tekutin, která může být doplněna perorální léčbou ureou nebo NaCl.
U pacientů s hyponatremií a hypovolemií je nutno především doplnit objem tekutin izotonickými roztoky.
Hypotonická hyponatremie je charakterizována poklesem osmolarity v CNS a rozvojem edému mozku. Hematoencefalická bariéra je volně prostupná pro vodu, ale nikoli pro sodík [14,15]. K časné, rychlé adaptaci na hyponatremii (pokles objemu mozku) dochází během několika dnů poklesem koncentrace mozkových elektrolytů, během dalších několika dnů se objem mozku normalizuje v důsledku ztráty organických osmolytů. Příliš rychlá korekce hyponatremie vede k osmotické dehydrataci mozku a demyelinizaci [16].
Antagonisté vazopresinu
V průběhu 90. let 20. století se podařilo vyvinout nepeptidové antagonisty V2 receptoru pro vazopresin, které se vyznačují různou mírou selektivity k V2 receptoru (různým stupněm inhibice V1 receptoru). Tolvaptan, s kterým proběhlo nejvíce klinických studií, je vysoce selektivní k V2 receptoru (poměr selektivity V2/V1 je 29) a má poměrně krátký biologický poločas 6–8 hod.
Tolvaptan byl testován ve 2 velkých randomizovaných kontrolovaných studiích (SALT1 a SALT2) u 448 pacientů s euvolemickou (SIADH) nebo hypervolemickou (srdeční selhání, jaterní cirhóza) hyponatremií. Natremie stoupla významně více u pacientů léčených tolvaptanem, a to již 4. den a byla významně vyšší i 30. den studie, vzestup natremie u pacientů léčených tolvaptanem byl významně vyšší u pacientů s mírnou i u pacientů s těžkou hyponatremií [17]. Tolvaptan byl dobře tolerován, pacienti léčení tolvaptanem udávali ve srovnání s placebem častěji žízeň, suchost v ústech a slabost.
Ve studii SALTWATER [18] bylo 111 pacientů, kteří byli původně léčeni tolvaptanem nebo placebem 1 měsíc ve studiích SALT1 a SALT2 převedeno na tolvaptan a sledováno celkem v průměru 701 dní. Tolvaptan udržel po celou dobu sledování stabilní natremii, léčba byla dobře tolerována, nejčastějšími nežádoucími účinky byly žízeň, polakisurie, únava, suchost v ústech, polydipsie a polyurie.
Účinnost a bezpečnost tolvaptanu byla ve studiích SALT1 a SALT2 samostatně hodnocena u 110 pacientů se SIADH [19]. Natremie byla 30. den léčby normalizována ve srovnání s placebem u významně vyššího počtu pacientů léčených tolvaptanem (67 % vs 27 %). Pacienti léčení tolvaptanem měli větší diurézu, větší příjem tekutin a více negativní bilanci tekutin. U pacientů léčených tolvaptanem byla statisticky významně (resp. hraničně významně) zlepšena fyzická i psychická komponenta SF–12. Léčbou tolvaptanem bylo ve srovnání s placebem dosaženo lepší korekce natremie i u 27 hyponatremických pacientů s malignitou [20]. U pacientů s SIADH byla léčba tolvaptanem srovnatelně účinná jako léčba perorální ureou [21].
Tolvaptan byl srovnáván s agonistou ANP carperitidem u 109 pacientů s akutním srdečním selháním [22]. Léčba tolvaptanem byla spojena s větší diurézou, menším poklesem TK, méně nežádoucími účinky a nižší cenou. Ve studii EVEREST [23] bylo 537 pacientů s horšícím se srdečním selháním randomizováno k tolvaptanu nebo placebu a sledováno v průměru 9,9 měsíců.
Tolvaptan neovlivnil celkovou ani kardiovaskulární mortalitu, ale snížil tělesnou hmotnost, zmírnil edémy a zlepšil dušnost. I v této studii byla tolerance tolvaptanu dobrá, hlavními nežádoucími účinky byla žízeň a suchost v ústech. Subanalýza studie EVEREST [24] ukázala podstatně horší prognózu u pacientů s (perzistující) hyponatremií a nižší mortalitu (ve srovnání s placebem) u pacientů s alespoň středně těžkou hyponatremií léčených tolvaptanem. Pacienti léčení tolvaptanem navíc vyžadovali nižší dávky diuretik.
Vaptany v doporučení pro léčbu hyponatremie
Tolvaptan (a konivaptan) je v USA registrován pro léčbu klinicky významné hypervolemické nebo euvolemické hyponatremie, včetně hyponatremie u srdečního selhání a SIADH, v Kanadě je tolvaptan registrován pro klinicky významnou non-hypovolemickou hyponatremii, v Evropě je naproti tomu tolvaptan registrován pouze pro hyponatremii u SIADH [25].
Podobně se výrazně rozcházejí v indikaci léčby hyponatremie vaptany i existující klinická doporučení. Zatímco evropská doporučení [9] nedoporučují použití vaptanů u žádného typu hyponatremie, doporučení amerického panelu expertů [26] doporučují použití vaptanu u pacientů s euvolemickou nebo hypervolemickou hyponatremií s výjimkou pacientů s chronickým onemocněním jater. Panel expertů [26] doporučuje vaptany jako ev. léčbu první volby (vedle restrikce tekutin a zejména u pacientů, kteří z jakéhokoli důvodu nejsou schopni dodržovat restrikci tekutin) u pacientů s SIADH (a podobné stanovisko zaujímají i národní doporučení britská, švédská a španělská), evropská doporučení [9] nedoporučují použití vaptanu ani u pacientů se SIADH.
Jaké jsou důvody pro tak velké rozdíly v registraci vaptanů a mezi jednotlivými doporučeními? Mezi hlavní příčiny zřejmě patří rozdílná dostupnost vaptanů a rozdílné zkušenosti s vaptany, jiná metodologie výběru a hodnocení dostupných důkazů, jak co se týče kvantity i kvality důkazů [25]. V evropských podmínkách lze vaptany použít mimo off-label indikace pouze u pacientů se SIADH, a i v těchto případech při stávajících rozporech mezi různými doporučeními hraje důležitou roli klinický úsudek zkušeného ošetřujícího lékaře.
Vaptany nepochybně patří do rukou lékaře, který má zkušenosti s léčbou hyponatremie. Léčba má být vždy zahájena u pacientů se SIADH, kteří nemají těžké příznaky hyponatremie, a to za pobytu pacienta v nemocnici, neměla by být zahajována bezprostředně po podání infuze hypertonického NaCl, větší opatrnosti (vzhledem k většímu riziku „přestřelení“) je třeba u pacienta s těžkou hyponatremií (Na < 120 mmol/l), natremii je třeba frekventně monitorovat, je třeba uvolnit příjem tekutin a při dosažení koncentrace Na > 125 mmol/l je možno podávání tolvaptanu na 1–2 dny přerušit [27]. Indikace vaptanu by měla být zvážena zejména u pacienta se SIADH, u kterého hyponatremie neodpovídá dostatečně na restrikci tekutin, nebo který není schopen restrikci tekutin dodržovat.
Při dlouhodobé léčbě tolvaptanem je třeba pravidelně kontrolovat jaterní testy. Při dlouhodobém podávání tolvaptanu u pacientů s autosomálně dominantními polycystickými ledvinami došlo totiž u některých pacientů k vzestupu jaterních testů a v jedné studii bylo u pacientů s jaterní cirhózou léčených tolvaptanem ve srovnání s placebem zaznamenáno vyšší riziko gastrointestinálního krvácení. FDA na základě těchto informací vydala v roce 2014 doporučení (http://www.fda.gov/Safety/MedWatch/SafetyInformation/ucm294226.htm), aby nebyl tolvaptan používán u pacientů se známým onemocněním jater.
Jaké jsou výhody tolvaptanu ve srovnání s jinými možnostmi léčby chronické hyponatremie [28]? Pacienti léčení vaptanem velmi ocení možnost ukončit restrikci tekutin. Výraznější úprava natremie může být u pacientů provázena zlepšením neurologické symptomatologie a při léčbě vaptanem dochází méně často než při restrikci tekutin k výrazným výkyvům (poklesům) natremie. Vaptany představují specifickou léčbu některých forem hypotonické hypovolemie a práce s nimi je jednodušší nejen pro pacienta, ale i pro (zkušeného) ošetřujícího lékaře.
Závěry
Tolvaptan (antagonista vazopresinu, inhibitor V2 receptoru pro vazopresin) normalizuje u většiny nemocných s normovolemickou a hypervolemickou hyponatremií sérové koncentrace sodíku. Současná doporučení se výrazně rozcházejí v názoru na jeho použití u pacientů s hyponatremií, v Evropě je tolvaptan registrován pouze pro pacienty se SIADH. Delší zkušenosti a ev. další klinické studie jistě postupně místo tolvaptanu v léčbě hyponatremie upřesní.
prof. MUDr. Vladimír Tesař, DrSc., MBA
vladimir.tesar@vfn.cz
Nefrologická klinika 1. LF UK a VFN v Praze
www.vfn.cz
Doručeno do redakce 28. 8. 2016
Přijato po recenzi 11. 10. 2016
Zdroje
1. Peitzman SJ. The flame photometer as engine of nephrology: a biography. Am J Kidney Dis 2010; 56(2): 379–386. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2010.02.343>.
2. Giebisch G. Coupled ion and fluid transport in the kidney. N Engl J Med 1972; 2878(18): 913–919.
3. Schrier RW, De Wardener HE. Tubular reabsorption of sodium ion: influence of factors other then aldosterone and glomerular filtration rate. First part. N Engl J Med 1971; 285(22): 1231–1243.
4. Palmer LG, Schnermann J. Integrated control of Na transport along the nephron. Clin J Am Soc Nephrol 2015; 10(4): 676–687. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.12391213>.
5. Bradley SE. Modern concepts of renal structure and function in chronic Bright´s disease. N Engl J Med 1944; 231 : 421–426. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM194409212311205>.
6. Eknoyan G. A history of diabetes insipidus: paging the road to internal water balance. Am J Kidney Dis 2010; 56(6): 1175–1183. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2010.08.002>.
7. Agre P, Sasaki S, Chrispels MJ. Aquaporins: a family of water channel proteins. Am J Physiol 1993; 265(3 Pt 2): F461.
8. Knepper MA, Kwon TH, Nielsen S. Molecular physiology of water balance. N Engl J Med 2015; 372(14): 1349–1358. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1404726>.
9. Spasovski G, Vanholder R, Allolio B et al. Clinical practice guideline on diagnosis and treatment of hyponatremia. Nephrol Dial Transplant 2014; 29(Suppl 2): i1-i39. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfu040>.
10. Allen LA, Gheorghiade M, Reid KJ et al. Identifying patients hospitalized with heart failure at risk for unfavorable future quality of life. Circ Cardiovasc Qual Outcomes 2011; 4(4): 389–398. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCOUTCOMES.110.958009>.
11. Kim WR, Biggins SW, Kremers WK et al. Hyponatremia and mortality among patients on the liver-transplant waiting list. N Engl J Med 2008; 359(10): 1018–1026. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0801209>.
12. Ahluwalia V, Heuman DM, Feldman G et al. Correction of hyponatremia improves cognition, quality of life, and brain oedema in cirrhosis. J Hepatol 2015; 62(1): 75–82.10. Dostupné z DOI: <http://dx.doi.org/1016/j.jhep.2014.07.033>.
13. Rosner MH. Lixivaptan: a vasopressin receptor antagonist for the treatment of hyponatremia. Kidney Int 2012; 82(11): 1154–1156. Dostupné z DOI: <http://dx.doi.org/10.1038/ki.2012.317>.
14. Adrogué HJ, Madias NE. Hyponatremia. N Engl J Med 2000; 342(21): 1581–1589.
15. Sterns RH. Disorders of plasma sodium – causes, consequences, and correction. N Engl J Med 2015; 372(1): 55–65. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1404489>.
16. Sterns RH, Riggs JE, Schochet SS Jr. Osmotic demyelination syndrome following correction of hyponatremia. N Engl J Med 1986; 314(24): 1535–1542.
17. Schier RW, Gross P, Gheorghiade M et al. Tolvaptan, a selective vasopressin V2-receptor antagonist, for hyponatremia. N Engl J Med 2006; 355(20): 2099–2112.
18. Berl T, Quittnat-Pelletier F, Verbalis JG et al. Oral tolvaptan is safe and effective in chronic hyponatremia. J Am Soc Nephrol 2010; 21(4): 705–712. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2009080857>.
19. Verbalis JG, Adler S, Schrier RW et al. Efficacy and safety of oral tolvaptan therapy in patients with the syndrome of inappropriate antidiuretic hormone secretion. Eur J Endocrinol 2011; 164(5): 725–732. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-10–1078>.
20. Salahudeen AK, Ali N, George M et al. Tolvaptan in hospitalized cancer patients with hyponatremia: a double-blind, randomized, placebo-controlled clinical trial on efficacy and safety. Cancer 2014; 120(5): 744–751. Dostupné z DOI: <http://dx.doi.org/10.1002/cncr.28468>.
21. Soupart A, Coffernils M, Couturier B et al. Efficacy and tolerance of urea compared with vaptans for long-term treatment of patients with SIADH. Clin J Am Soc Nephrol 2012; 7(5): 742–747. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.06990711>.
22. Suzuki S, Yoshihisa A, Yamaki T et al. Acute heart failure volume control multicenter randomized (AVCMA) trial: comparison of tolvaptan and carperitide. J Clin Pharmacol 2013; 53(12): 1277–1285. Dostupné z DOI: <http://dx.doi.org/10.1002/jcph.197>.
23. Konstam MA, Gheorghiade M, Burnett JC Jr et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA 2007; 297(12): 1319–1331.
24. Hauptman PJ, Burnett J, Gheorghiade M et al. Clinical course of patients with hyponatremia and decompensated systolic heart failure and the effect of vasopressin receptor antagonism with tolvaptan. J Card Fail 2013; 19(6): 390–397. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cardfail.2013.04.001>.
25. Verbalis JG, Grossman A, Hoybye C et al. Review and analysis of differing regulatory indications and expert panel guidelines for the treatment of hyponatremia. Curr Med Res Oppin 2014; 30(7): 1201–1207. Dostupné z DOI: <http://dx.doi.org/10.1185/03007995.2014.920314>.
26. Verbalis JG, Goldsmith SR, Greenberg A et al. Diagnosis, evaluation, and treatment of hyponatremia: expert panel recommendations. Am J Med 2013; 126(10 Suppl 1): S1-S42. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2013.07.006>.
27. Aylwin S, Burst V, Peri A et al. Dos and don´ts in the management of hyponatremia. Curr Med Res Opin 2015; 31(9): 1755–1761. Dostupné z DOI: <http://dx.doi.org/10.1185/03007995.2015.1072706>.
28. Gross P. Treatment of hyponatremia. Intern Med 2008; 47(10): 885–891.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2016 Číslo Suppl 6- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
-
Chronická dysfunkce transplantované ledviny:
stále nevyřešený problém - Současné možnosti sledování efektivnosti terapie hyponatremie
- Prof. Tomáš Ganz, MD, PhD., a prof. Peter Ganz, MD, synovia košického rodáka prof. Viliama Ganza, MD, PhD., FACC, navštívili Košice
- Rozdíl [Na+] – [Cl-] významně přispívá k acidemii pacientů s jaterní cirhózou
- Prevalence mikroalbuminurie u pacientů s diabetes mellitus v České republice: Projekt IDN-Micro
- Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou
- Prof. MUDr. Otto Schück, DrSc. – stálice na českém nefrologickém nebi
- Metabolická acidóza u chronického onemocnění ledvin
- Suplementácia vitamínu D3 a bunková homeostáza vápnika u pacientov pri chronickej chorobe obličiek
- Bioimpedometrie a její využití v dialyzační léčbě
- Obdiv k zakladatelům a zodpovědnost pokračovatelů
- Výsledky studie SPRINT z pohledu nefrologie
- Systémová a intraperitoneální inflamace u peritoneálně dialyzovaných pacientů
- Využitie salivárnych markerov v nefrológii
- IgA nefropatie – otázky, které nastolil výzkum
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
- Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin
- Theralite a mnohočetný myelom
- Současné možnosti léčby hyponatremie
-
Chronická dysfunkce transplantované ledviny:
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Metabolická acidóza u chronického onemocnění ledvin
- Současné možnosti léčby hyponatremie
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



