-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Komplikace po transplantaci plic
The complications after lung transplantation
Lung transplantation (LuTx) is an important treatment for a selected group of patients in the terminal stage of a number of lung diseases, which can bring them a significant improvement in quality of life and long-term survival. Nowadays a perioperative period is not significant limitation for patient survival due to the development of transplant surgery, but the period of months to years after LuTx is crucial for survival. The post-transplant period is very complicated for LuTx patients due to a special treatment regimen, special medication, especially immunosuppressive drugs and the possibility of many complications, whether early or late or acute or chronic. These complications can be divided into several groups. These are rejections, infections, tumors, non-infectious pulmonary complications, and extrapulmonary complications. This is a very wide range of diverse states and to cope with them, it is necessary, apart from good patient co-operation, to team together with specialists in many fields of medicine. But the reward is the satisfaction, good quality of life and long-term survival of transplanted patients.
Key words:
infection – lung transplantation – rejection – tumours
Autori: Petr Jakubec; Monika Žurková; Lenka Hajdová; Aneta Křenková; Vítězslav Kolek
Pôsobisko autorov: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc
Vyšlo v časopise: Vnitř Lék 2017; 63(11): 848-859
Kategória: Přehledné referáty
Súhrn
Transplantace plic (LuTx) je významným léčebným postupem pro vybranou skupinu pacientů v terminálním stadiu řady plicních onemocnění, který jim může přinášet výrazné zlepšení kvality života a dlouhodobé přežití. S rozvojem transplantační chirurgie je dnes pro přežití pacientů limitující z velké části nikoliv perioperační doba, ale spíše období měsíců až let po LuTx. Potransplantační období je pro pacienty po LuTx velmi složité kvůli speciálnímu léčebnému režimu, medikací mnoha léků, zvláště imunosupresiv a možnosti výskytu mnoha komplikací, ať už časných nebo pozdních či akutních nebo chronických. Tyto komplikace můžeme dělit do několika skupin. Jsou to rejekce, infekce, nádory, neinfekční plicní komplikace a mimoplicní komplikace. Jedná se o velmi široké spektrum různorodých stavů a k jejich zvládnutí je nutná mimo dobré spolupráce pacientů hlavně týmová spolupráce specialistů mnoha medicínských oborů. Odměnou je ale spokojenost, dobrá kvalita života a dlouhodobé přežití pacientů po LuTx.
Klíčová slova:
infekce – nádory – rejekce – transplantace plicÚvod
Transplantace plic (LuTx) je významným léčebným postupem pro vybranou skupinu pacientů v terminálním stadiu řady plicních onemocnění, který jim může přinášet výrazné zlepšení kvality života a dlouhodobé přežití. Od prvních úspěšných LuTx v 80. letech 20. století dochází ke stálému každoročnímu zvyšování počtu LuTx, který v roce 2012 přesáhl již číslo 3 700 ročně [1]. Medián přežití dospělých po LuTx dosáhl 5,7 roku v roce 2014, ještě lepší přežití je v případě oboustranných plicních transplantací, kde dosahuje 7 let oproti jednostranným transplantacím s mediánem přežití 4,5 roku [1]. S rozvojem chirurgických a transplantačních technik jsou dnes pro přežití pacientů limitující z velké části nikoliv časné perioperační komplikace, ale spíše komplikace objevující se v pozdější době od LuTx. Tyto komplikace můžeme dělit do několika skupin. Jsou to rejekční stavy, infekční komplikace, nádory, neinfekční plicní komplikace a mimoplicní komplikace.
Rejekce
Zásadním problémem transplantací zůstávají přes pokroky v imunosupresivní terapii rejekční stavy. Může se jednat o hyperakutní, akutní (humorální, celulární) nebo chronickou rejekci.
Hyperakutní rejekce
Hyperakutní rejekce se rozvíjí během minut až hodin po LuTx a je způsobená HLA donor - specifickými protilátkami příjemce. Dochází k hypoxemii, edému plic s difuzními opacitami na skiagramu hrudníku. Dnes se jedná o vzácný stav kvůli zavedení předtransplantačního screeningu HLA protilátek u příjemce.
Akutní humorální rejekce
Akutní rejekce se objevují v 1. roce po LuTx u více než 1/3 příjemců [2].
Akutní humorální rejekce je způsobena donor-specifickými protilátkami příjemce, které již byly v nízkém titru přítomny před transplantací nebo se vyvinou až po transplantaci. Dochází ke komplement-mediované cytotoxicitě se subendoteliální depozicí imunoglobulinů a komplementových produktů (zvláště C4d). Klinické příznaky jsou nespecifické, v týdnech až měsících po LuTx se náhle objevují dušnost, kašel, horečky, hemoptýza, hypoxemie a respirační selhání, někdy vyžadující mechanickou ventilaci [3]. Na skiagramu hrudníku jsou difuzní opacity, funkčně dochází k poklesu FEV1 a FVC. Histologicky bývá nalézána kapilaritida nebo obraz akutního plicního postižení (acute lung injury – ALI). Léčba je zaměřena na redukci protilátek a bývá většinou kombinovaná. Používají se intravenózní imunoglobuliny, plazmaferéza, rituximab, bortezomib, vysoké dávky kortikoidů. Tento typ rejekce mívá fulminantní průběh, medián přežití je 593 dny a přeživší mají zvýšené riziko vzniku chronické rejekce [3].
Akutní celulární rejekce
Akutní celulární rejekce (ACR) je nepoměrně častějším typem akutní rejekce. Je mediována T-lymfocyty, které rozpoznávají antigeny cizího HLA systému. K rizikovým faktorům této rejekce patří nesoulad v antigenech HLA systému dárce a příjemce, typ imunosuprese (nejvyšší riziko je u cyklosporinu, nejnižší u takrolimu), mladší věk, deficit vitaminu D [2,4–6]. Nejčastěji se objevuji v prvních 6 měsících po transplantaci. Průběh může být asymptomatický, případně jsou přítomny nespecifické příznaky – zvýšené teploty, dušnost, suchý nebo produktivní kašel, v nejtěžších případech probíhá rejekce až pod obrazem syndrom akutní dechové tísně (acute respiratory distress syndrome – ARDS).
Poslechově může být nález v normě, event. mohou být nalezeny chrůpky nebo oslabené dýchání při pleurálním výpotku. V současnosti neexistuje žádný specifický laboratorní marker akutní celulární rejekce. Spirometricky je typickým nálezem pokles FEV1, méně často současný pokles FEV1 a FVC. Pokles těchto hodnot o více než 10 % po dobu více než 2 dnů vzbuzuje podezření na rejekci nebo infekci. Skiagram hrudníku je často negativní, zvláště u pozdních epizod rejekce, nebo jsou přítomny perihilózní opacity, intersticiální edém s/bez pleurálního výpotku, na HRCT plic pak opacity mléčného skla, septální ztluštění, ztráta objemu parenchymu a pleurální výpotek [7]. Významné místo v diagnostice má bronchoskopické vyšetření. V bronchoalveolární tekutině (BALt) bývá přítomna lymfocytární alveolitida (10–60 % lymfocytů) s poklesem imunoregulačního indexu. Největší význam má biopsie plicní tkáně, ať už standardní klíšťková transbronchiální biopsie nebo kryobiopsie.
K diagnóze této rejekce vede charakteristický histologický nález bioptované plicní tkáně a vyloučení event. infekce [8]. Klasifikace tíže rejekce je založena na histologickém nálezu. Skládá se z hodnocení vaskulární komponenty (A): jsou nacházeny perivaskulární mononukleární infiltráty, které mohou invadovat do subendotelia, u těžkých rejekcí až do stěny alveolů. Postižení se dle nálezu dělí do 5 stadií (A0–A4). Druhou komponentou je hodnocení dýchacích cest (B): může být přítomna submukózní lymfocytární bronchiolitida, v těžkých případech lymfocyty invadují přes bazální membránu. Dle tíže se dělí do stadií B0–B2R, Bx je nejasný nález [8]. V léčbě se používají kortikoidy (včetně pulzů), azitromycin, montelukast, optimalizace hladiny udržovací imunosuprese, změna složení imunosupresiv, tymoglobulin (rATG), plazmaferéza, imunoglobuliny, rituximab, výjimečně retransplantace plic. Zkouší se i inhalační cyklosporin a selektivní blokátor T-lymfocytů belatacept [9].
Chronická rejekce
Chronická rejekce je zásadním zdrojem morbidity a mortality u transplantovaných, a to zvláště v době po 1. roce od LuTx, v níž je nejčastější příčinou smrti a způsobuje přes 40 % úmrtí [1]. Recentně vznikla nová klasifikace chronické rejekce, která je označována souborně jako chronic lung allograft dysfunction – CLAD [10]. Dochází při ní k trvalému poklesu FEV1 a/nebo FVC nejméně o 20 % v porovnání s výchozí pooperační hodnotou. Dominují v ní 2 fenotypy: bronchiolitis obliterans syndrome a restrictive allograft syndrome.
Bronchiolitis obliterans syndrome
Bronchiolitis obliterans syndrome (BOS) postihuje 48 % příjemců po 5 letech a 76 % po 10 letech od transplantace [11]. BOS je obstrukční plicní postižení, při němž dochází k částečné nebo úplné obliteraci bronchiolů denzní fibrózní jizevnatou tkání. Méně častá je chronická vaskulární rejekce s aterosklerózou pulmonální vaskulatury. K rizikovým faktorům vzniku BOS patří akutní rejekce, včetně mírné, vznik HLA donor-specifických protilátek, virové infekce – jak cytomegalovirové, tak běžné komunitní, bakteriální (Pseudomonas aeruginosa) a mykotické (Aspergillus fumigatus) kolonizace nebo infekce, primární dysfunkce štěpu, gastroezofageální reflux, typ transplantace, autoimunitní a aloimunitní stavy [12–18]. Klinické příznaky jsou nespecifické, mohou imitovat infekce horních cest dýchacích, dále bývá ponámahová až klidová dušnost, suchý nebo produktivní kašel. Prozatím nebyl pro BOS nalezen žádný diagnostický marker. Funkčně bývá prvním nálezem periferní obstrukce, typická je obstrukční ventilační porucha. Na HRCT plic bývá popisován air-trapping a bronchiektázie. Při bronchoskopickém vyšetření bývá v BALt neutrofilní alveolitida, z transbronchiální biopsie nebo kryobiopsie bývá histologický nález bronchiolitis obliterans. Diagnóza je pak verifikována histopatologickým nálezem, který se dle tíže dělí do 5 stupňů. V tomto případě mluvíme o bronchiolitis obliterans. V případě perzistující bronchiální obstrukce bez histologické verifikace a po vyloučení jiných příčin mluvíme o BOS.
V léčbě BOS je používán azitromycin, montelukast, kortikoidy, optimalizace hladiny udržovací imunosuprese, změna složení imunosupresiv včetně nasazení mTOR inhibitorů (sirolimus, everolimus), extrakorporální psoralenová fotoferéza, antilymfocytární a antithymocytární globuliny, anti-CD3 monoklonální protilátka muromononab [21]. Je možná i retransplantace plic, ale tito pacienti mají zvýšené riziko recidivy BOS [22]. BOS je obvykle progredující, ale rychlost progrese je variabilní, medián přežití je 3–5 let [23].
Restrictive allograft syndrome
Restrictive allograft syndrome (RAS) je charakterizován restrikční ventilační poruchou a periferní plicní fibrózou, dominantně v horních plicních lalocích, mohou být přítomny plicní infiltráty, dále bývají fibrózně postižena alveolární septa a viscerální pleura [19]. Často dochází k akutním exacerbacím s nálezem opacit mléčného skla na HRCT a histologickým obrazem difuzního alveolárního poškození [20].
RAS má horší prognózu než BOS, přežití je 6–18 měsíců. V rámci léčby RAS se používají azitromycin, kortikoidy (včetně pulzní léčby), optimalizace hladiny udržovací imunosuprese, změna složení imunosupresiv včetně nasazení mTOR inhibitorů (sirolimus, everolimus), tymoglobulin, plazmaferéza, zkouší se pirfenidon a monoklonální protilátka alemtuzumab proti antigenu CD52, což je protein na povrchu zralých lymfocytů.
Azitromycin responsive allograft dysfunction
Zvláštní nerejekční formou CLAD je tzv. azitromycin responsive allograft dysfunction (ARAD), který dobře reaguje na 3–6měsíční léčbu azitromycinem se vzestupem FEV1 ≥ 10 %. Bohužel u části těchto nemocných přechází časem toto postižení do BOS.
Infekce
Mimo rejekce jsou infekce nejčastější komplikací potransplantačního období. Mohou se objevit kdykoliv po LuTx. Vedou k 35 % úmrtí v 1. roce po LuTx a celkem ke 20 % úmrtí [24].
Virové infekce
Virové infekce komunitní či oportunní jsou častou komplikací potransplantačního období. Způsobují nejen zvýšenou morbiditu, ale jsou také spojeny se zvýšeným rizikem chronické rejekce.
Cytomegalovirus
Cytomegalovirus (CMV) je β-herpes virus, který způsobuje výraznou morbiditu i mortalitu u pacientů po LuTx. Je druhou nejčastější infekcí u těchto osob, hned po bakteriální pneumonii [25]. Může jít o primární infekci, přenos kontaktem, sexuálním stykem, transfuzí, placentou, mateřským mlékem, nebo reaktivaci latentní infekce. Největší riziko hrozí v případě CMV pozitivního dárce a CMV negativního příjemce. Rozlišujeme CMV infekci a CMV chorobu [26]. CMV infekce je nález viru nebo jeho antigenu v tělních tekutinách nebo tkáních u asymptomatických pacientů. Naproti tomu u CMV choroby jsou mimo nález viru přítomny různé klinické příznaky. Může se jednat o tzv. CMV syndrom s horečkou, únavou, slabostí, myalgiemi, artralgiemi, leukopenií, neutropenií, atypickou lymfocytózou, trombocytopenií a elevací transamináz. U invazivní orgánové CMV choroby jsou pak přítomny specifické symptomy z postižení daného orgánu. Nejčastější je CMV pneumonitida. Bývají zvýšené teploty, dušnost, suchý kašel, pokles spirometrických funkcí. Poslechově může být nález v normě nebo jsou slyšitelné chrůpky. Na RTG či CT hrudníku bývají nejčastěji bilaterální, symetrické, peribronchovaskulární, alveolární infiltráty charakteru mléčného skla, predilekčně postihující dolní laloky, mnohočetné nodulace, méně často retikulace, obraz tree-in-bud nebo pleurální výpotek. Z dalších invazivních forem se může méně často objevit CMV kolitida, gastroenteritida, hepatitida či postižení jiných orgánů.
Diagnostika CMV infekce je založena na kvantitativní RT-PCR metodě v krvi zjišťující nálož viru. Touto metodou lze vyšetřovat i další tělní tekutiny a tkáně. Problémem této metody je chybějící celosvětová standardizace a hodnocení. Další metodou je detekce CMV pp65 antigenu v leukocytech pomocí imunofluorescence. Výjimečně se používá vyšetření buněčné kultury s imunofluorescencí monoklonální protilátkou z BALt. Je možné i cytopatologické vyšetření s průkazem tzv. „sovích očí“ (intracelulárních inkluzí s jasným haló efektem) nebo histopatologické vyšetření tkáně s průkazem virových antigenů imunohistochemicky nebo in situ DNA hybridizací. V dnešní době je vyšetřována u příjemců i CMV specifická T-lymfocytární imunita, která určuje, zda bude pacient vyžadovat antivirotickou léčbu. Používá se metoda analogická IGRA testům u tuberkulózy – Quantiferon CMV assay [27].
O pravděpodobné diagnóze CMV pneumonitidy mluvíme v případě, že jsou přítomny respirační symptomy s pozitivním mikrobiologickým nálezem CMV a jsou vyloučeny jiné příčiny. Definitivní diagnóza CMV pneumonitidy je možná jen v případě průkazu CMV antigenu v plicní tkáni.
Léčba CMV infekce je založena na specifické antivirové terapii, a pokud je to možné také na úpravě imunosupresivní terapie na co nejnižší dávku, aby byla zlepšena CMV specifická imunita [28]. Vždy se léčí CMV choroba, u mnoha pacientů je ale léčena i CMV infekce. Vždy záleží na velikosti nálože CMV a stavu CMV specifické imunity. K léčbě CMV infekce nebo CMV syndromu můžeme použít perorální valgancyklovir. U pacientů s invazivní CMV chorobou je lékem první volby intravenózní gancyklovir. Tato léčba může být doplněna podáním CMV specifického imunoglobulinu. Terapie by měla trvat minimálně 2 týdny, resp. do doby než vymizí klinické příznaky a negativity RT-PCR CMV DNA vyšetření v krvi. Po této léčbě by měla ještě následovat 1–3měsíční léčba perorálním valganciklovirem [29]. Problémem mohou být mutované kmeny CMV s rezistencí na antivirotika. U mutace UL97 je nutno podávat zvýšenou dávku gancykloviru, u mutace UL54 pak foskarnet, event. zvolit kombinovanou léčbu gancyklovir + foskarnet a/nebo cidofovir [30,31].
Mimo samotné onemocnění je CMV infekce spojena se zvýšeným rizikem jiných, zvláště oportunních, infekcí, akutní celulární rejekcí, BOS, malignit a se zvýšenou mortalitou [32].
Epstein-Barrové virus
Virus Epstein-Barrové (EBV) je γ-herpes virus, kterému je exponováno asi 90 % populace. U EBV negativních příjemců po transplantaci od EBV pozitivního dárce může proběhnout infekce s horečkou, malátností, bolestí hlavy a bolestmi v krku. Závažnější je ale vznik potransplantačních lymfoproliferací (post-transplant lymphoproliferative disorders – PTLD), viz níže. Rizikovými faktory PLTD jsou úroveň imunosuprese, velikost nálože EBV a EBV nesoulad mezi dárcem a příjemcem orgánu. K diagnostice se používá vyšetření RT-PCR EBV v krvi.
Ostatní herpesviry
Herpes simplex virus 1 a 2 byly dříve obávanými původci těžké pneumonie s vysokou mortalitou. Časté byly komplikace, ke kterým patří bakteriální superinfekce, bronchiolitida, plicní fibróza, kryptogenní organizující se pneumonie, respirační selhání a ARDS. Diagnostika je založena na několika metodách jako jsou RAT (rapid antigen testing) pomocí imunofluorescence nebo ELISA, PCR nebo RT-PCR metoda, kterými jsou vyšetřovány různé biologické materiály (výtěr z nosohltanu, sputum, endosekret, BALt, krev). Je možné i vyšetření buněčných kultur či histopatologické vyšetření bioptované plicní tkáně. Léčba spočívá v podávání acykloviru. Nyní je ale díky účinné antivirové profylaxi herpetická pneumonie vzácnou komplikací.
Varicella-zoster virus může způsobovat pásový opar, ale v dnešní době je toto vzácné díky CMV profylaxi, která působí protektivně [33].
Dalšími herpesviry jsou humánní herpesviry 6, 7 a 8 (HHV6, HHV7, HHV8). V naprosté většině případů dochází k reaktivaci latentní infekce. HHV6 a HHV7 jsou spojeny se zvýšeným rizikem CMV koinfekce, chronické rejekce (BOS) a útlumu kostní dřeně [34]. HHV6 infekce je možným původcem kožního rashe, pneumonie, hepatitidy a encefalitidy. HHV8 je příčinou Kaposiho sarkomu.
Komunitní respirační viry
Do široké skupiny patogenů označovaných jako komunitní respirační viry (community-acquired respiratory viruses – CARV) patří ortomyxoviry (influenza A, B), paramyxoviry (respiratory syncytial virus – RSV, parainfluenza – PIV, human metapneumovirus – HMpV), pikornaviry (rhinovirus, enterovirus), koronaviry (koronavirus), adenoviry (adenovirus) a humánní bokavirus. Jsou původci 28–43 % všech infekcí dolních cest dýchacích a plic u pacientů po LuTx [35]. Onemocnění může probíhat asymptomaticky, přes lehký průběh až po těžkou pneumonii. Jsou také spojeny se zvýšeným rizikem akutní i chronické rejekce, zvláště BOS [36]. V diagnostice se uplatňují hlavně moderní metody jako RAT (rapid antigen test) a RT-PCR diagnostika, kterými vyšetřujeme nazofaryngeální výtěry, BALt či bioptovanou plicní tkáň. V léčbě RSV infekce se používá ribavirin (perorální nebo inhalační forma), imunoglobuliny nebo palivizumab (RSV monoklonální protilátka). U chřipky je podáván oseltamivir v dávce 75 mg 2krát denně po dobu minimálně 5 dnů, u těžkých průběhů až 10–14 dnů. U virových infekcí jsou většinou doporučována i širokospektrá antibiotika z důvodu časté bakteriální superinfekce. V případě těžkých infekcí jsou používány systémové kortikoidy.
Bakteriální infekce
Bakteriální infekce se mohou vyskytnout kdykoliv po LuTx, ale jsou nejčastější v časném období po LuTx, ve kterém jsou nejčastější příčinou úmrtí [37]. Mimo nejčastější pneumonie se může vyskytnout empyém, bakteriemie, infekce nitrohrudní, kožní nebo měkkých tkání. Bakteriální pneumonie v časném období po LuTx jsou většinou způsobeny typický nozokomiálními multirezistentními (multidrug-resistant – MDR) kmeny jako je Pseudomonas aeruginosa, Enterobaktery, Staphylococcus aureus (včetně MRSA) atd. V pozdějším období, zvláště po 6 měsících od LuTx, se mimo těchto MDR patogenů uplatňují i běžné komunitní baktérie včetně atypických nebo oportunní patogeny jako Nocardia sp. Klinický obraz může být typický s teplotami, kašlem, dušností, infiltráty na skiagramu hrudníku, ale může být i zastřen imunosupresivní léčbou. Při jakémkoliv podezření na infekci je nutné po ni intenzívně pátrat pomocí všech dostupných vyšetřovacích metod, často se v detekci patogenů uplatňuje BAL. Základem léčby je kombinovaná antibiotická terapie zaměřená na gramnegativní bakterie, Staphylococcus aureus (včetně MRSA) a atypické patogeny. Délka léčby je většinou 14 dnů. Kolonizace nebo infekce Pseudomonas aeruginosa je problémem zvláště pacientů s cystickou fibrózou (CF), u nichž dochází k šíření patogenu do plic z rezervoáru v horních cestách dýchacích a paranazálních dutin. V pozdějším období po LuTx je přítomnost Pseudomonas aeruginosa spojena se zvýšeném rizikem BOS [38]. Dalším problematickým patogenem u pacientů s CF je Burkholderia cepacia komplex, zvláště genomovar III – Burkholderia cenocepacia, která vede k cepacia syndromu (akutnímu respiračnímu selhání a těžké sepsi) s vysokou mortalitou. Nokardiová infekce se objeví u 1,9–3,5 % pacientů po LuTx, obvykle po více než 6 měsících od LuTx a většinou probíhá jako subakutní pneumonie [39]. V diagnostice se využívá mikroskopického vyšetření s modifikovaným ART barvením Kinyounovou procedurou, kultivace na speciálních půdách s delší inkubací (5–7 dnů), MALDI-TOF (matrix assisted laser desorption ionization-time of flight mass spectrometry; hmotnostní spektrometrie) a PCR metoda. Lékem první volby je kotrimoxazol, alternativy jsou amikacin, imipenem, meropenem, cefalosporiny III. generace, respirační fluorochinolony, linezolid, tigecyklin, dapson.
Tuberkulóza
Tuberkulóza (TBC) plic může vzniknout nejčastěji reaktivací latentní infekce, případně přenosem při LuTx či jako nozokomiální infekce. Pacienti před LuTx bývají vyšetřováni na latentní TBC a při pozitivitě léčeni. TBC se většinou objeví v období po 6 měsících od LuTx. Diagnostika a léčba TBC probíhá dle běžných standardů. Problémem je rifampicin, který indukuje rychlejší metabolizmus imunosupresiv s rychlým a nepředvídatelným poklesem jejich koncentrace. Diagnostika a léčba atypických mykobakterióz (nontuberculous mycobacteria – NTM) vychází u transplantovaných pacientů se stejných principů jako u ostatní populace, musí tedy splňovat klinická, radiologická a mikrobiologická kritéria. Diseminovaná infekce je u transplantovaných velmi vzácná. Rizikoví jsou zvláště pacienti s cystickou fibrózou, u kterých jsou v předtransplantačním období NTM infekce častější než u jiných skupin. Nalézány bývají hlavně Mycobacterium avium komplex, Mycobacterium abscessus, Mycobacterium gordonae a Mycobacterium fortuitum. NTM infekce nejsou absolutní kontraindikací LuTx.
Empyém se objeví u 3–5 % příjemců, téměř vždy v prvních 3 měsících po LuTx s mortalitou až 40 % [40]. Bakteriemie se vyskytuje u 11,5 % recipientů v prvních 5 letech od LuTx [41]. Je spojena se zvýšenou mortalitou. Proto mají být u všech pacientů s pneumonií a/nebo známkami systémové infekce odebrány hemokultury. Ranné infekce bývají způsobeny stejnými nozokomiálními patogeny jako časné pneumonie. Terapie empyému, bakteriemie a raných infekcí se neliší od léčby těchto onemocnění u běžné populace.
Infekce Clostridium difficile je častou komplikací v časném období po LuTx při imunosupresivní léčbě a potransplantační antibiotické profylaxi a postihuje až 6 % příjemců v prvních 90 dnech po LuTx [42].
Mykotické infekce
Mykotické infekce jsou častou infekční komplikací po LuTx s jednoroční kumulativní incidencí 8,6 % [43]. Nejčastějším mykotickým patogenem je Aspergillus sp., který společně s Candida sp. tvoří více než 80 % těchto infekcí.
Aspergilóza
Naprostou většinu infekcí aspergilových infekcí vyvolává Aspergillus fumigatus, ostatní aspergily jsou mnohem vzácnější. K rizikovým faktorům aspergilové infekce patří aspergilová kolonizace dýchacích cest, bronchiální ischemie, BOS, CMV infekce, vysoké dávky kortikoidů a léčba anti-T-lymfocytárními preparáty. Kolonizace dýchacích cest aspergily postihuje 25–30 % recipientů [44]. Aspergilová kolonizace je nejenom rizikovým faktorem infekce, ale i BOS [16,45]. Aspergilová infekce může probíhat jako infekce anastomózy, tracheobronchitida, semiinvazivní plicní forma (chronická nekrotizující plicní aspergilóza – CNPA a/nebo chronická kavitární plicní aspergilóza – CCPA), invazivní plicní aspergilóza (angioinvazivní nebo vzácnější bronchoinvazivní typ) nebo diseminovaná infekce. Nejčastější je tracheobronchitida, která se typicky objevuje v prvních 3 měsících od LuTx. Může být asymptomatická nebo mohou být přítomny teploty, kašel, pískoty a hemoptýza. Plicní forma se projevuje teplotami, suchým kašlem, dušností, případně hemoptýzou. Mimo plíce mohou být postiženy paranazální dutiny, orbity, centrální nervový systém (CNS), obratle, ploténky, pleura, perikard a vzácně i jiná místa. Na skiagramu hrudníku bývají různorodé nálezy, typické je znamení vzdušného půlměsíce (air crescent sign) se srpkem plynu uvnitř uzlu či konsolidace. Na HRCT plic bývají centrilobulární uzly s rozpadem, kavitace, centrální hypodenzity v oblasti nodulu nebo konsolidace (hypodense sign), „air crescent sign“, „znamení haló“ (halo sign) – jemné okrsky mléčného skla v okolí nodulů (prokrvácení a edém intersticia). Diagnostika je založena na klinickém a radiologickém podezření, které by mělo být verifikováno dalšími metodami, k nimž patří:
- mikrobiologická vyšetření biologických materiálů – mikroskopické vyšetření, mykologická kultivace, PCR metoda
- laboratorní metody – vyšetření galaktomannanu a 1,3-β-D-glukanu
- vyšetření bioptované tkáně – histologické vyšetření, imunohistochemické vyšetření anti-aspergilovými protilátkami, PCR metoda
V léčbě aspergilové tracheobronchitidy se používá perorální vorikonazol + inhalační amfotericin B + endoskopické ošetření dýchacích cest. Lékem první volby u plicní formy je vorikonazol, případě je možno podat v monoterapii lipofilní amfotericin B, při selhání úvodní léčby je možno podat vorikonazol + kaspofungin nebo lipofilní amfotericin B + kaspofungin. Profylakticky se po LuTx podává inhalační amfotericin B po dobu 1–3 měsíců.
Kandidóza
Běžně se manifestuje jako kandidemie během 1. měsíce po LuTx. Může způsobit také infekci pleury, mediastina, anastomózy nebo diseminovanou infekci. Kandidová pneumonie je velmi vzácná. Diagnostika se opírá o vyšetření hemokultur, detekci složek buněčné stěny kandid [mannan, β-(1,3)-D-glukan], protilátek (anti-mannan) v krvi, PCR vyšetření. Definitivní diagnózou kandidové pneumonie je histologický průkaz kandid v plicní tkáni. Vysoké podezření ale vzbuzuje masivní množství kandid v respiračních sekretech se sugestivním klinickým a radiologickým obrazem. U kandidového empyému je diagnostický nález kandid v pohrudniční tekutině. Léčba závisí na druhu kandid a jejich citlivosti, Candida albicans je citlivá na flukonazol, non-albicans Candidy je nutno léčit jinými antimykotiky (amfotericin B, azolová antimykotika, flucytosin, echinokandiny).
Kryptokokóza
Je způsobena kvasinkami Cryptococcus neoformans, Cryptococcus gattii. Je to 3. nejčastější mykotická infekce, která postihuje okolo 2 % příjemců. Může jít o reaktivaci latentní infekce nebo infekce de novo. Klinicky se projevuje jako plicní forma, která probíhá většinou pod obrazem lobární pneumonie, nebo jako diseminovaná infekce postihující CNS, kůži, měkké tkáně, kosti a klouby. Diagnostika je založena na mikroskopickém a kultivačním vyšetření nebo detekci antigenů v biologických materiálech, případně histopatologickém průkazu. Léčba mírné nebo středně těžké plicní formy spočívá v podávání flukonazolu, diseminovaná forma se léčí kombinací amfotericinu B a flucytosinu. Mortalita diseminované formy dosahuje 42 % [46].
Zygomykózy (mukormykózy)
Jedná se o infekce způsobené plísněmi řádu Mucorales (Rhizopus, Mucor, Rhizomucor a další). Tyto patogeny mají vysokou afinitu k cévní stěně s prorůstáním do cévního lumen a hematogenní diseminací. Onemocnění rychle progreduje a má tendenci šířit se i do okolních struktur. V diagnostice jsou prvním indikátorem široké neseptované hyfy ve sputu nebo BALt, potvrzením je identifikace patogenu histopatologicky s konfirmací kultivací nebo PCR metoda z histologického vzorku. V léčbě se uplatňuje amfotericin B, případně posakonazol.
Další mykózy
Scedosporium sp. mohou kolonizovat dýchací cesty a způsobovat bronchitidy nebo pneumonie, při těžké imunosupresi vedou k diseminované infekci s vysokou mortalitou [36].
Z endemických mykóz se mohou u transplantovaných vyskytnout histoplazmóza (houba Histoplasma capsulatum), kokcidioidomykóza (houba Coccidioides immitis) a blastomykóza (houba Blastomyces dermatitidis) [47]. Vedou k těžkým pneumoniím, často s rozpadovými ložisky, nebo v horším případě k diseminovaným infekcím s vysokou mortalitou. Diagnostická jsou mikroskopické vyšetření, kultivace, detekce antigenů, PCR metoda, histologické vyšetření. V léčbě se používají amfotericin B, triazoly, echinokandiny.
Pneumocystová pneumonie (PCP)
Původcem PCP je Pneumocystis jirovecii, zcela atypický houbový mikroorganizmus, který je velmi často nalézán v plicích zdravých lidí. Specifické protilátky proti Pneumocystis jirovecii jsou nalézány u většiny dětí. Pneumocystové onemocnění je typická oportunní infekce, může jít o primoinfekci nebo reaktivaci infekce. Nejčastějším klinickým projevem infekce je pneumonie, ale mohou být postiženy i játra, kostní dřeň, slezina, tenké střevo, ledviny a lymfatické uzliny. U pacientů po LuTx se dříve incidence PCP pohybovala mezi 10–40 % [48]. Častá je koincidence s infekcí CMV nebo jinými respiračními viry.
Z klinických příznaků jsou u PCP nejčastěji přítomny teploty (častěji jen subfebrilie), kašel, v naprosté většině případů neproduktivní, progredující dušnost a pocit tíhy na hrudníku. Poslechově bývají slyšitelné oboustranně difuzně přízvučné chrůpky, ale velmi často bývá auskultační nález normální. U 90 % nemocných s PCP bývá zvýšena sérová hladina laktátdehydrogenázy, naproti tomu hodnota leukocytů bývá často v normálním rozmezí. Hypoxemie doprovází těžší průběh onemocnění. Na skiagramu hrudníku jsou typickým nálezem difuzní oboustranné infiltráty, které se šíří od hilů do periferie a většinou bývají symetrické. Méně často se může jednat o infiltráty postihující jeden lalok, solitární nebo mnohočetná sytá ložiska, miliární rozsev, hilovou lymfadenopatii, rozpady, kavitace, pleurální výpotek či pneumotorax. U pacientů v časné fázi nemoci s lehkým průběhem může být skiagram hrudníku dokonce negativní. V těchto případech je možno použít HRCT vyšetření plic, při němž jsou klasickým nálezem neostře ohraničené opacity typu mléčného skla se ztluštěním interlobulárních sept.
Diagnóza PCP může být stanovena jedině na základě průkazu mikroorganizmu v plicním sekretu nebo přímo v plicní tkáni. Výtěžnost rutinního sputa je všeobecně nízká [49]. U vyšetření indukovaného sputa je popisována senzitivita 55 % a specificita 98 % [50]. Výtěžnějším způsobem k získání vhodného biologického materiálu je bronchoalveolární laváž. Dalšími možnostmi jsou bronchiální brushing se senzitivitou 39–79 %, transbronchiální plicní biopsie se senzitivitou 88–97 %, otevřená plicní biopsie se senzitivitou 99 %. Při současném provedení bronchoalveolární laváže a transbronchiální plicní biopsie stoupá senzitivita na 95–100 % [51]. Získaný materiál je pak zpracováván různými technikami. Barvením dle Giemsy nebo Wrighta lze detekovat trofozoitová stadia a intracystická tělíska. Cystická stadia lze zjistit po barvení toluidinovou modří, hematoxylinem-eozinem nebo po barvení dle Grocotta, Papanicolaua nebo Gomoriho (stříbření). Výtěžnější metodou je nepřímá imunofluorescence s využitím monoklonálních protilátek [52]. Toto vyšetření má dle literárních údajů senzitivitu 90–95 % a specificitu 100 %. V posledních letech se již rutinně využívá metoda PCR k detekci antigenů Pneumocystis jirovecii, a to nejen ve sputu a bronchoalveolární tekutině, ale i v krvi. Různé modifikace těchto metod dosahují senzitivity 65–100 % a specificity mezi 80 % a 96 % dle vyšetřovaného biologického materiálu [53,54]. Vyšetřování specifických protilátek oproti výše uvedeným metodám nemá diagnostickou hodnotu.
Lékem první volby je parenterální kotrimoxazol ve vysokých dávkách. Alternativním lékem je pentamidin v množství 3–4 mg/kg/den i.v. rozděleném do 2–4 dávek. Dalšími, ale již méně účinnými léky jsou dapson, atovaquon, primaquin, klindamycin, trimetrexát, pyrimetamin, makrolidy, kaspofungin. U pacientů s hypoxemií jsou indikovány systémové kortikoidy v dávce 40–60 mg prednisonu denně (nebo jeho ekvivalent) po dobu 5–7 dnů. U transplantovaných pacientů je indikována profylaxe infekce Pneumocystis jirovecii, u nás v režimu 2krát denně 480 mg kotrimoxazolu perorálně po 3 dny v týdnu. Prognóza PCP bez terapie je infaustní, mortalita u HIV negativních imunosuprimovaných osob je uváděna mezi 34–49 %. Ještě vyšší mortalitu mají pacienti vyžadující umělou plicní ventilaci, a to 69 % [55].
Parazitární infekce
Toxoplazmóza
Jedná se o oportunní infekci způsobenou prvokem Toxoplasma gondii. K onemocnění dochází přenosem od dárce, reaktivací latentní infekce nebo de novo infekcí. Obvykle se objeví v prvních 3 měsících po LuTx. Tíže nemoci přímo koreluje s úrovní imunosuprese [56]. Klinicky má infekce velmi různorodé projevy, nejčastější je encefalitida, může být meningitida, myokarditida, chorioretinitida. Prognosticky nejhorší formou je diseminovaná infekce se septickým šokem, u níž je uváděna mortalita přes 80 %. Toxoplazmová pneumonie je poměrně vzácná. Z příznaků dominuje teplota, dušnost a kašel. Na RTG hrudníku bývají oboustranné retikulonodulární infiltráty.
Diagnostika je založena na mikroskopickém průkazu tachyzoitů pomocí Giemsova barvení v biologických materiálech (sputum, BALt, plicní tkáň, mozkomíšní mok a jiné), molekulárně genetickém vyšetření (RT-PCR metoda) a sérologickém vyšetření.
Léčba trvá nejméně 6 týdnů. První volbou je kombinace pyrimetamin + sulfadiazin (+ kyselina listová), alternativní režimy jsou klindamycin + pyrimetamin (+ kyselina listová), trimetoprim-sulfamethoxazol (TMP-SMX), pyrimetamin + atovaquon, pyrimetamin + dapson, pyrimetamin + makrolidy, atovaquon (v monoterapii). U transplantovaných pacientů je indikována profylaxe infekce Toxoplasma gondii, u nás v režimu 2krát denně 480 mg kotrimoxazolu perorálně po 3 dny v týdnu.
Strongyloidóza
Příčinou onemocnění je malý červ Strongyloides stercoralis (hádě střevní), patřící mezi hlístice. Toto onemocnění je převážně doménou subtropických a tropických oblastí, ale vzácně se vyskytuje i v mírném pásmu. Plicní postižení může být způsobeno transpulmonální migrací červů, pak jsou přítomny suchý kašel, dušnost, pískoty, hemoptýza, bolesti v krku, Loefflerův syndrom. Druhou formou je chronické plicní postižení s opakovanými epizodami teplot, pneumonitidou, může dojít k přechodu do asthma bronchiale či restriktivního plicního postižení, vzácně se objeví plicní embolizace nebo akutní respirační selhání. Při postižení gastrointestinálního systému se objevují bolesti břicha, průjmy a krvácení. Nejvážnější je tzv. hyperinfekční syndrom při masivním uvolnění larev z GIT přes střevní stěnu do krevního oběhu a následnému postižení plic, jater, srdce, CNS, endokrinních žláz s obrazem septického šoku a multiorgánového selhání. V diagnostice se uplatňuje vyšetření stolice (mikroskopicky na parazity, PCR metoda, další speciální metody), vyšetření aspirátu duodenojejunální šťávy (Enterotest), mikroskopické vyšetření sputa, BALt, pleurální tekutiny. V léčbě se používá ivermektin, albendazol nebo jejich kombinace. U hyperinfekčního syndromu je mortalita 10–80 %.
Nádory
Hlavní, ale ne jedinou příčinou zvýšeného rizika maligního onemocnění u pacientů po LuTx je chronická imunosupresivní léčba [57]. Negativní vliv mají hlavně kalcineurinové inhibitory, zvláště cyklosporin, naopak inhibitory mTOR kinázy a mykofenolát snad riziko malignity dokonce snižují. Dalším příčinným faktorem jsou virové infekce. Nejvýznamnější je EBV infekce vedoucí k lymfoproliferativním onemocněním. Humánní herpesvirus 8 (HHV 8) má souvislost s Kaposiho sarkomem a humánní papilomavirus (HPV) se spinocelulárním karcinomem kůže. Přenos maligních buněk v dárcovském orgánu je naštěstí vzácný. Ve srovnání s celkovou populací je obecně u transplantovaných zvýšený výskyt hlavně Kaposiho sarkomu, nádorů kůže, melanomu, nádorů anogenitální oblasti, jater, plic, ledvin, střev a pankreatu [58]. Jednoznačně nejčastější jsou ale tzv. posttransplantační lymfoproliferativní onemocnění (post-transplant lymfoproliferative disease – PTLD). U většiny pacientů je způsobena proliferací B-lymfocytů indukovanou EBV infekcí při chronické imunosupresivní léčbě se snížením T-lymfocytární imunity [59]. K dalším rizikovým faktorům patří typ imunosuprese, nejvyšší riziko je u přímých anti-T-lymfocytárních léků a takrolimu, dále předtransplantační malignita, neshoda v HLA antigenech, a EBV sérostatus, u EBV negativních příjemců je riziko PTLD 24krát vyšší než u EBV pozitivních příjemců. PTLD se dělí do 3 typů. Jsou to časné léze (benigní polyklonální lymfoproliferace B-lymfocytů), které mohou probíhat pod obrazem akutní EBV-like infekce. Dále to jsou polymorfní PTLD s polyklonálními nebo monoklonálními lymfoidními infiltráty, které mají známky maligní transformace, ale nesplňují kritéria B nebo T lymfomů. Poslední jsou monomorfní PTLD, která již splňují kritéria B nebo T lymfomů. Klinicky se PTLD může projevovat příznaky EBV-like infekce, nespecifickými B příznaky – lymfadenopatií, extranodálními masami, které mohou způsobit útlakové příznaky nebo dysfunkci orgánů. Postiženy mohou být žaludek, střevo, plíce, játra, kůže, CNS. Někdy může PTLD probíhat jako multisystémové onemocnění. Pomocí PCR metody je zjišťována vysoká nálož EBV v krvi. Z dalších laboratorních známek mohou být přítomny anémie, trombocytopenie, leukopenie, elevace laktátdehydrogenázy, hyperkalcemie, hyperurikemie, monoklonální protein v krvi nebo v moči. V diagnostice se uplatňuje PET/CT vyšetření a biopsie tkáně s podrobným imunohistochemickým vyšetřením a dalšími speciálními diagnostickými metodami. Léčba PTLD přesahuje rámec tohoto textu.
Jiná postižení respiračního systému
Postižení dýchacích cest po LuTx jsou častá, predilekční místa jsou anastomózy, ale mohou být postiženy i jiné oblasti tracheobronchiálního stromu. Komplikace bronchiálních anastomóz se vyskytují u 2–33 % LuTx. K časným komplikacím v 1. měsíci po LuTx náleží infekce, nekróza, dehiscence, ostatní, níže uvedené, komplikace se objevují později. Hlavním důvodem tohoto typu postižení je pooperační ztráta krevního zásobení.
Nejčastější je bronchiální stenóza, která je často následkem infekce, nekrózy nebo dehiscence [60]. Někdy je asymptomatická, nebo jsou přítomny dušnost, pískoty, stridor, pokles ventilačních funkcí, postobstrukční pneumonie. Diagnostická je bronchoskopie, případně virtuální CT bronchoskopie. Stenóza spojného bronchu je označována jako „vanishing bronchus intermedius syndrome“ [61]. Příčinou je většinou ischemie, někdy ACR. Malé, asymptomatické stenózy je možno jen sledovat, u větších, symptomatických případů je preferovanou metodou volby balónková dilatace [62]. V případě refrakterních stenóz jsou dalšími možnostmi laser, kryoterapie, stenting, sleeve resekce stenózy, lobektomie nebo retransplantace [63].
Infekce anastomózy způsobují baktérie (nejčastěji Pseudomonas aeruginosa, Staphylococcus aureus) nebo mykotické patogeny. Průběh může být asymptomatický, případně bývají horečky, kašel, pískoty, hemoptýza. Léčba je založena na kombinaci lokálního bronchoskopického ošetření a podání ATB. Granulace v anastomóze se obvykle objeví v prvních měsících po LuTx. Někdy jsou asymptomatické, ale mohou se projevit dušností, kašlem, postobstrukční pneumonií. Léčba je endoskopická pomocí kleští, kryoterapie nebo laseru.
Bronchiální nekróza nebo dehiscence mohou být mírné, asymptomatické, těžší postižení vede k dušnosti, perzistujícímu air-leaku, pneumomediastinu a podkožnímu emfyzému. Léčba bronchiálních stenóz a dehiscencí závisí na tíži postižení a přidružených komplikacích. U nekróz nepostihujících celou bronchiální stěnu a bez air-leaku je doporučena konzervativní terapie s podáním ATB. U větších nekróz někteří autoři doporučují implantaci nekrytého samoroztažitelného kovového stentu, který stimuluje neoepitelizaci [64].
Při částečné dehiscenci je doporučována aplikace tkáňového lepidla s následnou implantací nekrytého kovového stentu. Při selhání této léčby nebo kompletní dehiscenci je nutné operační řešení – reanastomóza, pneumonektomie nebo retransplantace.
Další komplikací způsobenou ischemií nebo infekcí je tracheobronchomalacie, při níž dochází ve výdechu k minimálně 50% zmenšení průsvitu trachey a velkých bronchů. Projevuje se kašlem, dušností, pískoty, stridorem a recidivujícími respiračními infekcemi. Diagnostickou metodou je bronchoskopie. Asymptomatické nebo lehké formy se pouze sledují. U těžších forem se používá noční neinvazivní ventilační podpora, stenting, vzácně operační řešení (tracheobronchoplastika).
Vzácnou, ale velmi nebezpečnou komplikací jsou píštěle. Bronchopleurální píštěle způsobují pneumotorax, podkožní emfyzém, dechovou tíseň a hypotenzi. Léčba spočívá v hrudní drenáži, podání ATB, aplikaci tkáňového lepidla u malých píštělí, u velkých píštělí implantaci krytého kovového stentu nebo chirurgickém řešení. Bronchomediastinální píštěl vede k mediastinitidě. Léčí se ATB, drenáží mediastinálních tekutinových kolekcí, případně debridementem mediastina. Bronchovaskulární píštěle ústí do plicní tepny či žíly, aorty nebo levé srdeční síně. Jsou přítomny hemoptýza, známky sepse nebo vzduchové embolie. Léčba je komplexní, definitivním řešením je operace – lobektomie, pneumonektomie.
Potransplantační pleurální komplikace jsou také časté. Příčinou je poškození pleurální dutiny při operačním výkonu, rejekce nebo imunosupresivní léčba. Rizikovými faktory jsou preexistující poškození pleurálního prostoru a jejich léčba (drenáž, pleurodéza, pleurektomie).
Pleurální výpotek se může objevit časně po LuTx. Způsoben je zvýšenou kapilární permeabilitou, zapříčiněnou ischemií, denervací a následnou reperfuzí štěpu a/nebo poškozením lymfatických cév. Je většinou malého až středního rozsahu, hemoragický, neutrofilní a exsudát. Pozdní pleurální výpotek je spojen s ACR, předchozím zánětem pleury nebo malignitou (primární nebo sekundární). Je ale neobvyklým projevem PTLD [65]. Hemotorax se objevuje v pooperačním období. Pneumotorax může být způsobem malou dárcovskou plící, air-leakem z anastomózy, infekcí nebo iatrogenně. Chylotorax se vyskytuje u méně než 1 % pacientů po LuTx. Většinou se jedná o poškození ductus thoracicus, u pacientů s lymfangioleiomyomatózou (LAM) může jít o přesun chylózního ascitu skrze bránici či masivní únik lymfy z hrudních lymfatických cév [66]. Pozdní komplikací po LuTx může být pleuroparenchymatózní fibroelastóza jako projev CLAD [67].
Další jsou komplikace cévních anastomóz. Může jít o stenózu a. pulmonalis, která se projevuje dušností či známkami plicní hypertenze a pravostranného srdečního selhání. Řešení spočívá v dilataci balónkem nebo zavedení stentu, v případě jejich neúspěchu pak chirurgické rekonstrukci tepny. Útlak a. pulmonalis má obdobné příznaky jako stenóza a řeší se zavedením stentu. Trombóza plicních žil ohrožuje pacienta embolizací do systémového oběhu, zvláště embolizačními ikty. Při úplné obstrukci žil dochází k těžkému plicnímu edému refrakternímu na léčbu. Používá se antikoagulační léčba nebo trombolýza, u nejtěžších případů je indikována chirurgická trombektomie.
Poškození n. phrenicus s obrnou bránice se dle literárních údajů objevuje u 3–9 % pacientů po LuTx, projevuje se dušností, hypoxemií, hypoventilací, atelektázami [68]. Pacienti po LuTx mají zvýšené riziko tromboembolické nemoci. Žilní trombózy se vyskytnou u 20–45 % pacientů, plicní embolie pak u 5–6 % pacientů.
Rekurence primárního plicního onemocnění v dárcovské plíci není zcela neobvyklá a objevuje se u řady různých nemocí (tab. 1). Reakce štěpu proti hostiteli (graft-versus-host disease – GVHD) se projevuje postižením kůže, jater, GIT, kostní dřeně, typická je neutropenie, je to vzácná komplikace po LuTx, ale s vysokou mortalitou [69]. Polékové postižení plic je popisováno u inhibitorů mTOR kinázy [70].
Mimoplicní komplikace
Těchto komplikací je poměrně mnoho, postihují řadu různých orgánů a můžou se objevit časně po LuTx nebo se vyvíjí v pozdějších časových obdobích.
Z kardiálních komplikací jsou časté supraventrikulární arytmie, nejčastěji fibrilace síní. Dlouhodobě po LuTx je zvýšené riziko ischemické choroby srdeční díky vysoké prevalenci rizikových faktorů [71]. Od 6 měsících po LuTx se může objevit konstriktivní perikarditida, která je většinou řešena perikardiektomií [72]. Diabetes mellitus se objeví téměř u poloviny pacientů do 2 let od LuTx [73]. Rizikovými faktory jsou kortikoidy, kalcineurinové inhibitory, vyšší věk a obezita. Chronické renální selhání postihuje velkou část pacientů po LuTx, k rizikovým faktorům patří nefrotoxické léky, hypertenze, diabetes mellitus, věk a předchozí postižení ledvin. Neurologické komplikace jsou časté, v časném období po LuTx je nejběžnější encefalopatie. K dalším častým komplikacím patří osteoporóza, obezita, gastroezofageální reflux, gastroparéza, hyperlipidemie, myopatie respiračních a končetinových svalů. Můžou se objevit také cholecystitida, divertikulitida, pankreatitida, perforace GIT nebo distální intestinální obstrukční syndrom u pacientů s CF.
Závěr
Transplantace plic jsou velkým pokrokem v léčbě terminální fáze mnoha respiračních nemocí. Každoročně stoupají počty výkonů a tím i transplantovaných osob. Potransplantační období je pro pacienty po LuTx velmi složité kvůli speciálnímu léčebnému režimu, medikací mnoha léků, zvláště imunosupresiv a možnosti výskytu mnoha komplikací, ať už časných nebo pozdních či akutních nebo chronických. Spektrum komplikací je velmi široké a k jejich zvládnutí je nutná mimo dobré spolupráce pacientů hlavně týmová spolupráce specialistů mnoha medicínských oborů. Odměnou je ale spokojenost, dobrá kvalita života a dlouhodobé přežití pacientů po LuTx.
Tab. Rekurence primární plicní choroby u dárcovské plíce 
Obr. 1. RTG hrudníku: pneumonie vlevo 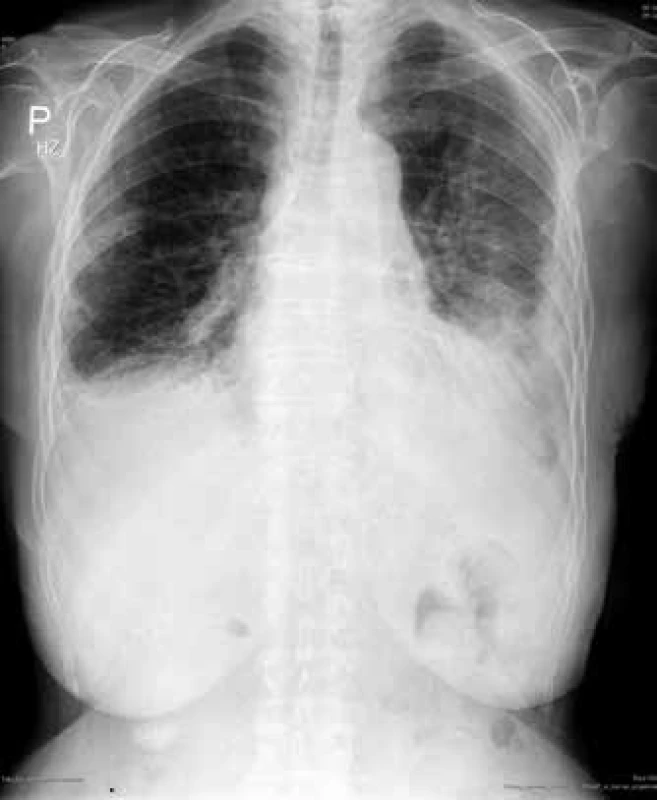
Obr. 2. CT hrudníku: pneumonie vlevo 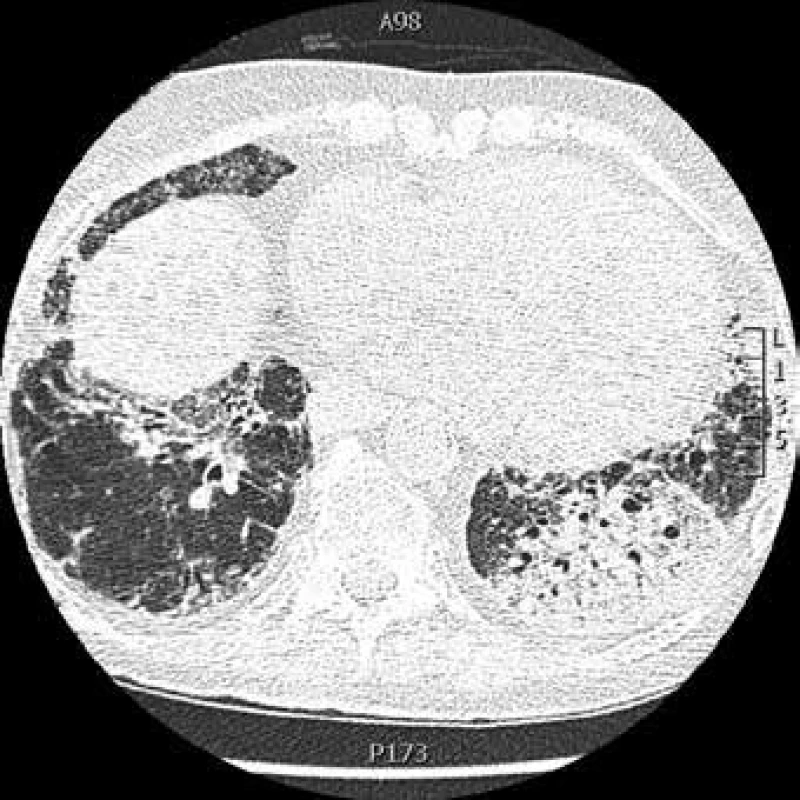
Obr. 3. RTG hrudníku: kryptogenní organizující se pneumonie 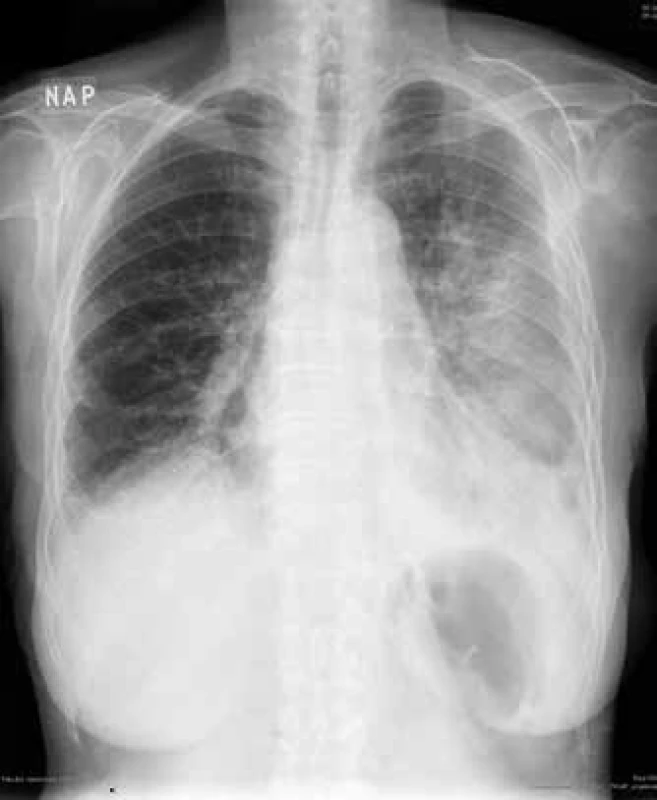
Obr. 4. CT hrudníku: kryptogenní organizující se pneumonie 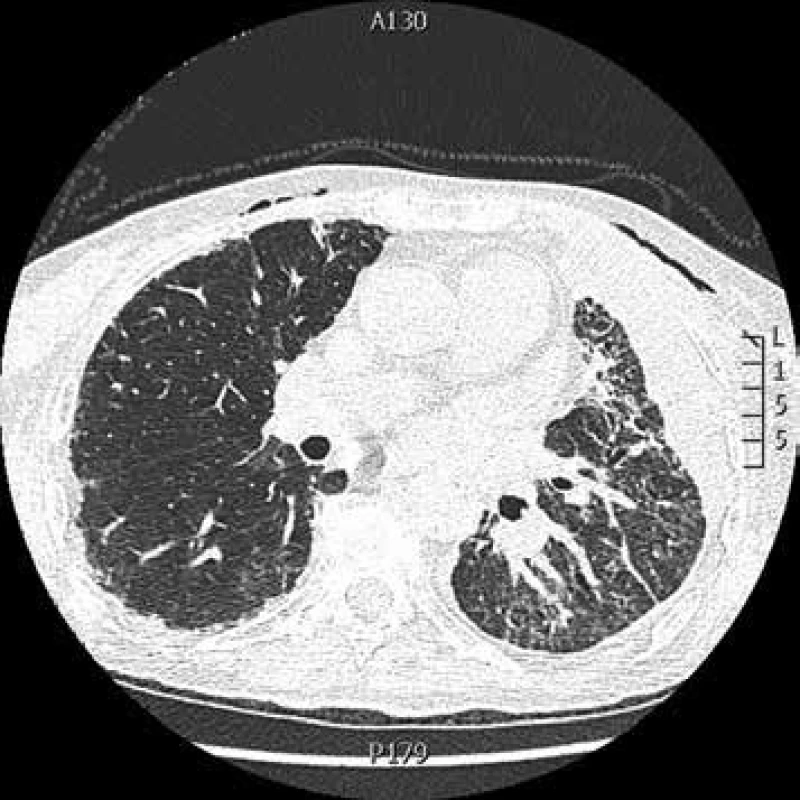
Obr. 5. RTG hrudníku: oboustranné pleurální výpotky 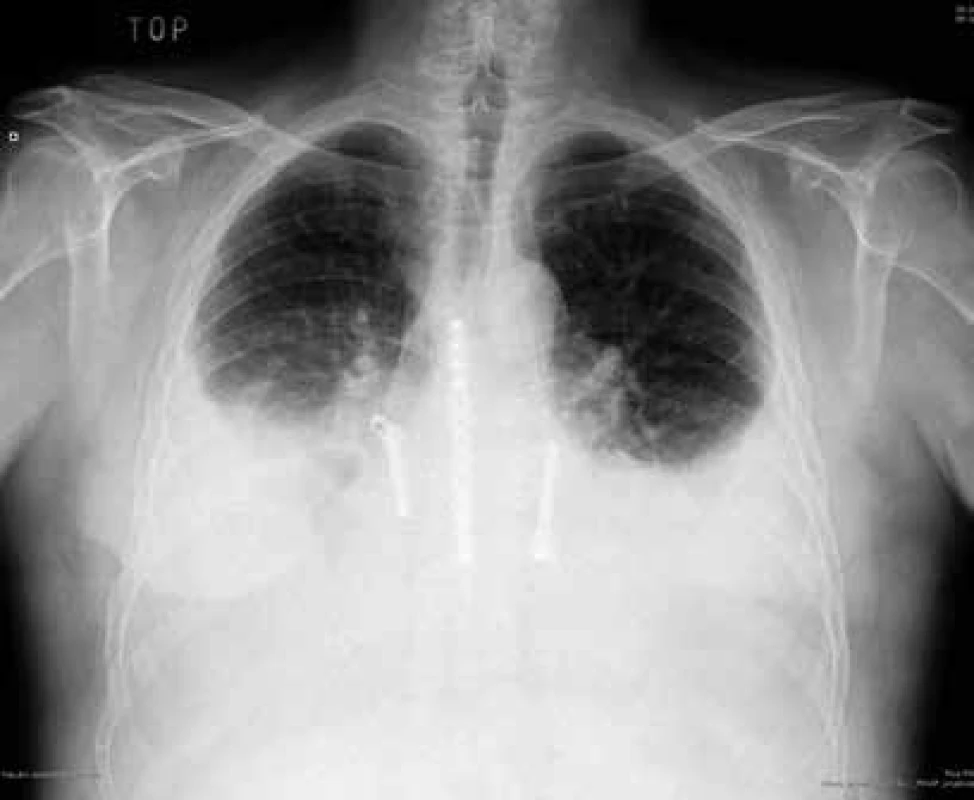
Obr. 6. CT hrudníku: kulovité ložisko pravé plíce 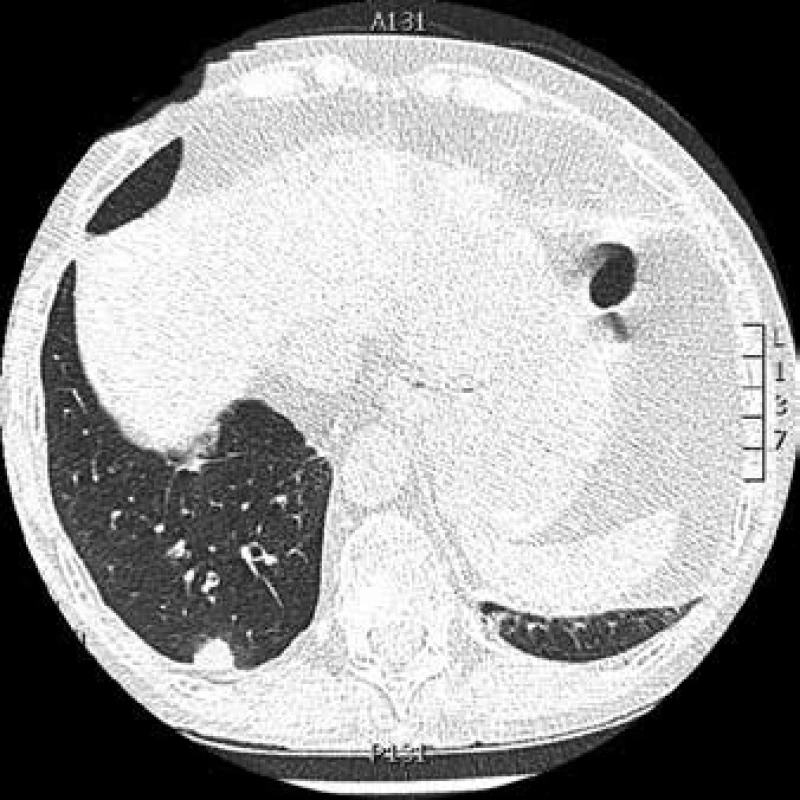
Obr. 7. CT hrudníku: atelektáza v levé plíci 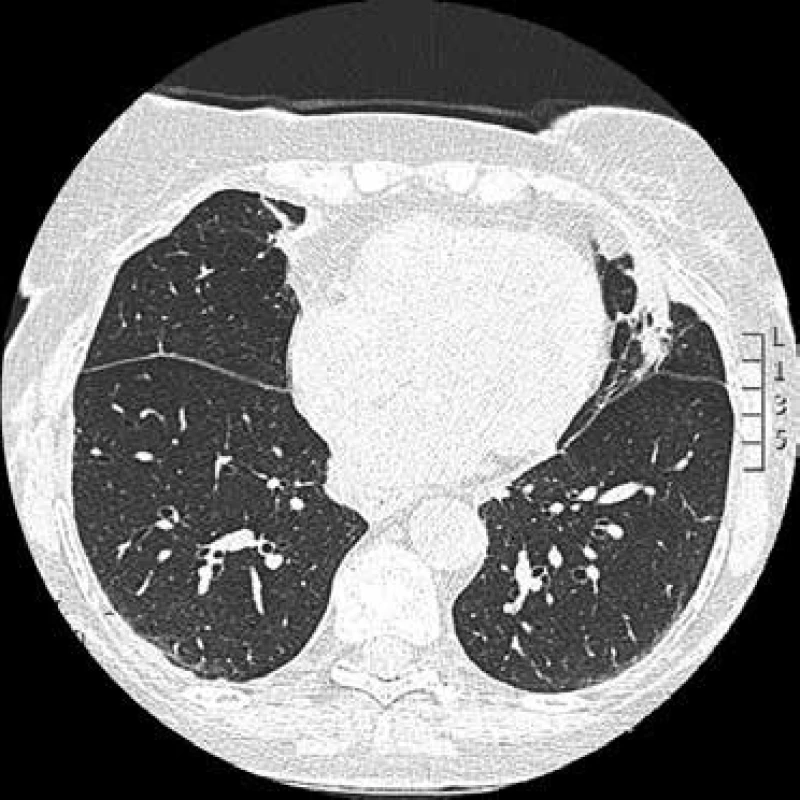
Obr. 8. Bronchoskopie: stenóza středního bronchu 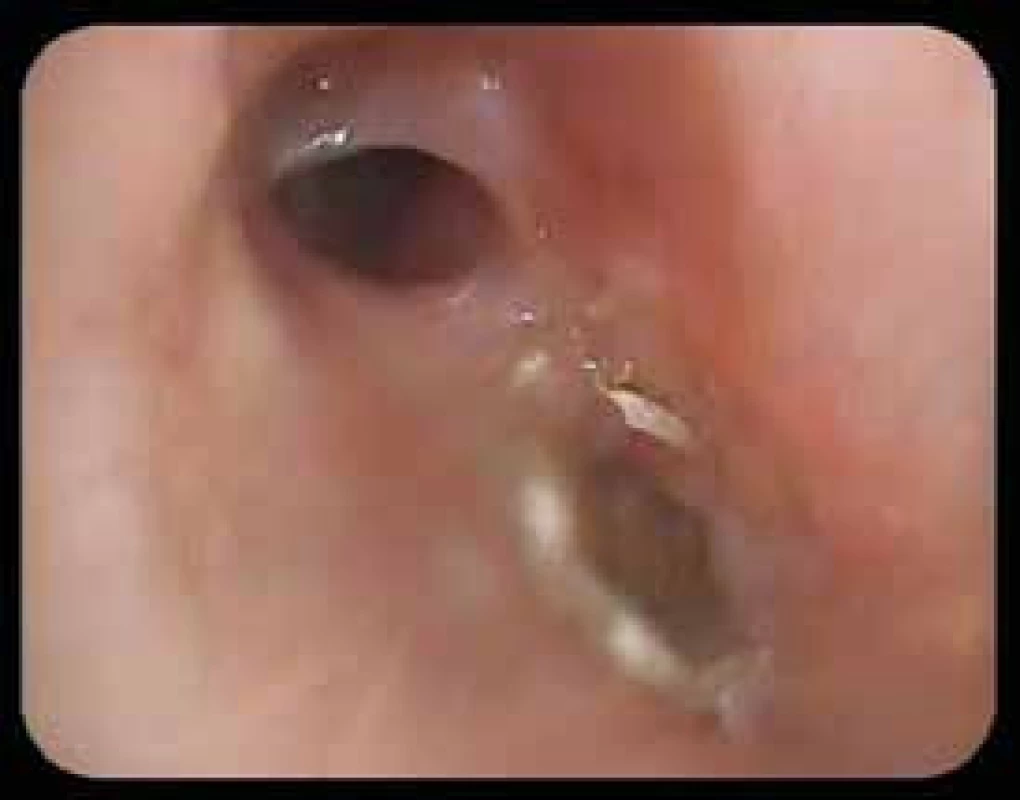
Obr. 9. Bronchoskopie: stenóza linguly 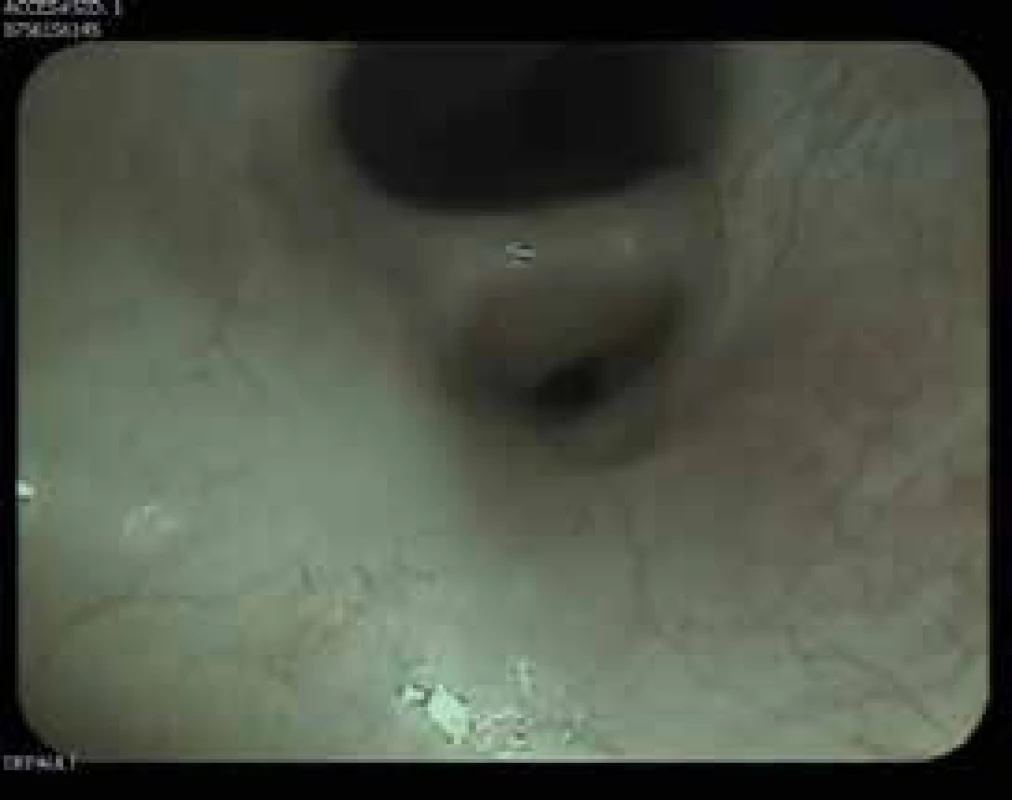
MUDr. Petr Jakubec, Ph.D.
jakubecp@fnol.cz
Klinika plicních nemocí a tuberkulózy LF UP a
FN v Olomouci
www.fnol.cz
Doručeno do redakce 20. 8. 2017
Přijato po recenzi 26. 9. 2017
Zdroje
1. Yusen RD, Edwards LB, Kucheryavaya AY et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Lung and Heart-Lung Transplantation Report 2015, Focus Theme: Early Graft Failure. J Heart Lung Transplant 2015; 34(10): 1264–1277. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2015.08.014>.
2. Martinu T, Pavlisko EN, Chen DF et al. Acute allograft rejection: cellular and humoral processes. Clin Chest Med 2011; 32(2): 295–310. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ccm.2011.02.008>.
3. Witt CA, Gaut JP, Yusen RD et al. Acute antibody-mediation rejection after lung transplantation. J Heart Lung Transplant 2013; 32(10): 1034–1040. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2013.07.004>.
4. Girnita DM, Webber SA, Zeevi A. Clinical impact of cytokine and growth factor genetic polymorphisms in thoracic organ transplantation. Clin Lab Med 2008; 28 : 423–440, vi. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cll.2008.08.002>.
5. Christie JD, Edwards LB, Kucheryavaya AY et al. The Registry of the International Society for Heart and Lung Transplantation: Twenty-eighth Adult Lung and Heart-Lung Transplant Report – 2011. J Heart Lung Transplant 2011; 30(10): 1104–1122. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2011.08.004>.
6. Lowery EM, Bemiss B, Cascino T et al. Low vitamin D levels are associated with increased rejection and infections after lung transplantation. J Heart Lung Transplant 2012; 31(7): 700–707. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2012.02.012>.
7. Martinu T, Chen DF, Palmer SM. Acute rejection and humoral sensitization in lung transplant recipients. Proc Am Thorac Soc 2009; 6(1): 54–65. Dostupné z DOI: <http://dx.doi.org/10.1513/pats.200808–080GO>.
8. Stewart S, Fishbein MC, Snell GI et al. Revision of the 1996 working formulation for the standardization of nomenclature in the diagnosis of lung rejection. J Heart Lung Transplant 2007; 26(12): 1229–1242.
9. Timofte I, Terrin M, Barr E et al. Belatacept for renal rescue in lung transplant patients. Transpl Int 2016; 29(4): 453–463. Dostupné z DOI: <http://dx.doi.org/10.1111/tri.12731>.
10. Verleden GM, Raghu G, Meyer KC et al. A new classification system for chronic lung allograft dysfunction. J Heart Lung Transplant 2014; 33(2): 127–133. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2013.10.022>.
11. Christie JD, Edwards LB, Kucheryavaya AY et al. The registry of the international society for heart and lung transplantation: 29th adult lung and heart-lung transplant report – 2012. J Heart Lung Transplant 2012; 31(10): 1073–1086. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2012.08.004>.
12. Hachem RR, Khalifah AP, Chakinala MM et al. The significance of a single episode of minimal acute rejection after lung transplantation. Transplantation 2005; 80(10): 1406–1413.
13. Hachem RR. Humoral responses after lung transplantation. Curr Opin Organ Transplant 2016; 21(3): 267–271. Dostupné z DOI: <http://dx.doi.org/10.1097/MOT.0000000000000308>.
14. Snyder LD, Finlen-Copeland CA, Turbyfill WJ et al. Cytomegalovirus pneumonitis is a risk for bronchiolitis obliterans syndrome in lung transplantation. Am J Respir Crit Care Med 2010; 181(12): 1391–1396. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.200911–1786OC>.
15. Allyn PR, Duffy EL, Humphries RM et al. Graft Loss and CLAD-Onset Is Hastened by Viral Pneumonia After Lung Transplantation. Transplantation 2016; 100(11): 2424–2431.
16. Weigt SS, Elashoff RM, Huang C et al. Aspergillus colonization of the lung allograft is a risk factor for bronchiolitis obliterans syndrome. Am J Transplant 2009; 9(8): 1903–1911. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2009.02635.x>.
17. Gregson AL, Wang X, Weigt SS et al. Interaction between Pseudomonas and CXC chemokines increases risk of bronchiolitis obliterans syndrome and death in lung transplantation. Am J Respir Crit Care Med 2013; 187(5): 518–526. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201207–1228OC>.
18. Hartwig MG, Anderson DJ, Onaitis MW et al. Fundoplication after lung transplantation prevents the allograft dysfunction associated with reflux. Ann Thorac Surg 2011; 92(2): 462–468. Dostupné z DOI: <http://dx.doi.org/10.1016/j.athoracsur.2011.04.035>.
19. Sato M, Waddell TK, Wagnetz U et al. Restrictive allograft syndrome (RAS): a novel form of chronic lung allograft dysfunction. J Heart Lung Transplant 2011; 30(7): 735–742. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2011.01.712>.
20. Sato M, Hwang DM, Waddell TK et al. Progression pattern of restrictive allograft syndrome after lung transplantation. J Heart Lung Transplant 2013; 32(1): 23–30. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2012.09.026>.
21. Jaksch P, Scheed A, Keplinger M et al. A prospective interventional study on the use of extracorporeal photopheresis in patients with bronchiolitis obliterans syndrome after lung transplantation. J Heart Lung Transplant 2012; 31(9): 950–957. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2012.05.002>.
22. Kawut SM, Lederer DJ, Keshavjee S et al. Outcomes after lung retransplantation in the modern era. Am J Respir Crit Care Med 2008; 177(1): 114–120.
23. Finlen-Copeland CA, Snyder LD, Zaas DW et al. Survival after bronchiolitis obliterans syndrome among bilateral lung transplant recipients. Am J Respir Crit Care Med 2010; 182(6): 784–789. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201002–0211OC>.
24. Trulock EP, Edwards LB, Taylor DO et al. Registry of the International Society for Heart and Lung Transplantation: twenty-second official adult lung and heart-lung transplant report – 2005. J Heart Lung Transplant 2005; 24(8): 956–967.
25. Zamora MR. Cytomegalovirus and lung transplantation. Am J Transplant 2004; 4(8): 1219–1226.
26. Ljungman P, Boeckh M, Hirsch HH et al. Definitions of Cytomegalovirus Infection and Disease in Transplant Patients for Use in Clinical Trials. Clin Infect Dis 2017; 64(1): 87–91.
27. Kotton CN, Kumar D, Caliendo AM et al. Updated international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Transplantation 2013; 96(4): 333–360. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e31829df29d>.
28. Beam E, Razonable RR. Cytomegalovirus in solid organ transplantation: epidemiology, prevention, and treatment. Curr Infect Dis Rep 2012; 14(6): 633–641. Dostupné z DOI: <http://dx.doi.org/10.1007/s11908–012–0292–2>.
29. Razonable RR, Humar A. [AST Infectious Diseases Community of Practice]. AST Infectious Diseases Community of Practice. Cytomegalovirus in solid organ transplantation. Am J Transplant 2013; 13(Suppl. 4): 93–106. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12103>.
30. West P, Schmiedeskamp M, Neeley H et al. Use of high-dose ganciclovir for a resistant cytomegalovirus infection due to UL97 mutation. Transpl Infect Dis 2008; 10(2): 129–132.
31. Hakki M, Chou S. The biology of cytomegalovirus drug resistance. Curr Opin Infect Dis 2011; 24(6): 605–611. Dostupné z DOI: <http://dx.doi.org/10.1097/QCO.0b013e32834cfb58>.
32. Snydman DR, Limaye AP, Potena L et al. Update and review: state-of-the-art management of cytomegalovirus infection and disease following thoracic organ transplantation. Transplant Proc 2011; 43(3 Suppl): S1-S17. Dostupné z DOI: <http://dx.doi.org/10.1016/j.transproceed.2011.02.069>.
33. Manuel O, Kumar D, Singer LG et al. Incidence and clinical characteristics of herpes zoster after lung transplantation. J Heart Lung Transplant 2007; 26(1): 41–47. J Heart Lung Transplant 2008; 27(1): 11–16. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2007.09.028>.
34. Jenkins FJ, Rowe DT, Rinaldo CR. Herpesvirus infections in organ transplant recipients. Clin Diagn Lab Immunol 2003; 10(1): 1–7.
35. Shah PD, Mc Dyer JF. Viral infections in lung transplant recipients. Semin Respir Cit Care Med 2010; 31(2): 243–254. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0030–1249120>.
36. Remund KF, Best M, Egan JJ. Infections Relevant to Lung Transplantation. Proc Am Thorac Soc 2009; 6(1): 94–100. Dostupné z DOI: <http://dx.doi.org/10.1513/pats.200809–113GO>.
37. Zaas AK, Alexander BD. New developments in the diagnosis and treatment of infections in lung transplant recipients. Respir Care Clin N Am 2004; 10(4): 531–547.
38. Botha P, Archer L, Anderson RL et al. Pseudomonas aeruginosa colonisation of the allograft after lung transplantation and the risk of bronchiolitis obliterans syndrome. Transplantation 2008; 85(5): 771–774. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e31816651de>.
39. Clark NM, Reid GE. [AST Infectious Diseases Community of Practice]. Nocardia infections in solid organ transplantation. Am J Transplant 2013; 13(Suppl 4): S83-S92. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12102>.
40. Nunley DR, Grgurich WF, Keenan RJ et al. Empyema complicating successful lung transplantation. Chest 1999; 115(5): 1312–1315.
41. Husain S, Chan, KM, Palmer, SM et al. Bacteremia in lung transplant recipients in the current era. Am J Transplant 2006; 6(12): 3000–3007.
42. Whiddon AR, Dawson KL, Fuentes A et al. Postoperative antimicrobials after lung transplantation and the development of multidrug-resistant bacterial and Clostridium difficile infections: an analysis of 500 non-cystic fibrosis lung transplant patients. Clin Transplant 2016; 30(7): 767–773. Dostupné z DOI: <http://dx.doi.org/10.1111/ctr.12746>.
43. Pappas PG, Alexander BD, Andes DR et al. Invasive fungal infections among organ transplant recipients: results of the Transplant-Associated Infection Surveillance Network (TRANSNET). Clin Infect Dis 2010; 50(8): 1101–1111. Dostupné z DOI: <http://dx.doi.org/10.1086/651262>.
44. Singh N, Paterson DL. Aspergillus infections in transplant recipients. Clin Microbiol Rev 2005; 18(1): 44–69.
45. Weigt SS, Copeland CA, Derhovanessian A et al. Colonization with small conidia Aspergillus species is associated with bronchiolitis obliterans syndrome: a two-center validation study. Am J Transplant 2013; 13(4): 919–927. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12131>.
46. Singh N, Dromer F, Perfect JR et al. Cryptococcosis in solid organ transplant recipients: current state of the science. Clin Infect Dis 2008; 47(10): 1321–1327. Dostupné z DOI: <http://dx.doi.org/10.1086/592690>.
47. Miller R, Assi M. [AST Infectious Diseases Community of Practice]. Endemic fungal infections in solid organ transplantation. Am J Transplant 2013; 13(Suppl 4): S250-S261. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12117>.
48. Fishman JA. Prevention of infection due to Pneumocystis carinii. Antimicrob Agents Chemother 1998; 42(5): 995–1004.
49. Martin SI, Fishman JA. [AST Infectious Diseases Community of Practice]. Pneumocystis Pneumonia in Solid Organ Transplantation. Am J Transplant 2013; 13(Suppl 4): S272-S279. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12119>.
50. Cruciani M, Marcati P, Malena M et al. Meta-analysis of diagnostic procedures for Pneumocystis carinii pneumonia in HIV-1-infected patients. Eur Respir J 2002; 20(4): 982–989.
51. Skřičková J. Pneumocystová pneumonie. Klin Farmakol Farm 2005; 19(2): 106–110.
52. Thomas CF, Limper AH. Pneumocystis pneumonia. N Engl J Med 2004; 350(24): 2487–2498.
53. Alvarez-Martínez MJ, Miró JM, Valls ME et al. Sensitivity and specificity of nested and real-time PCR for the detection of Pneumocystis jiroveci in clinical specimens. Diagn Microb Infect Dis 2006; 56(2): 153–160.
54. Huang L, Morris A, Limper AH et al. An Official ATS Workshop Summary: Recent Advances and Future Directions in Pneumocystis Pneumonia (PCP). Proc Am Thorac Soc 2006; 3(8): 655–664.
55. Mansharamani NG, Garland R, Delaney D et al. Management and outcome patterns for adult Pneumocystis carinii pneumonia, 1985 to 1995: comparison of HIV-associated cases to other immunocompromised states. Chest 2000; 118(3): 704–711.
56. Robert-Gangneux F, Dardé ML. Epidemiology of and diagnostic strategies for toxoplasmosis. Clin Microbiol Rev 2012; 25(2): 264–296. Dostupné z DOI: <http://dx.doi.org/10.1128/CMR.05013–11>.
57. Buell JF, Gross TG, Woodle ES. Malignancy after transplantation. Transplantation 2005; 80(2 Suppl): S254-S264.
58. Engels EA, Pfeiffer RM, Fraumeni JF Jr et al. Spectrum of cancer risk among US solid organ transplant recipients. JAMA 2011; 306(17): 1891–1901. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2011.1592>.
59. Swerdlow SH, Campo E, Harris NL et al. World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. IARC WHO Classification of Tumours, No 2: Lyon 2008. ISBN 9789283224310.
60. Santacruz JF, Mehta AC. Airway complications and management after lung transplantation: ischemia, dehiscence, and stenosis. Proc Am Thorac Soc 2009; 6(1): 79–93. Dostupné z DOI: <http://dx.doi.org/10.1513/pats.200808–094GO>.
61. Hasegawa T, Iacono AT, Orons PD et al. Segmental nonanastomotic bronchial stenosis after lung transplantation. Ann Thorac Surg 2000; 69(4): 1020–1024.
62. Moreno P, Alvarez A, Algar FJ et al. Incidence, management and clinical outcomes of patients with airway complications following lung transplantation. Eur J Cardiothorac Surg 2008; 34(6): 1198–1205. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ejcts.2008.08.006>.
63. Marulli G, Loy M, Rizzardi G et al. Surgical treatment of posttransplant bronchial stenoses: case reports. Transplant Proc 2007; 39(6): 1973–1975.
64. Kapoor BS, May B, Panu N et al. Endobronchial stent placement for the management of airway complications after lung transplantation. J Vasc Interv Radiol 2007; 18(5): 629–632.
65. Diez Martinez P, Pakkal M, Prenovault J et al. Postoperative imaging after lung transplantation. Clin Imaging 2013; 37(4): 617–623. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clinimag.2013.02.008>.
66. Ryu JH, Doerr CH, Fisher SD et al. Chylothorax in lymphangioleiomyomatosis. Chest 2003; 123(2): 623–627.
67. Ofek E, Sato M, Saito T et al. Restrictive allograft syndrome post lung transplantation is characterized by pleuroparenchymal fibroelastosis. Mod Pathol 2013; 26(3): 350–356. Dostupné z DOI: <http://dx.doi.org/10.1038/modpathol.2012.171>.
68. Berk Y, van der Bij W, Erasmus ME et al. Non-invasive ventilation in phrenic nerve dysfunction after lung transplantation: an attractive option. J Heart Lung Transplant 2006; 25(12): 1483–1485.
69. Luckraz H, Zagolin M, McNeil K et al. Graft-versus-host disease in lung transplantation: 4 case reports and literature review. J Heart Lung Transplant 2003; 22(6): 691–697.
70. Wang WL, Yu LX. Acute respiratory distress attributed to sirolimus in solid organ transplant recipients. Am J Emerg Med 2015; 33(1): 124.e1-e4. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ajem.2014.05.047>.
71. Silverborn M, Jeppsson A, Mårtensson G et al. New-onset cardiovascular risk factors in lung transplant recipients. J Heart Lung Transplant 2005; 24(10): 1536–1543.
72. Kamdar F, Hertz M, Shumway S et al. Late effusive-constrictive pericarditis after lung transplantation. Am J Med 2015; 128(6): e1-e2. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2014.12.017>.
73. Hackman KL, Snell GI, Bach LA. Prevalence and predictors of diabetes after lung transplantation: a prospective, longitudinal study. Diabetes Care 2014; 37(11): 2919–2925. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–0663>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Současná náplň pneumologieČlánek Nozokomiální pneumonieČlánek Cystická fibróza dospělýchČlánek Nemalobuněčný karcinom plicČlánek Neinvazivní ventilace
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2017 Číslo 11- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Současná náplň pneumologie
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



