-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Multimodálna liečba tymického karcinoidu: kazuistika
Multimodal treatment of thymic carcinoid: a case report
Thymic carcinoid account for cca 0.4 % of all carcinoid tumors in the body [1]. As compared to other neuroendocrinne tumors, high rates of reccurences after surgery, more aggressive behaviour and relatively high rates of paraneoplastic syndromes are characteristic for thymic carcinoid. The mainstay of treatment is radical surgery [2–4]. Therapy of locally advanced and metastatic stages is influenced by other neuroendocrinne tumors´guidelines. We present a case report of patient with locally advanced, atypical thymic carcinoid, treated with different modalities, including newer procedures like peptide radionuclide receptor therapy (PRRT).
Keywords:
peptide radionuclide receptor therapy – somatostatine analogues – thymic carcinoid
Autori: Radka Cahajlová 1; Mária Černá 1; Soňa Kiňová 2
Pôsobisko autorov: Oddelenie klinickej onkológie Kliniky pneumológie a funkčnej diagnostiky SZU a UNB, Nemocnica Ružinov, Bratislava, Slovenská republika 1; I. interná klinika LF UK a UNB, Nemocnica Staré mesto, Bratislava, Slovenská republika 2
Vyšlo v časopise: Vnitř Lék 2019; 65(5): 363-368
Kategória: Kazuistiky
Súhrn
Tymický karcinoid tvorí len asi 0,4 % zo všetkých karcinoidov v tele [1]. V porovnaní s ostatnými neuroendokrinnými nádormi sa vyznačuje agresívnejším správaním s vysokým percentom recidív po radikálnej liečbe, tendenciou k metastázovaniu a pomerne častým výskytom paraneoplastických syndrómov. Hlavným pilierom liečby je radikálny chirurgický zákrok [2–4]. Terapia pacientov v inoperabilnom alebo metastatickom štádiu sa opiera o postupy používané pri liečbe iných neuroendokrinných nádorov. V našej kazuistike prezentujeme manažment pacienta s lokálne pokročilým, atypickým karcinoidom týmusu, s využitím niekoľkých liečebných modalít, vrátane novších postupov, ako je receptorová rádionuklidová liečba (peptide radionuclide receptor therapy – PRRT).
Klíčová slova:
rádionuklidová receptorová liečba – somatostatínové analógy – tymický karcinoid
Úvod
Tymické neuroendokrinné nádory (Neuroendocrine Tumor – NET) prvý krát od tymómov odlíšili Rosai a Higa v roku 1972 [2,5]. Zároveň im pripísali asociáciu s Cushingovým syndrómom a MEN-1 syndrómom. Tymické karcinoidy tvoria minoritný podiel všetkých karcinoidov v tele, ich incidencia je 0,02/100 000 [1,5]. V porovnaní s inými dobre diferencovanými foregut nádormi sa vyznačujú pomerne agresívnym správaním, vysokým percentom lokálnych rekurencií a pravdepodobnosťou metastázovania [6,7]. Dominantne sa vyskytuje u mužov (3 : 1) [1,2,5,8] kaukazoidnej rasy, vo veku asi 40–50 rokov. Karcinoidový syndróm u pacientov s tymickým karcinoidom vidíme len zriedkavo (< 1 %) [9], častejšie býva zastúpený už vyššie spomínaný MEN-1 syndróm, Cushingov syndróm a akromegália [2,5,7]. Základným pilierom liečby je radikálny chirurgický výkon. Vzhľadom na vysoké percento rekurencií býva súčasťou komplexného manažmentu aj perioperačná, resp. (neo)adjuvantná chemoterapia a rádioterapia. Inoperabilné a metastatické ochorenia okrem chemoterapie a paliatívnych chirurgických výkonov (napr. pri hroziacom syndróme z útlaku hornej dutej žily) vieme ovplyvniť aplikáciou somatostatínových analógov a rádionuklidovou liečbou. U progredujúcich NET je možnosťou voľby everolimus, s rôznym úspechom boli skúšané inhibítory angiogenézy, ako sú sunitinib a bevacizumab.
Kazuistika
44-ročný pacient s anamnézou hyperparatyreoidizmu (sprevádzaný urolitiázou s nutnosťou stentovania a operačného riešenia) bol v marci roku 2014 prešetrovaný pre kašeľ. Pre suspektný nález na RTG hrudníka bolo doplnené CT vyšetrenie, ktoré v prednom mediastine nachádza nehomogénne sa sýtiacu, mäkkotkanivovú expanziu rozmerov 95 × 80 × 60 mm, tesne nasadajúcu na ascendentnú aortu a komprimujúcu brachiocefalické vény. Súčasne bola pri jej dolnom okraji popísaná suspektná lymfatická uzlina (LU), rovnako hraničné zväčšené sú LU v pravom pľúcnom hile a v oblasti bifurkácie trachey. Histologicky z biopsie ide o neuroendokrinnú neopláziu typu neuroendokrinného tumoru gr. II, podľa platnej klasifikácie nádorov pľúc, týmusu a pleury z roku 2004 agresívnu formu atypického karcinoidu týmusu so zvýšenou proliferačnou aktivitou – proliferačný index v tzv. ,,hotspots“ dosahoval až 20 % (tab. 1). Vzhľadom na lokálne pokročilé ochorenie bola indikovaná neoadjuvantná chemoterapia (CHT) v zložení cDDP + VP-16 (cisplatina + etopozid), celkovo bolo podaných 8 cyklov liečby. Kontrolné CT hrudníka je bez výraznejšej dynamiky nálezu, PET CT vyšetrenie popisuje hypermetabolickú mäkkotkanivovú formáciu (standard uptake value – SUV 8,48) v prednom mediastine so šírením kaudálne perikardiálne vpravo. LU v mediastine a v pravom pľúcnom hile majú mierne zvýšenú metabolickú aktivitu (SUV 3,37–3,67). Pacient bol za účelom rozhodnutia o ďalšom liečebnom postupe odoslaný na vyššie pracovisko. S prihliadnutím na metabolickú aktivitu tumoru podľa PET a histológie bola v júli roku 2015 indikovaná II. línia liečby v schéme ADOC (doxorubicín, cisplatina, vinkristín, cyklofosfamid). Po 2 cykloch na kontrolnom CT zaznamenávame čiastočnú liečebnú odpoveď so zmenšením tumoróznej masy o asi 8 mm. Nález opätovne konzultovaný na seminári Kliniky hrudníkovej chirurgie (KHCH), pre pretrvávajúcu masívnu infiltráciu v. cava superior a v. brachocephalica obojstranne však ostáva naďalej inoperabilný. Podané sú ďalšie 2 cykly CHT v identickej schéme. 4. cyklus je však komplikovaný rozvojom febrilnej neutropénie a leukopénie gr. IV s nutnosťou hospitalizácie. K vzniku hematologickej toxicity dochádza napriek sekundárnej profylaxii rastovým faktorom, ktorý bol aplikovaný od 2. cyklu pre predliečenosť a leukopéniu stupňa I po 1. cykle CHT. Neúspešná snaha o navodenie operability tumoru neoadjuvantnou chemoterapiou a toxicita viedli k jej ukončeniu. Na základe pozitivity octreoscanu, na ktorom nádor vykazoval vysokú denzitu somatostatínových receptorov, zahájil pacient v decembri roku 2015 terapiu somatostatínovými analógmi. Zároveň bolo konzultované pracovisko Rádiológie a nukleárnej medicíny v Basileji. Pacient bol akceptovaný k rádionuklidovej liečbe. 1. podanie s 90Y-DOTATOC (rádionuklidová liečba oktreotidom, značeným izotopom ytria) absolvoval vo februári roku 2016. V apríli a júni roku 2016 prebehli ďalšie 2 podania s 177Lu-DOTATOC (rádionuklidová liečba oktreotidom, značeným izotopom lutécia) s dobrou toleranciou a navodením parciálneho efektu v zmysle zníženia metabolickej aktivity tumoru (ktoré sa prejavilo zníženým vychytávaním rádiofarmaka), bez pribudnutia nových metastatických ložísk (obr. 1 a obr. 2). Následne sme pokračovali v mesačnej aplikácii somatostatínového analógu. Na kontrolnom PET CT realizovanom v novembri roku 2016, čiže asi po 5 mesiacoch od ukončenia rádionuklidovej liečby (PRRT), sme zaznamenali miernu veľkostnú aj metabolickú progresiu tumoru (obr. 3), octreoscan ostal bez zmeny. Ďalšiu miernu progresiu veľkosti potvrdilo aj vyšetrenie v máji roku 2017, okrem tumoru sprogredovali aj LU v mediastine, v oblasti 4R (oblasť mediastinálnych lymfatických uzlín, konkrétne ide o dolné paratracheálne uzliny vpravo), v pravom pľúcnom hile, pribudli nové intemamárne LU vľavo, subkostálne infiltráty bazálne vpravo a pleurálny infiltrát vpravo (obr. 4). Pre riziko rozvoja syndrómu hornej dutej žily (HDŽ) bola navrhovaná paliatívna rádioterapia, ktorú pacient iniciálne odmietal. Aktuálne je liečený na lokálnom rádioterapeutickom pracovisku, zvažovaná je ďalšia línia liečby everolimom. Napriek pokročilosti nádoru, takmer po 4 rokoch liečby, je klinický stav pacienta stále veľmi dobrý.
Tab. 1. WHO klasifikácia: neuroendokrinné nádory týmusu 2015 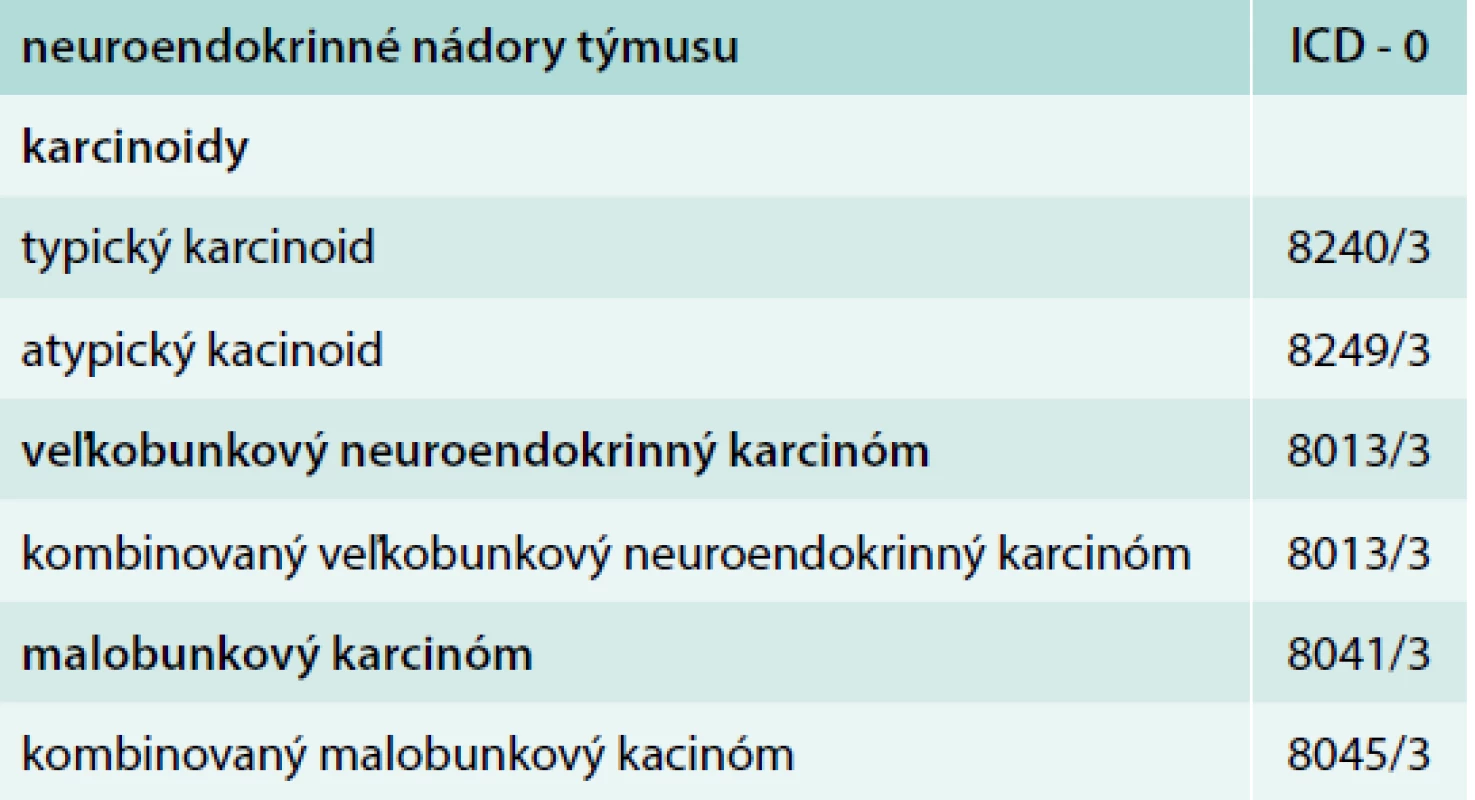
Obr. 1. Zobrazenie tumoru pred 1. aplikáciou PRRT. Z archívu spoluautorky MUDr. M. Černej, CSc. 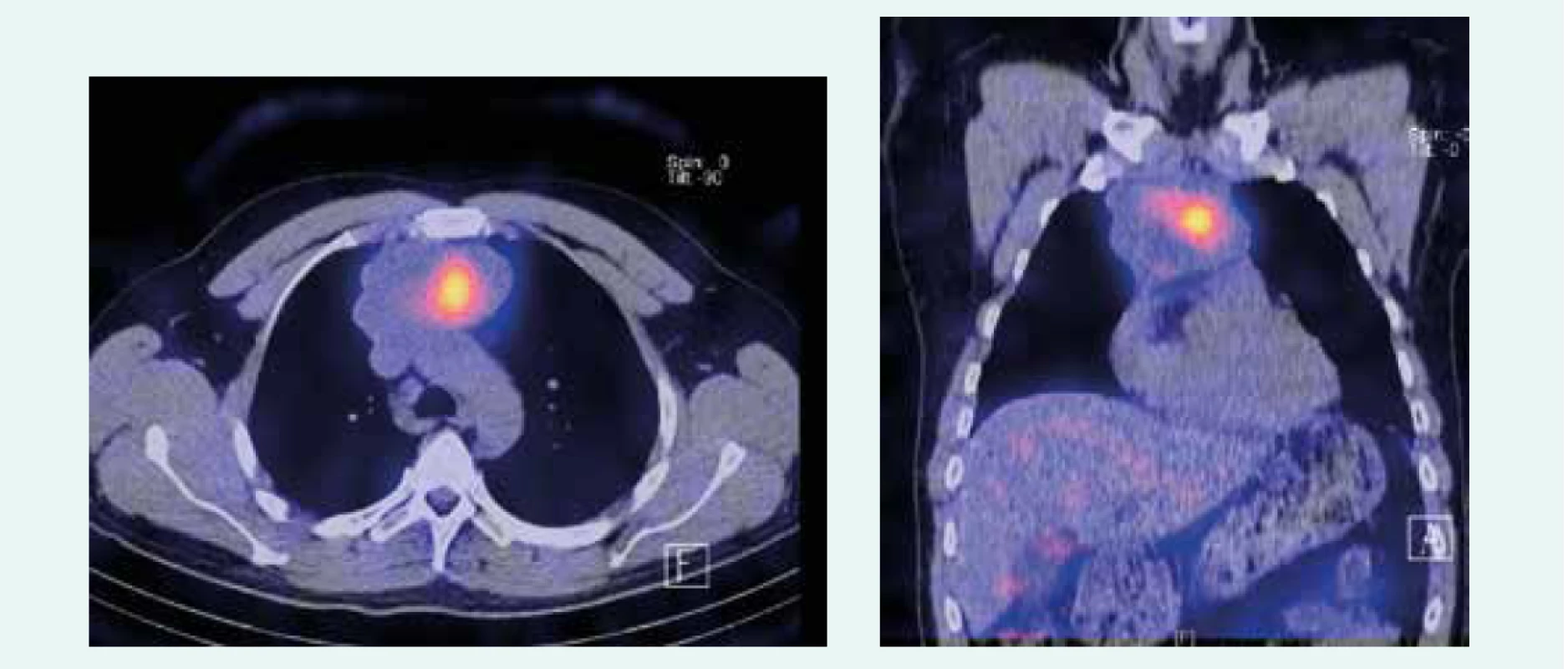
Obr. 2. Zobrazenie tumoru po poslednej aplikácii PRRT. Z archívu spoluautorky MUDr. M. Černej, CSc. 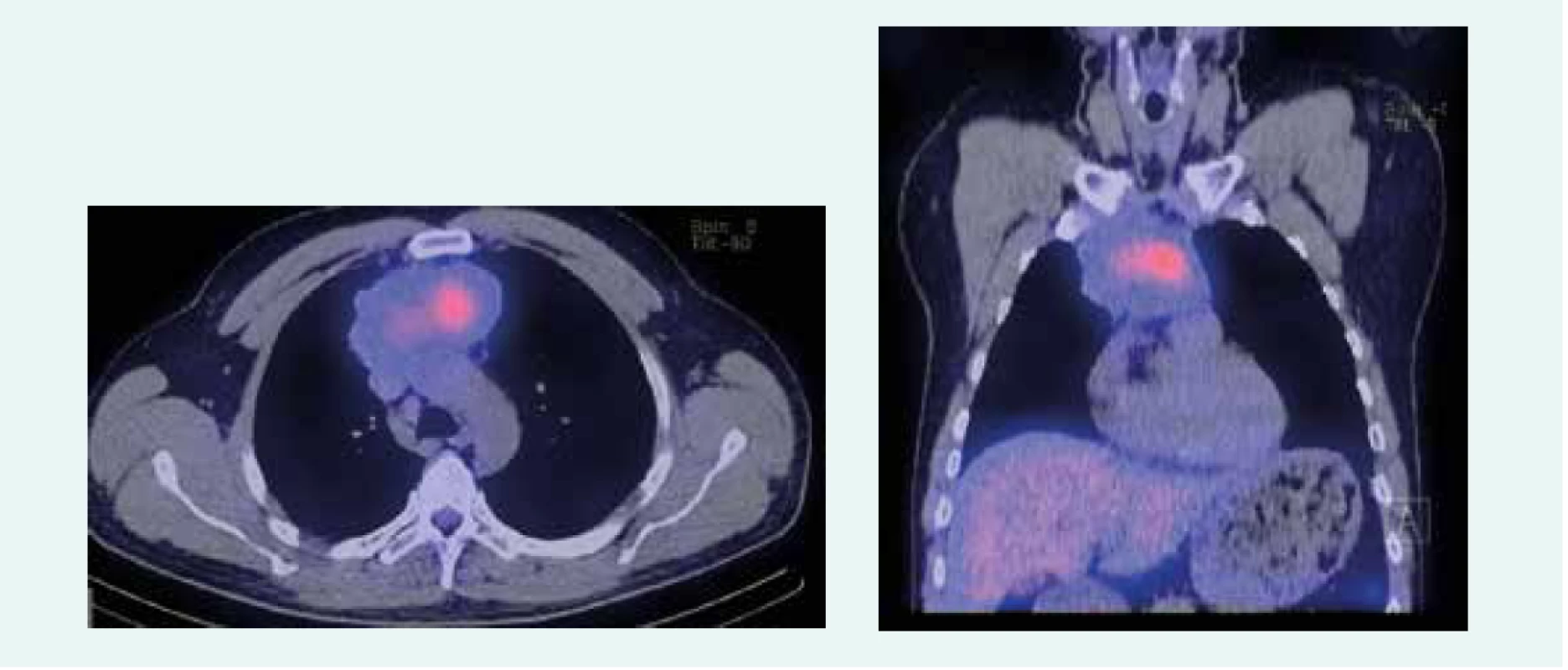
Obr. 3. CT a PET CT z novembra roku 2016. Z archívu spoluautorky MUDr. M. Černej, CSc. 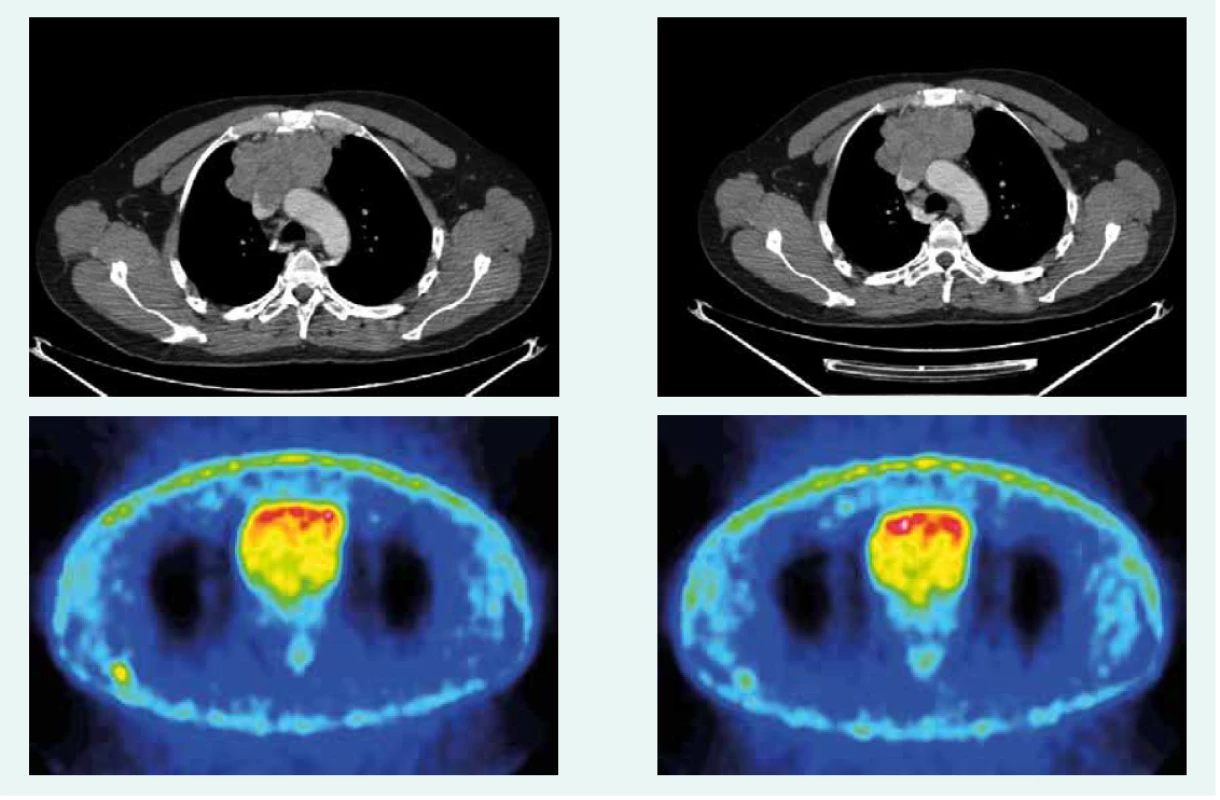
Obr. 4. CT a PET CT z mája roku 2017. Z archívu spoluautorky MUDr. M. Černej, CSc. 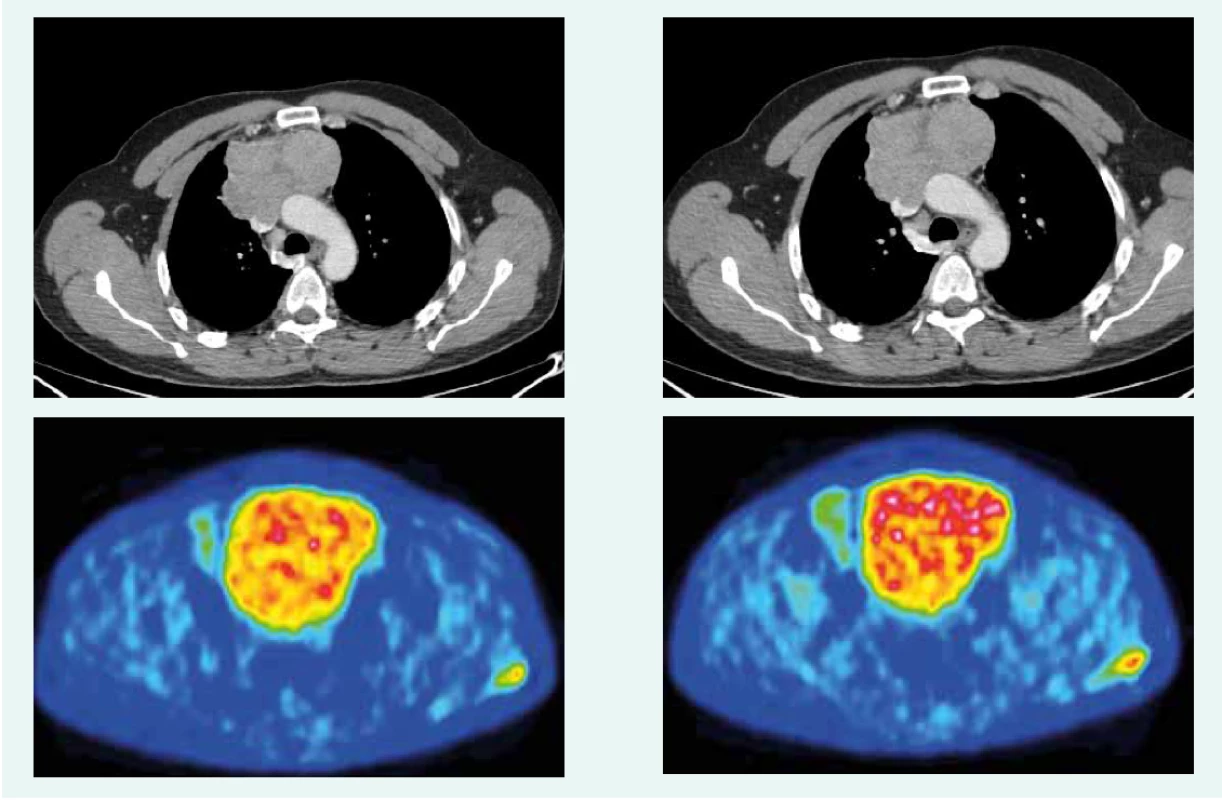
Diskusia
Tymický karcinoid je veľmi zriedkavým ochorením, s incidenciou 0,02/100 000 [11]. Z celkového počtu karcinoidov rôznej lokality predstavuje len asi 0,4 % [8,10], preto štandardné liečebné postupy nie sú určené. Ide väčšinou o odporúčania získané na základe pozorovaní z kazuistík a menších súborov pacientov. Radikálny operačný výkon je však súhlasne všetkými autormi považovaný za základný pilier liečby. V prípade lokálne pokročilého, inoperabilného štádia je možné iniciálne podať neoadjuvantnú liečbu v snahe o remisiu ochorenia a dosiahnutie operability. Najčastejšie sa spomína neoadjuvantná kombinovaná chemoterapia v zložení s platinou [12], ktorá bola použitá aj v prípade nášho pacienta s efektom stabilizácie ochorenia. Schéma ADOC síce bola čiastočne úspešná, ale pre pretrvávajúcu masívnu infiltráciu brachiocefalických vén a v. cava superior ostal nález inoperabilný.
Ako ďalšia možnosť v neoadjuvancii je spomínaná chemorádioterapia [4,7], v starších súboroch hlavne neoadjuvantná rádioterapia [9,13,14]. Za zmienku stojí zaujímavá kazuistika Anu Dhama et al [15], ktorý v neoadjuvancii úspešne použil kombináciu somatostatínového analógu a sunitinibu. Po 3 týždňoch bola dosiahnutá parciálna remisia nádoru s následnou R0 resekciou. Liečba somatostatínovými analógmi u foregut tumorov sa opiera o výsledky 2 štúdii s gastroenteropankreatickými neuroendokrinnými tumormi (NET) – PROMID a CLARINET. V prvej z nich u pacientov s aktívnymi aj inaktívnymi metastatickými mid-gut NET bolo dokázané predĺženie prežívania bez progresie (progression free survival – PFS) v porovnaní s placebom 14,3 vs 6 mesiacov, pričom benefit z liečby mali pacienti s funkčným aj nefunkčným tumorom [16]. Podobný výsledok priniesla štúdia CLARINET, v ktorej boli zahrnutí pacienti s nefunkčnými, prevažne gastroenteropankreotickými nádormi s pozitívnym octreoscanom [17].
Povzbudivé výsledky s liečbou metastatického pľúcneho karcinoidu publikovali Bongiovanni et al. Na súbore 30 pacientov s metastatickým pľúcnym karcinoidom dokázal efektivitu prvolíniovej liečby somatostatínovým analógom, v zmysle miery kontroly ochorenia a prežívania bez progresie [18].
U tymických neuroendokrinných nádorov zatiaľ ide len o skúsenosti z drobných súborov alebo kazuistík. Napriek absencii prospektívnych štúdií, somatostatínové analógy majú pravdepodobne rolu v liečbe pomaly progredujúcich, inoperabilných nádorov a u pacientov s karcinoidovým syndrómom, ktorým prinášajú zmiernenie symptómov [9]. U chorých s pokročilým, dobre diferencovaným neuroendokrinným nádorom s pozitivitou somatostatínových receptorov je možné zvážiť rádionuklidovú liečbu. Jej princíp spočíva v intravenóznom podaní rádiofarmaka obsahujúceho β-žiarič naviazaný na neradioaktívny ligand somatostatinových receptorov [19]. V súčasnosti sa najčastejšie využívajú izotopy ytria a lutécia, ktoré sa môžu v liečbe kombinovať. Na základe výsledkov štúdie NETTER-1 FDA v januári roku 2018 schválila liek LUTATHERA® (lutetium Lu 177 dotatate*) na liečbu somatostatín-receptor pozitívnych neuroendokrinných gastroenteropankretických nádorov, ale aj nádorov foregut a hindgut pôvodu.
Skúsenosti s PRRT u tymického karcinoidu publikovalo niekoľko autorov. Anna Imhof et al [20] v štúdii s Y90-DOTA-TOC u neuroendokrinných nádorov s pozitívnym octreoscanom zaradila aj 8 pacientov s tymickým karcinoidom. Medián prežívania bol 37 mesiacov (19–56 mesiacov), 3 pacienti dosiahli morfologickú odpoveď, 2 biochemickú a 2 klinickú odpoveď. Efekt rádionuklidovej liečby s LU 177-octreatate u 16 pacientov s foregut karcinoidmi skúmal Martijn van Essen [10]. Miera odpovedí v celej skupine predstavovala asi 50 %, čo bolo porovnateľné s ostatnými gastroenteropankretickými NET. Liečebná odpoveď u tymického karcinoidu ostala vzhľadom na to, že boli zaradení len 2 pacienti otázna (1 pacient dosiahol stabilizáciu ochorenia, druhý sprogredoval). Pradeep Thepa [21] sa rovnako zameral na neuroendokrinné nádory zriedkavej lokality, medzi ktoré zahrnul aj 3 tymické nádory. Liečebná odpoveď bola hodnotená na základe symptómov, biochemických markerov a zobrazovacích metód. 1 pacient s tymickým karcinoidom dosiahol stabilizáciu ochorenia, 1 parciálnu odpoveď podľa zobrazovacích metód a poklesu chromogranínu a jeden chorý sprogredoval. Veľmi zaujímavú kazuistiku predstavil Ameya D. Puranik [22]. Išlo o úspešnú liečbu 3 relapsov tymického karcinoidu Y a LU značeným somatostatínovým analógom opakovane v priebehu 8 rokov. Autor pritom zdôraznil hlavný cieľ liečby PRRT, a to je predĺženie prežívania pacientov pri dobrej kvalite života a potreba personalizovať liečbu podľa konkrétneho pacienta. U nášho pacienta sa nám podarilo s 3 podaniami PRRT dosiahnuť navodenie parciálneho efektu v zmysle zníženia metabolickej aktivity tumoru, bez pribudnutia nových metastatických ložísk. Následne pacient pokračoval v aplikácii octreotidu. Liečbou sa podarilo na určitú dobu dosiahnuť stabilizáciu ochorenia. PET CT realizované približne 5 mesiacov po ukončení PRRT popisuje miernu veľkostnú aj metabolickú progresiu tumoru. Ďalšiu progresiu tumoróznej masy, ale aj pribudnutie nových LU, subkostálnych a pleurálnych infiltrátov nachádza kontrolné vyšetrenie z mája roku 2017. U pacienta aktuálne do úvahy pripadala paliatívna rádioterapia v snahe o vyhnutiu sa rozvoja syndrómu HDŽ a následne ďalšia línia liečby everolimom (v štúdii RADIANT-4 v liečbe progredujúcich neuroendokriných nádorov gastroenteropankreatického a pľúcneho pôvodu liečba everolimom dokázala signifikantne predĺžiť PFS – v porovnaní s placebom 11 vs 3,9) [23].
Záver
Atypický karcinoid týmusu patrí do skupiny neuroendokrinných nádorov týmusu (tab. 2). Ide o veľmi zriedkavé ochorenie s celkovým počtom len niekoľko stoviek medzinárodne reportovaných prípadov [4,13,14,2]. Nešpecifické príznaky, ktorými sa tymický karcinoid iniciálne prezentuje ako sú kašeľ a diskomfort na hrudníku môžu viesť k neskorému odhaleniu diagnózy a strate možnosti radikálnej operačnej liečby. Manažment pacienta v inoperabilnom a metastatickom štádiu má za cieľ predĺžiť život pacienta a zachovať jeho kvalitu. Okrem chemoterapie a rádioterapie nám v súčasnosti pribudli aj nové liečebné možnosti na splnenie tohto cieľa, a to liečba somatostatínovými analógmi, rádionuklidmi a cielená liečba mTOR inhibítormi. Zaraďovanie pacientov do klinických štúdii, ale aj samotné kazuistiky napomáhajú v smerovaní liečby.
Tab. 2. WHO klasifikácia bronchopulmonálnych a tymických neuroendokrinných nádorov 2015 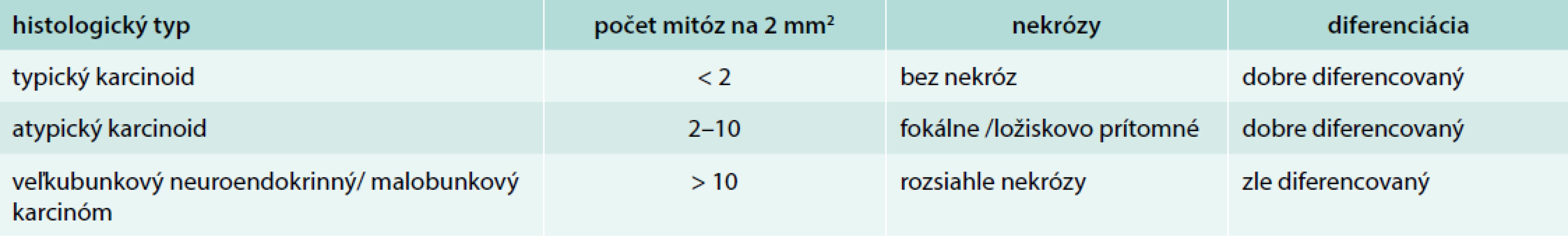
NENs – neuroendokrínne neoplazmata/Neuroendocrine Neoplasms WHO – Svetová zdravotnícka organizácia/World Health Organization MUDr. Radka Cahajlová
Oddelenie klinickej onkológie Kliniky pneumológie a funkčnej diagnostiky SZU a UNB, Nemocnica Ružinov, Bratislava, Slovenská republika
Doručeno do redakce 27. 3. 2018
Přijato po recenzi 5. 10. 2018
Zdroje
- Litvak A, Pietanza MC. Bronchial and Thymic Carcinoid Tumors.Hematol Oncol Clin North Am 2016;30(1):83–102. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hoc.2015.09.003>.
- Filosso PL, Actis Dato GM, Ruffini E et al. Multidisciplinary treatment of advanced thymic neuroendocrine carcinoma (carcinoid): Report of a succesful case and review of the literature[online]. J Thorac Cardiovasc Surg 2004; 127(4): 1215–1219. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jtcvs.2003.09.058>.
- Mikhail M, Mekhail Y, Mekhail T Thymic neoplasm: A clinical Update [online]. Curr Oncol Rep 2012; 14(4): 350–358. Dostupné z DOI: <http://dx.doi.org/10.1007/s11912–012–0246–8>.
- Gielda BT, Peng R, Colamen JL et al. Treatment of Early stage thymic tumors: surgery and radiotion therapy. Curr Treat Options Oncol 2008; 9(4–6): 259–268. Dostupné z DOI: <http://dx.doi.org/10.1007/s11864–008–0080–2>.
- Chaer R, Massad MG, Evans A et al. Primary neuroendocrine tumors of the thymus. Ann Thorac Surg 2002; 74(5): 1733–1740.
- Öberg K, Hellman P, Ferolla P et al. Neuroendocrine bronchial and thymic tumors: ESMO Clinical Pracstise Guidelines for diagnosis, treatment and follow up. Ann Oncol 2012; 23(Suppl 7): vii120–123. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mds267>.
- Filosso PL, Ruffini E, Solidoro P et al. Neuroendocrine tumors of the thymus. J Thorac Dis 2017; 9(Suppl 15): S1484-S1490. Dostupné z DOI: <http://dx.doi.org/10.21037/jtd.2017.10.83>.
- Tamura M, Ohta Y, Oda M et al. Thymic carcinoid Tumor. Jpn J Thorac Cardiovasc Surg 2003; 51(1): 29–31. Dostupné z DOI: <http://dx.doi.org/10.1007/s11748–003–0063-y>.
- Srirajaskanthan R, Toubanakis C, Dusmet M et al. A review of thymic tumours. Lung Cancer 2008; 60(1): 4–13. Dostupné z DOI: <http://dx.doi.org/10.1016/j.lungcan.2008.01.014>.
- van Essen M, Krenning EP, Bakker WH et al. Peptide receptor radionuclide therapy with 177 LU-octreotate in patients with foregit carcinoid tumours of bronchial, gastric and thymic origin. Eur J Nucl Med Mol Imaging 2007; 34(8): 1219–1227. Dostupné z DOI: <http://dx.doi.org/10.1007/s00259–006–0355–4>.
- Tomišková M. NEN plic a thymu. In: Sedláčová E, Bajčiová V (eds.) Neuroendokrinní nádory. Maxdorf: Praha 2016 : 180–202. ISBN 978–80–7345–468–5
- Girard N. Neuroendocrine tumors of the thymus: the oncologist point of view. J Thorac Dis. 2017; 9(Suppl 15): S1491-S1500. Dostupné z DOI: <http://dx.doi.org/10.21037/jtd.2017.08.18>.
- Crona J, Björklund P, Welin S et al. Treatment, prognostic markers and survival in thymic neuroendocrine tumours. A study from a single tertiary referral centre. Lung Cancer 2013; 79(3): 289–293. Dostupné z DOI: <http://dx.doi.org/10.1016/j.lungcan.2012.12.001>.
- Song Z, Zhang Y. Primary neuroendocrine tumors of the thymus: Clinical review of 22 cases. Oncol Lett 2014; 8(5): 2125–2129. Dostupné z DOI: <http://dx.doi.org/10.3892/ol.2014.2490>.
- Dham A, Truskinovsky AM, Dudek AZ Thymic Carcinoid Responds to Neoadjuvant Therapy with Sunitinib and Octreotide. A Case report. J Thorac Oncol 2008; 3(1): 94–97. Dostupné z DOI: <http://dx.doi.org/10.1097/JTO.0b013e31815eb7a2>.
- Rinke A, Müller HH, Schade-Brittinger Cet al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID study group. J Clin Oncol 2009; 27(28): 4656–4663. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2009.22.8510>.
- Caplin ME, Pavel M, Cwikla JB et al. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med 2014; 371(3): 224–233. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1316158>.
- Bongiovanni A, Recine F, Riva N et al. Outcome analysis of first-line Somatostatin Analog Treatment in Metastatic pulmonary Neuroendoctrine Tumors and prognostic Significance of 18 FDG-PET/CT. Clinical Lung Cancer 2017; 18(4): 415–420. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cllc.2016.11.004>.
- Zogala D. Terapie pomocí otevřených zářičü. In: Sedláčová E, Bajčiová V (eds) Neuroendokrinní nádory. Maxdorf: Praha 2016 : 156–164. ISBN 978–80–7345–468–5.
- Imhof A, Brunner P, Marincek N et al. Response, survival, and long-term toxicity after therapy with the radiolabeled somatostatin analogue [90Y-DOTA]-TOC in metastasized neuroendocrine cancers. J Clin Oncol 2011; 29(17): 2416–2423. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2010.33.7873>.
- Thapa P, Parghane R, Basu S. 177 Lu - DOTATE Peptide Receptor radionuclide Therapy in Metastatic or Advanced and Inoperable Primary Neuroendocrine Tumors of rare Sites. World J Nucl Med 201716(3):223–228. Dostupné z DOI: <http://dx.doi.org/10.4103/1450–1147.207283>.
- Puranik AD, Kulkarni HR, Singh A et al. 8-year survival with a metastatic thymic neuroendocrine tumor: emphasision redefining “treatment objectives” using personalized peptide receptor radionuclide therapy with 177LU - an 90Y-labeled somatostatin analogs. AACE Clinical Case Rep 2015; 1(2): e131-e135. Dostupné z DOI: <http://dx.doi.org/10.4158/EP14354.CR>.
- Yao JC et al. Everolimus for the treatment of advanced, on-functional neuroendorcrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-contralled, phasy 3 study. Lancet 2016; 387(10022): 968–977. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)00817-X>.
- Zhu S, Wang ZT, Liu WZ et al. Invasive atypical thymic carcinoid: three case reports and literature review. Onco Targets Ther 2016; 9 : 6171–6176. Dostupné z DOI: <http://dx.doi.org/10.2147/OTT.S109693>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Korespondence ke článku
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2019 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Netuberkulózní mykobakteriální onemocnění – editorial
- Neuroendokrinní nádory tymu – editorial
- Dodržování etických pravidel ve vědeckém publikování v biomedicínských Open Access časopisech indexovaných v Journal Citation Reports
- Limitovaná ambulantní noční monitorace spánku u pacientů s podezřením na syndrom obstrukční spánkové apnoe: Je dostatečně indikovaná?
- Chirurgická léčba chronické tromboembolické plicní hypertenze
- Komunikace s onkologickým pacientem
- Multimodálna liečba tymického karcinoidu: kazuistika
- Netuberkulózní mykobakteriální onemocnění: review na podkladě kazuistiky
- Použití idarucizumabu v klinické praxi: kazuistika
- Otto Kahler a jeho rod II: Léta zrání v Praze
- Korespondence ke článku
- Jan Švihovec, Jan Bultas et al (eds). Farmakologie
- Jan Krejsek, Ctirad Andrýs, Irena Krčmová. Imunologie člověka
- Petr Jakubec, Vítězslav Kolek. Pneumonie pro klinickou praxi
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Netuberkulózní mykobakteriální onemocnění – editorial
- Komunikace s onkologickým pacientem
- Chirurgická léčba chronické tromboembolické plicní hypertenze
- Limitovaná ambulantní noční monitorace spánku u pacientů s podezřením na syndrom obstrukční spánkové apnoe: Je dostatečně indikovaná?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



