-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
Are changes in the blood count clinically useful marker of azathioprine dose?
Introduction: The 6-thioguanine nucleotide (6-TGN) level, may be used to estimate dose-adequacy of azathioprine (AZA) therapy. 6-TGN test is not commercially available. The aim of the study was to determine whether a blood cell changes correlate also with the dose of AZA and may serve as a predictor of the dose adequacy (for MCV > 6 fl).
Methods: Retrospective, multicentre study in subjects with IBD treated with azathioprine. Demographic data, leukocyte, platelet counts, erythrocyte (MCV) and thrombocyte (MPV) volume, azathioprine dose, inflammatory activity in the 3rd, 6th and 12th months of treatment and presence of sideropenia were recorded.
Results: 103 subjects analysed. To increase the MCV by 6 fl, the AZA dose above 2 mg/kg is needed (p = 0.04). The MCV increases within 165 days (95% CI, 154–181 days, p = 0.002). Sideropenia has no impact on the MCV change. Number of leukocytes and thrombocytes decreases during treatment (p < 0.001). Change in their number as well as MPV, does not correlate with MCV change and is not affected by activity of the inflammation.
Conclusion: The MCV dynamics (> 6 fl within 6 months) is the only relevant indicator during AZA treatment. Changes in the number of leukocytes, platelets and their volume can not be used to assess the sufficiency of the AZA dose. Sideropenia has no impact on the dynamics of MCV.
Keywords:
azathioprine – blood test monitoring – inflammatory bowel diseases
Autori: Vladimír Kojecký 1; Jan Matouš 2; Zdena Zádorová 2; Bohuslav Kianička 3; Aleš Hep 4
Pôsobisko autorov: Interní oddělení Krajské nemocnice T. Bati, a. s., Zlín, LF MU Brno 1; II. interní klinika 3. LF UK a FN Královské Vinohrady Praha 2; II. interní klinika LF MU a FN u sv. Anny Brno 3; Interní gastroenterologická klinika LF MU a FN Brno, pracoviště Bohunice 4
Vyšlo v časopise: Vnitř Lék 2020; 66(4): 67-70
Kategória: Původní práce
Súhrn
Úvod: Hladinu 6-thioguanin nukleotidu (6-TGN), metabolitu azathioprinu (AZA), lze využít k posouzení dostatečnosti dávky. Vyšetření 6-TGN není běžně dostupné. Cílem práce bylo určit, zda změny krevního obrazu také korelují s dávkou AZA a lze je použít k odhadu její dostatečnosti (MCV > 6 fl) místo vyšetření 6-TGN.
Metody: Retrospektivní, multicentrické sledování u osob s idiopatickými střevními záněty, léčených azathioprinem. Zaznamenány byly demografické údaje, počet leukocytů, trombocytů, objem erytrocytů (MCV) a trombocytů (MPV), dávka azathioprinu a aktivita zánětu ve 3., 6. a 12. měsíci léčby, přítomnost sideropenie.
Výsledky: Hodnoceno bylo 103 osob. Pro zvětšení MCV o 6 fl je potřebná dávka AZA větší než 2 mg/kg (p = 0,04). K nárůstu dojde do 165 dní (95% CI; 154–181 dní, p = 0,002). Sideropenie nemá na změnu MCV vliv. Během léčby AZA klesá počet leukocytů (do 3. měsíce) i trombocytů (p < 0,001). Změna jejich počtu i MPV, se změnou MCV nekoreluje a není ovlivněna ani aktivitou zánětu.
Závěr: Při léčbě AZA má význam pouze sledování dynamiky MCV (> 6 fl do 6 měsíců). Změny počtu leukocytů, trombocytů a jejich objemu, nelze pro hodnocení ev. dostatečnosti dávky použít. Sideropenie nemá na dynamiku MCV vliv.
Klíčová slova:
azathioprin – idiopatické střevní záněty – krevní obraz
Úvod
Azathioprin (AZA) je používán jako imunomodulátor v léčbě řady autoimunitních onemocnění. Jde o proléčivo, které se dále metabolizuje přes merkaptopurinové nukleotidy na 6-thioguanin nukleotid (6-TGN), vlastní nosič účinku AZA. Část metabolitů je během konverze inaktivována na 6-metylmerkaptopurin a kyselinu 6-thiomočovou. Míra metabolizace AZA je individuálně odlišná a množství vzniklého 6-TGN je variabilní. Bylo navrženo, aby se dostatečnost dávky AZA posuzovala podle dosažené hladiny 6-TGN v erytrocytech (1). Vyšetření koncentrace 6-TGN se běžně neprovádí a pro rutinní kontroly je proto nepoužitelné. Podávání AZA provází změny počtu leukocytů, trombocytů a především objemu erytrocytu (2). Je otázkou, do jaké míry lze znalost hladiny 6-TGN nahradit průběžným sledováním vybraných změn krevního obrazu. Na některé ukazatele mají vliv dalšími faktory, jako je vlastní aktivita zánětu nebo sideropenie, které mohou výsledné působení AZA modifikovat. Cílem práce bylo určit, zda lze dostatečnou výši dávky AZA, posoudit pouze na základě změn v krevním obraze.
Cíle práce
Zvýšení středního objemu erytrocytů (MCV) o 6–8 fl se považuje za ukazatel, který by mohl odpovídat dosažení terapeutické hladiny 6-TGN (> 235 pmol/8 × 108 RBC) (2). Za indikátor dostatečné dávky AZA jsme proto považovali změnu MCV ≥ 6 fl.
Primárním cílem práce bylo určení dávky AZA a doby, potřebné pro zvětšení MCV o 6 fl a více.
Sekundárním cílem bylo zjištění, zda lze k posouzení dostatečnosti dávky použít změn počtu trombocytů, leukocytů, objemu trombocytů, zda má vliv sideropenie a aktivita střevního zánětu.
Soubor pacientů a metodika
Retrospektivní, multicentrické sledování. Do sledování byli zařazeni pacienti s Crohnovou chorobou, ulcerózní kolitidou, ve věku 18–60 let, sledovaní v gastroenterologické ambulanci Krajské nemocnice T. Bati ve Zlíně a na II. interní klinice 3. LF UK a FN Královské Vinohrady Praha. Vybrány byly osoby, u nichž jsme byli schopni dohledat ve zdravotnické databázi údaje o prvních 12 měsících léčby azathioprinem. Data byla zaznamenána anonymně a s písemným souhlasem pacientů.
Vylučující kritéria
Ze sběru dat jsme vyloučili osoby, u nichž byla léčba AZA v prvních 12 měsících přerušena, ukončena, případně u nich byla dávka AZA redukována. Dále byly vyloučeny osoby s anamnézou jakéhokoliv operačního výkonu, významného krvácení ve sledovaném intervalu, osoby léčené vitaminem B12, foláty, látkami ovlivňujícími počty leukocytů a trombocytů a ty, které dostaly transfuze. Dále byli vyloučeni gravidní, nemocní s jinými závažnými chorobami (jaterní, kardiální, renální) nebo abúzem alkoholu.
Sběr dat
Zaznamenali jsme věk, hmotnost, pohlaví, typ střevního zánětu, dávku AZA, hladinu CRP, aktivitu střevního zánětu, přítomnost sideropenie (podle hladiny železa, ferritinu, transferinu nebo vazebné kapacity transferinu), MCV, počet leukocytů, trombocytů a střední objem trombocytů (MPV), před zahájením léčby, dále ve 3., 6. a 12. měsíci podávání. Diferenciální krevní obraz nebyl u dostatečného počtu osob dispozici, proto jiné parametry (např. počet lymfocytů) sledovány nebyly. Za aktivní jsme považovali zánět s CDAI indexem nad 150 nebo Mayo skóre 3 a více, případně stav, kdy byla aktivita zánětu zjištěna endoskopicky nebo zobrazovacími metodami.
Statistická analýza
Kvantitativní proměnné byly analyzovány za pomoci párového T testu/Wilcoxonova testu nebo nepárového T testu/Mann Whitney testu, dle normality dat. K hodnocení vztahů mezi proměnnými bylo použito ROC analýzy, jednorozměrného a vícerozměrného lineárního regresního modelu. Za významné jsme považovali hodnoty p ≤ 0,05.
Výsledky
K dispozici byly údaje od 118 osob. Z analýzy byla pro nekompletnost nebo odlehlé hodnoty vyřazena data 15 subjektů. Analyzováno bylo celkem 103 subjektů.
Základní demografické údaje jsou uvedeny v Tab. 1.
Tab. 1. Základní charakteristika souboru 
CRP – C reaktivní protein, AZA – azathioprin
Hodnoty jsou uvedeny jako průměr (směrodatná odchylka) nebo absolutní (relativní četnost)Průměrná dávka azathioprinu se od 3. měsíce sledování neměnila (132,6 ± 35,4 mg a 137,1 ± 34,4 mg ve 12. měsíci). MCV se zvětšoval v prvních 6 měsících podávání AZA (p < 0,001) a dále se neměnil. Počet leukocytů klesl na stabilní hodnotu během prvních 3 měsíců (p = 0,001), počet trombocytů se snižoval po celých 12 měsíců (p < 0,001). Střední objem trombocytů byl během sledování stacionární (Tab. 2 a Graf 1).
Graf 1. Změny krevního obrazu v průběhu léčby azathioprinem
Relativní změna
MCV – střední objem erytrocytu Tab. 2. Změny krevního obrazu v průběhu léčby azathioprinem 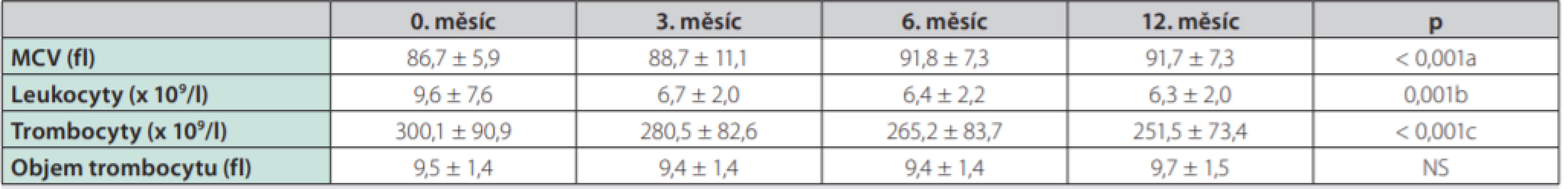
p ≤ 0,05 – významné
MCV – střední objem erytrocytu
a) rozdíl počátek vs. 6. měsíc
b) rozdíl počátek vs. 3. měsíc
c) rozdíl počátek vs. 12. měsíc
Hodnoty jsou uvedeny jako průměr (směrodatná odchylka) nebo absolutní (relativní četnost)Primární cíl
Ke zvětšení MCV o 6 fl došlo v 6. měsíci u 37 osob (35,9 %). Dávka AZA potřebná k dosažení této změny MCV je větší než 2,0 mg/kg (95% CI; 1,2–2,3, p = 0,044, AUC 0,62). Doba do nárůstu MCV o 6 fl je 165 dní (95% CI; 154–181 dní, p = 0,002, AUC 0,64).
Sekundární cíl
Nepodařilo se nám nalézt hraniční hodnotu pro změnu počtu leukocytů (ve 3. měsíci) ani trombocytů (12. měsíc), která je spojená se zvýšením MCV nad 6 fl. MPV se během doby nezměnil, spojitosti proto nebyly analyzovány.
Při multifaktoriální analýze jsme nenalezli asociaci mezi změnou MCV, počtem trombocytů (ve 12. měsíci), leukocytů (3. měsíc) ani žádným ze sledovaných faktorů (věk, pohlaví, typ střevního zánětu, hladina CRP, aktivita střevního zánětu). Na velikost změny MCV neměla vliv ani sideropenie. Počet leukocytů a trombocytů nekoreloval s aktivitou zánětu, hladinou CRP nebo dávkou AZA.
Diskuze
Thioguaninové nukleotidy jsou vlastní účinnou látkou při léčbě AZA. Působí jako purinoví antagonisté, kdy mají cytotoxické a imunosupresivní působení, které terapeuticky využíváme. AZA je asi z 80 % konvertován na 6 merkaptopurin (6-MP) (3). 6-MP se působením hypoxantin -guanin fosforibosyltransferázy mění na 6-TGN. Xantinoxidáza a thiopurin -metyltransferáza (TPMT) pak konvertují 6-MP a 6-TGN na neúčinné látky. Množství vznikajícího 6-TGN je individuálně velmi variabilní a závislé na aktivitě všech enzymů metabolické kaskády. Největší vliv na hladiny 6-TGN má katabolismus cestou TPMT. TPMT je enzymem s významným genovým polymorfismem. U asi 1/10 populace je jeho aktivita nízká, spojená s rizikem překročení toxických hladin 6-TGN i při běžném dávkování. U 80 % populace je aktivita enzymu normální. Zbývající desetina osob má aktivitu enzymu velmi vysokou (1) a koncentrace 6-TGN pak nedosáhnou terapeutických hodnot. Vyšetřením genotypu TPMT nelze spolehlivě predikovat hladinu 6-TGN. Fenotypizace s určením aktivity TPMT také není zásadně přínosná. Vlivem zevních faktorů (transfuze, léky) jsou výsledky tohoto vyšetření variabilní. Na hladiny 6-TGN také má vliv biologická dostupnost AZA, daná galenickou úpravou léčiva (4).
Koncentrace 6-TGN se stanovuje v erytrocytech, kde je hladina oproti plazmě stabilnější. Hladiny 6-TGN > 235 pmol/8 × 108 erytrocytů byly u IBD navrženy jako ukazatel hranice účinnosti (5). Koncentrace nad 450 pmol/8 × 108 erytrocytů jsou spojeny s rizikem toxicity a nejsou žádoucí.
Antimetabolický účinek AZA/6-TGN se projevuje změnami v červeném i bílém krevním obraze. Klesá počet erytrocytů, mění se jejich distribuční křivka, stoupá obsah korpuskulárního hemoglobinu a objem erytrocytů. Snižuje se i počet trombocytů, leukocytů a lymfocytů. Byla proto snaha využít těchto změn, jako náhrady za stanovení 6-TGN. Přínos změn krevního obrazu jako indikátoru adekvátnosti dávky AZA je hodnocen různě. Názory oscilují od odmítavého postoje (6, 7), až po uznání jejich přínosu (8).
Z hodnocených parametrů byla zkoumána změna MCV (7–9). Makrocytóza (MCV > 101 fl) podle některých autorů prakticky vylučuje subterapeutické hladiny 6-TGN (9). Velikost MCV v průběhu času i z důvodů variability metodiky kolísá a je otázkou, jakou změnu máme považovat za významnou. V práci D’Halluina et al (8) žádoucí hladině 6-TGN nad 235 pmol/8 × 108 erytrocytů odpovídalo zvětšení MCV o 6,5 fl a koncentraci 255 pmol/8 × 108 erytrocytů změna o 8 fl (2). Hodnotu 6 fl jsme použili jako hranici v naší práci. Došlo k ní jen u 2/5 pacientů. Změna objemu byla v celé skupině nižší, než je oněch 6 fl. Nejspíše jde o následek nedostatečné dávky AZA (průměr 1,9 mg/ kg). Z naší analýzy vyplývá, že množství AZA potřebné pro změnu větší než 6 fl, by mělo přesahovat 2 mg/kg.
AZA je lék s pomalým nástupem účinku (3–4 měsíce) (10). Námi zjištěná závislost mezi dobou potřebnou ke zvýšení objemu nad 6 fl s tímto faktem koreluje. Významné zvýšení MCV bylo patrno už ve 3. měsíci a ustálené hodnoty dosáhl MCV asi za 6 měsíců. Stejnou časovou závislost při porovnání hladin 6-TGN a změn MCV zaznamenal Decaux (2). Hodnocení doby nástupu klinického účinku AZA je při retrospektivním odhadu aktivity zánětu zavádějící, proto jsme jej neprováděli.
Z naší analýzy vyplývá, že s hodnocením efektu AZA lze vyčkat déle, než jsou doporučované 3–4 měsíce. Pokud při dávce 2 mg/kg nedojde do asi půl roku od zahájení léčby AZA k významnému zvětšení objemu erytrocytu, pak je vhodné, při trvající aktivitě zánětu, prověřit příčiny. Zkontrolovat adherenci pacienta k léčbě. Můžeme zvýšit dávku AZA dříve, než terapii, jako neefektivní, ukončíme.
Sideropenie je faktor vyvolávající mikrocytózu. V naší analýze její přítomnost neinterferovala se změnou MCV. Porovnat tento závěr s literaturou nelze pro nedostatek údajů. Hladiny vitaminu B12 a folátů jsme nehodnotili. Případný deficit vitaminu B12 by neměl být překážkou. Ke zvětšení MCV při léčbě AZA dochází i za nedostatku folátů a vitaminu B12 (11).
Leukocytóza a trombocytóza jsou jedny z průvodních známek zánětu, zvláště vysoce aktivního (12). Při léčbě AZA jejich množství klesá a počty korelují i s hladinami 6-TGN. V některých pracích jevila klinická odpověď u Crohnovy choroby souvislost se vznikem leukopenie (pod 5 000/ml) a neutropenie. Významná lymfopenie a leukopenie se považuje za indikátor dosažení toxických hladin 6-TGN (13). K poklesu počtu leukocytů a trombocytů však dochází i při snížení aktivity střevního zánětu. V naší práci počet leukocytů klesl v prvních 3 měsících, počet trombocytů se snižoval po celou dobu sledování. Změna byla v obou skupinách obdobná, bez ohledu na změnu MCV (nad a pod 6 fl). U většiny pacientů byl střevní zánět maximálně nízce aktivní a případná souvislost s CRP, jako objektivním ukazatelem zánětu, zjištěna nebyla. Změny počtu leukocytů a trombocytů nejsou ani podle jiných autorů natolik významné, aby se daly použít jako prediktory hladin 6-TGN (8).
Dalším faktorem, který je zmiňován v souvislosti se zánětem, je střední objem trombocytů. MPV inverzně koreluje s hladinou CRP a byl navržen jako možný ukazatel relapsu více chronických zánětlivých onemocnění, např. Crohnovy choroby (14), revmatoidní artritidy (15) nebo systémového lupus erytematodes (16). V naší práci se však objem trombocytů v průběhu léčby nezměnil.
Závěr
V situaci, kdy není k dispozici vyšetření hladiny 6-TGN, má sledování MCV svůj význam. U osob s terapeutickou dávkou AZA (nad 2 mg/kg), kdy nedošlo ani po půl roce léčby ke změně aktivity zánětu, je vhodné věnovat pozornost dynamice MCV. Významný nárůst (MCV > 6 fl) podporuje podezření na inefektivitu léčby. Jeho chybění ukazuje na možnou non-adherenci a prostor pro zvýšení dávky AZA. Sledování změn počtu leukocytů, trombocytů a jejich objemu, nemá pro posouzení výše dávky význam. Je však nezbytné pro monitorování bezpečnosti léčby.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Vladimír Kojecký, Ph.D.,
Interní oddělení Krajské nemocnice T. Bati, a.s.,
Havlíčkovo nábřeží 600,
760 01 Zlín
Cit. zkr: Vnitř Lék 2020; 66(4): e42–e45
Článek přijat redakcí: 31. 8. 2019
Zdroje
1. Cuffari C, Hunt S, Bayless T. Utilisation of erythrocyte 6-thioguanine metabolite levels to optimise azathioprine therapy in patients with inflammatory bowel disease. Gut 2001; 48 : 642–646.
2. Decaux G, Prospert F, Horsmans Y, et al. Relationship between red cell mean corpuscular volume and 6-thioguanine nucleotides in patients treated with azathioprine. J Lab Clin Med 2000; 135 : 256–262.
3. Wright S. Clinical significance of azathioprine active metabolite concentrations in inflammatory bowel disease. Gut 2004; 53 : 1123–1128.
4. Cuffari C, Hunt S, Bayless TM. Enhanced bioavailability of azathioprine compared to 6-mercaptopurine therapy in inflammatory bowel disease: correlation with treatment efficacy. Aliment Pharmacol Ther 2000; 14 : 1009–1014.
5. Osterman MT, Kundu R, Lichtenstein GR, et al. Association of 6-thioguanine nucleotide levels and inflammatory bowel disease activity: a meta -analysis. Gastroenterology 2006; 130 : 1047–1053.
6. Kopylov U, Battat R, Benmassaoud A, et al. Hematologic indices as surrogate markers for monitoring thiopurine therapy in IBD. Dig Dis Sci 2015; 60 : 478–484.
7. Belaiche J, Dessger JP, Horsmans Y, et al. Therapeutic drug monitoring of azathioprine and 6-mercaptopurine metabolites in Crohn disease. Scand J Gastroenterol 2001; 36 : 71–76.
8. D’Halluin PN, Tribut O, Branger B, et al. RBC 6-TGN and hematological parameters in patients with Crohn’s disease treated by azathioprine. Gastroenterol Clin Biol 2005; 29 : 1264–1269.
9. Heerasing NM, Ng JF, Dowling D. Does lymphopenia or macrocytosis reflect 6-thioguanine levels in patients with inflammatory bowel disease treated with azathioprine or 6-mercaptopurine? Intern Med J 2016; 46 : 465–469.
10. Sandborn WJ, Van O EC, Zins BJ, et al. An intravenous loading dose of azathioprine decreases the time to response in patients with Crohn’s disease. Gastroenterology 1995; 109 : 1808–1817.
11. Kirschner BS. Safety of azathioprine and 6-mercaptopurine in pediatric patients with inflammatory bowel disease. Gastroenterology 1998; 115 : 813–821.
12. Kapsoritakis AN, Koukourakis MI, Sfiridaki A, et al. Mean platelet volume: a useful marker of inflammatory bowel disease activity. Am J Gastroenterol 2001; 96 : 776–781.
13. Lee MN, Kang B, Choi SY, et al. Relationship between azathioprine dosage, 6-thioguanine nucleotide levels, and therapeutic response in pediatric patients with IBD treated with azathioprine. Inflamm Bowel Dis 2015; 21 : 1054–1062.
14. Douda T, Bureš J, Rejchrt S, et al. Mean platelet volume (MPV) in Crohn’s disease patients. Čas Lék Česk 2006; 145 : 870–873.
15. Tekeoglu I, Gürol G, Harman H, et al. Overlooked hematological markers of disease activity in rheumatoid arthritis. Int J Rheum Dis 2016; 19 : 1078–1082.
16. Hartmann LT, Alegretti AP, Machado ABMP, et al. Assessment of Mean Platelet Volume in Patients with Systemic Lupus Erythematosus. Open Rheumatol J. 2018; 12 : 129–138.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázyČlánek Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientovČlánek Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvinČlánek Jaterní fibrózaČlánek Mikroskopická polyangiitída
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2020 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Hyperurikemie z perspektivy nefrologického pacienta
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



