-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Patentní foramen ovale z pohledu intervenční kardiologie
Patent foramen ovale from the point of view of interventional cardiology
The link between patent foramen ovale (PFO) and paradoxical embolization, which may be cause of so-called “cryptogenic” ischemic stroke, has been known for more than 100 years. The catheteriziation closure of PFO as a secondary preventive treatment is performed in a greater extent since the end of the last century. The results of the first epidemiological and randomised clinical trials comparing antiagregation or anticoagulant therapy with the PFO closure did not show a clear benefit of any of these approaches. In 2017, major randomized clinical trials were published that demonstrated the benefit of PFO catheter closure compared to drug therapy alone. In this summary article we describe the diagnostic procedure of patients with PFO undergoing paradoxical embolization, indications and selections of a suitable patient for catheter closure of PFO, the procedure itself and subsequent clinical follow-up of these patients.
Keywords:
catheterization closure – cryptogenic stroke – occluder – patent foramen ovale
Autori: Martin Poloczek; Petr Kala; Tomáš Ondrúš
Pôsobisko autorov: Interní a kardiologická klinika FN Brno a LF MU, Brno
Vyšlo v časopise: Vnitř Lék 2021; 67(1): 22-28
Kategória:
Súhrn
Souvislost patentního foramen ovale (PFO) a paradoxní embolizace, která může být příčinou tzv. „kryptogenní“ ischemické cévní mozkové příhody, je známa více než 100 let. Katetrizační uzávěr PFO jako sekundárně preventivní léčba je ve větší míře prováděn od konce minulého století. Výsledky prvních epidemiologických a randomizovaných klinických studií srovnávajících antiagregační nebo antikoagulační léčbu s katetetrizačním uzávěrem PFO neprokazovaly jasný prospěch žádného z těchto přístupů. V roce 2017 byly publikovány zásadní randomizované klinické studie, které prokazují benefit katetrizačního uzávěru PFO ve srovnání se samotnou farmakoterapií. V tomto souhrnném článku se věnujeme diagnostice pacientů s PFO po prodělané paradoxní embolizaci, indikacemi a výběru vhodného pacienta ke katetrizačnímu uzávěru PFO, vlastnímu zákroku a následnému klinickému sledování těchto nemocných.
Klíčová slova:
katetrizační uzávěr – kryptogenní cévní mozková příhoda – okludér – patentní foramen ovale
Úvod
Patentní foramen ovale je ve fetálním období důležitou spojkou mezi pravým a levým srdcem umožňující rychlý přechod placentou okysličené krve do systémové cirkulace. Po narození se vlivem změny tlakových poměrů přikládá septum primum k septum secundum a u 3/4 dětí dochází k uzavření foramen ovale. U cca 25–30 % populace zůstává celoživotně foramen ovale otevřené ve formě „chlopně“, převážně se projevující v době zvýšeného tlaku krve v pravé srdeční síni.
Souvislost PFO a kryptogenní cévní mozkové příhody
PFO je ve většině případů náhodným nálezem při vyšetření jícnovou echokardiografií (TEE) a je klinicky němé. Jako takové není PFO vzhledem k prevalenci řazeno mezi klasické srdeční vady. U přibližně 25 % ischemických cévních mozkových příhod (iCMP) není známa jejíich jasná příčina – hovoříme o tzv. kryptogenní iCMP (1). Možná souvislost přítomnosti PFO s kryptogenní iCMP byla pozorována v několika epidemiologických studiích. U mladších pacientů byla u kryptogenní iCMP prevalence PFO 48 % vs. 4 % u iCMP se známou příčinou (2).
Randomizované studie
Studie CLOSURE I srovnávala uzávěr PFO okludérem Starflex (NMT Medical) s konzervativní, tzn. antiagregační nebo antikoagulační léčbou, u pacientů s kryptogenní iCMP nebo tranzitorní ischemickou atakou (TIA) do 60 let věku (3). Ve studii PC Trial bylo 414 pacientů po kryptogenní CMP mladších 60 let randomizováno 1 : 1 k uzávěru PFO pomocí Amplatzer PFO okludéru (Abbott) PFO okludéru nebo farmakoterapii (4). Žádná z těchto studií neprokázala signifikantní snížení recidivy CMP/TIA nebo úmrtí. Negativní výsledky těchto studií mohly být způsobeny malou velikostí souboru, problémy s pomalým a selektovaným náborem pacientů, typem okludéru a zvoleným primárním cílem studie (zahrnujícím TIA a celkovou mortalitu).
Ve studii RESPECT bylo pak randomizováno 980 pacientů po předchozí kryptogenní iCMP s PFO k 1/ uzávěru PFO pomocí Amplatzerova okludéru nebo 2/ antiagregační nebo antikoagulační léčbě. První výsledky publikované v roce 2013 prokázaly statisticky nevýznamné snížení rizika recidivy CMP nebo úmrtí ve větvi intervenované v tzv. intention‑to‑treat analýze (5). Statisticky významný rozdíl ve prospěch uzávěru PFO byl pak nalezen v dlouhodobém klinickém sledování (medián 6 let). iCMP nebo úmrtí prodělalo 18 pacientů v intervenční skupině vs. 28 pacientů léčených pouze farmakoterapií (p = 0,046). Recidivující kryptogenní iCMP byla také významně méně častá u pacientů po uzávěru PFO (10 vs. 23 pacientů; p = 0,007) (6).
Do předchozích studií byli randomizováni pacienti s přítomným PFO bez další selekce, jejich subanalýzy však poukázaly na potenciálně rizikovou anatomii mezisíňového septa, kterým byly aneurysma anebo velký zkrat. Na základě těchto poznatků byla designována studie CLOSE, ve které byli v poměru 1 : 1 : 1 randomizováni pacienti (n = 663) po kryptogenní iCMP s PFO s přítomným aneurysmatem mezisíňové přepážky nebo velkým pravolevým zkratem k uzávěru PFO + antiagregační léčbě vs. samotné antiagregaci vs. antikoagulaci. Primárním cílem byl výskyt recidivy iCMP. Pacienti byli sledováni průměrně 5,3 roků a velmi významné snížení recidivy CMP bylo zjištěno ve skupině PFO + antiagregace oproti antiagregaci samotné (Hazard ratio – HR 0,03; p < 0,001). V této studii byly použity různé typy PFO okludérů. Fibrilace síní jako nežádoucí příhoda byla zjištěna u 4,6 % pacientů po uzávěru PFO vs. 0,9 % v antiagregační větvi (7).
Pozitivní efekt uzávěru PFO byl prokázán také ve studii REDUCE na 664 pacientech. Ve srovnání s antiagregační léčbou došlo ke snížení rizika recidivy iCMP o 77 % (p = 0,002). Výskyt fibrilace síní byl opět častější v intervenční skupině (6,6 % vs. 0,4 %), možnou příčinou je absence nutnosti provedení dlouhodobého EKG monitorování ve vstupních kritériích studie (8).
Ve studii DEFENSE PFO bylo randomizováno 120 pacientů po kryptogenní CMP a „rizikovým“ PFO (aneurysma septa síní, hypermobilní septum nebo větší PFO se separací septum primum a secundum ≥2 mm). Primární kombinovaný cíl studie (recidiva CMP, vaskulární úmrtí nebo významné krvácení) se během 2 let sledování vyskytl pouze ve skupině léčené farmakoterapií (12,9 % vs. 0 % u uzávěru PFO; p = 0,013). Recidiva samotné iCMP byla 10,5 % vs. 0 %; p = 0,023) (9).
Uzávěr PFO je spojen s nižším rizikem recidivy iCMP ve srovnání s antitrombotickou léčbou v meta‑analýze 6 studií zahrnující i další nepublikovaná data studie CLOSE hodnotící celkem 3 650 pacientů (relativní riziko – RR 0,36) (10).
V současné době tedy výsledky randomizovaných studií a výše uvedené metaanalýzy prokazují lepší klinické výsledky katétrového uzávěru PFO oproti samotné farmakoterapii na výskyt recidiv iCMP. Vždy se jedná o pacienty po předchozí kryptogenní iCMP. Z výše uvedených studií je možné také poukázat na rizikovou anatomii mezisíňového septa spojenou s jeho aneurysmatem nebo větším zkratem. V roce 2018 se evropské společnosti zabývající se problematikou patentního foramen ovale a paradoxní embolizace shodly na základě doposud známých klinických studií a dalších dostupných poznatků na organizaci péče o pacienty s PFO (11).
Výběr pacientů k uzávěru PFO
Indikací k uzávěru PFO je předpokládaná předchozí paradoxní embolizace (nejčastěji trombu) z žilního systému přes PFO do systémového řečiště. Embolizace může být klinicky němá nebo se projevuje symptomy a příznaky ischemie, nejčastěji ve formě ischemické cévní mozkové příhody. Trombus však může embolizovat i do dalších orgánů nebo tepen horních či dolních končetin a způsobovat akutní infarkt myokardu, akutní ischemii a nekrózu ve splanchnickém řečišti, embolii a. oftalmica, akutní končetinovou ischemii a jiné. Indikace k uzávěru PFO je tedy sekundárně – preventivní, a to až po vyloučení jiné příčiny ischemické příhody. Při rizikové stratifikaci bychom si měli všímat klinických symptomů, anatomických charakteristik přidružených k PFO a typických nálezů na zobrazovacích metodách. U každého pacienta musíme zhodnotit individuálně pravděpodobnost PFO jako možného klíčového faktoru pro klinickou symptomatologii a pravděpodobnost recidivy paradoxní embolizace (11). Po celkovém zhodnocení indikujeme pacienta k případnému uzávěru PFO při vysoce pravděpodobné souvislosti s proběhlou systémovou embolizací. V případě iCMP je PFO zodpovědné za přibližně 5 % všech iCMP, resp. 10 % iCMP u pacientů v mladším a ve středním věku (≤ 55 let). V těchto případech se nově využívá termín „PFO‑asociovaná CMP“ (12).
Diagnostika PFO
Zlatým standardem pro diagnostiku PFO je transezofageální kontrastní echokardiografie (TEE) (Obr. 1, 2), která poskytuje poměrně přesné informace o eventuální přítomnosti funkčního pravo‑levého zkratu a srdeční morfologii, a to včetně vyloučení přítomnosti jiného zdroje embolizací. Senzitivita kontrastní TEE v průkazu PFO je pouze 89 % (ve srovnání s nálezy při autopsii, srdečních operacích nebo srdeční katetrizaci), hlavní příčinou nižší senzitivity je pravděpodobně neschopnost pacienta provést správný Valsalvův manévr při zavedené jícnové sondě (11). Již pomocí barevného doplerovského vyšetření (Obr. 3) je někdy možné zaznamenat tok přes PFO, zásadní však je vizualizace zkratu pomocí podání echokontrastu při správně provedeném Valsalvově manévru (Obr. 4). Pro potvrzení PFO svědčí přestup echokontrastu z pravé do levé síně časně – nejpozději v prvních 3–6 srdečních stazích. V případě pozdější detekce bublin se často jedná o intrapulmonální zkrat, kde se bublinky kontrastu objevují nejprve v místě vyústění plicních žil. Ačkoliv je echokardiografická detekce poměrně velmi přesná, definitivní průkaz přítomnosti PFO musí být verifikován srdeční katetrizací. U části pacientů s PFO je detekováno aneurysma mezisíňové přepážky (Obr. 5), které je definováno jako vychýlení přepážky do pravé nebo levé síně o 10 mm nebo 15 mm oboustranně a zajímá nás dále i přítomnost Eustachovy chlopně nebo Chiariho síťky v pravé síni, tloušťka septum primum a septum secundum (13). Během echokardiografického vyšetření můžeme měřit šířku a délku PFO kanálu nativně nebo při Valsalvově manévru (Obr. 6, 7). Pro detekci pravo‑levého zkratu můžeme použít i neinvazivní, transkraniální doplerovské vyšetření (TCD) s podáním kontrastní látky do kubitální žíly a detekcí zkratu po Valsalvově manévru. Toto vyšetření má ve srovnání s TEE vysokou senzitivitu (94 %) i specificitu (92 %). TCD nemůže odlišit zkrat přes defekt mezisíňového septa nebo intrapulmonální zkraty. Algoritmus pro diagnostiku PFO s použitím jednotlivých metod (TTE, TCD, resp. TEE) za účelem minimalizace falešně negativního nálezu je znázorněn na schématu 1 (11).
Obr. 1. Patentní foramen ovale – TEE 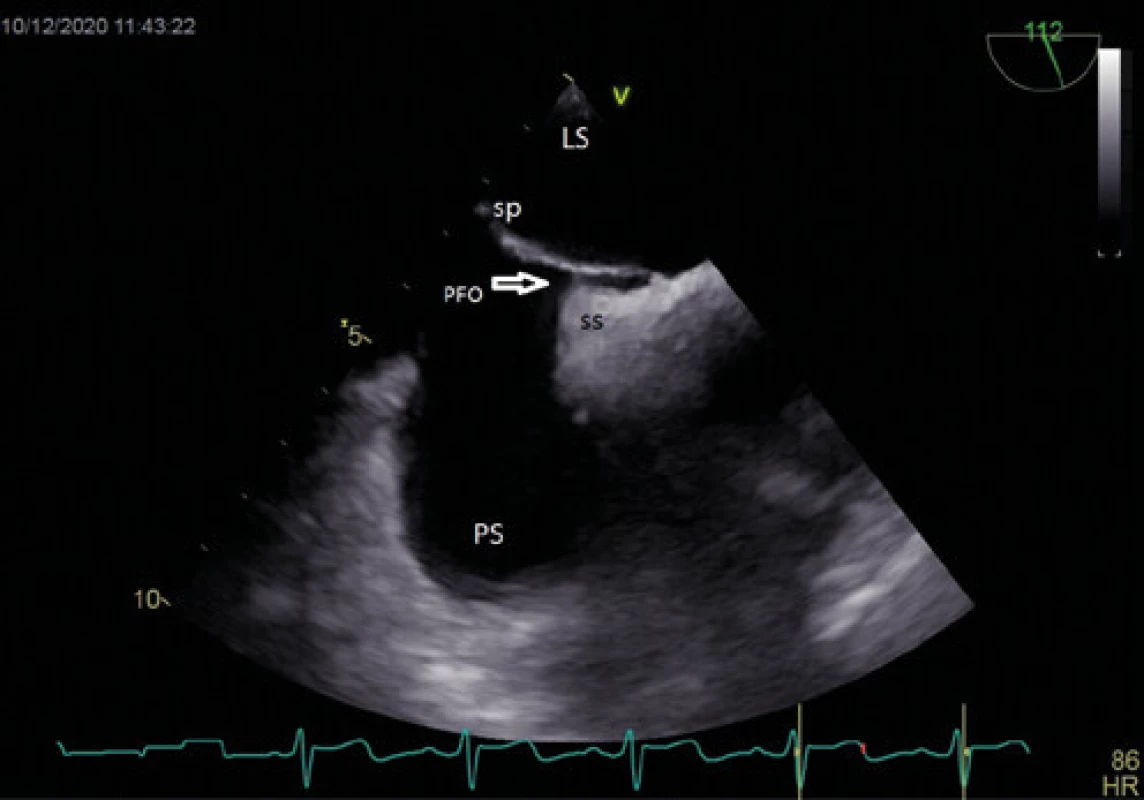
Vysvětlivky: LS – levá síň, PS – pravá síň, PFO – patentní foramen ovale (šipka), sp – septum primum, ss – septum secundum Obr. 2. Patentní foramen ovale se zavedením vodičem (3D jícnová echokardiografie) 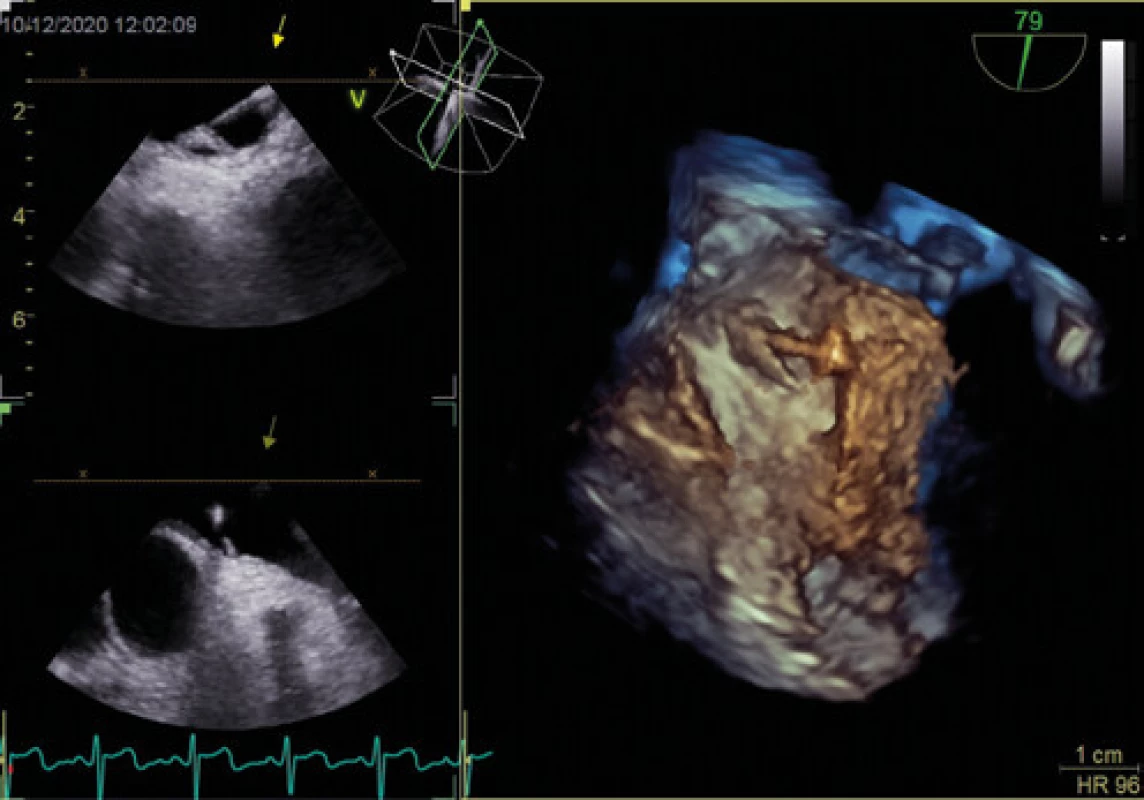
Obr. 3. Patentní foramen ovale – zkrat dle barevného dopplerovského echo vyšetření (ICE – intrakardiální echokardiografie) 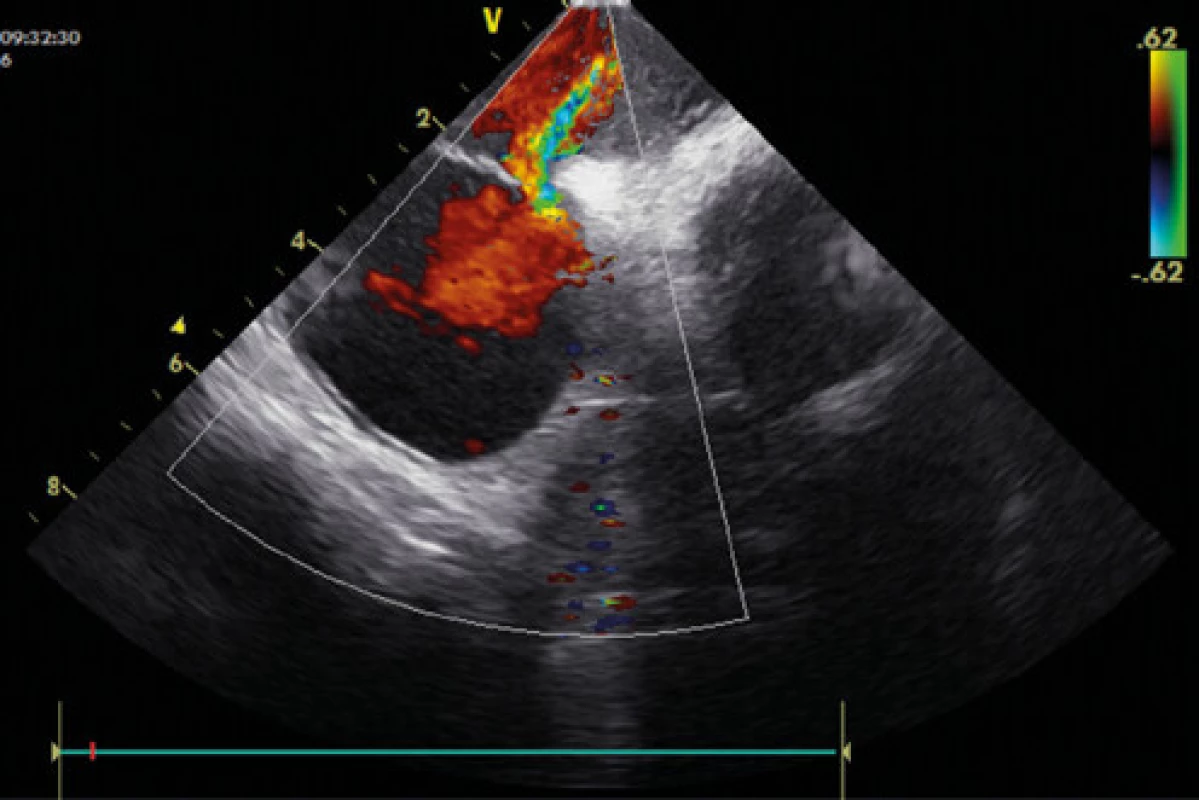
Obr. 4. Průnik mikrobublin přes PFO – významný zkrat – TEE 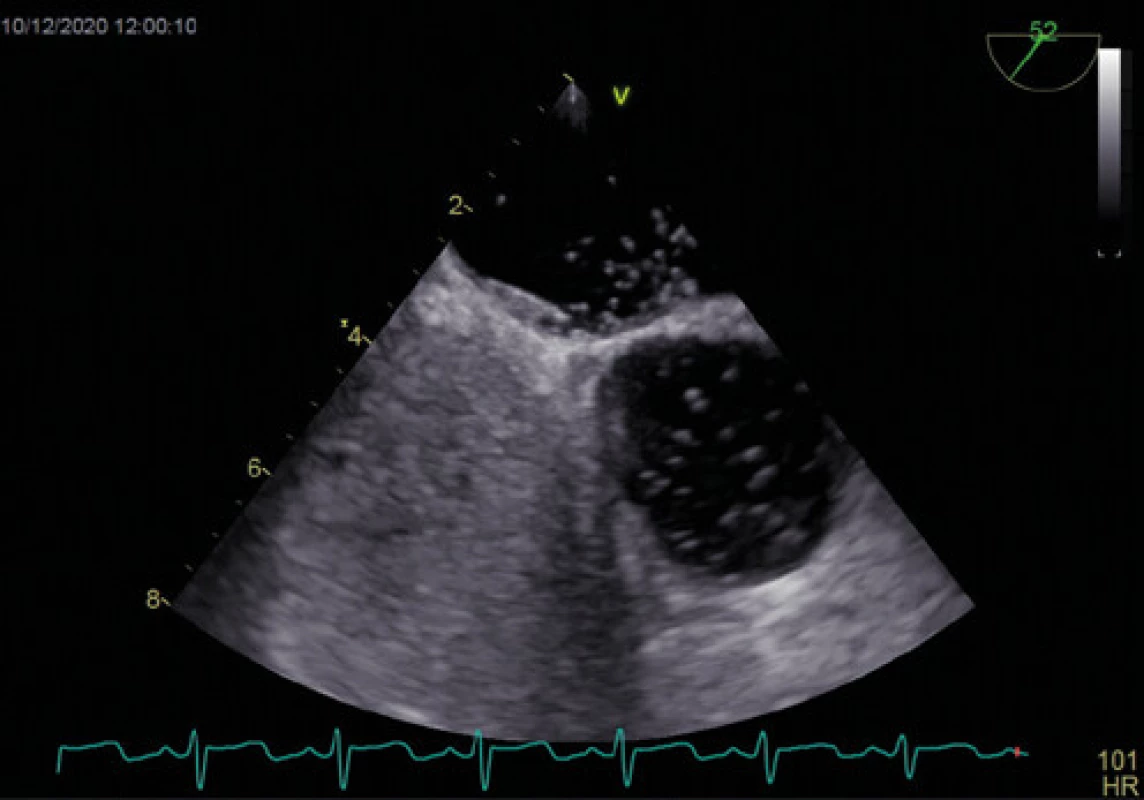
Obr. 5. Aneurysma mezisíňové přepážky – TEE 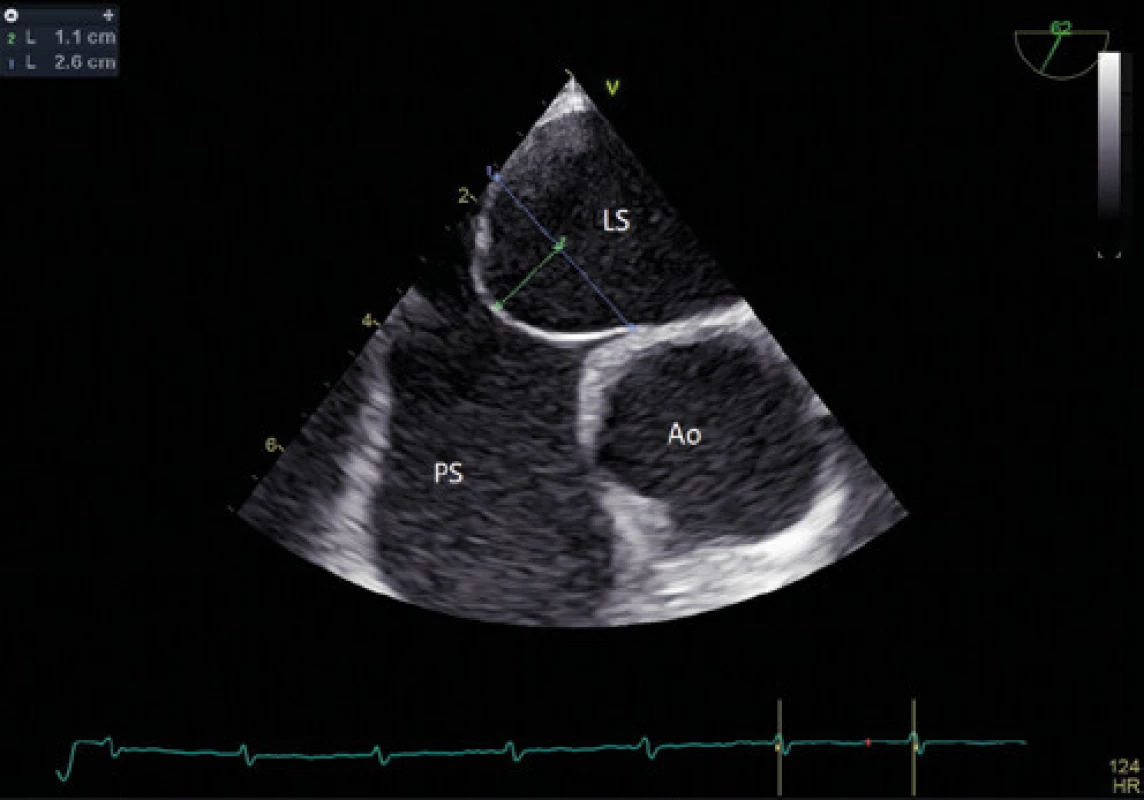
Obr. 6. Délka a šířka kanálu PFO při normální ventilaci – TEE 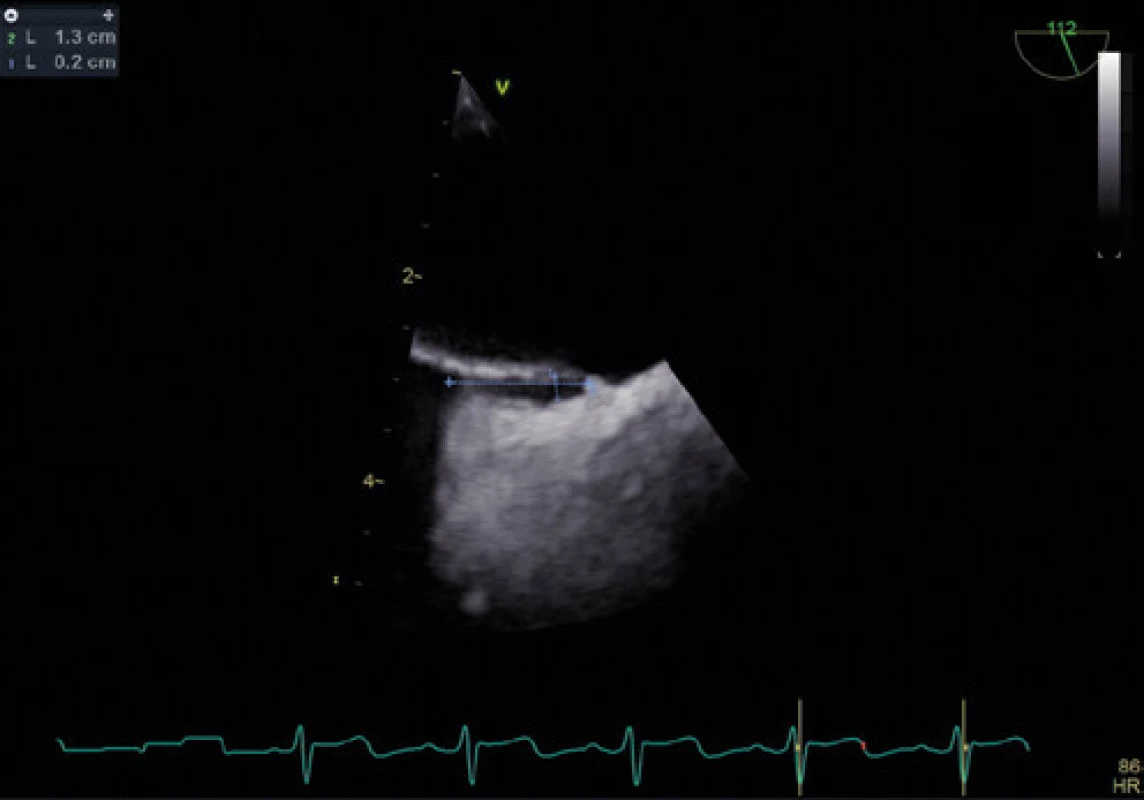
Obr. 7. Šířka kanálu PFO při Valsalvově manévru – TEE 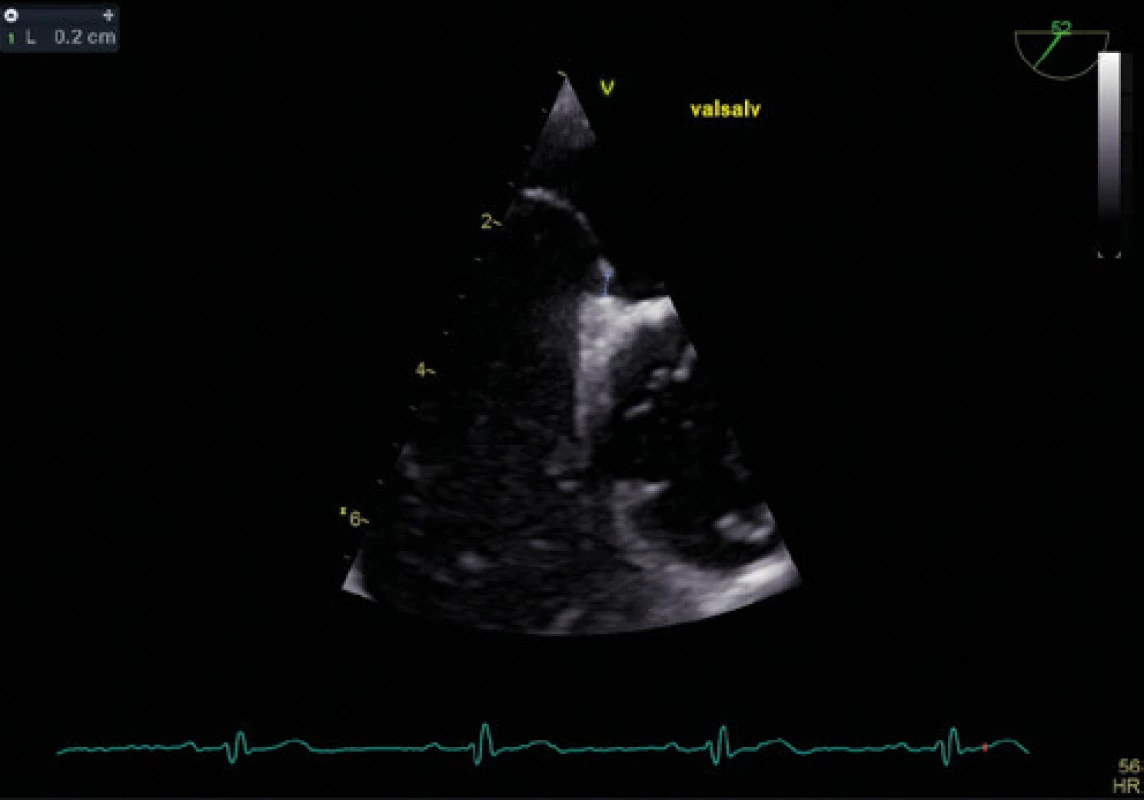
Obr. 8. Amplatzerův PFO okludér (Abbott) – RTG zobrazení 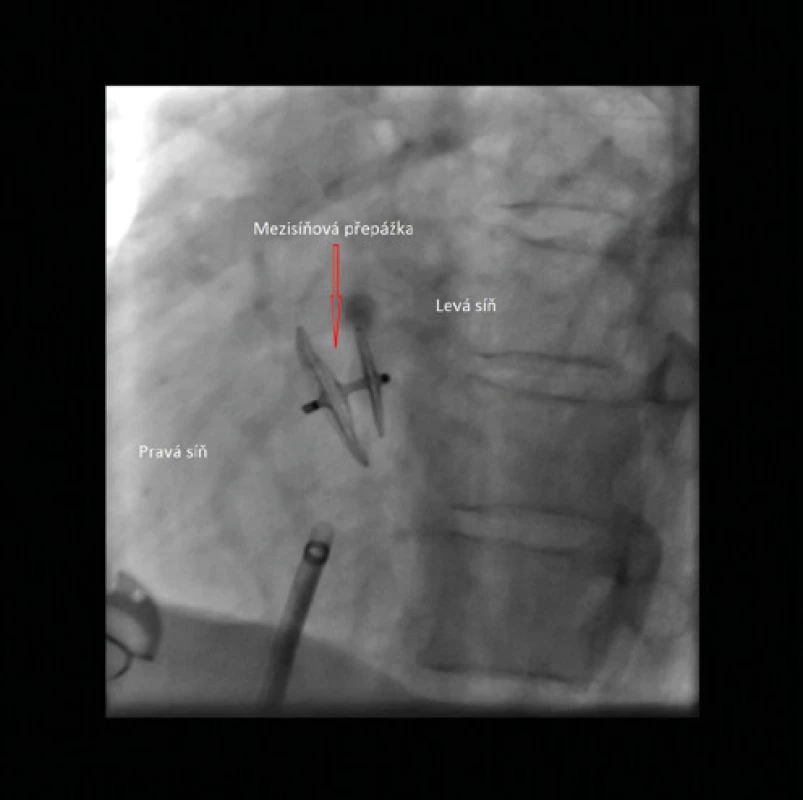
Schéma 1. Algoritmus pro diagnostiku PFO (upraveno dle 11) 
c-TTE – kontrastní transtorakální echokardiografie; c-TCD – kontrastní transkraniální Doppler; c-TEE – kontrastní transezofageální echokardiografie; + pozitivní test pro průkaz PL zkratu; – negativní test pro průkaz PL zkratu Odhad souvislosti PFO s iCMP
Při odhadu PFO‑asociované iCMP vycházíme z několika parametrů. Mladší pacienti mají větší pravděpodobnost, že přítomné PFO má přímou souvislost s prodělanou iCMP. Ve velkých klinických studiích byl většinou vstupním kritériem věk 18–60 let, s průměrem 43–51 let (7, 9). Vyšetřením pomocí CT nebo magnetické rezonance hodnotíme lokalizaci, velikost a četnost ischemických ložisek v mozku, kdy kortikální lokalizace je dávána častěji do souvislosti s možnou kardioembolizační příhodou.
Pacienti, kteří současně s iCMP mají průkaz hluboké žilní trombózy nebo plicní embolie, by měli podstoupit TEE, jelikož při průkazu PFO je velká pravděpodobnost předchozí paradoxní embolizace jako příčina iCMP (14). V souvislosti s možnou paradoxní embolizací hodnotíme i rizikové faktory pro vznik trombembolie, jako je imobilizace (dlouhé sezení – zaoceánské lety), pravděpodobnost dehydratace, anamnéza tromboembolie, trombofilní stavy.
Pacienti s přítomným aneurysmatem mezisíňové přepážky, mobilním septem nebo velkým zkratem (průnik 20 mikrobublin a více při TEE vyšetření) měli v klinických studiích větší benefit z uzávěru PFO než pacienti, u kterých tyto anatomické známky nebyly přítomny (7, 9). Přítomnost Eustachovy chlopně a Chiariho síťky v pravé síní navádí tok krve z dolní duté žíly směrem k PFO a může podpořit diagnózu paradoxní embolizace.
Nástrojem pro zhodnocení možné souvislosti kryptogenní mozkové příhody je tzv. RoPE skore (Risk of Paradoxical Embolization) (Tab. 1 a graf 1). Jedním bodem jsou hodnoceny nepřítomnost hypertenze, diabetu, kouření a jiné TIA/CMP v anamnéze, přítomnost kortikálního infarktu a dále je hodnocen věk – do 18–29 let 5 body, poté na každých 10 let o jeden bod méně. Vyšší celkové RoPE skóre předpovídá větší pravděpodobnost proběhlé PFO‑asociované CMP (88 % u skóre ≥9), ale menší riziko opakování CMP (20 % vs. 2 % u skóre ≤ 3 vs. ≥9), zjednodušeně řečeno mladší a doposud zdraví pacienti mají vysokou pravděpodobnost, že proběhlá příhoda je v souvislosti s PFO a jsou tedy indikováni k jeho uzávěru, ale riziko časné recidivy je u nich velmi nízké (15, 16). Zhodnocení RoPE skóre je velmi jednoduché, diagnostický přínos má však své limitace.
Vždy je však nutné myslet na to, že nejčastější příčinou iCMP, kterou musíme vyloučit, je ateroskleróza velkých tepen s nasedající trombózou. Pro průkaz stenózy, ev. aterosklerotického plátu provádíme CT angiografii mozkových tepen a duplexní sonografii. Ateroskleróza mozkových tepen je častější ve vyšším věku, mladší věk však nevylučuje tuto příčinu, zvláště pokud zjistíme přítomnost hemodynamicky nevýznamných stenóz magistrálních mozkových tepen (diametr stenózy < 50 %).
Souvislost s PFO je nepravděpodobná v případě nálezu lakunárních mozkových infarktů (malé subkortikální ischemické léze), anamnéza hypertenze, diabetes mellitus a mikroalbuminurie (17).
S vyšším věkem a proběhlou cévní mozkovou příhodou je spojena také diagnóza různých forem fibrilace síní (paroxysmální, perzistující nebo permanentní). Screening fibrilace síní po kryptogenní iCMP začíná již v nemocnici při kontinuální monitoraci EKG, následně je po propuštění doporučeno provedení 24hodinového Holterovského EKG monitorování a minimálně 2–3týdenní nasazení epizodního EKG záznamníku. Ještě přísnější monitorace – implantace smyčkového epizodního záznamníku – je doporučena u pacientů nad 65 let nebo s přítomnými rizikovými faktory pro fibrilaci síní (diabetes mellitus, hypertenze, srdeční selhání, onemocnění štítné žlázy aj. – viz schéma 2) (11). Ve studii CRYSTAL AF byli sledováni pacienti s kryptogenní iCMP a implantabilním smyčkovým záznamníkem EKG. Během 3 let se fibrilace síní objevila u 19 % pacientů, nejsilnější asociace byla s vyšším věkem (nad 60 let) (18).
Schéma 2. Algoritmus pro diagnostiku fibrilace síní (upraveno dle 11) 
FS – fibrilace síní; LS – levá síň; LK – levá komora; SVT – supraventrikulární tachykardie; ILR – implantabilní smyčkový záznamník EKG; CMP – cévní mozková příhoda Technické provedení uzávěru PFO
Amplatzerův PFO okludér byl uveden do praxe v roce 1997 (19, 20). Tento okludér tvoří 2 disky pletené z drátků nitinolu (slitiny nikl‑titan) kryté membránou z polyethylenu (Dacron). Disky jsou spojeny tenkým krčkem. Většina dalších typů PFO okludérů je konstruována na obdobném principu a jejich výhodou je schopnost samocentrování (Obr. 8, 9, 10).
Obr. 9. Cardia PFO okludér (Ultrasept) – RTG zobrazení 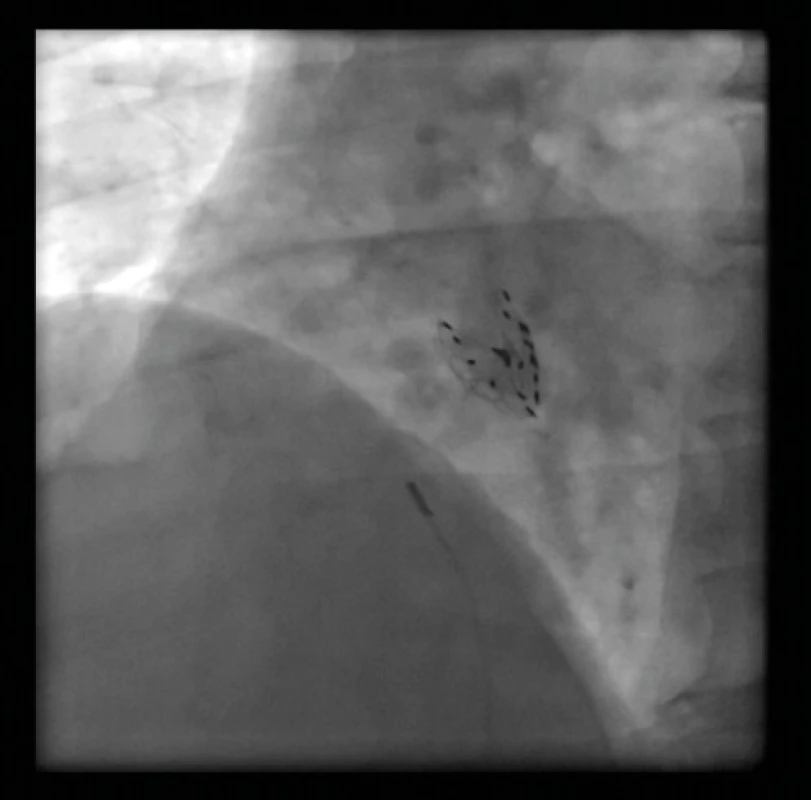
Obr. 10. Figulla PFO okludér (Occlutech) – RTG zobrazení 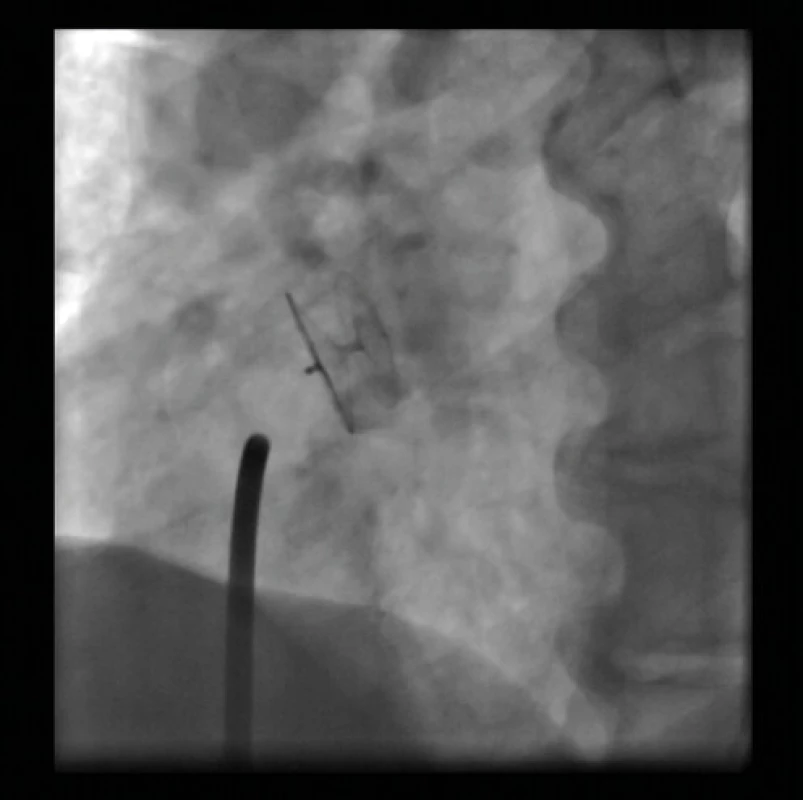
Vlastní výkon je relativně jednoduchý a je možné ho provést v lokální anestezii. Přístupovou cestou je v. femoralis communis, kdy za nejbezpečnější považujeme punkci pod ultrazvukovou kontrolou. Výkon je prováděn na katetrizačním sále pod rentgenovou kontrolou, která je v případě potřeby doplněna o kontrolu pomocí TEE nebo intrakardiální echokardiografie (ICE). V případě TEE se využívá pro snížení dyskomfortu celková anestezie nebo, tak jako na pracovišti autorů, analgosedace. Zvláště u PFO s jednoduchou anatomií je nejjednodušším provedení uzávěru pouze pod skiaskopickou kontrolou s použitím kontrastní látky, tento způsob je stejně bezpečný a efektivní jako uzávěr s echokontrolou (21, 22). Po punkci femorální žíly následuje zavedení krátkého femorálního sheathu a dlouhého vodícího drátu do pravé síně. Poté procházíme vodičem, ev. samotným katétrem do levé síně a dále do plicní žíly. Následně je tenký katétr nahrazen dlouhým 8–11 F sheathem, procházejícím přes PFO. Tímto katétrem je okludér tlačen na konec sheathu, poté pod skiaskopickou a ev. TEE/ICE kontrolou v levé síni rozvinut jeho levostranný disk. Zatažením celého instrumentária dosáhne levosíňový disk mezisíňové přepážky, poté je vysunut pravostranný disk v pravé síni. Kontrola správného uložení je provedena dle skiaskopie, disky na levé straně jsou více vzdáleny než vpravo (je to dáno nalehnutím na širší septum secundum) (Obr. 9). Před odpoutáním je proveden manévr stability (tzv. Minnesota manévr) zatlačením a zataháním za okludér umístěným přes PFO. Správná pozice je kontrolována pomocí zobrazovacích metod (Obr. 11, 12). V případě pouhé skiaskopické kontroly podáme cca 20ml kontrastní látky do pravé síně a ověřujeme správné uložení na mezisíňové přepážce. Následně je okludér odpoután od zaváděcího kabelu. Po vytažení dlouhého sheathu je komprimováno místo vpichu v poloze vleže na zádech. Před propuštěním je provedena kontrola TTE (kontrola uložení okludéru a perikardu). Od následujícího dne je pacient zcela bez omezení. V České republice jsou nejčastěji používanými PFO okludéry Amplatzerův okludér (Abbott), Figulla flex PFO okludér (Occlutech), resp. Cardia PFO okludér (Ultrasept). Okludéry jsou svým tvarem velmi podobné, jsou tvořeny dvěma kruhovými disky spojenými tenkým krčkem. Liší se typem uchycení okludéru k zaváděcímu systému. Krátkodobá i dlouhodobá rizika spojená s jednotlivými typy okludérů jsou podobná, z krátkodobých je nutno zmínit možnost vzniku paroxysmální fibrilace síní, z dlouhodobého hlediska je možným velmi vzácným rizikem eroze aortální stěny.
Obr. 11. Implantovaný Amplatzerův okludér – jícnová echokardiografie 
Obr. 12. Implantovaný okludér před odpoutáním – intrakardiální echokardiografie 
Vysvětlivky : LS – levá síň, PS – pravá síň, Ao – aortální chlopeň Farmakoterapie před a po uzávěru PFO
Pacienti jsou po proběhlé kryptogenní iCMP léčeni většinou antiagregační léčbou kyselinou acetylsalicylovou v dávce 100 mg nebo clopidogrelem v dávce 75 mg. Výjimečně jsou pacienti antikoagulováni warfarinem, případně nízkomolekulárním heparinem. U mladých pacientů s PFO‑asociovanou iCMP a s nízkým rizikem recidivy iCMP je většinou dostačující léčba antiagregační. Pro individuální stanovení rizikovosti PFO je možné využít RoPE score (Tab. 1 a graf 1) (16). U starších pacientů je, i s ohledem na možnou souvislost s dalším onemocněním – hluboká žilní trombóza, zatím nediagnostikovaná fibrilace síní, během došetření před ev. uzávěrem PFO nutno zvážit léčbu antikoagulační.
Tab. 1. RoPE skóre (upraveno dle 16) 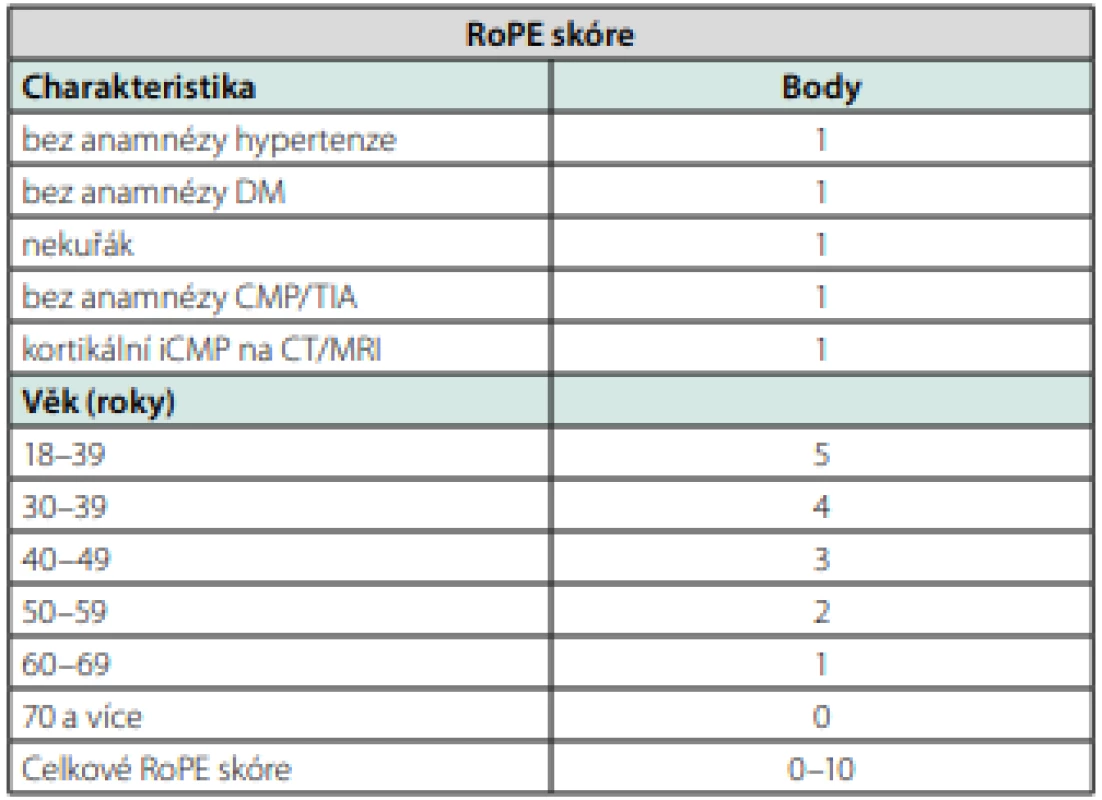
Graf 1. RoPE skóre – riziko souvislosti PFO a iCMP a pravděpodobnost recidivy iCMP (upraveno dle 16) 
Léčba po uzávěru PFO vychází převážně z designu velkých randomizovaných studií a běžné níže uvedené doporučení se týká pacientů bez závažných přidružených onemocnění.
Před uzávěrem PFO vysazujeme antikoagulaci (warfarin, LMWH), a to v případě, že není jiná indikace pro její podání, a podáváme duální antiagregaci kyselinou acetylsalicylovou 100 mg denně a clo ‑ pidogrelem 75 mg denně. Délka trvání duální antiagregační léčby je doporučována obvykle na dobu 1–6 měsíců po uzávěru PFO a její trvání je upraveno dle rizika recidivy iCMP nebo krvácivých komplikací u konkrétního pacienta. Na pracovišti autorů je zahájení této medikace doporučeno 3 dny před plánovaným uzávěrem PFO a u většiny pacientů pokračuje duální antiagregace po dobu 3 měsíců, poté je vysazen clopidogrel a dále je ponechána pouze kyselina acetylsalicylová. Individuální nastavení antitrombotické léčby je nutné u pacientů se závažnými přidruženými onemocněními, jako jsou tromboembolická nemoc nebo ischemická choroba srdce aj. V případě, že pacient vyžaduje antikoagulační léčbu, není přidání antiagregační léčby indikováno.
Po dobu 6 měsíců po výkonu je také indikována antibiotická profylaxe při provádění invazivních výkonů nebo operačních zákroků.
Sledování pacientů po implantaci PFO okludéru
Pacienti po implantaci okludéru jsou dále sledováni na sektorové kardiologii minimálně 1× ročně. Za 6 měsíců po implantaci je indikováno provedení kontrastní TTE k průkazu, ev. reziduálního zkratu, při jeho potvrzení doplníme TEE k posouzení jeho významnosti. Kompletní uzávěr je prokázán v 93–96 % případů, v případě nevýznamného reziduálního zkratu postupujeme konzervativně, nebylo prokázáno zvýšené riziko recidivy iCMP (23). U větších reziduálních zkratů je nutno zvážit implantaci dalšího okludéru.
Vyšetření pacientů po implantaci PFO okludéru magnetickou rezonancí
Doporučení a rizika k vyšetření magnetickou rezonancí (MRI) vycházejí v ČR z metodického pokynu Radiologické společnosti. Materiál okludérů je téměř výhradně nikl‑titanová sloučenina, nitinol. Do 6 týd ‑ nů od implantace okludéru je vyšetření MRI relativně nebezpečné do magnetického pole 3 T, a vyšetření MRI je relativní kontraindikací. Po 6 týdnech je již vyšetření pomocí MRI považováno za bezpečné (24).
Shrnutí
U pacientů s předchozí kryptogenní mozkovou příhodou prokázaly výsledky randomizovaných klinických studií méně recidiv iCMP po uzávěru PFO oproti antiagregační léčbě. V klinické praxi je třeba velmi pečlivě zhod ‑ notit možnou souvislost PFO s proběhlou CMP (PFO‑asociovanou CMP) či jinou paradoxní embolizací. Pokud je pravděpodobnost vysoká, indikujeme u těchto pacientů uzávěr PFO v sekundární prevenci paradoxní embolizace. Každá indikace vychází ze zhodnocení anamnestických, klinických, laboratorních a zobrazovacích metod a měla by probíhat interdisciplinárně.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Martin Poloczek,
Interní a kardiologická klinika FN Brno,
Jihlavská 20,
625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(1): 22–28
Článek přijat redakcí: 13. 12. 2020
Článek přijat po recenzích: 26. 1. 2021
Zdroje
1. Hart RG, Diener H‑C, Coutts SB et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014; 13(4): 429–438.
2. Di Tullio M, Sacco RL, Gopal A et al. Patent foramen ovale as a risk factor for cryptogenic stroke. Ann Intern Med. 1992;117(6): 461–465.
3. Furlan AJ, Reisman M, Massaro J et al. Closure or medical therapy for cryptogenic stroke with patent foramen ovale. N Engl J Med. 2012;366(11): 991–999.
4. Meier B, Kalesan B, Mattle HP et al. Percutaneous closure of patent foramen ovale in cryptogenic embolism. N Engl J Med. 2013;368(12): 1083–1091.
5. Carroll JD, Saver JL, Thaler DE et al. Closure of patent foramen ovale versus medical therapy after cryptogenic stroke. N Engl J Med. 2013; 368(12): 1092–1100.
6. Saver JL, Carroll JD, Thaler DE et al. Long‑Term Outcomes of Patent Foramen Ovale Closure or Medical Therapy after Stroke. N Engl J Med. 2017; 377(11): 1022–1032.
7. Mas J‑L, Derumeaux G, Guillon B et al. Patent Foramen Ovale Closure or Anticoagulati ‑ on vs. Antiplatelets after Stroke. N Engl J Med. 2017; 377(11): 1011–1021.
8. Søndergaard L, Kasner SE, Rhodes JF et al. Patent Foramen Ovale Closure or Antiplatelet Therapy for Cryptogenic Stroke. N Engl J Med. 2017; 377(11): 1033–1042.
9. Lee PH, Song J‑K, Kim JS et al. Cryptogenic Stroke and High‑Risk Patent Foramen Ova ‑ le. J Am Coll Cardiol. 2018; 71(20): 2335–2342.
10. Turc G, Calvet D, Guérin P et al. Closure, Anticoagulation, or Antiplatelet Therapy for Cryptogenic Stroke With Patent Foramen Ovale: Systematic Review of Randomized Trials, Sequential Meta‑Analysis, and New Insights From the CLOSE Study. J Am Heart Assoc Cardiovasc Cerebrovasc, DiS. J Am Heart Assoc. 2018; 7 : 1–12.
11. Pristipino C, Sievert H, D’Ascenzo F et al. European position paper on the management of patients with patent foramen ovale. General approach and left circulation thromboembolism. EuroIntervention J Eur Collab Work Group Interv Cardiol Eur Soc Cardiol. 2019;14(13): 1389–402.
12. Elgendy AY, Saver JL, Amin Z et al. Proposal for Updated Nomenclature and Classification of Potential Causative Mechanism in Patent Foramen Ovale‑Associated Stroke. JAMA Neurol. 2020; 77(7): 878–886.
13. Silvestry FE, Cohen MS, Armsby LB et al. Guidelines for the Echocardiographic Assessment of Atrial Septal Defect and Patent Foramen Ovale: From the American Society of Echocardiography and Society for Cardiac Angiography and Interventions. J Am Soc Echocardiogr Off Publ Am Soc Echocardiogr. 2015; 28(8): 910–958.
14. Le Moigne E, Timsit S, Ben Salem D et al. Patent Foramen Ovale and Ischemic Stroke in Patients With Pulmonary Embolism: A Prospective Cohort Study. Ann Intern Med. 2019; 170(11): 756–763.
15. Kent DM, Saver JL, Ruthazer R et al. Risk of Paradoxical Embolism (RoPE)-Estimated Attributable Fraction Correlates With the Benefit of Patent Foramen Ovale Closure: An Analysis of 3 Trials. Stroke. 2020; 51(10): 3119–3123.
16. Kent DM, Ruthazer R, Weimar C et al. An index to identify stroke‑related vs incidental patent foramen ovale in cryptogenic stroke. Neurology. 2013; 81(7): 619–625.
17. Safouris A, Kargiotis O, Psychogios K et al. A Narrative and Critical Review of Randomized ‑ ‑Controlled Clinical Trials on Patent Foramen Ovale Closure for Reducing the Risk of Stro ‑ ke Recurrence. Front Neurol. 2020; 11 : 434.
18. Thijs VN, Brachmann J, Morillo CA et al. Predictors for atrial fibrillation detection after cryptogenic stroke: Results from CRYSTAL AF. Neurology. 2016; 86(3): 261–269.
19. King TD, Thompson SL, Steiner C et al. Secundum atrial septal defect. Nonoperative closure during cardiac catheterization. JAMA. 1976; 235(23): 2506–2509.
20. Bridges ND, Hellenbrand W, Latson et al. Transcatheter closure of patent foramen ovale after presumed paradoxical embolism. Circulation. 1992; 86(6): 1902–1908.
21. Meier B. Patent foramen ovale and closure technique with the amplatzer occluder. Scientifica. 2014; 2014 : 129196.
22. Wahl A, Tai T, Praz F et al. Late results after percutaneous closure of patent foramen ovale for secondary prevention of paradoxical embolism using the amplatzer PFO occluder without intraprocedural echocardiography: effect of device size. JACC Cardiovasc Interv. 2009; 2(2): 116–123.
23. De Rosa S, Sievert H, Sabatino J et al. Percutaneous Closure Versus Medical Treatment in Stroke Patients With Patent Foramen Ovale: A Systematic Review and Meta‑analysis. Ann Intern Med. 2018; 168(5): 343–350.
24. Mechl M, Tintěra J, Žižka J et al. Kontraindikace a rizika vyšetření pomocí magnetické rezonance. Ces Radiol. 2010; 64(1): 69–75.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Internista a pacient po ischemické CMP
- Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
- Dlouhodobá EKG monitorace
- Patentní foramen ovale z pohledu intervenční kardiologie
- Následná péče po prodělaném covidu-19 a její úskalí
- Včasná a souběžná terapie dyslipidemie a hypertenze: kdy ji začít a jak udržet dlouhodobě dobrou adherenci pacientů?
- EMPEROR reduced – empagliflozin u nemocných se srdečním selháním se sníženou ejekční frakcí
- Kdy ukončit léčbu hepatitidy B?
- Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Diagnostické hospitalizácie pred zaradením pacienta na čakaciu listinu pre transplantáciu obličky
- Is autoimmune pancreatitis a risk factor for pancreatic adenocarcinoma?
- Komplexní interdisciplinární pohled na návrat ke sportu po prodělání infekce covid-19
- Úskalí řešení problémů polymedikace
- Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
- Horečka nejasného původu
- Nutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
- Kompetence pacienta a informovaný souhlas
- Prof. MUDr. Jiří Vítovec, CSc., FESC, má jubileum
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Horečka nejasného původu
- Dlouhodobá EKG monitorace
- Následná péče po prodělaném covidu-19 a její úskalí
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



