-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Horečka nejasného původu
Fever of unknown origin
Fever of unknown origin is a rare clinical syndrome, that represents a significant diagnostic challenge. There have been described more than 200 potential diseases, that can manifest as a fever of unknown origin. These are classically divided into following categories: infections, non-infectious inflammatory diseases, malignancies, and other miscellaneous disorders. Each of the disease type is associated with rather characteristic symptoms, clinical signs and laboratory findings, which are individually non-specific, but may provide helpful clues for a further focused diagnostic work-up. The clinician’s task is to be able to identify these hallmark clinical features and to correctly interpret their significance and limitations in the appropriate differential diagnostic context. The aim of this review is to provide up-to-date clinical research evidence and to propose a concise clue-oriented diagnostic approach.
Keywords:
diagnostic imaging – differential diagnosis – fever – granulomatous diseases – infections – inflammation – medical history taking – neoplasms – physical examination – rheumatic diseases
Autori: Vyacheslav Grebenyuk 1,2; Olga Kryštůfková 3; Monika Gregová 3; Magdalena Sokalská-Jurkiewicz 3; Renata Steinbauerová 4; Marie Sukovská 4; Lubica Gahérová 5; Ivana Zubatá 5; Jana Gregorová 6; Lucia Kaliská 7; Hana Roháčová 2; Milan Trojánek 1,2,8
Pôsobisko autorov: Klinika infekčních nemocí, 2. lékařská fakulta, Univerzita Karlova, Praha 1; Klinika infekčních, parazitárních a tropických nemocí, Fakultní nemocnice Bulovka, Praha 2; Revmatologický ústav, Praha 3; Oddělení klinické hematologie, Fakultní nemocnice Bulovka, Praha 4; Interní hematologická klinika, 3. lékařská fakulta a Fakultní nemocnice Královské Vinohrady, Praha 5; Oddělení klinické farmacie, Praha 6; Oddělení nukleární medicíny, Proton Therapy Center Czech, Praha 7; Katedra infekčního lékařství, IPVZ, Praha 8
Vyšlo v časopise: Vnitř Lék 2021; 67(1): 32-42
Kategória:
Súhrn
Horečka nejasného původu představuje vzácný klinický syndrom, avšak stanovení jeho etiologické diagnózy bývá relativně obtížné. Dosud bylo popsáno více než 200 různých příčin horečky nejasného původu, které náleží do těchto hlavních kategorií: infekční, neinfekční zánětlivá, hemato‑onkologická, nádorová či interní onemocnění. Jednotlivé skupiny onemocnění bývají doprovázeny charakteristickými soubory tzv. „malých“ symptomů a klinických nebo laboratorních nálezů, které samy o sobě jsou poměrně nespecifické, avšak představují pomocná diagnostická vodítka pro celý vyšetřovací proces. Úkolem klinika je především odhalit tyto záchytné body, správně interpretovat jejich význam či limitace a zařadit je do širších diferenciálně diagnostických souvislostí. Cílem přehledového sdělení je seznámit odbornou veřejnost se současnými vědeckými poznatky o horečce nejasného původu a navrhnout přehledný diagnostický postup odpovídající principům medicíny založené na důkazech.
Klíčová slova:
diferenciální diagnostika – fyzikální vyšetření – granulomatózní onemocnění – horečka – infekce – nádorová one‑ mocnění – odběr anamnézy – revmatologická onemocnění – zánět – zobrazovací metody
Kdo má uši, slyš.“ – Matouš 11, 15
Úvod
Horečka představuje častý příznak infekčních onemocnění, avšak může doprovázet i celou řadu neinfekčních chorob včetně imunopatologických stavů, hematologických či onkologických onemocnění. Přestože většina případů horečnatých onemocnění nečiní diagnostické obtíže, může přetrvávající febrilní stav nejasné etiologie představovat značnou diagnostickou výzvu. Diagnózu se mnohdy podaří správně stanovit pouze za cenu náročného a ekonomicky nákladného vyšetřovacího procesu se zapojením pracovišť různých odborností (1, 2).
Termín horečka nejasného původu (FUO, z anglického „fever of unknown origin“) bývá mnohdy užíván nevhodně pro označení stavů, kdy pacient přichází pro horečnaté onemocnění bez jiných symptomů a orgánově specifických klinických či laboratorních nálezů. K objasnění většiny těchto stavů však zpravidla postačuje krátkodobá hospitalizace či podrobnější ambulantní vyšetření (3).
První definice horečky nejasného původu byla navržena Beesonem a Petersdorfem v roce 1961: horečka trvající déle než 3 týdny, teplota opakovaně vyšší než 38,3 °C, přičemž diagnózu se nepodaří stanovit do 7 dnů vyšetřování za hospitalizace (4). Pozdější definice syndromu z devadesátých let již reflektují možnost provádět řadu vyšetření ambulantně i značně odlišné spektrum onemocnění u jedinců s poruchou imunity či u hospitalizovaných pacientů (5, 6). Současná definice FUO tak zahrnuje tři kritéria: 1) trvání onemocnění déle než 3 týdny; 2) opakovaně naměřená teplota ≥ 38,3 °C; 3) diagnóza není stanovená v průběhu třídenní hospitalizace či po třech ambulantních návštěvách. Navíc bylo zavedeno rozdělení horečky nejasné etiologie na čtyři samostatné kategorie: klasická FUO, FUO asociovaná se zdravotní péčí, FUO u HIV -pozitivních jedinců a FUO spojená s neutropenií (5).
Mezi nejčastější příčiny horečky nejasného původu patří infekční, revmatologická, hematologická, onkologická a vybraná interní onemocnění (4). Ostatní případy bývají vyvolány buď vzácnými chorobami, jež nespadají do žádné z výše uvedených kategorií, nebo zůstávají trvale bez kauzální diagnózy (nediagnostikované FUO) (1, 3, 8). Zastoupení etiologie FUO se rovněž liší v různých studiích. V souvislosti se zlepšením dostupnosti a rozšíření spektra laboratorních a zobrazovacích vyšetření došlo k poklesu podílu infekčních a nádorových onemocnění, avšak naopak se zvyšuje zastoupení revmatologických onemocnění a případů bez určené diagnózy (1, 4, 8, 9).
Přestože většina případů horeček neznámého původu není vyvolána infekcemi, jsou tito pacienti často předáváni do péče infektologů, neboť horečka či elevace zánětlivých parametrů bývají odbornou veřejností často asociovány právě s infekčním procesem. Cílem tohoto sdělení je seznámit odbornou veřejnost s problematikou, která vyžaduje široké diferenciálně diagnostické uvažování a kvalitní mezioborovou spolupráci.
Přehledové sdělení
První definice syndromu horečky neznámého původu byla navržena Petersdorfem a Beesonem v roce 1961 na základě prospektivního sledování 100 hospitalizovaných pacientů. Stanovením hranice 38,3 °C vyřazuje tato definice jedince s habituálně zvýšenou teplotou tělesného jádra v rámci interindividuální variability či diurnálního kolísání teploty. Požadavek na dobu trvání delší než 3 týdny eliminuje běžné virové infekce se spontánním ústupem, jejichž etiologii bývá obtížné prokázat. Pozdější modifikace kritérií podle Duracka a Streeta (1991) zohledňuje možnost ambulantního vyšetřovacího postupu. Kromě tzv. „klasické“ FUO byly rovněž zavedeny tři nové kategorie: nozokomiální FUO, neutropenická FUO a FUO asociovaná s HIV infekcí (6). V současné době řada zdrojů doporučuje užití přesnější „kvalitativní“ definice (Tab. 1) (3, 11–13).
Tab. 1. Definice horečky nejasné etiologie 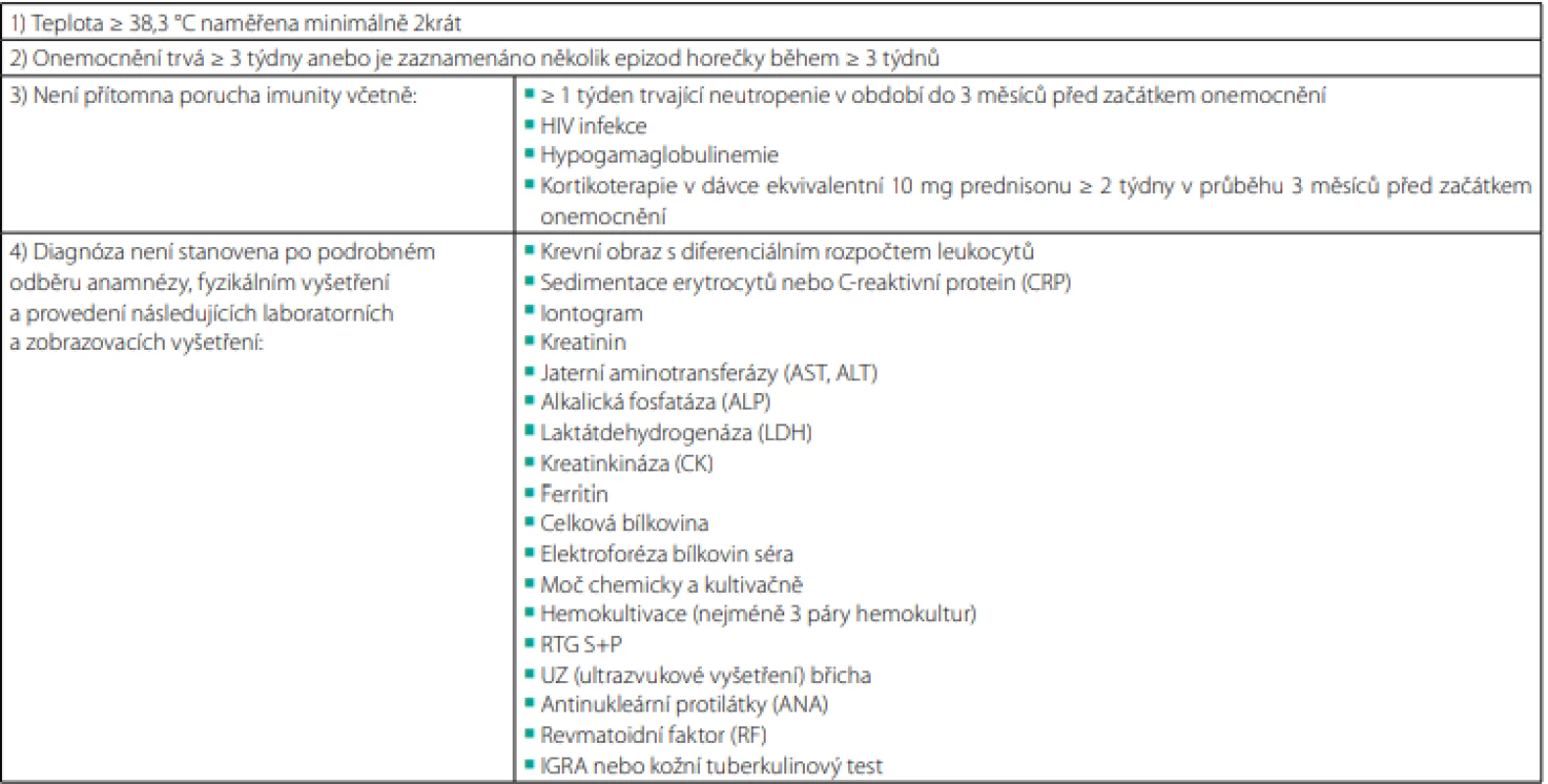
Zpracováno autory podle (3, 14) Etiologie
Většina případů horečky nejasného původu je obvykle vyvolána běžným onemocněním s méně obvyklým či atypickým průběhem než skutečně vzácnou chorobou (12). Mezi nejčastější příčiny FUO patří:
- Infekční onemocnění (16–37 %) (36 %)
- Neinfekční zánětlivá onemocnění (12–33 %) (13 %)
- Hemato -onkologická a nádorová onemocnění (3–28 %) (19 %)
- Ostatní (0–15 %) (25 %)
- Nediagnostikované (19–51 %) (7 %)
Zastoupení jednotlivých skupin se v různých studiích odlišuje. Data uvedená v kulatých závorkách pocházejí ze souborů z rozvinutých zemí publikovaných v posledních letech, zatímco údaje v hranatých závorkách přestavují data z původního souboru Petersdorfa a Beesona (4, 7). Podíl FUO, jež zůstávají bez diagnózy, dosahuje v některých souborech až 51 % (3).
Charakteristiky nejčastějších etiologických jednotek
Infekční onemocnění
Mezi nejčastější infekční příčiny horečky nejasného původu patří infekční endokarditida, infekce páteře, kostí a kloubů, močových či žlučových cest, cizích těles, ostatní nitrobřišní infekce či infekce doprovázené tvorbou abscesových ložisek (3, 14). V menší míře bývají zastoupeny nákazy vyvolané intracelulárními či atypickými agens, které je obtížné nebo zcela nemožné prokázat pomocí běžných kultivačních vyšetření (Bartonella, Coxiella, Chlamydia, Tropheryma whipplei). U pacientů s rizikovou epidemiologickou anamnézou je nutno zvážit leptospirózu, tularémii či psittakózu. Jako FUO se může prezentovat i syndrom infekční mononukleózy, přičemž v tomto kontextu mezi nejdůležitější původce patří HIV (akutní retrovirový syndrom), akutní CMV infekce či toxoplazmóza. U cestovatelů po návratu z tropů je navíc nutno zvažovat malárii, břišní tyfus a paratyfy, návratný tyfus, rickettsiózy, brucelózu, endemické mykózy, viscerální leishmaniózu či amébový jaterní absces (15). Podrobnější přehled nejčastějších infekčních příčin FUO uvádí tabulka 2.
Tab. 2. Nejčastější infekční příčiny horečky nejasného původu 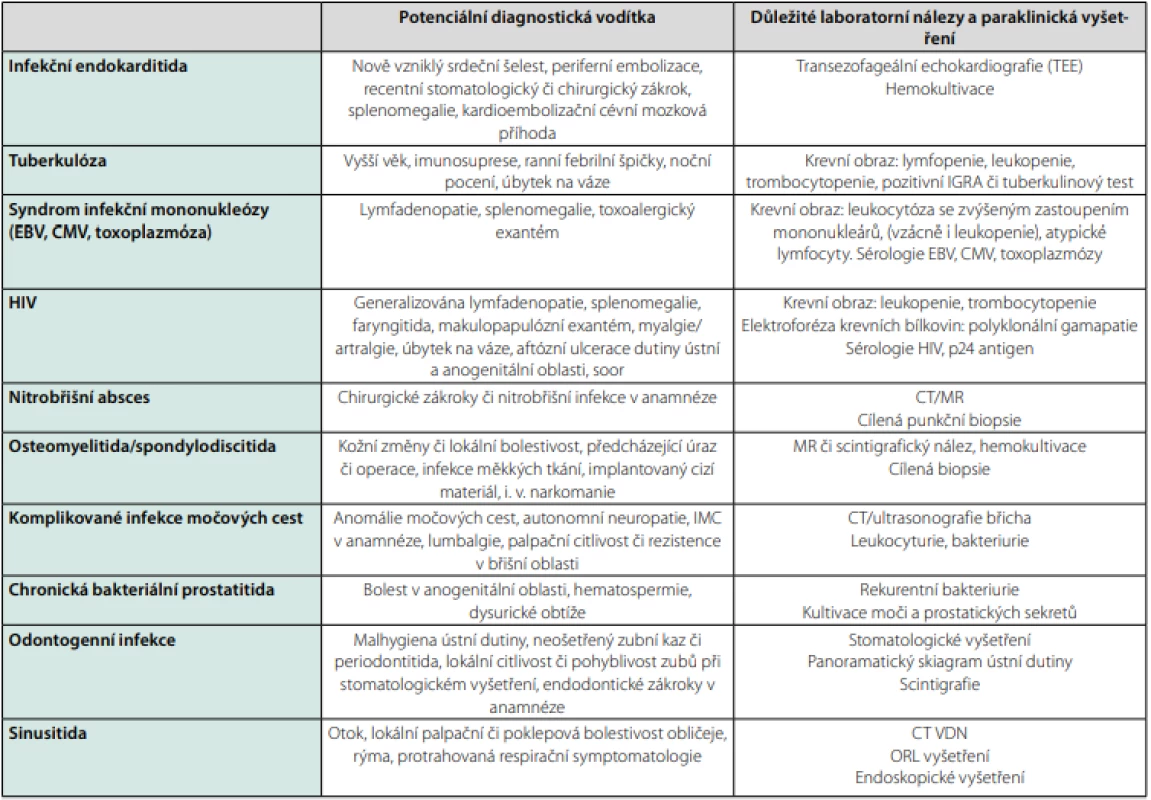
Zpracováno autory podle (7, 10, 12) Neinfekční zánětlivá onemocnění
Neinfekční zánětlivá onemocnění, včetně vaskulitid, systémových onemocnění pojiva či idiopatických granulomatózních onemocnění, patří mezi časté příčiny FUO. Nejčastější revmatologické příčiny FUO uvádí tabulka 3 a patří mezi ně především vybrané vaskulitidy a Stillova choroba v dospělosti (3, 10, 16). V případě této skupiny onemocnění může horečka předcházet rozvoji orgánově specifických nálezů či pozitivitě imunologických markerů o řadu týdnů. Diagnózu se někdy podaří stanovit pouze při dlouhodobém sledování pacienta a po pečlivém vyloučení infekce či malignity. Dominujícími symptomy revmatologických onemocnění jsou především artralgie či ranní ztuhlost kloubů, bolesti svalů nebo šlachových úponů, svalová slabost, úbytek na váze a kožní změny. V diagnostice může být přínosné stanovení celkových imunoglobulinů, autoprotilátek a složek komplementu. U pacientů vyššího věku při odpovídající symptomatologii je nutné pomýšlet na temporální arteriitidu a zvážit případné bioptické vyšetření. Přínosným vyšetřením u vaskulitid velkých tepen a u lokalizovaných granulomatózních procesů včetně sarkoidózy či Crohnovy choroby je 18FDG -PET/CT trupu. Naopak Stillova choroba v dospělosti a revmatická polymyalgie jsou příklady onemocnění, pro které neexistuje dostatečně specifický diagnostický test. Diagnózu lze stanovit pouze na základě souborů klinických a laboratorních kritérií a po vyloučení alternativních příčin (16, 17).
Tab. 3. Nejčastější neinfekční zánětlivé příčiny horečky nejasného původu 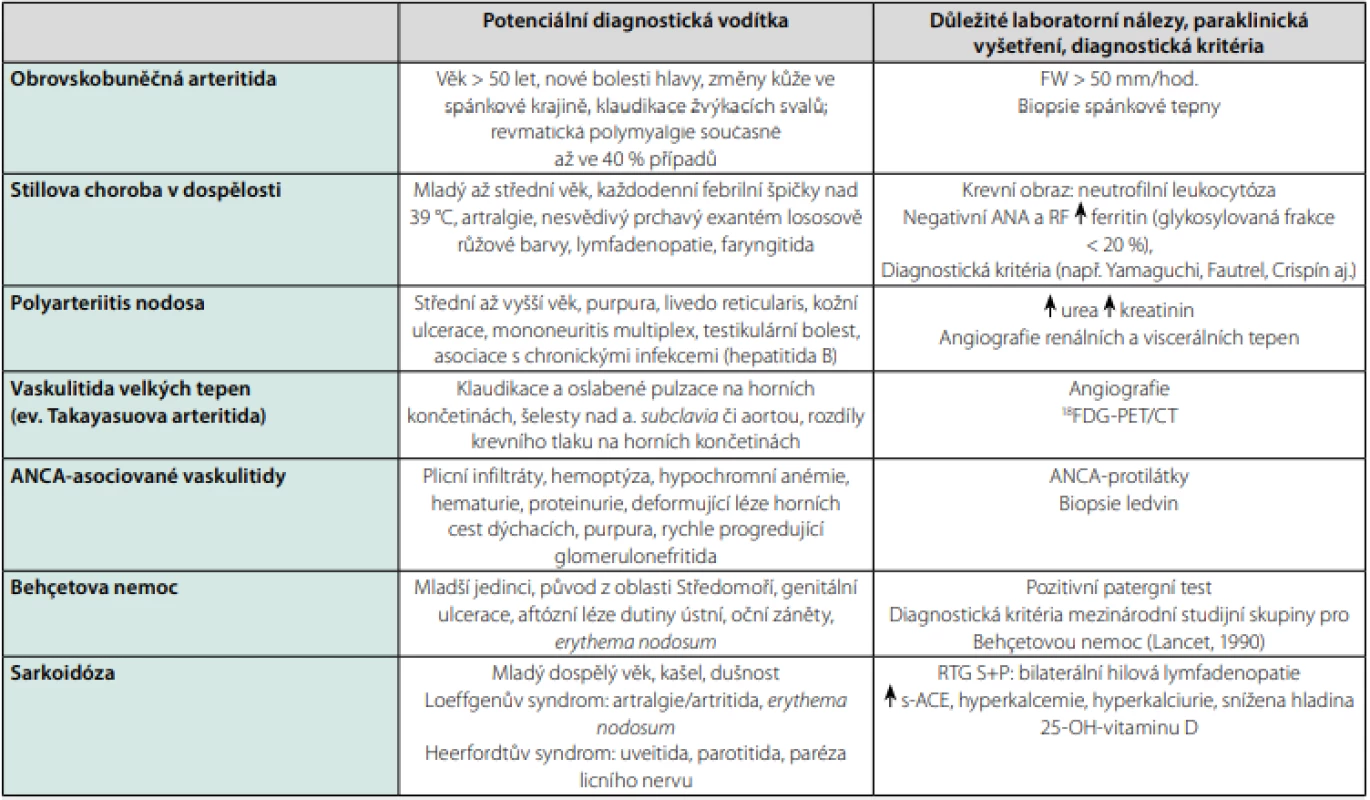
Zpracováno autory podle (7, 10, 12) Hemato‑onkologická a nádorová onemocnění
Mezi nejčastější maligní příčiny FUO patří lymfomy, leukemie, karcinomy ledvin a jater (7, 10, 19). Horečka u této skupiny chorob zpravidla nebývá spojená s třesavkou či výraznější alterací celkového stavu a lépe odpovídá na nesteroidní antirevmatika než na paracetamol (18). Terapeutický pokus s podáváním naproxenu po dobu 3 dny lze použít v diferenciální diagnostice maligních a infekčních příčin horečky, avšak jeho specificita je stále předmětem diskuzí (10, 19). V tabulce 4 jsou uvedeny nejčastější hematologické a onkologické příčiny FUO.
Tab. 4. Nejčastější hemato-onkologické a nádorové příčiny horečky nejasného původu 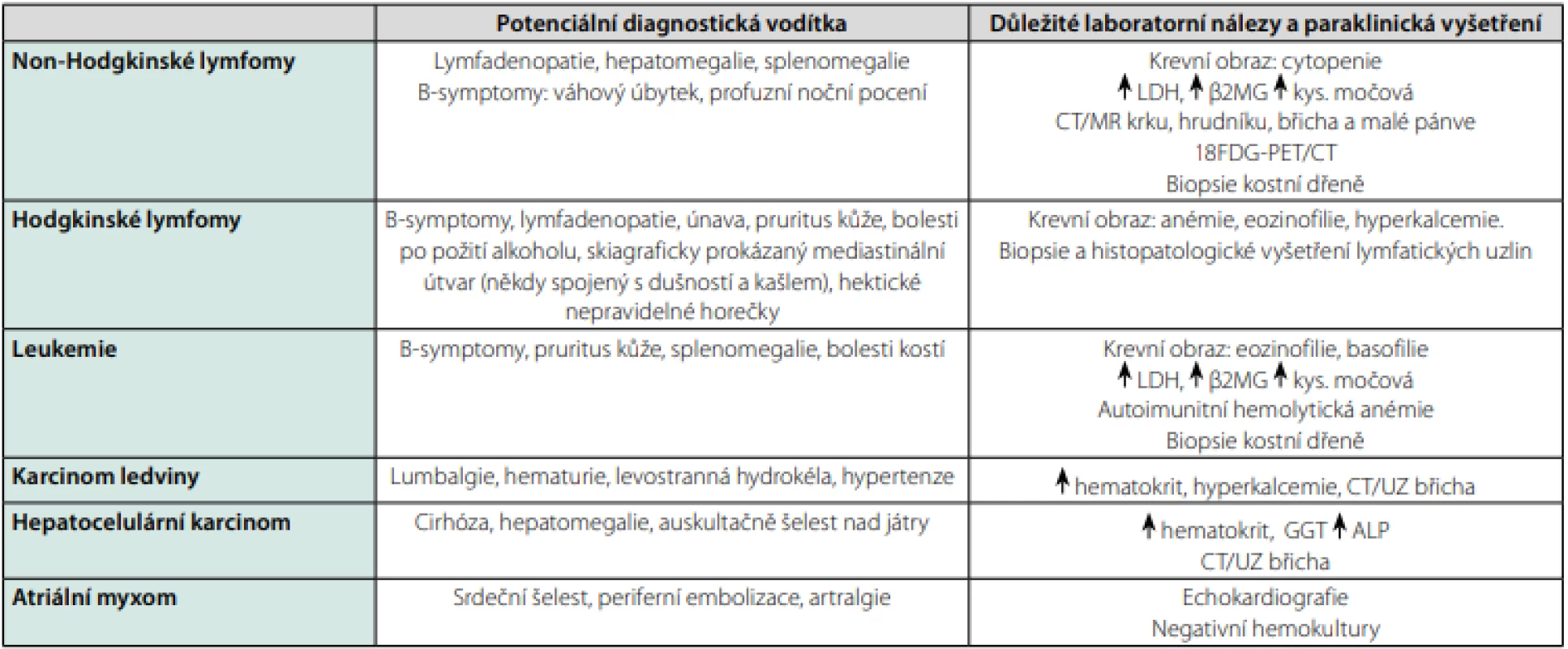
Zpracováno autory podle (7, 10, 12) Polékové horečky
Horečka může být jedinou nežádoucí reakcí na podání celé řady léků (20). V současnosti je rozlišováno celkem pět základních mechanismů, jakými léčivý přípravek dokáže vyvolat horečku (viz Tab. 5). Nejčastější jsou hypersenzitivní reakce spojené s tvorbou imunokomplexů nebo T -buněčnou imunitní odpovědí na samotný lék či jeho metabolity. K rozvoji hypersenzitivní reakce může docházet v řádu několika dní až několika let od prvního podání léku. Vysazení léku vede k promptnímu poklesu teploty, zatímco opakovaná expozice znovu vyvolá horečku (21). V naprosté většině případů k odeznění horečky dochází do 96 hodin po vysazení kauzálního léku, ačkoliv horečka může přetrvávat i delší dobu, zejména dojde -li k narušení funkce orgánů zajišťujících metabolismus léku anebo u látek s velmi dlouhým poločasem vylučování (např. teikoplanin) (20–22). Mezi nejrizikovější léčiva vyvolávající polékové horečky patří zejména antiepileptika a antibiotika, přičemž odhadována četnost hypersenzitivních reakcí dosahuje až 1 na 5 000 léčených pacientů (23). Horečka může být doprovázena lymfadenopatií, hepatocelulární lézí, zvýšením zánětlivých parametrů, zmnožením mononukleárů a nálezem atypických lymfocytů v periferní krvi. Často se vyskytují kožní projevy v podobě generalizovaného morbiliformního exantému anebo závažnějších rekcí typu Stevens -Johnsonova syndromu či toxické epidermální nekrolýzy. Jako DRESS (Drug Rash with Eosinophilia and Systemic Symptoms) syndrom se označuje vzácná a potenciálně život ohrožující hypersenzitivní poléková reakce zahrnující kožní projevy, změny v krevním obraze (eozinofilie, atypická lymfocytóza) a postižení vnitřních orgánů. Mezi nejčastější manifestace orgánového postižení patří hepatitida a intersticiální nefritida, ačkoliv zasažen může být prakticky kterýkoliv orgán (11, 24). Přerušení podávání suspektního léčiva a následná reexpozice bývá mnohdy jedinou cestou k diagnóze.
Tab. 5. Mechanismy polékových horeček a příklady léčiv 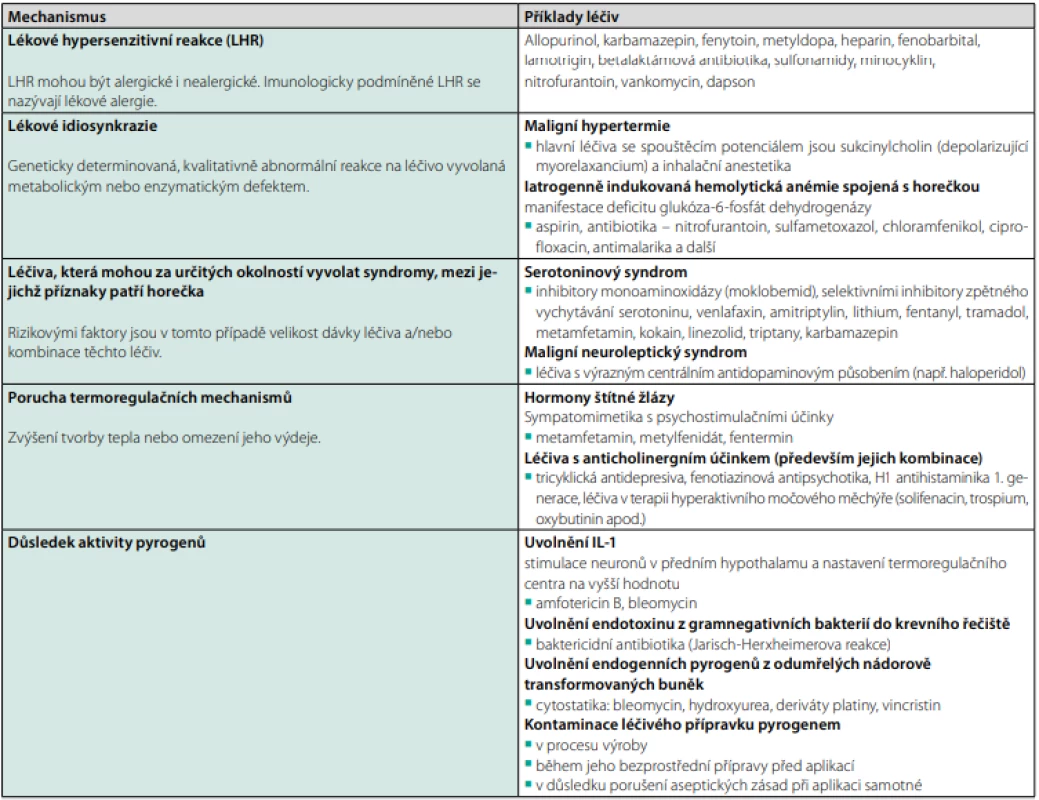
Zpracováno autory podle (14, 20, 21, 24) Diagnostický postup
Stanovení etiologie horečky nejasného původu patří mezi nejobtížnější diferenciálně -diagnostické úkoly ve vnitřním lékařství. V etiologii se uplatňuje více než 200 různých jednotek (7). Jednotlivé skupiny onemocnění bývají často doprovázeny charakteristickou skupinou „malých“ symptomů, z nichž každý sám o sobě obvykle má pouze nízkou specifitu. Avšak pokud je na ně nahlíženo v souvislostech, mohou napomoci k zúžení spektra zvažovaných diagnóz a k omezení neúčelných a finančně náročných vyšetření (10).
Anamnéza a fyzikální vyšetření
Při prvním kontaktu s pacientem bychom měli nejprve zjistit, zda nemocný splňuje výše uvedená kritéria horečky nejasné etiologie. Dále bychom se měli zaměřit na pečlivý odběr anamnézy a provedení základních paraklinických vyšetření. Již v této fázi je vhodné stratifikovat pacienty dle nejpravděpodobnější povahy základního onemocnění s použitím výše popsaných diagnostických vodítek.
Význam teplotních křivek a relativní bradykardie bývá uváděn zejména v diferenciální diagnostice infekčních onemocnění. Přirozený průběh horečky však je často zastřen symptomatickou léčbou či antibiotiky. Relativní bradykardie obvykle doprovází břišní tyfus, Q horečku, leptospirózu a ehrlichiózu, ale vyskytuje se také u lymfomů, nádorů CNS či polékových horeček. Ranní teplotní špičky se vyskytují u mimoplicní tuberkulózy, ale také u polyarteritis nodosa (PAN). Bifazická teplotní křivka se vyskytuje u lokalizovaných hnisavých procesů, Stillovy choroby v dospělosti či mimoplicní tuberkulózy. Zvláštní formu teplotní křivky představuje Pel -Ebsteinova horečka při Hodgkinově lymfomu, kdy se týdny bez zvýšených teplot střídají s febrilními epizodami (25).
Výtěžnost fyzikálního vyšetření bývá nejvyšší, pokud je vyšetření opakováno a hodnoceno znovu s časovým odstupem. V případě horečky nejasného původu je významné především vyšetření kůže, kloubů, lymfatických uzlin, jater a sleziny (7, 25).
Mezi nejdůležitější kožní projevy infekčních onemocnění patří imunopatologické a embolizační fenomény – Oslerovy uzly, Janewayovy léze či třískovité hemoragie nehtových lůžek. Tyto příznaky jsou téměř patognomonické pro diagnózu infekční endokarditidy. Nespecifické, tzv. „parainfekční“, exantémy vídáme v praxi u celé řady virových infektů, které se ovšem málokdy manifestují jako FUO. Polymorfní a proměnlivé exantémy mohou doprovázet akutní retrovirový syndrom či syndrom infekční mononukleózy. Své specifické kožní projevy má řada revmatologických onemocnění. Nesvědící makulopapulózní exantém lososově růžové barvy objevující se zejména na vrcholu horečky a často spontánně mizející doprovází Stillovou chorobu v dospělosti v 60 až 80 % případů, přičemž vyrážka bývá lokalizována na trupu a končetinách (17). Naopak fotosenzitivní dermatitida v obličeji patří mezi nejčastější klinické projevy systémového lupus erythematodes (SLE). Petechie a purpura jsou drobné neblednoucí hemoragické kožní léze způsobené extravazací erytrocytů a bývají známkou vaskulitidy malých tepen. Pro postižení tepen středního kalibru jsou charakteristické spíše nodulární útvary v podkoží, hluboké ulcerace či síťovitě prosvítající cévní kresba charakteru jemného mramorování (livedo reticularis), ev. hrubšího lomeného vzoru (livedo racemosa) (26). Mezi léze, jež mohou imitovat vaskulitidu, zmíníme poštípání členovci, livedo reticularis při embolizaci cholesterolových platů, projevy chronické žilní insuficience a různé dermatózy (např. fototoxické, traumatické, v souvislosti s kortikoterapií či hormonální antikoncepcí). Výsev generalizovaného morbiliformního exantému někdy doprovází polékové horečky. Hemato -onkologická onemocnění bývají doprovázena intenzivním svěděním kůže, výraznými hypersenzitivními reakcemi (např. po poštípání hmyzem či členovci) nebo iritací kůže po kontaktu s teplou vodou) (27).
Kloubní obtíže typicky doprovází revmatologická onemocnění. Při vyšetření kloubů je potřeba se zaměřit na přesný popis charakteru a intenzity obtíží (bolest či otok), jejich distribuce (mono-, oligo - či polyartikulární, symetrická či asymetrická), vyvolávajících faktorů, doby začátku a trvání. Zánětlivé postižení kloubů je pravděpodobnější, pokud pacient udává zhoršení symptomů při inaktivitě (např. typická ranní ztuhlost), symetrické postižení a dobu trvání delší než 6 týdnů (28).
Lokalizovaná lymfadenopatie nejčastěji souvisí s infekčním procesem v drénované oblasti lymfatické uzliny. Akutně zánětlivě postižené uzliny bývají zpravidla měkké a bolestivé na pohmat. Nezánětlivá lymfadenopatie vzniká infiltrací uzliny maligními buňkami při hemato-onkologických onemocněních či metastazujících karcinomech, přičemž v tomto případě bývají uzliny tužší, nebolestivé a někdy dokonce fixované k okolním strukturám. Avšak toto pravidlo neplatí absolutně, neboť pacient může někdy udávat bolesti i u nádorově zvětšené uzliny, která je dána agresivním a rychle rostoucím nádorem utlačujícím okolní tkáně. Riziko lymfadenopatie maligní etiologie se obecně zvyšuje s věkem a dosahuje 4 % u pacientů starších 40 let oproti 0,4 % u mladších jedinců (29). Generalizovaná lymfadenopatie, někdy s doprovodnou splenomegalií, se vyskytuje u syndromu infekční mononukleózy (infekce EBV, CMV, HIV, toxoplazmóza), hemato -onkologických onemocnění, polékových horeček, méně často u sarkoidózy či mimoplicní tuberkulózy. Splenomegalie v kontextu horečnatého onemocnění se vyskytuje nejčastěji u hematologických onemocnění, z infekcí pak u HIV/AIDS a infekční endokarditidy. Z ostatních příčin musíme vyloučit venózní městnání při současném onemocnění jater či infiltrativní postižení při sarkoidóze, amyloidóze, autoimunitní hemolytické anémii, Feltyho syndromu či SLE. Masivní splenomegalie přesahující střední čáru se vyskytuje zejména u myeloproliferativních onemocnění, myelofibrózy a některých leukemií. U pacientů s cestovatelskou anamnézou je nutno vyloučit malárii a viscerální leishmaniózu. Při izolované hepatomegalii v úvahu připadá především primární onemocnění jater včetně infekčních a autoimunitních hepatitid, dále toxické či metabolické hepatopatie. Systémové příčiny zvětšení jater jsou obdobné jako u splenomegalie, která se může vyskytovat současně (30, 31).
Často opomíjeno bývá oční vyšetření, které rovněž může významně přispět ke stanovení diagnózy. Rothovy skvrny jsou typickým příznakem infekční endokarditidy, avšak udávána senzitivita je pouze 2 % (32). Sítnicová krvácení různých tvarů a tzv. vatovitá ložiska se rovněž vyskytují u IE, ale zároveň i u pacientů se systémovými chorobami pojiva (např. SLE), vaskulitidami (PAN, obrovskobuněčná arteriitida), leukemiemi a lymfomy (33).
Laboratorní vyšetření
Pro zvýšení výtěžnosti laboratorních vyšetření je obvykle nezbytné správně interpretovat kombinace výsledků nespecifických vyšetření a při jejich posuzování je nutné hodnotit i míru odchylky od fyziologických norem.
Základní vyšetření ve vnitřním lékařství představuje krevní obraz. Samozřejmostí v případě horečnatých stavů je vyšetření diferenciálního rozpočtu leukocytů, přičemž již samotné změny v krevním obraze mohou přispět k diferenciální diagnostice (Tab. 6). Pro infektologa bývá obvykle významný nález lymfocytózy s doprovodnými atypickými lymfocyty či lymfomonocyty, který definuje syndrom infekční mononukleózy, přičemž se uvádí, že vysoký podíl atypických lymfocytů bývá zejména u infekce EBV či CMV, v menší míře se objevuje i u toxoplazmózy či akutního retrovirového syndromu. Obdobné nálezy jsou popisovány i u polékových horeček a hemato -onkologických onemocnění (10).
Tab. 6. Nálezy v krevním obraze 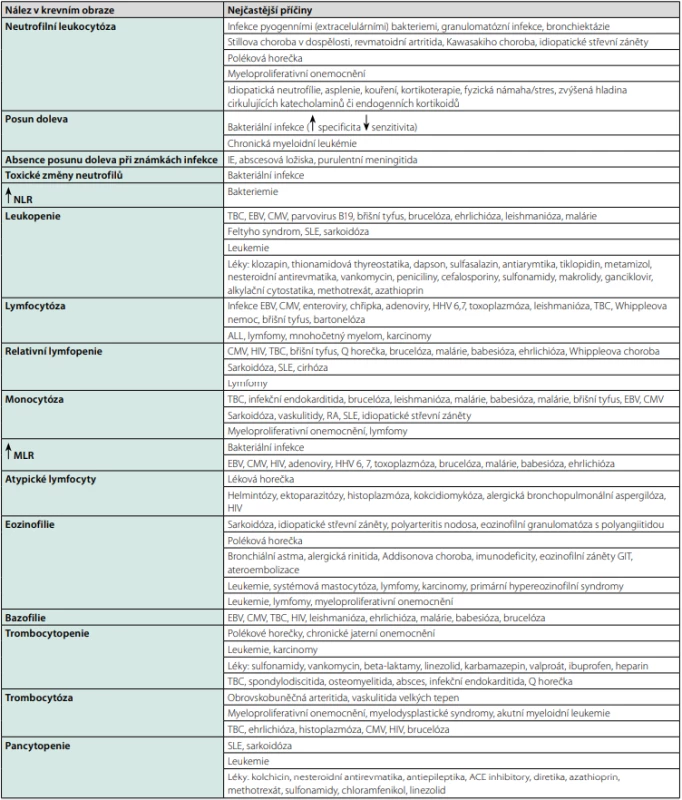
NLR: poměr neutrofilů a lymfocytů, MLR: poměr monocytů a lymfocytů Zpracováno autory podle (14, 24) Vyšetření renálních a jaterních parametrů je užitečné především jako marker subklinického postižení těchto orgánů. Odchylky iontogramu mají obecně velmi široké spektrum možných příčin, pozornost klinika by však měla upoutat zejména kombinace hyponatremie a hyperkalémie vyskytující se např. u adrenální insuficience, která byla popsána mezi vzácnějšími příčinami FUO (2). Samotná hyponatremie může být důsledkem nepřiměřené produkce antidiuretického hormonu (ADH) neuroendokrinními nádory, dále při zánětlivých a nádorových onemocněních plic či mozku. Účinek ADH může zvyšovat také celá řada léků (zejm. antidepresiva, antipsychotika a antiepileptika). Hyperkalcemie může být paraneoplastickým projevem některých nádorů, přímým následkem infiltrace kostní dřeně nádorovým onemocněním nebo může doprovázet granulomatózní onemocnění (sarkoidóza) (34). Dvě nejčastější endokrinní poruchy způsobující FUO jsou subakutní thyreoiditida a hyperthyroidismus (12). V případě subklinické thyreoiditidy mohou k diagnóze napomoci i mírné odchylky hormonů štítné žlázy a TSH.
Hodnota sedimentace erytrocytů (ESR z angl. erythrocyte sedimentation rate) udává rychlost klesání červených krvinek ve vzorku nesrážlivé krve a je ovlivněna koncentrací sérových proteinů a vybraných reaktantů akutní fáze, zejména fibrinogenu a gama -globulinů. Hodnoty ESR je potřeba korigovat na věk a pohlaví pacienta či hodnotu hemoglobinu (urychlení sedimentace u pacientů s anémií). Výraznější elevace ESR (> 100 mm/hod.) doprovází hemato -onkologická a vybraná nádorová onemocnění (karcinom ledviny, chronická lymfocytární leukemie, Hodgkinův lymfom, mnohočetný myelom…), obrovskobuněčnou arteriitidu, revmatickou polymyalgii a další revmatologická onemocnění (35).
C -reaktivní protein (CRP) je syntetizován v játrech po stimulaci prozánětlivými cytokiny (IL-1, IL-6, TNFα). Přestože vyšetření CRP bývá v rutinní klinické praxi často užíváno k odlišení bakteriální a nebakteriální infekce, musíme si uvědomit, že přesná cut -off hodnota není stanovena, jelikož i některé nekomplikované virové infekce mohou být doprovázeny významnou elevací CRP (nad 100 mg/l). Naopak lokalizované infekce či infekce vyvolané atypickými nebo intracelulárními bakteriemi mohou vést pouze k mírnému zvýšení CRP (do 100 mg/l) (36). K signifikantnímu vzestupu CRP dochází i u vybraných systémových onemocnění pojiva (s výjimkou SLE a příbuzných syndromů), nádorových, hemato-onkologických onemocnění či u polékových reakcí (37).
Role prokalcitoninu (PCT) v diferenciální diagnostice FUO je zatím spíše kontroverzní. Obecně lze uvést, že signifikantní elevace (nad 5 μg/l) obvykle svědčí pro bakteriální infekce doprovázené systémovou zánětlivou odpovědí. Naopak u virových, atypických či lokalizovaných bakteriálních infekcí, neinfekčních zánětlivých nebo nádorových onemocnění bývají hodnoty obvykle normální či pouze mírně zvýšené. K elevaci prokalcitoninu může dojít i u pacientů s renální insuficiencí a při paraneoplastické produkci u medulárního karcinomu či malobuněčného karcinomu plic (37).
Laktátdehydrogenáza (LDH) je cytoplazmatický enzym, jehož tkáňové koncentrace mnohonásobně převyšují sérové hodnoty, proto i minimální tkáňové poškození vede ke zvýšení sérové aktivity LDH. Jedná se o nespecifický, ale velmi citlivý marker buněčného rozpadu (především hepatocytů, svalových a krevních buněk). Ve většině případů akutního zvýšení hodnot LDH jsou přítomny jasné klinické známky poškození určitého orgánu či tkáně (např. akutní infarktu myokardu, hemolytická anémie). U chronických onemocnění lze LDH použít jako nespecifický tumorový marker, jehož zvýšení doprovází celou řadu solidních nádorů (např. kolorektální karcinom, melanom, bronchogenní karcinom či karcinom prostaty) a hemato -onkologických onemocnění (zejm. lymfomů). Ke zvýšení LDH však mohou vést i infekční či revmatologická onemocnění, zejména pokud jsou spojena s postižením jater či svalů (38).
Molekula beta-2-mikroglobulinu (B2M) tvoří lehký řetězec hlavního histokompatibilního komplexu I (MHC I) exprimovaného na povrchu všech jaderných buněk. Hlavní funkcí tohoto systému je prezentace antigenů cytotoxickým T -lymfocytům. Ke zvýšení sérové koncentrace B2M dochází při aktivaci buněčné imunity, při některých hemato -onkologických onemocněních či následkem snížené glomerulární filtrace při chorobách ledvin. Z tohoto plyne, že při renální insuficienci je interpretace hodnoty B2M obtížná. B2M se běžně užívá ke sledování dynamiky vývoje a efektu léčby lymfomů. Elevace B2M ovšem není specifická pro lymfoproliferativní onemocnění, neboť doprovází také virové infekce (zejména CMV, HIV), idiopatické střevní záněty, vyskytuje se ale i u sarkoidózy a revmatologických onemocnění (39).
Ferritin je protein sloužící k intracelulárnímu skladování železa v organismu. Jeho syntéza probíhá v orgánech retikuloendoteliálního systému a je stimulována přísunem železa, prozánětlivými cytokiny (IL-1, IL-6, TNFα), oxidačním stresem a růstovými faktory (40). Zvýšení sérových koncentrací ferritinu doprovází akutní a chronické zánětlivé stavy nebo malignity. Výrazná elevace sérového ferritinu (v řadu několika tisíc μg/l) doprovází Stillovou chorobu v dospělosti, juvenilní idiopatickou artritidu a hemofagocytující lymfohistiocytózu, a dokonce patří mezi diagnostická kritéria těchto onemocnění (17, 37). U osob ve věku nad 50 let však daleko častěji doprovází lymfomy, leukemie, mnohočetný myelom a karcinomy solidních orgánů. Z infekčních onemocnění bývají spojeny s elevací ferritinu zejména mimoplicní tuberkulóza, virové nákazy (HIV, EBV, CMV) nebo ehrlichióza (10). Hodnoty ferritinu je nutno interpretovat velmi obezřetně u pacientů po opakovaných krevních transfúzích.
Elektroforéza sérových bílkovin je nespecifické, avšak poměrně finančně nenáročné screeningové vyšetření, které může být přínosné k zúžení spektra potenciálních diagnóz a nasměrování dalšího diagnostického postupu (10). U zánětlivých onemocnění dochází k nárůstu α1 i α2 frakcí tvořených reaktanty akutní fáze (α1 - antitrypsin, haptoglobin, ceruloplasmin). S přechodem onemocnění do chronicity dochází ke snížení frakce albuminu a ke zvýšení intenzity zóny γ s obrazem polyklonální gamapatie. Monoklonální gamapatii odpovídá homogenní vrchol kdekoliv v oblasti β až γ (41).
Mezi základní imunologická vyšetření patří vyšetření hladin jednotlivých tříd imunoglobulinů, autoprotilátek a složek komplementu. Hypergamaglobulinemie se vyskytuje u infekčních systémových zánětlivých onemocnění, chronických jaterních chorob a monoklonální gamapatie. Chronické infekce sliznic zažívacího či respiračního traktu a idiopatické střevní záněty bývají asociovány se zvýšením hladin IgA. Snížené hladiny imunoglobulinu všech tříd mohou být důsledkem ztrát proteinů (nefrotický syndrom, protein ztrácející enteropatie). Hypogamaglobulinemie je dále zjišťována při dysfunkci plazmatických buněk (tzv. „imunologické parézy“) u hemato -onkologických onemocnění či sekundárně po imunochemoterapii s dlouhodobě lymfopenizujícím účinkem (40, 42, 43).
Snížené hladiny složek komplementu mohou být markerem onemocnění spojených s tvorbou a ukládáním imunokomplexů včetně SLE či některých glomerulonefritid. Ke snížení hladin složek komplementu může docházet také u infekcí (IE, přechodně i u virových nákaz) a pokročilého jaterního onemocnění. Složky komplementu C3 a C4 patří mezi reaktanty akutní fáze a jejich zvýšení je nespecifickým markerem zánětu. Pozitivita autoprotilátek nemá jednoznačný diagnostický význam: může předcházet klinické manifestaci onemocnění, provázet aktivní fázi onemocnění, přetrvávat po prodělané chorobě anebo se vyskytovat i u zcela zdravých jedinců. Autoprotilátky lze detekovat také u některých pacientů s hemato -onkologickým onemocněním při nespecifické zánětlivé imunitní odpovědi na nádorový proces (44). Revmatoidní faktor (RF) je autoprotilátka reagující s Fc fragmentem různých IgG, přičemž samotný RF může být imunoglobulinem libovolné třídy. Senzitivita i specificita RF pro revmatoidní artritidu (RA) se pohybuje kolem 70 %. Ke zvýšení RF mohou vést jiné systémové autoimunity, chronické infekce (chronické virové hepatitidy, IE), intersticiální plicní procesy, sarkoidóza či lymfoproliferativní onemocnění. Srovnatelnou senzitivitu s RF, avšak podstatně vyšší specificitu pro RA mají protilátky proti cyklickým citrulinovaným polypeptidům (anti -CCP). Antinukleární protilátky (ANA) jsou širokou skupinou autoprotilátek proti různým jaderným autoantigenům. Historicky byly tyto protilátky nejvíce užívány pro diagnostiku SLE, kde jejich senzitivita dosahuje 95 %, avšak specificita činí pouze 60 %. Zvýšení ANA doprovází také řadu dalších systémových revmatologických onemocnění (RA, systémová sklerodermie, Sjögrenův syndrom, smíšená nemoc pojiva, polymyozitida), orgánově specifických autoimunit (autoimunitní hepatitida, thyreoiditida, Gravesova choroba, primární sklerotizující cholangoitida), infekcí i malignit. Vyšetření ANA slouží především jako screeningový test, při pozitivitě je nutné provést podrobnější rozbor a vyšetření dalších protilátek. Protilátky proti dvouvláknové DNA (anti-dsDNA), proti histonům, nukleosomům a Smithovu antigenu (anti -Sm) mají vysokou specificitu pro SLE. Široké uplatnění má skupina protilátek proti extrahovatelným nukleárním antigenům (ENA), které lze také použit jako screeningový test. Stanovením jednotlivých subtypů ENA lze podpořit diagnózu Sjögrenova syndromu (anti -Ro, anti -La), systémové sklerodermie (anti -Scl-70, protilátky proti centromerám), smíšené nemoci pojiva (anti -U1RNP) či zánětlivých myopatií (anti -Jo1, anti -Mi2, anti -SRP). Protilátky proti cytoplazmě neutrofilů (ANCA) se vyskytují u systémových nekrotizujících vaskulitid včetně GPA, EGPA a, MPA. Bývají pozitivní rovněž u pacientů s idiopatickými střevními záněty, primární sklerotizující cholangitidou, RA a SLE. Nespecifická pozitivita ANCA byla popsána po léčbě thyreostatiky a u některých infekcí (hepatitida C, IE) (40).
Mikrobiologická vyšetření
Důležité postavení v diagnostice febrilních stavů má hemokultivace. Jedná se o nezastupitelné vyšetření v diagnostice infekční endokarditidy nebo jiných bakteriemických infekcí. U cestovatelů mohou napomoci ke stanovení diagnózy břišního tyfu či brucelózy. Při správné technice odběru a bez přechozí antibiotické léčby dosahuje senzitivita vyšetření celkem tří párů hemokultur pro průkaz bakteriemických infekcí až 98 %. Falešná pozitivita však činí téměř 50 %, často vede k prodloužení doby hospitalizace a zvýšení celkových nákladů na zdravotní péči. Pouze 4–7 % všech odebraných hemokultur je diagnosticky přínosných (45). Rovněž tak je nutné pomýšlet i na infekce vyvolané pomalu rostoucími či obtížně kultivovatelnými agens, proto je někdy vhodné indikovat prodloužení doby kultivace či zvážit provedení molekulárně -genetických vyšetření (46).
Zobrazovací vyšetření
Pro užití zobrazovacích metod při diagnostice FUO platí, že tyto metody by neměly být užívány „screeningově“, ale s ohledem na vysoký podíl falešně pozitivních výsledků, by měly sloužit především k zodpovězení jasně formulovaných otázek vycházejících z pečlivého vyhodnocení dostupných klinických a laboratorních nálezů (3).
Prostý skiagram hrudníku patří do základního souboru vyšetření, jež je třeba provést k naplnění samotné definice FUO (viz Tab. 1). Vyšetření přispívá k průkazu hrubších patologických změn charakteru zánětlivých plicních infiltrátů či větších solidních tumorů v plicním parenchymu. Pro diagnostiku intersticiálních plicních procesů, menších pleurální výpotků, drobných nodulárních útvaru a lymfadenopatie má vyšší citlivost CT, resp. HRCT. CT břicha a malé pánve nahradila diagnostickou laparotomii při pátrání po okultních abscesových ložiscích či hluboce uložené lymfadenopatii (47). Podobné uplatnění má magnetická rezonance, avšak s vyšší senzitivitou pro průkaz vertebrogenních zánětlivých procesů (spondylodiscitida, epidurální absces) a vaskulitidy velkých tepen. Ultrazvuk břicha považujeme za hrubě orientační metodu významně limitovanou zkušenostmi vyšetřujícího sonografisty. Senzitivita transtorakální echokardiografie pro průkaz vegetací srdečních chlopní dosahuje dle optimistických odhadů pouze 75 %, oproti zhruba 90 % u transezofageální echokardiografie (48). Z dalších radiologických metod zmíníme panoramatický snímek ústní dutiny přínosný v diagnostice odontogenních zánětu a CT vyšetření vedlejších nosních dutin při podezření na sinusitidu.
Metody nukleární medicíny
Metody nukleární medicíny mají v diagnostice horečky nejasného původu zcela nezastupitelné postavení. Jejich význam spočívá zejména ve schopnosti rozpoznat metabolickou aktivitu dané tkáně, přičemž právě kombinace funkčních a morfologických metod může poskytnout cenné informace při diferenciálně diagnostickém postupu. Vzhledem k omezené dostupnosti a poměrně vysoké finanční náročnosti těchto metod je jejich užití zatím omezeno na případy, kdy vstupní vyšetřovací algoritmus nevede ke stanovení diagnózy.
V diagnostice okultních zánětů se může uplatnit scintigrafie značenými leukocyty (111In, 99mTc). Leukoscitigrafie je přínosná při suspekci na bakteriální infekci, především při vysokém počtu leukocytů v periferní krvi. Vzhledem k velmi širokému etiologickému spektru a relativně nízkému zastoupení infekčních příčin má scintigrafie značenými leukocyty nízkou senzitivitu a pouze okrajový význam v diagnostice FUO (49). V minulosti používána scintigrafie s 67Ga -citrátem, který se váže na laktoferrin produkovaný leukocyty v místě zánětu, byla v současné době zcela nahrazena hybridní modalitou PET/CT s aplikací radiofarmaka 2-deoxy-2-[18F]fluoro -D-glukóza (18F -FDG). Právě zavedením PET/CT do klinické praxe bylo dosaženo velkého pokroku v diagnostice FUO. V kombinaci s výpočetní tomografií poskytující anatomickou orientaci činí celkový diagnostický přínos 18F -FDG PET/CT 38 až 75 % dle výsledků 16 různých studií (medián 53 %). Pokud se vyloučí případy, ve kterých se diagnózu nepodaří zjistit vůbec, dosahuje senzitivita metody 72 až 98 % (13). Význam 18F -FDG PET/CT spočívá především v detekci okultních nádorů, abscesových ložisek, granulomatózních onemocnění a vaskulitidy velkých tepen. Senzitivita je vyšší než u 67Ga -scintigrafie (79 % vs 45 %, p < 0,05 dle Hunga et al., 2017) a 111In -leukoscintigrafie (86 % vs. 20% p < 0,01 dle Seshadri et al., 2012) (50, 51). Vyšetření je poměrně nákladově efektivní, zejména pokud je provedeno v časné fázi diagnostického algoritmu FUO. Dle výsledků publikovaných studií může 18F -FDG PET/CT zkrátit dobu hospitalizace, snížit množství neúčelných testů a významně redukovat celkové náklady spojené s diagnostikou horečky nejasného původu (51).
Invazivní vyšetření
Nejčastějším invazivním vyšetřením v diagnostice FUO je odběr lymfatické uzliny k histopatologickému vyšetření. Obecně málo výtěžná bývají vyšetření předních cervikálních, axilárních a inguinální uzlin, kde bývají mnohdy zachyceny pouze nespecifické reaktivní změny, které nepomohou k vyloučení infekčního, ani maligního procesu. Přínosnější bývá vyšetření zadních cervikálních, supra – a infraklavikulárních, mediastinálních a retroperitoneálních uzlin. Vyšetření kostní dřeně se užívá nejen při podezření na vybraná hematologická onemocnění, ale i mimoplicní tuberkulózu, viscerální leishmaniózu, Whippleovu nemoc, břišní tyfus, systémovou mastocytózu či Castlemanovu chorobu. Biopsie jater je diagnosticky přínosná v 9–17 % případů FUO a může být nápomocná v diagnostice mimoplicní tuberkulózy, sarkoidózy či jiných granulomatózních onemocnění (7, 10)
Symptomatologie temporální arteritidy je u pacientů starších 55 let indikací k biopsii spánkové tepny (3). U všech pacientů ve vyšším věku by měla být zvážena onkologická screeningová vyšetření (endoskopie zažívacího traktu, gynekologické vyšetření apod.) (12). Při neurologických příznacích někteří autoři doporučuji zvážit lumbální punkci (52).
Terapeutický pokus
Empirické podávání antibiotik u pacientů s FUO zpravidla oddaluje diagnózu. Použití antibiotik je však na místě při známkách sepse, hemodynamické nestability či u pacientů s neutropenií (3). Kortikoterapie by neměla být zahájena do spolehlivého vyloučení infekčního onemocnění či lymfomu, není-li stav pacienta život ohrožující. V případě lymfomů totiž užití kortikoterapie může znemožnit diagnostiku, neboť terapeutická odpověď zabrání možnosti histologické verifikace. Kortikoidy rovněž snižují výtěžnost imunologických vyšetření a 18FDG -PET/CT v diagnostice zánětlivých onemocnění a lymfomů.
Neobjasněná etiologie a prognóza
Zastoupení případů FUO bez objasněné etiologie se v souborech publikovaných v posledních letech pohybuje v rozmezí 19 až 51 % (8). U řady těchto případů po neprůkazném extenzivním vyšetřovacím procesu dochází během sledování ke spontánnímu ústupu obtíží (11). Dle Tana et al. (2019) dosahuje smrtnost nediagnostikované FUO v průběhu 10letého sledování 17,2 % (53).
Prognóza pacientů závisí na vyvolávající příčině. Obecně lze uvést, že nejpříznivější prognózu mají infekční onemocnění, u kterých mnohdy dochází k plné úzdravě pacienta. Naopak u neinfekčních zánětlivých onemocnění může docházet k relapsům a tato onemocnění často vyžadují dlouhodobé sledování a léčbu. Nejvyšší smrtnost je popisována u non-hodgkinských lymfomů, případně jiných maligních onemocnění (11, 53).
Závěr a doporučený diagnostický postup
Horečka nejasného původu (FUO) je definovaná jako tělesná teplota ≥ 38,3 °C trvající nebo opakovaně se vyskytující během ≥ 3 týdnů a jejíž příčina zůstává neobjasněna navzdory intenzivnímu vyšetřovacímu procesu. V etiologii FUO se uplatňují infekční, neinfekční zánětlivá, nádorová, hemato-onkologická a vybraná interní onemocnění. Dosud neexistuje všeobecně uznávaný diagnostický postup odpovídající striktním požadavkům medicíny založené na důkazech. Naše doporučení bychom mohli shrnout do následujících kroku:
- Odběr podrobné anamnézy a důkladné fyzikální vyšetření s opakovaným přehodnocením stavu -> pátraní po orgánově specifických příznacích a potenciálních diagnostických vodítkách, zohlednění kombinace tzv. malých příznaků
- Provedení základního souboru laboratorních a zobrazovacích vyšetření (viz Tab. 1)
- Při neprůkaznosti vstupních vyšetření a elevaci zánětlivých parametrů doplnit další podrobnější imunologická a zobrazovacích vyšetření, zvážit 18 F -FDG -PET/CT vyšetření
- Doplnit případná invazivní vyšetření: histopatologické vyšetření lymfatických uzlin, sternální punkce/trepanobiopsie kostní dřeně, lumbální punkce, endoskopická vyšetření apod.
- Zůstává-li etiologie neobjasněna, je nutno pokračovat v ambulantním sledování pacienta a při přetrvávání obtíží zopakovat vyšetření (včetně invazivních) s časovým odstupem.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Milan Trojánek, Ph.D.,
Klinika infekčních nemocí,
2. lékařská fakulta UK a Fakultní nemocnice Bulovka,
Budínova 2,
180 81 Praha 8
Cit. zkr: Vnitř Lék 2021; 67(1): e32–e42
Článek přijat redakcí: 11. 8. 2020
Článek přijat po recenzích: 19. 1. 2021
Zdroje
1. Vanderschueren S, Knockaert D, Adriaenssens T, et al. From prolonged febrile illness to fever of unknown origin: the challenge continues. Arch Intern Med 2003; 163(9): 1033–1041.
2. Arnow PM, Flaherty JP. Fever of unknown origin. Lancet 1997; 350(9077): 575–580.
3. Bleeker -Rovers CP, Vos FJ, de Kleijn EM, et al. A prospective multicenter study on fever of unknown origin: the yield of a structured diagnostic protocol. Medicine (Baltimore) 2007; 86(1): 26–38.
4. Petersdorf RG, Beeson PB. Fever of unexplained origin: report on 100 cases. Medicine (Baltimore) 1961; 40 : 1–0.
5. Durack DT, Street AC. Fever of unknown origin-reexamined and redefined. Curr Clin Top Infect Dis 1991; 11 : 35–51.
6. Knockaert DC, Vanneste LJ, Vanneste SB, et al. Fever of Unknown Origin in the 1980 s: An Update of the Diagnostic Spectrum. Arch Intern Med 1992; 152(1): 51–55.
7. Hayakawa K, Ramasamy B, Chandrasekar PH. Fever of unknown origin: an evidence-based review. Am J Med Sci 2012; 344(4): 307–316.
8. de Kleijn EM, Vandenbroucke JP, van der Meer JW. Fever of unknown origin (FUO). I A. prospective multicenter study of 167 patients with FUO, using fixed epidemiologic entry criteria. The Netherlands FUO Study Group. Medicine (Baltimore) 1997; 76(6): 392–400.
9. Mourad O, Palda V, Detsky AS. A comprehensive evidence -based approach to fever of unknown origin. Arch Intern Med 2003; 163(5): 545–551.
10. Cunha BA, Lortholary O, Cunha CB. Fever of unknown origin: a clinical approach. Am J Med 2015; 128(10): 1138. e1–e15.
11. Bleeker -Rovers CP, van der Meer JWM. Fever of unknown origin. In: Kasper DL, Fauci AS, Longo DL, Hauser SL, Jameson JL, Loscalzo J (eds). Harrison’s Principles of Internal Medicine. 19th ed. McGraw -Hill: New York 2016 : 135–142.
12. Hersch EC, Oh RC. Prolonged febrile illness and fever of unknown origin in adults. Am Fam Physician 2014; 90(2): 91–96.
13. Kouijzer IJE, Mulders -Manders CM, Bleeker -Rovers CP, et al. Fever of Unknown Origin: the Value of FDG -PET/CT. Semin Nucl Med 2018; 48(2): 100–107.
14. Mackowiak PA, Durack DT. Fever of unknown origin. In: Bennett JE, Dolin R, Blaser MJ, Parta M (eds). Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 8th ed. Elsevier Saunders: Philadelphia 2015 : 721–729.
15. Bottieau E, Clerinx J, Van den Enden E, et al. Fever after a stay in the tropics: diagnostic predictors of the leading tropical conditions. Medicine (Baltimore) 2007; 86(1): 18–25.
16. Zenone T. Fever of unknown origin in rheumatic diseases. Infect Dis Clin North Am 2007; 21(4): 1115–1135.
17. Gerfaud -Valentin M, Jamilloux Y, Iwaz J, Sève P. Adult -onset Still’s disease. Autoimmun Rev 2014; 13(7): 708–722.
18. Foggo V, Cavenagh J. Malignant causes of fever of unknown origin. Clin Med (Lond) 2015; 15(3): 292–294.
19. Chang JC, Gross HM. Utility of naproxen in the differential diagnosis of fever of undetermined origin in patients with cancer. Am J Med 1984; 76 : 597–603.
20. Roush MK, Nelson KM. Understanding drug -induced febrile reactions. Am Pharm 1993; 33(10): 39–42.
21. Mackowiak PA. Drug fever: mechanisms, maxims and misconceptions. Am J Med Sci. 1987; 294(4): 275–286.
22. Ochi H, Wada K, Okada H, et al. The persistence of drug -induced fever by teicoplanin-a case report. Int J Clin Pharmacol Ther. 2011; 49(5): 339–343.
23. Roujeau JC, Stern RS. Severe adverse cutaneous reactions to drugs. N Engl J Med 1994; 331(19): 1272–1285.
24. Husain Z, Reddy BY, Schwartz RA. DRESS syndrome: Part I. Clinical perspectives. J Am Acad Dermatol 2013; 68(5): 693.e1–e14.
25. Cunha BA. Fever of unknown origin: focused diagnostic approach based on clinical clues from the history, physical examination, and laboratory tests. Infect Dis Clin North Am 2007; 21(4): 1137–1187.
26. Kovačevičová M, Švestková S. Retikulární exantémy – patofyziologie, etiopatogeneze, klasifikace. Čes -slov Derm 2012; 87(6): 211–219.
27. Fogo A, du Vivier A. The cutaneous manifestations of haematological malignancy. Clin Med (Lond) 2009; 9(4): 366–370.
28. Shmerling RH. Evaluation of the adult with polyarticular pain. UpToDate 2020. [cit. 2020-06-25]. Dostupné z www: .
29. Gaddey HL, Riegel AM. Unexplained Lymphadenopathy: Evaluation and Differential Diagnosis. Am Fam Physician 2016; 94(11): 896–903.
30. Bona R. Evaluation of splenomegaly and other splenic disorders in adults. UpToDate 2020. [cit. 2020-06-25]. Dostupné z www: .
31. Curry MP, Bonder A. Overwiew of the evaluation of hepatomegaly in adults. UpToDate. 2020 [cited 2020 Jun 25]. Dostupné z www: .
32. Loughrey PB, Armstrong D, Lockhart CJ. Classical eye signs in bacterial endocarditis. QJM 2015; 108(11): 909–910.
33. Ruddy SM, Bergstrom R, Tivakaran VS. Roth Spots. StatPearls 2020. [cit. 2020-06-25]. Dostupné z www: .
34. Shane E. Diagnostic approach to hypercalcemia. UpToDate 2020. [cit. 2020-07-12]. Dostupné z www: < https://www.uptodate.com/contents/diagnostic -approach -to -hypercalcemia>.
35. Bray C, Bell LN, Liang H, et al. Erythrocyte Sedimentation Rate and C -reactive Protein Measurements and Their Relevance in Clinical Medicine. WMJ 2016; 115(6): 317–321.
36. Simon L, Gauvin F, Amre DK, et al. Serum procalcitonin and C -reactive protein levels as markers of bacterial infection: a systematic review and meta -analysis. Clin Infect Dis 2004; 39(2): 206–217.
37. Maruna P. Proteiny akutní fáze. 1. vydání. Maxdorf: Praha 2004.
38. Erez A, Shental O, Tchebiner JZ, et al. Diagnostic and prognostic value of very high serum lactate dehydrogenase in admitted medical patients. Isr Med Assoc J 2014; 16(7): 439–443.
39. Li L, Dong M, Wang XG. The Implication and Significance of Beta 2 Microglobulin: A Conservative Multifunctional Regulator. Chin Med J (Engl) 2016; 129(4): 448–455.
40. Castro C, Gourley M. Diagnostic testing and interpretation of tests for autoimmunity. J Allergy Clin Immunol 2010; 125(Suppl 2): S238–S247.
41. Dasgupta A, Wahed A. Protein Electrophoresis and Immunofixation. In Dasgupta A, Wahed A (authors). Clinical chemistry, immunology and laboratory quality control: A comprehensive review for board preparation, certification and clinical practice. 1st ed. Elsevier: Amsterdam 2014 : 391–405.
42. Casulo C, Maragulia J, Zelenetz AD. Incidence of Hypogammaglobulinemia in Patients Receiving Rituximab and the Use of Intravenous Immunoglobulin for Recurrent Infections. Clin Lymphoma Myeloma Leuk 2013; 13(2): 106–111.
43. De Angelis F, Tosti ME, Capria S, et al. Risk of secondary hypogammaglobulinaemia after Rituximab and Fludarabine in indolent non -Hodgkin lymphomas: A retrospective cohort study. Leuk Res 2015; 39(12): 1382–1388.
44. Guyomard S, Salles G, Coudurier M et al. Prevalence and pattern of antinuclear autoantibodies in 347 patients with non-Hodgkin’s lymphoma. Br J Haematol 2003; 123(1): 90–99.
45. Coburn B, Morris AM, Tomlinson G, et al. Does this adult patient with suspected bacteremia require blood cultures? JAMA 2012; 308(5): 502–511.
46. Werner M, Andersson R, Olaison L, et al. A clinical study of culture -negative endocarditis. Medicine (Baltimore) 2003; 82(4): 263–273.
47. Dibble EH, Yoo DC, Noto RB. Role of PET/CT in Workup of Fever without a Source. Radiographics 2016; 36(4): 1166–1177.
48. Vilacosta I, Olmos C, de Agustín A, et al. The diagnostic ability of echocardiography for infective endocarditis and its associated complications. Expert Rev Cardiovasc Ther 2015; 13(11): 1225–1236.
49. Censullo A, Vijayan T. Using Nuclear Medicine Imaging Wisely in Diagnosing Infectious Diseases. Open Forum Infect Dis 2017; 4(1): ofx011. Dostupné z DOI: .
50. Hung BT, Wang PW, Su YJ, et al. The efficacy of 18 F -FDG PET/CT and 67Ga SPECT/CT in diagnosing fever of unknown origin. Int J Infect Dis 2017; 62 : 10–17.
51. Seshadri N, Sonoda LI, Lever AM, et al. Superiority of 18F -FDG PET compared to 111In -labelled leucocyte scintigraphy in the evaluation of fever of unknown origin.J Infect 2012; 65(1): 71–79.
52. Roth AR, Basello GM. Approach to the adult patient with fever of unknown origin. Am Fam Physician 2003; 68(11): 2223–2228.
53. Tan Y, Liu X, Shi X. Clinical features and outcomes of patients with fever of unknown origin: a retrospective study. BMC Infect Dis 2019; 19(1): 198.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Internista a pacient po ischemické CMP
- Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
- Dlouhodobá EKG monitorace
- Patentní foramen ovale z pohledu intervenční kardiologie
- Následná péče po prodělaném covidu-19 a její úskalí
- Včasná a souběžná terapie dyslipidemie a hypertenze: kdy ji začít a jak udržet dlouhodobě dobrou adherenci pacientů?
- EMPEROR reduced – empagliflozin u nemocných se srdečním selháním se sníženou ejekční frakcí
- Kdy ukončit léčbu hepatitidy B?
- Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Diagnostické hospitalizácie pred zaradením pacienta na čakaciu listinu pre transplantáciu obličky
- Is autoimmune pancreatitis a risk factor for pancreatic adenocarcinoma?
- Komplexní interdisciplinární pohled na návrat ke sportu po prodělání infekce covid-19
- Úskalí řešení problémů polymedikace
- Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
- Horečka nejasného původu
- Nutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
- Kompetence pacienta a informovaný souhlas
- Prof. MUDr. Jiří Vítovec, CSc., FESC, má jubileum
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Horečka nejasného původu
- Dlouhodobá EKG monitorace
- Následná péče po prodělaném covidu-19 a její úskalí
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



