-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Osteoporóza u premenopauzálnych žien
Osteoporosis in premenopausal women
In contrast to postmenopausal women diagnostic process and treatment of premenopausal osteoporosis in young women reamin poorly defined. A low bone mineral density in premenopausal women is not associated with the same risk of fractures as in postmenopausal women, therefore diagnosis requires not only densitometric examination but depends on the consideration of other risk factors. Most cases of premenopausal osteoporosis are associated with chronic diseases affecting bone metabolism. Treatment of the underlying disease may improve bone density as well as bone quality. Rarely, a bone-specific antiporotic therapy may be used, although quality evidence is scarce. This article will review current opinion on definition, diagnosis and treatment of premenopausal osteoporosis.
Keywords:
premenopausal osteoporosis – risk of fracture – densitometry – treatment
Autori: Juraj Payer; Juraj Smaha; Martin Kužma; Zdenko Killinger; Peter Jackuliak
Pôsobisko autorov: V. interná klinika Lekárskej fakulty UK a Univerzitnej nemocnice Bratislava
Vyšlo v časopise: Vnitř Lék 2021; 67(5): 284-290
Kategória:
Súhrn
U mladých, premenopauzálnych žien v súčasnosti neexistujú jednoznačné odporúčania diagnostiky a liečby osteoporózy. Nízka hodnota kostnej hustoty u premenopauzálnych žien nie je asociovaná s rovnakým rizikom fraktúry ako u postmenopauzálnych žien, preto u nich nie je možné v diagnostickom procese využiť iba denzitometrické vyšetrenie. Väčšina prípadov premenopauzálnej osteoporózy je spôsobená chronickými ochoreniami, ktoré zasahujú do kostného metabolizmu. Liečba základného ochorenia často vedie k zlepšeniu nielen denzity, ale aj kvality kosti. Zriedkavo je nutné využiť špecifickú antiporotickú liečbu, avšak v súčasnosti nemáme dostatok dôkazov o efektivite a rizikách takejto liečby. Cieľom tohto článku je priniesť súčasný pohľad na definíciu, diagnostiku a liečbu premenopauzálnej osteoporózy.
Klíčová slova:
liečba – kostná denzitometria – riziko zlomenin – premenopauzálna osteoporóza
Maximálna hustota kostí tzv. peak bone mass sa za normálnych fyziologických podmienok zvyčajne dosiahne u väčšiny žien vo veku 20 rokov. Osteoporóza s nadmernou stratou kostí u inak zdravých premenopauzálnych žien je preto menej očakávaná než v postmenopauze. Osteoporóza ako chronické ochorenie vedúce k zníženiu kvantity a kvality kostnej hmoty spôsobujúce fraktúry je dobre definovaná najmä u postmenopauzálnych žien. Tu je vzťah medzi BMD a rizikom zlomeniny jasný a potvrdený, s každým poklesom štandardnej odchýlky (SD) pri denzitometrickom vyšetrení sa očakáva zdvojnásobenie rizika zlomeniny (1, 2).
Epidemiológia osteoporózy a počet zlomenín u premenopauzálnych žien nie sú presne známe. Prevalencia osteoporózy u premenopauzálnych žien sa pohybuje od 0,5 % do 50 % v závislosti od skúmanej populácie, použitej definície osteoporózy a referenčného centra, typu základného ochorenia, či spôsobu liečby základného ochorenia (2, 3). V európskej štúdii u premenopauzálnych žien (priemerný vek 33,8 ± 0,5) v neselektovanej populácii sa nezistili žiadne ženy s osteoporózou (definovanou ako T-skóre ≤ -2,5 SD) a asi 10,6 % žien malo potvrdenú osteopéniu (T-skóre > -2,5 a ≤ -1,0 SD) (4). Naopak, u premenopauzálnych žien so známymi príčinami sekundárnej osteoporózy bola prevalencia nízkej kostnej hmotnosti (definovaná ako Z-skóre ≤ -2 SD) u 17,3 % pacientok postihnutých systémovým lupus erythematosus (5), u 7,3 % pacientok s reumatoidnou artritídou (6), 44,5 % u pacientok s Cushingovým syndrómom (7), 35 % u HIV pacientok (8) a 45 % u pacientok s cystickou fibrózou (9).
Patogenéza
Asociácia medzi nízkou hodnotou kostnej minerálovej hustoty (BMD – bone mineral density) a vyšším rizikom fraktúry je u premenopauzálnych žien oveľa slabšia ako u žien po menopauze (10). Pri rovnakej hodnote BMD má premenopauzálna žena nižšie riziko vzniku fraktúry než postmenopauzálna, čo súvisí s ďalšími rizikovými faktormi rozvoja fraktúr (napr. premenopauzálne ženy majú väčšie množstvo svalstva, vyššie hodnoty estrogénov, nižší kostný obrat, hrubšiu kortikális, menej pádov atď.). Nízka hodnota BMD nemusí u mladých žien reflektovať ochorenie skeletu ale môže znamenať iba nízku dosiahnutú maximálnu kostnú hmotu (peak bone mass), prípadne menšie rozmery skeletu. Maximálna kostná hmota je podmienená geneticky, ale ovplyvňujú ju aj mnohé enviromentálne faktory počas rastu skeletu, ako napríklad telesné cvičenie, príjem vápnika a vitamínu D, fajčenie, príjem alkoholu, BMI (body mass index) v období menarché, nástup puberty či hormonálny status. Každá žena dosiahne maximálnu kostnú hmotu, ale nie každá žena nevyhnutne dosiahne optimálnu kostnú hmotu (11). V klinickej praxi je teda veľmi dôležité odlíšiť pacientky, u ktorých nízka BMD reflektuje nízku dosiahnutú maximálnu kostnú hmotu od tých, u ktorých je nízka BMD skutočne prejavom osteoporózy v dôsledku patologickej modelácie/remodelácie kostí.
Diagnostika
Kostná hustota je v dospelosti výsledkom dvoch faktorov – maximálnej hodnoty BMD dosiahnutej v priebehu času a množstva straty kostí až do času uvedeného merania alebo posúdenia BMD. Jednorázová nízka hodnota BMD u premenopauzálnej ženy môže naznačovať nedostatočné dosiahnutie maximálnej kostnej hmoty alebo môže naznačovať jej nadmernú predchádzajúcu alebo súčasnú stratu kostnej hmoty. Tieto podmienky môžu mať za následok podobné nízke BMD, ale vplyv na zlomeniny sa môže výrazne líšiť. Suboptimálne dosiahnutie maximálnej kostnej hmotnosti predstavuje stabilný stav s nízkym obratom, zatiaľ čo aktívna strata kostí je spojená so stavom s vysokým obratom, alebo naopak s nízkou novotvorbou kostnej hmoty. Pri hodnotení nízkej kostnej hmoty v premenopauze je dôležité pokúsiť sa rozlišovať medzi týmito dvoma stavmi, hoci niekedy to môže byť ťažké (najmä ak je k dispozícii len jedno meranie BMD).
Vzhľadom na vyššie uvedené, nemožno u premenopauzálnych žien použiť súčasnú definíciu osteoporózy podľa Svetovej zdravotníckej organizácie (WHO – World Health Organization), ktorá bola primárne navrhnutá pre definovanie osteoporózy u postmenopauzálnych žien.
U premenopauzálnych žien by sa podľa Medzinárodnej spoločnosti pre klinickú denzitometriu (ISCD – International Society for Clinical Densitometry) mala kostná denzita hodnotiť na základe Z-skóre. Z-skóre nižšie ako -2 SD sa však definuje ako „znížená kostná denzita pod očakávaným rozsahom pre danú vekovú skupinu“ a nie ako „premenopauzálna osteoporóza“. Hodnota Z-skóre vyššia ako -2 SD sa má definovať ako „v rámci očakávaného rozmedzia pre danú vekovú skupinu“. Podľa ISCD sa u premenopauzálnych žien nemá používať pojem osteopénia (12, 13). IOF pracovná skupina (International Osteoporosis Foundation Working Group) má na definovanie osteoporózy v premenopauzálnom veku rozdielny názor. Podľa definície IOF by sa malo Z skóre používať na určenie nízkej kostnej hmoty u adolescentov, ktorí ešte nedosiahli maximálnu kostnú hmotu. U mladých ľudí, ktorí už majú vybudovanú maximálnu kostnú hmotu možno pri diagnostike osteoporózy použiť T-skóre. Avšak T-skóre je diagnostickým znakom pre osteoporózu iba u mladých ľudí (14):
s chronickými ochoreniami, o ktorých je známe, že ovplyvňujú kostný metabolizmus alebo
bez chronických ochorení, ktoré ovplyvňujú kostný metabolizmus, ale u ktorých sú prevalentné nízkoenergetické zlomeniny stavcov, alebo sú prítomné viac ako 2 nízkoenergetické zlomeniny (15).
Možno teda zhrnúť, že podľa súčasných odporúčaní môže mať premenopauzálna žena stanovenú diagnózu osteoporózy, ak má BMD Z-skóre nižšie ako -2 SD alebo T skóre nižšie ako -2,5 SD a chronické ochorenie asociované s poruchou kostného metabolizmu alebo anamnézu vertebrálnych alebo non-vertebrálnych nízkoenergetických fraktúr.
U týchto žien treba ďalej pátrať po príčinách osteoporózy, ktorá je zväčša spôsobená sekundárne buď rôznymi systémovými, často nepoznanými, ochoreniami alebo chronickou liečbou, ktorá zasahuje do kostného obratu. Len malý podiel prípadov tvorí idiopatická osteoporóza (5). Niektorí autori ešte samostatne vyčleňujú osteoporózu asociovanú s tehotenstvom a laktáciou a geneticky podmienenú osteoporózu. Prehľad možných príčin premenopauzálnej osteoporózy je uvedený v tabuľke 1.
Tab. 1. Možné príčiny premenopauzálenej osteoporózy (16) 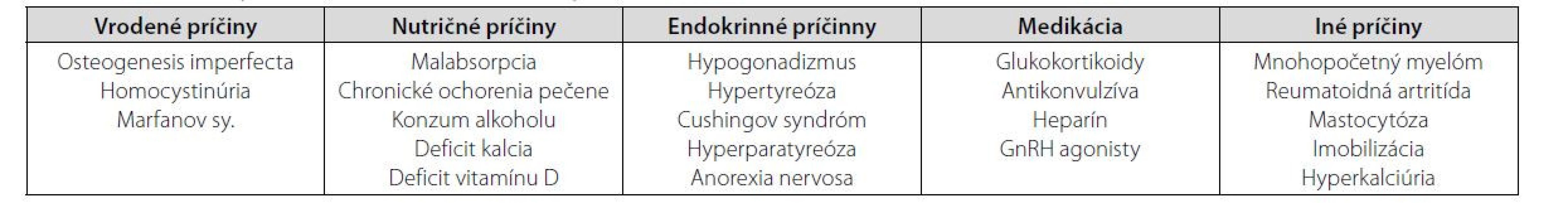
Rutinný skríning kostnej denzity u premenopauzálnych žien sa neodporúča. Medzi indikácie na vyšetrenie BMD u premenopauzálnych žien podľa ISCD patria (17):
prítomnosť nízkoenergetickej fraktúry,
prítomnosť ochorenia alebo stavu asociovaného s nízkou kostnou hmotou alebo stratou kostnej hmoty,
užívanie medikácie asociovanej s nízkou kostnou hmotou alebo jej stratou,
začatie špecifickej antiporotickej liečby,
monitorovanie efektivity liečby.
Podľa odporúčaní Americkej reumatologickej spoločnosti (ACR – American College of Rheumatology) by sa mala stanoviť hodnota BMD u pacientov mladších ako 40 rokov s vysokým rizikom fraktúry (anamnéza nízkoenergetickej fraktúry, malnutrícia, nízke BMI, hypogonadizmus, sekundárna hyperparatyreóza, ochorenie štítnej žľazy, rodinná anamnéza fraktúry krčka femuru, fajčenie, abúzus alkoholu) čím skôr po zahájení liečby glukokortikoidmi (z akejkoľvek indikácie), najneskôr však do 6-tich mesiacov od zahájenia liečby. Kontrolné BMD by sa u týchto pacientov malo realizovať každé 2–3 roky (18). Z hľadiska fraktúr treba zdôrazniť, že približne u 30 % všetkých žien v premenopauzálnom veku dôjde k vzniku fraktúry, ktorá je zvyčajne traumatická a málokedy viacpočetná. Tieto fraktúry sú asociované práve s nízkou dosiahnutou maximálnou kostnou hmotou u inak zdravých žien (19). Preto by sa nemalo realizovať denzitometrické vyšetrenie u každej ženy s fraktúrou, pokiaľ okolnosti vzniku nesvedčia pre nízkoenergetickú fraktúru (typicky definovanú ako fraktúra po páde z výšky približne rovnakej ako je výška danej osoby, prípadne menšej), nie sú frekventné (viac ako dve), alebo miesto fraktúry je pre mladú ženu netypické (stavce).
Každá premenopauzálna žena, u ktorej sa zistí nízka hodnota BMD, by mala byť následne prešetrená, rovnako ako premenopauzálne ženy s anamnézou nízkoenergetických fraktúr alebo zníženou kvalitou kostného tkaniva.
Diagnostický prístup začína vylúčením sekundárnych príčin osteoporózy a následne pokračuje zhodnotením možnej prítomnosti genetických porúch vedúcich k zvýšenej kostnej fragilite. Podľa údajov z literatúry u 44–90 % mladých pacientov s osteoporózou sa zistí sekundárna príčina a výrazný percentuálny rozdiel medzi jednotlivými štúdiami zrejme reflektuje viac alebo menej intenzívne diferenciálno - diagnostické úsilie (15).
V osobnej a rodinnej anamnéze sa treba cielene pýtať na výskyt ochorenia kostí, endokrinopatií, metabolických alebo chronických zápalových ochorení, na výskyt, počet a typ fraktúr, veľmi dôležitá je gynekologická anamnéza (nástup menarché, amenorea, tehotenstvo, laktácia), nemenej dôležité sú informácie o fyzickej aktivite, stravovacích návykoch, prípadných gastrointestinálych ťažkostiach, nesmieme zabudnúť na podrobnú liekovú anamnézu. V rámci fyzikálneho vyšetrenia je potrebné si všímať typické znaky ochorení/stavov vyvolávajúcic (sekundárnu) osteoporózu. Medzi fyzikálne nálezy, ktoré sú prítomné u madých ľudí s osteoporózou patria nízky vzrast a/alebo nízke BMI, hyperpigmentácia alebo znížená pilozita (hypogonadizmus), prítomnosť kyfózy, deformity končatín, známky zápalu kĺbov, hypermobilita kĺbov, modré skléry, zlá dentícia. V rámci laboratórneho skríningu by mala mať každá pacientka vyšetrené parametre minerálového metabolizmu (sérový vápnik korigovaný k hodnote albumínu, fosfát, vitamín D, alkalická fosfatáza), renálne funkcie (urea, kreatinín), hepatálne enzýmy, zápalové parametre (C-reaktívny proteín, sedimentáciu), krvný obraz a diferenciál, ďalej hodnotu glykémie nalačno, hodnotu tyreotropného hormónu, 24-hodinový zber moču na kalcium a vyšetrenie protilátok proti celiakii na vylúčenie prípadnej malabsorpcie, či imunofixáciu pre skríning paraproteinémie.
Na základe výsledkov anamnézy, fyzikálneho nálezu a laboratórnych skríningových vyšetrení možno v ďalšom kroku cielene doplniť iné špecifické vyšetrenia za účelom potvrdenia správnej diagnózy.
Vyšetrenie kostných markerov môže byť užitočné, ak je k dispozícii len jedno hodnotenie BMD, pretože môžu poskytnúť dodatočné informácie o možnej aktívnej strate kostí a vysokom obrate s inherentným zvýšeným rizikom zlomenín. Markery kostného obratu by sa ale nemali používať na prijímanie rozhodnutí o potrebe DXA skenu alebo ako indikácia na použitie liečby špecifickej pre kosti.
Veľmi sľubným nástrojom v odhade rizika fraktúry sa zdá byť trabekulárne kostné skóre (TBS – Trabecular Bone Score) (20). TBS je neinvazívna metóda, ktorá sa stanovuje z bežnej denzitometrickej snímky lumbálnej chrbtice na základe odtieňov šedej farby a dokáže kvantifikovať trabekulárnu kostnú mikroarchitektoniku. Pri premenopauzálnej osteoporóze dokáže pomôcť v prípade žien, ktoré utrpeli osteoporotickú fraktúru avšak BMD je vzhľadom na vek primeraná. Vtedy nám neadekvátne nízka hodnota TBS dokáže odhaliť sekundárnu osteoporózu pri subklinických (oligosymptomatických) formách ochorení, ako sú napríklad primárna hyperparatyreóza, hypertyreóza alebo diabetes mellitus 2. typu (21, 22).
Liečba premenopauzálnej osteoporózy
V súčasnosti nemáme k dispozícii jednoznačné odporúčania na liečbu premenopauzálnej osteoporózy. Chýbajú kvalitné štúdie u tejto skupiny pacientok, ktoré by jednoznačne preukázali priaznivý efekt špecifickej antiporotickej liečby na zníženie rizika fraktúr.
Všetky premenopauzálne ženy by mali byť svojimi ošetrujúcimi lekármi oboznámené o všeobecných odporúčaniach prevencie osteoporózy. Medzi základné opatrenia patria adekvátny príjem vápnika (1 000–1 500 mg elementárneho vápnika denne, preferenčne prijatého v potrave), adekvátny príjem vitamínu D3 v snahe udržať hodnoty 25-hydroxy-D3 približne na hodnote 30 ng/ml (75 nmol/l), pravidelná fyzická aktivita, vyvarovanie sa fajčeniu a excesívnemu príjmu alkoholu, udržiavanie normálnej hodnoty BMI bez extrémnych výkyvov telesnej hmotnosti (23).
Taktiež jednou z možných príčin nízkej kostnej hmoty u žien pred menopauzou je porucha cyklu, v takom prípade je nutná úzka spolupráca s gynekológom a liečebné gynekologické intervencie.
Antiporotiká by sa mali indikovať len v špecifikovaných prípadoch, pričom základom je, že liečba by sa mala podávať len nevyhnutne dlhú dobu. Bisfosfonáty sú vyhradené pre premenopauzálne ženy s anamnézou osteoporotických zlomenín a dokázanou stratou BMD. Najmä sú to premenopauzálne ženy užívajúce glukokortikoidy. V tehotenstve sú bisfosfonáty zaradené do kategórie C z hľadiska bezpečnosti, pretože sa hromadia v kostiach, prechádzajú placentou a hromadia sa aj v kostiach plodu (24). V doterajších štúdiách sa nepreukázal výrazný teratogénny efekt, ale výsledky zároveň poukazujú na zvýšené riziko neonatálnych komplikácií (25). Tieto údaje pochádzajú samozrejme z animálnych modelov, avšak u ľudí sa predpokladá rovnaký účinok. Počas používania bisfosfonátov by sa mala podporovať účinná antikoncepcia. Vzhľadom ale na to, že bisfosfonáty ostávajú v kostiach aj po ukončení liečby by sa pri premenopauzálnych ženách mali používať s veľkou opatrnosťou a ako posledná možnosť liečby u žien, ktoré môžu byť v budúcnosti tehotné (26). Celková dĺžka užívania týchto preparátov pri jednotlivých indikáciách u premenopauzálnych žien nie je zatiaľ jednoznačne stanovená. Napríklad pri dlhotrvajúcej liečbe bisfosfonátmi sa zvyšuje riziko zastavenia remodelácie kosti, môže dochádzať k predĺženému hojeniu kosti, s dĺžkou terapie bisfosfonátmi sa taktiež zvyšuje riziko atypických zlomenín femuru či osteonekrózy čeľuste (27, 28). Bisfosfonáty majú aj antianginózny efekt, čo môže viesť k redukcii množstva transkortikálnych ciev, ktoré zabezpečujú 80 % krvného zásobenia kosti, a tým takisto k ovplyvneniu hojenia kostného tkaniva (29).
U žien s karcinómom prsníka vedie onkologická liečba s GnRH analógmi, tamoxifénom a inhibítormi aromatázy k rozvoju hypogonadizmu a akcelerovanej strate kostnej hmoty (30). Podávanie kyseliny zoledrónovej (4 mg i. v. každých 6 mesiacov počas užívania chemoterapie) u premenopauzálnych žien (priemerný vek 44–46 rokov) s karcinómom prsníka, ktoré podstúpili adjuvantnú chemoterapiu viedlo k prevencii straty kostnej denzity v oblasti LS chrbtice v porovnaní s kontrolnou skupinou. V skupine žien liečených kyselinou zoledrónovou pretrvávala stabilná hodnota kostnej denzity viac ako 5 rokov, čo je v ostrom kontraste s kontrolnou skupinou, kde došlo k strmému poklesu kostnej denzity (31). Ďalšia štúdia s kyselinou zoledrónovou (4 mg i. v. každé 3 mesiace) viedla u žien s novodiagnostikovaným karcinómom prsníka (priemerný vek 42 rokov) po 12 mesiacoch liečby k stabilnej hodnote kostnej denzity na rozdiel od žien, ktorým bolo podávané placebo, a u ktorých došlo v sledovanom období k signifikantnej redukcii hodnoty kostnej denzity (32). Terapia rizedronátom (30 mg rizedronátu per os denne 2 týždne, potom 10 týždňov bez liečby, režim zopakovaný 8 × počas 2 rokov) viedla k signifikantnému nárastu kostnej denzity u žien s karcinómom prsníka v kontraste k signifikantnému zníženiu kostnej denzity u pacientok v kontrolnej skupine, ktorým bolo podávané placebo (33). Iná štúdia s rizedronátom (35 mg týždenne) u premenopauzálnych žien s karcinómom prsníka (priemerný vek 43 rokov) však neviedla po 2 rokoch terapie k signifikantnému zvýšeniu kostnej denzity v porovnaní s placebom (34). Vo všeobecnosti možno povedať, že podávanie kyseliny zoledrónovej u premenopauzálnych žien s karcinómom prsníka je podporené presvedčivejšími dôkazmi a bezpečnostný profil u týchto žien je porovnateľný s tým u žien po menopauze, i napriek frekventnejšiemu dávkovaniu (každých 3–6 mesiacov vs. raz ročne). Alternatívou je podávanie denosumabu, avšak chýbajú relevantné dáta v populácii premenopauzálnych žien (35).
Je málo údajov aj o účinkoch teriparatidu u premenopauzálnych žien, ale tento liek bol skúmaný u žien s amenoreou vyvolanou liekmi (36), žien s idiopatickou osteoporózou (37), žien s graviditou alebo zlomeninami súvisiacimi s laktáciou (38) a u žien s glukokortikoidmi indikovanou osteoporózou (39). Keďže dlhodobé osteoformačné účinky teriparatidu u mladých žien nie sú presne známe, použitie by malo byť vyhradené pre osoby s najvyšším rizikom zlomenín alebo pre osoby, ktoré majú opakujúce sa zlomeniny. U žien mladších ako 25 rokov sa pred zvážením liečby teriparatidom odporúča dokumentovať kostný vek uzavretými epifýzami, pretože je počas rastu kontraindikovaný. Všeobecný mamažment premenopauzálnej osteoporózy je na obrázku č. 1.
Obr. 1. Manažment premenopauzálnej osteoporózy 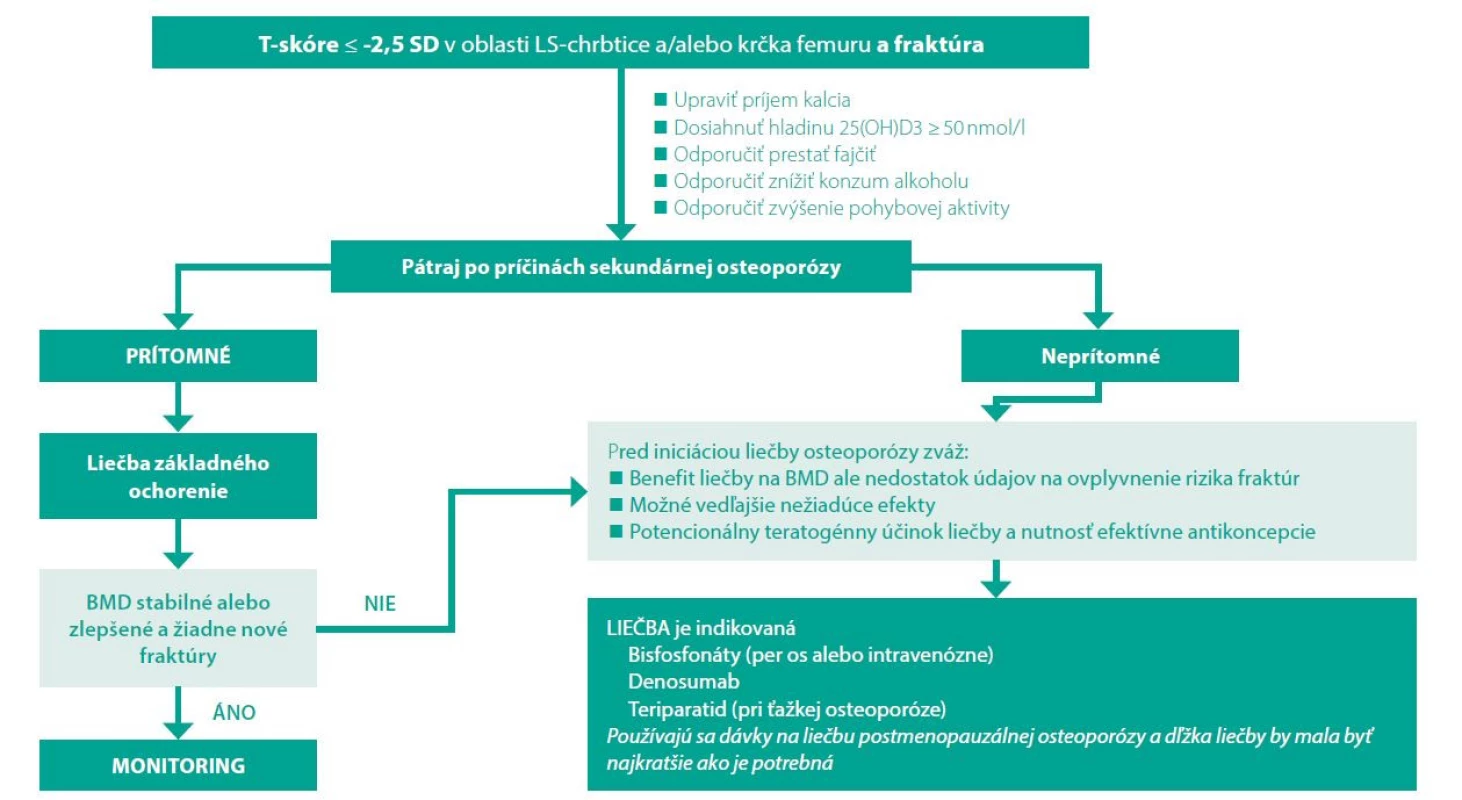
Najčastejšie príčiny sekundárnej osteoporózy u premenopauzálnych žien
Najčastejšou formou sekundárnej osteoporózy zapríčinenej liekmi je osteoporóza v dôsledku terapie glukokortikoidmi. Asi 30–40 % pacientov na chronickej liečbe glukokortikoidmi má rádiologický nález vertebrálnej fraktúry (efekt glukokortikoidov na kosť je výraznejšie vyjadrený na kvalite trabekulárnej kosti) (40). Efekt glukokortikoidov na kosť znázorňuje obrázok 2.
Obr. 2. Mechanizmus efektu glukortikoidov na kosť (41, 42) 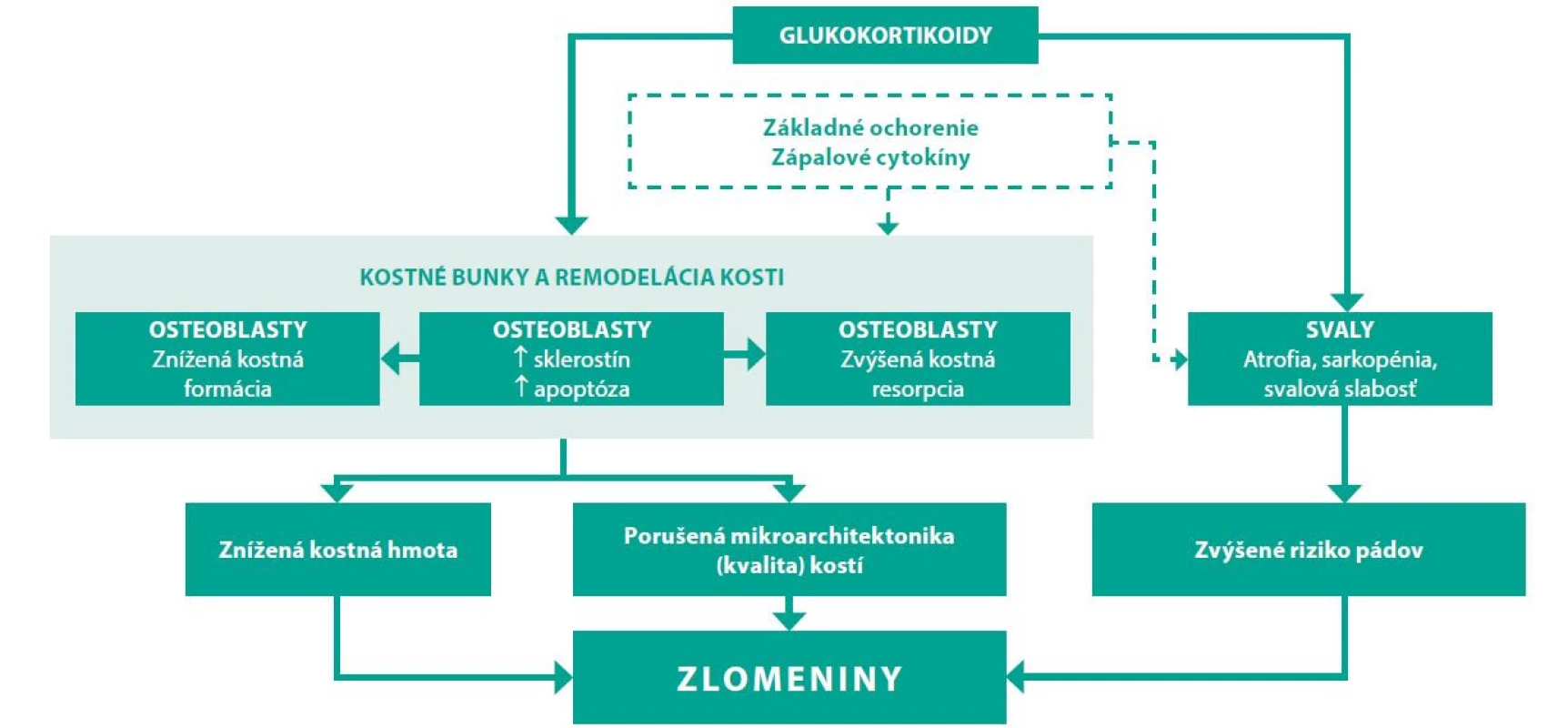
Negatívny účinok závisí od dávky glukokortikoidov a dĺžky podávania. Glukokortikoidmi indukovaná osteoporóza je však potenciálne reverzibilné ochorenie. Po ukončení kortikoterapie hodnota BMD stúpa a riziko fraktúr klesá a mladé ženy, ktoré sú síce často liečené vysokými dávkami glukokortikoidov, majú vo všeobecnosti väčší potenciál pre návrat kostnej denzity k východzej hodnote (43). Vo všeobecnosti možno odporučiť liečiť premenopauzálne ženy najnižšími možnými účinnými dávkami glukokortikoidov v čo najkratšom čase. Z hľadiska špecifickej antiporotickej farmakoterapie glukokortikoidmi indukovanej osteoporózy sú perorálne bisfosfonáty liekmi prvej voľby. Dôvodom je ich nízka cena, vyhovujúci bezpečnostný profil a relatívny dostatok dát o ich efektivite v redukcii rizika fraktúr. Podľa odporúčaní Americkej reumatologickej spoločnosti z roku 2017 všetky ženy v reprodukčnom veku mladšie ako 40 rokov so stredne vysokým až vysokým rizikom, ktoré zároveň neplánujú otehotnieť počas užívania špecifickej antiporotickej liečby a užívajú efektívnu antikoncepciu by mali byť liečené perorálnymi bisfosfonátmi. Stredne vysoké až vysoké riziko je v odporúčaniach definované nasledovne (18):
anamnéza nízkoenergetickej fraktúry; alebo
liečba glukokortikoidmi dlhšia ako 6 mesiacov dávkou väčšou než 7,5 mg denne u pacientok so Z skóre nižším ako -3 SD; alebo
strata kostnej denzity viac ako 10 % za rok u pacientok užívajúcich dávku glukokortikoidov väčšiu než 7,5 mg denne; alebo
vek viac ako 30 rokov a užívanie veľmi vysokých dávaok glukokortikoidov.
U žien s nízkym rizikom stačí podľa odporúčaní optimalizovať denný prísun kalcia, vitamínu D a edukovať pacientku o režimových opatreniach. Pokiaľ v konkrétnom prípade použitie perorálnych bisfosfonátov nie je možné, možno skúsiť liečbu teriparatidom. Liečbu denosumabom alebo vysokými dávkami intravenóznych bisfosfonátov možno pre nedostatok dát o ich bezpečnosti u týchto žien použiť iba v prípade veľmi vysokého rizika fraktúr, alebo u tých, u ktorých nemožno v liečbe z akéhokoľvek dôvodu využiť perorálne bisfosfonáty alebo teriparatid.
Nízka hmotnosť a nedostatočný nutričný príjem sa považujú za najdôležitejšie determinanty BMD u žien s anorexia nervosa (44). Klasický obraz anorektickej pacientky je kombinácia psychiatrických príznakov a somatických prejavov vrátane nízkej BMD, podvýživy, nízkeho telesného tuku a nízkej hmotnosti. Okrem toho významné hormonálne zmeny (hypogonadizmus/amenorea, hyperkorticizmus, nízka hladina testosterónu a rezistencia na rastový hormón s nízkym IGF-1) vedú k signifikantne nižšej BMD a vyššej fragilite kostí (45). Estrogénne prípravky sú v tejto skupine vo všeobecnosti neúčinné (46). Ukázalo sa, že alendronát aj rizedronát významne zvyšujú BMD u mladých žien s anorexiou. Základom liečby je aj v tomto prípade zvládnutie základného ochorenia.
Z ochorení štítnej žľazy má vplyv na kostný metabolizmus najmä neliečená hypertyreóza a supresná liečba tyroxínom u pacientok s karcinómom štítnej žľazy. Primerane substituovaná hypotyreóza k osteoporóze nevedie. Hlavnými príčinami hypertyreózy sú Gravesova - Basedowova choroba, toxická viacuzlová struma a toxická jednouzlová struma (toxický adenóm). U pacientok dochádza k zvýšeniu kostného obratu, laboratórne býva zvýšená kalciúria, supresia PTH, nižšie hladiny vitamínu D3, zvyšuje sa hladina markerov kostného obratu (21, 47). Podľa štandardných smerníc prevencie osteoporózy má byť BMD vyšetrená 1 až 2 roky od začiatku supresívnej liečby, s následnými kontrolami v jeden - až dvojročných intervaloch.
Účinok rastového hormónu (GH) na skelet je komplexný a nie je podmienený len GH a IGF (Insulin like Growth Factor), ale aj samotnými proteínmi viažucimi IGF v plazme, ktoré môžu mať buď inhibičný, alebo stimulujúci vplyv na pôsobenie IGF. Dospelí pacienti s deficitom rastového hormónu (GHD) majú znížený kostný obrat a kosť je mierne rezistentná na účinok parathormónu. Typický je obraz nízkoobratovej osteoporózy predilekčne v oblasti kortikálnej kosti. Účinok na kostnú denzitu sa potencuje, ak je súčasne pri deficite rastového hormónu prítomný deficit iných hormónov hypofýzy, najmä gonadotropínov (48–50). Liečba rastovým hormónom u pacientov s GHD viedla k zvýšeniu BMD, avšak až po dlhšom čase užívania (18–24 mesiacov).
Akromegália je ochorenie charakterizované nadprodukciou rastového hormónu, za ktorú je v 99 % prípadov zodpovedný nezhubný adenóm hypofýzy. Pre nadbytok rastového hormónu je typický vysoký kostný obrat s prevahou osteoresorpcie. Laboratórne sú vyššie sérové hladiny kalcia, fosforu a PTH. Údaje o vzniku osteoporózy u pacientov s akromegáliou sú kontroverzné. Podľa viacerých klinických štúdií je prítomný pokles BMD v oblasti lumbálnej chrbtice, kde je najväčšie zastúpenie trabekulárnej kosti. V oblasti chrbtice bývajú prítomné deformity a predpokladá sa aj vyššie riziko fraktúr. Naopak, v oblasti distálneho predlaktia, kde je prevaha kortikálnej kosti, bol pozorovaný nárast kostnej denzity (51). Vo všetkých týchto prípadoch je mimoriadne dôležité a prínosné vyšetrenie kostnej kvality pomocou TBS (52), resp. novšie metódy posúdenia rizika fraktúr ako je 3D-Shaper, ktoré včas dokážu odlíšiť pacienta s asymptomatickou vertebrálnou fraktúrou (53).
Vzťahu diabetes mellitus a riziku osteoporózy sa venuje samostatný článok v tomto čísle.
Osteoporóza asociovaná s tehotenstvom a laktáciou
Telo matky sa počas tehotenstva a kojenia adaptuje na zvýšený výdaj a spotrebu kalcia asociovaný s potrebami plodu a s neskoršou laktáciou prostredníctvom zvýšenej kostnej resorpcie a zníženej renálnej exkrécie kalcia. Spotreba kalcia počas tehotenstva sa zvyšuje približne o 300–500 mg denne a počas laktácie približne o 210 mg denne. WHO odporúča tehotným ženám príjem 1 500–2 000 mg elementárneho kalcia denne od 20. gestačného týždňa až do konca gravidity (54). Denná doporučená dávka vitamínu D je minimálne 600 IU, v prípade deficitu vitamínu D dávka 150–2 000 IU (55). Suplementácia kalcia však u postpartálnych zdravých žien neviedla v porovnaní s placebom k prevencii straty kostnej denzity počas laktácie a bola asociovaná iba s miernym vzostupom kostnej denzity po ukončení dojčenia (56, 57). Tehotenstvo a laktácia sú asociované s poklesom v kostnej denzite hlavne trabekulárnej kosti, ktorý sa napraví zvyčajne do 6–12 mesiacov po skončení dojčenia. Osteoporóza asociovaná s tehotenstvom a laktáciou je zriedkavé ochorenie, ktoré sa môže manifestovať vo forme osteoporózy axiálneho skeletu (pregnancy spinal osteoporosis – PSO) alebo prechodnej osteoporózy bedrového kĺbu (transient osteoporosis of the hip during pregnancy – OHP). Podávanie bisfosfonátov (v priemere počas 24 mesiacov) alebo teriparatidu (počas 18 mesiacov) bolo u týchto žien asociované so zvýšením BMD, ale nie s redukciou počtu fraktúr (38, 58, 59). Navyše uvedené štúdie sú realizované na veľmi malej vzorke žien (9, resp. 3) a treba podotknúť, že hodnota BMD po ukončení laktácie u žien typicky vzrastie a nie je jasné, či v týchto štúdiách mala špecifická antiporotická liečby vôbec nejaký efekt, a či nešlo iba o prirodzený nárast BMD po ukončení laktácie. Ženám v reprodukčnom veku s diagnostikovanou osteoporózou možno ako ďalšiu terapeutickú možnosť doporučiť vyhnúť sa kojeniu.
Tab. 2. Zmeny BMD počas gravidity (60) 
Idiopatická osteoporóza
Pred tým, než stanovíme diagnózu idiopatickej osteoporózy u premenopauzálnej ženy, musíme sa uistiť, že sme pacientku podrobili extenzívnemu prešetrovaniu a jednoznačne sme vylúčili všetky príčiny sekundárnej osteoporózy. Začatie špecifickej antiporotickej liečby bez terapeutického ovplyvnenia možnej sekundárnej príčiny je postup non-lege artis. U mnohých žien s idiopatickou osteoporózou možno uplatniť všeobecné odporúčania za účelom zabránenia negatívnej bilancie vápnika. Štúdia na 16 ženách s diagnózou idiopatickej osteoporózy ukázala, že adekvátny príjem kalcia, vitamínu D, zvýšenie fyzickej aktivity a vyhýbanie sa fajčeniu viedlo k signifikantnému nárastu BMD v oblasti lumbálnej chrbtice aj femuru, pričom sa počas sledovaného obdobia nevyskytla žiadna fraktúra (61). O efektivite a bezpečnosti liečby bisfosfonátmi alebo teriparatidom u mladých premenopauzálnych žien s idiopatickou osteoporózou nemáme dostatok informácií.
Záver
Nízka hodnota BMD u premenopauzálnych žien nie je asociovaná s rovnakým rizikom fraktúry ako u žien po menopauze. Neexistuje jednoznačná zhoda v definovaní osteoporózy u premenopauzálnych žien a jej diagnostika nemôže byť postavená iba na základe denzitometrického vyšetrenia. Väčšina prípadov osteoporózy u premenopauzálnych žien je v dôsledku identifikovateľnej sekundárnej príčiny, ktorej správna diagnostika a liečba môže viesť aj k zlepšeniu kvality kosti. Až po dôslednom vylúčení všetkých príčin sekundárnej osteoporózy môžeme stanoviť diagnózu idiopatickej osteoporózy. Základom v manažmente je prevencia, a preto by všetky premenopauzálne ženy, najmä s ochoreniami vedúcimi k poklesu kostnej hmoty, mali byť edukované o základných odporučeniach prevencie osteoporózy. Antiporotická liečba nemusí fungovať rovnako u pre - aj postmenopauzálnych žien, najmä vo vzťahu k redukcii rizika fraktúr. Platí, že u premenopauzálnych žien, u ktorých je známa sekundárna príčina osteoporózy sa treba pri liečbe zamerať predovšetkým na liečbu základného ochorenia. Začatie špecifickej farmakologickej liečby treba posudzovať individuálne hlavne u žien s prítomnými fraktúrami, u žien s dokumentovanou progredujúcou stratou kostnej hmoty napriek adekvátnej liečbe základného ochorenia alebo pri extrémne nízkej hodnote BMD (T alebo Z-skóre menej ako -3 SD).
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Peter Jackuliak, PhD., MPH
V. interná klinika LF UK a UNB Ružinovská 6, 826 06 Bratislava
Cit. zkr: Vnitř Lék 2021; 67(5): 284–290
Článek přijat redakcí: 18. 6. 2021
Článek přijat po recenzích: 28. 6. 2021
Zdroje
1. Kanis JA et al. Algorithm for the management of patients at low, high and very high risk of osteoporotic fractures. Osteoporosis International, 2020; 31(1): p. 1–12.
2. Rozenberg S et al. How to manage osteoporosis before the age of 50. Maturitas, 2020; 138: p. 14–25.
3. Khan AA, Syed Z. Bone densitometry in premenopausal women: synthesis and review. J Clin Densitom, 2004; 7(1): p. 85–92.
4. Liu JM et al. IGF-1 as an early marker for low bone mass or osteoporosis in premenopausal and postmenopausal women. J Bone Miner Metab, 2008; 26(2): p. 159–164.
5. Cramarossa G. et al. Prevalence and associated factors of low bone mass in adults with systemic lupus erythematosus. Lupus, 2017; 26(4): p. 365–372.
6. Sharma M, et al. Lean Mass and Disease Activity are the Best Predictors of Bone Mineral Loss in the Premenopausal Women with Rheumatoid Arthritis. Indian J Endocrinol Metab, 2018; 22(2): p. 236–243.
7. Rahaman SH et al. Bone Health in Patients with Cushing’s Syndrome. Indian J Endocrinol Metab, 2018; 22(6): p. 766–769.
8. Dutta D et al. Occurrence & predictors of osteoporosis & impact of body composition alterations on bone mineral health in asymptomatic pre-menopausal women with HIV infection. The Indian journal of medical research, 2018; 147(5): p. 484–495.
9. Cairoli E et al. Bone involvement in young adults with cystic fibrosis awaiting lung transplantation for end-stage respiratory failure. Osteoporos Int, 2019. 30(6): p. 1255–1263.
10. Martínez-Morillo MD. Grados, and S. Holgado, Premenopausal Osteoporosis: How to Treat? Reumatología Clínica (English Edition), 2012; 8(2): p. 93–97.
11. Weaver CM et al. The National Osteoporosis Foundation’s position statement on peak bone mass development and lifestyle factors: a systematic review and implementation recommendations. Osteoporos Int, 2016; 27(4): p. 1281–1386.
12. Schousboe JT et al. Executive summary of the 2013 International Society for Clinical Densitometry Position Development Conference on bone densitometry. J Clin Densitom, 2013; 16(4): p. 455–466.
13. Shepherd JA et al. Executive Summary of the 2015 ISCD Position Development Conference on Advanced Measures From DXA and QCT: Fracture Prediction Beyond BMD. J Clin Densitom, 2015; 18(3): p. 274–286.
14. Greendale GA et al. Bone mineral density loss in relation to the final menstrual period in a multiethnic cohort: results from the Study of Women’s Health Across the Nation (SWAN). J Bone Miner Res, 2012; 27(1): p. 111–118.
15. Ferrari S et al. Osteoporosis in young adults: pathophysiology, diagnosis, and management. Osteoporos Int, 2012; 23(12): p. 2735–2748.
16. Lewiecki EM et al. Proceedings of the 2016 Santa Fe Bone Symposium: New Concepts in the Management of Osteoporosis and Metabolic Bone Diseases. Journal of Clinical Densitometry, 2017; 20(2): p. 134–152.
17. Lewiecki EM et al. International Society for Clinical Densitometry 2007 Adult and Pediatric Official Positions. Bone, 2008; 43(6): p. 1115–1121.
18. Buckley L et al. 2017 American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. Arthritis Rheumatol, 2017; 69(8): p. 1521–1537.
19. Ferrari SL et al. Childhood fractures are associated with decreased bone mass gain during puberty: an early marker of persistent bone fragility? J Bone Miner Res, 2006; 21(4): p. 501–507.
20. Greendale GA et al. Premenopausal and early postmenopausal trabecular bone score (TBS) and fracture risk: Study of Women’s Health Across the Nation (SWAN). Bone, 2020; 140: p. 115543.
21. Kužma M et al. High Serum Fractalkine is Associated with Lower Trabecular Bone Score in Premenopausal Women with Graves’ Disease. Horm Metab Res, 2018; 50(8): p. 609–614.
22. Jackuliak P et al. Good long-term glycemic compensation is associated with better trabecular bone score in postmenopausal women with type 2 diabetes. Physiol Res, 2019; 68(Suppl 2): p. S149–s156.
23. Ross AC et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol M et al. Effects of the bisphosphonate, alendronate, on parturition in the rat. Toxicol Appl Pharmacol, 1993; 121(2): p. 217–223.
24. Sokal A et al. Pregnancy and newborn outcomes after exposure to bisphosphonates: a case-control study. Osteoporos Int, 2019; 30(1): p. 221–229.
25. Cohen A, Shane E. Evaluation and management of the premenopausal woman with low BMD. Current osteoporosis reports, 2013; 11(4): p. 276–285.
26. Fink HA et al. Long-Term Drug Therapy and Drug Discontinuations and Holidays for Osteoporosis Fracture Prevention: A Systematic Review. Ann Intern Med, 2019; 171(1): p. 37–50.
27. Wotton CJ et al. Use of oral bisphosphonates and risk of hospital admission with osteonecrosis of the jaw: Large prospective cohort study in UK women. Bone, 2019. 124: p. 69–74.
28. Wood J et al. Novel antiangiogenic effects of the bisphosphonate compound zoledronic acid. J Pharmacol Exp Ther, 2002; 302(3): p. 1055–1061.
29. Taxel P et al. Cancer Treatment-Induced Bone Loss in Women With Breast Cancer and Men With Prostate Cancer. Journal of the Endocrine Society, 2018; 2(7): p. 574–588.
30. Gnant M et al. Adjuvant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer: 62-month follow-up from the ABCSG-12 randomised trial. Lancet Oncol, 2011; 12(7): p. 631–641.
31. Hershman DL et al. Prevention of bone loss by zoledronic acid in premenopausal women undergoing adjuvant chemotherapy persist up to one year following discontinuing treatment. J Clin Endocrinol Metab, 2010; 95(2): p. 559–566.
32. Delmas PD et al. Bisphosphonate risedronate prevents bone loss in women with artificial menopause due to chemotherapy of breast cancer: a double-blind, placebo-controlled study. J Clin Oncol, 1997; 15(3): p. 955–962.
33. Hines SL et al. Phase III randomized, placebo-controlled, double-blind trial of risedronate for the prevention of bone loss in premenopausal women undergoing chemotherapy for primary breast cancer. J Clin Oncol, 2009; 27(7): p. 1047–1053.
34. Bone HG et al. Effects of Denosumab on Bone Mineral Density and Bone Turnover in Postmenopausal Women. The Journal of Clinical Endocrinology & Metabolism, 2008; 93(6): p. 2149–2157.
35. Finkelstein JS et al. Prevention of estrogen deficiency-related bone loss with human parathyroid hormone-(1-34): a randomized controlled trial. Jama, 1998; 280(12): p. 1067–1073.
36. Cohen A et al. Teriparatide for idiopathic osteoporosis in premenopausal women: a pilot study. J Clin Endocrinol Metab, 2013; 98(5): p. 1971–1981.
37. Choe EY et al. Effect of teriparatide on pregnancy and lactation-associated osteoporosis with multiple vertebral fractures. J Bone Miner Metab, 2012; 30(5): p. 596–601.
38. Langdahl BL et al. Teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: an analysis by gender and menopausal status. Osteoporos Int, 2009; 20(12): p. 2095–2104.
39. Curtis JR et al. Population-based assessment of adverse events associated with long - -term glucocorticoid use. Arthritis Rheum, 2006; 55(3): p. 420–426.
40. Rizzoli R, Biver E. Glucocorticoid-induced osteoporosis: who to treat with what agent? Nat Rev Rheumatol, 2015; 11(2): p. 98–109.
41. Payer J, Brazdilova K, Jackuliak P. Management of glucocorticoid-induced osteoporosis: prevalence, and emerging treatment options. Drug Healthc Patient Saf, 2010; 2: p. 49–59.
42. Van Staa TP et al. Use of oral corticosteroids and risk of fractures. J Bone Miner Res, 2000; 15(6): p. 993–1000.
43. Miller KK et al. Determinants of skeletal loss and recovery in anorexia nervosa. J Clin Endocrinol Metab, 2006; 91(8): p. 2931–2937.
44. Tichá Ľ et al. Porucha kostného metabolizmu pri mentálnej anorexii Čes-slov Pediat., 2016; 71(5–6): p. 287–292.
45. Sim LA et al. Effect on bone health of estrogen preparations in premenopausal women with anorexia nervosa: a systematic review and meta-analyses. Int J Eat Disord, 2010; 43(3): p. 218–225.
46. Baqi L et al. Thyrotropin versus thyroid hormone in regulating bone density and turnover in premenopausal women. Endocr Regul, 2010; 44(2): p. 57–63.
47. Kuzma M, Payer J. (Growth hormone deficiency, its influence on bone mineral density and risk of osteoporotic fractures). Cas Lek Cesk, 2010; 149(5): p. 211–216.
48. Kužma M et al. (Issues related to secondary osteoporosis associated with growth hormone deficiency in adulthood). Vnitr Lek, 2017; 63(10): p. 658–661.
49. Kužma M et al. Impact of the growth hormone replacement on bone status in growth hormone deficient adults. Growth Horm IGF Res, 2014; 24(1): p. 22–28.
50. Kužma M et al. Kvalita kosti u akromegalikov. Vnitřní lékařství, 2017; 63(9): p. 589–592.
51. Kužma M et al. Trabecular Bone Score Change Differs with Regard to 25(OH)D Levels in Patients Treated for Adult-Onset Growth Hormone Deficiency. Endocrine Practice, 2016; 22(8): p. 951–958.
52. Kužma M et al. Non-invasive DXA-derived bone structure assessment of acromegaly patients: a cross-sectional study. Eur J Endocrinol, 2019; 180(3): p. 201–211.
53. World Health, O., Guideline: calcium supplementation in pregnant women. 2013, Geneva: World Health Organization.
54. Holick MF et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab, 2011; 96(7): p. 1911–1930.
55. Kalkwarf HJ et al. The effect of calcium supplementation on bone density during lactation and after weaning. N Engl J Med, 1997; 337(8): p. 523–528.
56. Scioscia MF et al. Severe Bone Microarchitecture Impairment in Women With Pregnancy and Lactation-Associated Osteoporosis. J Endocr Soc, 2021; 5(5): p. bvab031.
57. O’Sullivan SM et al. Bisphosphonates in pregnancy and lactation-associated osteoporosis. Osteoporos Int, 2006; 17(7): p. 1008–1012.
58. Cerit ET, Cerit M. A case of pregnancy and lactation associated osteoporosis in the third pregnancy; robust response to teriparatide despite delayed administration. Bone reports, 2020; 13: p. 100706–100706.
59. Recker RR et al. Bone gain in young adult women. Jama, 1992; 268(17): p. 2403–2408.
60. Peris P et al. Bone mineral density evolution in young premenopausal women with idiopathic osteoporosis. Clin Rheumatol, 2007; 26(6): p. 958–961.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2021 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Endokrinológia, zaostrené na osteoporózu
- Kostní nemoc při selhání ledvin – renální i non-renální komponenta
- Výskyt osteoporózy u pacientov na substitučnej liečbe hypokorticizmu u Addisonovej choroby
- Osteoporóza u mužů: podceňovaná a neléčená
- Osteoporóza u premenopauzálnych žien
- Osteoporóza u pacientov s diabetes mellitus
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Role zánětu a imunity u aterosklerózy a možné způsoby jejich ovlivnění
- Karcinoidový syndróm – diagnostika a manažment
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteoporóza u premenopauzálnych žien
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Karcinoidový syndróm – diagnostika a manažment
- Osteoporóza u mužů: podceňovaná a neléčená
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



