FDG-PET/CT dokumentované vymizení nekrobiotického xantogranulomu při potlačení tvorby monoklonálního imunoglobulinu bortezomibem, lenalidomidem a dexametazonem Popis případu a přehled literatury o léčbě nekrobiotického xantogranulomu
Complete remission of necrobiotic xanthogranuloma after disappearance of monoclonal immunoglobulin induced by bortezomib, lenalidomid and dexamethasone
Necrobiotic xanthogranuloma (NXG) is a rare chronic condition, belonging to the group non-Langerhans cell histiocytoses, which is relevant due to the possibility of extracutaneous involvement and association with systemic diseases, particularly monoclonal gammopathy, MGUS and multiple myeloma. The case reported here NXG was diagnosed after 1 years of evolution in patient with asymptomatic multiple myeloma. After treatment with bortezomib, lenalidomid and dexamethasone, there was evident abrupt decrease of monoclonal immunoglobulin to not measurable level (complete remission of multiple myeloma) and in the same time was evident disappearance of cutaneous and hepatic lesions of NXG on FDG-PET/CT. The etiopathogenetic association of monoclonal immunoglobulin with NXG is documented in this case report with disappearance of NXG in the time of disappearance of monoclonal immunoglobulin.
Keywords:
Multiple myeloma – monoclonal gammopathy – necrobiotic xanthogranuloma
Autori:
Zdeněk Adam 1; Luděk Pour 1; Zdeněk Řehák 2; Klára Dvořáková 3; Renata Koukalová 2; Josef Feit 3; Petr Kameník 4; Marta Krejčí 1; Martin Štork 1; Martin Krejčí 1; Viera Sandecká 1; Ivanna Boichuk 1; Zdeněk Král 1
Pôsobisko autorov:
Interní hematologická a onkologická klinika LF MU a FN Brno
1; Oddělení nukleární medicíny Masarykův onkologický ústav Brno
2; Patologicko-anatomické oddělení, Nemocnice Jihlava
3; Interní oddělení Nemocnice Jihlava
4
Vyšlo v časopise:
Vnitř Lék 2021; 67(6): 352-356
Kategória:
Kazuistiky
Súhrn
Nekrobiotický xantogranulom je vzácné chronické onemocnění, řazené do skupiny non-Langerhans cell histiocytóz. Může mít závažné mimokožní příznaky. Obvykle je asociováno s monoklonální gamapatií typu MGUS nebo s mnohočetným myelomem. V textu popisovaný případ nekrobiotického xantogranulomu byl diagnostikován rok po stanovení diagnózy asymptomatického myelomu. Po léčbě složené z bortezomibu, lenalidomidu a dexametazonu bylo dosaženo kompletní remise mnohočetného myelomu, což znamená, že byla potlačena tvorba monoklonálního imunoglobulinu, takže nebyl detekovatelný ani imunofixační elektroforézou a v téže době vymizela kožní i jaterní ložiska nekrobiotického xantogranulomu na FDG-PET/CT zobrazení. Tento případ dokumentuje kauzální souvislost mezi monoklonálním imunoglobulinem a nekrobiotickým xantogranulomem.
Klíčová slova:
mnohočetný myelom – monoklonální gamapatie – nekrobiotický xantogranulom
Úvod
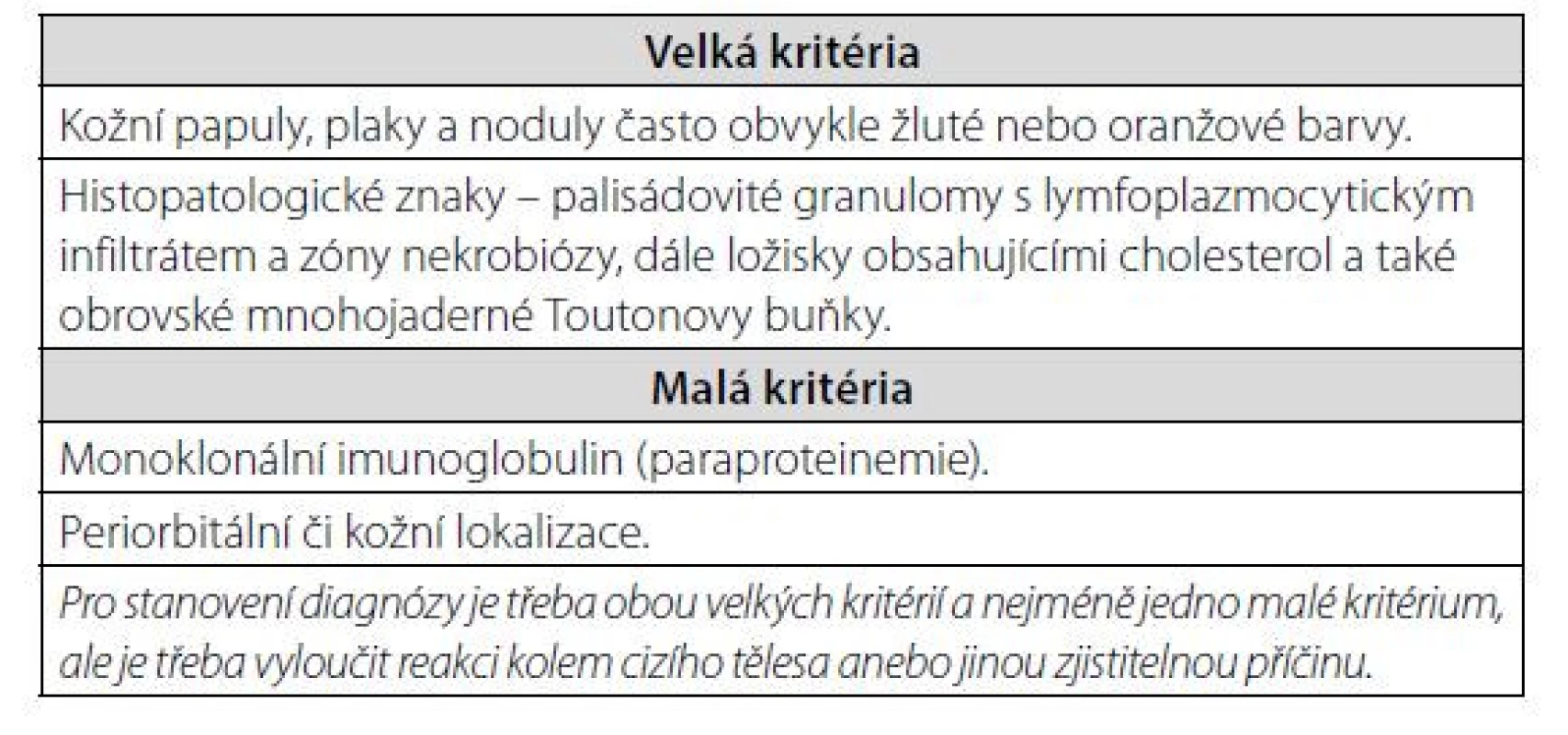
Nekrobiotický xantogranulom (NXG) je vzácným, velmi pravděpodobně reaktivním histiocytárním onemocněním. Přítomnost monoklonálního imunoglobulinu (M-Ig) je popsána u velké většiny nemocných, ale přesná etiopatogenetická souvislost M-Ig s tímto nálezem není známa. Nicméně souvislost mezi NXG a M-Ig potvrzuje tento případ mnohočetných kožních, ale i hepatálních ložisek NXG, která vymizela při léčbě, vedoucí k poklesu M-Ig pod měřitelné hodnoty. Vývoj ložisek NXG byl sledován pomocí opakovaných FDG-PET/CT vyšetření. Tento popis případu může být stimulem pro vyvinutí maximální snahy o dosažení kompletní remise monoklonální gamapatie u pacientů s NXG. Nekrobiotický xantogranulom je uveden v histologické klasifikaci krevních chorob ve skupině histiocytárních onemocnění. V roce 2020 se poprvé objevila v odborné literatuře (1) kritéria této nemoci, která uvádí tabulka 1.
Popis případu
Muž, narozený 1957, byl do naší ambulance odeslán v dubnu roku 2019 z Hematologického oddělení nemocnice Jihlava, kam se dostal pro vysokou hodnotu celkové bílkoviny, která vždy budí podezření na zvýšenou koncentraci imunoglobulinů, ať již polyklonálních, nebo monoklonálního imunoglobulinu. V tomto případě se jednalo o vysokou koncentraci M-Ig typu IgG kappa v séru, dosahující hodnoty 32 g/l. V trepanobiopsii bylo popsáno 2–20 % klonálních plazmocytů. Vstupní rentgenové vyšetření skeletu neprokázalo žádné osteolytické změny, typické pro mnohočetný myelom. Koncentrace hemoglobinu byla 141 g/l a hodnoty kreatininu a kalcia v séru byly v normě. Diagnóza byla uzavřena jako asymptomatický myelom.
V rámci kompletnosti pohledu bylo v červnu 2019 provedeno první FDG-PET/CT vyšetření, které se na první pohled jevilo být bez patologického nálezu. Byla popsána mírně zvýšená akumulace fluorodeoxyglukózy (FDG) v retromandibulární uzlině vpravo a zvýšená akumulace FDG v podkoží pravého stehna, ale průměr ložiska byl menší než 1 cm. Kožní ložisko bylo považováno za drobnou kožní zánětlivou reakci a nijak jsme jej nekontrolovali. Ale jak se při dalším vyšetření ukázalo, šlo zřejmě o počínající nekrobiotický xantogranulom. Zobrazená retromandibulární uzlina nebyla ale tak velká, aby byla dobře hmatná.
Druhé FDG-PET/CT vyšetření bylo provedeno skoro o rok později, v květnu 2020, a toto vyšetření již přineslo překvapivý patologický nález několika ložisek zvýšené akumulace, ale ne v kostech. Byla popsána zvětšená jugulární uzlina vpravo velikosti 15 mm zvýšeně akumulující FDG (SUVmax 3,73). Dále pak byla v low-dose CT vyšetření popsána zvětšená játra. Pravý lalok kraniokaudálně měřil 16 cm a měl nehomogenní strukturu. Slezina se oproti přechozímu vyšetření také zvětšila. Na skeletu byla zřetelná osteoporóza a prolomená horní krycí ploška těla obratle L2. V kůži a podkoží femorální oblasti vpravo laterálně byl již na low-dose CT zřetelný infiltrát 24 x 24 x 12 mm. V PET obraze tohoto vyšetření bylo překvapivě více ložisek s patologickou akumulací FDG v obou lalocích jater s maximem kaudálně (SUVmax do výše 6,5). Izolovaně aktivní ložisko povrchově laterálně na pravém stehně intenzivně akumulovalo FDG, takže hodnotaSUVmax dosáhla 12,15. Biochemické vyšetření v té době dokumentovalo normální bilirubin, z jaterních enzymů pouze AST bylo zcela nepatrně vyšší 1,01 μkat/l.
Domluvili jsme přešetření těchto ložisek na Interním oddělení Nemocnice Jihlava. V plánu bylo odebrat histologii z podkožního ložiska a případně provést biopsii ložiska v játrech. Odběr histologie proběl v nemocnici Jihlava a stejně tak i první histologické hodnocení podkožního ložiska.
Patoložka v excizi z kožního ložiska popsala rozsáhlý granulomatózní zánět, zasahující do tukové tkáně, s četnými velkými mnohojadernými histiocyty, se septy místy fibrotizujícími, místy se znakem nekrobiózy, ale bez pěnitých buněk. Plazmocyty byly jen místy a byly dle barvení kappa a lambda řetězců polyklonální. Histologický závěr: nekrobiotický xantogranulom bez pěnitých buněk.
Tenkojehlová biopsie z jater nepřinesla diagnostický závěr. Ve FN Brno se zvažoval operační odběr vzorků z jater na histologii, ale chirurgové jej vyhodnotili jako extrémně rizikový a jeho provedení nedoporučili.
V listopadu 2020 se pacient i přes všechny tyto nálezy cítil stále zdráv, neměl pocit, že by byl svoji nemocí nějak omezován, jedinou novinkou byla přítomnost tlaku v pravém podžebří, když ležel v posteli, což dříve nemíval.
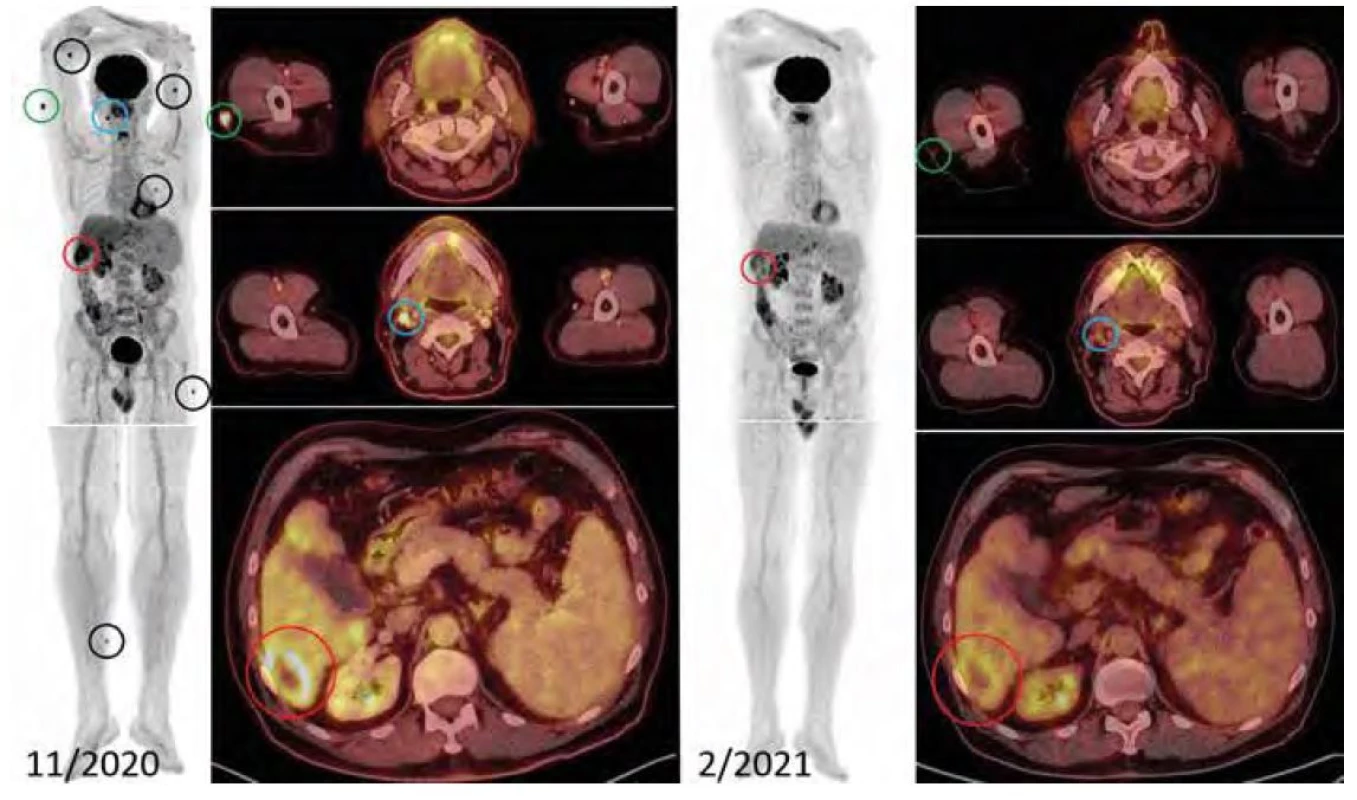
Třetí FDG-PET/CT vyšetření, jehož cílem bylo dokumentovat dynamiku procesu vzhledem ke zcela nejasnému vývoji, bylo provedeno v listopadu 2020. Toto vyšetření zjistilo, že akumulace v jugulární uzlině na krku vpravo se zvýšila, oproti předchozí hodnotě 3,73 SUVmax dosáhla hodnoty 7,72. V játrech se objevila nehomogenní struktura, byla patrna progrese hypodenzních ložisek a velké ložisko v segmentu S6 mělo nyní i centrální nekrózu. Průměr ložiska v S6 segmentu byl 5 cm, na předchozím vyšetření byl průměr jen 3,5 cm. Hepatosplenomegalie byla stacionární, pankreas a ledviny bez expanze. Na povrchu těla v kůži a podkoží byla nalezena vícečetná patologická ložiska ve shodě s PET zobrazením největší na proximálním předloktí, vpravo, laterálně na paži vpravo dále v polovině levé paže a další ložisko na DKK laterálně na pravém stehně a distální třetině pravého lýtka mediálně, všechna do průměru 1 cm. V PET obraze byla zřetelná splývající ložiska v játrech, největší v segmentu S6, toto ložisko bylo aktivní v povrchovém lemu a neaktivní centrálně (nejspíše nekrotizace).
Při porovnání s předchozím vyšetřením v květnu 2020 se míra akumulace FDG zvýšila v absolutních hodnotách SUVmax. Dále v játrech přibyly nehomogenity v rozložení farmaka, ale bez přesvědčivých ložisek. Povrchově v kůži a podkoží bylo popsáno 5 hypermetabolických ložisek, na proximálním předloktíSUVmax10,03, laterálně na paži vpravo SUVmax 20,64, v polovině levé paže SUVmax15,7, dorsálně na hrudníku SUVmax 4,48 a další ložiska na dolních končetinách. Tedy oproti květnu se zvětšila četnost kožních a podkožních ložisek a zvýšila se akumulace FDG v nich. Tato zřetelná progrese si vyžádala zahájení léčby. Překvapivě, i když byl patologický nález na FDG-PET/CT v játrech, bilirubin i jaterní enzymy byly v mezích normy. A taktéž cholesterol a triglyceridy byly v normě.
Vzhledem k etiologické vazbě mezi NXG a monoklonální gamapatií byla koncem listopadu 2020 zahájena léčba kombinací lenalidomidu, bortezomibu a dexametazonu. Bortezomib a dexametazon dostával klasicky 1x týdně a lenalidomid 25 mg vždy 21 dní s následující týdenní pauzou.
Čtvrtý cyklus byl ukončen v březnu 2021. Pátý cyklus měl být zahájen koncem března 2021, jenže i přes všechna preventivní opatření ochořel onemocněním covid-19 způsobeným virem SARS-CoV-2, který se do ČR dostal v rámci globální pandemie z Číny. Na kovidovém oddělení nemocnice Jihlava dostal remdesivir a rekonvalescentní plazmu. Po této léčbě se zlepšil, byl propuštěn a pokračoval v započaté léčbě. Vzhledem k dosažení kompletní remise mnohočetného myelomu byla po sedmi cyklech ukončena léčba bortezomibem a dále pokračuje jen dlouhodobá perorální léčba lenalidomidem a dexametazonem. Vývoj monoklonálního imunoglobulinu ilustruje graf 1.

Kontrolní FDG-PET/CT bylo provedeno v únoru počátkem čtvrtého cyklu (měsíce) léčby. Při srovnání s vyšetřením z listopadu 2020 je vidět parciální regrese ložiska v játrech, prakticky úplná morfometabolická regrese minule aktivní jugulární uzliny a úplná morfometabolická regrese všech patologických infiltrátů kůže a podkoží. Tedy velmi rychlá léčebná odpověď, podobně jak rychlý byl pokles monoklonálního imunoglobulinu, jehož vývoj uvádí graf 1.
Diskuze
Předložený článek navazuje na předchozí publikace věnované této tematice (2–6). Jde o histiocytární onemocnění, které je ve většině případů diagnostikováno u pacientů s M-Ig, z čehož plyne, že M-Ig zde má něco společného s etiologií a patofyziologií vzniku NXG. Etiopatogenezi zkoumal Raphael Szalat a své výzkumy zveřejnil ve dvou publikacích. Dospěl k závěru, že příčinou je tvorba imunokomplexů a interakce mezi M-Ig a lipoproteiny, Ve svých publikacích uvádí jako důkaz etiopatogenetické souvislosti NXG a monoklonální gamapatie ústup NXG při potlačení tvorby M-Ig (7, 8).
Souvislost NXG a monoklonální gamapatií potvrzuje i naše pozorování, protože když M-Ig vymizel, tak vymizela současné i ložiska NXG. Podobný, poměrně rychlý ústup kožní patologie u pacienta po vymizení M-Ig po léčbě jsme pozorovali u jiné kožní patologie, související s M-Ig, u skleromyxedému. Vymizení M-Ig vedlo k vymizení skleromyxedému a recidiva gamapatie vedla k jeho obnovení. A stejně tak u pacientky s IgA-pemphigem a mnohočetným myelomem typu IgA vymizely kožní morfy po dosažení kompletní remise po léčbě a vrátily se v době recidivy. M-Ig může zřejmě dle zaměření své antigenní determinanty indukovat různá kožní, případně i jiná onemocnění.
Léčba NXG nemá vlastní pravidla charakteru léčebných doporučení, k dispozici je pouze několik přehledových prací, které vyšly v posledních pěti letech (1, 9–13). V poslední přehledové publikaci z roku 2020 je analyzováno celkem 235 pacientů s NXG z několika velkých nemocnic v USA (1).
Z těchto 235 pacientů mělo 193 (82,1 %) monoklonální imunoglobulin, nejčastější byl IgG-κ, a to u 117 z 235 pacientů (50,0 %), ale i ostatní typy M-Ig byly pozorovány. Není jasné, zda u případů bez monoklonálního imunoglobulinu byla prováděna imunoelektroforéza, protože tyto případy byly publikovány dermatology, kteří s monoklonálními gamapatiemi a jejich diagnostickými metodami nemají praxi.
Z celého souboru 235 pacientů mělo 59 (25,1 %) maligní onemocnění typu mnohočetného myelomu. Solidní tumory byly vzácné a vždy byly provázeny přítomností M-Ig. U některých pacientů s NTX byl pozorován postupný vývoj MGUS do mnohočetného myelomu. Morfy nabývaly různých forem. Nejčastější byly NXG morfy periorbitálně (u 60 %), v další části obličeje (22,8 %), na trupu (53 %), na končetinách (56 %). Naopak mezi výjimečné lokalizace pak patřil mozek, gastrointestinální trakt, srdce, játra, plíce, svaly a příušní žláza (1).
V odborné literatuře za posledních 10 let jsme nalezli pouze 2 popisy lokalizace NTX v játrech (14, 15). Přehledová práce z roku 2020 cituje jen ty terapeutické postupy, které vedly k léčebné odpovědi alespoň u tří pacientů. Léčba pomocí intravenózních imunoglobulinů dosáhla léčebné odpovědi u 9 z 9 léčených osob, antimalarika u 4 z 5 pacientů (80 %), nitroložisková léčba triamcinolonem acetátem u 6 z 8 léčených (75 %), chirurgický zákrok u 3 ze 4 operovaných (75 %), chemoterapie u 8 z 12 léčených (67 %) a léky ze skupiny IMIDs lenalidomid a thalidomid u 5 z 8 léčených (63 %). V literatuře jsme nalezli ještě další publikace, popisující léčebný účinek léků ze skupiny IMIDs, a to jak léčbu starším thalidomidem, tak novějším lenalidomidem (16–20). Pomalidomid zatím čeká na otestování v této indikaci. O něco více případů bylo léčeno nitrožilními imunoglobuliny (21–27). Nelze ale říci, co je účinnější léčba. Domníváme se, že existuje analogie s léčbou skleromyxedému, neboť u obou těchto chorob (NXG a skleromyxedému) je možné léčbu cílit na klonální plazmatické buňky s nadějí, že při senzitivitě monoklonální gamapatie poklesne koncentrace M-Ig a tedy ustoupí projevy NXG anebo skleromyxedému, které monoklonální imunoglobulin zřejmě vyvolává. Záleží ale na senzitivitě plazmocelulární dyskrazie k léčbě, zda je tato léčba účinná či není. V případě, kdy nelze cílenou léčbou odstranit tvorbu M-Ig, pomáhá léčba pomocí nitrožilních imunoglobulinů (IVIGů). IVIGy narušují vazbu M-Ig na cílové struktury, které tuto nemoc spouští. V případě NXG tedy zřejmě vazbu M-Ig na lipoproteiny a tvorbu imunokomplexů (5–8). A proto i u nekrobiotického xantogranulomu lze léčbu cílit oběma směry. Schéma léčby, které publikoval Haber v roce 2020 pro skleromyxedému, je vlastně shodné s léčebných schématem nekrobiotického xantogranulomu, protože v obou případech je vyvolávajícím momentem reakce monoklonálního imunoglobulinu s některými tělu vlastními autoantigeny, viz graf 2 (28).

Náš případ dokumentuje, že léčba úspěšně potlačující tvorbu M-Ig je spojena s regresí morf NTX, jak dokumentuje FDG-PET/CT, které je vhodné pro sledování této nemoci (29–31).
Závěr
Na etiopatogenezi nekrobiotického xantogranulomu se podílí M-Ig vazbou na lipoproteiny a tvorbou imunokomplexů, případně dalšími zatím neznámými mechanismy. Námi popsaný případ dokumentuje s pomocí FDG-PET/CT zobrazení, že vymizení monoklonálního imunoglobulinu vede k ústupu ložisek nekrobiotického xantogranulomu. Obáváme se však, že případná recidiva myelomu bude spojena s recidivou xantogranulomu. Proto jsou oprávněné léčebné postupy zaměřené na potlačení tvorby monoklonálního imunoglobulinu. Nepodaří-li se potlačit tvorbu M-Ig, přicházejí do úvahy další v textu zmíněné léčebné postupy.
Vypracováno v rámci Institucionální podpory MOÚ:
MZ ČR – RVO (MOÚ, 00209805).
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno, Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(6): 352–356
Článek přijat redakcí: 21. 4. 2021
Článek přijat po recenzích: 26. 8. 2021
Zdroje
1. Nelson CA, Zhong CS, Hashemi DA et al. A Multicenter Cross-Sectional Study and Systematic Review of Necrobiotic Xanthogranuloma With Proposed Diagnostic Criteria. JAMA Dermatol. 2020; 156(3): 270–279.
2. Král Z, Krejčí M, Kynclová J et al. Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností. Transfuze a hematologie dnes. 2020; 26(4): 310–319.
3. Zahradová L, Adam Z, Fait J et al. Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem. Vnitřní lékařství. 2010; 56(suppl. 2): 2S179–2S182.
4. Sýkorová T. Histiocytózy z non-Langerhansových buněk. Klinická dermatovenerologie. první vydání. Praha: Mladá fronta. 2019. 2019: 1027–1036.
5. Adam Z, Zahradová L,https://www.medvik.cz/bmc/refine.do?author=547627 Krejčí M. Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET – CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury. Vnitřní lékařství. 2010; 56(11): 1158–1159.
6. Adam Z, Veselý K, Motyčková I et al. Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie Vnitřní lékařství. 2012; 58(5): 365–377.
7. Szalat R, Pirault J, Fermand JP et al. Physiopathology of necrobiotic xanthogranuloma with monoclonal gammopathy. J Intern Med. 2014; 276(3): 269–284.
8. Szalat R, Arnulf B, Karlin L et al. Pathogenesis and treatment of xanthomatosis associated with monoclonal gammopathy. Blood. 2011; 118(14): 3777–3784.
9. Miguel D, Lukacs J, Illing T et al. Treatment of necrobiotic xanthogranuloma – a systematic review. J Eur Acad Dermatol Venereol. 2017; 31(2): 221–235.
10. : Wick MR, Patterson JW. Cutaneous paraneoplastic syndromes. Semin Diagn Pathol. 2019; 36(4): 211–228.
11. Hilal T, DiCaudo DJ, Connolly SM et al. Necrobiotic xanthogranuloma: a 30-year single- -center experience. Ann Hematol.2018; 97(8): 1471–1479.
12. Khoschbin T, Löser C, Dippel E. Paraneoplastische Hauterkrankungen. Internist (Berl). 2019; 60(8): 775–782.
13. Weidenthaler-Barth B. Klinisches und histologisches Spektrum der Palisadengranulome: Granuloma anulare, Necrobiosis lipoidica, Rheumaknoten und nekrobiotisches Xanthogranulom Hautarzt. 2017; 68(7): 541s.
14. Nguyen BD. Hepatobiliary and Pancreatic: Hepatic necrobiotic xanthogranuloma. J Gastroenterol Hepatol 2017; 32(10): 1667. doi: 10.1111/jgh.13858.
15. Santosaputri E, Ellis EJ, Nagiah S et al. A multisystem granulomatous disease: necrobiotic xanthogranuloma with hepatic involvement. Med J Aust. 2014; 200(8): 490–4903.
16. Mello RB, Vale ECSD. Necrobiotic xanthogranuloma associated with smoldering multiple myeloma: satisfactory response to cyclophosphamide, dexamethasone, and thalidomide. An Bras Dermatol. 2019; 94(3): 337–340.
17. Efebera Y, Blanchard E, Allam C et al. Complete response to thalidomide and dexamethasone in a patient with necrobiotic xanthogranuloma associated with monoclonal gammopathy: a case report and review of the literature. Clin Lymphoma Myeloma Leuk. 2011; 11(3): 298–302.
18. Mahendran P, Wee J, Chong H et al. Necrobiotic xanthogranuloma treated with lenalidomide. Clin Exp Dermatol. 2018; 43(3): 345–347.
19. Dholaria BR, Cappel M, Roy V. Necrobiotic xanthogranuloma associated with monoclonal gammopathy: successful treatment with lenalidomide and dexamethasone. Ann Hematol. 2016; 95(4): 671–672.
20. Ghani S, Al Ustwani O, Khalid B et al. Periorbital necrobiotic xanthogranuloma treated successfully with novel multiple myeloma therapy. Clin Adv Hematol Oncol. 2013; 11(10): 678–680. PMID.
21. Olson RM, Harrison AR, Maltry A et al. Periorbital Necrobiotic Xanthogranuloma Successfully Treated with Intravenous Immunoglobulin. Case Rep Ophthalmol. 2018; 9(1): 70–75.
22. Goyal A, O'Leary D, Vercellotti G et al. Intravenous immunoglobulin for treatment of necrobiotic xanthogranuloma. Dermatol Ther. 2019; 32(1): e12744. doi: 10.1111/dth.12744.
23. Lukács J, Goetze S, Elsner P. Periocular Necrobiotic Xanthogranuloma Successfully Treated with Intravenous Immunoglobulin. Acta Derm Venereol.2017; 97(6): 754–755.
24. Rubinstein A, Wolf DJ, Granstein RD. Successful treatment of necrobiotic xanthogranuloma with intravenous immunoglobulin. J Cutan Med Surg. 2013; 17(5): 347–350.
25. Liszewski W, Wisniewski JD, Safah H et al. Treatment of refraktory necrobiotic xanthogranulomas with extracorporeal photopheresis and intravenous immunoglobulin. Dermatol Ther. 2014; 27(5): 268–271.
26. Nambudiri VE, McLaughlin C, Lo TC et al. Successful multimodality treatment of recalcitrant necrobiotic xanthogranuloma using electron beam radiation and intravenous immunoglobulin. Clin Exp Dermatol. 2016; 41(2): 179–182.
27. Pedrosa AF, Ferreira O, Calistru A et al. Necrobiotic xanthogranuloma with giant cell hepatitis, successfully treated with intravenous immunoglobulins. Dermatol Ther. 2015; 28(2): 68–70.
28. Haber R, Bachour, Gemayel ME. Scleromyxedema treatment: systemic reviewand update. Intern. J Dermatol 2020; 59(10): 1191–1201.
29. Eltilib M, Fenner J, Saramago I et al. Necrobiotic Xanthogranuloma on 18F-FDG PET/ CT. Clin Nucl Med.2020; 45(12): 967–969.
30. Hou J, Long T, Hu S. Application of F-FDG-PET/CT in necrobiotic xanthogranuloma involving multiple organs. Eur J Nucl Med Mol Imaging. 2021; 48(1): 321–322.
31. Koukalová R, Selingerová I, Řehák Z et al. FDG-PET/CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra. Klin. Onkol. 2021; 34(2): 1–
8.
Štítky
Diabetológia Endokrinológia Interné lekárstvoČlánok vyšiel v časopise
Vnitřní lékařství

2021 Číslo 6
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Role praktického lékaře v péči o pacienta s familiární hypercholesterolémií
- Nech brouka žít… Ať žije astma!
Najčítanejšie v tomto čísle
- Lokalizované formy plicní amyloidózy
- Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
- Respirační insuficience, chronická hyperkapnie a domácí neinvazivní ventilace z pohledu pneumologa
- Screening gestačního diabetes mellitus
