-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Proč brát vážně orgánové poškození u hypertenze?
Why take organ damage in hypertension seriously?
The focus of recent European guidelines has been early initiation of antihypertensive therapy in risk groups, rapid achievement of target blood pressure with fixed combinations of antihypertensive drugs, and the best possible management of an individual’s cardiovascular risk. Early intervention in the development of hypertension-mediated organ damage (HMOD) has been shown to have an effect on the subsequent reduction in the risk of cardiovascular events.
The point of HMOD origination correlates with the magnitude and duration of blood pressure elevation, and there is no clearly defined boundary from which vascular damage begins to develop. A reduction in blood pressure with pharmacotherapy demonstrably decreases the risk of ischaemic heart disease, stroke, as well as the mortality rate (1). Large clinical trials have consistently shown a significant reduction in the risk of these complications with antihypertensive medications across the entire spectrum from mild to severe hypertension, including hypertension in the elderly as well as isolated systolic hypertension (2). Based on the latest knowledge, a reduction in blood pressure by a mere 5 mm Hg has a cardioprotective effect even in normotensive individuals, which fundamentally changes the view on the diagnosis and definition of hypertension as a disease (3).
Keywords:
albuminuria – arterial hypertension – left ventricular hypertrophy – HMOD – organ damage
Autori: Eva Kociánová
Pôsobisko autorov: I. interní klinika – kardiologická, Fakultní nemocnice Olomouc
Vyšlo v časopise: Vnitř Lék 2022; 68(5): 303-308
Kategória:
doi: https://doi.org/10.36290/vnl.2022.064Súhrn
Těžiště posledních evropských doporučení spočívá v časném zahájení antihypertenzní léčby u rizikových skupin, rychlém dosažení cílového krevního tlaku za pomoci použití fixních kombinací antihypertenziv a maximálním ovlivnění kardiovaskulárního rizika jednotlivce. Časný zásah do rozvoje hypertenzí mediovaného orgánového poškození (hypertenison mediated organ damage = HMOD) má prokazatelně vliv na následné snížení rizika kardiovaskulárních příhod.
Okamžik vzniku HMOD koreluje s výší a délkou trvání elevace krevního tlaku, přičemž neexistuje jasně definovatelná hranice, od které se poškození cév začíná rozvíjet. Snížení krevního tlaku farmakoterapií prokazatelně snižuje riziko ischemické choroby srdeční, cévní mozkové příhody a také mortalitu (1). Velké klinické studie shodně prokázaly významné snížení rizika těchto komplikací vlivem antihypertenzní medikace, a to v celém spektru od lehké po těžkou hypertenzi, včetně hypertenze starších osob i izolované systolické hypertenze (2). Na základě nejnovějších poznatků snížení krevního tlaku už o 5 mm Hg působí kardioprotektivně i u normotenzních jedinců, což zcela zásadně mění pohled na diagnózu a definici hypertenze jako onemocnění (3).
Klíčová slova:
arteriální hypertenze – albuminurie – HMOD – orgánové poškození – hypertrofie levé komory srdeční
Nové cíle léčby hypertenze
Samotným cílem léčby hypertenze je předejít orgánovému a vaskulárnímu poškození a takto je také potřeba o cíli přemýšlet a v souladu s tím edukovat pacienty. Na základě důkazů je vysoce pravděpodobné, že k tomu nestačí snížení krevního tlaku pod arbitrární hranici 140/90 mm Hg, protože většina pacientů s výjimkou starších fragilních nemocných profituje z ještě přísnější kontroly krevního tlaku s předpokládanou ideální hodnotou mezi 120–130 mm Hg systolického a 70–80 mm Hg diastolického krevního tlaku (2). Současně se zavedením režimových opatření se doporučuje se neprodlená léčba pacientů s hypertenzí 2. a 3. stupně a rizikových pacientů s hypertenzí 1. stupně, což jsou pacienti s vysokým nebo velmi vysokým kardiovaskulárním rizikem, ischemickou chorobou srdeční, chronickou renální insuficiencí nebo průkazem hypertenzí mediovaného orgánového poškození. U všech nově diagnostikovaných pacientů s arteriální hypertenzí je ku prospěchu kontrola krevního tlaku k cílovým hodnotám do tří měsíců, a to preferenčně za pomoci fixní kombinace dvou antihypertenziv s rychlou intenzifikací na fixní trojkombinaci, pokud do jednoho měsíce nedojde k dosažení cílového krevního tlaku.
Vliv orgánového poškození na prognózu
Orgánové poškození je u hypertenze nositelem kardiovaskulárního rizika, pravým důvodem, proč hypertenzi léčíme, a jeho prevence je tedy současně cíl léčby hypertenze. Vliv přítomného orgánového poškození na zvýšení kardiovaskulárního rizika u pacientů s hypertenzí je dobře popsán a je znázorněn na obrázku 1, z něhož je dobře patrné, že už pacient s vysokým normálním tlakem nebo s lehkou hypertenzí se při vzniku orgánového poškození posouvá z kategorie nízkého rizika do rizika vysokého (4).
Obr. 1. Vliv vzniku orgánového poškození na kardiovaskulární riziko 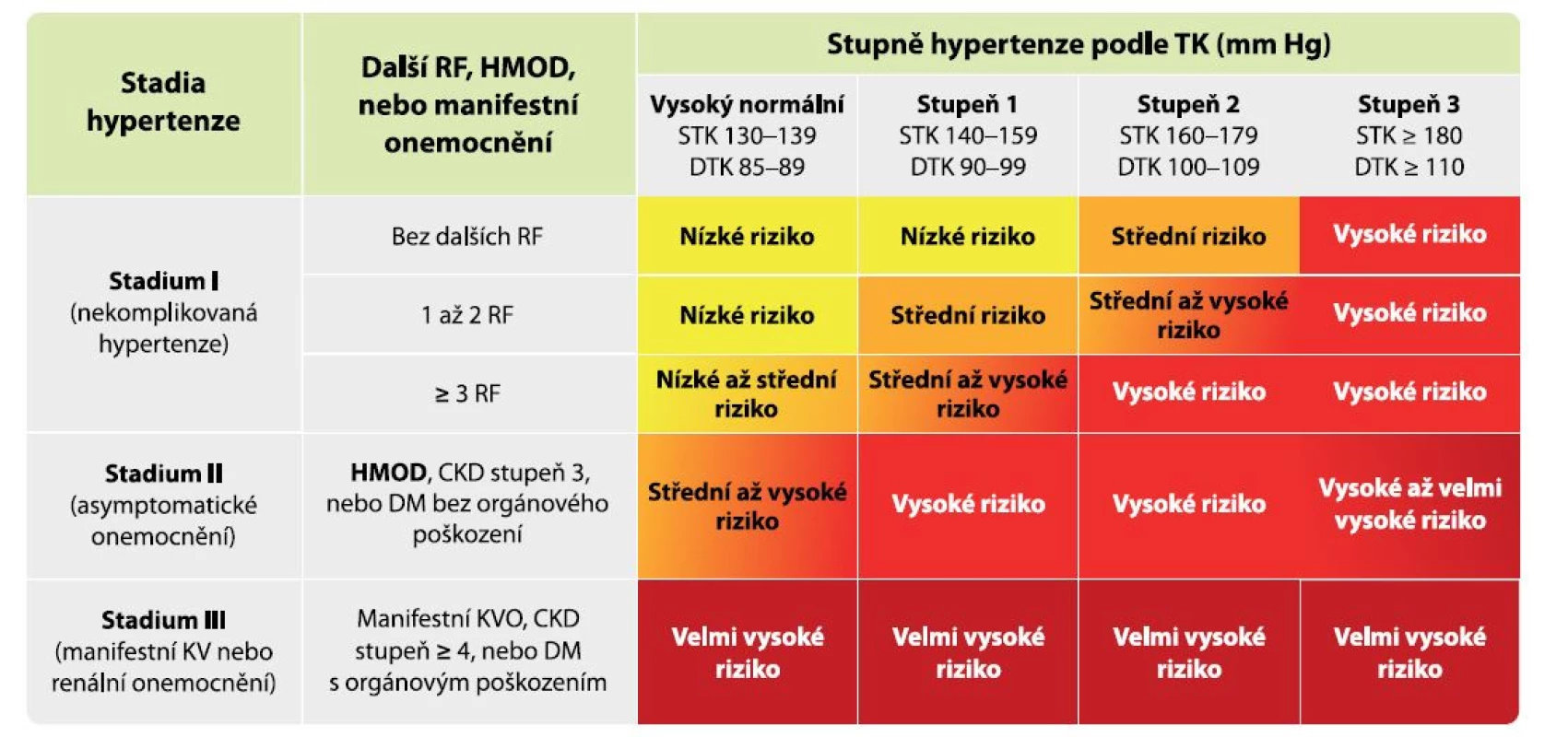
Legenda: CKD – chronické renální onemocnění; DM – diabetes mellitus; DTK – diastolický krevní tlak; HMOD – hypertension-mediated organ damage, tj. orgánové poškození způsobené hypertenzí; KVO – kardiovaskulární onemocnění; KV RF – kardiovaskulární rizikové faktory; RF – rizikové faktory; STK – systolický krevní tlak; TK – krevní tlak Za optimální krevní tlak v cévách je považován systolický tlak mezi 90–119 mm Hg a diastolický tlak 60–79 mm Hg (2). Okamžik vzniku HMOD koreluje s výší a délkou trvání elevace krevního tlaku, přičemž neexistuje jasně definovatelná hranice, od které se poškození cév začíná rozvíjet. V literatuře najdeme důkazy, že vztah HMOD a krevního tlaku je lineární a je detekovatelný již u jedinců s vysokým normálním krevním tlakem (5). Nebezpečí délky expozice elevovaným krevním tlakem lze odvodit od vícero prací, ve kterých bylo prokázáno nejvyšší dlouhodobé riziko úmrtí z kardiovaskuárních příčin i terminálního selhání ledvin u jedinců s hypertenzí vzniklou v mladém věku (6, 7). Orgánové poškození je třeba brát jako dynamický proces, který může být do určitého stadia při správně nastavené léčbě reverzibilní. Tento bod reverzibility je zásadní pro prognózu pacientů, nicméně samotný bod „point of no return“ (= bod nemožnosti návratu) je prozkoumán málo a neexistují žádné markery k jeho detekci. Čím vyšší míra poškození orgánů je u pacienta přítomna, tím nižší je šance návratu jednotlivých parametrů HMOD do normálních mezí. Míru orgánového poškození proto můžeme hodnotit pouze podle jeho vývoje při správně nastavené organoprotektivní antihypertenzní léčbě a bezchybné spolupráci pacienta. Nezvratné orgánové poškození s sebou nese nejen vysoké riziko komplikací, ale také zhoršenou odpověď na režimová opatření a farmakologickou léčbu hypertenze a nižší šanci dosáhnout cílového krevního tlaku.
Možnosti detekce orgánového poškození
Možností detekce HMOD je mnoho, liší se senzitivitou ke změnám, časem k měřitelné změně, dostupností a prognostickou výpovědní hodnotou. Viz tabulka 1.
Tab. 1. Význam jednotlivých způsobů detekce HMOD 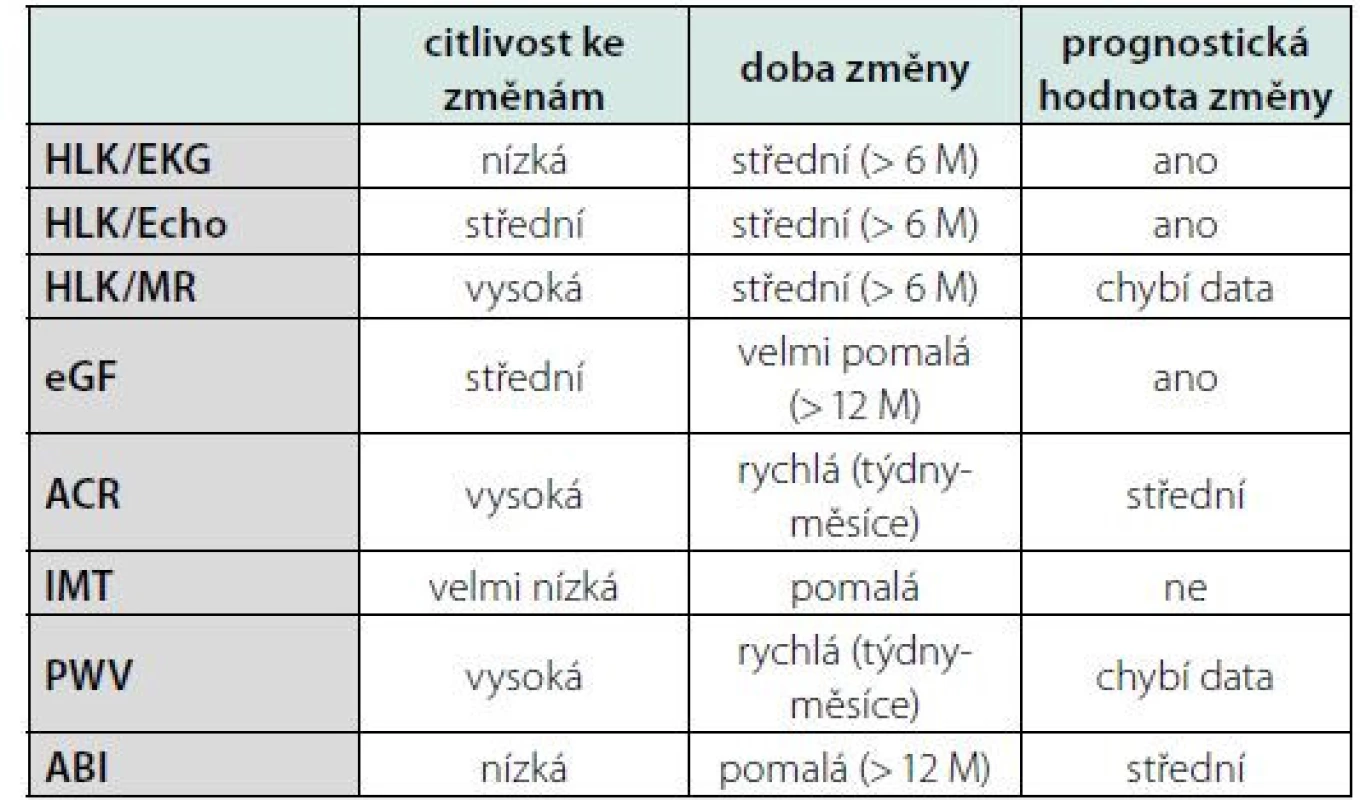
Legenda: HLK – hypertrofie levé komory, EKG – elektrokardiografie, ECHO – echokardiografie, MR – magnetická rezonance, eGF – odhad glomerulární filtrace, ACR – poměr albuminu a kreatininu v ranní moči, IMT – tloušťka intimy/ medie karotické stěny, PWV – rychlost pulzové vlny, ABI – index kotník-paže. Přeloženo z (2) Nejvíce prozkoumané jsou hodnocení hypertrofie levé komory (HLK) srdeční pomocí EKG, echokardiografie nebo magnetické rezonance, hodnocení glomerulární filtrace, albuminurie, rychlost pulzové vlny, tloušťka stěny karotické arterie a index kotník‑paže. S ohledem zvláště na prognostickou hodnotu, rychlost vývoje změn, dostupnost a reprodukovatelnost patří mezi nejvíce ceněné metody detekce HMOD u hypertenzních pacientů echokardiograficky detekovaná HLK a albuminurie vyjádřená poměrem albuminu kreatininu (ACR) v ranní moči (8). Riziko kardiovaskulárního úmrtí se v přítomnosti albuminurie a HLK zdvojnásobuje nezávisle na výši rizika SCORE, a to i u jedinců s vypočteným SCORE < 1 % (9). Oba parametry se přitom zdají být nezávislé, v dostupné práci nebyla nalezena žádná statistická závislost mezi albuminurií a LV mass (10). Léčbou navozená regrese albuminurie a HLK zlepšuje prognózu pacientů nezávisle na Framinghamském skóre, jde tedy o modifikovatelné parametry s jasným odrazem v prognóze, které odráží rozdílné aspekty kardiovaskulárního poškození (11). Albuminurie odráží rychlé až střednědobé změny v kompenzaci krevního tlaku (týdny až měsíce), zatímco hypertrofie levé komory srdeční reflektuje spíše změny dlouhodobější (měsíce až roky). Oba markery proto přináší důležitou a jedinečnou informaci k odhadu prognózy a pravděpodobně i pomocné vodítko pro management kontroly kompenzace krevního tlaku (2). Albuminurie i hypertrofie levé komory korelují lépe s ambulantním monitorováním krevního tlaku (ABPM) a domácím monitorováním krevního tlaku (HBPM), které jsou prognosticky cennější, než s tlakem v ordinaci (OBP) (12).
Poškození srdce u hypertenze
Zvýšená masa levé komory (left ventricular mass = LV mass) je číselné vyjádření hypertrofie levé komory srdeční (HLK). Normální hodnoty echokardiograficky detekované HLK je LV mass > 50 g/m u mužů a > 47 g/m u žen (m je výška v metrech). Normální hodnoty indexované na povrch těla – LVMI (left ventricular mass index) jsou podle současných doporučení pro muže < 115 g/m2 a < 95 g/m2 pro ženy (13). Prevalence zvýšené LV mass byla popsána 12 % u jedinců v riziku SCORE > 5 %, u jedinců v nízkém riziku SCORE < 5 % pak ve 2,6 %. Její přítomnost je asociovaná s dvojnásobným zvýšením kardiovaskulárního rizika (HR 2,2). Vypočítaná indexovaná LV mass > 51 g/m2 predikuje rozvoj srdečního selhání (9). Potencionální reverzibilita hypertrofie levé komory srdeční byla opakovaně prokázána. Signifikantně nižší kardiovaskulární riziko mají již po dvou letech pacienti s hypertenzí, u kterých dojde k regresi kvantitativně vyjádřené masy levé komory srdeční měřené echokardiograficky, proti těm, u kterých nadále perzistuje (RR 0,36 vs. 0,62, p = 0,002). Tyto změny nebyly zachytitelné pomocí EKG měření HLK (14). V prevenci vzniku nebo regresi orgánového poškození, jako je HLK, byly v provedených studiích efektivní blokátory renin angiotenzin aldosteronového systému (RAAS), indapamid a blokátory kalciového kanálu (15, 16, 17).
Poškození ledvin u hypertenze
Hodnocení albuminurie je levná, dostupná a snadno repetitivní metoda detekce vaskulárního orgánového poškození u pacientů s arteriální hypertenzí (18). Normální exkrece albuminu za 24 hodin u zdravých jedinců zřídka přesahuje 30 mg, hodnotíme ji pak jako normální až mírně zvýšenou – A1. Vyšší exkrece albuminu je senzitivní marker poškození glomerulárního aparátu s prognostickým významem jako časný signál diabetických, hypertenzních a vaskulárních komplikací. Albuminurie je také známka vysokého kardiovaskulárního rizika u pacientů s chronickou renální insuficiencí, která může být detekována v kterémkoli z pěti stupňů chronické renální insuficience podle KDIGO klasifikace (19). Na základě doporučených postupů KDIGO hodnotíme albuminurii jako středně zvýšenou – A2 a těžce zvýšenou – A3. Hodnocení albuminurie je uvedeno v tabulce 2 (20, 21). Poměr albumin-kreatinin v ranním vzorku moči (albumin‑creatitine ratio = ACR) je považován za nejlepší způsob hodnocení albuminurie pro svou vysokou senzitivitu a nejnižší intraindividuální biologickou variabilitou (22). Rutinní skrínink ACR je doporučován u každého pacienta s hypertenzí, a to jak v úvodní rizikové stratifikaci, tak při sledování úspěšnosti léčby (1).
Tab. 2. Kategorie CHRI (chronická renální insuficience) podle albuminurie a porovnání s proteinurií 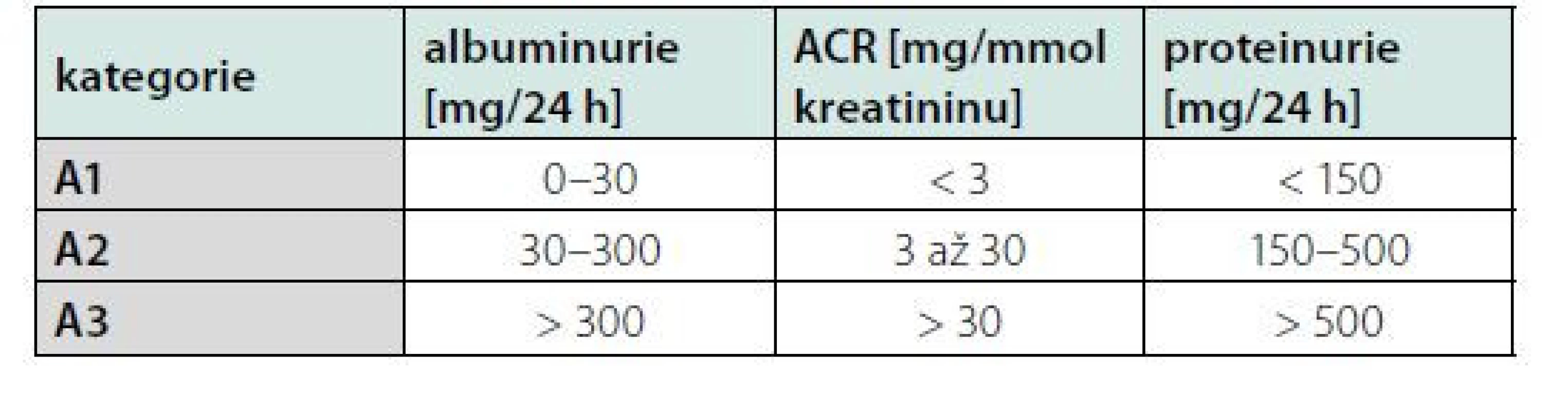
Ochrana renálních funkcí je prognosticky důležitá, neboť jejich zhoršení koreluje se zvýšenou mortalitou i kardiovaskulárním rizikem (19). Renální poškození u hypertenze je definované jako zvýšení ACR (3,4–34 mg/mmol), středně významná renální insuficience (eGFR 30–59 ml/min/1,73 m2 BSA) nebo závažná renální insuficience (eGFR < 30 mL/min/1,73 m2) (2). Už zvýšení ACR 1,1 mg/mmol bylo ve všeobecné populaci spojeno se zvýšením rizika úmrtí (20). Zvýšení ACR nad 90. percentil se vyskytovalo u jedinců s nízkým SCORE rizikem (< 5 %) v 7,8 % a u jedinců s rizikem SCORE > 5 % vs. 16,2 % (21). Vyšší albuminurie je běžná u rezistentní hypertenze, maskované hypertenze a noční hypertenze (22). Naopak antihypertenzní léčbou indukovaná regrese albuminurie a GFR vede ke snížení kardiovaskulárního rizika jak u diabetiků, tak u nediabetických pacientů (23, 24).
Hodnocení albuminurie a HLK u pacientů s hypertenzí a diabetem
U diabetických pacientů může být albuminurie časnou manifestací diabetického onemocnění ledvin. Prevalence středně zvýšené albuminurie u pacientů s diabetem se odhaduje mezi 25 a 40 % (25). Albuminurie u onemocnění ledvin je perzistující, proto by měla být zvýšená hodnota potvrzena 2× v rozmezí 3–6 měsíců. Také u pacientů s diabetem je ale přítomnost albuminurie spojená se signifikantním zvýšením kardiovaskulárního rizika (HR 2,4) (9). Vztah mezi diabetickým a hypertenzním poškozením ledvin byl prokázán jako vzájemně se potencující, a jeho dopad je větší než sumace nezávislých vlivů obou onemocnění na poškození ledvin (26). Faktor krevního tlaku se přitom zdá v rozvoji albuminurie potentnější než glykemická kontrola. Adekvátní kompenzace krevního tlaku < 130/80 mm Hg byla u diabetiků spojena s nižší albuminurií než při dekompenzovaném krevním tlaku, a to nezávisle na glykemické kontrole. Naopak intenzivní glykemická kontrola k HbA1c < 6,5 % byla spojena s nižší albuminurií pouze u pacientů s neuspokojivou kompenzací krevního tlaku, kdežto u dobře kompenzovaných nepřinesla další benefit (27).
Rutinní skrínink hypertrofie levé komory srdeční u diabetických pacientů 2. typu se neprovádí, přestože kardiovaskulární příhody jsou nejdůležitější příčinou morbidity a mortality, na nichž se podílí dvěma třetinami. Odhadovaná prevalence hypertrofie levé komory srdeční u diabetiků je 56–71 %, a je tak 1,5× častější než u nediabetických kontrol (28, 29). U pacientů se současným výskytem hypertenze a diabetu je rozlišení hypertenzí mediované hypertrofie levé komory srdeční a diabetické kardiomyopatie problematické. Diabetická kardiomyopatie je definovaná jako s diabetem spojené strukturální a funkční poškození myokardu, které není příslušné komorbiditám, jako je hypertenze nebo koronární nemoc (28). Tento jev je nezávislý na výši krevního tlaku a BMI, ale vykazuje souvislost s centrální obezitou a inzulinovou rezistencí (30, 31). Naopak u pacientů s koincidencí hypertenze a diabetes mellitus byla těsná kontrola krevního tlaku a glykemie spojena s nižší prevalencí HLK, zvláště pokud bylo dosaženo přísnějšího cíle (27).
Doporučení do praxe
První hodnocení orgánového poškození (vyšetření moči na ACR, EKG nebo lépe echokardiografie k detekci HLK, měření eGF a výpočet kardiovaskulárního rizika) by mělo být samozřejmostí u všech jedinců s vysokým normálním tlakem v ordinaci. Incicence maskované hypertenze je v některých subpopulacích vysoká (například diabetici, pacienti s metabolickým syndromem anebo obstrukční spánkovou apnoe, pacienti s renální insuficiencí), proto právě nález HMOD může být prvním vodítkem k pečlivějšímu ověření průměrné výše krevního tlaku. Také u nově diagnostikovaných hypertoniků patří základní skrínink HMOD mezi jednoznačně doporučená vyšetření. Přítomnost HMOD v okamžiku diagnózy znamená potvrzení, že krevní tlak je elevovaný a pacient bude profitovat z kombinované léčby hypertenze. Opakované hodnocení HMOD v průběhu léčby bychom měli provádět nejméně 1× za dva roky, u jedinců se vstupně pozitivním nálezem anebo neuspokojivou kompenzací krevního tlaku či rezistentní arteriální hypertenzí i častěji. Nejkratší racionální odstup mezi dvěma echokardiografickými hodnoceními hypertrofie levé komory je 1 rok, hodnocení albuminurie může být přínosné provádět při každé návštěvě.
Za předpokladu správného vedení antihypertenzní léčby můžeme z absence regrese parametrů orgánového poškození nepřímo usuzovat na nedostatečnou spolupráci pacienta anebo na přítomnost ireverzibilního orgánového poškození, které znamená vysoké riziko srdečního a renálního selhání a celkově horší kardiovaskulární i celkovou prognózu.
K léčbě pacientů s detekovaným orgánovým poškozením je třeba maximálně vybírat farmaka, která mají důkazy o schopnosti jeho redukce, což jsou blokátory renin angiotenzin aldosteronového systému (RAAS), indapamid a blokátory kalciového kanálu. S ohledem na robustní kardioprotektivní evidenci se jako nejvýhodnější jeví strategie léčby založená na perindoprilu, a to i s ohledem na svoji následnou kombinovatelnost. Maximální využití kombinované léčby ve fixní kombinaci a rychlé dosažení cílové hodnoty krevního tlaku by mělo být základním nástrojem zabránění rozvoje nevratného orgánového poškození. Obr. 2.
Obr. 2. Jak postupovat v léčbě hypertenze 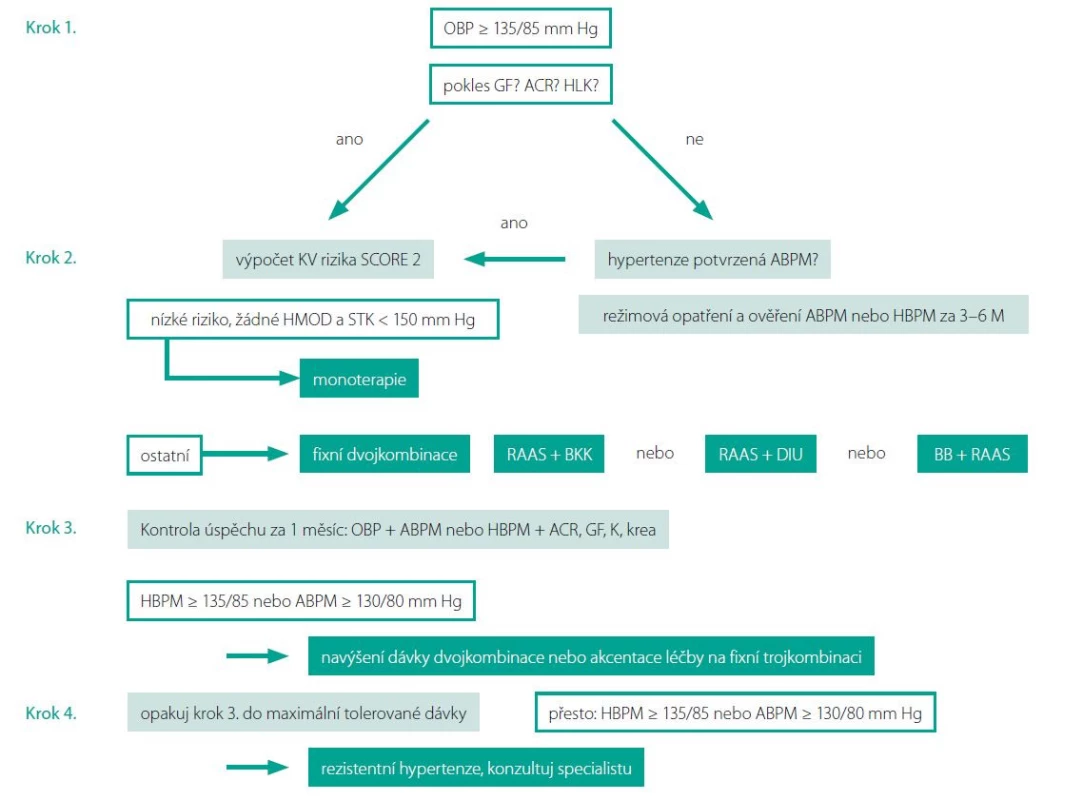
Legenda: GF – glomerulární filtrace, ACR – albumin/kreatinin poměr, LK – levá komora, OBP – tlak v ordinaci, ABPM – ambulantní monitorování krevního tlaku, HBPM – domácí monitorování krevního tlaku, HMOD – hypertenzí mediované orgánové poškození, RAAS – blokátor renin-angiotenzin-aldosterononového systému, DIU – indapamid nebo chlortalidon, BB – betablokátor Závěr
Za optimální krevní tlak v cévách se považuje systolický krevní tlak nižší než 120 mm Hg a diastolický krevní tlak nižší než 80 mm Hg. Krevní tlak jakkoli elevovaný nad tuto optimální hodnotu s sebou nese riziko rozvoje HMOD (hypertenzí mediovaného orgánového poškození), jehož míra a reverzibilita je závislá na míře a době trvání elevace. Na výši krevního tlaku je proto třeba nahlížet jako na ovlivnitelný rizikový faktor, jehož rychlou intervencí můžeme zabránit nevratným změnám na arteriálním stromu a orgánech a potažmo i kardiovaskulárním a renálním příhodám jednotlivce.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Eva Kociánová, Ph.D.
I. interní klinika – kardiologická, Fakultní nemocnice Olomouc
I. P. Pavlova 6, 775 00 Olomouc
Cit. zkr: Vnitř Lék. 2022;68(5):303-308
Článek přijat redakcí: 25. 5. 2022
Článek přijat po recenzích: 30. 6. 2022
Zdroje
1. Ettehad D, Emdin CA, Kiran A et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta‑analysis. Lancet 2016; 387(10022):957-967.
2. Williams B, Mancia G, Spiering W et al. Desormais and E. S. C. S. D. Group „2018 ESC/ESH Guidelines for the management of arterial hypertension.“ Eur Heart J 2018; 39(33): 3021-3104.
3. Rahimi K, Bidel Z, Nazarzadeh M et al. Blood pressure treatment: how low should you go? – Authors’ reply. Lancet 2021; 398(10312):1684-1685.
4. Brown MJ, Williams B, Morant SV et al. British Hypertension Society’s and G. Treatment of Hypertension with Algorithm‑based Therapy Studies. „Effect of amiloride, or amiloride plus hydrochlorothiazide, versus hydrochlorothiazide on glucose tolerance and blood pressure (PATHWAY-3): a parallel‑group, double‑blind randomised phase 4 trial.“ Lancet Diabetes Endocrinol 2016; 4(2):136-147.
5. Cuspidi CR, Facchetti M, Bombelli M et al. High Normal Blood Pressure and Left Ventricular Hypertrophy Echocardiographic Findings From the PAMELA Population. Hypertension 2019; 73(3):612-619.
6. Wang C, Yuan Y, Zheng M et al. Association of Age of Onset of Hypertension With Cardiovascular Diseases and Mortality. J Am Coll Cardiol 2020; 75(23):2921-2930.
7. Leiba A, Fishman B, Twig G et al. Association of Adolescent Hypertension With Future End‑stage Renal Disease. JAMA Intern Med 2019; 179(4):517-523.
8. Perrone‑Filardi P, Coca A, Galderisi M et al. Non‑invasive cardiovascular imaging for evaluating subclinical target organ damage in hypertensive patients: A consensus paper from the European Association of Cardiovascular Imaging (EACVI), the European Society of Cardiology Council on Hypertension, and the European Society of Hypertension (ESH). Eur Heart J Cardiovasc Imaging 2017; 18(9):945-960.
9. Sehestedt T, Jeppesen J. Hansen TW et al. Risk prediction is improved by adding markers of subclinical organ damage to SCORE. Eur Heart J 2010; 31(7):883-891.
10. Ren Q, Ma C, Wang J et al. Albuminuria and other target organ damage in Chinese patients with hypertension and diabetes: A data analysis based on the ATTEND study. J Diabetes Complications 2020; 34(1): 107470.
11. Olsen MH, Wachtell K, Ibsen H. Reductions in albuminuria and in electrocardiographic left ventricular hypertrophy independently improve prognosis in hypertension: the LIFE study. J Hypertens 2006; 24(4):775-781.
12. Agarwal R. Ambulatory blood pressure and cardiovascular events in chronic kidney disease. Semin Nephrol 2007; 27(5):538-543.
13. Marwick TH, Gillebert TC, Aurigemma G et al. Recommendations on the Use of Echocardiography in Adult Hypertension: A Report from the European Association of Cardiovascular Imaging (EACVI) and the American Society of Echocardiography (ASE). J Am Soc Echocardiogr 2015; 28(7):727-754.
14. Pierdomenico SD, Lapenna D, Cuccurullo F. Regression of echocardiographic left ventricular hypertrophy after 2 years of therapy reduces cardiovascular risk in patients with essential hypertension. Am J Hypertens 2008; 21(4):464-470.
15. Thomopoulos C, Parati G, Zanchetti A. Effects of blood‑pressure‑lowering treatment on outcome incidence in hypertension. 11. Effects of total cardiovascular risk and achieved blood pressure: overview and meta‑analyses of randomized trials. J Hypertens 2017; 35(11):2138-2149.
16. Asmar RG, Pannier B, Santoni JP et al. Reversion of cardiac hypertrophy and reduced arterial compliance after converting enzyme inhibition in essential hypertension. Circulation 1988; 78(4):941-950.
17. Okin PM, Wachtell K, Gerdts E. Relationship of left ventricular systolic function to persistence or development of electrocardiographic left ventricular hypertrophy in hypertensive patients: implications for the development of new heart failure.“J Hypertens 2014; 32(12):2472-2478; discussion 2478.
18. Calhoun DA, Jones D, Textor S et al. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Circulation 117(25):e510-526.
19. Al‑Aly ZA, Zeringue J, Fu MI et al. Rate of kidney function decline associates with mortality. J Am Soc Nephrol 2010; 21(11):1961-1969.
20. Chronic Kidney Disease Prognosis, C. (2018). „Erratum: Evans M, Grams ME, Sang Y, et al., for the Chronic Kidney Disease Prognosis Consortium. Risk factors for prognosis in patients with severely decreased GFR. Kidney Int Rep. 2018;3 : 625-637.“ Kidney Int Rep 3(6): 1506.
21. Sehestedt T. Olsen MH. Subclinical organ damage and cardiovascular risk prediction. Blood Press 19(3):132-139.
22. Drawz PE, Alper AB, Anderson AH et al. Chronic Renal Insufficiency Cohort Study. Masked Hypertension and Elevated Nighttime Blood Pressure in CKD: Prevalence and Association with Target Organ Damage. Clin J Am Soc Nephrol 2016; 11(4):642-652.
23. Ibsen H, Olsen MH, Wachtell K et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study. Hypertension 2005; 45(2):198-202.
24. Schmieder RE, Mann JF, Schumacher H et al. Changes in albuminuria predict mortality and morbidity in patients with vascular disease. J Am Soc Nephrol 2011; 22(7):1353-1364.
25. Parving HH, Lewis JB, Ravid M et al. Prevalence and risk factors for microalbuminuria in a referred cohort of type II diabetic patients: a global perspective. Kidney Int 2006; 69(11):2057-2063.
26. Shi W, Wang H, Zhou Y et al. Synergistic interaction of hypertension and diabetes on chronic kidney disease: Insights from the National Health and Nutrition Examination Survey 1999-2006. J Diabetes Complications 2020; 34(2):107447.
27. Zhang W, Liu CY, Ji LN et al. Blood pressure and glucose control and the prevalence of albuminuria and left ventricular hypertrophy in patients with hypertension and diabetes. J Clin Hypertens (Greenwich) 2020; 22(2):212-220.
28. Fang ZY, Prins JB, Marwick TH. Diabetic cardiomyopathy: evidence, mechanisms, and therapeutic implications. Endocr Rev 2004; 25(4):543-567.
29. Dawson A, Morris AD, Struthers AD. The epidemiology of left ventricular hypertrophy in type 2 diabetes mellitus. Diabetologia 2005; 48(10):1971-1979.
30. Eguchi K, Boden‑Albala B, Jin Z. Association between diabetes mellitus and left ventricular hypertrophy in a multiethnic population. Am J Cardiol 2008; 101(12):1787-1791.
31. Rutter M., Parise H, Benjamin EJ et al. Impact of glucose intolerance and insulin resistance on cardiac structure and function: sex‑related differences in the Framingham Heart Study. Circulation 2003; 107(3):448-454.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2022 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Hlavní téma – Aktuality v revmatologii
- Léčba obrovskobuněčné arteriitidy – současnost a otevírající se možnosti
- Co nového v léčbě systémového lupus erytematodes?
- Novinky v léčbě axiálních spondyloartritid
- Časná diagnostika systémové sklerodermie
- Difuzní alveolární hemoragie jako život ohrožující manifestace nově diagnostikované granulomatózy s polyangiitidou navazující na infekci covid-19 – kazuistika
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Proč brát vážně orgánové poškození u hypertenze?
- Zánět a vaskulární onemocnění
- Time in range: nový parametr v diabetologii
- Co je nového v Doporučených postupech ESC 2020 pro diagnostiku a léčbu akutních koronárních syndromů bez ST elevací?
- Diferenciální diagnostika bolestí zad
- Entresto (sakubitril-valsartan) získalo prestižní mezinárodní Galénovu cenu za nejlepší farmaceutický produkt pro rok 2022
- XXXIX. dny mladých internistů v Martině
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika bolestí zad
- Časná diagnostika systémové sklerodermie
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Co nového v léčbě systémového lupus erytematodes?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



