-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Histaminová intolerance
Histamine intolerance
Histamine intolerance (HIT) is a non-immunological disorder associated with an impaired ability to metabolize ingested histamine. Manifestation of HIT includes gastrointestinal and non-gastrointestinal symptoms. Clinical symptoms of HIT are non-specific and can imitate different diseases such as allergies, food intolerance, mastocytosis and other. The diagnosis of HIT is difficult. There are several candidate tests to detect DAO insufficiency, but their informative value is questionable. Currently, a positive clinical effect of a low-histamine diet is the most important for establishing the diagnosis. Equally in the treatment, a low-histamine diet is the most crucial approach. Other therapeutic options such as DAO supplementation treatment with antihistamines or probiotics are considered as complementary treatments. Our article provides a review on histamine intolerance, focusing on etiology and the diagnostic and treatment possibilities.
Keywords:
histamine intolerance – diamine oxidase (DAO) – histamine intoxication
Autori: Roman Hakl; Jiří Litzman
Pôsobisko autorov: Ústav klinické imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova, univerzita, Brno
Vyšlo v časopise: Vnitř Lék 2023; 69(1): 37-40
Kategória:
doi: https://doi.org/10.36290/vnl.2023.005Súhrn
Histaminová intolerance (HIT) je neimunologická reakce organismu na požitý histamin. Projevy HIT zahrnují intestinální a negastrointestinální projevy. Klinické projevy HIT jsou nespecifické a mohou napodobovat alergické příznaky, potravinové intolerance, mastocytózu, syndrom aktivovaných mastocytů (MCAS) a další. Stanovení diagnózy HIT je komplikované. Nabízí se celá řada kandidátních testů, nicméně s nejasnou výpovědní hodnotou. V současnosti je pro stanovení diagnózy nejdůležitější pozitivní klinický efekt po zavedení nízkohistaminové diety. Rovněž základem léčby je v současnosti nízkohistaminová dieta. Další terapeutické možnosti, jako suplementace DAO, léčba antihistaminiky nebo probiotiky, jsou nyní považovány za doplňkovou léčbu. Článek shrnuje aktuální informace o etiologii, klinických projevech, aktuálních možnostech diagnostiky a léčby onemocnění.
Klíčová slova:
histaminová intolerance – enzym diaminooxidáza (DAO) – intoxikace histaminem
Úvod
Histaminová intolerance (HIT) je neimunologická reakce organismu na požitý histamin, příčinou je nefunkční enzym diaminooxidáza (DAO) (1, 2). V poslední době se objevuje řada až rozporuplných údajů o mechanismech vzniku klinických příznaků vyvolaných histaminem. Příznaky mohou být totožné s alergickými projevy, proto jsme se rozhodli sumarizovat, kdy je třeba zvažovat i diagnózu HIT. Článek shrnuje aktuální informace o etiologii, klinických projevech, aktuálních možnostech diagnostiky a léčby onemocnění
Histamin
Histamin je biogenní amin vznikající dekarboxylací aminokyseliny histidinu enzymem histidindekarboxyláza (2, 3). Histamin je látkou s velmi širokým uplatněním v organismu.
Fyziologický i patofyziologický vliv histaminu na lidské tělo byl poprvé popsán v roce 1910 Henrym Dalem a Patrickem Laidlawem (4). Histamin se syntetizuje a ukládá ve vysokých koncentracích v sekrečních granulích, hlavně v bazofilních granulocytech a žírných buňkách, ale i v žaludečních enterochromafinních buňkách. Uplatnění histaminu je velmi široké, účastní se zánětu, kontrakcí hladké svaloviny, stimulace sekrece žaludeční šťávy, produkce cytokinů a působí i jako neurotransmiter. Tento široký záběr realizuje skrze čtyři receptory, označované jako H1 až H4.
Metabolismus histaminu
Rozklad histaminu je zajištěn se dvěma enzymy: diaminoxodázou (DAO) a histamin‑N‑metyltransferázou (HNMT). Histamin je těmito enzymy deaminován nebo methylován (2).
DAO je aminooxidáza kódovaná genem AOC lokalizovaným na chromozomu 7 (7q34-36), jedná se o homodimer se dvěma izoformami a katalyzuje oxidační deaminaci primární aminoskupiny histaminu (2). Mimo histaminu je DAO schopna metabolizovat i jiné biogenní aminy, například kadaverin nebo putrescin. DAO je uložena ve vezikulárních strukturách plazmatické membrány a je zodpovědná za degradaci extracelulárního histaminu jak přijatého v potravě, tak endogenně uvolněného z granulí žírných buněk a bazofilů. U člověka je exprese DAO omezena na tenké střevo, kde se aktivita DAO postupně zvyšuje od duodena k ileu, dále se nachází ve vzestupném tračníku, v placentě či ledvinách (2).
Druhý enzym, který se podílí na metabolismu histaminu, je HNMT. Tento enzym je kódován jediným genem na chromozomu 2 (2q22.1). HNMT je cytosolový protein zodpovědný za inaktivaci intracelulárního histaminu. Ve vztahu k histaminu je HNMT, na rozdíl od DAO, velice selektivní enzym. Katalyzuje methylaci histaminu v přítomnosti S-adenosylmethioninu za vzniku N‑methylhistaminu. Enzym HNMT je přítomen ve většině tkání, nicméně v séru se nenachází.
DAO hraje klíčovou roli v ochraně těla před exogenním histaminem pocházejícím z potravy, respektive střevní mikroflórou vyprodukovaným histaminem. HNMT patrně hraje klíčovou roli v ochraně před endogenním histaminem, u histaminu z gastrointestinálního traktu má HNMT až druhotnou roli (2, 5).
Histaminové receptory
Histamin realizuje své působení skrze receptory označované H1, H2, H3 a H4. Jedná se o skupinu receptorů spřažených s G‑proteinem. Subtypy receptorů jsou charakterizovány různou afinitou k molekule histaminu. H1 a H2 vykazují nízkou, zatímco H3 a H4 vysokou afinitu (1). H1 jsou přítomny v endotelu a buňkách hladkého svalstva cév prakticky všech tkání (jejich hustota je zvláště vysoká podél gastrointestinálního traktu), v hypotalamu, dřeni nadledvin a v imunokompetentních buňkách (1). Jejich stimulace navozuje systémovou vazodilataci, zvyšuje vaskulární permeabilitu, stimuluje zánět, navozuje bronchokonstrikci, kontrakci ilea a regulaci cirkadiánního cyklu. H1 receptor je hlavní receptor podílející se na rozvoji alergických reakcí (1). H2 nacházíme v parietálních buňkách žaludku, enterocytech, endotelu, buňkách hladkého svalstva cév, kardiomyocytech sinusového uzlu, imunokompetentních buňkách (zejména lymfocytech) a gangliích svalového plexu. Hlavní účinky stimulace H2 jsou sekrece kyseliny chlorovodíkové, tachykardie, relaxace buněk hladkého svalstva, protizánětlivé účinky (potlačení produkce cytokinů IL-12, IFN‑γ, TNF‑α monocyty nebo makrofágy a mastocyty) (1). H3 se nacházejí výhradně v centrálním nervovém systému (1). Aktivace H3 receptorů snižuje produkci a uvolňování acetylcholinu, serotoninu a norepinefrinu a hraje důležitou roli u poruch spánku a pozornosti (1). Receptory H4 jsou přítomny hlavně na buňkách krve, leukocytech a žírných buňkách lamina propria a submukózy, slezině, brzlíku, kostní dřeni, lymfoidní tkáni ve střevním epitelu a neuroendokrinních buňkách a také ve žlučových a pankreatických vývodech (1). Podílejí se na rozvoji zánětu a hypersenzitivní reakcí.
Zdroje histaminu
Hlavním zdrojem exogenního histaminu, ale i ostatních biogenních aminů jako tyraminu, putresinu nebo kadaverinu, jsou potraviny (2). Co do množství je jejich obsah v různých potravinách různý. Vysoký obsah histaminu je zejména v bakteriálně ovlivněných potravinách nebo v mikroorganismy fermentovaných potravinách (2). Zvláště vysoký obsah histaminu a dalších biogenních aminů je v nevhodně skladovaných rybách. Pro takto navozené histaminové otravy se zažil termín scombroid syndrom (6).
Za vznik histaminu v potravinách je odpovědná L‑histidindekarboxyláza, která dekarboxyluje histidin (2, 7). Enzymatická aktivita je odvislá i od bakteriálního druhu. Mezi nejschopnější producenty histaminu v rybách patří čeleď enterobakterie–rody Hafnia, Morganella nebo Raoultella, v sýrech, fermentovaném mase, rostlinných derivátech a fermentovaných nápojích jsou to bakterie mléčného kvašení a rovněž enterobakterie (2, 7, 8).
Současně je třeba zmínit roli histaminoliberátorů, což mohou být potraviny nebo léky, které podporují uvolňování histaminu z endogenních zásob (9) (Tab. 1).
Histaminová intolerance, enterální histaminóza
Histaminová intolerance (HIT) je nežádoucí neimunologická potravinová reakce, její příčinou je neschopnost DAO ve střevě odbourat histamin uvolněný z potravy. Příčinou HIT je nedostatečná funkce DAO, což vede k akumulaci histaminu v plazmě a s tím spojeným výskytem nežádoucích účinků (2, 10). Jedná se o potravinovou intoleranci, tedy reakci vyvolanou potravinou nebo některou z jejích složek v dávce, kterou normálně zdravá populace toleruje (11). Výskyt v populaci se odhaduje na 1–3 %, s predominancí u žen a se zvýšenou citlivostí na histamin v premenstruační fázi, rovněž v dětské populaci je prevalence patrně vyšší (2, 5, 10).
Klinické projevy HIT zahrnují velmi širokou symptomatologii, která zahrnuje gastrointestinální i negastrointestinální projevy, jejichž příčina je působení histaminu na receptory H1 až H4 (2, 5, 11). Gastrointestinální projevy zahrnují bolestivost břicha, zvracení, průjem a další nespecifické projevy. Z negastrointestinálních projevů se nejčastěji HIT manifestuje na kardiovaskulárním, kožním, respiračním nebo/a nervovém systému (Tab. 2) (10). Diagnostika Stanovení diagnózy histaminové intolerance je v současnosti komplikované, protože chybí přesná diagnostická kritéria a jednoznačný postup (2, 10).
Tab. 2. Klinické symptomy histaminové intolerance 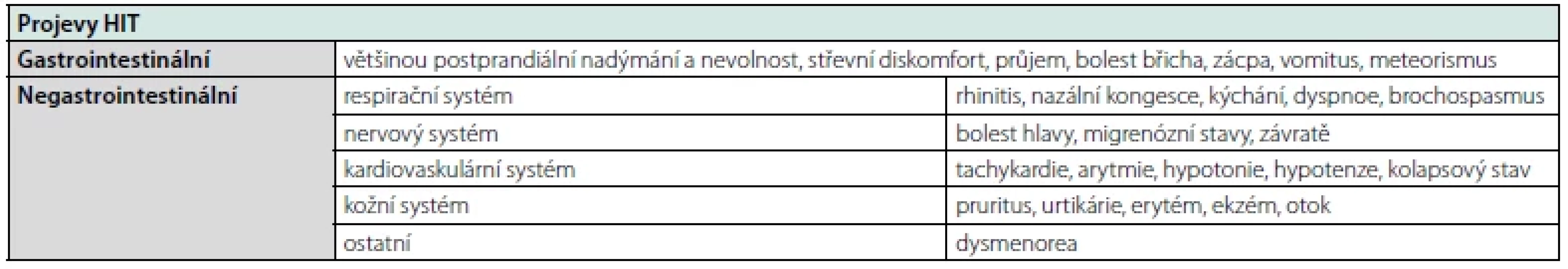
Diagnostika
HIT spočívá v objektivizaci klinických projevů (alespoň 2 ≥ HIT symptomů) a současném vyloučení dalších možných příčin klinických obtíží pacienta (2, 5).
Vylučujeme stavy, které jsou spojeny se zvýšením hladiny plazmatického histaminu (IgE mediované alergické reakce, systémová mastocytóza) (2, 5, 10, 11). Dalším krokem je vyloučit sekundárně navozenou DAO insuficienci, kdy příčinou je jiné onemocnění například střevní zánětlivé onemocnění nebo léčba (Tab. 1) (2).
Oproti tomu primární insuficience DAO je geneticky podmíněná (2). Existuje celá řada polymorfismů v genu pro DAO, většina z nich má vliv na kinetiku enzymu, a to ve smyslu snížení, ale jsou popsány i mutace, jejichž výsledkem je zvýšení aktivity enzymu.
V současnosti je pro stanovení diagnózy nejdůležitější pozitivní klinický efekt po zavedení nízkohistaminové diety (2). Délka trvání nízkohistaminové diety k potvrzení diagnózy se pohybuje mezi 4 až 8 týdny (2, 11).
Zatím neexistuje spolehlivý laboratorní test k potvrzení insuficience DAO. Nabízí se celá řada kandidátních testů, nicméně s nejasnou výpovědní hodnotou. Nejvíce používaným je stanovení plazmatické aktivity DAO, kdy se stanovuje množství histaminu degradovaného ve vzorku krve v daném časovém intervalu (2). Uvedené vyšetření vyvolává řadu kontroverzí, někteří autoři doporučují vyšetření jako vhodné pro identifikaci symptomatických pacientů s histaminovou intolerancí, naproti tomu existují práce, které nenalezly významný vztah mezi klinickou anamnézou pacientů s typickými příznaky histaminové intolerance a sérovými hodnotami aktivity DAO (12). Dalším diskutovaným vyšetřením k průkazu histaminové intolerance jsou kožní testy (prick testy s diagnostickými alergeny). Jedná se o variantu kožního alergologického testování. Rozdíl spočívá v době za jakou se odečítají kožní testy (50 min) a v hodnocení, kdy se měří doba remise pupence po aplikaci histaminu. Pacienti se symptomy intolerance vykazovali opožděnou remisi pupence, což autoři interpretovali jako sníženou degradační schopnost. Nicméně na základě tohoto testu může být obtížné odlišit HIT od jiných, např. alergických poruch (13).
Vzhledem k tomu, že střevo je hlavním místem působení DAO, se jako nejnadějnější možností diagnostiky HIT jeví měření intestinální aktivity DAO pomocí biopsie tlustého střeva (2). Zvažovanou možností je i provokační test histaminem. Dostupné jsou výsledky dvou dvojitě zaslepených studií, nicméně jejich výsledky jsou rozporuplné (14, 15). Neinvazivní zkoumanou možností diagnostiky insuficience DAO je stanovení vylučování histaminu a jeho metabolitů v moči. Hypotézou je, že jedinci s histaminovou intolerancí by mohli mít jiný profil vylučování histaminu a jeho metabolitů v moči než ostatní jedinci (16). Všechny tyto metodiky je třeba ověřit na větších počtech pacientů.
Terapeutické možnosti
V současné době je hlavní strategií terapie dodržování nízkohistaminové diety (2, 17). Suplementace exogenním DAO je považována jako doplňková léčba (10, 18).
Nízkohistaminová dieta
Nízkohistaminová nebo bezhistaminová dieta je nyní považována jako základní léčba HIT (2, 11). Neexistuje však jediné dietní doporučení nízkohistaminové diety (2). Histamin je velmi široce zastoupen v celé řadě potravin (2, 17), nejdůležitější viz tabulka 1. Kromě samotné potraviny je třeba zohlednit i čerstvost, zpracování nebo hygienické podmínky, za kterých byla potravina skladována nebo kterým byla vystavena. Všechny tyto faktory ovlivňují množství histaminu. Nicméně je nutné zohlednit i obsah ostatních biogenních aminů, jako jsou putrescin a kadaverin (5, 19). Účinnost nízkohistaminové diety byla prokázána v celé řadě klinických studií (2).
Exogenní suplementace DAO
V současnosti je dostupná perorální substituce DAO, jedná se o doplněk stravy s doporučeným dávkováním 15 minut před jídlem obsahujícím histamin. Hlavním zdrojem enzymu DAO jsou prasečí ledviny, jedná se o proteinový extrakt prasečí ledviny s enterosolventním povlakem (2, 20). Kromě živočišného zdroje mohou být zdrojem substituce DAO i rostliny, konkrétně naklíčené klíčky luštěnin, které mají i vyšší katalytickou kapacitu enzymů při degradaci aminosubstrátů ve srovnání s enzymy živočišného původu (2).
Antihistaminika
Pro úplnost je ještě třeba uvést terapii antihistaminiky, ale i zde chybí důkaz o účinnosti potvrzený randomizovanými klinickými studiemi (10).
Probiotika
Jak již bylo zmíněno, množství histaminu a ostatních biogenních aminů ovlivňuje přítomnost bakteriálních kmenů. Existuje tedy hypotéza, že na zvýšené hladině biogenních aminů a histaminu se kromě zhoršené degradace v důsledku deficitu DAO může podílet i narušená střevní flóra (21). U pacientů s HIT byla prokázána nižší bakteriální diverzita s narušenou střevní bariérou (21). Podkladem dysbiózy je zvýšené množství proteobakterií, snížené množství bakterií rodu Bifidobacterium (21). Nabízí se tak možnost probiotické terapie tímto rodem. Nicméně i tato hypotéza potřebuje prověření na větší skupině pacientů (21).
Diferenciální diagnostika HIT
Jak již bylo řečeno, v rámci diferenciální diagnostiky HIT je třeba vyloučit stavy spojené se zvýšením hladiny plazmatického histaminu (IgE mediované alergické reakce, systémová mastocytóza, MCAS). Mezi tyto stavy patří i intoxikace histaminem tzv. scombroid syndrom. Jedná se o otravu způsobenou konzumací nadměrného množství histaminu a ostatních biogenních aminů. Vzhledem k tomu, že většinou je původcem otravy rybí maso, je název scombroid odvozen, latinského označení čeledi makrelovití Scombridae. Nicméně, jak již bylo uvedeno výše, zdrojem biogenních aminů mohou být i jiné potraviny, většinou nějakým způsobem zrající, fermentované nebo zkažené. Podobně jako u HIT je výskyt scombroid syndromu pouze odhadován, udává se, že stojí za až kolem 5 % alimentárních otrav. V čerstvých rybách se histamin nenachází, vzniká až působením enzymu histidindekarboxylázy. Uvedený enzym obsahují bakterie v rybích žábrách a v gastrointestinálním traktu. Klíčové pro aktivaci histidindekarboxylázy je teplota skladování, pokojová teplota enzym zvýšeně aktivuje, teploty pod bodem mrazu enzym inhibují. Maso kontaminované ryby má normální vzhled i chuť a vyprodukovaný histamin nezničí žádný způsob zpracování potraviny. Intoxikace histaminem je charakterizován krátkou inkubační dobou (20–30 minut po požití) a odezněním symptomů během několika hodin (2). Klinické projevy a rychlost nástupu potíží často imitují alergickou reakci a mají i stejně široké projevy. Zahrnují kožní, gastrointestinální, neurologické nebo kardiovaskulární projevy (2). Předpokládá se, že průběh histaminové intoxikace může být ovlivněn alkoholem nebo dalšími biogenními aminy v potravě (2, 5).
Závěr
HIT má velmi širokou klinickou manifestaci, která pacienty může přivést do ambulancí nejrůznějších specialistů. Často není možné odlišit, jestli se jedná o samotnou HIT nebo současnou manifestaci i jiného onemocnění. Stanovení diagnózy HIT, aktuálně spočívá ve vyloučení ostatních možných příčin a pozitivním klinickém efektu po zavedení nízkohistaminové diety (2). Diagnóza HIT je tedy diagnosis per exclusione. Existuje sice celá řada možných vyšetření, nicméně jejich výsledky jsou rozporuplné. Rovněž na poli terapie chybí průkaz její efektivity a základem léčby zůstává nízkohistaminová dieta. I zde je prostor pro realizaci klinických hodnocení k průkazu efektivity terapie. Nadějné a elegantní řešení je ovlivnění střevního mikrobiomu (2).
Kdy tedy přemýšlet o HIT?
Diagnózu HIT bychom měli zvažovat při přítomnosti alespoň 2 ≥ HIT symptomů, které se manifestují do 4 hodin po konzumaci potraviny (Tab. 2). Současně je třeba zohlednit další diagnózy a používanou medikaci.
MUDr. Roman Hakl, Ph.D.
Ústav klinické imunologie a alergologie, FN u sv. Anny, LF MU, Brno
roman.hakl@fnusa.czCit. zkr: Vnitř Lék. 2023;69(1):37-40
Článek přijat redakcí: 6. 11. 2022
Článek přijat po recenzích: 4. 1. 2023
Zdroje
1. Shulpekova YO, Nechaev VM, Popova IR, Deeva TA, Kopylov AT, Malsagova KA, et al. Food Intolerance: The Role of Histamine. Nutrients. 2021;13(9).
2. Comas‑Basté O, Sánchez‑Pérez S, Veciana‑Nogués MT, Latorre‑Moratalla M, Vidal‑Carou MDC. Histamine Intolerance: The Current State of the Art. Biomolecules. 2020;10(8).
3. Panula P. Histamine receptors, agonists, and antagonists in health and disease. Handb Clin Neurol. 2021;180 : 377-87.
4. RILEY JF. HISTAMINE AND SIR HENRY DALE. Br Med J. 1965;1(5448):1488-90.
5. Kovacova‑Hanuskova E, Buday T, Gavliakova S, Plevkova J. Histamine, histamine intoxication and intolerance. Allergol Immunopathol (Madr). 2015;43(5):498-506.
6. Brock I, Eng N, Maitland A. Adult‑onset mast cell activation syndrome following scombroid poisoning: a case report and review of the literature. J Med Case Rep. 2021;15(1):620.
7. Doeun D, Davaatseren M, Chung MS. Biogenic amines in foods. Food Sci Biotechnol. 2017;26(6):1463-74.
8. Visciano P, Schirone M, Paparella A. An Overview of Histamine and Other Biogenic Amines in Fish and Fish Products. Foods. 2020;9(12).
9. Fuchs M, Švarcová I, Macková L, Mynaříková H. Histaminová intolerance, snížená aktivita diaminooxidázy. Alergie2011. p. 229-33.
10. Hrubisko M, Danis R, Huorka M, Wawruch M. Histamine Intolerance‑The More We Know the Less We Know. A Review. Nutrients. 2021;13(7).
11. Tuck CJ, Biesiekierski JR, Schmid‑Grendelmeier P, Pohl D. Food Intolerances. Nutrients. 2019;11(7).
12. Schnedl WJ, Enko D. Histamine Intolerance Originates in the Gut. Nutrients. 2021;13(4).
13. Wagner A, Buczyłko K, Zielińska‑Bliźniewska H, Wagner W. Impaired resolution of wheals in the skin prick test and low diamine oxidase blood level in allergic patients. Postepy Dermatol Alergol. 2019;36(5):538-43.
14. Reese I, Ballmer‑Weber B, Beyer K, Dölle‑Bierke S, Kleine‑Tebbe J, Klimek L, et al. Guideline on management of suspected adverse reactions to ingested histamine: Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Society for Pediatric Allergology and Environmental Medicine (GPA), the Medical Association of German Allergologists (AeDA) as well as the Swiss Society for Allergology and Immunology (SGAI) and the Austrian Society for Allergology and Immunology (ÖGAI). Allergol Select. 2021;5 : 305-14.
15. Komericki P, Klein G, Reider N, Hawranek T, Strimitzer T, Lang R, et al. Histamine intolerance: lack of reproducibility of single symptoms by oral provocation with histamine: a randomised, double‑blind, placebo‑controlled cross‑over study. Wien Klin Wochenschr. 2011;123(1-2):15-20.
16. Comas‑Basté O, Latorre‑Moratalla ML, Bernacchia R, Veciana‑Nogués MT, Vidal‑Carou MC. New approach for the diagnosis of histamine intolerance based on the determination of histamine and methylhistamine in urine. J Pharm Biomed Anal. 2017;145 : 379-85.
17. Sánchez‑Pérez S, Comas‑Basté O, Veciana‑Nogués MT, Latorre‑Moratalla ML, Vidal‑Carou MC. Low‑Histamine Diets: Is the Exclusion of Foods Justified by Their Histamine Content? Nutrients. 2021;13(5).
18. Schnedl WJ, Schenk M, Lackner S, Enko D, Mangge H, Forster F. Diamine oxidase supplementation improves symptoms in patients with histamine intolerance. Food Sci Biotechnol. 2019;28(6):1779-84.
19. Sánchez‑Pérez S, Comas‑Basté O, Rabell‑González J, Veciana‑Nogués MT, Latorre‑Moratalla ML, Vidal‑Carou MC. Biogenic Amines in Plant‑Origin Foods: Are They Frequently Underestimated in Low‑Histamine Diets? Foods. 2018;7(12).
20. Kettner L, Seitl I, Fischer L. Evaluation of porcine diamine oxidase for the conversion of histamine in food‑relevant amounts. J Food Sci. 2020;85(3):843-52.
21. Schink M, Konturek PC, Tietz E, Dieterich W, Pinzer TC, Wirtz S, et al. Microbial patterns in patients with histamine intolerance. J Physiol Pharmacol. 2018;69(4).
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2023 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Jistoty a nejistoty na křižovatkách současné medicíny
- Izolovaná plicní embolie – specifická klinická jednotka?
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
- Infekční komplikace syndromu diabetické nohy – diagnostika a léčba
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Histaminová intolerance
- Črevný mikrobióm a transplantácia obličky
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Novinky v kardiologii 2022
- ESC 2022 a studie DELIVER
- Zprávy o knihách
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Histaminová intolerance
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




