-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Infekční komplikace syndromu diabetické nohy – diagnostika a léčba
Diabetic foot infection – diagnosis and treatment
Diabetic foot (DF) is one of the most serious complications of diabetes, leading to high morbidity and mortality in patients with diabetes, significantly affecting their quality of life and placing a huge burden on the healthcare system. Diabetic foot infection (DFI) is a major factor in the non-healing of diabetic ulcerations of the lower limbs, increases the number of hospital admissions, prolongs their duration and is a frequent cause of increased number of amputations. The most serious form of foot infection is osteomyelitis. Management of infection in SDN includes proper diagnosis, including obtaining appropriate specimens for culture, indication of rational antimicrobial therapy or early surgical intervention, and provision of all other necessary wound care and overall patient care to prevent recurrence of DFI.
Keywords:
diabetes mellitus – diabetic foot – infection
Autori: Robert Bém
Pôsobisko autorov: Centrum diabetologie, Institut klinické a experimentální medicíny, Praha
Vyšlo v časopise: Vnitř Lék 2023; 69(1): 25-30
Kategória:
doi: https://doi.org/10.36290/vnl.2023.003Súhrn
Syndrom diabetické nohy (SDN) je jednou z nejzávažnějších komplikací diabetu, která vede k vysoké morbiditě a mortalitě pacientů s diabetem, významně ovlivňuje kvalitu jejich života a enormně zatěžuje zdravotnický systém. Infekce nohy v rámci SDN je zásadním faktorem nehojení diabetických ulcerací dolních končetin, zvyšuje počet hospitalizací, prodlužuje jejich délku a je častou příčinou zvýšeného počtu amputací. Nejzávažnější formou infekce nohy je osteomyelitis. Management infekce u SDN zahrnuje správnou diagnostiku, vč. získání vhodných vzorků pro kultivaci, indikaci racionální antimikrobiální terapie, případně včasného chirurgického zákroku, a poskytnutí veškeré další potřebné péče o ránu a celkovou péči o pacienta z hlediska prevence recidivy SDN.
Klíčová slova:
diabetes mellitus – syndrom diabetické nohy – infekce
Úvod
Syndrom diabetické nohy (SDN) je jednou z nejčastějších pozdních komplikací diabetu, který významně ovlivňuje kvalitu života pacientů s diabetem. SDN je dle WHO definován jako infekce, ulcerace nebo destrukce hlubokých tkání nohy spojená s neurologickými abnormalitami a s různým stupněm ischemické choroby dolní končetiny – ICHDK (1). SDN postihuje během života až 25 % všech pacientů s diabetem a je nejčastější příčinou netraumatických amputací v České republice i celosvětově (2–4). Vhodnými preventivními i terapeutickými postupy lze často amputacím předejít, přesto počet amputačních výkonů stále narůstá (5).
Infekce, ischemie a neuropatie jsou významnými patogenetickými faktory SDN (viz Obr. 1). Vznik SDN je nejčastěji podmíněn diabetickou neuropatií a ischemií; diabetická neuropatie byla prokázána u 85–90 % diabetiků s ulcerací, ischemie byla prokázána asi u 45 % pacientů (6). Infekce je obecně definována jako průnik a zmnožení mikroorganismů v hostitelských tkáních, což vyvolává zánětlivou odpověď hostitele, obvykle následovanou destrukcí tkáně. Infekce nohy u pacientů s diabetem je závažnou komplikací a častou příčinou zvýšeného počtu amputací. Infekce zvyšuje počet hospitalizací, prodlužuje jejich délku a výrazně tak zvyšuje ekonomické náklady (7, 8). Téměř vždy se infekce u SDN vyskytuje v otevřených ranách, přičemž infekci nelze definovat pouze pomocí výsledků kultivace z rány. Klinicky je definována jako přítomnost projevů zánětlivého procesu ve tkáních pod kotníkem u člověka s diabetem (9). Infekce v rámci SDN může mít charakter nezávažné infekce (lokalizovaná povrchová infekce), středně závažné (průnik infekce do hlubších struktur nohy) a život ohrožující (hluboká infekce nohy s celkovými příznaky, sepse), viz Obr. 2. Míra závažnosti infekce signifikantně koreluje s rizikem amputace (9, 10). Rizikovými faktory pro vznik infekce u SDN jsou např. trvání ulcerace déle než jeden měsíc, přítomnost ICHDK a traumatická etiologie rány (6, 11). Infekce nohy většinou začíná jako povrchní. Mikroorganismy se však mohou rychle šířit do podkoží, včetně fascií, šlach, svalů, kloubů a kostí, a to cestou nejmenšího odporu do několika samostatných, ale vzájemně propojených kompartmentů. Zánětlivá odpověď vyvolaná infekcí pak může způsobit tlak v kompartmentu, který nezřídka vede k nekróze ischemické tkáně a k progresi infekce.
Obr. 1. Patogeneze syndromu diabetické nohy a úloha infekce v tomto procesu, tzv. schody k amputaci 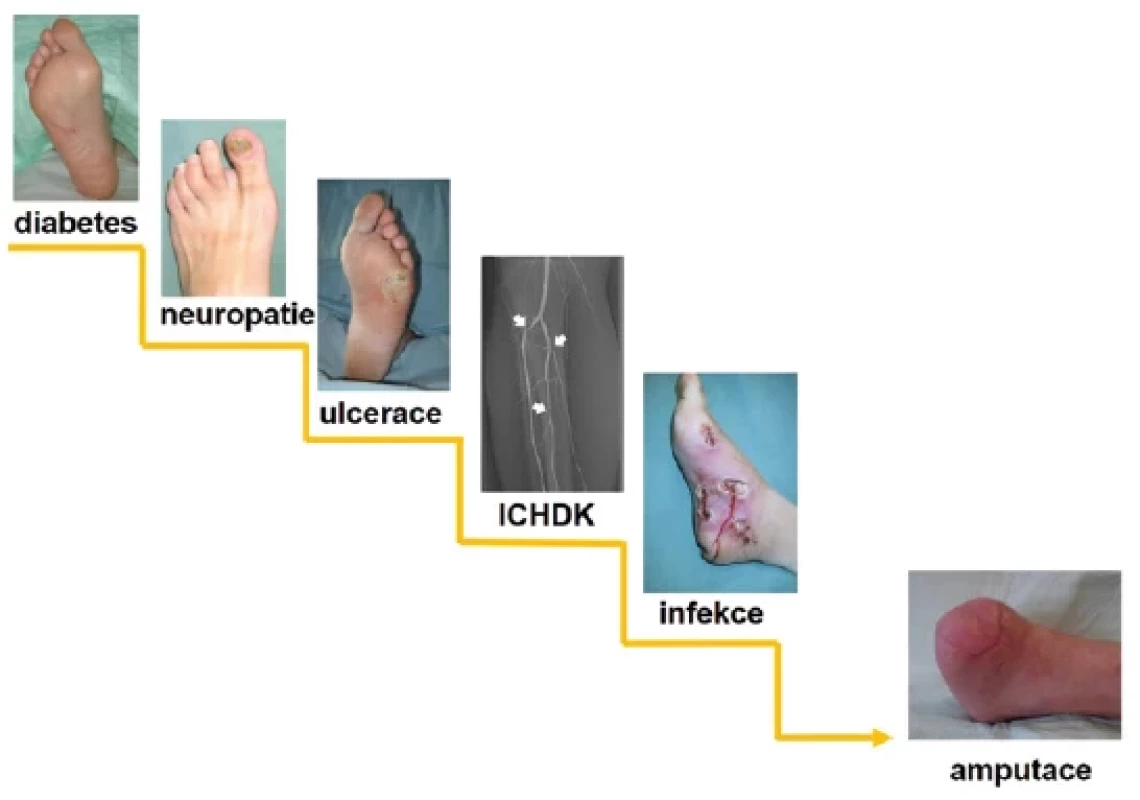
Obr. 2. Závažná infekce v rámci syndromu diabetické nohy; klinický obraz před chirurgickým zákrokem (A) a po něm (B) 
Management infekce u SDN zahrnuje správnou diagnostiku, vč. získání vhodných vzorků pro kultivaci, indikaci racionální antimikrobiální terapie, případně včasného chirurgického zákroku, a poskytnutí veškeré další potřebné péče o ránu a celkovou péči o pacienta z hlediska prevence recidivy SDN (12).
Diagnostika infekce u syndromu diabetické nohy
Přítomnost infekce u SDN by měla být zjišťována u všech pacientů s ulcerací nohy. Mezi lokální známky infekce nohy patří zarudnutí, otok, patologická sekrece z rány a zvýšená lokální teplota (1). Systémové příznaky infekce (např. horečka, zimnice), výrazná leukocytóza nebo závažné metabolické poruchy nemusí být u pacientů se SDN plně vyjádřeny (až u poloviny pacientů se závažným lokálním nálezem (13)), ale jejich přítomnost svědčí pro závažnější, potenciálně končetinu/život ohrožující infekci. Příznaky mohou být také maskovány přítomností neuropatie, ischemie či imunopatie. Závažná infekce by měla být diagnostikována a řešena do 24 hodin.
Diagnostika infekce v rámci SDN zahrnuje anamnézu, klinické, laboratorní a mikrobiologické vyšetření. Součástí jsou taktéž zobrazovací metody (14).
U anamnézy je kladen důraz na typ a kompenzaci diabetu, jeho trvání a výskyt jeho komplikací. Dále je zjišťována přítomnost ulcerace a případně infekce nohy v minulosti. U ulcerace je důležité posoudit příčinu vzniku, délku jejího trvání a tendenci k hojení. Infekce je typicky přítomna u pacientů s anamnesticky neuspokojivou kompenzací diabetu, s přítomnými ostatními komplikacemi diabetu, s trváním ulcerace déle než jeden měsíc, často traumatické etiologie a bez tendence k hojení (15).
Klinické vyšetření by mělo zahrnovat vyšetření a popis obou dolních končetin se zaměřením na přítomnost ulcerací. Zde je důležité všímat si lokálních známek infekce, jako je zarudnutí, otok, zvýšená teplota v okolí ulcerace, případně bolestivost. Ta je však při přítomné neuropatii vzácností. U pacientů s diabetem, u kterých je diagnóza infekce nejasná, je třeba zvážit vyšetření sérových biomarkerů zánětu, například C‑reaktivního proteinu (CRP), sedimentace erytrocytů a popřípadě i prokalcitoninu (16).
Diagnostika infekce u SDN pomocí biochemických parametrů je však též značně problematická. Některé práce ukazují, že počet leukocytů a hodnota CRP nejsou vhodnými parametry pro diagnostiku infekce v rámci SDN. Jiná práce ale prokazuje, že sérový prokalcitonin a hladina CRP jsou parametry s vysokou specificitou i senzitivitou pro diagnózu infekce u pacientů se SDN (17). Všechny tyto markery mohou být totiž ovlivněny infekcí v jiných lokalizacích než je SDN a vést ke sporným závěrům. Obecně lze uzavřít, že CRP a prokalcitonin mají vyšší diagnostickou přesnost než stanovení leukocytů a sedimentace. Některé studie se snažily verifikovat efektivitu různých kombinací těchto zánětlivých markerů, ale nebyl prokázán jasný význam pro praxi (18, 19).
Kultivační vyšetření z rány, nejlépe z hlubokých struktur nohy nebo biopsie, pak usnadňuje cílenou antibiotickou (ATB) léčbu, která je často zahajována empiricky a je delší než u ranných infekcí v jiné lokalizaci (20). Povrchové stěry mohou být často zavádějící a nemusí často zachytit skutečné původce infekce. V kultivačních vyšetřeních jsou často rány infikovány více patogeny. Polymikrobiální infekce byla zaznamenána až u 84 % pozitivních kultivací z diabetických ulcerací nohy (21). Nejčastějšími aerobními patogeny jsou Staphyloccus aureus a koaguláza negativní, Streptococcus sp., Enterococcus sp., Corynebacterium sp. a Pseudomonas aeruginosa (22). Z anaerobů bývají nejčastěji zastoupeny gram pozitivní koky, Prevotella sp., Porphyromonas sp. a Bacteroides fragilis. V posledním období roste počet rezistentních kmenů, zejména methicilin‑rezistetních kmenů Staphylococcus aureus (MRSA) a Pseudomonas aeruginosa, které jsou pak častější příčinou amputací a nutnosti použití záložních ATB, což vede k výraznému zvyšování nákladů na péči o tyto pacienty.
Osteomyelitis u syndromu diabetické nohy
Závažnou komplikací infekce nohy je osteomyelitis (OM). OM je přítomna u přibližně 20 % pacientů s infekcí diabetické nohy (23, 24) a je jednou z nejčastějších příčin amputací u pacientů se SDN (25). Ke vzniku OM dochází nejčastěji přestupem infekce z měkkých tkání v oblasti ulcerace na kosti, které jsou v její blízkosti. Významným rizikovým faktorem pro vznik OM je tedy palpace kosti na spodině ulcerace (26). Infekce způsobuje devitalizaci kortexu kosti a poté se velmi snadno šíří Haverskými systémy tak, že v krátké době může postihnout všechny struktury kosti včetně kostní dřeně. Na základě přítomné kostní nekrózy dochází následně k sekvestraci kosti, přičemž periost má stále tendenci k hojení (27). Přetrvávání OM i při intenzivní léčbě má řadu příčin, mezi které patří porušená imunitní a zánětlivá odpověď. Oblasti kostní nekrózy a sekvestrů jsou dobrou živnou půdou pro řadu bakterií a navíc jsou tyto oblasti špatně přístupné imunitnímu systému organismu (28, 29). OM se diagnostikuje zpravidla na podkladě klinického nálezu, kdy je přítomen otok, zarudnutí a zvýšená kožní teplota v okolí ulcerace, zjištěna pozitivní palpace kosti na spodině ulcerace nebo přítomnost kostních sekvestrů. Ze zobrazovacích metod se používá rentgen (RTG), počítačová tomografie (CT), magnetická rezonance (MRI) a scintigrafie skeletu (30). U pacientů s podezřením na infekci kostí (osteomyelitis – OM) by měl být na počátku diagnostiky proveden RTG nohy, přičemž je třeba vzít v úvahu, že rentgenové snímky jsou často během prvních 2–3 týdnů negativní a abnormální nálezy mohou být mimo jiné způsobeny Charcotovou osteoartropatií a dalšími kostními onemocněními (31). Naopak pro použití RTG hovoří jeho dostupnost a cena. Lepší zobrazení OM, zejména rozsahu a lokalizace, lze zajistit pomocí CT. MRI je pak zejména využívána k zobrazení infekce měkkých tkání, zejména šlach, plantární aponeurózy apod. K potvrzení diagnózy OM je možnost provedení kostní biopsie, která má i svá rizika, např. rozsev infekce do zatím nepostižených tkání (32). Vzorky z kostní biopsie se doporučuje odeslat jak na mikrobiologické, tak histologické vyšetření.
Klasifikace infekce u syndromu diabetické nohy
Většina v současnosti používaných klasifikací pro SDN zahrnuje zhodnocení infekce. Ta je však u některých klasifikací definována velice nespecificky, a proto se spíše doporučuje používat klasifikace, které mají infekci jasně definovanou a jsou validovány, že míra závažnosti infekce je spojena s větší pravděpodobností hospitalizace, s delším pobytem v nemocnici, či s větší pravděpodobností amputace. Tato kritéria splňují v podstatě 3 klasifikační systémy – IWGDF/IDSA – Tab. 1 (10), WIfI (wound, ischemia, foot infection = rána, ischemie, infekce nohou) (33) a SINBAD (Site, Ischemia, Neuropathy, Bacterial infection, Depth = lokalizace, ischemie, neuropatie, bakteriální infekce a hloubka) (34). Pro lékaře je relativně snadné tyto klasifikace používat, protože vyžadují pouze klinické vyšetření a standardní laboratorní a zobrazovací metody (35).
Tab. 1. IWGDF/IDSA klasifikace (1) 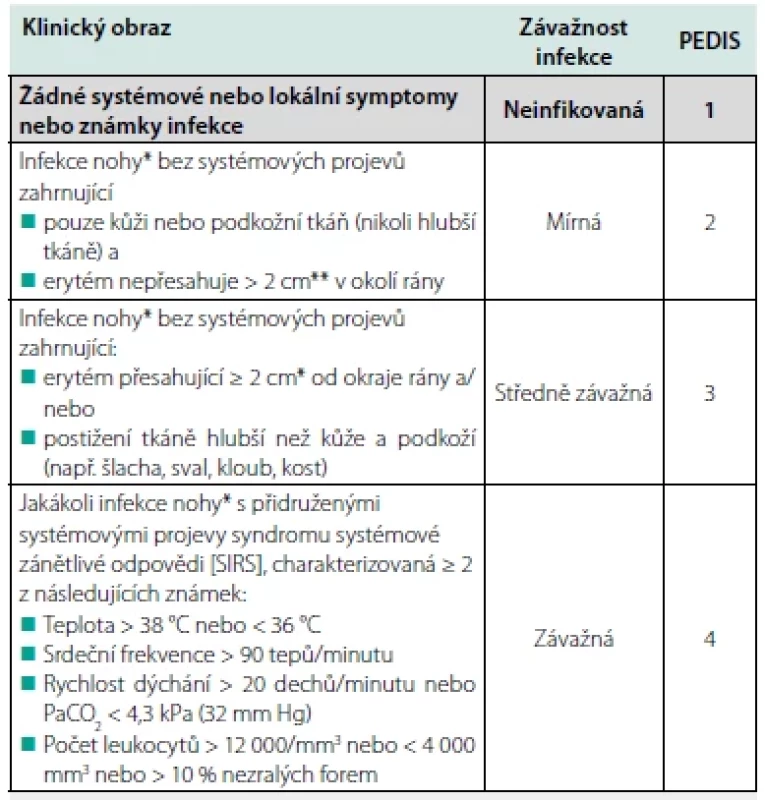
*Infekce nohy znamená, že jsou přítomny alespoň dvě z těchto známek: lokální otok nebo indurace; erytém> 0,5 cm kolem rány; lokální brnění nebo bolest; lokální zvýšení teploty; nebo purulentní sekrece Terapie infekce u syndromu diabetické nohy
Léčba SDN je často obtížná a její úspěšnost velmi závisí na jejím včasném zahájení. Musí být komplexní, což vyžaduje spolupráci celé řady odborníků (1). U řady pacientů je vhodná hospitalizace, a to zejména u těch, kteří vyžadují intenzivnější sledování při progresi lokálních a systémových známek infekce; k urychlení diagnostiky (zobrazovací metody, ischémie apod.); podávání parenterální antibiotické terapie a při indikaci chirurgické léčby (Schéma 1).
Schéma 1. Management péče o pacienta s podezřením na infekci v rámci syndromu diabetické nohy 
Mezi nejdůležitější opatření při léčbě diabetických ulcerací včetně těch infikovaných je jejich maximální odlehčení (36). Bez odstranění tlaku na ulceraci je hojení velmi obtížné, prodlužuje se významně jeho délka a je vysoké riziko přechodu akutního defektu do chronického stadia. K odlehčení defektů je využívána celá řada opatření a pomůcek. Mezi tyto pomůcky patří terapeutická obuv, TCC, ortézy (RCC – removable contact cast) RWC – removable walking cast), které se používají současně s podpažními berlemi. Při výskytu defektů na obou dolních končetinách je nutné odlehčení pomocí pojízdných vozíků.
U pacientů s prokázanou ischemií a nehojící se ulcerací nohy je nutné (pokud je to možné) končetinu revaskularizovat, tedy provést PTA nebo periferní bypass (37). Ischemie sama o sobě je rizikovým faktorem infekce, umožňuje její progresi a zhoršuje výsledky léčby. Kombinace infekce a ischemie signifikantně zvyšuje riziko vysoké amputace (15).
V případě prokázané infekce je nutno zahájit adekvátní ATB terapii – nejprve empirickou, posléze dle klinického obrazu a výsledku kultivace z rány cílenou (38, 39). ATB terapie by měla být agresivní i s ohledem na omezenou prostupnost do tkání i vzhledem k vysokému výskytu ischemie (Tab. 2). Léčba OM u SDN je značně problematická a v současné době nejsou jasné doporučené postupy (40). Konzervativní léčba zahrnující zejména dlouhodobé podávání ATB je velmi zdlouhavá a nezřídka stejně končí amputačním výkonem. K této léčbě jsou indikováni pacienti s první atakou OM, s dobrou citlivostí na ATB léčbu při uspokojivém prokrvení nohy a motivovaní spolupracující pacienti. Při selhání konzervativní terapie je indikováno chirurgické řešení – odstranění postižené kosti (resekcí nebo amputací).
Tab. 2. ATB terapie u pacientů s infikovaným syndromem diabetické nohy dle Lipsky et al. (38) 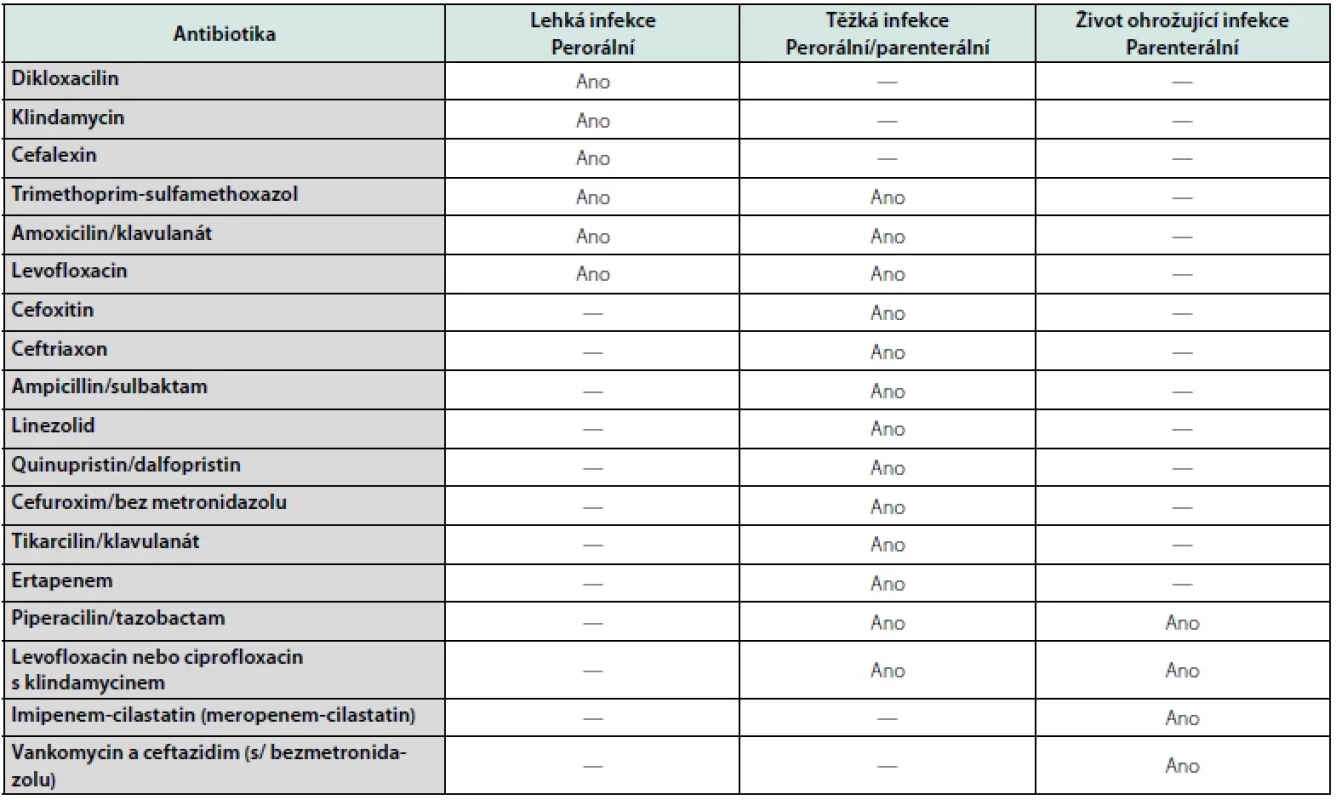
Další nezbytnou součástí terapie infikovaných diabetických ulcerací je lokální léčba, především debridement – očištění rány a snesení hyperkeratóz. Chirurgický debridement, který je nejběžnější, nelze použít u všech typů ran – např. dutinových, členitých, s podminovanými okraji nebo tam, kde je nebezpečí poranění struktur, jako jsou šlachy, nervy apod. Navíc se při chirurgickém ošetření zvyšuje riziko krvácení a dochází k porušení granulační tkáně. Při jiném typu debridementu, mechanickém pomocí vlhké gázy, je riziko porušení zdravé tkáně ještě větší. Autolytický nebo enzymatický debridement nemusí vést k úplnému vyčištění rány a navíc je při něm, zejména u SDN, zvýšené riziko šíření infekce a vzniku flegmóny. Podávání lokálních ATB není povětšinou doporučováno pro nízkou efektivitu této formy aplikace (41).
Podle typu rány jsou pak přikládány vhodné prostředky krytí rány. Významný antimikrobiální efekt byl prokázán u larvální terapie, léčby ozónem či lokálním podtlakem. Nesmí být zapomenuto na léčbu edémů, kompenzaci diabetu a léčbu dalších onemocnění ovlivňující hojení.
Závěr
Infekce u SDN je často společně s ischemií kritickým faktorem rozhodujícím o amputaci končetiny. Zásadní je včasná diagnostika a adekvátní terapie, která nezřídka zahrnuje léčbu chirurgickou.
MUDr. Robert Bém, Ph.D., MHA
Centrum diabetologie, Institut klinické a experimentální medicíny, Praha
robe@ikem.czCit. zkr: Vnitř Lék. 2023;69(1):25-30
Článek přijat redakcí: 29. 12. 2022
Článek přijat po recenzích: 10. 1. 2023
Zdroje
1. IWGDF. International Consensus on the Diabetic Foot. 2019.
2. Apelqvist J. The foot in perspective. Diabetes Metab Res Rev. 2008;24 (Suppl) 1:S110-5.
3. Van Netten JJ, Woodburn J, Bus SA. The future for diabetic foot ulcer prevention: A paradigm shift from stratified healthcare towards personalized medicine. Diabetes Metab Res Rev. 2020;36 Suppl 1:e3234.
4. Bem R, Dubsky M, Fejfarova V, Husakova J, Woskova V. Diabetic foot. Vnitr Lek. 2020;66(2):92-7.
5. Harb M, Greige W, Ephrem C. Infected diabetic ulcers, when to amputate. J Infect Dev Ctries. 2018;12(2.1):21S.
6. Prompers L, Huijberts M, Apelqvist J, Jude E, Piaggesi A, Bakker K, et al. High prevalence of ischaemia, infection and serious comorbidity in patients with diabetic foot disease in Europe. Baseline results from the Eurodiale study. Diabetologia. 2007;50(1):18-25.
7. Laowahutanon T, Nakamura H, Tachimori H, Nomura S, Liabsuetrakul T, Lim A, et al. Hospital admission for type 2 diabetes mellitus under the Universal Coverage Scheme in Thailand: A time - and geographical‑trend analysis, 2009-2016. PLoS One. 2021;16(7):e0253434.
8. Nieto‑Gil P, Ortega‑Avila AB, Pardo‑Rios M, Cobo‑Najar M, Blasco‑Garcia C, Gijon‑Nogueron G. Hospitalisation Cost of Patients with Diabetic Foot Ulcers in Valencia (Spain) in the Period 2009(-)2013: A Retrospective Descriptive Analysis. Int J Environ Res Public Health. 2018;15(9).
9. Lipsky BA, Senneville E, Abbas ZG, Aragon‑Sanchez J, Diggle M, Embil JM, et al. Guidelines on the diagnosis and treatment of foot infection in persons with diabetes (IWGDF 2019 update). Diabetes Metab Res Rev. 2020;36 (Suppl) 1:e3280.
10. Lavery LA, Armstrong DG, Murdoch DP, Peters EJ, Lipsky BA. Validation of the Infectious Diseases Society of America’s diabetic foot infection classification system. Clin Infect, DiS. 2007;44(4):562-5.
11. Lavery LA, Armstrong DG, Wunderlich RP, Mohler MJ, Wendel CS, Lipsky BA. Risk factors for foot infections in individuals with diabetes. Diabetes Care. 2006;29(6):1288-93.
12. Wang A, Lv G, Cheng X, Ma X, Wang W, Gui J, et al. Guidelines on multidisciplinary approaches for the prevention and management of diabetic foot disease (2020 edition). Burns Trauma. 2020;8:tkaa017.
13. Lavery LA, Armstrong DG, Wunderlich RP, Tredwell J, Boulton AJ. Diabetic foot syndrome: evaluating the prevalence and incidence of foot pathology in Mexican Americans and non‑Hispanic whites from a diabetes disease management cohort. Diabetes Care. 2003;26(5):1435-8.
14. Daneshvar K, Anwander H. Diagnostic Imaging of Diabetic Foot Disorders. Foot Ankle Clin. 2022;27(3):513-27.
15. Wukich DK, Johnson MJ, Raspovic KM. Limb Salvage in Severe Diabetic Foot Infection. Foot Ankle Clin. 2022;27(3):655-70.
16. Reiner MM, Khoury WE, Canales MB, Chmielewski RA, Patel K, Razzante MC, et al. Procalcitonin as a Biomarker for Predicting Amputation Level in Lower Extremity Infections. J Foot Ankle Surg. 2017;56(3):484-91.
17. Jeandrot A, Richard JL, Combescure C, Jourdan N, Finge S, Rodier M, et al. Serum procalcitonin and C‑reactive protein concentrations to distinguish mildly infected from non‑infected diabetic foot ulcers: a pilot study. Diabetologia. 2008;51(2):347-52.
18. Lavery LA, Ahn J, Ryan EC, Bhavan K, Oz OK, La Fontaine J, et al. What are the Optimal Cutoff Values for ESR and CRP to Diagnose Osteomyelitis in Patients with Diabetes‑related Foot Infections? Clin Orthop Relat Res. 2019;477(7):1594-602.
19. Zhang WQ, Tang W, Hu SQ, Fu XL, Wu H, Shen WQ, et al. C‑reactive protein and diabetic foot ulcer infections: A meta‑analysis. J Tissue Viability. 2022;31(3):537-43.
20. Lipsky BA, Berendt AR, Deery HG, Embil JM, Joseph WS, Karchmer AW, et al. Diagnosis and treatment of diabetic foot infections. Plast Reconstr Surg. 2006;117(7 Suppl):212S-38S.
21. Citron DM, Goldstein EJ, Merriam CV, Lipsky BA, Abramson MA. Bacteriology of moderate‑to‑severe diabetic foot infections and in vitro activity of antimicrobial agents. J Clin Microbiol. 2007;45(9):2819-28.
22. Fejfarova V, Jirkovska A, Petkov V, Boucek P, Skibova J. Comparison of microbial findings and resistance to antibiotics between transplant patients, patients on hemodialysis, and other patients with the diabetic foot. J Diabetes Complications. 2004;18(2):108-12.
23. Mandell JC, Khurana B, Smith JT, Czuczman GJ, Ghazikhanian V, Smith SE. Osteomyelitis of the lower extremity: pathophysiology, imaging, and classification, with an emphasis on diabetic foot infection. Emerg Radiol. 2018;25(2):175-88.
24. Giurato L, Meloni M, Izzo V, Uccioli L. Osteomyelitis in diabetic foot: A comprehensive overview. World J Diabetes. 2017;8(4):135-42.
25. Chou YY, Hou CC, Wu CW, Huang DW, Tsai SL, Liu TH, et al. Risk factors that predict major amputations and amputation time intervals for hospitalised diabetic patients with foot complications. Int Wound J. 2022;19(6):1329-38.
26. Lam K, van Asten SA, Nguyen T, La Fontaine J, Lavery LA. Diagnostic Accuracy of Probe to Bone to Detect Osteomyelitis in the Diabetic Foot: A Systematic Review. Clin Infect, DiS. 2016;63(7):944-8.
27. Berendt AR, Peters EJ, Bakker K, Embil JM, Eneroth M, Hinchliffe RJ, et al. Diabetic foot osteomyelitis: a progress report on diagnosis and a systematic review of treatment. Diabetes Metab Res Rev. 2008;24 Suppl 1:S145-61.
28. Embil JM, Trepman E. Microbiological evaluation of diabetic foot osteomyelitis. Clin Infect, DiS. 2006;42(1):63-5.
29. Lavery LA, Sariaya M, Ashry H, Harkless LB. Microbiology of osteomyelitis in diabetic foot infections. J Foot Ankle Surg. 1995;34(1):61-4.
30. Lipsky BA, Berendt AR, Embil J, De Lalla F. Diagnosing and treating diabetic foot infections. Diabetes Metab Res Rev. 2004;20 Suppl 1:S56-64.
31. Sella EJ, Grosser DM. Imaging modalities of the diabetic foot. Clin Podiatr Med Surg. 2003;20(4):729-40.
32. Berendt AR, Lipsky B. Is this bone infected or not? Differentiating neuro‑osteoarthropathy from osteomyelitis in the diabetic foot. Curr Diab Rep. 2004;4(6):424-9.
33. Zhan LX, Branco BC, Armstrong DG, Mills JL, Sr. The Society for Vascular Surgery lower extremity threatened limb classification system based on Wound, Ischemia, and foot Infection (WIfI) correlates with risk of major amputation and time to wound healing. J Vasc Surg. 2015;61(4):939-44.
34. Ince P, Abbas ZG, Lutale JK, Basit A, Ali SM, Chohan F, et al. Use of the SINBAD classification system and score in comparing outcome of foot ulcer management on three continents. Diabetes Care. 2008;31(5):964-7.
35. Lavery LA, Ryan EC, Ahn J, Crisologo PA, Oz OK, La Fontaine J, et al. The Infected Diabetic Foot: Re‑evaluating the Infectious Diseases Society of America Diabetic Foot Infection Classification. Clin Infect, DiS. 2020;70(8):1573-9.
36. Armstrong DG, Nguyen HC, Lavery LA, van Schie CH, Boulton AJ, Harkless LB. Off‑loading the diabetic foot wound: a randomized clinical trial. Diabetes Care. 2001;24(6):1019-22.
37. Hinchliffe RJ, Forsythe RO, Apelqvist J, Boyko EJ, Fitridge R, Hong JP, et al. Guidelines on diagnosis, prognosis, and management of peripheral artery disease in patients with foot ulcers and diabetes (IWGDF 2019 update). Diabetes Metab Res Rev. 2020;36 Suppl 1:e3276.
38. Lipsky BA. Empirical therapy for diabetic foot infections: are there clinical clues to guide antibiotic selection? Clin Microbiol Infect. 2007;13(4):351-3.
39. Uckay I, Berli M, Sendi P, Lipsky BA. Principles and practice of antibiotic stewardship in the management of diabetic foot infections. Curr Opin Infect, DiS. 2019;32(2):95-101.
40. Jeffcoate WJ. Osteomyelitis of the foot: non‑surgical management, SPECT/CT scanning and minimising the duration of antibiotic use. Diabetologia. 2017;60(12):2337-40.
41. Chatzipapas C, Karaglani M, Papanas N, Tilkeridis K, Drosos GI. Local Antibiotic Delivery Systems in Diabetic Foot Osteomyelitis: A Brief Review. Rev Diabet Stud. 2021;17(2):75-81.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Histaminová intoleranceČlánek Novinky v kardiologii 2022Článek ESC 2022 a studie DELIVERČlánek Zprávy o knihách
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2023 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Jistoty a nejistoty na křižovatkách současné medicíny
- Izolovaná plicní embolie – specifická klinická jednotka?
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
- Infekční komplikace syndromu diabetické nohy – diagnostika a léčba
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Histaminová intolerance
- Črevný mikrobióm a transplantácia obličky
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Novinky v kardiologii 2022
- ESC 2022 a studie DELIVER
- Zprávy o knihách
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Histaminová intolerance
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



