-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Izolovaná plicní embolie – specifická klinická jednotka?
Isolated pulmonary embolism – a specific clinical entity?
Pulmonary embolism in classical meaning is a complication of deep vein thrombosis (usually in the leg veins), developing after a part of the thrombus dislodged and got wedged in pulmonary arteries. However, in half of the patients with pulmonary embolism, deep vein thrombosis is not found. One potential explanation is a different, less common location of the thrombus or previous complete embolization of the whole thrombotic mass. Another possibility is pulmonary artery thrombosis in situ, which is a specific clinical entity associated with some typical risk factors. It develops in the place of vascular injury, as a consequence of hypoxia, inflammatory changes, endothelial dysfunction and injury. Pulmonary artery thrombosis in situ can be a complication after lung resection, radiation therapy, chest trauma, in the patients with Behçet´s disease, sickle cell anemia, chronic obstructive pulmonary disease, tuberculosis or covid pneumonia. Pulmonary artery thrombosis in situ may differ from classical pulmonary embolism in prognosis as well as in therapeutic approach.
Keywords:
Deep vein thrombosis – Pulmonary embolism – anticoagulation – pulmonary artery
Autori: Jana Hirmerová 1; Simona Bílková 1; Vlastimil Woznica 2
Pôsobisko autorov: II. interní klinika LF UK a FN Plzeň 1; Oddělení plastické chirurgie LF UK a FN Plzeň 2
Vyšlo v časopise: Vnitř Lék 2023; 69(1): 8-13
Kategória:
doi: https://doi.org/10.36290/vnl.2023.001Súhrn
Plicní embolie v klasickém pojetí znamená komplikaci hluboké žilní trombózy (obvykle v žilách dolních končetin), vzniklou uvolněním části trombu a jeho zaklíněním v plicním řečišti. Až u poloviny pacientů s plicní embolií však není současně zjištěna hluboká žilní trombóza. Vysvětlením může být výskyt zdroje (trombu) v méně obvyklé lokalizaci nebo embolizace celého trombu do plic. Specifickou jednotkou pak je trombóza plicní arterie in situ. Ta je spojena s určitými rizikovými faktory, vzniká v místě cévního poškození, následkem hypoxie, zánětlivých změn, dysfunkce a poškození endotelu. Vyskytuje se např. po resekci plic, po radioterapii, po traumatech hrudníku, u nemocných s Behçetovou chorobou, srpkovitou anémií, chronickou obstrukční plicní nemocí, tuberkulózou či covid‑pneumonií. Trombóza plicní tepny in situ se od klasické plicní embolie může odlišovat prognózou i terapeutickým přístupem.
Klíčová slova:
hluboká žilní trombóza – antikoagulace – plicní embolie – plicní arterie
Úvod
Již německý patolog Rudolf Virchow v polovině 19. století popsal, že tromby z periferních částí těla mohou způsobit sekundární obstrukci cév v plicích v důsledku vzniku „metastatických depozit“ (embolů). K těmto poznatkům dospěl jednak na základě pitevních studií, jednak pokusů, v nichž zjistil, že cizí těleso aplikované do žíly se pak objeví v plicních tepnách (1, 2).
Žilní tromboembolická nemoc (TEN) je tedy v klasickém pojetí vnímána jako klinická jednotka zahrnující 2 podjednotky – hlubokou žilní trombózu (HŽT) a plicní embolii (PE). Trombus se obvykle iniciálně tvoří v bércových žilách, predilekčně v oblasti cípu žilní chlopně, tedy v místě, kde často dochází k alteraci jedné či více složek Virchowovy triády (poškození endotelu a stáza krve). Zároveň je aktivován fibrinolytický proces. Může dojít k lýze vytvořeného trombu nebo jeho extenzi proximálním směrem a případně uvolnění trombu či jeho části, jeho pohybu krevním proudem a zaklínění v plicním řečišti (3).
Různé klinické manifestace TEN
Typický pacient s TEN by tedy měl mít příznaky HŽT a následně (pokud terapeuticky nezasáhneme) i příznaky PE a obojí by mělo být potvrzeno objektivními (zobrazovacími) metodami.
Z literatury i praxe však víme, že HŽT se může vyskytovat bez PE a naopak, u některých pacientů diagnostikujeme PE, avšak bez současného průkazu HŽT. Typickou ukázkou prvního případu je tzv. „paradox leidenské mutace“ (factor V Leiden paradox, FVL paradox). Již v roce 1996 se objevily zprávy o tom, že u nositelů leidenské mutace se relativně častěji vyskytuje izolovaná HŽT než HŽT spolu s PE či izolovaná PE. Později byl tento fenomen nazván „FVL paradox“ (4). Příčina nebyla zcela uspokojivě vysvětlena, někteří autoři se domnívají, že trombus u nositelů leidenské mutace má jinou strukturu, pevněji lne k žilní stěně a méně často embolizuje (5).
Izolovaná PE
Méně logický se zdá opačný nález, tj. PE bez současného zjištění zdroje v hlubokých žilách dolních končetin (DK). Podle literatury se toto týká zhruba poloviny pacientů s PE, i když údaje jsou poměrně inkonzistentní.
Téma izolované PE se objevuje v odborné literatuře sice nepříliš často, ale již delší dobu. Lze najít starší práce zabývající se výskytem izolované PE v pitevních nálezech. Velký soubor například publikovali němečtí patologové. Zhodnotili 5 039 pitevních nálezů ze dvou univerzitních nemocnic z let 1975–1980 a 1987–1988. U 1500 případů byla popsána PE, z toho v 59,4 % byl zjištěn zdroj v hlubokých žilách dolních končetin (DK), ve 12,6 % v žilách horních končetin (HK). V 28 % autoři zdroj embolie nenalezli a vyjádřili předpoklad, že došlo k embolizaci celé masy trombu (6).
Do tohoto období lze zařadit i práci z českého pracoviště (IKEM). Autoři na základě pitevních nálezů analyzovali výskyt PE u zemřelých na kardiologickém oddělení, počet smrtelných PE a také nalezené zdroje PE, a to v období 1979–1983 a 1984–1988. Vycházeli z celkem 780 pitevních nálezů (při udávané „propitvanosti“ 97 %). Při pitvách byly hodnoceny rovněž femorální a ilické žíly, dolní a horní dutá žíla. Zdroj PE byl nalezen v prvním uvedeném období v 74,7 % a ve druhém v 78,6 %, přičemž četností lehce převládal jako zdroj trombus v pravém srdci (55,1 % v prvním a 50 % v druhém období) nad zdrojem v žilním systému (7).
Z pohledu klinika musíme hodnotit diagnózu izolované PE podle symptomů, klinického nálezu a výsledku zobrazovacích metod. HŽT může být někdy asymptomatická či oligosymptomatická a může tedy nastat několik scénářů:
- Pacient má klinické symptomy PE i HŽT a obojí je potvrzeno objektivním vyšetřením.
- Pacient má pouze klinické symptomy PE a může či nemusí být vyšetřen i na potenciální přítomnost zdroje v hlubokých žilách (to je obvykle dáno zvyklostmi pracoviště). Pokud tedy takový pacient není odeslán na sonografii žil DK, pravděpodobně určitý podíl asymptomatických HŽT diagnóze unikne.
- Pacient s PE (ať již má, či nemá symptomy HŽT) je odeslán na žilní sonografii, ta bývá dle časových možností a dle zvyklostí pracoviště prováděna buď jako tzv. limitovaná (tříbodová), či kompletní sonografie – tříbodová znamená přiložení sondy v oblasti společné femorální žíly, femorální žíly a popliteální žíly, kompletní spočívá ve vyšetření žil od kotníku po tříslo, případně i žil pánevních. Limitovaná sonografie je časově nepříliš náročná, avšak je schopna diagnostikovat jen proximální trombózu, diagnóze tak unikne trombóza distální (bércová). Ani kompletní sonografie nemusí trombózu vždy odhalit, neboť (zejména u obéznějších pacientů) je její citlivost nižší v oblasti pánevních či bércových žil (8, 9).
Diagnóza izolované PE tedy může být přiřazena jak pacientovi se symptomatickou PE bez klinických projevů HŽT, tak pacientovi s PE, u nějž nebyla HŽT zobrazovací metodou prokázána. Ne vždy jsou však tyto terminologické „detaily“ specifikovány v metodice jednotlivých studií. I proto je obtížné objektivně zhodnotit prevalenci izolované PE v běžné populaci.
Sami jsme na našem pracovišti provedli retrospektivní analýzu výskytu HŽT u 428 pacientů se symptomatickou a objektivně diagnostikovanou PE. Všichni nemocní byli vyšetřeni duplexní sonografií žil dolních končetin (kompletní). HŽT byla diagnostikována u 71 % z nich, z toho bylo 70 % trombóz v proximální lokalizaci. Nadpoloviční část HŽT byla asymptomatická (57 %). Ženské pohlaví a přítomnost aktivní malignity byly faktory signifikantně asociované s přítomností HŽT (10).
Holandská studie, provedená ve dvou akademických centrech, si přímo dala za cíl pátrat u pacientů s prokázanou PE po zdroji, tedy žilní trombóze (11). Použila k tomu tzv. přímé zobrazení trombu pomocí magnetické rezonance (magnetic resonance direct thrombus imaging, MRDTI). Při tomto vyšetření je zjišťován v místě akutní trombózy hyperintenzní signál, a to v důsledku tvorby methemoglobinu v erytrocytech. Nález se normalizuje do 6 měsíců (12). Jedná se o metodu s vysokou senzitivitou (95–98 %) i specificitou (96–100 %), navíc celotělovou, takže by s jistotou měla odhalit akutní HŽT (a tedy zdroj již diagnostikované PE) v kterékoli části těla. Ve zmíněné holandské studii bylo zařazeno 99 pacientů s PE objektivně potvrzenou počítačovou tomografií (CT), u těch bylo do 7 dní doplněno MRDTI. U 56 % z nich nebyl trombus v žíle nalezen. Autoři vyjádřili několik hypotéz:
- Vyšetření nemělo dostatečnou senzitivitu (toto vysvětlení není příliš pravděpodobné).
- Došlo k embolizaci celého trombu (takže poté již nebyly trombotické hmoty v hlubokých žilách nalezeny).
- Existuje jiný potenciální zdroj PE, např. trombus v pravém srdci.
- Jedná se opravdu o izolovanou PE či PE de novo, přesněji řečeno se vlastně nejedná o embolii, ale o trombózu in situ (11).
Výskyt izolované PE, specifické rizikové faktory
Problematikou izolované PE se zabývali autoři z různých oborů a v různých souvislostech. Publikované práce jsou dosti heterogenní a v podstatě je lze rozdělit na studie zkoumající výskyt izolované PE v určitých selektovaných skupinách pacientů (obvykle nepříliš početných) a studie zaměřené na podíl pacientů s izolovanou PE ve větších skupinách pacientů s TEN a na identifikaci případných rizikových faktorů.
1. Studie izolované PE v selektovaných skupinách pacientů
- Starší studie zkoumala výskyt trombózy plicní arterie na malém vzorku dospělých pacientů s Eisenmengerovým syndromem. Vyšetření pomocí CT angiografie prokázala trombózu v plicní tepně – plicní arteriální trombózu (PAT) u 21 % z nich, přičemž vyšší riziko této komplikace měly ženy a pacienti s nižší saturací kyslíku (13).
- O zcela jednoznačnou PAT in situ se jedná u pacientů po pneumonektomii či lobektomii. U části z nich může dojít k trombóze v pahýlu plicní arterie. Ve starší studii u 89 pacientů po pneumonektomii byla na kontrolním CT (s odstupem průměrně 34 měsíců po operaci) zjištěna trombóza v pahýlu plicní tepny u 12,4 %. Na kontrolním CT (za dalších 25 měsíců) byl u většiny pacientů trombus stabilní, bez propagace, u 4 pacientů byl trombus dokonce zmenšen (14).
- Postižení plicní arterie trombózou bylo popsáno též u nemocných s Behçetovou chorobou. Turečtí autoři vybrali z 2 500 nemocných s Behçetovou chorobou 47 pacientů s postižením plicní tepny. Z nich mělo 8 nemocných trombózu plicní tepny jako komplikaci aneuryzmatu této tepny a 13 pacientů mělo izolovanou PAT (15).
- Velmi malou a velmi selektovanou skupinu hodnotili autoři korejské studie. Ti srovnávali skupinu 23 pacientů s izolovanou trombózou plicní tepny s kontrolní skupinou pacientů s „klasickou“ PE jako komplikací HŽT. PAT in situ vznikla nejčastěji v terénu plíce poškozené tuberkulózou (47,8 %), dále u pacientů po pneumonektomii či lobektomii (30,4 %) (16).
- Američtí rentgenologové popsali 27 pacientů s postiradiační PAT, zjištěnou incidentálně na CT plic. Jednalo se o onkologické pacienty (81 % z nich mělo karcinom plic a 19 % mezoteliom), interval od ukončení radioterapie se pohyboval v rozmezí 53–2522 dní‚ průměr 675 dní). U všech pacientů byla přítomna postiradiační fibróza plic. PAT byla u všech asymptomatická, antikoagulační léčba byla podána v 16 případech (v této léčené podskupině došlo častěji k ústupu trombózy ve srovnání s druhou podskupinou bez antikoagulační léčby, nicméně počty pacientů byly příliš malé na získání statisticky validních dat) (17).
- Již od počátku pandemie onemocnění covid-19 se objevovaly zprávy o tromboembolických komplikacích. Udávané počty jsou však dosti variabilní, liší se v jednotlivých vlnách pandemie, kolísají i v souvislosti s tíží onemocnění (nejvyšší výskyt byl popisován u pacientů v intenzivní péči) či diagnostickými zvyklostmi pracovišť (vyšetřování na TEN screeningově či jen při klinickém podezření na tromboembolickou komplikaci), výskyt byl jistě ovlivněn i použitím různých způsobů tromboprofylaxe (a v případě farmakologické tromboprofylaxe i různých dávek a různého trvání). Velká epidemiologická studie ze Švédska zkoumala incidenci tromboembolických komplikací u 1 057 174 jedinců léčených s covidem mezi únorem 2020 a květnem 2021 oproti více než 4 milionům kontrol. V prvních 30 dnech od začátku covidu-19 byl výskyt tromboembolických komplikací výrazně zvýšen, což platilo i pro HŽT (5,9× vyšší incidence), avšak incidence PE byla mnohonásobně vyšší (31,59× vyšší incidence) (18).
2. Studie izolované PE u pacientů s TEN
- Holandští autoři se zaměřili na obvyklé rizikové faktory TEN a separátně u nich analyzovali míru rizika pro HŽT a pro PE. Použili k tomu vlastní data, resp. výsledky z velké studie MEGA, populačně založené studie případů TEN a kontrol, celkem zahrnující více než 11 000 osob. Tento výzkum potvrdil, že některé rizikové faktory jsou významněji asociovány s rizikem HŽT (leidenská mutace, užívání hormonální antikoncepce, gravidita a šestinedělí, méně závažné úrazy DK a obezita) a některé s rizikem PE (chronická obstrukční plicní nemoc – CHOPN, pneumonie a srpkovitá anémie) (19).
- Italský registr START2 (prospektivní, observační, multicentrický registr dospělých pacientů s TEN na antikoagulační léčbě) rovněž porovnával rozdíly mezi skupinou s izolovanou PE a skupinou s HŽT (bez PE či s PE). Z 3 573 pacientů mělo 19,4 % izolovanou PE (tj. symptomatickou PE bez průkazu HŽT na žilní USG). V tomto případě se tedy jednalo o větší skupiny, navíc byly prospektivně sledované. Jako rizikový faktor izolované PE byly identifikovány věk nad 75 let, ženské pohlaví, srdeční selhání, maligní onemocnění a užívání hormonální antikoncepce. Naopak pacienti s trombofilním stavem měli významně častěji HŽT či HŽT+PE. Během follow‑up (celkem u 3 573 pacientů 4 504 roků sledování) nebyly mezi skupinami s izolovanou PE a skupinou s HŽT/HŽT+PE rozdíly co do krvácivých komplikací či výskytu recidivy žilních tromboembolických komplikací (0,86 % versus 1,94 %), ačkoli recidiva ve formě izolované PE byla opět častější ve skupině s izolovanou PE. Zajímavým zjištěním byl vyšší výskyt arteriálních příhod (infarkt myokardu, cévní mozková příhoda, tranzitorní ischemická ataka či periferní tepenný uzávěr) během follow‑up právě ve skupině s izolovanou PE (1,01 % versus 0,28 %, p = 0,008) (20).
3. Další studie výskytu izolované PE
- Američtí autoři provedli retrospektivní analýzu 2700 CT hrudníku, z toho bylo u 230 nalezena PE. Z těchto byl ultrazvukovým vyšetřením (USG) žil HK i DK nalezen zdroj, resp. HŽT u 57 %; 23 % mělo negativní nález na ultrazvuku žil DK, ale neměli provedeno USG žil HK; u 13,5 % nebyly ultrazvukem vyšetřeny žíly DK ani HK; 6,5 % pacientů mělo USG žil HK i DK bez průkazu trombu. K metodologii studie lze namítnout, že se jedná o retrospektivní analýzu; není uvedeno, zda pacienti měli či neměli příznaky HŽT; autoři se zaměřili na potenciální zdroj i v HK, což v ostatních uvedených studiích vyšetřováno nebylo. Poté byly porovnány charakteristiky dvou z uvedených podskupin – pacientů s prokázanou HŽT a těch, kteří měli ultrazvukem vyloučenu trombózu na DK i na HK. Jediným statisticky významným rozdílem mezi porovnávanými dvěma skupinami byl vyšší výskyt malignity u pacientů s izolovanou PE (21).
- Další americká studie retrospektivně analyzovala výskyt izolované PE u 2 881 pacientů hospitalizovaných na traumatologii. U těch bylo pravidelně (1–2× týdně) prováděno screeningové ultrazvukové vyšetření žil DK k vyloučení HŽT. V této skupině došlo v 31 případech k PE v intervalu do 6 týdnů od úrazu, z toho se v nadpoloviční části (61 %) jednalo o izolovanou PE. Byť se jednalo o malou skupinu pacientů, autoři se pokusili najít rozdíly mezi nemocnými s izolovanou PE a PE asociovanou s HŽT. Pacienti s izolovanou PE byli mladší, měli častěji fraktury žeber, kontuzi plic a plicní symptomatologii, na CT obraze se izolovaná PE spíše nacházela v periferní lokalizaci (22).
Možné patofyziologické mechanismy
Rizikové faktory HŽT, PE asociované s HŽT i izolované PE či PAT in situ jsou znázorněny na obr. 1. Uplatňují se mnohé patofyziologické mechanismy, celkově zapadající do některé složky Virchowovy triády.
Obr. 1. Rizikové faktory hluboké žilní trombózy, plicní embolie asociované s hlubokou žilní trombózou a plicní arteriální trombózy in situ. Upraveno dle (2) 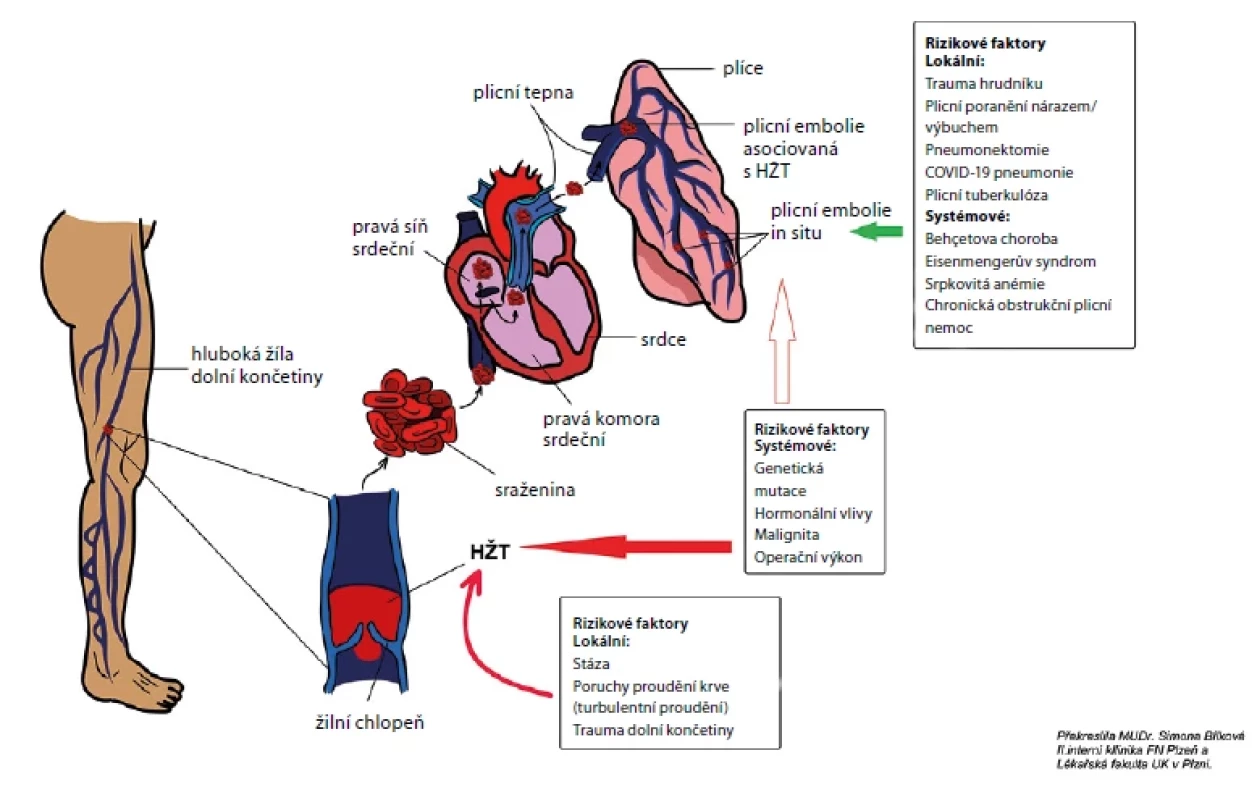
Specifické rizikové faktory PAT zahrnují prokoagulační stav i lokální faktory v plicním řečišti – hypoxie, zánětlivé procesy, dysfunkce a poškození endotelu plicních cév – viz obrázek 2.
Obr. 2. Patogenetické mechanismy plicní arteriální trombózy (PAT) 
Poškození endotelu v plicním řečišti v důsledku hypoxie a zánětu, následná aktivace koagulační kaskády.
1) Poškození endoteliálních buněk, upregulace exprese TF na monocytech
2) Poškozené endoteliální buňky stimulují uvolnění P-selektinu z trombocytů, což dále zvyšuje produkci TF
3) Endoteliální buňky samotné uvolňují P-selektin, ten adheruje k trombocytům a leukocytům, čímž facilituje jejich navázání na endotelie
4) Zvýšená produkce TF stimuluje tvorbu trombinu, jehož působením nastává přeměna fibrinogenu na fibrin
5) Navázané leukocyty a trombocyty jsou zavzaty do fibrinové sítě a dochází ke vzniku plicní arteriální trombózy in situ
TF – tissue factor, tkáňový faktor; WPb – Weibel-Paladeho tělíska; PSGL-1 – P-selektinový glykoproteinový ligand 1
Upraveno dle (2)- Poranění hrudníku kontuzí či tlakovou vlnou vede k destrukci alveolárních kapilár a k exsudaci do plicního intersticia, může způsobit atelektázu, hypoxii a hypoxickou vazokontrikci. Zánětlivé buňky infiltrují poraněnou plicní tkáň a uvolňují zánětlivé mediátory, např. interleukin-6 a interleukin-8. Následuje aktivace endotelu a lokální aktivace koagulace.
- U pacientů po pneumonektomii či lobektomii se kromě operačního traumatu může uplatňovat i stáza krve v pahýlu plicní tepny a pravděpodobně i hyperkogulační stav asociovaný s malignitou (pro kterou byl pacient operován).
- U postiradiační PAT dochází k přímému poškození endotelu, fibrotickým změnám, postižení vasa vasorum, akceleraci aterosklerózy.
- Lokální zánětlivé změny s následnou aktivací koagulace a inhibicí fibrinolýzy se uplatňují v případě CHOPN, pneumonie či bronchiálního astmatu.
- U onemocnění covid-19 je patogeneze ještě složitější. Coronavirus má široký tkáňový a orgánový tropismus, primárně však zasahuje plíce. V těžších případech covidu-19 dochází k vývoji tzv. protrombotické koagulopatie, tzv. „COVID associated coagulopathy“ (CAC). Etiopatogeneze této specifické koagulopatie je nejspíše komplexní. V rámci silné imunitní odpovědi dochází k uvolnění řady zánětlivých mediátorů (cytokinová bouře), k tvorbě tzv. neutrofilních extracelulárních pastí (neutrophil extracellular traps, NET), k aktivaci komplementu a k dysfunkci endotelu. Virus způsobuje i přímé poškození cévního endotelu (svou invazí cestou receptoru ACE2 – angiotensin converting enzyme 2). Následkem těchto dějů je aktivace koagulace, potlačení funkce přirozených inhibitorů koagulace, aktivace trombocytů, porucha fibrinolýzy. Celý proces bývá označován jako imuno‑trombóza. Výsledkem může být jak makrovaskulární trombóza, tak i difuzní tromby v plicní mikrocirkulaci.
- Srpkovitá anémie navozuje prokoagulační stav v důsledku expozice fosfatidyletanolaminu a fosfatidylserinu na povrchu erytrocytů, povrch pak váže koagulační faktory.
- PAT u Behçetovy choroby může vzniknout jako komplikace vaskulitidy, poškození endotelu či aneuryzmatu plicní tepny.
- U pacientů s Eisenmengerovým syndromem dochází v důsledku plicní hypertenze ke strukturálním a funkčním změnám ve stěně plicních tepen, může se vyvinout aneuryzma s následnou komplikací ve smyslu stázy a nástěnného trombu, rovněž se popisuje dysfunkce endotelu (2, 13, 17, 23).
Izolovaná PE – praktické implikace
V klinické praxi je vhodné v určitých situacích na možnost PAT in situ myslet.
PAT může být např. příčinou některých neobjasněných případů chronické tromboembolické plicní hypertenze (CTEPH). Značná část pacientů s CTEPH totiž nemá anamnézu prodělané tromboembolické příhody a nabízí se vysvětlení, že v těchto případech předcházela právě PAT in situ s neúplnou rekanalizací.
V praxi je důležité rozlišit PAT in situ od „klasické“ PE. Rozlišení klasické PE a PAT in situ nemusí být vždy snadné, ale klinik ve spolupráci s radiologem by se o to měli pokusit, např. z nálezu na CTAG a z klinických souvislostí (např. dle přítomnosti či nepřítomnosti některých typických rizikových faktorů PAT a také dle klinické manifestace – u PAT většinou nedochází ke vzniku symptomů akutně). Prognóza i terapeutický přístup se totiž u obou těchto jednotek může lišit.
U klasické PE je základem antikoagulační léčba. V některých případech PAT in situ je použití antikoagulační léčby kontroverzní (např. trombóza v pahýlu plicní tepny po pneumonektomii, PAT u Eisenmengerova syndromu). Naopak často je v případě PAT nutné léčit základní diagnózu (např. imunosupresivní terapie u Behçetovy choroby, léčba covid‑pneumonie a jiných plicních infekčních a zánětlivých nemocí apod.).
Rozlišení klasické PE a PAT in situ může také hrát roli ve specifické situaci, resp. u pacientů, u nichž je zvažována indikace k implantaci filtru dolní duté žíly (typicky pacient s akutní TEN a kontraindikací antikoagulační léčby). Doporučení odborných společností k implantaci filtru dolní duté žíly nezmiňují konkrétně PAT in situ. Nicméně cílem kaválního filtru je zachytit trombotické hmoty pocházející z pánevních či končetinových žil a zabránit jejich embolizaci do plicní tepny, v případě trombózy primárně vytvořené v plicní tepně je tedy jeho implantace bezpředmětná.
Závěr
Termín izolovaná PE se užívá ne zcela přesně a konzistentně, někdy pro označení symptomatické PE, u níž chybí příznaky HŽT, někdy pro PE, u níž nebyl zobrazovací metodou prokázán zdroj v žilách DK. Může se jednat o „klasickou“ PE s neodhaleným zdrojem v méně obvyklé lokalizaci (např. pánevních žilách, v žilách HK, v pravém srdci) či vzniklou jako následek embolizace celého trombu z žil DK, nebo o poněkud odlišnou klinickou jednotku – PAT in situ. Ta se vyznačuje specifickými rizikovými faktory a od klasické PE se může odlišovat prognózou i terapeutickým přístupem.
Podpořeno Kardiovaskulárním výzkumným programem Univerzity Karlovy „COOPERATIO – kardiovaskulární vědy“
doc. MUDr. Jana Hirmerová, Ph.D.
II. interní klinika LFUK a FN Plzeň
hirmerova@fnplzen.czCit. zkr: Vnitř Lék. 2023;69(1):8-13
Článek přijat redakcí: 1. 12. 2022
Článek přijat po recenzích: 23. 1. 2023
Zdroje
1. Kumar DR, Hanlin E, Glurich I, et al. Virchow’s contribution to the understanding of thrombosis and cellular biology. Clin Med Res. 2010;8(3-4):168-172.
2. Cao Y, Geng C, Li Y, Zhang Y. In situ Pulmonary Artery Thrombosis: A Previously Overlooked Disease. Front Pharmacol. 2021;12 : 671589.
3. Kearon C. Natural history of venous thromboembolism. Circulation. 2003;107(23 Suppl 1):I22-I30.
4. Bounameaux H. Factor V Leiden paradox: risk of deep‑vein thrombosis but not of pulmonary embolism. Lancet. 2000;356(9225):182-183.
5. Manten B, Westendorp RG, Koster T, Reitsma PH, Rosendaal FR. Risk factor profiles in patients with different clinical manifestations of venous thromboembolism: a focus on the factor V Leiden mutation. Thromb Haemost. 1996;76(4):510-513.
6. Diebold J, Löhrs U. Venous thrombosis and pulmonary embolism. A study of 5039 autopsies. Pathol Res Pract. 1991;187(2-3):260-266.
7. Urbanová D, Staněk V. Čas Lék čes. 1990,129 : 747-50.
8. Canty D, Mufti K, Bridgford L, Denault A. Point‑of‑care ultrasound for deep venous thrombosis of the lower limb. Australas J Ultrasound Med. 2019;23(2):111-120.
9. Vítovec M, Pecháček V. Doporučení pro duplexní ultrazvukové vyšetření končetinových žil. Vnitr Lek. 2009;55(2):136-146.
10. Hirmerova J, Seidlerova J, Chudacek Z. The Prevalence of Concomitant Deep Vein Thrombosis, Symptomatic or Asymptomatic, Proximal or Distal, in Patients With Symptomatic Pulmonary Embolism. Clin Appl Thromb Hemost. 2018;24(8):1352-1357.
11. van Langevelde K, Srámek A, Vincken PW, et al. Finding the origin of pulmonary emboli with a total‑body magnetic resonance direct thrombus imaging technique. Haematologica. 2013;98(2):309-315.
12. van Dam LF, Dronkers CEA, Gautam G, et al. Magnetic resonance imaging for diagnosis of recurrent ipsilateral deep vein thrombosis. Blood. 2020;135(16):1377-1385.
13. Silversides CK, Granton JT, Konen E, Hart MA, Webb GD, Therrien J. Pulmonary thrombosis in adults with Eisenmenger syndrome. J Am Coll Cardiol. 2003;42(11):1982-1987.
14. Kwek BH, Wittram C. Postpneumonectomy pulmonary artery stump thrombosis: CT features and imaging follow‑up. Radiology. 2005;237(1):338-341.
15. Seyahi E, Melikoglu M, Akman C, et al. Pulmonary artery involvement and associated lung disease in Behçet disease: a series of 47 patients. Medicine (Baltimore). 2012;91(1):35-48.
16. Cha SI, Choi KJ, Shin KM, et al. Clinical characteristics of in‑situ pulmonary artery thrombosis in Korea. Blood Coagul Fibrinolysis. 2015;26(8):903-907.
17. Ahuja J, Shroff GS, Benveniste MF, Marom EM, Truong MT, Wu CC. In Situ Pulmonary Artery Thrombosis: Unrecognized Complication of Radiation Therapy. AJR Am J Roentgenol. 2020;215(6):1329-1334.
18. Katsoularis I, Fonseca‑Rodríguez O, Farrington P, et al. Risks of deep vein thrombosis, pulmonary embolism, and bleeding after covid-19: nationwide self‑controlled cases series and matched cohort study. BMJ. 2022;377:e069590.
19. van Langevelde K, Flinterman LE, van Hylckama Vlieg A, et al. Broadening the factor V Leiden paradox: pulmonary embolism and deep‑vein thrombosis as 2 sides of the spectrum. Blood. 2012;120(5):933-946.
20. Palareti G, Antonucci E, Dentali F, et al. Patients with isolated pulmonary embolism in comparison to those with deep venous thrombosis. Differences in characteristics and clinical evolution. Eur J Intern Med. 2019;69 : 64-70.
21. Schwartz T, Hingorani A, Ascher E, et al. Pulmonary embolism without deep venous thrombosis. Ann Vasc Surg. 2012;26(7):973-976.
22. Van Gent JM, Zander AL, Olson EJ, et al. Pulmonary embolism without deep venous thrombosis: De novo or missed deep venous thrombosis?. J Trauma Acute Care Surg. 2014;76(5):1270-1274.
23. Bílková S, Hirmerová J. Koagulopatie asociovaná s onemocněním COVID-19. Vnitr Lek. 2020, 66(7):402-408.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Histaminová intoleranceČlánek Novinky v kardiologii 2022Článek ESC 2022 a studie DELIVERČlánek Zprávy o knihách
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2023 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Jistoty a nejistoty na křižovatkách současné medicíny
- Izolovaná plicní embolie – specifická klinická jednotka?
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
- Infekční komplikace syndromu diabetické nohy – diagnostika a léčba
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Histaminová intolerance
- Črevný mikrobióm a transplantácia obličky
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Novinky v kardiologii 2022
- ESC 2022 a studie DELIVER
- Zprávy o knihách
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Histaminová intolerance
- Diferenciální diagnostika urychlení sedimentace erytrocytů
- Dentálne výkony pri perorálnej antitrombotickej liečbe
- Co je nového v doporučeních ESC 2022 pro předoperační vyšetření a perioperační péči
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



