-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Osteoporóza u dospělých osob v klinické praxi (1): diagnostika a diferenciální diagnostika
Osteoporosis in adults in clinical practice (1): diagnosis and differential diagnosis
Osteoporosis is a systemic metabolic disease of the skeleton characterized by low bone strength that results in an increased risk of fracture. Fractures are associated with serious clinical consequences, including pain, disability, loss of independence, and death, as well as high healthcare costs. Early identification and intervention with patients at high risk for fracture is needed to reduce the burden of osteoporotic fractures. The identification of a patient at high risk of fracture should be followed by evaluation for factors contributing to low bone mineral density (BMD) and/or low bone quality, falls, and fractures. Components of the osteological evaluation include an assessment of BMD by dual-energy X-ray absorptiometry, osteoporosis-directed medical history and physical exam, laboratory studies, and possibly skeletal imaging. Disorders other than osteoporosis, requiring other types of treatment, may be found. This overview summarizes the basic procedures for the diagnosis and differential diagnosis of osteoporosis, which are necessary before starting treatment.
Keywords:
diagnosis – fractures – differential diagnosis – osteoporosis
Autori: Vít Zikán
Pôsobisko autorov: Osteocentrum, 3. interní klinika 1. LF UK a VFN, Praha
Vyšlo v časopise: Vnitř Lék 2023; 69(E-4): 4-15
Kategória:
doi: https://doi.org/10.36290/vnl.2023.052Súhrn
Osteoporóza je systémové metabolické onemocnění skeletu charakterizované sníženou pevností kostí, která má za následek zvýšené riziko zlomenin. Zlomeniny jsou spojeny s vážnými klinickými následky, včetně bolesti, invalidity, ztráty soběstačnosti a předčasného úmrtí, stejně jako vysokých nákladů na zdravotní péči. Včasná identifikace a intervence u pacientů s vysokým rizikem zlomeniny je nutná ke snížení zátěže v důsledku zlomenin. Po identifikaci pacienta s vysokým rizikem zlomeniny by mělo následovat vyhodnocení faktorů přispívajících k nízké denzitě kostního minerálu (BMD) a špatné kvalitě kosti, pádům a zlomeninám. Osteologické vyšetření zahrnuje hodnocení BMD pomocí dvouenergiové rentgenové denzitometrie, anamnézu a fyzikální vyšetření zaměřené na osteoporózu, laboratorní vyšetření a případně další zobrazovací metody. Mohou se objevit i jiná metabolická nebo nádorová onemocnění skeletu než osteoporóza, která vyžadují jiné typy léčby. V tomto přehledu jsou shrnuty základní postupy diagnostiky a diferenciální diagnostiky osteoporózy, které jsou nezbytné před zahájením léčby.
Klíčová slova:
diagnostika – osteoporóza – zlomeniny – diferenciální diagnostika
Úvod
Osteoporóza je systémové metabolické onemocnění skeletu charakterizované sníženou pevností kostí a zvýšeným rizikem zlomenin. Porucha mechanické odolnosti kosti vzniká v důsledku úbytku kostní hmoty a /nebo zhoršení její kvality (1). Jde o závažné, chronické a progresivní metabolické onemocnění skeletu. Zlomeniny obratlů, zlomeniny kyčle a zlomeniny proximálního humeru a distálního úseku předloktí jsou společně považovány za hlavní osteoporotické zlomeniny. Bylo prokázáno, že jsou spojeny se zvýšeným rizikem následných zlomenin, se sníženou kvalitou života, invaliditou a zvýšenou mortalitou (2–4). Průměrné celoživotní riziko 50leté osoby utrpět jednu z hlavních osteoporotických zlomenin je odhadováno na téměř 50 % u žen a na 22 % u mužů (5). Obecně se osteoporotické zlomeniny mohou vyskytovat i na mnoha jiných anatomických místech, jako je pánev, tibie nebo žebra (6). Předpokládá se, že mezi lety 2010 a 2040 se počet osob s vysokým rizikem zlomenin celosvětově zdvojnásobí (7). V Evropské unii, ve Spojeném království a Švýcarsku (země EU 27 + 2) se odhaduje, že do roku 2034 bude postiženo zlomeninami více než 5,3 milionu osob, což je nárůst o 1,06 milionů (24,8 %) od roku 2019 (8). Podle diagnostických kritérií Světové zdravotnické organizace pro osteoporózu na základě měření BMD bylo v roce 2019 v České republice přibližně 572 000 osob s osteoporózou, z nichž přibližně 80 % tvořily ženy (9). Prevalence osteoporózy v celkové populaci ČR činila 5,0 %, což je srovnatelné s průměrem EU 27 + 2 (5,6 %). Očekává se, že současný rostoucí trend stárnoucí populace bude v příštích letech pokračovat a bude tedy doprovázen i rostoucí zátěží zlomeninami (8). Incidence zlomenin v roce 2019 se v ČR odhadovala na 91 000, což odpovídá 250 zlomeninám denně. Očekává se, že roční počet osteoporotických zlomenin v ČR vzroste v roce 2034 o 32 000 na 123 000 (9). Osteoporóza má řadu příčin a s její manifestací se setkávají prakticky všechny medicínské odbornosti. Protože osteoporóza je dlouhou dobu asymptomatická, začíná péče o pacienty již u lékařů, kteří zajišťují primární prevenci. Včasná identifikace a intervence u pacientů s vysokým rizikem zlomeniny je klíčová pro snížení zátěže osteoporotickými zlomeninami. Management pacienta s denzitometrickou diagnózou osteoporózy nebo nízké kostní hmoty (osteopenie) a nízkotraumatické zlomeniny zahrnuje posouzení sekundárních příčin fragility skeletu, posouzení pravděpodobnosti prodělat v dalších 10 letech zlomeninu, rozhodnutí o zahájení léčby a identifikaci všech relevantních klinických faktorů, které mohou ovlivnit jeho léčbu (10). Vzhledem k rozsahu problematiky je nezbytné, aby management osteoporózy zajišťovali lékaři různých specializací ve spolupráci s klinickými osteology. Článek (I) shrnuje základní postupy diagnostiky a diferenciální diagnostiky osteoporózy, které jsou nezbytné před zahájením léčby.
Klasifikace osteoporózy
Osteoporózu klasifikujeme jako primární a sekundární. Zvláštní jednotky představují stavy s lokálním úbytkem kostní hmoty.
Primární osteoporóza
Mezi primární osteoporózu patří idiopatická osteoporóza (IOP) u mladých dospělých osob a involuční osteoporóza (11). Diagnóza IOP je stanovena per exclusionem až po vyloučení známých sekundárních nebo genetických příčin osteoporózy (12). Zlomeniny mohou být opakované, častěji byly dokumentovány zlomeniny obratlů. Nízkou BMD u konstitučně štíhlých osob, ale bez prevalentních zlomenin nelze automaticky považovat za IOP, jelikož samotná nízká BMD může být důsledkem nedosažené vrcholové kostní hmoty u jinak zdravých osob a souvisí s genetickou predispozicí a životosprávou nebo nemocemi během vývoje skeletu. U mužů byla dokumentována nižší tělesná hmotnost a snížená BMD v oblasti bederní páteře a také tenčí kortikální kost v oblasti dlouhých kostí. Zlomeniny obratlů, které jsou běžné u mužské IOP, byly spojeny se zvýšenou kortikální porozitou v oblasti lopaty kosti kyčelní. Nízká kostní novotvorba u mužů byla asociována s nízkými cirkulujícími hladinami IGF-1 a volného estradiolu a vyššími koncentracemi SHBG. U mužů byla dokumentována i genetická predispozice (byly zjištěny např. polymorfismy genu pro LRP5) a může se uplatnit i nízká vrcholová kostní hmota. Kostní biopsie z lopaty kosti kyčelní u premenopauzálních žen s IOP dokumentovaly nedostatečnou kostní novotvorbu a významně tenčí kortikální kost i kostní trámce. Nízká kostní novotvorba asociovala s vyššími cirkulujícími koncentracemi IGF-1 a tedy s možnou rezistencí osteoblastů na IGF 1 (13). Byl dokumentován také zvýšený kostní obrat a snížené sérové koncentrace volného estradiolu. Involuční osteoporóza je spojována se stárnutím a vzniká v důsledku zhoršování kvality kosti, kdy s věkem klesá osteoblastická kostní novotvorba a přidávají se faktory, které zvyšují kostní resorpci (např. úbytek svalové hmoty a nedostatek vitaminu D). Mezi typické zlomeniny u žen nad 65 let věku a u mužů nad 70 let patří neobratlové zlomeniny, které tvoří 80 % všech zlomenin (11).
Sekundární osteoporóza
Sekundární příčiny osteoporózy jsou uvedeny v tabulce 1 (14). Objasnění sekundárních příčin osteoporózy je klíčové pro volbu kauzálních léčebných opatření, která mohou významně snížit riziko zlomenin. Nejčastějším typem sekundární osteoporózy je postmenopauzální osteoporóza, pro kterou je charakteristický zrychlený úbytek kostní hmoty po menopauze, který trvá 5–10 let v důsledku deficitu estrogenů a dalších faktorů, jako je chronický zánět. Velmi častým typem sekundární osteoporózy je glukokortikoidy indukovaná osteoporóza (15). U řady onemocnění, jako jsou např. revmatické a gastrointestinální zánětlivé choroby, je etiopatogeneze osteoporózy komplexní (kombinace systémového zánětu, deficitu estrogenů a vitaminu D, léčba glukokortikoidy ad.). V klinické praxi je důležité nepřehlédnout i subklinické formy onemocnění, např. subklinický hyperkortizolismus, asymptomatická primární hyperparatyreóza nebo malabsorpce při celiakii, která nemusí mít u dospělých osob klasické gastrointestinální příznaky. Zvláštní jednotky představují stavy s lokálním úbytkem kostní hmoty, např. komplexní regionální bolestivý syndrom (Sudeckova atrofie kosti), regionální osteoporóza po fixaci končetiny, při zánětlivém procesu ad.
Tab. 1. Sekundární příčiny osteoporózy a zlomenin 
Tab. 1. Sekundární příčiny osteoporózy a zlomenin – pokračování 
Vysvětlivky: HIV – virus lidské imunodeficience; GnRH – hormon uvolňující gonadotropin; SSRI – selektivní inhibitor zpětného vychytávání serotoninu. Diagnostika
Anamnéza rizikových faktorů osteoporózy a zlomenin (nástroj FRAX) je klíčová pro indikaci dvouenergiové rentgenové kostní denzitometrie (dual energy X‑ray absorptiometry, DXA) a osteologického vyšetření. Osteologické vyšetření včetně DXA je doporučeno provést u osob s prodělanou nízkotraumatickou zlomeninou typickou pro osteoporózu (zejména u postmenopauzálních žen a u mužů starších 50 let) nebo u chronických onemocnění a dalších stavů, které jsou spojeny s úbytkem a zhoršením kvality kostní hmoty (Tab. 1, 2).
Tab. 2. Indikace kostní denzitometrie (DXA) a morfometrie obratlů (RTG nebo VFA) 
*Zlomeniny v dětství a dospívání jsou běžné a obvykle traumatické, samotná anamnéza takové zlomeniny nepředstavuje indikaci pro DXA a další vyšetření. Na druhé straně mladí dospělí, kteří utrpěli zlomeninu obratle nebo mnohočetné zlomeniny nebo trpí chronickým onemocněním, které poškozuje skelet, by měli absolvovat osteologické vyšetření včetně DXA.
**Pokud užívají nebo začnou užívat dlouhodobě p.o. glukokortikoidy, pokud mají primární hyperparatyreózu, hyperkortizolismus, hypertyreózu; malabsorpci nebo je vysoká pravděpodobnost zlomeniny na základě vyšetření FRAX.Hodnocení množství kostní hmoty
Standardem pro diagnostiku osteoporózy je hodnocení BMD metodou DXA v oblasti krčku femuru, celkového proximálního femuru a bederní páteře (L1–L4) nebo v oblasti distálního úseku radia (1/3 radius), pokud oblast proximálního femuru a/nebo páteře nelze validně interpretovat (např. při degenerativních změnách), při hyperparatyreóze nebo u obézních pacientů při překročení váhového limitu přístroje (1, 16). DXA měří plošnou (areal) BMD v g/cm2. Směrodatná odchylka od průměru BMD u populace mladých zdravých dospělých osob se označuje jako T‑skóre. Osteoporóza je definována podle WHO u postmenopauzálních žen a u mužů starších 50 let jako snížení BMD alespoň o 2,5 směrodatné odchylky (SD) proti průměru u mladých dospělých osob (T‑skóre ≤ -2,5 SD) (1). Manifestovaná (těžká) osteoporóza je definována současně přítomností alespoň 1 osteoporotické zlomeniny. Pacienti s T‑skóre v rozmezí mezi -1 až -2,5 SD se řadí do kategorie osteopenie, která znamená podprůměrný, ale ještě normální nález (nejedná se o nemoc). Pacienti s osteopenií ale mohou mít vyšší riziko zlomenin, pokud je současně poškozená kvalita kosti. Mezinárodní společnost pro klinickou denzitometrii (ISCD) i IOF (Mezinárodní nadace pro osteoporózu) doporučuje užívání jednotné referenční databáze bílých žen ve věku 20–29 let (NHANES III) pro hodnocení T‑skóre proximálního femuru a krčku femuru u žen i u mužů bez ohledu na etnikum (17, 18). Referenční databáze pro T‑skóre bederní páteře a distálního úseku předloktí jsou vypočteny zvlášť pro muže i ženy všech etnik obvykle podle výrobce DXA skeneru. U mužů ≤ 50 let věku a u premenopauzálních žen doporučuje ISCD pro hodnocení plošné BMD užívat Z‑skóre (srovnání s populací stejného pohlaví a odpovídajícího kalendářního věku) (16). Hodnoty Z‑skóre ≤ -2,0 se považují za „významně snížené vzhledem ke kalendářnímu věku“. Pro spolehlivou diagnózu osteoporózy u mladých osob je vyžadována jak nízká BMD (Z‑skóre ≤ 2 SD), tak současná přítomnost nízkotraumatické zlomeniny nebo sekundárních faktorů a klinických stavů, které vedou k úbytku kostní hmoty a zvyšují riziko zlomenin.
Výhodou DXA oproti jiným metodám je velmi nízká radiační expozice (při vyšetření BMD jednoho místa <0,4-5 μSv), rychlost vyšetření a vysoká reprodukovatelnost (16). DXA má ale řadu technických omezení, které je nutné zvažovat při interpretaci výsledků (19). Páteř není vždy spolehlivým místem pro hodnocení nebo pro diagnostiku osteoporózy u starších lidí kvůli vysoké prevalenci degenerativních změn, které významně nadhodnocují BMD. Nicméně nález nízké BMD v páteři je klinicky významný, zejména u lidí s neúměrně nízkou BMD v páteři ve srovnání s proximálním femurem. Přítomnost osteomalacie podhodnocuje BMD kvůli snížené mineralizaci kosti. V případě lokalizovaných změn BMD v důsledku artrózy, zlomeniny nebo skoliózy je nezbytné postiženou oblast zájmu vyloučit z analýzy a v popisu vyšetření uvést tyto limitace (20).
Cílem měření BMD pomocí DXA je poskytnout diagnostická kritéria, prognostické informace o pravděpodobnosti budoucích fraktur a vstupní hodnoty BMD, které slouží pro sledování vývoje BMD při preventivních nebo léčebných opatřeních. Opakované měření BMD je vhodné k vyloučení pokračující ztráty kostní hmoty a k identifikaci osob s vyšším rizikem zlomeniny, zejména v případě sekundárních faktorů, které mohou vést ke ztrátě BMD. Indikace k DXA vyšetření včetně hodnocení obratlových zlomenin – VFA (Vertebral Fracture Assessment) jsou uvedeny v tabulce (Tab. 2).
Osteoporotické zlomeniny
Mezi typické osteoporotické zlomeniny patří kompresivní zlomeniny obratlů, zlomeniny distálního úseku předloktí, zlomeniny proximálního konce humeru, zlomeniny proximálního konce stehenní kosti (nejčastěji zlomeniny krčku femuru a pertrochanterické zlomeniny), dále zlomeniny žeber, pánve a tibie. Přítomnost nízkotraumatické zlomeniny u postmenopauzálních žen nebo u mužů starších 50 let je silným rizikovým faktorem pro další zlomeniny (21). Každá nízkotraumatická zlomenina zvyšuje riziko následné zlomeniny nejméně dvakrát, a to platí i pro asymptomatické morfometrické zlomeniny obratlů (2. nebo 3. stupně) (22, 23). Nárůst rizika je ještě vyšší při vícečetných zlomeninách obratlů. Po zlomenině je riziko následné zlomeniny nejvyšší v intervalu bezprostředně po zlomenině („imminent risk“), kdy více než 1/3 zlomenin v průběhu následujících deseti let vzniká v prvním roce po zlomenině (24,25). Přibližně polovina všech osob, které utrpěly zlomeninu proximálního femuru, již dříve prodělala osteoporotickou zlomeninu v jiné oblasti skeletu. Je proto mimořádně důležité nepodceňovat i „banální“ nízkotraumatické zlomeniny (např. v oblasti předloktí), které mohou být prvním varováním již probíhající osteoporózy. Zlomeniny rukou, nohou, lebky a krční páteře nejsou považovány za osteoporotická zlomeniny, mj. proto, že nepredikují riziko budoucích zlomenin. Zvláštní pozornost ale vyžadují tzv. „únavové zlomeniny“ (např. metatarsů) nebo „atypické“ zlomeniny diafýzy femuru, které se mohou vyskytovat u vzácných osteopatií, např. při hypofosfatázii (laboratorně je nízká aktivita celkové ALP v séru). Zvláštní skupinu představují atypické zlomeniny při dlouhodobé léčbě aminobisfosfonáty anebo denosumabem (26).
Hodnocení zlomenin obratlů
Většina zlomenin obratlů není v současné době včas diagnostikována, protože jsou minimálně symptomatické nebo asymptomatické a jejich diagnostice není věnována náležitá pozornost (27). Středně těžké zlomeniny obratlů, i když jsou asymptomatické, jsou silné rizikové faktory pro následné zlomeniny obratlů i dalších zlomenin (23, 28, 29). Vyšetření DXA umožňuje vizualizovat laterální snímek páteře (od úrovně Th4 do L4) k detekci zlomenin obratlových těl (Vertebral Fracture Assessment, VFA) (30). Hodnocení přítomnosti obratlových zlomenin zlepšuje hodnocení rizika zlomenin, protože pacienti s prevalentní zlomeninou obratle nemusí mít BMD v pásmu osteoporózy. Výhodou VFA je výrazně nižší radiační zátěž při srovnání se standardními rentgenovými snímky páteře (31). Indikace pro zhodnocení přítomnosti zlomenin obratlů pomocí VFA při DXA nebo radiograficky jsou uvedeny v tabulce 2.
Hodnocení klinických faktorů rizika zlomenin a nástroj FRAX®
I když diagnóza osteoporózy závisí zejména na kvantitativním hodnocení BMD, která je významným faktorem určujícím pevnost kosti, klinický význam osteoporózy spočívá ve zlomeninách, které vznikají po nepřiměřeně malé zátěži. Nízká BMD je důležitý rizikový faktor, který je třeba vzít v úvahu při posuzování rizika zlomenin. Riziko zlomenin se progresivně zvyšuje s klesající BMD (přibližně se zdvojnásobuje při poklesu BMD o každou 1 směrodatnou odchylku) (32). Většina osob, které utrpí zlomeninu, má ale BMD v krčku femuru mimo pásmo osteoporózy (T‑skóre nad -2,5), což svědčí o vlivu dalších faktorů, které ovlivňují kvalitu kosti a riziko zlomenin nezávisle na BMD (33).
Pro identifikaci rizikových osob v klinické praxi je doporučený nástroj FRAX, který kombinuje klinické faktory rizika zlomenin buď současně s hodnotou BMD krčku stehenní kosti nebo bez ní. Kombinace BMD a klinických faktorů rizika zlomenin, nezávislých na BMD, vyjadřuje pravděpodobnost zlomeniny u jednotlivého pacienta lépe než samotné BMD (34). FRAX je založen na analýze dat z 12 velkých prospektivních observačních studií u přibližně 60 000 neléčených mužů a žen v různých oblastech světa a odhaduje pravděpodobnost prodělat zlomeninu kyčle nebo některou z hlavních osteoporotických zlomenin (tj. zlomeninu obratle, kyčle, proximálního humeru a distálního úseku předloktí) v následujících 10 letech. FRAX je dostupný online na http://www.shef. ac.uk/FRAX a na většině verzí softwaru systémů DXA. Vstupem pro FRAX je věk, pohlaví, výška, hmotnost pacienta, odpověď „ano“ nebo „ne“ označující přítomnost nebo nepřítomnost pro každý ze 7 klinických faktorů rizika zlomenin (Tab. 3). Nově je dostupný vstup i pro informaci o skóre trabekulární kosti (TBS).
Tab. 3. Rizikové faktory zlomenin zadávané v nástroji FRAX (upraveno podle 40) 
Pro generování platného výstupu FRAX musí být odpovědi na otázky klinických faktorů rizika zlomenin správné; například nesprávné zadání revmatoidní artritidy nebo užití glukokortikoidů by mohlo zkreslit výsledky směrem k nadhodnocení rizika zlomenin. FRAX může podceňovat nebo nadhodnocovat riziko zlomenin kvůli dichotomizovanému vstupu (ano nebo ne) pro klinické rizikové faktory, které jsou ve skutečnosti spojeny s rozsahem rizika, které se liší podle dávky a trvání expozice nebo závažnosti. FRAX je validován pouze u neléčených pacientů. V této souvislosti vápník a vitamin D nepředstavují léčbu. Odpověď „ano“ pro kategorii sekundární osteoporózy nemá žádný vliv na výpočet rizika zlomeniny, pokud je zadána hodnota BMD krčku stehenní kosti. Některé důležité rizikové faktory zlomenin, jako jsou pády a sarkopenie nebo syndrom křehkosti (frailty), nejsou přímo zahrnuty do FRAX. Také další léky, které zvyšují riziko zlomenin, jako jsou inhibitory aromatázy a androgenní deprivace nebo léčba thiazolidindiony, není v algoritmu FRAX hodnocena. FRAX může podceňovat riziko zlomenin, když je BMD bederní páteře podstatně nižší než BMD krčku stehenní kosti (35). Ačkoli má FRAX omezený vstup proměnných, jsou k dispozici relativně jednoduché aritmetické postupy, které lze užít a upravit odhad pravděpodobnosti na základě znalostí dávky perorálních glukokortikoidů (36); BMD bederní páteře (34); anamnézy častých pádů (37); diabetes mellitus 2. typu (38) nebo recentně prodělané hlavní osteoporotické zlomeniny (39). FRAX je začleněn do mnoha doporučení pro klinickou praxi a v současné době se vypracovávají doporučení i pro ČR. V kombinaci s analýzou nákladů na léčbu lze odvodit úroveň rizika zlomenin, při které je léčba osteoporózy nákladově efektivní. FRAX je vhodný nástroj pro odhad pravděpodobnosti zlomenin v první linii kontaktu např. v ambulanci praktického lékaře nebo internisty u neléčených osob. Odhad pravděpodobnosti prodělat zlomeninu (FRAX) podobně jako hodnotu BMD nelze zaměnit za klinickou diagnózu osteoporózy, ale nástroj lze užít jako vodítko pro klinické rozhodování a vysvětlení rizika zlomenin pro jednotlivé pacienty. Riziko je pacientům nejlépe prezentováno numericky, např. 25% riziko říká, že „ze 100 osob jako vy, během příštích 10 let, 25 prodělá zlomeninu a 75 ne“. Pouze popis rizika se slovy „máte vysokou pravděpodobnost prodělat zlomeninu“ neposkytuje pacientům dostatečnou informaci potřebnou k učinění informovaného rozhodnutí (40).
Osteologické vyšetření
V praxi by osteologické vyšetření mělo zahrnovat úplnou osobní, rodinnou a pracovní anamnézu (Tab. 4), pečlivé fyzikální vyšetření (Tab. 5, 6) a laboratorní diferenciálně diagnostické vyšetření (Tab. 7). Při absenci známé sekundární etiologie osteoporózy je vhodné zvažovat i vzácná genetická (monogenní) onemocnění (Tab. 8) nebo idiopatickou osteoporózu (IOP) zvláště u mladých osob (premenopauzální ženy a muži ≤ 50 let). Diferenciálně diagnostický přístup u osob s nízkou BMD a/nebo zlomeninou znázorňuje schéma.
Tab. 4. Anamnéza při podezření na metabolické onemocnění skeletu (upraveno podle 14) 
Tab. 5. Fyzikální vyšetření 
RA – revmatoidní artritida; OI – osteogenesis imperfecta, SLE – systémový lupus erytematodes Tab. 6. Rizikové faktory pádů (upraveno podle 64) 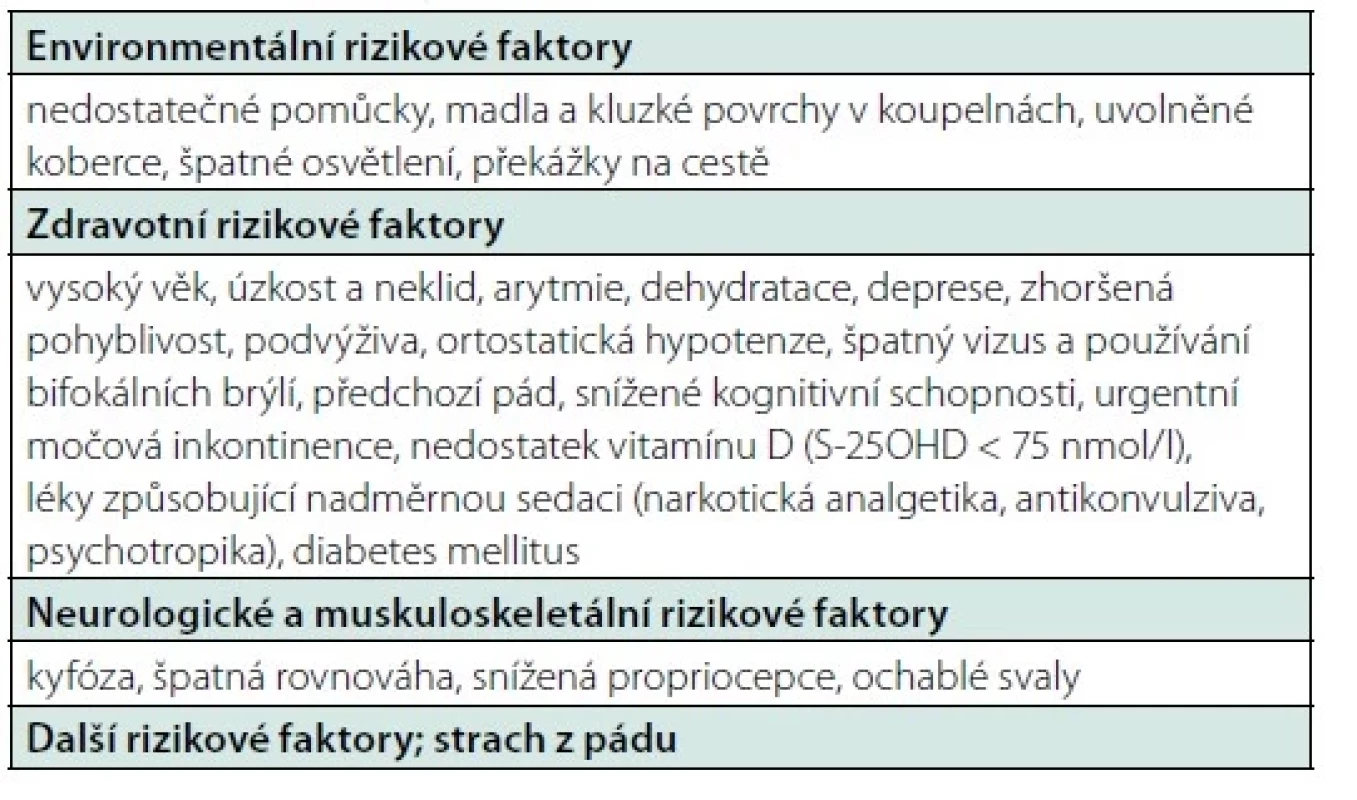
Tab. 7. Diferenciálně diagnostické laboratorní vyšetření při osteoporóze 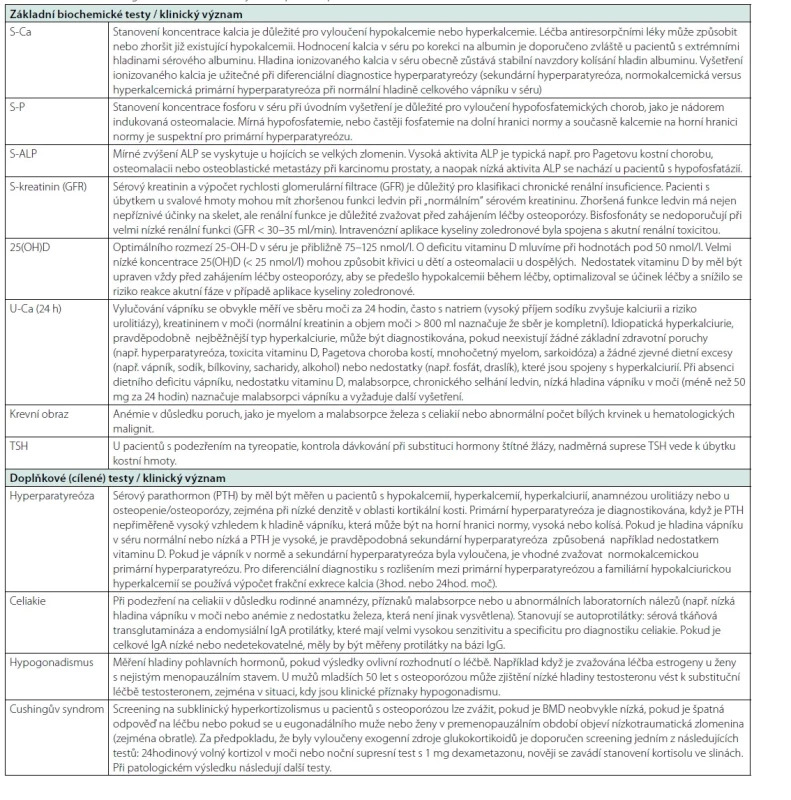
Tab. 7. Diferenciálně diagnostické laboratorní vyšetření při osteoporóze – pokračování 
Další laboratorní testy mohou zahrnovat: S-PSA (prostatický sérový antigen); S-revmatoidní faktor; specifické testování pro vzácné stavy v indikovaných případech, např. hemochromatóza (S-ferritin), hypofosfatázie (U-fosfoethanolamin, S-pyridoxal 5 fosfát), Gaucherova choroba (S-glukocerebrosidáza), anti-HIV protilátky. Tab. 8. Vybrané monogenní choroby, které se manifestují zlomeninou (upraveno podle 65) 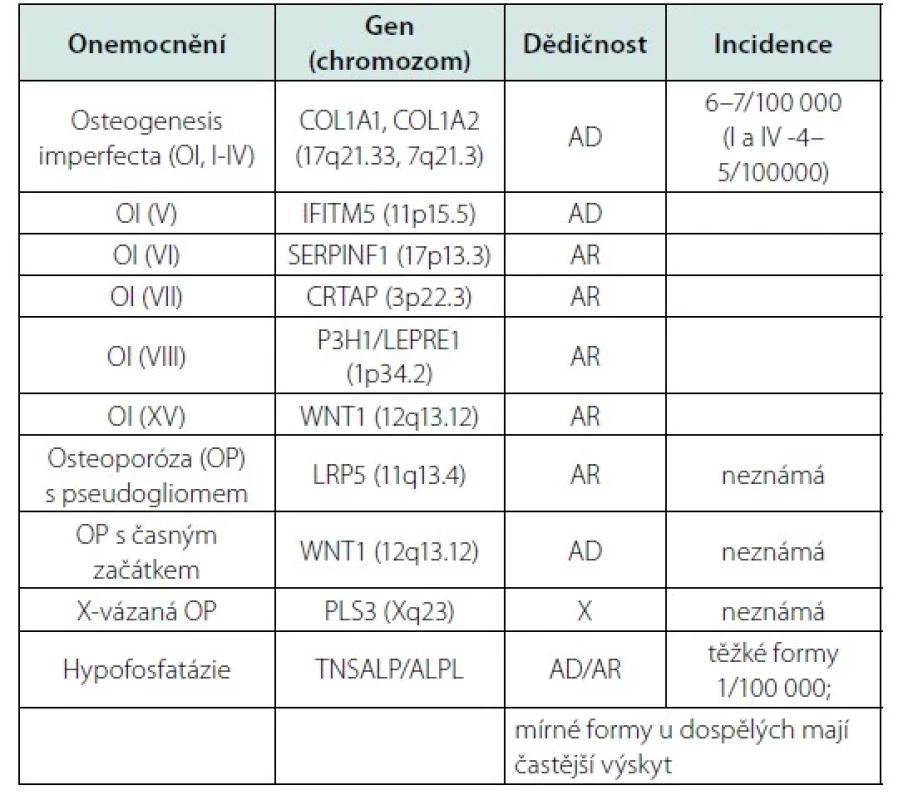
Schéma 1. Schéma postupu vyšetření u dospělých osob s nízkou BMD nebo s anamnézou nízkotraumatické zlomeniny (RF: rizikové faktory osteoporózy a zlomenin, BMD: denzita kostního minerálu) 
Anamnéza
Cílená anamnéza může odhalit důležité informace o rizikových faktorech přispívajících k rozvoji osteoporózy a zlomenin (Tab 3, 4). Anamnestická data jsou klíčová pro indikaci k DXA, hodnocení rizika zlomenin (podklady pro FRAX®), hodnocení sekundárních příčin osteoporózy, pro výběr nejvhodnější léčby ke snížení rizika zlomenin a identifikaci rizikových faktorů, které by mohly snižovat účinnost léčby nebo zvyšovat riziko pádů. Anamnéza by neměla opomenout období dětství a dospívání, které je důležité pro dosažení vrcholové kostní hmoty. Mezi anamnesticky důležité údaje patří údaje o pohybové aktivitě, nutričním stavu (intolerance mléčných výrobků, lepku, dietní opatření, známky malnutrice), věku menarche a nástupu puberty (opožděný nástup puberty je rizikový faktor pro nízký vrchol kostní hmoty). Modré skléry při narození mohou svědčit pro osteogenesis imperfekta a časná ztráta mléčných zubů může být projevem dětské hypofosfatázie. Hodnotíme hormonální stav (u žen poruchy menstruačního cyklu, amenorea, věk menopauzy, počet těhotenství a délka laktace a u mužů příznaky hypogonadismu, ztrátu libida). Anamnéza může odhalit onemocnění a léky s rizikem pro skelet (např. glukokortikoidy nebo komorbidity, které by mohly ovlivnit rozhodnutí o léčbě – např. zúžení jícnu je kontraindikací pro perorální aminobisfosfonáty). Anamnéza častých pádů je významným prediktorem budoucích pádů, přičemž toto riziko je potenciálně modifikovatelné vhodnými intervencemi. Rizikové faktory pádů jsou uvedeny v tabulce 6.
Diferenciální diagnostika
Diferenciálně diagnostická vyšetření u pacientů s nízkou BMD nebo prodělanou nízkotraumatickou zlomeninou by měla vyloučit jiná metabolická nebo nádorová onemocnění, která napodobují osteoporózu, identifikovat možné příčiny sekundární osteoporózy (léky a komorbidity, které mají vliv na kostní metabolismus) (Tab. 1). Nízká kostní denzita (BMD) může být v souvislosti s nedosažením vrcholové kostní hmoty (geneticky determinované maximum kostní hmoty) nebo v důsledku úbytku kostní hmoty v dospělosti (při převaze kostní resorpce nad její novotvorbou). Je pravděpodobné, že většina pacientů s osteoporózou má klinicky významné faktory, které přispívají k úbytku BMD a mohou ovlivnit účinnost léčby. Nedostatek vápníku a vitaminu D nebo sedavý způsob života s nedostatečnou fyzickou aktivitou významně přispívají k úbytku kostní hmoty. Mezi časté příčiny sekundární osteoporózy patří užívání glukokortikoidů, deficit estrogenů nebo hypogonadismus u mužů, úbytek hmotnosti, nedostatek vitaminu D (sérové 25OHD < 50 nmol/l), hyperkalciurie, malabsorpce a primární nebo sekundární hyperparatyreóza. Sekundární osteoporózou a zlomeninami jsou ohroženy ženy s karcinomem prsu léčené inhibitory aromatázy a muži s karcinomem prostaty a androgenní deprivační terapií. Mezi léčitelné, ale snadno přehlédnutelné sekundární příčiny osteoporózy patří asymptomatická primární hyperparatyreóza, subklinická hypertyreóza, subklinický Cushingův syndrom a malabsorpce způsobená nerozpoznanou celiakií. Nízká BMD není typická jen pro osteoporózu, ale také pro osteomalacii (zejména při hypokalcemii), některá hematologická onemocnění (např. mnohočetný myelom) nebo ve spojení s kostní a minerálovou chorobou u pacientů s chronickou nedostatečností ledvin.
Fyzikální vyšetření
Klinický obraz osteoporózy u pacientů bez zlomenin je většinou bez specifických nálezů. Důležité je hledat projevy onemocnění, které mohou sekundárně přispívat k úbytku kostní hmoty a/nebo zhoršení její kvality a vyšší náchylnosti ke zlomeninám (Tab. 5), rozpoznat pacienty s vysokým rizikem pádů (Tab. 6) a identifikovat následky předchozích zlomenin.
Antropometrické údaje
Přesné měření tělesné výšky pomocí kalibrovaného stadiometru a její porovnání s předchozí měřenou nebo maximální (anamnestickou) výškou je důležité pro posouzení možné zlomeniny obratle. Ztráta tělesné výšky ≥ 6,0 cm ve srovnání s historickým maximem nebo ztráta ≥ 2,0 cm ve srovnání s dříve naměřenou výškou naznačuje vysokou pravděpodobnost zlomeniny obratle. Lokalizovaná bolestivost v oblasti páteře, kyfóza nebo zmenšená vzdálenost mezi dolními žebry a okrajem pánve mohou být výsledkem jedné nebo více zlomenin obratlů. Indikace k boční radiografii nebo DXA morfometrii obratlů (VFA) jsou uvedeny v tabulce 2 (Tab. 2). Nález dříve nerozpoznané zlomeniny obratle je významný rizikový faktor dalších zlomenin a může významně ovlivnit diagnostickou klasifikaci a rozhodnutí o léčbě. Nízká tělesná hmotnost (BMI ≤ 19 kg/m2) (47) nebo ztráta tělesné hmotnosti o ≥ 5 % je spojena se zvýšeným rizikem zlomenin (48). Stupeň nechtěného hubnutí si zasluhuje vždy pečlivé zhodnocení a jako jeho práh se uvádí ztráta hmotnosti 5 % během 1 měsíce nebo 10 % během půl roku. Na druhé straně obezita snižuje riziko zlomenin, ale ne na všech místech skeletu, přičemž syndrom křehkosti seniorů („frailty“) oslabuje ochranný účinek obezity u velkých osteoporotických zlomenin (49).
Chůze, svalová síla a rovnováha
Abnormality chůze, držení těla, poruchy rovnováhy, snížení svalové síly nebo přítomnost posturální hypotenze jsou spojeny se zvýšeným rizikem pádu. Mezi příčiny zhoršené chůze a rovnováhy patří neurologická onemocnění (např. CMP, roztroušená skleróza), artróza, svalová slabost a vestibulární poruchy. Jednoduché testy rovnováhy zahrnují stoj na jedné noze a testování tandemové chůze. Kvantitativní testy k posouzení rizika pádu mohou zahrnovat nejčastěji test Timed Up and Go (TUG), kdy pacient musí vstát ze židle, ujít 10 metrů, otočit se a vrátit se zpět na židli a sednout si (50). Z dalších testů je možné provést 30sekundový test Sit‑To‑Stand (30STS) (51) nebo test 5 Times Sit‑To‑Stand (5TSTS), který měří čas 5 opakovaných vstávání a sednutí na židli, kdy pacient sedí opřený o opěradlo židle s rukama založenýma přes hrudník (52). Prodloužený čas v testech TUG nebo 5TSTS ≥ 12 s nebo méně než 7 opakování v modifikovaném 30STS testu bylo spojeno se zvýšeným rizikem pádů u starších institucializovaných osob (53, 54). U pacientů s vysokým rizikem pádů je vhodné intervenovat rizikové faktory (Tab. 6).
Další fyzikální nálezy
Orientačně by měl být vždy zhodnocen zrak a sluch s ohledem na možnosti korekce. Na místě je vždy posouzení stavu chrupu a dutiny ústní. Struma může být přítomna u pacientů s tyreotoxikózou i hypotyreózou. Chirurgické jizvy mohou upozornit na tyreoidektomii nebo paratyreoidektomii, o kterých se pacient nezmínil. Vyšetření kloubů může odhalit nálezy revmatoidní artritidy, rizikového faktoru zlomenin. Deformace skeletu mohou být výsledkem předchozích zlomenin, jako je tomu u kyfózy způsobené zlomeninami obratlů. Lokalizovaná bolestivost trnového výběžku může být výsledkem akutní zlomeniny obratle. Některé deformity skeletu mohou zhoršit chůzi a zvyšují riziko pádů. Modré skléry naznačují osteogenesis imperfecta. Špatný chrup může být pozorován při osteogenesis imperfecta nebo hypofosfatázii a je rizikovým faktorem pro osteonekrózu čelisti. Fyzikální nálezy městnavého srdečního selhání nebo chronické obstrukční plicní nemoci (CHOPN) naznačují křehkost a zvýšené riziko pádů. Léčba těchto onemocnění léky, jako jsou diuretika a glukokortikoidy, může mít důsledky týkající se kalciové homeostázy a rizika zlomenin. Zlomeniny obratlů u pacienta s CHOPN jsou významnou komplikací, protože mohou zhoršit již tak narušenou plicní funkci. Tromboembolické příhody se mohou objevit u některých léků používaných k léčbě osteoporózy, jako jsou estrogeny a raloxifen. Hepatomegalie může být známkou chronického onemocnění jater.
Laboratorní vyšetření
Minimální nezbytná laboratorní vyšetření, která se běžně doporučují všem pacientům s osteoporózou, zahrnují kompletní krevní obraz, rychlost sedimentace erytrocytů, biochemické testy v séru (vápník, albumin, fosfor, alkalická fosfatáza, kreatinin s vypočítanou nebo naměřenou clearance kreatininu, 25 hydroxyvitamin D a TSH, pokud není dokumentováno) a 24hodinové odpady vápníku močí. Tyto testy je nezbytné vyhodnotit vždy před zahájením léčby osteoporózy. Další laboratorní testy mohou být indikovány podle klinického profilu pacienta a nastavení praxe pracoviště (např. biochemické markery kostní remodelace a parathormon). V tabulce 7 je uveden souhrn užitečných běžných i cílených laboratorních vyšetření s komentářem k jejich možnému klinickému významu.
Biochemické markery kostního obratu
Biochemické markery kostního obratu (BTM), jako marker resorpční aktivity osteoklastů C ‑ telopeptid kolagenu typu I (βCTX) a marker syntézy kostního kolagenu intaktní N‑terminální propeptid prokolagenu I (P1NP), nelze použít k určení příčiny osteoporózy, ale mohou být užitečné při odhadu rizika zlomenin, predikci rychlosti úbytku kostní hmoty a hodnocení účinků léčby na kostní remodelaci. BTM v klinických studiích pomohly pochopit mechanismus účinku farmakologické léčby na kost, ale mají řadu úskalí v interpretaci u jednotlivých pacientů (55). BTM se mění v závislosti na povaze onemocnění a jeho závažnosti a aktivitě, terapii, stejně jako na fyzické aktivitě a výživě. Nízký kostní obrat může svědčit pro hyperkortizolismus. Nízká BMD a zvýšené BTM mohou svědčit pro zrychlený úbytek kostní hmoty. Zvýšené hodnoty BTM přetrvávají i několik měsíců po zlomenině. Snížení BTM při antiresorpční léčbě je prediktivní pro následné zvýšení BMD (56) a snížení rizika zlomenin (57). U osteonabolické léčby teriparatidem je časné zvýšení hladin PINP v séruprediktivní pro následné zvýšení BMD (58). Významná změna hladiny BTM ve vhodném směru při léčbě osteoporózy je podpůrným důkazem, že pacient užívá lék pravidelně, správně a že má očekávaný účinek na kostní remodelaci. Použití BTM umožňuje hodnocení účinku léku dříve, než se projeví změny BMD. Lékaři, kteří jsou obeznámeni s výhodami a limitacemi BTM, je považují ve spojení s hodnocením BMD za užitečný nástroj pro monitorování léčby pacientů s osteoporózou.
Genetické (monogenní) příčiny osteoporózy a zlomenin
Nízkotraumatické zlomeniny u mladých dospělých osob mohou ve vzácných případech představovat pozdější projev monogenního onemocnění (59, 60). Bylo popsáno již více než 400 monogenních poruch s kosterními projevy, včetně mutací souvisejících s vyšší lomivostí kostí (61). Častější monogenní choroby, které se manifestují zlomeninou, jsou uvedeny v tabulce 8. U osob s opakovanými nízko‑traumatickými zlomeninami (bez ohledu na BMD) a bez zjištěných sekundárních příčin by měly být vyloučeny zejména mírné formy osteogenesis imperfekta a další vzácnější onemocnění, jako je hypofosfatázie, syndrom osteoporózy s pseudogliomem, Marfanův syndrom a Ehlers‑Danlosův syndrom, Gaucherova a Pompeho choroba nebo endokrinní syndromy (včetně hypogonadotropního hypogonadismu, mutací estrogenových receptorů nebo aromatázy) (62).
Zobrazovací metody
Standardní rentgenové snímky se používají k diagnostice zlomenin všech typů a mohou být užitečné k odhalení sekundární příčiny osteoporózy. Radiologické vyšetření páteře se využívá zejména pro posouzení osteoporotických zlomenin (morfometrie obratlů). Nejčastěji se využívá Genantova klasifikace, která hodnotí postižený obratel v bočné RTG projekci. Jedná se o semikvantitativní schéma, kdy je definována přední, střední a zadní výšku obratlového těla. Výsledné zařazení do skupiny je definováno z poměrů definovaných výšek: stupeň 1: lehká zlomenina (<25% ztráta výšky), stupeň 2: středně těžká zlomenina (25% až 40% ztráta výšky), stupeň 3: těžká zlomenina (>40% ztráta výšky) (63). Pseudofraktury (Looserovy zóny) jsou radiolucentní linie probíhající kolmo ke korikalis, které lze pozorovat u pacientů s osteomalacií. Pravděpodobně představují stresové zlomeniny, které se zhojily špatně mineralizovaným osteoidem. Na rentgenových snímcích kostí pacientů se systémovou mastocytózou lze pozorovat bodové radiolucence. Dlouho nepoznaná primární hyperparatyreóza může způsobit hyperparatyreózní osteodystrofii (kostní cysty, subperiostální kostní resorpci, hnědé nádory a demineralizaci -např. vzor „sůl a pepř“ v oblasti lebky). MRI, CT nebo metody nukleární mediciny lze použít k detekci stresových zlomenin, které nejsou viditelné na rentgenovém snímku. MRI páteře se běžně používá před vertebroplastikou nebo kyfoplastikou k určení stáří zlomeniny, pravděpodobnosti zlomeniny z jiných příčin než osteoporózy a zda dochází k retropulzi kostních fragmentů, která by mohla poškodit neurologické funkce. Scintigrafické vyšetření skeletu s užitím osteotropního radioindikátoru 99mTc‑DMP (metylendifosfonát) je užíváno při detekci kostních lézí se zvýšenou osteoblastickou aktivitou jak u metabolických onemocnění skeletu, tak u nádorového postižení skeletu (posouzení přítomnosti metastáz a staging a vývoj primárních kostních tumorů). Z neonkologických indikací se scintigrafie skeletu užívá při diagnostice (určení rozsahu a aktivity onemocnění) u Pagetovy kostní choroby, fibrózní dysplazie, osteomyelitidy nebo zhodnocení změn při systémových metabolických onemocněních (např. u hyperparatyreózní osteodystrofie nebo osteomalacie). Rovněž v oblasti zlomenin a infrakcí kosti s projevy lokálního hojení lze pozorovat zvýšenou akumulaci radioizotopu v důsledku aktivace osteoblastické aktivity.
Kostní biopsie
Kvantitativní histomorfometrie s biopsií z hřebene kosti kyčelní značenou dvojitým tetracyklinem je metodou „zlatého standardu“ pro diagnostiku osteomalacie a klasifikaci pacientů s renální osteodystrofií. S pokročilými analytickými technikami mohou být kostní biopsie užitečné také při hodnocení vzácných onemocnění kostí, jako je Pagetova kostní choroba, osteogenesis imperfecta, fibrózní dysplazie a progresivní fibrodysplasia ossificans. Nejčastější indikací kostní biopsie bývá diferenciální diagnostika nejasných lokalizovaných kostních procesů, ale v klinické praxi se používá jen zřídka kvůli své invazivní povaze a omezenému počtu pracovišť provádějících výkon a kvalitní interpretaci patologických nálezů.
Závěr
Osteoporóza je nejčastější metabolické onemocnění skeletu s dlouhodobým asymptomatickým průběhem, ale se závažnými klinickými následky. Po identifikaci pacienta s vysokým rizikem zlomeniny by mělo následovat osteologické vyšetření, které zahrnuje kromě hodnocení BMD anamnézu, fyzikální vyšetření a laboratorní vyšetření a případně další zobrazovací vyšetření, která jsou nezbytná k vyloučení sekundární etiologie osteoporózy a jiných metabolických nebo nádorových onemocnění skeletu. Současně je vhodné vyhodnocení individuální pravděpodobnosti prodělat zlomeninu (FRAX) a identifikovat všechny další relevantní klinické faktory, které mohou ovlivnit léčbu (např. nutriční deficity). Vzhledem k rozsahu problematiky je nezbytné, aby management osteoporózy zajišťovali lékaři různých specializací ve spolupráci s pracovišti klinické osteologie. Včasná identifikace a intervence u pacientů s vysokým rizikem zlomeniny je klíčová pro snížení zátěže zlomeninami.
Článek přijat redakcí: 20. 3. 2023
Článek přijat po recenzích: 13. 4. 2023
doc. MUDr. Vít Zikán, Ph.D.
Osteocentrum, 3. interní klinika 1. LF UK a VFN, Praha
Zdroje
1. World Health Organisation (1994) Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organ Tech Rep Ser, 1994/01/01 edn, 1-129.
2. Svedbom A, Borgström F, Hernlund E, et al. Quality of life after hip, vertebral, and distal forearm fragility fractures measured using the EQ-5D-3L, EQ‑VAS, and time‑trade‑of: results from the ICUROS. Qual Life Res. 2018;27 : 707-716.
3. Johansson H, Siggeirsdottir K, Harvey NC, et al. Imminent risk of fracture after fracture. Osteoporos Int. 2017;28 : 775–780.
4. Tran T, Bliuc D, Hansen L, et al. Persistence of excess mortality following individual nonhip fractures: a relative survival analysis. J Clin Endocrinol Metab. 2018;103 : 3205–3214
5. Johnell O, Kanis J Epidemiology of osteoporotic fractures. Osteoporos Int. 2005;16(Suppl 2):S3-7.
6. Warriner AH, Patkar NM, et al. Which fractures are most attributable to osteoporosis. J Clin Epidemiol. 2011;64 : 46–53.
7. Oden A, McCloskey EV, Kanis JA, et al. Burden of high fracture probability worldwide: secular increases 2010–2040. Osteoporos Int. 2015; 26 : 2243-2248.
8. Kanis JA, Norton N, Harvey NC, et al. SCOPE 2021: a new scorecard for osteoporosis in Europe. Arch Osteoporos. 2021;16 : 82.
9. Willers C, Norton N, Harvey NC, et al. Osteoporosis in Europe: a compendium of country‑specific reports. Archives of Osteoporosis. 2022;17 : 23.
10. Kanis JA, Cooper C, Rizzoli R, Reginster JY. Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2019 Jan;30(1):3-44.
11. Štěpán J. Osteoporóza a metabolická onemocnění skeletu. In: Revmatologie. Eds.: Pavelka K, Vencovský J, Horák P, Šenolt L, Mann H, Štěpán J a kol. 2. aktualizované a rozšířené vydání 2018; 600-601.
12. Pepe J, Body JJ, Hadji P, et al. Osteoporosis in Premenopausal Women: A Clinical Narrative Review by the ECTS and the IOF. J Clin Endocrinol Metab. 2020; 1;105(8):dgaa306.
13. Goetz TG, Nair N, Shiau S, et al. In premenopausal women with idiopathic osteoporosis, lower bone formation rate is associated with higher body fat and higher IGF-1.Osteoporos Int. 2022; 33(3):659-672.
14. Lewiecki EM. Evaluating Patients for Secondary Causes of Osteoporosis. Curr Osteoporos Rep. 2022 Feb;20(1):1-12.
15. Laurent MR, Goemaere S, Verroken C et al. Prevention and Treatment of Glucocorticoid‑Induced Osteoporosis in Adults: Consensus Recommendations From the Belgian Bone Club. Front Endocrinol (Lausanne). 2022 Jun 9;13 : 908727.
16. The International Society for Clinical Densitometry (ISCD) official‑positions 2019; https://www.iscd.org/official‑positions/2019-iscd‑official‑positions‑adult/ (Accessed on July 08, 2019)
17. Looker AC, Wahner HW, Dunn WL Calvo MS, Harris TB, Heyse SP, Johnston CC, Jr., Lindsay R (1998) Updated data on proximal femur bone mineral levels of US adults. Osteoporos Int. 8 : 468-489.
18. Kanis JA, Gluer CC (2000) An update on the diagnosis and assessment of osteoporosis with densitometry. Committee of Scientific Advisors, International Osteoporosis Foundation. Osteoporos Int. 11 : 192-202.
19. Watts NB (2004) Fundamentals and pitfalls of bone densitometry using dual‑energy X‑ray absorptiometry (DXA). Osteoporos Int. 15 : 847-854.
20. Jha S, Chapman M, Roszko K. When low bone mineral density and fractures is not osteoporosis. Current Osteoporosis Reports. 2019;17(5):324–32.
21. Leslie WD, Schousboe JT, Morin SN, et al. (2020) Fracture risk following high‑trauma versus low‑trauma fracture: a registry‑based cohort study. Osteoporos Int. 31 : 1059-1067.
22. Kanis J, Johnell O, Laet CD, et al (2004) A meta‑analysis of previous fracture and subsequent fracture risk. Bone. 35 : 375-382.
23. Johansson H, Odén A, McCloskey EV, Kanis JA. Mild morphometric vertebral fractures predict vertebral fractures but not non‑vertebral fractures. Osteoporos Int. 2014; 25 : 235–241.
24. Kanis JA, Johansson H, Odén A, et al. Characteristics of recurrent fractures. Osteoporos Int. 2018;29 : 1747–1757.
25. Kanis JA, Johansson H, Harvey NC, et al. Adjusting conventional FRAX estimates of fracture probability according to the recency of sentinel fractures. Osteoporos Int. 2020;31 : 1817–1828.
26. Starr J, Tay YKD, Shane E. Current Understanding of Epidemiology, Pathophysiology, and Management of Atypical Femur Fractures. Curr Osteoporos Rep. 2018 Aug;16(4):519-529.
27. Fink HA, Milavetz DL, Palermo L, Nevitt MC, Cauley JA, Genant HK. What proportion of incident radiographic vertebral deformities is clinically diagnosed and vice versa? J Bone Miner Res. 2005;20 : 1216-1222.
28. Melton LJ 3rd, Atkinson EJ, Cooper C, O’Fallon WM, Riggs BL. Vertebral fractures predict subsequent fractures. Osteoporos Int. 1999;10 : 214-221.
29. Lindsay R, Silverman SL, Cooper C, et al. Risk of new vertebral fracture in the year following a fracture. JAMA. 2001;285 : 320-323.
30. Jang HD, Kim EH, Lee JC, Choi SW, Kim K, Shin BJ. Current concepts in the management of osteoporotic vertebral fractures: a narrative review. Asian Spine J. 2020;14 : 898-909.
31. Lewiecki EM. Bone densitometry and vertebral fracture assessment. Curr Osteoporos Rep. 2010;8 : 123-130.
32. Johnell O, Kanis JA, Oden A, et al. Predictive value of BMD for hip and other fractures. J Bone Miner Res. 2005;20 : 1185-1194.
33. Kanis JA, Johnell O, Odén A, Dawson A, De Laet C, Jonsson B. Ten‑year probabilities of osteoporotic fractures according to BMD and diagnostic thresholds. Osteoporos Int. 2001;12 : 989-995.
34. Kanis JA, Oden A, Johnell O, et al. The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women. Osteoporos.Int. 2007;18(8):1033-1046.
35. Leslie WD, Lix LM, Johansson H, et al. Spine‑hip discordance and fracture risk assessment: a physician‑friendly FRAX enhancement. Osteoporos Int. 2011;22 : 839-847.
36. Kanis JA, Johansson H, Oden A, McCloskey EV. Guidance for the adjustment of FRAX according to the dose of glucocorticoids. Osteoporos Int. 2011;22(3):809-16.
37. Masud T, Binkley N, Boonen S, Hannan MT. Official Positions for FRAX® clinical regarding falls and frailty: can falls and frailty be used in FRAX®? From Joint Official Positions Development Conference of the International Society for Clinical Densitometry and International Osteoporosis Foundation on FRAX®. J Clin Densitom. 2011;14 : 194-204.
38. Leslie WD, Johansson H, McCloskey EV, Harvey NC, Kanis JA, Hans D. Comparison of Methods for Improving Fracture Risk Assessment in Diabetes: The Manitoba BMD Registry. J Bone Mineral Res. 2018;33 : 1923-1930.
39. Kanis JA, Johansson H, Harvey NC, et al. Adjusting conventional FRAX estimates of fracture probability according to the recency of sentinel fractures. Osteoporos Int. 2020;31 : 1817-182.
40. Gregson CL, Armstrong DJ, Bowden J, et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022 Apr 5;17(1):58.
41. Laet C, Kanis J, Oden A, et al. Body mass index as a predictor of fracture risk: a meta‑analysis. Osteoporos Int. 2005;16 : 1330-1338.
42. Kanis JA, Johansson H, Oden A, et al. A family history of fracture and fracture risk: a meta‑analysis. Bone 2004;35 : 1029-1037.
43. Kanis JA, Johansson H, Oden A, et al. A meta‑analysis of prior corticosteroid use and fracture risk. J Bone Mineral Research. 2004;19 : 893-899.
44. Kanis JA, Johnell O, Oden A, et al. Smoking and fracture risk: a meta‑analysis. Osteoporos Int 2005; 16 : 155-162.
45. Kanis JA, Johansson H, Johnell O, et al. Alcohol intake as a risk factor for fracture. Osteoporos Int. 2005;16 : 737-742.
46. Vilaca T, Schini M, Harnan S, et al. The risk of hip and non‑vertebral fractures in type 1 and type 2 diabetes: a systematic review and meta‑analysis update. Bone 2020; 137 : 115457.
47. de Laet C, Kanis JA, Oden A, et al. Body mass index as a predictor of fracture risk: a meta‑analysis. Osteoporos.Int. 2005;16(11):1330-1338.
48. Vilaca T, Schini M, Harnan S, et al. The risk of hip and non‑vertebral fractures in type 1 and type 2 diabetes: a systematic review and meta‑analysis update. Bone. 2020;137 : 115457.
49. Li G, Compston JE, Leslie WD, et al. Relationship between obesity and risk of major osteoporotic fracture in postmenopausal women: taking frailty into consideration. J Bone Miner Res. 2020;35(12):2355-62.
50. Prevention CfDCa. Timed Up & Go (TUG). Centers for Disease Control and Prevention. 2017. https://www.cdc.gov/steadi/pdf/TUG_test‑print.pdf. Accessed June 19, 2021.
51. Centers for Disease Control and Prevention. 30-Second Chair Stand. Centers for Disease Control and Prevention, 2017. https://www.cdc.gov/steadi/pdf/STEADI‑Assessment-30Sec-508.pdf. Accessed June 19, 2021.
52. Yee XS, Ng YS, Allen JC, Latib A, Tay EL, Abu Bakar HM, Ho CYJ, Koh WCC, Kwek HHT, Tay L. Performance on sit‑to‑stand tests in relation to measures of functional fitness and sarcopenia diagnosis in community‑dwelling older adults. Eur Rev Aging Phys Act. 2021;18(1):1.
53. Lusardi MM, Fritz S, Middleton A, et al. Determining risk of falls in community dwelling older adults: a systematic review and meta‑analysis using posttest probability. J Geriatr Phys Ther. 2017;40(1):1-36.
54. Applebaum EV, Breton D, Feng ZW, et al. Modified 30-second Sit to Stand test predicts falls in a cohort of institutionalized older veterans. PLoS One. 2017;12(5):e0176946.
55. Pikner R, Palička V, Rosa J et al. Markery kostního obratu u osteoporózy: společné stanovisko k jejich využití Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně (SMOS ČLS JEP) a České společnosti klinické biochemie České lékařské společnosti J. E. Purkyně (ČSKB ČLS JEP). Clin Osteol. 2020; 25(2):65-82.
56. Greenspan SL, Parker RA, Ferguson L, et al. Early changes in biochemical markers of bone turnover predict the long‑term response to alendronate therapy in representative elderly women: a randomized clinical trial. J Bone Miner Res. 1998;13 : 1431–143
57. Eastell R, Barton I, Hannon RA, Chines A, Garnero P, Delmas PD. Relationship of early changes in bone resorption to the reduction in fracture risk with risedronate. J Bone Miner Res. 2003;18 : 1051-1056
58. Chen P, Satterwhite JH, Licata AA, et al. Early changes in biochemical markers of bone formation predict BMD response to teriparatide in postmenopausal women with osteoporosis. J Bone Miner Res. 2005;20(6):962-970.
59. Cohen A, Hostyk J, Baugh EH, et al. Whole exome sequencing reveals potentially pathogenic variants in a small subset of premenopausal women with idiopathic osteoporosis. Bone. 2022; 154 : 116253.
60. Stürznickel J, Rolvien T, Delsmann A, et al. Clinical Phenotype and Relevance of LRP5 and LRP6 Variants in Patients With Early‑Onset Osteoporosis (EOOP). J Bone Miner Res. 2021; 36(2):271-282.
61. Mortier GR, Cohn DH, Cormier‑Daire V, et al. Nosology and classification of genetic skeletal disorders: 2019 revision. Am J Med Genet A. 2019; 179(12):2393-2419.
62. Ferrari S, Bianchi ML, Eisman JA, eta l. IOF Committee of Scientific Advisors Working Group on Osteoporosis Pathophysiology. Osteoporosis in young adults: pathophysiology, diagnosis, and management. Osteoporos Int. 2012; 23(12):2735-48.
63. Genant HK, Wu CY, van Kuijk C, et al. Vertebral fracture assessment using a semiquantitative technique. J Bone Miner Res. 1993 Sep;8(9):1137-48.
64. Cosman F, de Beur SJ, LeBoff MS et al. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporos Int. 2014;25(10):2359-81.
65. Ferrari S, Bianchi ML, Eisman JA, eta l. IOF Committee of Scientific Advisors Working Group on Osteoporosis Pathophysiology. Osteoporosis in young adults: pathophysiology, diagnosis, and management. Osteoporos Int. 2012; 23(12):2735-48.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2023 Číslo E-4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
Najčítanejšie v tomto čísle- Komplikácie po podaní mRNA vakcíny proti COVID-19 – kazuistika a krátky prehľad
- Osteoporóza u dospělých osob v klinické praxi (1): diagnostika a diferenciální diagnostika
- Dočasná oběhová nestabilita způsobená TIPS
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



