-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Komplikácie po podaní mRNA vakcíny proti COVID-19 – kazuistika a krátky prehľad
Complications after administration of mRNA vaccine against COVID-19 – case report and short review
The pandemic of the disease COVID-19 (COronaVIrus Disease 2019) caused by the SARS-CoV-2 coronavirus (severe acute respiratory syndrome coronavirus 2) resulted in millions of deaths and many patients have chronic consequences after overcoming the acute condition. Several vaccines have been developed in an effort to stop the spread of the virus, but they have potentially serious adverse effects. We present a case report of a patient with acute (myocarditis, exacerbation of bronchial asthma) and long-term (postural orthostatic tachycardia syndrome – POTS) complications after vaccination with the second dose of mRNA vaccine BNT162b2 (Comirnaty®). Treatment consists of regimen measures, numerous pharmacotherapy (metoprolol, ivabradine, corticosteroids, antihistamines, antiphlogistics, bronchodilators) and several nutraceuticals (maritime pine bark extract, quercetin, vitamins, magnesium, phosphatidylcholine). In the discussion, we analyze post-vaccination injury and present a short review of the current literature.
Keywords:
nutraceuticals – vaccination – Asthma – myocarditis – COVID-19 – POTS
Autori: Ivan Varga 1; Peter Michalka 2; Jana Poláková Mištinová 3
Pôsobisko autorov: Cardio-Integra, s. r. o., Bratislava 1; Anesteziologicko-resuscitační oddělení / mezioborová JIP, Nemocnice AGEL Nový Jičín, a. s. 2; Národný ústav srdcových a cievnych chorôb, a. s., Bratislava 3
Vyšlo v časopise: Vnitř Lék 2023; 69(E-4): 20-27
Kategória: Kazuistiky
doi: https://doi.org/10.36290/vnl.2023.054Súhrn
Pandémia ochorenia COVID-19 (COronaVIrus Disease 2019) spôsobená koronavírusom SARS‑CoV - 2 (severe acute respiratory syndrome coronavirus 2) zapríčinila milióny úmrtí a mnoho pacientov má po prekonaní akútneho stavu chronické následky. V snahe o zastavenie šírenia vírusu boli vyvinuté viaceré očkovacie látky, ktoré však majú potenciálne vážne nežiaduce účinky. Prezentujeme kazuistiku pacienta s akútnymi (myokarditída, exacerbácia bronchiálnej astmy) aj dlhodobými (syndróm posturálnej ortostatickej tachykardie − POTS) komplikáciami po očkovaní druhou dávkou mRNA vakcíny BNT162b2 (Comirnaty®). Liečba pozostáva z režimových opatrení, početnej farmakoterapie (metoprolol, ivabradín, kortikosteroidy, antihistaminiká, antiflogistiká, bronchodilatanciá) a viacerých nutraceutík (extrakt z borovice prímorskej, kvercetín, vitamíny, horčík, fosfatidylcholín). V diskusii analyzujeme povakcinačné poškodenie a prinášame krátky prehľad z aktuálnej literatúry.
Klíčová slova:
nutraceutika – myokarditida – COVID-19 – astma – očkovanie – POTS
Úvod
Pandémii ochorenia COVID-19 (COronaVIrus Disease 2019) spôsobenej novým druhom koronavírusu SARS‑CoV - 2 (severe acute respiratory syndrome coronavirus 2) podľahlo celosvetovo už viac ako 6 miliónov ľudí (1). V snahe zastaviť šírenie vírusu a dosiahnuť tzv. kolektívnu imunitu boli vyvinuté očkovacie látky, z ktorých viaceré preukázali viac ako 90 % účinnosť v prevencii symptomatických prípadov COVID-19. Najčastejšie používané vakcíny indukujú tvorbu tzv. hrotového proteínu (väzbového proteínu vírusu) v tele človeka na základe informácie z geneticky modifikovaného adenovírusu (vektorové vakcíny) alebo mediátorovej ribonukleovej kyseliny (mRNA) obalenej v lipidových nanočasticiach (mRNA vakcíny) (2). Preparáty na báze mRNA sú všeobecne považované za účinnejšie a bezpečnejšie (3). Po ich podaní dochádza k vzniku protilátok proti hrotovému („spike“) proteínu, ktorý je syntetizovaný rôznymi tkanivami v závislosti od distribúcie nanočastíc v organizme.
V literatúre sa však objavuje čoraz viac správ o poškodeniach, ktoré sú dôsledkami pôsobenia „spike“ proteínu (prípadne ďalších látok vo vakcíne), bez nutnej prítomnosti kompletného vírusu SARS‑CoV - 2 (4–6). Hrotový proteín má totiž vlastnosti silného toxínu s potenciálom vzniku trombotických príhod, autoimunitných, neurodegeneratívnych a ďalších ochorení. Hovoríme o povakcinačnom syndróme, ktorý v mnohom pripomína tzv. pokovidový syndróm – dlhodobé zdravotné komplikácie po prekonaní COVID-19 (7, 8). Pokovidový syndróm charakterizuje pretrvávajúca únava, bolesti na hrudi, palpitácie, zhoršenie mentálnych funkcií, cefalea, artralgie, myalgie, poruchy chuti a čuchu, hematologické a gastrointestinálne ťažkosti (9). Jednou z príčin symptómov môže byť dysfunkcia autonómneho nervového systému, ktorá vedie k rozvoju syndrómu posturálnej ortostatickej tachykardie (POTS) (10). Ďalšou príčinou je pravdepodobne zvýšená hladina cirkulujúcich aktivovaných monocytov s vysokým obsahom hrotového proteínu a pokračujúcou produkciou cytokínov (11).
V práci prinášame kazuistiku pacienta so vznikom bezprostredných i dlhodobých kardiálnych a respiračných ťažkostí po očkovaní mRNA vakcínou Comirnaty® (známej aj pod označením BNT162b2) od spoločnosti Pfizer/BioNTech. V diskusii analyzujeme problematiku z pohľadu aktuálnych poznatkov s poukázaním na potenciálny prínos nutraceutík.
Kazuistika
26ročný pacient kontaktoval začiatkom júla 2021 pneumológa pre dyspnoe sprevádzané slabosťou a závratmi, subfebrility a doma nameraný pokles saturácie krvi kyslíkom na 88 %. Ťažkosti sa rozvinuli 3 dni po očkovaní 2. dávkou vakcíny Comirnaty® (po 1. dávke začiatkom júna mal iba lokálnu reakciu v mieste vpichu). V minulosti bol sledovaný pre bronchiálnu astmu, ktorá bola dlhodobo v remisii a nevyžadovala lieky kontrolnej terapie (len príležitostnú inhaláciu salbutamolu). V anamnéze má polyvalentnú alergiu (peľ tráv, korenie, orechy, tropické ovocie, sója) aj s anafylaktickými reakciami (napr. po hyposenzibilizačnej špecifickej imunoterapii) a závažnú bradykardiu po podaní tiopentalu pri operácii menisku ľavého kolena. Prekonal opakované zranenia členkov v súvislosti s intenzívnym rekreačným športovaním (futbal) a má známu heparínom indukovanú trombocytopéniu. Test PCR (polymerase chain reaction) na ochorenie COVID-19 bol opakovane negatívny, iné komorbidity alebo abúzy návykových látok neboli prítomné. Žije s rodinou, v období nástupu ťažkostí má ročného syna a vykonáva administratívnu prácu. Rodinná anamnéza je až na liečenú artériovú hypertenziu u starých rodičov negatívna v zmysle kardio‑respiračných ochorení.
Pneumológ stav zhodnotil ako exacerbáciu bronchiálnej astmy. Iniciovaná bola pravidelná bronchodilatačná liečba (budezonid a formoterol) spolu s preliečením moxifloxacínom, ktoré viedli k parciálnemu zlepšeniu zdravotného stavu. Vyšetrenie pľúc počítačovou tomografiou (CT) bolo bez nálezu intersticiálnej pneumopatie, spirometria potvrdila periférnu obštrukciu ľahkého stupňa (vitálna kapacita pľúc, Tifenneauov index aj pulzoximetria boli v norme). S cieľom potlačenia autoimunitnej reakcie bola začatá liečba prednizónom v dávke 20 mg denne s jej znížením o polovicu každých 10 dní (Tab. 1).
Tab. 1. Klinický priebeh ochorenia (ďalšie informácie sú uvedené v texte) 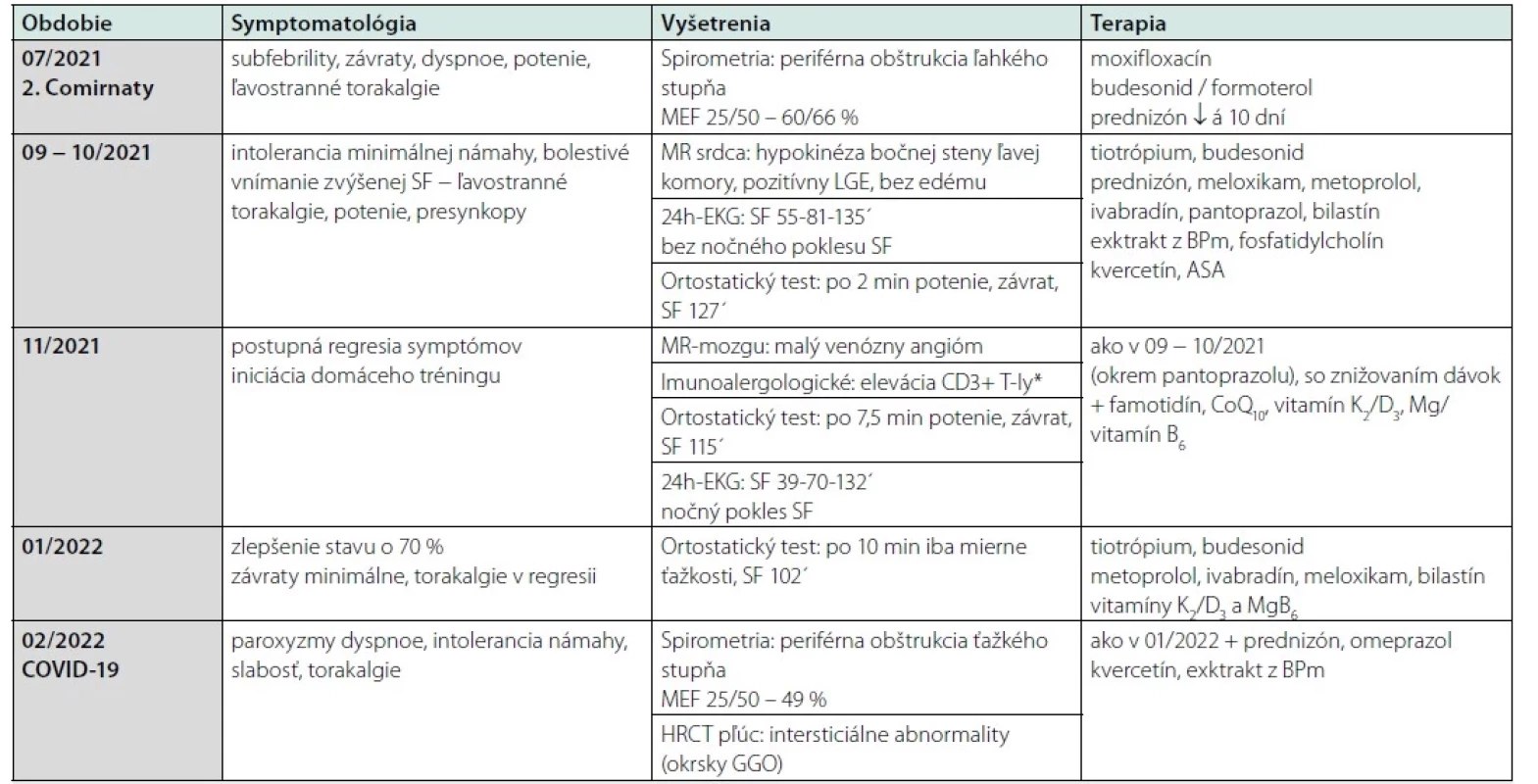
ASA – kyselina acetylsalicylová, BPm – borovica prímorská, CoQ10 – koenzým Q10, COVID-19 – COronaVIrus Disease 2019, EKG – elektrokardiogram, GGO – zatienenie charakteru mliečneho skla, HRCT – počítačová tomografia s vysokým rozlíšením, LGE – neskoré vysycovanie gadolínia, MEF – maximálny výdychový prietok, MR – magnetická rezonancia, SF – srdcová frekvencia, T-ly – T-lymfocyty. *laboratórna analýza bola realizovaná pri liečbe prednizónom (10 mg denne) Po vysadení prednizónu sa stav pacienta v septembri významne zhoršil, k dyspnoe sa pridali občasné ľavostranné bolesti na hrudníku (nemali charakter stenokardií), palpitácie a progredujúca intolerancia fyzickej námahy. Laboratórnou analýzou sme nezistili zvýšenie kardiomarkerov, zápalových alebo protrombotických parametrov. Iné hodnoty boli tiež opakovane v referenčnom rozmedzí, až na hypovitaminózu D a miernu hypercholesterolémiu pri opätovne iniciovanej liečbe prednizónom v dávke 2,5 mg (Tab. 2). Na elektrokardiograme (EKG) boli prítomné len nešpecifické zmeny repolarizácie. Echokardiograficky sme zistili dobrú systolickú funkciu nedilatovanej komory (bez viditeľných porúch kinetiky) a minimálne regurgitácie na mitrálnej, trikuspidálnej aj pulmonálnej chlopni. CT‑pulmoangiografia bola negatívna a bolo vyslovené podozrenie na povakcinačnú myokarditídu. Upravili sme inhalačnú bronchodilatačnú liečbu a do perorálnej terapie bol pridaný metoprolol (25 mg ráno a večer). S cieľom potlačenia možného zápalu a tlmenia hrudných bolestí užíval pacient ibuprofén (2 − 3× denne 400 mg), v prevencii ulkusovej choroby bol podávaný pantoprazol (20 mg). Z nutraceutík bol iniciovaný extrakt z borovice prímorskej (40 mg 2× denne) (Tab. 1).
Tab. 2. Laboratórna analýza 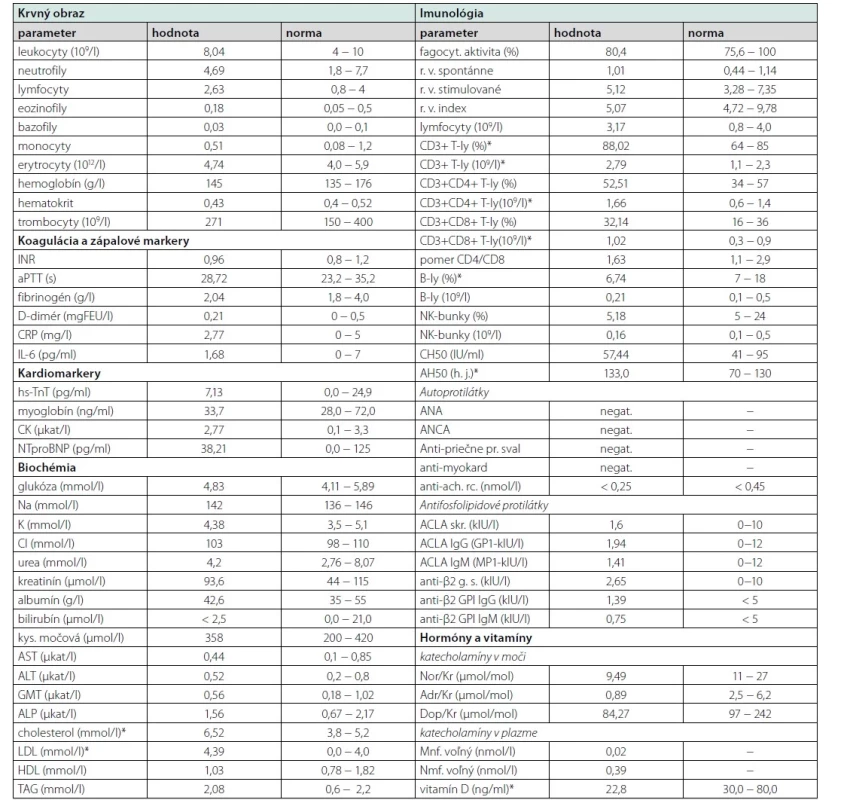
*patologické hodnoty; komentár v texte článku.
ACLA – antikardiolipínové protilátky, Adr – adrenalín, AH – test celkovej aktivity komplementovej kaskády alternatívnou cestou, ach. rc. – acetylcholínové receptory, ALP – alkalická fosfatáza, ALT – alanínaminotransferáza, ANA – antinukleárne protilátky, ANCA – protilátky proti cytoplyzme netrofilov, aPTT – aktivovaný parciálny tromboplastínový čas, AST – asprtátaminotransferáza, B-ly – B-lymfocyty, Dop – dopamín, fagocyt. – fagocytárna, FEU – jednotky fibrinogénového ekvivalentu, CH – test celkovej aktivity komplementovej kaskády klasickou cestou, CK – kreatínkináza, CRP – C-reaktívny proteín, GMT – gama-glutamyltransferáza, g. s. – glykoproteínový skríning, HDL – lipoproteíny s vysokou hustotou, hs-TnT – vysokosenzitívny troponín T, Ig – imunoglobulín, IL-6 – interleukín 6, INR – medzinárodný normalizovaný pomer, Kr – kreatinín, kys. – kyselina, LDL – lipoproteíny s nízkou hustotou, Mnf – metanefrín, NK – prirodzené zabíjačské, Nmf – normetanefrín, Nor – noradrenalín, NTproBNP - N-terminálny fragment prohormónu nátriuretického peptidu typu B, pr. – pruhovaný, r. v. – respiračné vzplanutie, skr. – skríning, TAG – triacylglycreoly, T-ly – T-lymfocytyNapriek liečbe stav progredoval s bolestivým vnímaním rýchlejšej tepovej frekvencie, častejšími ľavostrannými torakalgiami a intoleranciou minimálnej námahy (presynkopy, intenzívne potenie, intermitentne pocit dyspnoe a cefalea). Analýzou kardiomarkerov, EKG, echokardiogramu či pľúcnych funkcií nebola zistená dynamika nálezov. Magnetická rezonancia (MR) srdca (realizovaná tri mesiace od začiatku ťažkostí) bola s nálezom naznačenej hypokinézy bočnej steny ľavej komory midventrikulárne s prítomným oneskoreným vysycovaním gadolínia – LGE (mierne, škvrnité zmeny, do 50 % hrúbky steny, 8 mm), bez akútnych edematóznych prejavov (Obr. 1). Nález na perikarde aj ejekčná frakcia oboch komôr boli v norme.
Obr. 1. Oneskorená postkontrastná MDE (myocardial delayed enhancement) sekvencia v štvordutinovej projekcii (vľavo) a v projekcii v krátkej osi (vpravo). Prítomné hyperintenzívne zmeny laterálnej steny – late gadolinium enhancement (šípky). Nemali korelát akútnych zmien – s primeranými hodnotami T1 a T2 máp (Klinika diagnostickej a intervenčnej rádiologie LF SZU a NÚSCH, a. s. – pracovisko magnetickej rezonancie; 30.09.2021) 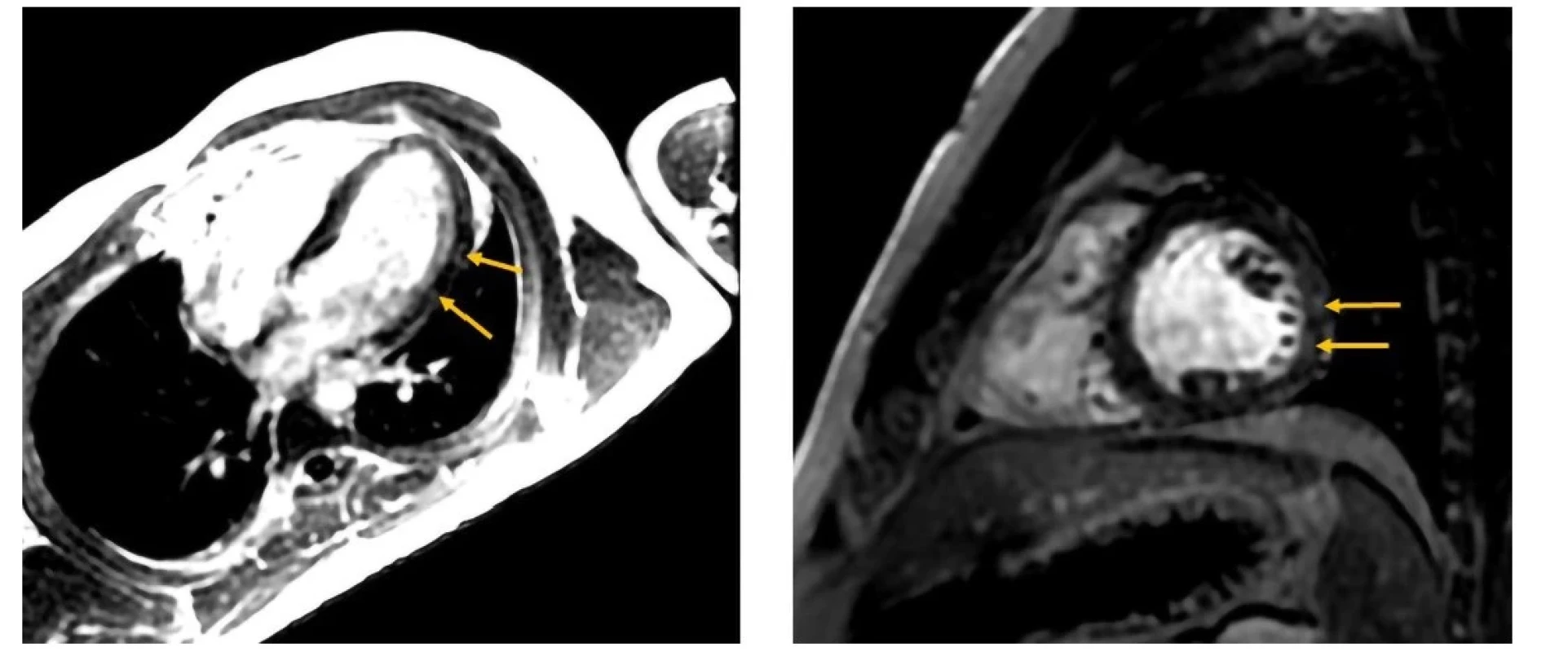
Ortostatickým testom sme zistili zmeny typické pre syndróm posturálnej ortostatickej tachykardie (POTS) – nárast srdcovej frekvencie do patologických hodnôt (69…128/min) po 2 minútach v stoji, bez poklesu tlaku krvi (125/87…132/84 mmHg) alebo saturácie kyslíka (95…97 %). Ergometria bola negatívna z hľadiska ischemických zmien v rámci dosiahnutej záťaže (65 % kalkulovanej maximálnej tepovej frekvencie). Bicyklovanie pacient toleroval podstatne lepšie ako ortostatický test. Pôvodne zvažovanú CT‑koronarografiu sme po uvedených zisteniach a aj vzhľadom na rezervovaný postoj pacienta nerealizovali. Ambulantné 24-hodinové meranie tlaku krvi bolo bez nálezu artériovej hypertenzie. Naopak, holterovským monitorovaním EKG sme zistili sklon k vyššej pokojovej srdcovej frekvencii (priemer cca 80/min), neprítomnosť jej poklesu v nočných hodinách a frekventnú symptomatológiu pri nevýznamnej záťaži (Obr. 2). Dysrytmie neboli prítomné. K metoprololu sme pridali ivabradín (2,5 mg 2× denne) a vilanterol bol nahradený za tiotrópium bromid. Pre predpokladaný vplyv imunitných patomechanizmov sme dočasne zvýšili dávku prednizónu (na 10 mg), do liečby sme pridali kyselinu acetylsalicylovú (30 mg), kvercetín (500 mg 2x denne) a fosfatidylcholín (350 mg 2x denne). V manažmente POTS mal pacient odporučený vyšší príjem tekutín a soli, spolu s nosením kompresívnych pančúch. Torakalgie a cefalea boli podstatne miernejšie po zmene ibuprofénu za meloxikam (15 mg) na základe odporúčania neurológa. Imunoalergológ odporučil užívanie bilastínu (10 mg), laboratórne výsledky nesvedčili jednoznačne pre prítomnosť autoimunity
Obr. 2. Polymorfné ťažkosti pacienta počas 24-hodinového monitoringu EKG (Oddelenie funkčnej diagnostiky, UN - Nemocnica svätého Michala, a. s.; 29.9.2021) 
Liečba viedla k stabilizácii ochorenia a postupnému zlepšovaniu stavu (v novembri bol pacient schopný urobiť 5 drepov alebo bicyklovať sa na stacionárnom bicykli pár minút bez rozvoja významnejších symptómov). V ortostatickom teste bolo dokumentované predĺženie intervalu tolerancie vzpriamenej polohy (z 2 na 7,5 minúty) (Obr. 3). 24-hodinovým monitorovaním EKG sme potvrdili zníženie priemernej srdcovej frekvencie spolu s obnovením fyziologického nočného poklesu (pacient si neskôr vysadil večernú dávku ivabradínu). V terapii sme pantoprazol nahradili famotidínom (20 mg), z nutraceutík sme pridali do užívania koenzým Q10 (100 mg) a magnézium s vitamínom B6 (MgB6; dávka 470/5 mg). Pre hypovitaminózu D sme indikovali suplementáciu kombinovaným preparátom K2/D3 (100/50 μg, t. j. 2 000 IU vitamínu D) (Tab. 2). Dávku prednizónu sme znížili na 2,5 mg denne.
Obr. 3. Ortostatický test – zmeny v sledovanom období SF - srdcová frekvencia/ min; min - čas v stoji v minútach (Oddelenie funkčnej diagnostiky, UN - Nemocnica svätého Michala, a. s.) 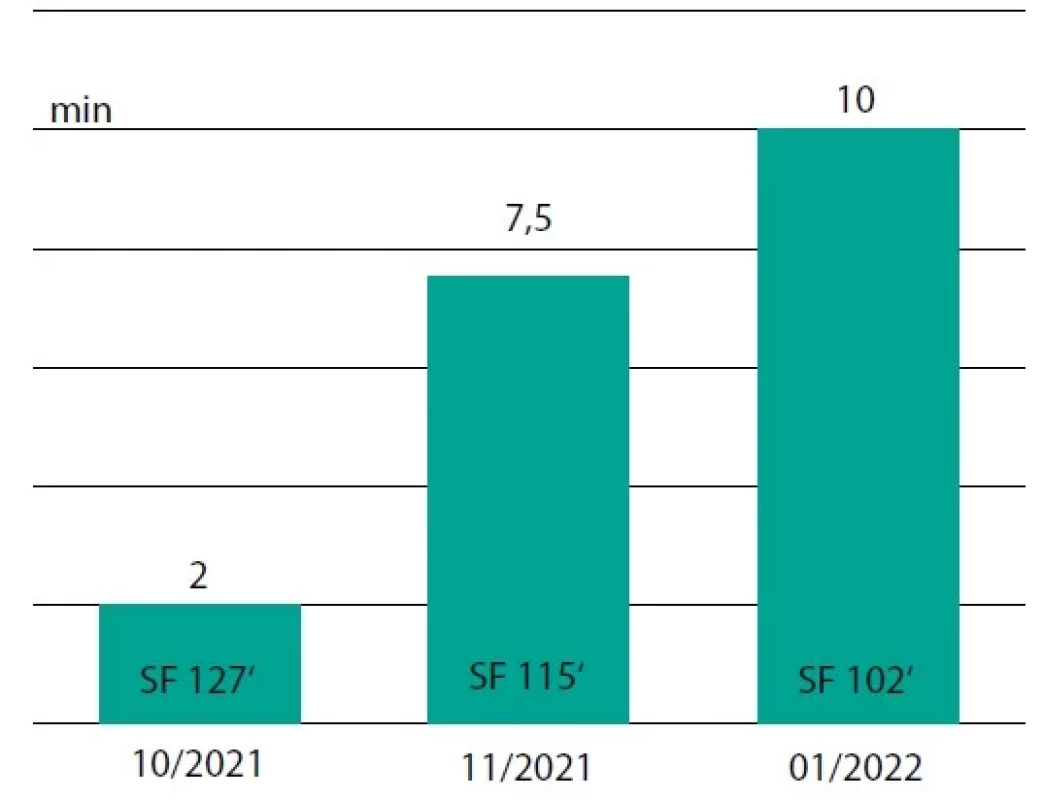
Pri kontrole koncom januára 2022 (pol roka od začiatku ťažkostí) hlásil pacient zlepšenie stavu asi o 70 %. Vládal prejsť pokojnou chôdzou 1,5 km, na stacionárnom bicykli dokázal trénovať pri nižšej intenzite asi 20 minút denne. Závraty mal len pri dlhšom státí, v ortostatickom teste vydržal stáť 10 minút bez ťažkostí až na mierne potenie (srdcová frekvencia na konci testu bola 102/min; Obr. 3). Laboratórne sme potvrdili úpravu hladiny vitamínu D (35,4 ng/ml). Okrem inhalačnej a bradykardizujúcej terapie užíval meloxikam, bilastín a vitamíny (K2/D3; MgB6), ostatnú liečbu (vrátane prednizónu) bolo možné ukončiť.
Začiatkom februára 2022 pacient nastúpil opäť do práce, v kolektíve sa však infikoval SARS‑CoV - 2. Ochorenie COVID-19 prekonal bez ťažkostí, o dva týždne ale prišlo k recidíve symptómov ako po druhej dávke mRNA vakcíny. Kardiologické vyšetrenie bolo bez dynamiky nálezov, pri spirometrickom vyšetrení sa zistila periférna obštrukcia ťažkého stupňa. Na CT pľúc s vysokým rozlíšením boli prítomné mierne zmeny typické pre postihnutie pľúcneho parenchýmu pri infekcii COVID-19 – jemné okrsky mliečneho skla v subpleurálnych zónach oboch dolných lalokov. Klinický stav sa prechodne zlepšil po reiniciácii prednizónu (denne až 50 mg), do terapie bol znovu zaradený extrakt z borovice prímorskej a kvercetín (Tab. 1).
V ďalšom období bol stav komplikovaný exacerbáciami intenzívnych ťažkostí, ktoré vznikli pri detrakcii kortikoidov pravdepodobne vplyvom imunitnej dysregulácie po COVID-19. Intravenózna pulzná kortikoterapia (125 mg, neskôr 250 mg metylprednizolónu každé 3 týždne) nemala dostatočný efekt, následné podanie ľudských imunoglobulínov (50 mg) viedlo k významnému, avšak nie úplnému zlepšeniu zdravotného stavu. Pri kontrolnej MR srdca (máj 2022) pretrvávali oneskorené postkontrastné zmeny (late gadolinium enhancement; LGE) v oblasti laterálnej steny ľavej komory, s miernou regresiou ich rozsahu (25 − 50 % hrúbky steny). Stav pacienta vyžaduje pneumologickú a kardiologickú dispenzarizáciu (aktuálne už na inom pracovisku), nevyhnutná je dlhodobá kortikoterapia (prednizón 2,5 mg denne spolu s pulzným podávaním 125 mg metylprednizolónu každé 4 týždne).
Diskusia
Očkovacie látky na báze mRNA technológie sú použité po prvý raz v ľudskej histórii z dôvodu pandemickej situácie a vzhľadom na pozitívne výsledky klinických štúdií (12, 13). Neukončené klinické skúšania, dobrovoľné hlásenia nežiaducich reakcií a subklinický priebeh poškodení na druhej strane podhodnocujú skutočný počet povakcinačných komplikácií (14, 15). Po troch mesiacoch od začiatku celosvetovej distribúcie vakcíny BNT162b2 bolo v pasívnych systémoch hlásenia zaznamenaných viac ako 1 200 podozrení na úmrtia po jej podaní. Spomedzi viac ako 42 000 nežiaducich účinkov tvorili kardiálne, tromboembolické a vaskulárne príhody spolu takmer 4,5 %, hlásené boli prípady myokarditídy (25×) aj POTS (7×) (15). V klinickej praxi sa ako najrizikovejšia javí populácia ľudí do 40 rokov (16).
Patofyziológia poškodenia po očkovaní mRNA vakcínami stále nie je úplne objasnená (17, 18). Hrotový proteín má nielen silné prozápalové a protrombogénne vlastnosti, ale aj potenciál navodiť alebo reaktivovať autoimunitné ochorenia. Dochádza k poruche vrodenej aj získanej imunity, napr. k skríženej reakcii vakcínou indukovaných protilátok s rôznymi peptidmi (neurofilamentový proteín, tyreoperoxidáza, alfa‑myozín, inzulín, pečeňový mikrozóm, pľúcny surfaktant a jemu príbuzné proteíny, atď.) (19). Exacerbácia autoimunitných ochorení je častejšia po druhej dávke očkovania (20). Dokumentovaný je prípad mladej pacientky, u ktorej došlo po podaní BNT162b2 k ťažkým astmatickým atakom napriek eskalácii bronchodilatancií, antihistaminík, užívaniu antagonistu leukotriénov a orálnej liečbe prednizónom vo vyšších dávkach (50 mg/deň). Stav si vyžiadal intravenóznu kortikoterapiu spolu s podaním biologickej liečby (mepolizumab) (21). U nášho pacienta sa podarilo exacerbáciu astmy zvládnuť intenzifikovanou bronchodilatačnou liečbou a užívaním orálneho prednizónu v nižšej dávke. Je možné, že pravidelná kontrolná terapia (napr. inhalačným kortikoidom) v období pred očkovaním by znížila intenzitu povakcinačného respiračného poškodenia, destabilizácii astmy by však pravdepodobne nezabránila. Po prekonaní COVID-19 bolo nevyhnutné imunitnú reakciu tlmiť parenterálnou kortikoterapiou, neskôr až podaním ľudského imunoglobulínu. Anamnéza bronchiálnej astmy alebo iných komorbidít môže predstavovať rizikový faktor pre vznik myokarditídy po očkovaní, priama súvislosť však nie je potvrdená (22). Polyvalentná alergia a nežiaduce reakcie na niektoré lieky by mohli byť v našom prípade považované za rizikový faktor, napriek tomu pacient absolvoval prvú dávku očkovania prakticky bez ťažkostí.
Myokarditída (s alebo bez perikarditídy) je obávanou nežiaducou reakciou po podaní mRNA vakcín (inými sú infarkt myokardu, Takotsubo kardiomyopatia, dysrytmie ap.) (23, 24). Riziko myokarditídy v celej populácii je vyššie po infekcii SARS‑CoV - 2 ako po očkovaní proti COVID-19 a zostáva mierne aj po podaní tzv. posilňujúcich dávok. V mužskej populácii do 40 rokov je však diagnostikovaná častejšie a po dvoch dávkach Comirnaty® je jej výskyt porovnateľný s frekvenciou po prekonaní COVID-19 (spolu 15 prípadov na milión obyvateľov po očkovaní v porovnaní so 16 myokarditídami po vírusovej infekcii). Po vakcíne Spikevax® od spoločnosti Moderna bol však rozdiel výraznejší – asi 7-násobne viac prípadov po očkovaní, u žien bol v tejto vekovej kategórii po druhej dávke výskyt povakcinačnej a povírusovej myokarditídy prakticky rovnaký (7, respektíve 8 prípadov na milión obyvateľov) (25). V klinickom obraze ochorenia dominujú torakalgie, dyspnoe, slabosť, palpitácie a subfebrility až febrility. Diagnostika sa opiera najmä o laboratórny nález (zvýšená hladina troponínu a C ‑ reaktívneho proteínu) a zmeny pri magnetickej rezonancii (prítomný LGE a edém myokardu). Povakcinačná myokarditída má väčšinou mierny priebeh, v prípade závažných porúch rytmu alebo rozvoja srdcového zlyhávania sa liečba riadi príslušnými odporúčaniami. S cieľom potlačiť zápal sú podávané nesteroidné antiflogistiká alebo kortikoidy, spolu s ďalšou podpornou terapiou (26). Uvedené charakteristiky neplatia absolútne, potvrdené sú desiatky úmrtí na povakcinačnú myokarditídu u ľudí s priemerným vekom nad 60 rokov (25).
Klinické charakteristiky nášho pacienta korelujú so všeobecne udávanými údajmi (26-ročný, na nič pravidelne neliečený muž, s rozvojom ťažkostí po druhej dávke očkovania a s miernym priebehom z hľadiska hemodynamickej stability). Do úvahy však treba vziať včasné podávanie prednizónu, ktoré okrem priaznivého vplyvu na prejavy bronchiálnej astmy pravdepodobne viedlo aj k eliminácii zápalu v myokarde. Nález v MR obraze sme aj vzhľadom na normálne výsledky ostatných vyšetrení zhodnotili ako fibrotické zmeny po prekonanej myokarditíde (27). Pre negatívnu anamnézu torakalgií ako aj intenzívne rekreačné športovanie do obdobia očkovania sa domnievame, že zmeny sú dôsledkom povakcinačného poškodenia. Pri kontrolnej MR (takmer 11 mesiacov od vzniku prvých ťažkostí) sme potvrdili pretrvávanie postkontrastných zmien (fibrózy) v oblasti bočnej steny ľavej komory, ich regresia bola len mierna. Prítomnosť LGE po prekonaní myokarditídy sa tradične spája s nepriaznivou dlhodobou prognózou. V prípade zmien po podaní mRNA vakcín údaje zatiaľ k dispozícii nie sú. Pretrvávanie LGE po 3 − 8 mesiacoch bolo potvrdené u asi 70 % vyšetrovaných adolescentov, hodnoty pri kontrole boli však takmer o polovicu nižšie. Na druhej strane ostali prakticky bez zmeny patologické hodnoty globálneho longitudinálneho strainu, ktorý sa spája s vyšším rizikom závažných nežiaducich kardiovaskulárnych príhod (28). Deformačná analýza pri MR ani echokardiografickom vyšetrení u nášho pacienta nebola realizovaná. V sledovanom intervale sme nezaznamenali pokles funkcie ľavej komory alebo signifikantné poruchy rytmu, k čomu mohlo prispieť užívanie metoprololu.
Cirkulačné ťažkosti v nami prezentovanom prípade súviseli s rozvinutým POTS, v patogenéze ktorého sa okrem autonómnej dysfunkcie uplatňuje aj poškodenie ciev, myokardu a chronický zápal (29). Symptómy ochorenia zahŕňajú kardiálne prejavy (intolerancia horizontálnej polohy so sprievodnou tachykardiou, závraty, dyspnoe a neanginózne torakalgie) aj príznaky poškodenia autonómnej regulácie iných orgánov (celková slabosť, cefalea, myalgie, zvýšené potenie, ťažkosti s trávením, dýchaním alebo močením a iné). Diagnostickým kritériom je vzostup tepovej frekvencie o 30 pulzov za minútu počas 10 minútového státia (alebo v teste na naklonenej rovine), bez sprievodného poklesu tlaku krvi a vylúčení iných príčin (30). Autonómna dysfunkcia je najpravdepodobnejšie dôsledkom poškodení nervovej sústavy vplyvom imunitnej reakcie navodenej protilátkami alebo cirkulujúcimi exozómami (membránovými vezikulami) (31). Autoprotilátky sú namierené proti adrenergickým a muskarínovým acetylcholínovým receptorom, ako aj proti mnohým kardiálnym proteínom (29, 32). Mikrovaskulárna dysfunkcia zahŕňa poškodenie endotelu s adhéziou až agregáciou trombocytov, ktoré okrem ischémie indukujú aj aktiváciu mastocytov. V závislosti od lokalizácie vedie degranulácia mastocytov buď k zhoršeniu bronchiálnej astmy (bronchokonstrikcia, hlienotvorba) alebo napr. k aktivácii mikroglií a neuroinflamácii (33, 34). Protilátky proti adrenergickým receptorom uľahčujú vyzrievanie a degranuláciu mastocytov v myokardiálnom tkanive in vitro, čo by mohlo vysvetľovať multiorgánové postvakcinačné poškodenie aj v našom prípade (35). V laboratórnej analýze boli však hodnoty až na miernu eleváciu CD3+ T‑lymfocytov v norme alebo na hranici referenčného intervalu. Odbery krvi boli ale realizované „pod clonou“ kortikoidov (prednizón 10 mg), čo mohlo ovplyvniť zistený výsledok. Infiltrácia CD3+ T‑lymfocytmi je dokumentovaná v bioptických vzorkách u niektorých pacientov s povakcinačnou myokarditídou, elevácia v plazme doteraz nebola opísaná (23). Vo vzťahu k POTS nie je známa špecifická korelácia, no autoimunitnú patogenézu ťažkostí u pacienta považujeme za pomerne jednoznačnú, čo opakovane potvrdilo zlepšenie klinického stavu vplyvom imunosupresívnej a imunomodulačnej liečby.
Liečba POTS zahŕňa nefarmakologické opatrenia (dostatočný príjem tekutín a soli, nosenie kompresívnych pančúch a aeróbne cvičenia), z farmák sú odporúčané betablokátory a ivabradín, možné je podávanie midodrínu alebo pyridostigmínu (36). V prípade prejavov aktivácie mastocytov je vhodná terapia s cieľom jej potlačenia (29, 34, 37). Pri podávaní metoprololu s ivabradínom, bronchodilatancií bez tachykardizujúceho účinku, antihistaminík spolu s nízkou dávkou kyseliny acetylsalicylovej (supresia aktivity mastocytov), meloxikamu, nutraceutík a režimovými opatreniami sme po pol roku dosiahli signifikantné zlepšenie stavu s možnosťou zníženia dávok a vysadenia viacerých liekov (vrátane prednizónu).
Nedávno publikovaná observačná štúdia zistila v kohorte takmer 300 000 pacientov signifikantne častejší výskyt POTS po očkovaní mRNA vakcínami (OR 1,33), hoci riziko je 5× nižšie než po prekonaní COVID-19 (OR 5,35) (38). V literatúre je opísaných päť kazuistík vzniku POTS u dospelých po očkovaní mRNA aj vektorovými vakcínami proti COVID-19. V prípade Comirnaty® ide o 42-ročnú pacientku so vznikom ťažkostí v priebehu 24 hodín po očkovaní. Symptómy sú dlhodobé, potrebné sú režimové opatrenia (zvýšený príjem soli, nosenie kompresívnych pančúch) (6). V inej práci je udávaný vznik ťažkostí 1,5 hodiny od očkovania s plným rozvinutím klinického obrazu o 7 dní. Išlo o 46-ročnú pacientku, liečenú na pracovisku, kde sú využívané postupy integratívnej kardiológie. Cirkulačné ťažkosti sa upravili pri liečbe ivabradínom (2× denne 5 mg) spolu s kombináciou vyšších dávok nutraceutík (2 000 mg kurkumy, 200 mg vitamínu C, 2000 IU vitamínu D3, 400 mg vitamínu B2, 4 800 mg cesnakového extraktu, 1 200 mg kadidlovníka, 800 mg resveratrolu spolu s kvercetínom, 1 200 mg extraktu z borovice prímorskej) (39). V prípade vakcíny Spikevax® ide o 40-ročného muža s ťažkosťami po týždni od prvej dávky. Stav sa podarilo zvládnuť užívaním propranololu (20 mg 3× denne) asi po 2 mesiacoch (40). Dve kazuistiky po očkovaní vektorovou vakcínou ChAdOx1nCoV-19 od spoločnosti AstraZeneca udávajú rozvoj POTS u 29-ročného muža (na 4. deň po očkovaní) a 30-ročnej ženy (nástup ťažkostí už po 6 hodinách). Spoločným laboratórnym nálezom bola hypovitaminóza B12, ktorá bola riešená parenterálnou substitúciou, u ženy bol navyše podávaný pre nízku hladinu aj vitamín D (41, 42). Napriek liečbe a zlepšeniu hemodynamických prejavov u väčšiny pacientov polymorfné ťažkosti (únava, Raynaudov fenomén…) pretrvávajú. Dokumentovaný je tiež prípad pediatrického pacienta s kombinovaným poškodením (POTS a myokarditída), ktoré vzniklo na 2. deň po podaní druhej dávky Comirnaty®. Pre myokarditídu bolo potrebné podať intravenózne imunoglobulíny v dávke 2 g/kg hmotnosti. Symptómy POTS ustúpili až po takmer 8 mesiacoch liečby pri kombinácii propranololu (10 mg 2× denne) a prekurzora noradrenalínu – droxidopa (200 mg 2× denne) spolu s režimovými opatreniami (43).
S cieľom potlačiť patomechanizmy ochorenia sme odporučili u nášho pacienta užívanie kvercetínu (supresia zápalu a aktivity mastocytov), fosfatidylcholínu (ovplyvnenie neuropatie), koenzýmu Q10 (podpora tvorby energie v tkanivách) a extraktu z borovice prímorskej (supresia zápalu a zlepšenie mikrocirkulácie) (44-47). Tieto opatrenia sa ukázali ako efektívne, avšak prekonanie COVID-19 viedlo k recidíve ťažkostí, pravdepodobne opäť v dôsledku intenzívnej autoimunitnej reakcie. Adekvátna suplementácia nutraceutikami (napr. vitamín D, B12, selén a zinok) pred očkovaním proti COVID-19 je potenciálnou prevenciou komplikácií po očkovaní aspoň u časti pacientov (48). Nutraceutiká a funkčné potraviny (čierny sezam, probiotiká) sú tiež súčasťou komplexného protokolu, ktorý je určený na liečbu povakcinačného syndrómu (I‑RECOVER) (8). U chorých s perzistujúcim autoimunitným zápalom sa ako účinné ukazuje podávanie imunomodulačnej liečby (kortikosteroidy, imunoglobulíny) (43, 49, 50).
Záver
mRNA vakcíny proti COVID-19 sú všeobecne považované za bezpečné a efektívne v prevencii symptomatickej infekcie SARS‑CoV - 2 a ťažkého priebehu ochorenia. Údaje o ich nežiaducich účinkoch sú však neustále upresňované, pričom priebeh poškodení nemusí byť vždy priaznivý a dlhodobé následky nie sú zatiaľ známe. Včasná diagnostika a správna liečba vzniknutých komplikácií (myokarditídy, POTS, bronchiálnej astmy a iných) sú rozhodujúce pre zníženie morbidity a mortality povakcinačného syndrómu. S cieľom minimalizovať poškodenie zdravia pacientov je možné využiť preventívny a terapeutický potenciál nutraceutík, vzhľadom na ich priaznivé účinky a vyhovujúci bezpečnostný profil. Pri trvaní ťažkostí sú pre chorých potenciálnou liečbou kortikosteroidy alebo podanie imunoglobulínov.
Článek přijat redakcí: 26. 1. 2023
Článek přijat po recenzích: 3. 4. 2023
MUDr. Ivan Varga, PhD.
Cardio-Integra, s. r. o., Bratislava
Zdroje
1. Chen C, Haupert SR, Zimmermann L, et al. Global prevalence of post‑coronavirus disease 2019 (COVID-19) condition or long COVID: a meta‑analysis and systematic review. J Infect, DiS. 2022;226(9):1593-1607.
2. Fiolet T, Kherabi Y, MacDonald CJ, et al. Comparing COVID-19 vaccines for their characteristics, efficacy and effectiveness against SARS‑CoV-2 and variants of concern: a narrative review. Clin Microbiol Infect. 2022;28(2):202-221.
3. Shiravi AA, Ardekani A, Sheikhbahaei E, et al. Cardiovascular complications of SARS‑CoV-2 vaccines: an overview. Cardiol Ther. 2022;11(1):13-21.
4. Alhumaid S, Al Mutair A, Al Alawi Z, et al. Anaphylactic and nonanaphylactic reactions to SARS‑CoV-2 vaccines: a systematic review and meta‑analysis. Allergy Asthma Clin Immunol. 2021;17(1):109.
5. Choi S, Lee S, Seo JW, et al. Myocarditis‑induced sudden death after BNT162b2 mRNA COVID-19 vaccination in Korea: case report focusing on histopathological findings. J Korean Med Sci 2021;36(40):e286.
6. Reddy S, Reddy S, Aror, M.A. case of postural orthostatic tachycardia syndrome secondary to the messenger RNA COVID-19 vaccine. Cureus 2021;13(5):e14837.
7. Said KB, Al‑Otaibi A, Aljaloud L on behalf of the Ha’il Com Research Unit Group. The frequency and patterns of post‑COVID-19 vaccination syndrome reveal initially mild and potentially immunocytopenic signs in primarily young Saudi women. Vaccines (Basel). 2022;10(7):1015.
8. Marik PE, Kory P on behalf of the Front Line COVID-19 Critical Care Alliance (FLCCC). Prevention & Treatment protocols for COVID-19. I‑RECOVER: Post‑Vaccine Treatment. Available from: https://covid19criticalcare.com/covid-19-protocols/i‑recover‑post‑vaccine‑treatment/Cited 30. 11. 2022
9. Sovová E, Genzor S, Sova M, et al. Covid-19 a postcovid – Jekyll a Hyde moderní medicíny. Vnitř Lék 2022;68(4):208-211.
10. Pesce M, Agostoni P, Bøtker HE, et al. COVID-19-related cardiac complications from clinical evidences to basic mechanisms: opinion paper of the ESC Working group on cellular biology of the heart. Cardiovasc Res. 2021;117(10):2148-2160.
11. Patterson BK, Francisco EB, Yogendra R, et al. Persistence of SARS CoV-2 S1 protein in CD16+ monocytes in Post‑Acute Sequelae of COVID-19 (PASC) up to 15 months post‑infection. Front Immunol. 2022;12 : 746021.
12. Polack FP, Thomas SJ, Kitchin N, et al. C4591001 Clinical Trial Group. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020;383(27):2603-2615.
13. Baden LR, El Sahly HM, Essink B, et al. COVE Study Group. Efficacy and safety of the mRNA-1273 SARS‑CoV-2 vaccine. N Engl J Med. 2021;384(5):403-416.
14. Mansanguan S, Charunwatthana P, Piyaphanee W, et al. Cardiovascular manifestation of the BNT162b2 mRNA COVID-19 vaccine in adolescents. Trop Med Infect, DiS. 2022 Aug 19;7(8):196.
15. Pfizer. 5. 3. 6 Cumulative analysis of post‑authorization adverse event reports of PF-07302048 (BNT162b2) received through 28-Feb-2021. Approved on 30-Apr-2021. https://phmpt.org/wp‑content/uploads/2022/04/reissue_5. 3. 6-postmarketing‑experience. pdf#page=30
16. Sun CLF, Jaffe E, Levi R. Increased emergency cardiovascular events among under-40 population in Israel during vaccine rollout and third COVID-19 wave. Sci Rep. 2022;12(1):6978.
17. Pillay J, Gaudet L, Wingert A, et al. Incidence, risk factors, natural history, and hypothesised mechanisms of myocarditis and pericarditis following covid-19 vaccination: living evidence syntheses and review. BMJ 2022;378:e069445.
18. Cadegiani FA. Catecholamines are the key trigger of COVID-19 mRNA vaccine‑induced myocarditis: a compelling hypothesis supported by epidemiological, anatomopathological, molecular, and physiological findings. Cureus. 2022;14(8):e27883.
19. Vojdani A, Vojdani E, Kharrazian D. Reaction of human monoclonal antibodies to SARS‑CoV-2 proteins with tissue antigens: implications for autoimmune diseases. Front Immunol. 2021;11 : 617089.
20. Rodríguez Y, Rojas M, Beltrán S, et al. Autoimmune and autoinflammatory conditions after COVID-19 vaccination. New case reports and updated literature review. J Autoimmun. 2022;132 : 102898.
21. Colaneri M, De Filippo M, Licari A, et al. COVID vaccination and asthma exacerbation: might there be a link? Int J Infect, DiS. 2021;112 : 243-246.
22. Cushion S, Arboleda V, Hasanain Y, et al. Comorbidities and symptomatology of SARS‑CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2)-related myocarditis and SARS‑CoV-2 vaccine‑related myocarditis: A review. Cureus. 2022;14(4):e24084.
23. Fazlollahi A, Zahmatyar M, Noori M, et al. Cardiac complications following mRNA COVID-19 vaccines: A systematic review of case reports and case series. Rev Med Virol. 2022 Jul;32(4):e2318.
24. Patone M, Mei XW, Handunnetthi L, Dixon S, Zaccardi F, Shankar‑Hari M, et al. Risks of myocarditis, pericarditis, and cardiac arrhythmias associated with COVID-19 vaccination or SARS‑CoV-2 infection. Nat Med. 2022;28(2):410-422.
25. Patone M, Mei XW, Handunnetthi L, et al. Risk of myocarditis after sequential doses of COVID-19 vaccine and SARS‑CoV-2 infection by age and sex. Circulation. 2022;146(10):743-754.
26. Heidecker B, Dagan N, Balicer R, et al. Myocarditis following COVID-19 vaccine: incidence, presentation, diagnosis, pathophysiology, therapy, and outcomes put into perspective. Eur J Heart Fail 2022; 24(11): 2000-2018.
27. Sanchez Tijmes F, Thavendiranathan P. Cardiac MRI assessment of nonischemic myocardial inflammation: state of the art review and update on myocarditis associated with COVID-19 vaccination. Radiol Cardiothorac Imaging. 2021;3(6):e210252.
28. Schauer J, Buddhe S, Gulhane A, et al. Persistent cardiac magnetic resonance imaging findings in a cohort of adolescents with post‑coronavirus disease 2019 mRNA vaccine myopericarditis. J Pediatr. 2022;245 : 233-237.
29. Ståhlberg M, Reistam U, Fedorowski A, et al. Post‑COVID-19 tachycardia syndrome: a distinct phenotype of post‑acute COVID-19 syndrome. Am J Med. 2021;134(12):1451-1456.
30. Becker RC. Autonomic dysfunction in SARS‑COV-2 infection acute and long‑term implications. COVID-19 editor’s page series. J Thromb Thrombolysis. 2021;52(3):692-707.
31. Mishra R, Banerjea AC. SARS‑CoV-2 spike targets USP33-IRF9 axis via exosomal miR-148a to activate human microglia. Front Immunol. 2021;12 : 656700.
32. Shoenfeld Y, Ryabkova VA, Scheibenbogen C, et al. Complex syndromes of chronic pain, fatigue and cognitive impairment linked to autoimmune dysautonomia and small fiber neuropathy. Clin Immunol. 2020;214 : 108384.
33. Takeda T, Morita H, Saito H, et al. Recent advances in understanding the roles of blood platelets in the pathogenesis of allergic inflammation and bronchial asthma. Allergol Int. 2018;67(3):326-333.
34. Theoharides TC, Cholevas C, Polyzoidis K, et al. Long‑COVID syndrome‑associated brain fog and chemofog: luteolin to the rescue. Biofactors. 2021;47(2):232-241.
35. Larsen NW, Stiles LE, Miglis MG. Preparing for the long‑haul: autonomic complications of COVID-19. Auton Neurosci. 2021;235 : 102841.
36. Brugada J, Katritsis DG, Arbelo E on behalf of the Task force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). 2019 ESC guidelines for the management of patients with supraventricular tachycardia. Developed in collaboration with the Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2020;41(5):655-720.
37. Giannetti A, Filice E, Caffarelli C, et al. Mast Cell Activation Disorders. Medicina. 2021;57(2):124.
38. Kwan AC, Ebinger JE, Wei J, et al. Apparent risks of postural orthostatic tachycardia syndrome diagnoses after COVID-19 vaccination and SARS‑CoV-2 infection. Nat Cardiovasc Res. 2022;1 : 1187-1194.
39. Hermel M, Sweeney M, Abud E, et al. COVID-19 vaccination might induce postural orthostatic tachycardia syndrome: a case report. Vaccines (Basel). 2022;10(7):991.
40. Park J, Kim S, Lee J, An JY. A case of transient POTS following COVID-19 vaccine. Acta Neurol Belg. 2022;122(4):1081-1083.
41. Karimi Galougahi K. Autonomic dysfunction post‑inoculation with ChAdOx1 nCoV-19 vaccine. Eur Heart J Case Rep. 2021;5(12):ytab472.
42. Carroll HA, Millar E, Deans KA. Vitamin B12 and D deficiency as cofactors of COVID-19 vaccine‑induced chronic neurological adverse reactions: Two cases and a hypothesis. 8. 3. 2022, preprint (version1) available at Research Square: Available from: https://doi.org/10.21203/rs.3.rs-1425014/v1
43. Sanada Y, Azuma J, Hirano Y, et al. Overlapping myocarditis and postural orthostatic tachycardia syndrome after COVID-19 messenger RNA vaccination: a case report. Cureus. 2022;14(11):e31006.
44. Demopoulos C, Antonopoulou S, Theoharides TC. COVID-19, microthromboses, inflammation, and platelet activating factor. Biofactors. 2020 Nov;46(6):927-933.
45. Schenkel LC, Singh RK, Michel V, et al. Mechanism of choline deficiency and membrane alteration in postural orthostatic tachycardia syndrome primary skin fibroblasts. FASEB J. 2015;29(5):1663-1675.
46. Belcaro G, Cornelli U, Cesarone MR, et al. Preventive effects of Pycnogenol® on cardiovascular risk factors (including endothelial function) and microcirculation in subjects recovering from coronavirus disease 2019 (COVID-19). Minerva Med. 2022;113(2):300-308.
47. Hansen KS, Mogensen TH, Agergaard J, et al. High‑dose coenzyme Q10 therapy versus placebo in patients with post COVID-19 condition: A randomized, phase 2, crossover trial. Lancet Reg Health Eur. 2022 Nov 2 : 100539.
48. Dalan R, Boehm BO. Micronutrient supplementation before COVID-19 vaccination can protect against adverse effects. Clin Nutr ESPEN. 2022;47 : 433-434.
49. Safavi F, Gustafson L, Walitt B, et al. Neuropathic symptoms with SARS‑CoV-2 vaccination. medRxiv [Preprint] 2022 May 17 : 2022. 05. 16.22274439.
50. Finsterer J. Small fiber neuropathy as a complication of SARSCoV2 vaccinations. J Family Med Prim Care. 2022;11 : 4071-4073.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2023 Číslo E-4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
Najčítanejšie v tomto čísle- Komplikácie po podaní mRNA vakcíny proti COVID-19 – kazuistika a krátky prehľad
- Osteoporóza u dospělých osob v klinické praxi (1): diagnostika a diferenciální diagnostika
- Dočasná oběhová nestabilita způsobená TIPS
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



