Vysokoobjemová versus standardní hemofiltrace v experimentální sepsi při peritonitidě*
High - versus standard-volume haemofiltration in experimental peritonitis-induced sepsis
Objective:
The role of haemofiltration as an adjunctive treatment of sepsis remains a contentious issue. To address the role of the dose and to explore the biological effects of haemofiltration we compared the effects of standard and high-volume haemofiltration in a peritonitis-induced model of porcine septic shock.
Design and setting:
Randomized, controlled experimental study.
Materials and methods:
Hyperdynamic sepsis secondary to peritonitis was induced in 21 anaesthetized and mechanically ventilated pigs. After 12 hours of sepsis the animals were randomized to receive either supportive treatment (control group, CON, n = 7), standard haemofiltration (HF, 35 ml/kg/h, n = 7) or high-volume haemofiltration (HVHF, 100 ml/kg/h, n = 7).
Results:
Systemic and hepatosplanchnic haemodynamics, oxygen exchange, energy metabolism (lactate/pyruvate, ketone body ratios), ileal and renal cortex microcirculation and systemic inflammation (TNF-α, IL-6), nitrosative/oxidative stress (TBARS, nitrates, GSH/GSSG) and endothelial/coagulation dysfunction (von Willebrand factor, asymmetric dimethylarginine, platelet count) were assessed before and after 12, 18, and 22 hours of peritonitis. Although fewer haemofiltration-treated animals required noradrenalin support (86%, 43% and 29% animals in the control, HF and HVHF groups, respectively), neither of the haemofiltration doses reversed the hyperdynamic circulation and lung dysfunction, or ameliorated alterations in the gut and kidney microvascular perfusion. Both HF and HVHF failed to attenuate sepsis-induced alterations in surrogate markers of cellular energetics, nitrosative/oxidative stress, endothelial injury or systemic inflammation.
Conclusions:
In this porcine model of moderate septic shock, early HVHF proved superior in preventing the development of septic hypotension. However, neither of the haemofiltration doses was capable of reversing the progressive disturbances in microvascular, metabolic, endothelial and lung function at least within the timeframe of this study and this model severity.
Keywords:
sepsis – haemofiltration – high volume haemofiltration – microcirculation – energy metabolism – oxidative stress
Authors:
Sýkora Roman 1,2; Chvojka Jiří 1,2; Kroužecký Aleš 1,2; Raděj Jaroslav 1,2; Karvunidis Thomas 1,2; Varnerová Veronika 2; Novák Ivan 1,2; Matějovič Martin 1,2
Authors‘ workplace:
Jednotka intenzivní péče, I. interní klinka, Fakultní nemocnice Plzeň
1; Lékařská fakulta v Plzni, Univerzita Karlova v Praze
2
Published in:
Anest. intenziv. Med., 20, 2009, č. 5, s. 246-256
Category:
Intensive Care Medicine - Original Paper
Overview
Cíl studie:
Úloha hemoeliminačních metod jako pomocné léčby sepse zůstává stále otevřeným tématem. Cílem studie bylo zhodnotit biologický efekt hemofiltrace a úlohu její dávky. Porovnávali jsme standardní dávku hemofiltrace s vysokoobjemovou hemofiltrací (HVHF) v experimentálním modelu septického šoku selete při peritonitidě.
Typ studie:
Kontrolovaná randomizovaná experimentální studie.
Materiál a metody:
Ve studii jsme použili 21 ventilovaných selat v celkové anestezii. Po 12 hodinách hyperdynamické sepse jsme selata rozdělili do tří skupin: 1. kontrolní, tj. jen podpůrná léčba, (CON, n = 7), 2. podpůrná léčba + standardní dávka hemofiltrace (HF, 35 ml . kg-1 . h-1, n = 7), 3. podpůrná léčba + HVHF (100 ml . kg-1 . h-1, n = 7), vždy na 10 hodin.
Výsledky:
Před indukcí peritonitidy, po 12, 18 a 22 h jsme měřili systémovou a hepatosplanchnickou hemodynamiku, metabolismus kyslíku, energetický metabolismus (laktát/pyruvát, poměr ketolátek), mikrocirkulaci sliznice ilea a kůry ledviny, systémovou inflamaci (TNF-α, IL-6), nitrosativní/oxidativní stres (reaktanty s kyselinou thiobarbiturovou, nitráty + nitrity, poměr glutathionu) a dysfunkci endotelu a koagulace (von Willebrandův faktor, asymetrický dimetylarginin, počet destiček). Přestože méně zvířat léčených hemofiltrací potřebovalo podporu oběhu noradrenalinem (86 %, 43 % a 29 % selat v kontrolní, HF a HVHF skupině), žádná z dávek hemofiltrace nezvrátila hyperdynamickou cirkulaci a plicní dysfunkci, ani nezlepšila poškození mikrovaskulární perfuze střeva a ledviny. Účinek HF i HVHF se neprojevil ani v ostatních sepsí navozených změnách a markerech buněčné energetiky, nitrosativního/oxidativního stresu, endoteliální/koagulační dysfunkce a systémového zánětu.
Závěr:
V tomto klinicky relevantním modelu septického šoku byla časná léčba HVHF učinnější v prevenci rozvoje hypotenze. Žádná z hemoeliminačních metod však nezabránila progresivním poruchám mikrocirkulace, energetického metabolismu, funkce endotelu a plic.
Klíčová slova:
sepse – hemofiltrace – vysokoobjemová hemofiltrace – mikrocirkulace – energetický metabolismus – oxidativní stres
Úvod
Použití mimotělních očišťovacích metod v léčbě sepse je koncepčně zajímavým, ale nadále kontroverzním tématem [1–3]. Nejčastější metodou hemopurifikace na jednotkách intenzivní péče (JIP) je hemofiltrace (CVVH, continuous veno-venous hemofiltration). Tato metoda však není účinná v redukci koncentrace cirkulujících plazmatických cytokinů a nezlepšuje orgánové funkce u septických pacientů, používáme-li nízké dávky ultrafiltrace (UF) (2000 ml . h -1) [4]. Na druhou stranu existují podklady poukazující na význam intenzity hemoeliminačních metod u kriticky nemocných s akutním selháním ledvin [5–7]. V literatuře často akcentovaný přínos vyšších dávek u metod náhrady funkce ledvin (UF ≥ 35 ml . kg. -1 . h -1) je nyní usměrňován výsledky recentní a dosud jediné multicentrické studie zkoumající vztah dávky UF a mortality u nemocných s aktuním selháním ledvin [8]. Podobně přínos vysokoobjemové hemofiltrace (HVHF) v léčbě sepse bez současného akutního selhání ledvin zůstává nadále diskutabilní. Doposud bylo provedeno několik klinických i experimentálních studií zkoumajících problematiku HVHF (UF 50–200 ml . kg. -1 . h -1) v léčbě endotoxémie nebo septického šoku. Přes určité metodologické nedostatky tyto studie shodně uvádějí nižší potřebu vazopresorů a lepší hemodynamickou stabilitu [9–20]. U klinických studií se však často jednalo o retrospektivní studie či studie bez kontrolní skupiny, což velmi limituje váhu jejich závěrů [21]. Obdobně omezené jsou i experimentální studie, které se zaměřují především na hemodynamiku, výměnu plynů, plazmatické koncentrace cytokinů, imunoparalýzu a krátkodobé přežití. Vyvození závěrů z experimentálních studií je omezeno několika skutečnostmi:
- Zahájení hemofiltrace je často realizováno před inzultem nebo časně po něm endotoxinem či indukcí sepse [21].
- Výzkum je prováděný převážně na hypodynamických modelech charakterizovaných hypotenzí a nízkým srdečním výdejem, což kontrastuje s hyperdynamickou cirkulací obvyklou u pacientů v septickém šoku.
- Všechny studie porovnávaly účinnost HVHF s neléčenými subjekty či s nízkoobjemovou hemofiltrací (tzn. 20 ml . kg. -1 . h -1). K dnešnímu dni není stále jasné, zda další navyšování dávky UF nad současně akceptovaných 35 ml . kg. -1 . h -1 může přinést další prospěch u septických nemocných.
Na podkladě výše uvedených podkladů jsme se rozhodli v experimentálním modelu resuscitovaného septického šoku:
- zhodnotit vliv hemofiltrace na úrovni systémové hemodynamiky, regionální hemodynamiky, mikrocirkulace, energetického metabolismu, oxidativního stresu, endotelu a koagulace;
- ověřit, zda použití vysokoobjemové hemofiltrace s dávkou 100 ml . kg. -1 . h -1 přinese další prospěch v porovnání s „konvenční – septickou“ dávkou hemofiltrace 35 ml . kg. -1 . h -1.
Materiál a metody
Experimentální práce byly provedeny v souladu se závaznými doporučeními pro práci s laboratorními zvířaty a schváleny Etickou komisí Lékařské fakulty UK v Plzni.
Anestezie a instrumentace experimentálních zvířat
V experimentech jsme použili 21 selat obou pohlaví vážících 38 (34, 42) kg. Jako premedikaci jsme intramuskulárně podávali atropin (1 mg), ketamin (50 mg) a azaperon titrovaný podle klinického efektu. Na úvod do anestezie byl podán intravenózně atropin (0,5 mg), propofol 2% (1–2 mg . kg-1), ketamin (2 mg . kg-1) a pancuronium (4 mg). Po intubaci byla selata napojena na umělou plicní ventilaci (FiO2 0,4; PEEP 5–10 cm H2O; dechový objem 10 ml . kg-1; dechová frekvence byla nastavena tak, aby se cílový arteriální pCO2 pohyboval mezi 4,0 a 5,0 kPa). Během chirurgické instrumentace byla celková anestezie vedena kontinuál. intravenózním podáváním thiopentalu (10 mg . kg-1 . h-1) a fentanylu (10–15 µg . kg-1 . h-1). Po dokončení operace byly sníženy dávky thiopentalu (5 mg . kg-1 . h-1) i fentanylu (5 µg . kg-1 . h-1) a touto rychlostí byly podávány do konce experimentu. Svalová relaxace byla zajištěna kontinuálním intravenózním podáváním pancuronia (0,2 mg . kg-1 . h-1) po celou dobu experimentu. Infuzní roztok PlasmaLyte byl podáván v průběhu chirurgické instrumentace rychlostí 15 ml . kg-1 . h-1, poté byla dávka snížena na 7 ml . kg-1 . h-1. Hladina glykémie v arteriální krvi byla udržována mezi 4,5–7 mmol . l-1 infuzí 20% glukózy v průběhu celého experimentu.
Do levé jugulární žíly byl zaveden trojcestný centrální žilní katétr k podávání farmak a infuzí. Cestou pravé jugulární žíly byl zaveden plícnicový katétr. Do levé femorální tepny jsme zavedli katétr, který sloužil k invazivnímu monitorování krevního tlaku, sběru vzorků a k zavádění fibrooptického katétru určeného k měření nitrohrudního objemu krve (ITBV, intrathoracic blood volume) a extravaskulární plicní tekutiny (EVLW, extravascular lung water). Do pravé femorální žíly byla zavedena dialyzační kanyla, přes kterou byla selata napojována na CVVH. Po provedení horní střední laparotomie jsme na portální žílu, společnou jaterní tepnu a renální tepnu vlevo upevnili ultrazvukové průtokové sondy (Transonic Systems, Ithaca, New York). Poté jsme do portální a renální žíly vlevo zavedli katétry ke sběru vzorků. Do jaterní žíly jsme pod ultrazvukovou kontrolou zavedli katétr až po ukončení operativy. Přímo na povrch levé ledviny, skrze incizi v renálním pouzdře, jsme umístili laser-Doppler sondu (PF 404, Suturable angled probe, Perimed, Jarfalla, Švédsko) sloužící k monitorování mikrocirkulace kortexu. Následovalo vyšití dvouhlavňové ileostomie, kterou jsme použili k monitorování střevní slizniční mikrocirkulace, a to laser-Doppler sondou (PF 409, Straight endoscopic probe, Perimed, Jarfalla, Švédsko) a intravitalní videomikroskopií (Microscan, MicroVision Medical, Amsterdam, Holandsko). Ileostomie byla mezi měřeními přikryta sterilní gázou navlhčenou fyziologickým roztokem a zakryta stomickým sáčkem. Na konci operace jsme perkutánně umístili do břišní dutiny dva trubicové drény k derivaci ascitu a k indukci peritonitidy. Perkutánně jsme rovněž zavedli cystostomický katétr pod ultrazvukovou kontrolou. Po ukončení chirurgické instrumentace následovalo 6 hodin pooperační stabilizace. Současně s úvodem do anestezie bylo 0,5 g . kg -1 autologní stolice selete rozpuštěno ve 200 ml fyziologického roztoku a kultivováno ve vodní lázni při 37 °C. Tento roztok byl použit následně k indukci peritonitidy.
Měření systémové a regionální hemodynamiky, mikrocirkulace a výpočty
Z parametrů systémové hemodynamiky byly měřeny tyto parametry: srdeční výdej, systémová vaskulární rezistence, ITBV a plnicí tlaky obou komor. Na úrovní regionální hemodynamiky hepatosplanchniku byly monitorovány průtoky krve portální žilou, společnou jaterní tepnou a levou renální tepnou. Odebírali jsme vzorky arteriální, portální, jaterní a renální žilní krve k analýze pH, pO2, pCO2 a saturace hemoglobinu kyslíkem. Následně jsme podle obvyklých vzorců vypočítávali systémovou a především regionální dodávku kyslíku, spotřebu kyslíku jater a ledviny [22–24]. Mikrovaskulární perfuze sliznice ilea a kůry ledviny byla hodnocena za použití laser dopplerometrické metody (LDF) hodnocením perfuzních jednotek při adekvátním zpětně odráženém signálu (back scattered light) [22–24]. Současně jsme využili techniku intravitální videomikroskopie (SDF, Side-stream Dark imaging) k přímému zobrazení mikrocirkulace sliznice ilea [25]. Během každého měření jsme natočili ze tří různých míst sliznice ilea dvacetivteřinovou videosekvenci. Za pomoci softwaru vyvinutého k hodnocení těchto sekvencí (Microscan Analyzing Software, MicroVision Medical, Amsterdam, The Netherlands) jsme měřili microvascular flow index (MFI) [26]. MFI je založen na hodnocení jednotlivých charakterů průtoku v kapilárách a cévách do 20 mikrometrů průměru v každém ze 4 kvadrantů videosekvence (žádný průtok = 0, intermitentní = 1, zpomalený = 2, kontinuální = 3). Průměr hodnot z jednotlivých kvadrantů je MFI, v naší studii jako výsledek uvádíme průměrný MFI ze tří náhodně vybraných lokalit sliznice ilea.
Odběr a hodnocení vzorků krve, plazmy a tkání
Z arteriální, portální, jaterní a renální žilní krve jsme stanovovali koncentrace laktátu (L) a pyruvátu (P), dále byly stanoveny atreriální sérová hladina alaninaminotransferázy (ALT) a poměry ketolátek z jaterní žilní krve (KBR, acetoacetát/β-hydroxybutyrát) [22–24]. K posouzení oxidativního a nitrosativního stresu jsme měřili arteriální reaktanty s kyselinou thiobarbiturovou (TBARS, thiobarbituric acid reactive species) a koncentraci arteriálních nitrátů a nitritů [22–24]. Z arteriální krve jsme rovněž stanovovali aktivitu von Willebrandova faktoru (vWF), koncentrace komplexů trombinu-antitrombinu (TAT), počet krevních destiček, koncentrace asymetrického dimetylargininu (ADMA), tumor necrosis faktoru alfa (TNF-α) a interleukinu 6 (IL-6). Všechny vzorky jsme hodnotili dvojmo a abychom eliminovali vliv hemodiluce při objemové resuscitaci, korigovali jsme následující hodnoty na celkovou bílkovinu: NOx, TBARS, AMDA, ALT, vWF, TAT, TNF-α, IL-6 [22–24].
Protokol studie
První měření a sběry vzorků byly provedeny po 6hodinovém zotavení z chirurgické instrumentace. Následovala indukce peritonitidy inokulací 0,5 g. kg -1 autologní stolice rozpuštěné v 200 ml fyziologického roztoku do břišní dutiny jedním z drénů. Druhý set měření a sběru vzorků byl proveden po 12 hodinách od indukce peritonitidy. V této době byla již plně rozvinutá hyperdynamická sepse. Poté byla zvířata rozdělena do jedné ze tří skupin:
- kontrolní skupina, kde spontánně progredovala sepse (CON, n = 7);
- 10hodinová léčba standardní hemofiltrací 35 ml . kg-1 . h-1 (HF, n = 7);
- 10hodinová léčba vysookobjemovou hemofiltrací 100 ml . kg -1 . h -1 (HVHF, n = 7).
Další měření byla provedena v 18. a 22. hodině od indukce peritonitidy (obr. 1). K udržovací infuzi roztoku PlasmaLyte jsme od šesté hodiny od indukce peritonitidy přidali infuzi 6% hydroxyetylškrobu 130 kD/0,4 rychlostí 10 ml . kg-1 . h-1 (7 ml . kg-1 . h-1 v případě, že byl CVP nebo PAOP vyšší než 18 mm Hg) tak, abychom udrželi plnicí tlaky komor vyšší než 12 mm Hg. Kontinuální infuze noradrenalinu byla zahájena, pokud se tekutinovou resuscitací nedařilo udržet střední arteriální tlak nad 70 mm Hg. Po odběru poslední série měření byla zvířata utracena za hluboké celkové anestezie injekcí KCl.
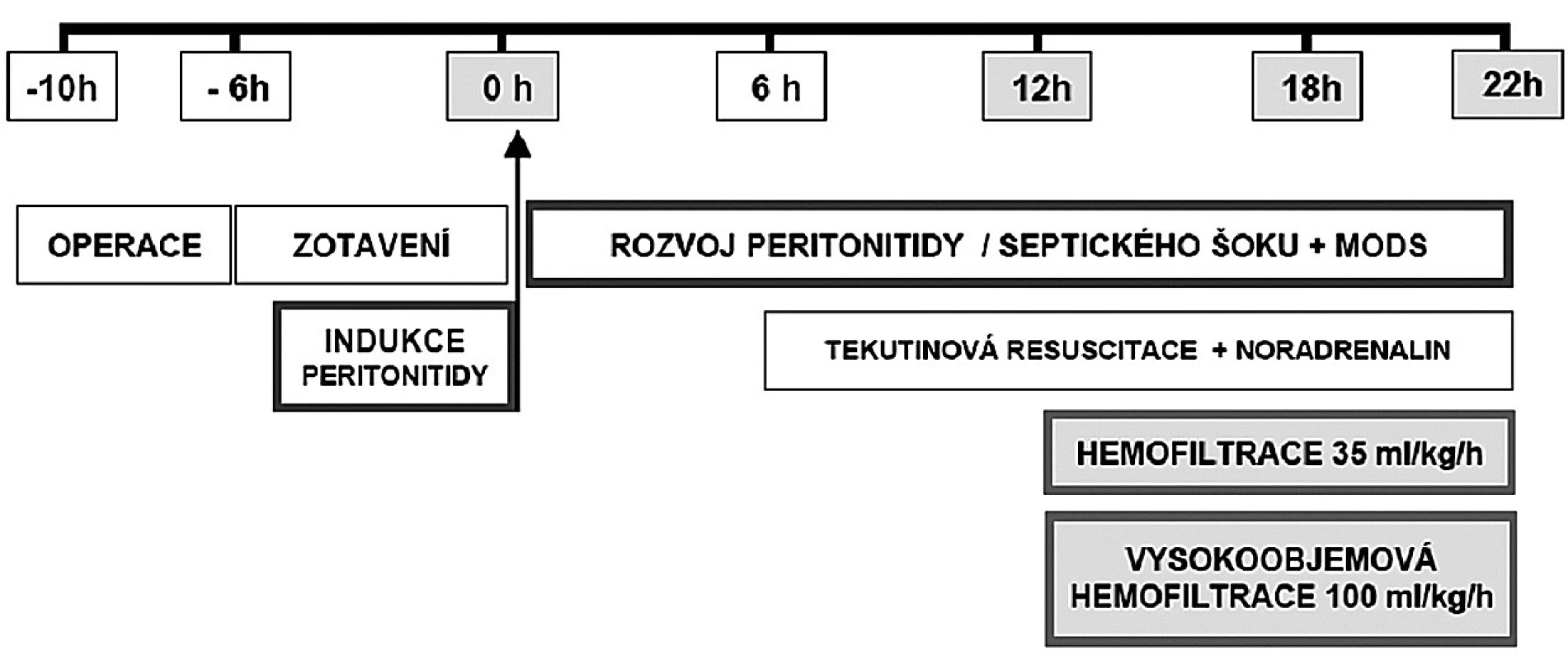
Nastavení kontinuální veno-venózní hemofiltrace
K hemofiltraci byl použitý přístroj MultiFiltrate (Fresenius Medical Care AG & Co. KGaA, Bad Homburg, SRN) se syntetickou membránou (Ultraflux AV600S; high-flux polysulphon filter, povrch 1,4 m2, cut-off do 30 000 Daltonů, Fresenius Medical Care). Kontinuální veno-venózní hemofiltrace a vysokoobjemová hemofiltrace s nulovou cílovou ultrafiltrací byly nastaveny na dávku hemofiltrace 35 a 100 ml . kg -1 . h -1. Průtok krve byl nastaven na 200 ml . min-1. K substituci byl použit bikarbonátový roztok (35 mmol . l -1), který byl napojen rovnoměrně pre - i postdilučním způsobem (50 % + 50 %). K prevenci poklesu tělesné teploty v mimotělním okruhu byl substituční roztok ohříván na 39 °C v hemoeliminačním přístroji a současně byl zapojen na venózní linku i ohřívač HOTLINE®. K antikoagulaci všech zvířat (včetně kontrolních) jsme použili intravenózní bolus 0,2 ml na 10 kg nadroparinu těsně po druhém měření a sběru vzorků (viz obr. 1). V průběhu studie jsme neměnili hemofiltry.
Použité statistické metody
Hodnoty výsledků prezentujeme jako medián a 25. a 75. percentil (interkvartilové rozpětí). Absenci normálního rozložení hodnot jsme testovali testem normality Kolmogorovova-Smirnovova.
Rozdíly v čase před indukcí a po indukci peritonitidy v rámci jedné skupiny byly testovány statistickým testem ANOVA při opakovaných měřeních (Friedman ANOVA on ranks) za následného použití post hoc Dunnova testu pro identifikaci statisticky významných rozdílů při mnohočetném porovnávání. Rozdíly mezi skupinami v jednotlivých měřených intervalech byly testovány za pomoci Kruskalova-Wallisova testu (Kruskal-Wallis ANOVA), opět s následným použitím post hoc Dunnova testu. Použité grafy jsou buď jednoduché bodové grafy, nebo standardní krabicové grafy zobrazující medián, interkvartilové rozpětí a rozpětí rozsahu neodlehlých hodnot (koeficient 1,5).
Výsledky
Ve vstupních hodnotách nebyly žádné statisticky významné rozdíly mezi oběma skupinami.
Systémová hemodynamika, kinetika kyslíku, metabolismus a plicní funkce
Celkové množství podaných koloidních roztoků se mezi třemi skupinami nelišilo (CON 167 [154;186], HF 194 [160;210], HVHF 194 [159;202] ml . kg -1). Tekutinovou resuscitací byl udržen srovnatelný ITBV i plnicí tlaky (data nejsou prezentována) bez meziskupinových rozdílů. Všechna selata rozvinula hyperdynamickou cirkulaci s narůstajícím srdečním výdejem a nízkou systémovou vaskulární rezistencí. Hemofiltrace hyperdynamickou cirkulaci nezvrátila. V kontrolní skupině potřebovalo noradrenalin šest zvířat (86 %), tři ve skupině HF (43 %) a dvě (29 %) ve skupině HVHF (graf 1). U selat s potřebou noradrenalinu se nelišil medián času do rozvoje hypotenze (CON 19 [18; 20], HF group 17 [17; 20], HVHF group 18 [17; 19] h) (viz graf 1). U všech zvířat vedl zvýšený srdeční výdej k významnému nárůstu dodávky kyslíku, zatímco spotřeba kyslíku se v průběhu času nijak neměnila. Pokles arteriálního pH byl méně výrazný u obou hemofiltrovaných skupin, přesto nedosáhl statistické významnosti. Významný byl i progresivní pokles PaO2/FiO2 a postupný nárůst poměru L/P u všech zvířat bez rozdílu. V průběhu experimentu jsme nepozorovali rozdíly v teplotě tělesného jádra mezi jednotlivými skupinami (p = 0,079 ve 22. hodině) – tabulka 1.

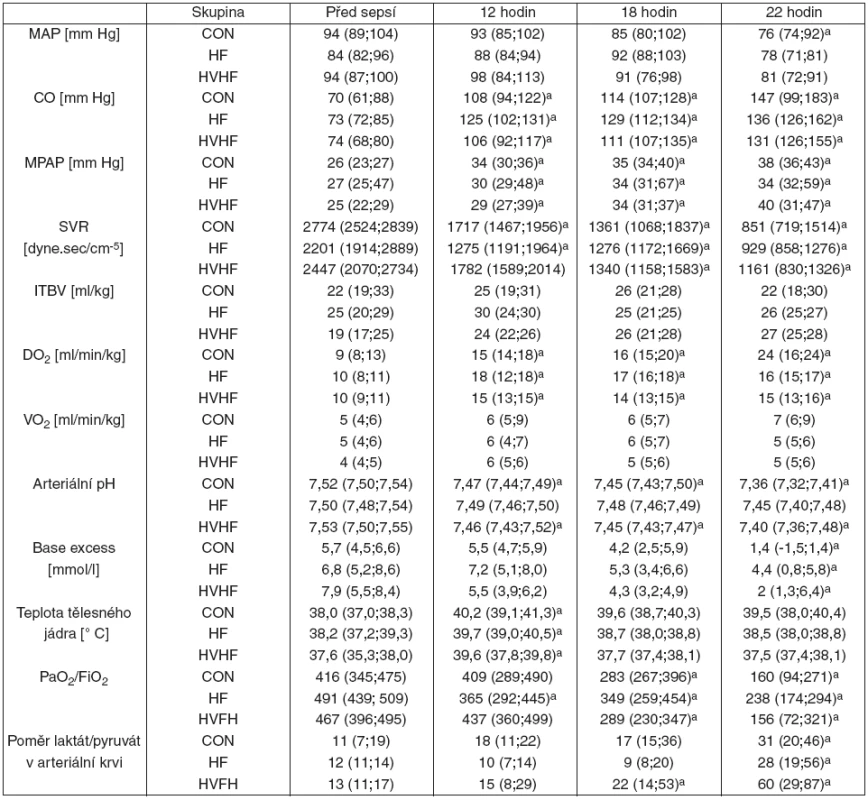
Regionální hemodynamika, mikrocirkulace, energetický metabolismus a orgánové funkce
Přestože došlo k nárůstu průtoku krve játry a současně k nárůstu dodávky kyslíku do jater, spotřeba kyslíku zůstala nezměněna ve všech třech skupinách. Průtok krve renální tepnou, dodávka kyslíku i jeho spotřeba ledvinou se neměnily v průběhu času, ani mezi skupinami. I přes nezměněnou regionální perfuzi došlo v průběhu sepse k významnému zhoršení mikrocirkulace sliznice ilea i kůry ledviny hodnocené LDF v kontrolní a HVHF skupinách (graf 2). Ve skupině HF sice nedosáhl pokles mikrovaskulární perfuze kůry ledviny v průběhu sepse statistické významnosti v průběhu času, nicméně mezi skupinami nebyl žádný signifikantí rozdíl na konci experimentu (viz graf 2). Přímá vizualizace mikrocirkulace sliznice ilea za pomoci SDF přinesla výsledky konzistentní s LDF měřením. Kvalitní perfuze střevních klků s vysokým MFI před indukcí peritonitidy se v průběhu sepse postupně zhoršovala, ovšem bez rozdílu mezi jednotlivými skupinami. Pokles pH renální a jaterní žilní krve nedosáhl na konci pokusu statistické významnosti mezi skupinami a žádná z dávek hemofiltrace významně neovlivnila sepsí indukované změny v poměrech L/P a KBR v krvi z hepatosplanchnické oblasti (graf 3). Významný nárůst aktivity ALT u kontrolní skupiny a skupiny HF nedosáhl meziskupinové významnosti (tab. 2) a podle očekávání selata léčená hemofiltrací měla nižší hladinu sérového kreatininu.


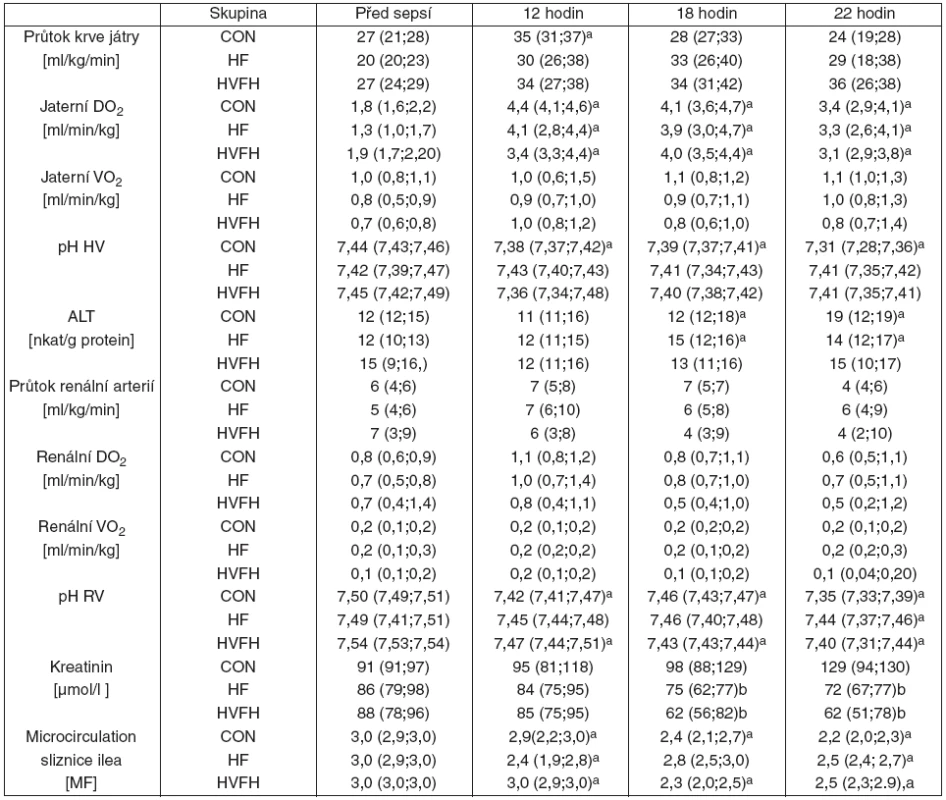
Systémová zánětlivá odpověď, oxidativní/nitrosativní stres, koagulace a endoteliální dysfunkce
Průběh septického šoku byl provázen progresivně narůstajícími plazmatickými koncentracemi TNF-α a IL-6 (tab. 3) a nadprodukcí oxidu dusnatého, jak vyplývá z významného vzestupu koncentrací NOx (graf 4). Současně došlo i k několikanásobnému nárůstu TBARS a poměru GSH/GSSG (viz tab. 3) svědčící pro oxidativní stres a alteraci redoxního stavu. V průběhu peritonotidy nedošlo k významnému nárůstu koncentrace ADMA (viz tab. 3). Oxidativní/nitrosativní stres byl provázen značným nárůstem plazmatických hladin vWF, markeru endoteliální dysfunkce (viz graf 4). Plazmatické hladiny IL-6 nebyly ovlivněny hemofiltrací. Přestože u skupiny HVHF byl sledovatelný trend k nižším plazmatickým hladinám TNF-α v sepsi, žádná z dávek hemofiltrace neovlivnila markery oxidativního/nitrosativního stresu a endoteliální dysfunkce. Počet destiček progresivně klesal v průběhu sepse bez meziskupinového rozdílu (viz graf 4). Vysoká hladina plazmatických cytokinů IL-6 a TNF-α se neodrazila v jejich koncentraci v hemofiltrátu u HF i HVHF, kde se blížila nule (data nejsou prezentována).
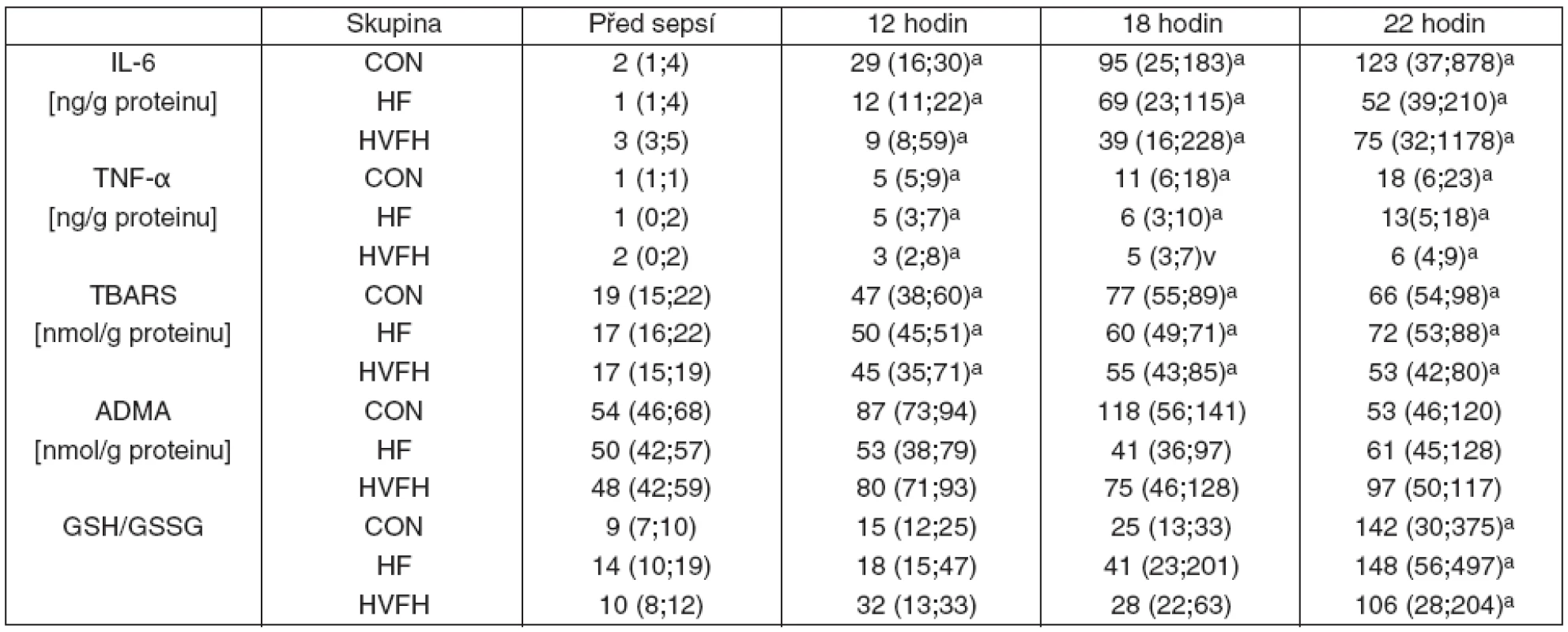

U instrumentovaných selat bez peritonitidy (sham--oprated) nevedlo napojení na hemofiltraci k ovlivnění systémové hemodynamiky, mikrocirkulace, metabolických dat, markerů zánětu, oxidativního stresu ani endoteliální dysfunkce (data nejsou prezentována).
Diskuse
V této experimentální studii byl na modelu septického šoku selete vyhodnocen účinek konvenční a vysokoobjemové kotinuální veno-venózní hemofiltrace na různých biologických úrovních a v řadě klinicky relevantních patofyziologických mechanismech. Hlavní poznatky studie jsou následující:
- Hemofiltrace v průběhu experimentu zabraňuje rozvoji septické hypotenze. Tento účinek je více vyjádřen u HVHF.
- Příznivý vliv hemofiltrace na potřebu vazopresorů však nebyl u žádné z dávek UF provázen zlepšením poruch mikrocirkulace, energetického metabolismu, endoteliální dysfunkce či oxidativního stresu.
Obdobný vliv hemofiltrace na potřebu vazopresorů byl pozorován i v jiných experimentálních [16, 19, 20, 27] a klinických studiích [9, 11, 13, 14]. Vzhledem k tomu, že v naší studii nebyly pozorovány rozdíly ve výkonnosti srdce ani v preloadu, je pravděpodobné, že hemofiltrace sehrála svou úlohu především ovlivněním mechanismů, které regulují cévní tonus (např. cytokiny zprostředkovaná nadprodukce NO aktivací indukovatelné NO syntázy nebo otevření ATP-senzitivních draslíkových kanálů) [28, 29]. První z mechanismů však patrně nebyl hemofiltrací ovlivněn, protože jsme neprokázali významné odstraňování prozánětlivých cytokinů (TNF-α a IL-6), ani potlačení zvýšené produkce NO. Alternativní možností je potlačení produkce reaktivních kyslíkových a dusíkových radikálů, které jsou schopny působit vaskulární hyporeaktivitu, vazodilataci a hypotenzi [30–32]. Hemofiltrace však neovlivnila námi sledované ukazatele oxidativního/nitrosativního stresu, a tak lze důvodně spekulovat o tom, že vliv hemofiltrace na potřebu vazopresorů nelze přisoudit zásahu do uvedených patofyziologických mechanismů. Lze namítat, že by pozorovaný hemodynamický efekt v průběhu hemofiltrace mohl být spíše důsledkem ochlazení [33], či lepší kontroly acidobazické rovnováhy [34, 35] než ovlivněním mediátorových mechanismů. My jsme však nezaznamenali žádné statisticky významné změny teploty jádra či systémového pH. Přesto nelze přispění mírného poklesu teploty ke snížení spotřeby noradrenalinu zcela zamítnout. Tento argument je podpořen naší recentní klinickou studií, ve které jsme prokázali, že i mírný pokles teploty v průběhu hemofiltrace, srovnatelný s poklesem v této studii, zvyšuje systémovou vaskulární rezistenci u septických pacientů [33]. Na druhou stranu Rogiers et al. pozorovali, že snížení tělesné teploty v průběhu hemofiltrace vedlo k rychlému rozvoji hypotenze a hypodynamické cirkulace při septickém šoku u ovcí [36]. Je důležité uvést, že ve zmíněné studii tělesná teplota zvířat klesala výrazně pod výchozí hodnoty, což významně kontrastuje s naší studií. Pozorovaný pozitivní efekt na systémovou hemodynamiku by rovněž mohl být vysvětlen snížením jen vrcholových koncentrací cytokinů bez jejich měřitelného poklesu v plazmatických hladinách [37] nebo odstraňováním jiných, námi neměřených vazodilatačních a zánětlivých mediátorů [9, 38–40]. V teoretické rovině nelze vyloučit ani odstraňování složek analgosedace s následnou vyšší sympatickou aktivitou.
Zásadním výsledkem naší studie je zjevná disociace mezi pozitivním vlivem hemofiltrace na potřebu vazopresorů a absencí příznivého účinku ve všech ostatních sledovaných biologických systémech. Naše studie je první a zatím jedinou studií, která hodnotila působení hemofiltrace na mikrovaskulární perfuzi a energetický metabolismus různých orgánů v sepsi. Použití laser doppler flowmetrie neodhalilo jakýkoliv pozitivní vliv hemofiltrace na porušenou mikrocirkulaci sliznice ilea či kůry ledviny. Konzistentní nálezy získané přímou vizualizací mikrocirkulace sliznice ilea za pomoci SDF navíc svědčí proti argumentu, že bychom vzhledem ke známým limitacím dopplerovské metody nezastihli eventuální příznivý vliv hemofiltrace na mikrocirkulaci. Tyto nálezy mohou být velmi důležité vzhledem ke skutečnosti, že časné poškození mikrocirkulace je spojeno s horší prognózou v sepsi [41]. Vezmeme-li v úvahu, že se hlavní hypotéza příznivého vlivu hemoeliminačních metod opírá o efektivní odstraňování mediátorů sepse, měli bychom očekávat pozitivní změny i na úrovni energetického metabolismu, který prozánětlivé působky nepřímo ovlivňují. Progresivní porucha cytozolového (odvozeno poměrem L/P) a mitochondriálního (odvozeno poměrem ketolátek) redox potenciálu [42] v hepatosplanchnické oblasti však svědčí proti zlepšení buněčné energetiky v průběhu hemofiltrace. Naše výsledky jsou v ostrém kontrastu s daty ze studie Li et al., ve které při HVHF (100 ml . kg -1 . h -1) pozorovali zlepšení myokardiálního mitochondirálního komplexu I v průběhu peritonitidy selete [43]. Rozdíly ve výsledcích jsou vysvětlitelné především podstatnými rozdíly ve zvířecích modelech a protokolech obou studií. Zvířata ve výše zmiňované studii procházela těžkým hypodynamickým hypotenzním šokem a data byla sbírána pouze do 12 hodin od zahájení peritonitidy, zatímco v naší studii jsme zkoumali účinek hemofiltrace v průběhu 22 hodin trvající hyperdynamické sepse. Navíc profylaktické použití hemofiltrace (hodinu po inzultu) a nedostatečná hemodynamická resuscitace ve studii Li et al. činí srovnání a interpretaci výsledků problematickými. Zda-li lze vysvětlit neschopnost hemofiltrace zvrátit sepsí vyvolané změny mikrocirkulace a metabolismu selháním metody ovlivnit tkáňové nebo buňečné koncentrace mediátorů sepse, zůstává díky metodologickým limitacím naší studie spekulativní [44–46].
Endotel je zásadním cílovým orgánem pro celou řadu zánětlivých mediátorů a předpokládá se jeho klíčová úloha v patofyziologii sepse [47, 48]. Nejsou však dostupná data, která by dokumentovala schopnost hemofiltrace ovlivnit sepsí indukované poruchy endotelu a úzce související koagulace. V naší studii hemofiltrace nezabránila vzestupu plazmatických koncentrací vWf, obecně uznávaného markeru poškození endotelu [49]. Podobně ani progresivní pokles počtu destiček (pravděpodobně jako projev diseminované intravaskulární koagulopatie) nebyl hemofiltrací příznivě ovlivněn. Podíl mimotělního okruhu per se se zdá být zanedbatelný, jak vyplývá z výsledků u skupiny instrumentovaných zdravých selat napojených na hemofiltraci. Tento úsudek podporuje i nedávno publikovaná klinická studie, která prokázala, že kontinuální veno-venózní hemofiltrace neovlivňuje ani plazmatické koncentrace vWf, ani počet krevních destiček [50].
Všechny předchozí experimentální studie porovnávaly účinek HVHF buď s neléčenými zvířaty, nebo s nízkoobjemovou hemofiltrací (20 ml . kg -1 . h -1). Naše studie je první, která zkoumá, zda zvyšování dávky nad dosud obecně akceptovanou standardní dávku UF (tj. 35 ml . kg -1 . h -1) přináší nějaký přídatný prospěch. Přestože naše pozorování podporují výsledky experimentálních [16, 19, 20, 27] i klinických [9–14] pokusů vykazujících pozitivní vliv na hemodynamiku, dávka ultrafiltrace 100 ml . kg -1 . h -1 se žádným způsobem nepromítla do zlepšení v ostatních nezávislých biologických systémech. Naše výsledky mimo jiné vyvolávají značné pochybnosti o tom, zda by pouhé změny v dávce vazopresorů měly být všeobecně považovány za vhodný a adekvátní ukazatel efektivity hemoeliminačních metod. Výstupy naší studie nepřímo podporují názor, že nejlepšího účinku hemofiltrace lze dosáhnout při jejím použití současně s endotoxémií/sepsí, či ještě před jejich zahájením [21, 51, 52]. Klinické využití této metody je tím však značně limitováno.
Navzdory klinické relevanci našeho modelu je na místě zmínit několik jeho limitací. Použití antibiotik by náš model ještě více přiblížilo klinické situaci. Naším cílem však bylo neovlivnit dalším zásahem přirozený vývoj sepse s progresí do septického šoku. Studie rovněž nebyla plánována ke zhodnocení mortality zvířat. Naopak, námi zvolený model byl primárně zaměřen na vyhodnocení potenciálních a klinicky relevantních biologických cílů hemoeliminačních metod. V neposlední řadě lze jen spekulovat, zda-li celková délka léčby byla dostatečná k dosažení významných změn ve sledovaných parametrech. Nelze rovněž vyloučit, že při eventuální větší tíži septického šoku by mohly být odpovědi na léčbu hemofiltrací odlišné.
Závěr
V tomto klinicky relevantním modelu septického šoku vyvolaného peritonitidou bylo časné zahájení HVHF účinnější ve srovnání se standardní hemofiltrací pouze v prevenci rozvoje septické hypotenze. Příznivý vliv na potřebu vazopresorů se však neprojevil na úrovni mikrocirkulace, metabolizmu, endotelu a koagulace.
Poděkování: Studie byla provedena za podpory hlavního výzkumného záměru LFUK v Plzni č. MSM 0021620819 Náhrada a podpora funkce některých životně důležitých orgánů. Děkujeme L. Trefilovi, L. Vítovi a L. Reifové za vynikající technickou a laboratorní pomoc a analýzy.
*Studie byla publikována v originálním znění pod názvem: High versus standard-volume haemofiltration in hyperdynamic porcine peritonitis: effects beyond haemodynamics? Intensive Care Medicine, 2009, 35 (2), p. 371–380. Překlad originálního článku. Roman Sýkora a Jiří Chvojka přispěli ke studii stejnou měrou.
Studie byla provedena v experimentální laboratoři centrálního zvěřince Lékařské fakulty v Plzni.
Studie byla vypracována s podporou v rámci hlavního výzkumného záměru č. MSM 0021620819 Náhrada a podpora funkce některých životně důležitých orgánů.
Studie byla oceněna cenou za nejlepší přednášku z oblasti intenzivní medicíny (I. česko-slovenský kongres intenzivní medicíny dětí a dospělých a XIV. národní kongres ČSARIM, 2007).
Došlo 10. 6. 2009.
Přijato 30. 7. 2009.
Adresa pro korespondenci:
Prof. MUDr. Martin Matějovič, Ph.D
I. interní klinka FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: matejovic@fnplzen.cz
Sources
1. Cariou, A. et al. Adjunctive therapies in sepsis: an evidence - based review. Crit. Care Med., 2004, 32, p. S562–570.
2. Honoré, P. M. et al. Blood and plasma treatments: the rationale of high-volume haemofiltration. Contrib. Nephrol., 2007, 156, p. 387–395.
3. Bellomo, R. et al. Extracorporeal blood treatment (EBT) methods in SIRS/Sepsis. Int. J. Artif. Organs., 2005, 28, p. 450–458.
4. Cole, L. et al. A phase II randomized, controlled trial of continuous haemofiltration in sepsis. Crit. Care Med., 2002, 30, p. 100–106.
5. Ronco, C. et al. Effects of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomised trial. Lancet, 2000, 356, p. 26–30.
6. Saudan, P. et al. Adding a dialysis dose to continuous haemofiltration increases survival in patients with acute renal failure. Kidney Int., 2006, 70, p. 1312–1317.
7. Schiffl, H. et al. Daily hemodialysis and the outcome of acute renal failure. N. Engl. J. Med., 2002, 31, p. 305–310.
8. Palevsky, P. M. et al. Intensity of renal support in critically ill patients with acute kidney injury. N. Engl. J. Med., 2008, 359, p. 7–20.
9. Cole, L. et al. High-volume haemofiltration in human septic shock. Intensive Care Med., 2001, 27, p. 978–986.
10. Honore, P.M. et al. Prospective evaluation of short-term, high-volume isovolemic haemofiltration on the hemodynamic course and outcome in patients with intractable circulatory failure resulting from septic shock. Crit. Care Med., 2000, 28, p. 3581–3587.
11. Ratanarat, R. et al. Pulse high-volume haemofiltration for treatment of severe sepsis: effects on haemodynamics and survival. Crit. Care, 2005, 9, p. 294–302.
12. Oudemans-van Straaten, H. M. et al. Outcome of critically ill patients treated with intermittent high-volume haemofiltration: a prospective cohort analysis. Intensive Care Med., 1999, 25, p. 814–821.
13. Joannes-Boyau, O. et al. Impact of high volume haemofiltration on hemodynamic disturbance and outcome during septic shock. ASAIO J., 2005, 50, p. 102–109.
14. Piccinni, P. et al. Early isovolaemic haemofiltration in oliguric patients with septic shock. Intensive Care Med., 2006, 32, p. 80–86.
15. Cornejo, R. et al. High-volume haemofiltration as salvage therapy in severe hyperdynamic septic shock. Intensive Care Med., 2006, 32, p. 713–722.
16. Grootendorst, A.F. et al. High volume haemofiltration improves right ventricular function in endotoxin-induced shock in the pig. Intensive Care Med., 1992, 18, p. 235–240.
17. Ullrich, R. et al. Continuous venovenous haemofiltration improves arterial oxygenation in endotoxin-induced lung injury in pigs. Anesthesiology, 2001, 95, p. 428–436.
18. Yekebas, E. F. et al. Attenuation of sepsis-related immunoparalysis by continuous veno-venous haemofiltration in experimental porcine pancreatitis. Crit. Care Med., 2001, 29, p. 1423–1430.
19. Bellomo, R. et al. The effect of intensive plasma water exchange by haemofiltration on haemodynamics and soluble mediators in canine endotoxemia. Am. J. Respir. Crit. Care Med., 2000, 161, p. 1429–1436.
20. Rogiers, P. et al. Continuous venovenous haemofiltration improves cardiac performance by mechanisms other than tumor necrosis factor-alpha attenuation during endotoxic shock. Crit. Care Med., 1999, 27, p. 1848–1855.
21. Bouman, C. S. et al. Haemofiltration in sepsis and systemic inflammatory response syndrome: the role of dosing and timing. J. Crit. Care, 2007, 22, p. 1–12.
22. Matejovic, M. et al. Selective inducible nitric oxide synthase inhibition during long-term hyperdynamic porcine bacteremia. Shock, 2004, 21, p. 458–465.
23. Matejovic, M. et al. Effects of tempol, a free radical scavenger, on long-term hyperdynamic porcine bacteremia. Crit. Care Med., 2005, 33, p. 1057–1063.
24. Matejovic, M. et al. Effects of combining inducible nitric oxide synthase inhibitor and radical scavenger during porcine bacteremia. Shock, 2007, 27, p. 61–68.
25. Tugtekin, I. F. et al. Increased ileal-mucosal-arterial PCO2 gap is associated with impaired villus microcirculation in endotoxic pigs. Intensive Care Med., 2001, 27, p. 757–766.
26. De Backer, D. et al. How to evaluate the microcirculation: report of a round table conference. Crit. Care, 2007, 10, 11, p. R101.
27. Yekebas, E. F. et al. Impact of different modalities of continuous venovenous haemofiltration on sepsis-induced alterations in experimental pancreatitis. Kidney Int., 2002, 62, p. 1806–1818.
28. Asfar, P. et al. Catecholamines and vasopressin during critical illness. Crit Care Clin., 2006, 22, p. 131–149.
29. Landry, D. W. et al. The pathogenesis of vasodilatory shock. N. Engl. J. Med., 2001, 345, p. 588–595.
30. Takakura, K. et al. Modification of alfa-1 adrenoreceptors by peroxynitrite as a possible mechanism of systemic hypotension in sepsis. Crit. Care Med., 2002, 30, p. 894–899.
31. Takakura, K. et al. Deactivation of noradrenaline by peroxynitrite as a new pathogenesis in the hypotension of septic shock. Anestesiology, 2003, 98, p. 928–934.
32. Macarthur, H. et al. Modulation of serum cytokine levels by a novel superoxide dismutase mimetic, M40401, in an Escherichia coli model of septic shock: correlation with preserved circulating catecholamines. Crit. Care Med., 2003, 31, p. 237–245.
33. Rokyta Jr., R. et al. Effects of continuous venovenous haemofiltration-induced cooling on global haemodynamics, splanchnic oxygen and energy balance in critically ill patients. Nephrol. Dial. Transplant., 2004, 19, p. 623–630.
34. Marsh, J. D. et al. Mechanism of diminished contractile response to catecholamines during acidosis. Am. J. Physiol., 1988, 254, p. H20–27.
35. Kellum, J. A.et al. Effects of hyperchloremic acidosis on arterial pressure and circulating inflammatory molecules in experimental sepsis. Chest, 2004, 125, p. 243–248.
36. Rogiers, P. et al. Blood warming during haemofiltration can improve haemodynamics and outcome in ovine septic shock. Anesthesiology, 2006, 104, p. 1216–1222.
37. Ronco, C. et al. Interpreting the mechanisms of continuous renal replacement therapy in sepsis: the peak concentration hypothesis. Artif. Organs, 2003, 27, p. 792–801.
38. Hoffmann, J. N. et al. Effect of haemofiltration on haemodynamics and systemic concentrations of anaphylatoxins and cytokines in human sepsis. Intensive Care Med., 1996, 22, p. 1360–1367.
39. Silvester, W. Mediator removal with CRRT: complement and cytokines. Am. J. Kidney Dis., 1997, 30, p. S38–43.
40. Wang, Y. et al. Polymyxin B binds to anandamide and inhibits its cytotoxic effect. FEBS Lett., 2000, 24, 470, p. 151–155.
41. Trzeciak, S. et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: relationship to haemodynamics, oxygen transport, and survival. Ann. Emerg. Med., 2007, 49, p. 88–98.
42. Leverve, X. M. From tissue perfusion to metabolic marker: assessing organ competition and co-operation in critically ill patients? Intensive Care Med., 1999, 25, p. 890–892.
43. Li, C. M. et al. Continuous veno-venous haemofiltration attenuates myocardial mitochondrial respiratory chain complexes activity in porcine septic shock. Anaesth. Intensive Care, 2007, 35, p. 911–919.
44. Joannes-Boyau, O. et al. Haemofiltration: The case for removal of sepsis mediators from where they do harm. Crit. Care Med., 2006, 34, p. 2244–2246.
45. Honoré, P.M. et al. Extracorporeal removal for sepsis: Acting at the tissue level – the beginning of a new era for this treatment modality in septic shock. Crit. Care Med., 2004, 32, p. 896–897.
46. Ronco, C. The immunomodulatory effect of extracorporeal therapies in sepsis: A reconciliation of three theories. Int. J. Artif. Organs, 2007, 30, p. 855–857.
47. Hack, C. E. et al. The endothelium in sepsis: source of and target for inflammation. Crit. Care Med., 2001, 29, p. S21–27.
48. Schouten, M. et al. Inflammation, endothelium, and coagulation in sepsis. J. Leukoc. Biol., 2008, 83, p. 536–545.
49. Reinhart, K. et al. Markers of endothelial damage in organ dysfunction and sepsis. Crit. Care Med., 2002, 30, p. S302–312.
50. Polanska, K. et al. Effect of regional citrate anticoagulation on thrombogenicity and biocompatibility during CVVHDF. Ren. Fail., 2006, 28, p. 107–118.
51. Honoré, P.M. et al. The big bang of haemofiltration: the beginning of a new era in the third millennium for extra-corporeal blood purification! Int. J. Artif. Organs, 2006, 29, p. 649–659.
52. Mink, S. N. et al. Early but not delayed continuous arteriovenous haemofiltration improves cardiovascular function in sepsis in dogs. Intensive Care Med., 1999, 25, p. 733–743.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2009 Issue 5
-
All articles in this issue
- Doba úvodu a zotavení z celkové anestezie – prospektivní studie
- Odložené plánované operační výkony ve třech českých fakultních nemocnicích – prospektivní studie
- Vysokoobjemová versus standardní hemofiltrace v experimentální sepsi při peritonitidě*
- Vliv stáří transfuzních jednotek erytrocytů na koncentrace vybraných biochemických veličin
- Regionální antikoagulace citrátem při eliminačních metodách u kardiochirurgického pacienta s vysokým rizikem krvácení – kazuistiky
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Doba úvodu a zotavení z celkové anestezie – prospektivní studie
- Odložené plánované operační výkony ve třech českých fakultních nemocnicích – prospektivní studie
- Regionální antikoagulace citrátem při eliminačních metodách u kardiochirurgického pacienta s vysokým rizikem krvácení – kazuistiky
- Vliv stáří transfuzních jednotek erytrocytů na koncentrace vybraných biochemických veličin
