Těžká smíšená dyslipidemie jako projev hematologického onemocnění: kazuistika
Severe mixed dyslipidemia as a manifestation of hematological disease: case report
Multiple myeloma is one of the common hematological diseases and, in most cases, is manifested by the known CRAB criteria. One possible atypical manifestation of this disease may be severe mixed dyslipidemia, often in combination with hyperviscosity syndrome or cryoglobulinemia. Diagnosis of myeloma under these conditions is hampered by a number of specific problems. Our case report demonstrates a complicated journey from the patient’s symptoms to the definitive diagnosis and appropriately chosen treatment.
Keywords:
muscular dystrophy – hyperviscosity syndrome – plasmapheresis – cryoglobulinemia
Authors:
Martin Šatný 1; Michal Vrablík 1; Janka Franeková 2; Jan Kovář 3
Authors‘ workplace:
III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
1; Oddělení klinické biochemie IKEM a 1. LF UK, Praha
2; Laboratoř pro výzkum aterosklerózy IKEM, Praha
3
Published in:
AtheroRev 2019; 4(1): 38-43
Category:
Overview
Mnohočetný myelom patří mezi častá hematoonkologická onemocnění a ve většině případů se manifestuje známými CRAB kritérii. Jedním z možných atypických projevů této choroby však může být těžká smíšená dyslipidemie, a to často v kombinaci s hyperviskózním syndromem či kryoglobulinemií. Diagnostika myelomu za těchto podmínek naráží na řadu specifických problémů. Naše kazuistika demonstruje složitou cestu od příznaků pacienta k definitivní diagnóze a adekvátně zvolené léčbě.
Klíčová slova:
hyperviskózní syndrom – kryoglobulinemie – sekundární glaukom – smíšená dyslipidemie
Úvod
Mnohočetný myelom (MM) ze skupiny tzv. monoklonálních gamapatií je globálně druhým nejčastějším hematoonkologickým onemocněním (po non-Hodgkinském lymfomu), které vzniká na podkladě maligního zvratu a monoklonální expanze terminálně diferencovaných plazmatických buněk primárně se vyskytujících v kostní dřeni, respektive migrujících do periferní krve či dalších cílových orgánů a tkání [1]. Ve většině případů je MM spojován s produkcí monoklonálních imunoglobulinů – tzv. M-proteinu či paraproteinu, nebo alespoň jejich součástí, tj. lehkých řetězců (kappa či lambda) detekovatelných v séru či moči. Velmi vzácně se vyskytuje i tzv. asekretorický MM, který netvoří žádné monoklonální proteiny.
Předpokládaná roční incidence MM v ČR se uvádí 2,65/100 000 obyvatel [2]; dle zahraničních prací (USA) MM zastává 1,7 % onkologických onemocnění a 17 % všech hematologický malignit [3].
MM může být dlouhou dobu zcela asymptomatický a často se projeví až poškozením cílových orgánů – zejména kostní dřeně (resp. kostí) či ledvin. Běžně se v literatuře setkáváme s pojmem kritéria CRAB (C – hyperkalcemie R – renální postižení A/B – anémie anebo lytická kostní ložiska), která názorně demonstrují nálezy, jež mohou být důvodem návštěvy lékaře. Bohužel, nezřídka je první manifestací toho onemocnění až dokumentovaná patologická fraktura kostí. Mezi další možné projevy MM řadíme hyperviskózní syndrom (HVS) způsobený hyperproteinemií či těžkou smíšenou dyslipidemii (DLP), dosud ne zcela jasné etiologie, špatně reagující na kombinační léčbu statinem a fibrátem, ale promptně se upravující adekvátní hematologickou léčbou. Plazmocyty pacientů s MM v některých případech produkují také kryoglobuliny, které vyvolávají typické teplotně vázané příznaky.
Pilířem diagnostiky MM je komplexní hematologické vyšetření zahrnující vyšetření krevního obrazu včetně diferenciálu, provedení elektroforézy plazmatických bílkovin, imunofixaci séra, imunofenotypizaci krevních elementů, trepanobiopsii či vyšetření volných lehkých řetězců v séru a moči. Zobrazovací metody pak využíváme především k ozřejmění rozsahu onemocnění. Vyšetřovací proces naráží na řadu úskalí, zejména u pacientů s těžkou smíšenou DLP s výrazně chylózním sérem, u nichž řadu analytů stanovit nejde, či jsou stanovovány chybně.
Léčbou volby MM je chemoterapie (obvykle kombinace dexametazonu, bortezomibu s cyklofosfamidem) s následnou autologní transplantací kmenových buněk (Autologous Stem Cell Transplantation – ASCT) [4].
Popis případu
Uvádíme případ 55letého muže, který byl přivezen rychlou záchrannou službou na akutní interní příjem po krátké poruše vědomí bez křečí, morsury, pokálení či pomočení s promptní úpravou ad integrum, přičemž další v době přijetí aktuální obtíží pacienta bylo 4 dny trvající vertigo bez stranové predilekce doprovázené tinnitem. Pro minerálovou dysbalanci, těžkou smíšenou DLP s výraznou chylozitou séra (dle popisu z laboratoře přítomna chylomikra ve vysoké koncentraci) a k dalšímu vyšetření neurologické problematiky byl pacient přijat k hospitalizaci na standardní lůžkové oddělení.
Jednalo se o nemocného s vyjádřeným metabolickým syndromem, tj. s arteriální hypertenzí na kombinační terapii perindoprilem s karvediolem, s onemocněním diabetes mellitus 2. typu kompenzovaným terapií fixní kombinací empagliflozinu s metforminem, se smíšenou DLP léčenou kombinací statinu s fenofibrátem a obezitou II. stupně s abdominální adipozitou. Mimo to pacient udával letité „obtíže se slinivkou“, dle dostupné dokumentace trpěl chronickou pankreatitidou, v minulosti opakovaně exacerbovanou. Jelikož při těchto exacerbacích proběhla hospitalizace vždy v naší nemocnici, je zdokumentováno, že příčinou pankreatitidy nebyla ani v jednom případě těžká hypertriglyceridemie. V osobní anamnéze nemocného dále figurovala diagnóza dilatační kardiomyopatie s ejekční frakcí levé komory (EF LK) 40 %, dle dokumentace nejspíše „toxonutritivní“ etiologie; tou se vysvětlovala také přítomná hepatopatie. Krátce před hospitalizací na našem pracovišti se pacient léčil pro levostrannou bazální pleurobronchopneumonii v jiném zdravotním zařízení. Alergická a rodinná anamnéza byla zcela nevýznamná; kromě výše jmenované medikace pacient užíval ještě levocetirizin a kyselinu acetylsalicylovou z ne zcela jasné indikace. Vzhledem k faktu, že se jednalo o číšníka, nebyl překvapujícím udávaný abusus, a to 20 cigaret denně od mládí a 0,5 litru vína denně ve formě střiku po řadu let, avšak dle aktuální reference v době příjmu již 2 měsíce abstinoval.
Při přijetí na oddělení pacient popisoval postupné chřadnutí, a to zejména v posledních cca 4 týdnech po prodělané levostranné bazální pleurobronchopneumonii. Pro toto onemocnění byl vyšetřen v jiném zdravotnickém zařízení, v němž odmítl navrženou hospitalizaci k parenterální aplikaci antibiotik (ATB), podepsal negativní revers a zařízení opustil na perorální ATB léčbě amoxicilinem s klavulanátem. Následující měsíc pak pravidelně docházel na kontroly; vzhledem k fluktuujícím parametrům zánětu musela být několikrát měněna ATB (amoxicilin/klavulanát -> klaritromycin -> cefuroxim). V mezidobí také absolvoval CT hrudníku, ale nebyla zastižena překvapivě žádná (ani hojící se) ložiska infiltrátu, ale vedlejším nálezem byla sériová fraktura žeber vlevo.
Stav slabosti progredoval v posledních 4 dnech před přijetím, během nichž se nově objevilo i vertigo bez stranové predilekce s doprovodným tinnitem. Pacient nejprve navštívil svého praktického lékaře, který ho však rovnou nasměroval převozovým sanitním vozem do nejbližší nemocnice. Stav se zkomplikoval hned na samém začátku, protože při nastupování do sanity došlo ke krátké, výše popsané, poruše vědomí, pročež byla volána rychlá záchranná služba.
Při vstupně provedeném základním fyzikálním vyšetření dominovaly známky dehydratace, obezita, mapovité fialové eflorescence s výbledy difuzně po těle, nejspíše lipom na šíji; ostatní nález byl v mezích normy. Pacient byl hypertenzní, bez tachykardie, afebrilní. Paraklinická vyšetření zachytila (souhrnně v tab. 1) těžkou smíšenou DLP, hyperglykemii, vyšší hodnoty jaterních testů, normální hodnoty plazmatických bílkovin i amylázy.
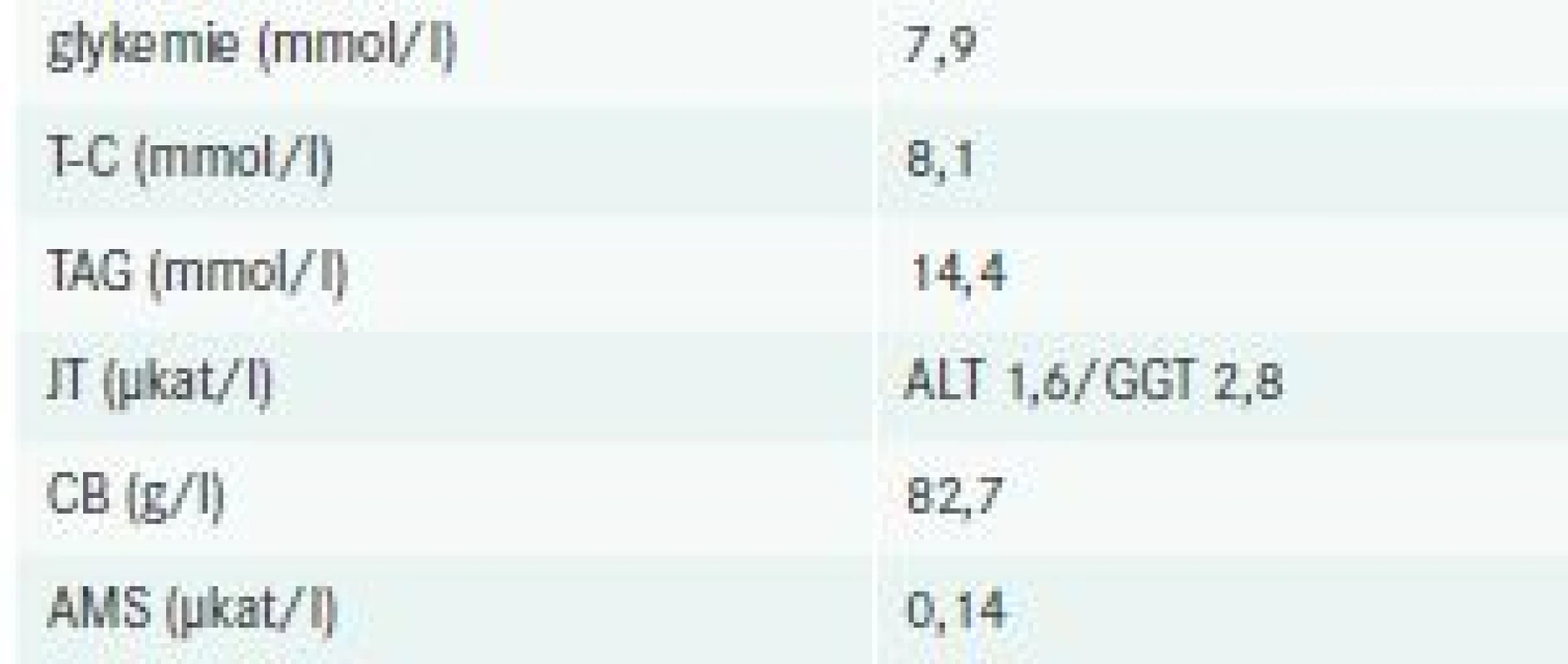
Vstupní elektrokardiogram zaznamenal sinusový rytmus bez známek akutní ischemické či ložiskové léze. Krátce po přijetí na oddělení bylo doplněno CT mozku a RTG hrudníku, obě tato vyšetření neshledala patologický nález. Vzhledem k referovanému vertigu s tinnitem byl pacient vyšetřen neurologickým a otorinolaryngologickým konziliářem, opět bez nálezu vysvětlující patologie; oba tito specialisté doporučili doplnění duplexní sonografie tepen zásobujících mozek. Spolu s tímto vyšetřením se naplánovala také echokardiografie srdce, která vyvrátila diagnózu dilatační kardiomyopatie, avšak zaznamenaná EF LK byla stále lehce pod dolní hranicí normy; při ultrasonografickém vyšetření karotid se zobrazil drobný echogenní plát v pravé bifurkaci. Během hospitalizace byly opakovaně prováděny krevní odběry dokumentující progredující smíšenou DLP (graf); řadu analytů nebylo možné pro výraznou chylozitu séra stanovit. V hematologickém nálezu došlo k mírnému poklesu hemoglobinu na 126 g/l, nově se objevila spontánní koagulopatie s INR 1,5 nejasné etiologie. Doplněná imunofenotypizace leukocytů periferní krve neprokázala žádné plazmocyty ani známky lymfoproliferace.
Při odběrech jsme pravidelně pozorovali krev s velmi vysokou viskozitou, tento jev spolu s výsledky dosavadních vyšetření vedl k pracovní diagnóze – hyperviskózní syndrom (HVS) s doprovodnými neurologickými příznaky ne zcela jasné etiologie (literárně není těžká hypertriglyceridemie jako příčina HVS uváděna).
Vzhledem k možným trombotickým, respektive ztíženým reologickým podmínkám v rámci HVS, byly podávány rehydratační infuze s důslednou prevencí tromboembolizmu pomocí nízkomolekulárního heparinu. Vzhledem k těžké smíšené DLP proběhla edukace nutričním terapeutem a diabetologickou sestrou, do medikace byly přidány omega-3 mastné kyseliny ve vysokých dávkách (3 g/den); upravena byla chronická perorální antidiabetická léčba. Při zavedené terapii došlo k ústupu subjektivních obtíží nemocného, laboratorně však stále přetrvávala těžká smíšená DLP nereagující na léčbu.
Jelikož byl pacient vstupně přijat mimo jiné pro poruchu vědomí, proběhlo u něj také 24hodinové monitorování krevního tlaku a EKG, které nepotvrdilo kardiální etiologii tohoto stavu.
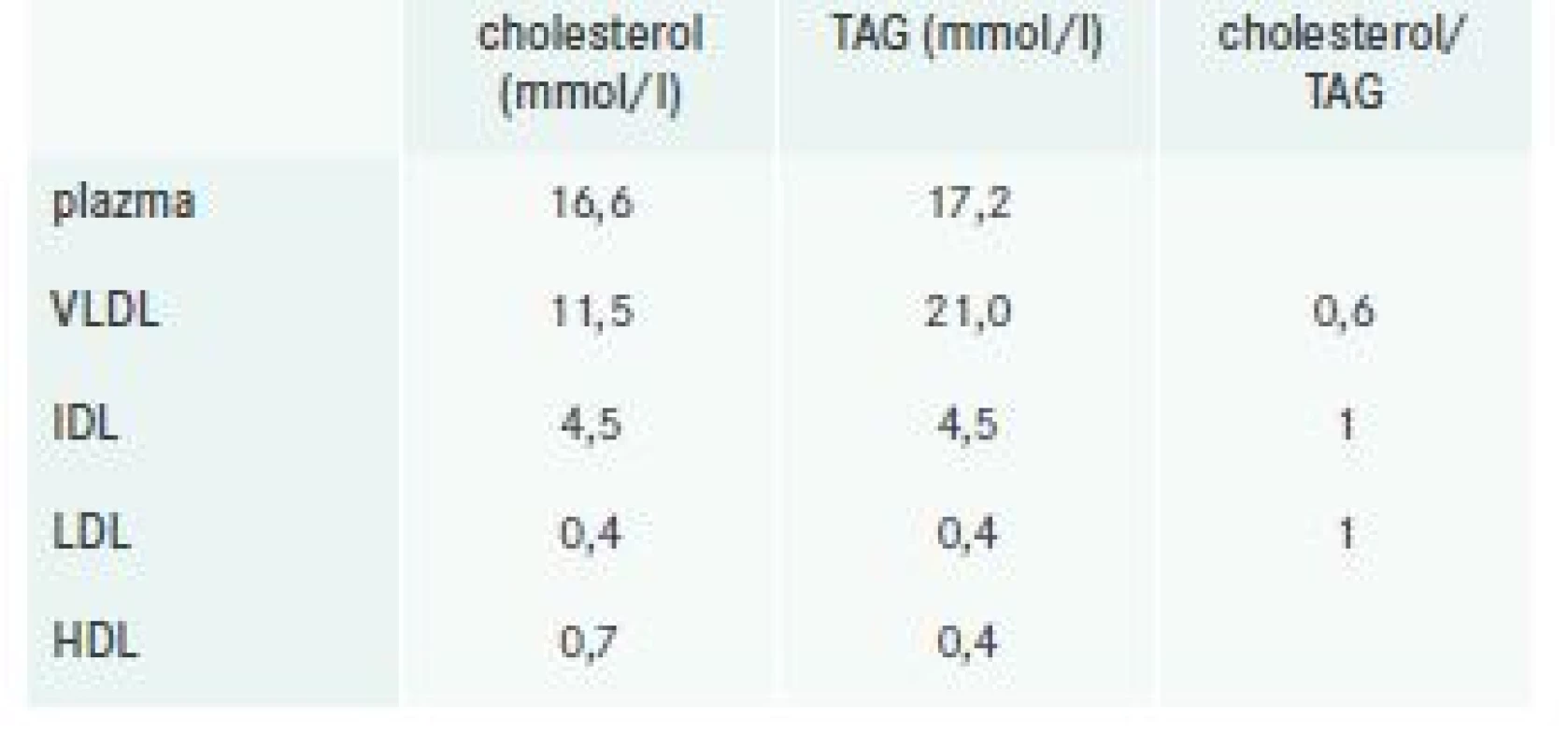
Pro nejasný nález při echokardiografickém vyšetření a anamnézu dilatační kardiomyopatie se doplňovala CT koronarografie; ta sice nezachytila významné aterosklerotické postižení koronárního řečiště, avšak vedlejším nálezem byla osteolytická ložiska obratlových těl hrudní páteře (pozn. ta se nepopisovala na CT hrudníku provedeném pro pleurobronchopneumonii na jiném pracovišti). S ohledem na tento nález bylo vysloveno podezření na MM, zarážející byl však fakt, že při laboratorních vyšetřeních se opakovaně zjistila normální hodnota krevních bílkovin. Elektroforézu bílkovin, ani imunofixaci séra nešlo v naší laboratoři pro jeho chylozitu vyšetřit; močový nález volných lehkých řetězců byl negativní. Proto hematologové indikovali provedení trepanobiopsie z lopaty kosti kyčelní. V mezidobí bylo osloveno laboratorní pracoviště v Institutu klinické a experimentální medicíny v Praze, kde bylo provedeno superkonziliární vyšetření krve našeho nemocného, které odhalilo přítomnost kryoglobulinů, a po laboratorní přípravě i koncentraci celkové bílkoviny 104 g/l. Dalším dodatečným vyšetřením byl dokumentován paraprotein IgA kappa, denzitometricky asi 18 g/l. Ultracentrifugací lipoproteinů se zjistilo, že těžká smíšená DLP je podmíněna akumulací VLDL - a IDL-částic v plazmě, zatímco LDL-částice byly zastoupeny velmi málo (tab. 2).
Výsledek provedené trepanobiopsie definitivně potvrdil diagnózu MM s paraproteinem typu IgA, řetezci kappa a současnou kryoglobulinemií.
U pacienta hematologové následně naplánovali chemoterapii (CHT) kombinační léčbou bortezomibem, dexametazonem a cyklofosfamidem; ta měla být v budoucnu následována ASCT.
Krátce před zahájením hematologické léčby došlo náhle ke zhoršení vizu nemocného s nutností návštěvy oční pohotovosti, kde byl diagnostikován sekundární glaukom při bilaterální okluzi centrální retinální žíly. Oftalmologové opakovaně prováděli proplachy přední oční komory, jejíž komorový úhel byl uzavřen shluky bělavých hmot, diferenciálně diagnosticky „snad“ lipoproteiny či kryoglobuliny, paraprotein zde nebyl elektroforeticky prokázán. Vzhledem k této akutní oční komplikaci bylo indikováno provedení plazmaferézy s velmi dobrým laboratorním i klinickým efektem (graf). Po opakovaném laserovém ošetření sítnice pacient konečně přešel do péče hematologů, kteří zahájili výše zmíněnou CHT. Po několika měsících této léčby proběhla také úspěšná ASCT.

Zahájením léčby došlo k rychlému a velmi výraznému poklesu, respektive normalizaci hladin krevních lipidů a lipoproteinových částic. Celý případ jsme tedy uzavřeli jako mnohočetný myelom s paraproteinem IgA kappa a kryoglobulinemií komplikovaný hyperviskózním syndromem a těžkou smíšenou DLP při pravděpodobné interferenci paraproteinu s intravaskulární lipolýzou (vs lipoproteinovou lipázou).
Diskuse
V případu našeho pacienta jsme dokumentovali v úvodu zdánlivě nesouvisející příznaky – vertigo doprovázené tinnitem, slabost, kožní eflorescence a těžkou smíšenou DLP.
Vzhledem k neurologické symptomatologii bylo na začátku nutno specialistou vyloučit možné akutní neurologické onemocnění, které zahrnovalo nejen základní fyzikální neurologické vyšetření, ale také nativní CT mozku jako zlatý standard mezi zobrazovacími metodami centrálního nervového systému. Jelikož se nepotvrdila patologie neurologického rázu, připadal dále diferenciálně diagnosticky v úvahu tzv. periferní vestibulární syndrom; ten ale následně vyloučil otorhinolaryngolog. Další možné příčiny vertiga mohou vést i k námi prezentovanému případu: tento symptom patřil spolu se slabostí a kožními eflorescencemi do klinického obrazu HVS.
Diagnostikovali jsme jednu z poměrně vzácných sekundárních DLP provázejících MM. Jelikož se jednalo o pacienta s anamnézou diabetes mellitus 2. typu (DM2T), pracujícího v gastronomii, na prvním místě se v rámci diagnostické rozvahy nabízela DLP při abúzu alkoholu či dekompenzaci DM2T, které vídáme v tomto kontextu relativně běžně. Léčbou volby jsou striktní dietní opatření, přísná abstinence alkoholu, dále pak zahájení terapie fenofibrátem, který je možné kombinovat s gramovými dávkami omega-3 mastných kyselin. Pacienta musíme vždy poučit o možných závažných komplikacích těžké hypertriglyceridemie (TAG > 10 mmol/l), tj. o riziku vzniku akutní pankreatitidy jako potenciálně život ohrožujícího stavu. Současně musí být vyloučeny jiné možné příčiny smíšené DLP, jako je například hypotyreóza a další endokrinopatie, nefrotický syndrom či vliv konkomitantní medikace. Pokud však deklarujeme dobrou adherenci pacienta k léčbě, která je ale neúspěšná či DLP při ní dokonce progreduje, je na místě zvažovat méně běžné příčiny, jako je například hematologické onemocnění – typicky monoklonální gamapatie. Pilířem diagnostiky je komplexní hematologické vyšetření zahrnující vyšetření krevního obrazu včetně diferenciálu (i manuálního), provedení elektroforézy plazmatických bílkovin, imunofixaci séra, imunofenotypizaci krevních elementů, trepanobiopsii či vyšetření volných lehkých řetězců v séru a moči. Vyšetřovací proces však, stejně jako v našem případě, naráží na řadu úskalí, zejména při vyšetření pacientů s těžkou hypertriglyceridemií a výrazně chylózním sérem, u nichž řadu analytů stanovit nelze, či jsou stanovovány chybně. Běžnými automatickými analyzátory nemusí být získány validní výsledky: např. naší laboratoří byly vícekrát za sebou naměřeny normální či dokonce nižší hodnoty celkové bílkoviny, zatímco při vyšetření v laboratoři jiného pracoviště zaznamenali hodnoty zcela patologické, kompatibilní s diagnózou MM. Dílčí vyšetření mohou být také limitována jednotlivými nálezy, jako například elektroforéza či imunofixace séra výraznou chylozitou séra. Je tedy evidentní, že diagnostika MM může být daleko komplikovanější, než by se na první pohled mohlo zdát. V souladu s literaturou konstatujeme, že MM zůstává poměrně dlouhou dobu zcela asymptomatický a často se neprojeví obvyklými příznaky či nálezy (CRAB kritéria – viz výše), ale zcela atypicky např. smíšenou DLP nebo při patologicky zvýšené koncentraci plazmatických bílkovin, stejně jako u námi prezentovaného případu, vznikem HVS s doprovodnými kožními, očními či neurologickými příznaky (vertigo, tinnitus, lividní kožní eflorescence, sekundární glaukom). Musíme vždy uvažovat o tom, zda za jednotlivými příznaky nestojí jedno onemocnění, či lépe řečeno patologický stav. V zásadě se pak jedná o diagnózu per exclusionem za předpokladu, že jsou vyloučeny jiné možné patologie.
U pacientů s MM těžká smíšená DLP (včetně kožních projevů ve smyslu xantomatózy) zpravidla špatně reaguje na kombinační léčbu statinu s fibrátem, ale promptně se upravuje adekvátní hematologickou léčbou, což demonstruje i náš případ. Patogeneze vzniku DLP u MM není zcela objasněna, předpokládá se interakce paraproteinu jednak se samotnými lipoproteiny a jejich receptory, jednak s lipolytickými enzymy (zejména lipoproteinovou a hepatální lipázou). První zmínka o problematice tzv. autoimunitních či imunitně zprostředkovaných DLP se v literatuře objevila již v roce 1977, kdy Beaumont et al uvedli práci s názvem „Autoimunitní hyperlipidemie“, v níž byly popsány právě výše jmenované mechanizmy vzniku sekundární DLP [5]. Existuje řada kazuistických sdělení zabývajících se také problematikou DLP u pacientů s MM; za zmínění stojí práce „Hyperlipidemický myelom: review 53 případů“ kolektivu autorů v čele s Benjaminem Misselwitzem. Autoři došli k závěru, že DLP byla pozorována nejčastěji při paraproteinemii IgA a IgG, přičemž medián celkového cholesterolu byl 11,5 mmol/l, TAG 16,5 mmol/l; HVS se vyskytoval u 14 z 53 případů. Všichni pacienti z této práce nereagovali na zvyklou hypolipidemickou léčbu, ale (dle očekávání) pokles hodnot lipidogramu nastal právě při léčbě hematoonkologické [6].
Plazmocyty pacientů s MM v některých případech produkují také kryoglobuliny, tj. imunoglobuliny, které precipitují při nízké teplotě; mechanizmus precipitace není dosud dobře pochopen. Kryoglobulinemie vede většinou k systémové zánětlivé odpovědi, jež se projevuje slabostí, bolestí kloubů, purpurou, neuropatií či glomerulonefritidou. Z hlediska prevalence se jedná o vzácnou chorobu (1 : 100 000, poměr žen a mužů 3 : 1), avšak existuje celá řada relativně častých predispozic vyvolávajících toto onemocnění, jako např. infekce virem hepatitidy C, onemocnění pojiva či lymfoproliferativní onemocnění. Typické klinické projevy kryoglobulinemie jsou pro přehlednost shrnuty v tab. 3. Až u 40 % zdravých jedinců detekujeme velmi nízké titry kryoglobulinů, ty však nevyvolávají žádné klinicky relevantní příznaky. Rozlišujeme kryoglobulinemii typu I-III: typ I je spojen s výskytem monoklonálních kryoglobulinů vznikajících v kontextu lymfoproliferativních onemocnění. Vysoké koncentrace těchto látek mohou díky svým vlastnostem do značné míry zkreslovat výsledky stanovované automatickými analyzátory. Diagnostika kryoglobulinemie se opírá o klinický obraz (purpura u našeho nemocného), často pozorovanou zvýšenou viskozitu krve (v této kazuistice jistě kombinované etiologie), dále pak o vyšetření komplementu, sedimentace, C-reaktivního proteinu či stanovení antinukleárních protilátek, respektive revmatoidního faktoru. Kryoglobulinemie jako taková se většinou neléčí, je ale nutné vždy sanovat její vyvolávající příčinu, tj. v našem případě základní onemocnění MM. Pokud dochází k její fulminantní manifestaci, je metodou volby plazmaferéza, ideálně prováděná 3krát týdně po dobu 3 týdnů [7].
![Klinické projevy kryoglobulinemie. Upraveno dle [7]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/c629af35462145409ff545c12eb72352.jpeg)
Obecně lze konstatovat, že plazmaferéza by měla být indikována nejen u pacientů s kryoglobulinemií, ale také u pacientů s těžkou smíšenou DLP (nereagující na léčbu) či HVS, a to preferenčně v kontextu jeho možných komplikací. Díky této metodě dokážeme velmi rychle normalizovat patologicky zvýšené hladiny jak krevních lipidů a lipoproteinových částic, tak plazmatických bílkovin, a minimalizovat tím dopady těchto stavů.
Diagnostická kritéria MM jsou pro přehlednost uvedena v tab. 4.
![Diagnostická kritéria MM. Upraveno podle [8]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/42022ec773eb5670e327d093bc61f737.jpeg)
Zvyklou léčbu MM v ČR představuje chemoterapie (typicky kombinace dexametazonu a bortezomibu s cyklofosfamidem) s následnou ASCT. V souladu s literárními prameny vedla tato léčba i v naší kazuistice k promptní úpravě lipidogramu a dalších laboratorních parametrů.
Závěr
Závěrem lze shrnout, že v případě záchytu smíšené DLP je třeba v prvé řadě vyloučit její možné sekundární příčiny, nejčastěji dekompenzaci diabetes mellitus či hypotyreózu, avšak v případě farmakorezistentní DLP musíme pomýšlet i na možné vzácné sekundarity – jako například námi diskutovaný MM. Prezentovaná kazuistika dobře demonstruje komplexnost celého problému, který vyžaduje multidisciplinární přístup se zapojením řady odborníků různých specializací. Pro praxi je jistě důležitý fakt, že v případě těžké smíšené DLP, zvláště v kontextu HVS či kryoglobulinemie, lze využít plazmaferézy, jakožto suverénní metody vedoucí k normalizaci jak klinického, tak laboratorního nálezu.
MUDr. Martin Šatný
Doručeno do redakce/Doručené do redakcie/Received 10. 1. 2019
Přijato po recenzi/Prijaté po recenzii/Accepted 30. 1. 2019
Sources
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin 2018; 68(1): 7–30. Dostupné z DOI: <http://dx.doi.org/10.3322/caac.21442>.
- Mnohočetný myelom. Česká myelomová skupina [online]. [cit. 2018–12–30]. Dostupné z WWW: <https://www.myeloma.cz>.
- Kumar SK, Rajkumar V, Kyle RA et al. Multiple myeloma. Nat Rev Dis Primers [online] 2017; 3 : 17046. Dostupné z DOI: <http://dx.doi.org/10.1038/nrdp.2017.46>.
- Herold G. Innere Medizin 2017. Gerd Herold Verlag: Köln 2016. ISBN 978–3981466065.
- Beaumont JL, Beaumont V. Autoimmune hyperlipidemia. Atherosclerosis 1977; 26(4): 405–418. Dostupné z DOI: <https://doi.org/10.1016/0021–9150(77)90111–3>.
- Misselwitz B, Benjamin, Goede JS et al. Hyperlipidemic myeloma: review of 53 cases. Ann Hematol 2010; 89(6): 569–577. Dostupné z DOI: <http://dx.doi.org/10.1007/s00277–009–0849–9>.
- Takada S et al. Cryoglobulinemia (Review). Mol Med Rep 2012; 6(1): 3–8. Dostupné z DOI: <http://dx.doi.org/10.3892/mmr.2012.861>.
- Ščudla V, Minařík J, Pika T et al. Diferenciální diagnostika monoklonálních gamapatií z pohledu klinické praxe I. Maligní monoklonální gamapatie. Interní Med Praxi. 2017; 19(5): 274–278. Dostupné z WWW: <https://www.internimedicina.cz/pdfs/int/2017/05/08.pdf>.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adultsArticle was published in
Athero Review

2019 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine Eases Daily Life for Patients and Caregivers
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Těžká smíšená dyslipidemie jako projev hematologického onemocnění: kazuistika
- Vliv alirokumabu na kardiovaskulární příhody: Co ukázala studie ODYSSEY OUTCOMES?
- Nutraceutika s hypolipidemickým účinkem v klinické praxi: shrnutí stanoviska Mezinárodního expertního panelu lipidologů vypracované výborem České společnosti pro aterosklerózu
- Iniciativa k ustavení aferetických center: indikace a provádění lipoproteinové aferézy v České republice
- Deficit lyzosomální kyselé lipázy v diferenciální diagnostice familiární hypercholesterolemie
- Terapie dyslipidemie u pacienta se svalovou dystrofií: kazuistika
- Psoriáza ako rizikový faktor kardiovaskulárnych príhod: kazuistika
- Intenzívny manažment dyslipidémie u veľmi vysokorizikových pacientov pomocou PCSK9-inhibítorov
- Athero Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Nutraceutika s hypolipidemickým účinkem v klinické praxi: shrnutí stanoviska Mezinárodního expertního panelu lipidologů vypracované výborem České společnosti pro aterosklerózu
- Deficit lyzosomální kyselé lipázy v diferenciální diagnostice familiární hypercholesterolemie
- Terapie dyslipidemie u pacienta se svalovou dystrofií: kazuistika
- Psoriáza ako rizikový faktor kardiovaskulárnych príhod: kazuistika
