Renesance antialdosteronik v soudobé kardiologii
Antialdosteronics renaissance in the contemporary cardiology
We present an overview on synthesis and effects of aldosterone and their competitive inhibitors spironolactone and eplerenone. We briefly mention the indications, contraindications and adverse effects of the nonspecific inhibitor spironolactone in patients with primary and secondary hyperaldosteronism and its significance in hypertension treatment. Small doses of spironolactone (25 mg daily) in chronic heart failure NYHA II–IV represent a new indication, where the antiproliferative effect on progression of heart failure takes place (RALES study). Eplerenon is a specific inhibitor and presents a minimum of adverse effects. It was successfully tested in patients with hypertensive left ventricular hypertrophy (4E study) and in patients suffering from chronic heart failure (the EPHESUS study).
Keywords:
aldosterone – spironolactone – eplerenone – chronic heart failure – left ventricular hypertrophy – hypertension
Authors:
M. Štejfa
Published in:
Kardiol Rev Int Med 2005, 7(1): 21-24
Overview
V článku je podán přehled o vzniku a účincích aldosteronu a jeho kompetitivních inhibitorech spironolaktonu a eplerenonu. Jsou stručně probrány indikace, kontraindikace a nežádoucí účinky nespecifického inhibitoru spironolaktonu u primárních a sekundárních hyperaldosteronizmů a jeho významu pro léčbu hypertenze. Novou indikací jsou malé dávky spironolaktonu (25 mg denně) chronického srdečního selhání NYHA II–IV, kdy se uplatňuje jeho tkáňový antiproliferativní účinek na progresi srdečního selhání, jak prokázala studie RALES. Specifický inhibitor eplerenon má méně nežádoucích účinků. Byl testován úspěšně u nemocných s hypertenzní hypertrofií levé komory (studie 4E) a ve studii u chronického srdečního selhání (EPHESUS).
Klíčová slova:
aldosteron – spironolakton – eplerenon – chronické srdeční selhání – hypertrofie levé komory – hypertenze
Aldosteron (obr. 1), nejúčinnější mineralokortikoid, byl objeven v USA během týmového výzkumu hormonů kůry nadledvin r. 1953. Jeho nespecifický kompetitivní inhibitor spironolakton sestrojili ve farmaceutických laboratořích Searle r. 1957. Do běžného klinického užívání byl uveden o několik let později. K dalšímu pokroku došlo až v r. 1987 objevem derivátů spironolaktonu. Do praxe se uvádí specifický kompetitivní inhibitor eplerenon, s nímž byly dokončeny klinické studie teprve v posledních letech.
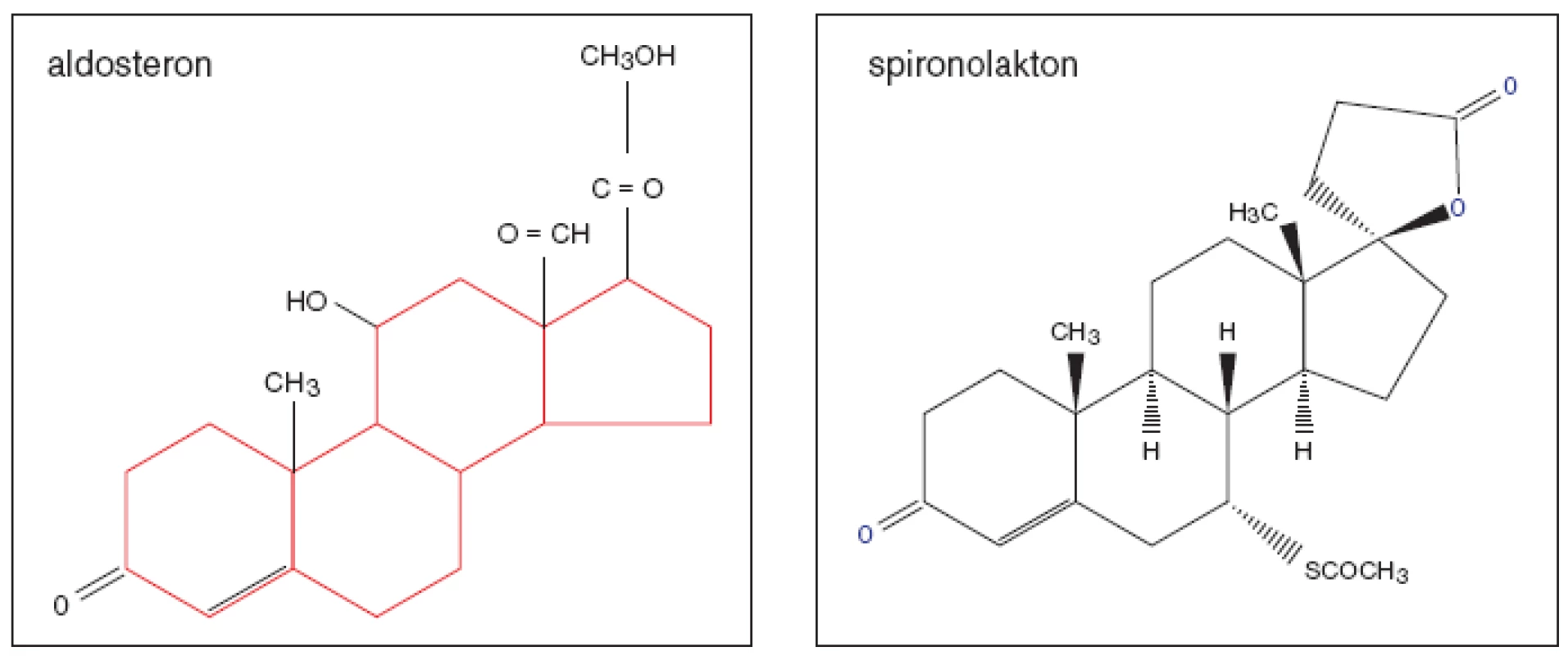
Aldosteron
Syntéza a uvolňování aldosteronu z buněk v zona glomerulosa kůry nadledvin, myokardu a stěny cév jsou regulovány přes zde uložené receptory pro angiotenzin II (AT1). Regulační vliv ACTH, hyperkalemie, hyponatremie, endotelinu, vazopresinu aj. má za běžných okolností podřadný význam.
Aldosteron působí na intracelulární mineralokortikoidní receptory, které patří k nadrodině steroidních transkripčních regulátorů, obsažených intracelulárně v tubulárních epiteliích ledvin, v myokardu a cévní stěně, kosterním svalu aj. Celá kaskáda je tedy následující: angiotenzin konvertující enzym – angiotenzin II – receptory AT1 – uvolnění aldosteronu – mineralokortikoidní receptory cílového orgánu.
Fylogeneticky je aldosteron jako konečný článek systému renin – angiotenzin – aldosteron určen pro nápravu ztráty tekutin a soli. Působí v tubulárních epiteliích ledvin tlustého segmentu Henleovy kličky reabsorpci Na+ a vody, tedy zvýšení objemu intravaskulární a extracelulární tekutiny. Při dlouhodobě zvýšené hladině plazmatického aldosteronu dochází k nadměrné retenci tekutin, drenáži K+, Mg++ a H+, tedy dysionii a metabolické alkalóze, zpětné stimulaci sympatického systému, uvolňování noradrenalinu v myokardu, zvýšení cévní rezistence a zhoršení baroreflexní odpovědi.
Tkáňový aldosteron vede v buněčných jádrech cílových orgánů ke změně proteosyntézy a je odpovědný za hypertrofii a remodelaci myokardu a cévní stěny, zmnožení kolagenu, zhoršování komorové dysfunkce, dále za riziko ischemie (endotelová dysfunkce, snížená koronární rezerva, zvýšení noradrenalinemie) a riziko arytmií (hypokalemie, hypernoradrenalinemie, ischemie, fibróza), mimo kardiovaskulární systém např. za remodelaci mezangia ledvin. Úspěch léčby chronického srdečního selhání ACE–inhibitory a antagonisty angiotenzinu II typu AT1 je dán též regresí hypertrofie a remodelace levé komory, na jejímž vzniku se uplatňuje především tkáňový aldosteron [10].
Antialdosteronika
Antialdosteronika kompetitivně vytlačují aldosteron z vazby na receptory a potlačují resp. napravují plazmatické i tkáňové nežádoucí účinky dlouhodobé hyperaldosteronemie. Je nutno podtrhnout přídatné účinky pozitivně inotropní a antiarytmické. Potencují účinek digoxinu, diuretik, ACE–inhibitorů (kombinace s ACE–I může vést k hyperkalemii), solí lithia, snižují účinek antikoagulancií.
Spironolakton (Verospiron® Richter Gedeon) je prolékem, v játrech se mění na účinný kanrenoát. Spironolakton se podává v tabletách, kanreonát je vhodný pro podání v mikroinfuzích. Plného účinku je dosaženo až po 3 dnech léčby. Aldosteronové receptory jsou blokovány dlouhodobě. Spironolakton jako nespecifický blokátor mineralokortikoidních receptorů blokuje i další steroidní receptory – glukokortikoidní, progesteronové a androgenní. To je příčinou nežádoucích účinků léčby, které se vyskytovaly u původního dávkování ve více než 10 %, např. především hyperkalemie a zvýšení kreatininu, dále dyspepsie, kožní alergie, u mužů gynekomastie, poruch potence, u žen mastodynie, virilizace, poruchy menstruačního cyklu a další. Kontraindikací je peptický vřed, oligoanurie, gestace.
Eplerenon (Inspra® Pfizer) je specifickým přímým blokátorem aldosteronových receptorů. Je nutno kontrolovat kalemii a sérový kreatinin, jejichž odchylky jsou podle studií významnější než po placebu. Další kortikoidní receptory blokuje nevýrazně, tyto vedlejší účinky nepřesahují výskyt po placebu.
Původní indikace spironolaktonu
Od 60. let se spironolakton používá k léčbě primárního hyperaldosteronizmu (Connův syndrom) při hyperplazii nadledvin, adenomu aj. Dávkování je vysoké, 200–300 mg denně i více.
Další častější indikací je použití spironolaktonu při sekundárním hyperaldosteronizmu, kromě nefrotického syndromu a jaterní cirhózy s ascitem u těžkého městnaného srdečního selhání. Spironolakton je slabým diuretikem, zvyšuje diurézu nejvíce o 2 % glomerulárního filtrátu, ale šetří draslík. Proto se u edémových stavů používá v kombinaci s „kličkovými“ diuretiky (furosemid). Dávkování se pohybuje mezi 50–200 mg denně, případně ve formě mikroinfuzí kanreonátu. Při současné léčbě srdečního selhání je kardiální anasarka již vzácným jevem.
U hypertenze se spironolokaton přidává jako „draslík šetřící diuretikum“ k antihypertenzivní léčbě saluretiky pro prevenci nebo úpravu hypokalemie, a to v malých dávkách. Vlivem propracované laboratorní diagnostiky se předpokládá určitá účast aldosteronu až u 20–30 % hypertenzí.
Současná renesance spironolaktonuv léčbě chronického srdečního selhání
Nemocní s chronickým srdečním selháním vlivem moderní léčby (ACEI, sartany, betablokátory, diuretika) přežívají déle, avšak posléze za cenu snížené kvality života a velkých ekonomických nákladů. Progrese chronického srdečního selhání do terminální fáze souvisí se zvyšující se hladinou aldosteronu, která statisticky koreluje s mortalitou selhání (obr. 2) [3,4,9,10].
![Vyšší hladiny aldosteronu u nemocných chronickým srdečním selháním jsou provázeny vyšší úmrtností než nižší hladiny [9].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2201be077f1213f2f9702427ecc72a2d.png)
U chronického srdečního selhání stoupá koncentrace aldosteronu (normál 5–15 ng/dl) až 20krát, jednak vlivem angiotenzinu II, avšak též vlivem aktivace dalších regulačních mechanizmů jako endotelinu, vazopresinu, ACTH aj, dále vlivem snížené perfuze ledvin a snížené perfuze jater (pokles odbourání o 25–50 %).
ACE inhibice dlouhodobě vzniku angiotenzinu II nezabrání, neboť se aktivují alternativní cesty konverze. Ani sartany nedokáží zablokovat uvolňování aldosteronu, pravděpodobně mechanizmem „rebound“. Během 6–12 měsíců se však hladina aldosteronu vrací k výchozí hladině (tzv. aldosteronový escape) (obr. 3) [1]. Největší a nejdelší pokles koncentrace aldosteronu lze dosáhnout u refrakterních selhání kombinací ACEI + sartan.
![Aldosteronový escape – po podání enalaprilu se významně sníží plazmatická hladina angiotenyin–konvertujícího enzymu, avšak plazmatická hladina aldosteronu se po krátkém poklesu vrací k normálu [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cfd1a72f63f9d81d44f49853065ea43f.png)
Pilotní studie RALES (Randomized ALdactone Evaluation Study, 1996) testovala otázku, jak malé (nediuretické) dávky spironolaktonu (12,5–25–50 mg/den) působí ve srovnání s placebem u standardně léčených pacientů s chronickým srdečním selháním NYHA II–IV. Bylo sledováno 214 pacientů po dobu 3 měsíců. Všechny testované dávky snížily hladinu aldosteronu, neboť při nezměněné diuréze zvýšily vylučování aldosteronu do moči, snížily hladinu angiotenzinu II (vyšetřovanou pomocí plazmatické reninové aktivity, která je inverzním markerem hladiny angiotenzinu II). Nevznikala hyperkalemie, snížila se hladina ANP, která koreluje s tlakem v zaklínění. Experimentálně pak byla prokázána schopnost spironolaktonu bránit vzniku fibrózy.
Mortalitní studie RALES (1999) s 25 mg spironolaktonu denně u 1 600 standardně léčených pacientů ve stadiu NYHA III–IV (ejekční frakce pod 35 %) proti placebu [4] vedla během 24 měsíců k významnému snížení celkové a kardiální mortality, kombinaci mortalita + hospitalizace a ke zlepšení třídy NYHA v průměru o 30 % (obr. 4, tab. 1). Preventivní význam u lehčích selhání není dosud znám.
![Studie RALES – přežívání nemocných s chronickým srdečním selháním při standardní léčbě je po přidání malé dávky spironolaktonu významně zlepšené: snížení rizika smrti o 30 % (p 0,001) [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/675049a8a33d0da6fb5c8c83f9b2da3c.png)
Na jedné straně je nutno podtrhnout, že pro léčbu malými dávkami spironolokatonu (obvykle 25 mg/den, u nemocných s velmi nízkou hmotností 12,5 mg/den) musí být odpovědně vybráni nemocní s nelepšícím se srdečním selháním NYHA III–IV a nízkou erekční frakcí (pod 35 %), kteří jsou léčeni standardní terapií ACE–inhibitory, beta–blokátory, diuretiky a případně digoxinem, nesmí užívat draslíkové přídavky, nesmí mít hyperkalemii anebo závažnou nedostatečnost ledvin. Při nesprávné indikaci hrozí hyperkalemie až u 25 % léčených, která se klinicky může projevit závažnými poruchami vodivé srdeční soustavy anebo rozvojem renální nedostatečnosti. Pacienti tedy musí být klinicky a laboratorně monitorováni (kalemie, kreatinin) [2].
Na druhé straně podle Widimského [11] však zatím dostává tuto kombinaci pouze 16–17 % nemocných s CHSS, ačkoli při správné indikaci, správném dávkování a monitorování přináší pacientům prospěch.
Eplerenon
Studie EPHESUS (Eplerenon Post–acute myocardial infarction HEart failure efficacy and SUrvival Study) byla multicentrická, randomizovaná, dvojitě zaslepená studie kontrolovaná placebem, která hodnotila účinek eplerenonu v dávce 25 až 50 mg/den na celkovou a kardiovaskulární úmrtnost nebo hospitalizaci z kardiovaskulárních příčin u více než 6 000 pacientů po akutním infarktu s levokomorovou dysfunkcí optimální standardní terapií. Byla ukončena po 16 měsících a statisticky významně snížila celkovou úmrtnost, kardiovaskulární úmrtnost, počet hospitalizací a výskyt náhlé kardiovaskulární smrti (obr. 5) [5,7].
![Studie EPHESUS – Kaplan-Meierova křivka kumulativního nárůstu kardiovaskulárních úmrtí a hospitalizací při standardní léčbě je s přídavkem 25 mg spironolaktonu/den významně pomalejší (p < 0,002) [7].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/22e72873b48d4b13176799d5aea77425.png)
Studie 4E (studie Efficacy and safety of Eplerenone, Enalapril and Eplerenone/Enalapril combination therapy in pacients with left ventricular hypertrophy) u hypertoniků s hypertrofií levé komory ukázala, že eplerenon snižuje nejen krevní tlak (především systolický), ale též hmotnost levé komory: eplerenon sám podobně jako enalapril sám o 13 %, kombinace eplerenonu s enalaprilem o 26 % [6].
Výsledky studií jsou známy teprve krátce, lze však očekávat, že se upřesnění indikací eplerenonu brzy objeví v léčebných doporučeních.
Závěr
U závažně systolicky selhávajících pacientů s EF pod 35 % (NYHA III–IV) standardně léčených je možné přidat ke standardní léčbě (12,5)–25–(50) mg spironolaktonu denně. Spironolakton v této dávce většinou nemá nežádoucí účinky, je však nutné monitorovat kalemii a kreatininemii. Spironolakton v malých dávkách blokuje nárůst myokardiální fibrózy, zpomaluje progresi srdečního selhání a snižuje mortalitu.
Novou úspěšnou látkou pro léčení chronického srdečního selhání v kombinaci se standardní léčbou a s vlivem na regresi hypertrofie a remodelace levé komory je specifický blokátor aldosteronových receptorů eplerenon v dávkování 25 až 50 mg/den.
Prof. MUDr. Miloš Štejfa, DrSc., FESC
emeritní profesor LF MU Brno
Prof. MUDr. Miloš Štejfa, DrSc., FESC
Prof. MUDr. Miloš Štejfa, DrSc., FESC, emeritní profesor lékařské fakulty Masarykovy univerzity, se narodil 28. května 1929 v Brně, kde také vystudoval. Na Lékařské fakultě Masarykovy univerzity promoval v roce 1953. Tři roky potom působil jako sekundární lékař v KÚNZ Bánská Bystrica. V roce 1957 nastoupil na II. interní kliniku ve Fakultní nemocnici U sv. Anny v Brně. Setrval tu plných 32 roků, nejprve jako sekundář, odborný asistent, od roku 1968 docent (od roku 1979 vedoucí jednotky intenzivní péče) a v posledním roce jako profesor. Od roku 1990 do penzionování v roce 1997 zastával místo přednosty I. interní kliniky ve Fakultní nemocnici U sv. Anny. Miloš Štejfa obhájil kandidátskou práci v roce 1963, habilitoval se v roce 1968 a v roce 1987 obhájil doktorskou disertaci. Během své odborné dráhy působil též v zahraničí, v letech 1969 až 1974 jako přednosta interní kliniky v Centre Hospitalier et Universitaire v Oranu a jako stipendista v Greifswaldu (1964), Leydenu a Budapešti (1968) a konečně v Los Angeles (1992). V letech 1986–1987 byl na několikaměsíčním pobytu v Instituto National de Cardiologia v Mexiku. Od počátků se cíleně věnuje kardiologii. Je autorem a spoluautorem 17 monografií a 240 odborných prací, zaměřených z větší části na problematiku ischemické choroby a srdečního selhání. Za svůj přínos byl vyznamenán čestným členstvím České internistické společnosti, České kardiologické společnosti, řádem Rytíř České lékařské komory, Libánského medailí, pamětní medailí Lékařské fakulty Masarykovy univerzity, Spolku lékařů v Brně a dalších. Je členem European Society of Cardiology a Pařížské lékařské společnosti. Jako emeritní profesor Masarykovy univerzity byl požádán o založení a řídí časopis Kardiologická revue a jeho pravidelnou edukační přílohu Kardiofórum.
Sources
1. Biollaz J et al. Antihypertensive therapy with MK421. J Cardiovasc Pharmacol 1982; 4(6): 966–972.
2. Bozkurt B et al. Complications of inappropriate use of spironolactone in heart failure. J Am Coll Cardiol 2003; 41(2): 211–214.
3. Packer M. The neurohumoral hypothesis: a theory to explain the mechanism of disease progression in heart failure. J Am Coll Card 1992; 20 : 248–254.
4. Pitt B et al. The effect of spironolactone on morbidity and mortality in patiens with severe heart failure. N Engl Med J 1999; 341 : 709–717.
5. Pitt B et al. The EPHESUS trial: eplerenon in patients with heart failure due to systolic dysfunction complicating acute myocardial infarction: eplerenon post–acute myocardial infarction heart failure efficacy and survival study. Cardiovasc Drug Ther 2001; 15 : 79–87.
6. Pitt B et al. Efficacy and safety of eplerenone, enalapril and eplerenone/enalapril combination therapy in pacients with left ventricular hypertrophy. Am J Hypertens 2002; 15 : 23.
7. Pitt B et al. Eplerenon post–acute myocardial infarction heart failure efficacy and survival study. N Engl J Med 2003; 348 : 1309–1321.
8. Struthers AD. Aldosterone escape dutiny angiotensin–converting enzyme therapy in chronic heart failure. J Cardiac Failure 1996; 2(1): 47–54.
9. Swedberg K et al. Hormones regulating function in patients with severe congestive heart failure and their relation to mortality. Circulation 1990; 82(5): 1730–1736.
10. Weber KT. Aldosterone and spironolactone in heart failure. N Engl Med J 1999; 341 : 753–755.
11. Widimský J et al. Improvement of heart failure 2. Cor Vasa 2001; 43 : 345–352.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2005 Issue 1
Most read in this issue
- Trimetazidin v léčbě anginy pectoris a ostatních forem ICHS
- Praktické aspekty a novinky ve farmakologické léčbě arytmií
- Rehabilitace po infarktu myokardu
- Renesance antialdosteronik v soudobé kardiologii


