Akutní infarkt myokardu u nemocných s renálním selháním II: Kontrastová nefropatie, moderní eliminační léčebné metody, význam stanovení troponinu
Acute myocardial infarction in renal insufficiency II: Contrast induced nephropathy, modern continuous elimination methods, importance of troponin evaluation
The serious complication of modern interventional treatment of acute myocardial infarction (AMI) with impaired renal function is so called contrast-induced nephropathy that is connected with significantly higher morbidity and mortality. That risk is increased with stage of renal insuficiency (RI) and is also significantly higher in diabetics. Therefore its prevention is important approach to reduction mortality and rate of cardiovascular complication. The basic approach is beside risk stratification the elimination of potentially nephrotoxic drugs and the use of nonionic low - or iso-osmolality radiocontrast media with minimalization of their dosis The very important is adequate hydration and monitoring of renal function and diuresis after interventional procedure. The application of N-acetylcystein-is promising preventive pharmacotherapy. The modern continuous elimination methods are of great benefit for patients with AMI and severe renal failure, because that could be performed bedside in the intensive care department. The higher serum concentration of troponins frequently observed in patients with RI without AMI can cause some problems in diagnostics. It is very considerable that also non-coronary increase of serum troponin concentration in RI is significant negative prognostic factor
Key words:
acute myocardial infarction, renal insufficiency, contrast induced nephropathy, prevention, modern continuous elimination methods, troponin
Authors:
S. Janoušek
Authors‘ workplace:
Interní kardiologická klinika
; FN Brno, pracoviště Bohunice
; doc. MUDr. Stanislav Janoušek, CSc.
Published in:
Kardiol Rev Int Med 2007, 9(2): 90-98
Category:
Editorial
Overview
Závažnou komplikací moderních léčebných intervenčních metod akutního infarktu myokardu (AIM) při zhoršené funkci ledvin je tzv. kontrastová nefropatie, která je spojena s významně vyšší morbiditou i mortalitou. Toto riziko se zvyšuje s tíží renálního selhání (RI) a je významně vyšší také u diabetiků. Její prevence je proto významnou cestou ke snížení mortality a kardiovaskulárních komplikací. Základním postupem je kromě stratifikace nemocných podle rizika také eliminace potenciálně nefrotoxických léků a použití neionálních nízkoosmolárních, resp. izoosmolárních, kontrastních látek a rovněž snaha o minimalizaci jejich dávky. Důležitá je dostatečná hydratace nemocného i sledování diurézy a funkce ledvin po intervečním zákroku. Co se týče preventivních farmakologických postupů, jeví se jako nadějné podávaní N-acetylcysteinu.
Velkým přínosem jsou u těžkých RI pro nemocné s AIM moderní kontinuální eliminační metody, které je možno aplikovat přímo u lůžka nemocného na oddělení intenzivní péče.
Zvýšení troponinu často pozorované u některých nemocných s RI bez AIM může vést k diagnostickým problémům. Důležité je, že i nekoronární pozitivita troponinu u RI je významným negativním prognostickým faktorem.
Klíčová slova:
akutní infarkt myokardu, renální insuficience, kontrastová nefropatie, prevence, moderní kontinuální eliminační metody, troponiny
Kontrastová (radiokontrastní) nefropatie
Podání radiodiagnostických kontrastních látek (KL) může způsobit zhoršení ledvinných funkcí až akutní selhání ledvin (ARI), které je obvykle reverzibilní, ale může být příčinou závažné morbidity a mortality nemocných [1] (viz Janoušek [106], graf 8). Tento stav nazývaný kontrastová nebo radiokontrastní nefropatie (KN) je obvykle definován jako zvýšení koncentrace kreatininu o 25 % nebo absolutně o 44 μmol/l za 48 hod po IV. aplikaci KL [2].
Nefrotoxicita jódových KL je známa už desítky let. Jód je známým silným oxidačním činidlem a je dlouhodobě používán jako součást antiseptických roztoků. V posledních letech stoupá počet kontrastních vyšetření především díky rozvoji intervenční kardiologie, a proto se ve vyspělých krajinách stává KN nejčastější příčinou ARI.
Pokud se vinou KN rozvine ARI, obvykle se jedná o kombinaci prerenálního a renálního selhání. KN je multifaktoriální onemocnění, její patogeneze dodnes není zcela detailně objasněna [3-8]. Zde uvádíme jen stručný přehled, k detailům odkazujeme na podrobnější literaturu [9-11].
Patogeneze KN:
- Přímá
cytotoxicita
Za přímou cytotoxicitu KL zodpovídá v první řadě tvorba volných kyslíkových radikálů. Příznivý efekt preventivního podávání N-acetylcysteinu (NAC) potvrzuje, že tento mechanizmus je nejvýznamnějším patogenetickým faktorem. Intenzivní výzkum různých KL [12,13] ukázal, že při použití neionových KL je podstatně nižší výskyt KN [12,14-19]. Co se týče osmolality, byly zpočátku preferovány nízkoosmolární KL [20,21], poslední studie ukázaly, že u diabetické nefropatie ještě lepší prevenci poskytují izoosmolární média [18].U nerizikových pacientů se nízkoosmolární KL nedoporučují, a to především pro jejich vyšší cenu. Výskyt KN je u nemocných s dobrou funkcí ledvin u obou skupin KL srovnatelný. Významnou úlohu hraje i množství použité KL [2,14,22-24], proto se obecně nedoporučuje užívat více než 100 ml, je ovšem známo, že u vysoce rizikových nemocných, jako jsou pacienti s diabetickou neuropatií a hodnotami kreatininu > 440 μmol/l, jsou riziková už množství KL přesahující 30 ml [22].
Poruchy renální hemodynamiky
Po podání KL se mění renální hemodynamika. V kůře (podstatně méně v dřeni) nastává krátká přechodná vazodilatace, která odkrví už primárně relativně hypoxickou dřeň. V 2. fázi nastává v celém parenchymu prolongovaná vazokonstrikce, která vede k poklesu glomerulární filtrace (GF). Vystupňovaná hypoxie může vést až k nekróze tubulárních buněk, které jsou vzhledem ke své vysoké metabolické aktivitě na hypoxii citlivější. Selhání postupů podporujících a zlepšujících renální hemodynamiku (viz dále I) bez prokázaného příznivého klinického vlivu na KN ukazuje, že tento mechanizmus při rozvoji KN zřejmě nehraje zcela zásadní úlohu.
Málo je známo, že na vzniku KN při PCI se v malé, ale nikoli nevýznamné míře podílejí také cholesterolové mikroembolizace do renálních tepen [25].
Potencující faktory
- a) stavy redukující renální perfuzi jako pokročilé srdeční selhání nebo hypovolemie se snížením efektivního cirkulujícího objemu při dehydrataci, zvracení, popáleninách, redistribuci objemu (ascites, nefrotický syndrom atd.)
- b) podávání potenciálně nefrotoxických látek a léků (nesteroidní antirevmatika, aminoglykosidy, cyklosporin, vankomycin, amfotericin B, cisplatina atd)
- c) podávání léků ovlivňujících regulaci perfuze ledvin (ACE-inhibitory, diuretika a také vyšší dávka kontrastní látky)
- d) nefropatie
zvláště se snížením GF [4,14,15,23,24,26-28].
Jedná se především o tyto rizikové skupin nemocných [27]- A) renální
selhání (KrCl < 60 ml/min/1,73 m2)
Analýza ukazuje, že při zhoršující se funkci ledvin prudce narůstá riziko KN.
Při normální funkci ledvin je toto riziko 0,5-1,0 %; pokud vyjdeme pouze ze SKr, je při hodnotách 130-350 μmol/l riziko KN 4-30 % a při koncentraci > 350 μmol/l se pohybuje již v rozmezí 30-40 %.
B) Diabetici jsou druhou takovou skupinou. Obecně platí, že nemocní s diabetem (bez diabetické nefropatie) mají riziko vzniku KN zhruba 5krát vyšší než běžná populace [29].
C) mnohočetný myelom [30,31]
Uvádějí se i další rizikové faktory (RF) jako je věk, hypertenze, hyperurikemie, ženské pohlaví atd, ale diskutuje se o tom, zda se jedná o skutečně nezávislé RF. Někteří doporučují použití dotazníku [32], který umožní odhadnout zvýšené riziko po zodpovězení jednoduchých otázek (DM, věk, hypertenze, předchozí vyšetření prostřednictvím KL apod), ale praktické zkušenosti s tímto postupem zatím nejsou dostatečné.
Kromě již výše uvedeného výběru vhodné KL a minimalizace jejích dávek byla v prevenci KN vyzkoušena celá řada dalších postupů:
- A) renální
selhání (KrCl < 60 ml/min/1,73 m2)
I. Bez prokázaného příznivého efektu
- A) Forsírovaná diuréza. Podání fyziologického roztoku (FR), furosemidu a manitolu při začátku PCI nedokázalo znatelnější redukci rizika KN než pouhá hydratace [33].
- B) Hemodialýza a další eliminační metody. K odstranění KL z oběhu by pravděpodobně byla vhodná hemodiafiltrace, musela by být ale použita bezprostředně po radiokontrastním vyšetření. Při hodnocení vlivu eliminačních metod na incidenci KN jsou dosavadní výsledky rozporné [34-37], a proto dnes žádná z metod čištění krve není v prevenci KN jednoznačně doporučována.
- C) Teofylin. Jedná se o inhibitor vazokostrikčně působícího adenozinu. Zjistil se jeho příznivý efekt na renální hemodynamiku, avšak bez redukce rizika KN [38].
- D) Dopamin. Příznivě ovlivňuje renální hemodynamiku, avšak studie nedokázaly příznivý efekt na incidenci KN [39,40].
- E) Atriální natriuretický faktor (ANF). V experimentu zvyšuje renální průtok, v prevenci KN se neosvědčil [40,41].
- F) Kalciové blokátory. Několik menších studií neprokázalo příznivý efekt nifedipinu, nitrendipinu a felodipinu při podání před výkonem [39]. Malá randomizovaná studie zjistila zlepšení GF při podávání nitrendipinu jeden den před a dva dny po výkonu [42]. Větší randomizovaná studie nebyla zatím publikovaná.
- G) Prostaglandin E1 (PGE1). V malé studii u pacientů s nefropatií aplikace PGE1 1 h před výkonem snížila riziko KN [43]. Rozsáhlejší randomizovaná studie nebyla zatím publikovaná.
- H) Fenoldapam. Je to dopamin-1 selektivní agonista, který zvyšuje průtok kůrou i dření ledvin i GF, nemetabolizuje se přes systém cytochromu P-450, není nutná redukce dávky při renálním nebo hepatálním poškození. Pro tyto svoje výhodné vlastnosti se jevil jako velmi nadějný v prevenci KN. Proto byla provedena studie CONTRAST [44], která randomizovala 315 pacientů, všichni byli IV hydratovaní, byla použita neionová nízkoosmolární KL. Pacienti dostávali IV fenoldapam nebo placebo 1 h před a kontinuálně po dobu 12 h po výkonu. Rozdíl v incidenci KN nebyl významný (dokonce byl překvapivě statisticky nevýznamně vyšší při podání fenoldapamu).
II. S prokázaným příznivým efektem
A) Hydratace. Zlepšuje renální perfuzi a GF, riziko KN se hydratací snižuje zhruba o 20-35 %. Lepší výsledky byly dosažené s izotonickým FR oproti hypotonickému [45]. Jako velmi nadějná se jeví izotonická hydratace prostřednictvím NaHCO3, která navíc působí renoprotektivně alkalinizací tubulární tekutiny [46], tento fakt bude ovšem vyžadovat ověření v dalších studiích.
Adekvátní hydratace je v prevenci KN na prvním místě. Snažíme se o udržení pozitivní bilance tekutin, s diurézou alespoň 125 ml/hod, ještě lépe > 150 ml/hod. Zvláštní pozornost si vyžadují pacienti s městnavým srdečním selháním a nemožností odkladu výkonu. Příjem tekutin je u nich limitovaný, doporučuje se monitorování centrálního žilního tlaku, u vysoce rizikových pak udržování pulmonálního kapilárního tlaku v zaklínění na horní hranici normálu [39].
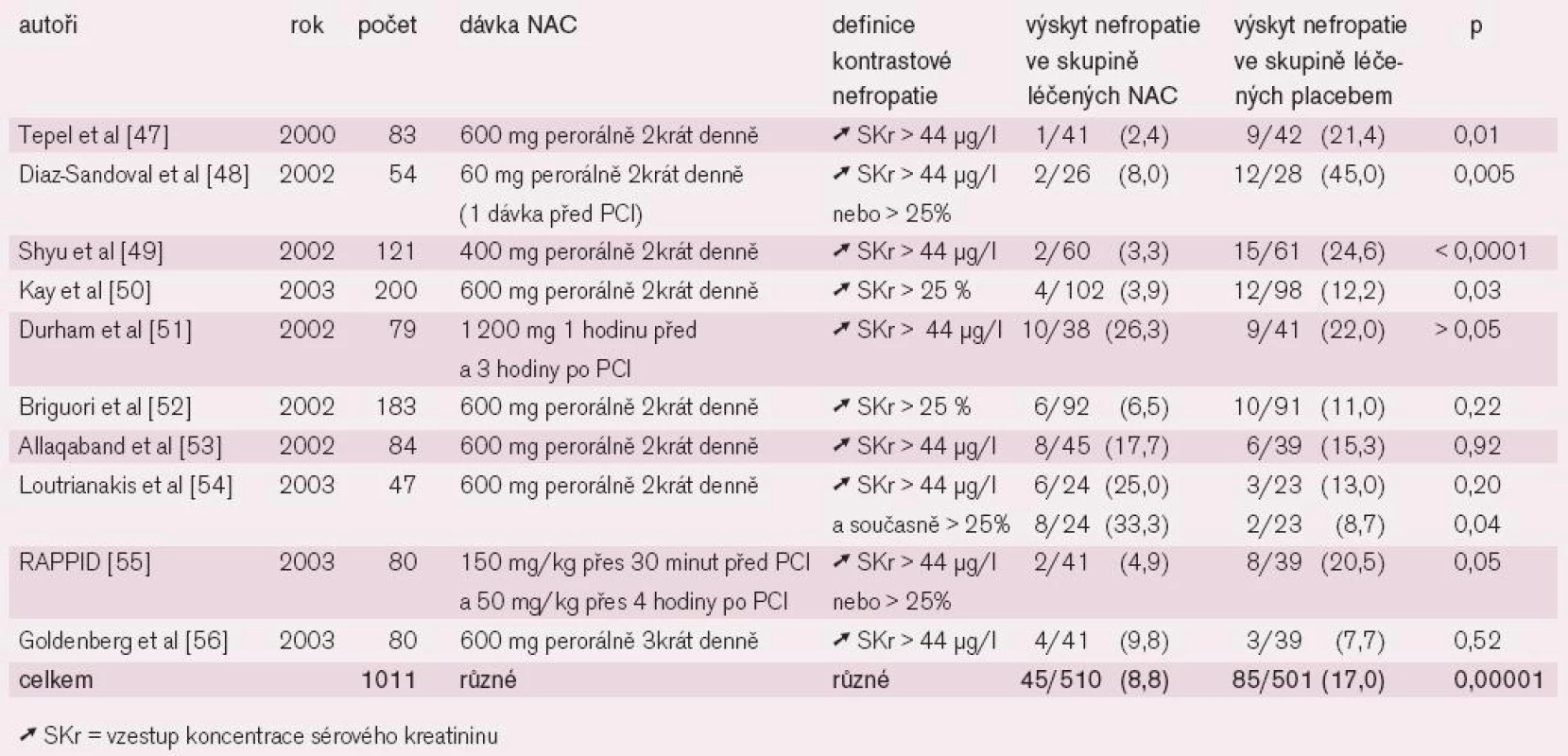
B) NAC: V běžné praxi se používá jako mukolytikum a expektorans. Je to laciný a bezpečný preparát granulátu, roztoku, kapslí a šumivých tablet (ACC, L-Cimexyl, Mucobene, Solmucol, NAC apod.). Jde o acetylovanou aminokyselinu, která má díky reaktivní sulfhydrylové skupině antioxidační schopnosti. Jako scavenger volných kyslíkových radikálů oslabuje cytotoxický efekt KL. Kromě toho mírně potencuje renální vazodilataci zvýšením tvorby oxidu dusnatého. Příznivé výsledky metaanylýzy randomizovaných studií prevence KN při podání NAC jsou uvedeny v tabulce 5 první části tohoto sdělení (viz Janoušek [106], tab. 5) .
Zvlášť příznivý je efekt podání NAC u hemodialyzovaných nemocných léčených PCI [57], ve smyslu snížení závažných komplikací včetně mortality. Nejedná se jen o krátkodobý efekt; byl potvrzen i pro následné 2leté období sledování (viz Janoušek [106], graf 9) [57].
Proto je v současnosti podávání NAC zařazeno do algoritmu prevence KN [39]. Doporučuje se dávka 2 x 600 mg p. o. 1 den před a 1 den po angiografii. Opatrnost vyžadují astmatici pro naštěstí vzácnou možnost provokace bronchospazmu.
V poslední době byla publikována randomizovaná studie, která ukázala, že zvýšení podávané dávky NAC na dvojnásobek má další významně příznivý efekt: brání vzniku KN, zmírňuje jeho průběh KN a snižuje mortalitu [58]. Bude však nutné ověřit toto působení v klinické praxi.
Na základě výše uvedených studií bylo vypracováno mezinárodně přijímané doporučení k prevenci KN.
Doporučený postup prevence KN
(předpokládané snížení rizika o > 50 %)
- Vysazení potenciálně nefrotoxických léků před aplikací KL - NSAID, aminoglykosidy, cyklosporin atd
- Kde GF < 15 ml/min/1,73 m2 konzultovat nefrologa před aplikací KL - zvážit provedení hemodialýzy (HD) po zákroku
- Dostatečná hydratace pacientů před i po zákroku: 4. aplikace FR v dávce 150 ml/hod 3 hod před a 6 hod po zákroku, 300-500 ml během zákroku
- Kde je nebezpečí městnavého srdečního selhání, je vhodné kontinuální monitorování centrálního žilního tlaku, u vysoce rizikových i tlaku v plícnici v zaklínění
- Podání NAC 2krát denně 600 mg p.o. před a znovu po aplikaci KL
- Redukce toxicity KL (odpovídá osmolalitě KL) – užití nízkoosmolárních nebo izoosmolárních neiontových KL, u diabetické nefropatie je preferován iodixanol (VisipaqueR)
- Redukce dávek KL - nepodávat více jak 100 ml KL
- Monitorování funkce ledvin po aplikaci KL, udržení dostatečné diurézy (> 150 ml/h)
Důležité je načasování vyšetření KL (timing) [59]
Riziko je vyšší u pacientů, kteří překonali v posledních 24 h AIM nebo cirkulační kolaps a u pacientů, kterým byla podaná KL v předcházejících 48 h. Přínos PCI u AIM však převyšuje riziko podání kontrastu, u pacientů po kolapsu je samozřejmostí maximální snaha o stabilizaci hemodynamiky. V neurgentních případech má být interval mezi opakovaným podáním KL u nerizikových pacientů alespoň 48 h, u rizikových 72 h, u diabetiků víc než 72 h. Pokud došlo k vzestupu SKr, má být opakované podání KL odloženo až po dosažení vrcholu a při tendenci k jejímu poklesu.
Vzhledem k tomu, že KN je závažná až život ohrožující komplikace, stálo by za seriózní úvahu, zda by nemocní z rizikových skupin neměli před vyšetřením nebo léčbou se 4. aplikací KL podepsat speciální informovaný souhlas, ve kterém by byli seznámeni s možnými riziky vzniku KN.
Moderní eliminační metody u nemocných s RI
Hemodialýza (HD) je nezbytnou léčebnou metodou při RI těžšího stupně. Zjevné riziko tohoto léčebného postupu spočívá v mnohahodinovém pobytu nemocného s AIM mimo KJ, což může znamenat různé závažná komplikace. Menší pozornost je obvykle věnována skrytému riziku, spočívajícím v možném ovlivnění plazmatických koncentrací léků nebo jejich účinných metabolitů. Obecný návod nelze podat, ke každému léku je nutný individuální přístup, údaje jsou zpracovány a známy především hemodialyzačním centrům, které je vhodné kontaktovat (viz Janoušek [106], tab. 4). Lze jen orientačně doporučit, aby léky, jejichž koncentrace jsou pro nás prioritní (antibiotika, antiarytmika) byly podávány ihned po ukončení běhu HD. Jak bylo zmíněno v předchozí kapitole o léčbě, není plně objasněno, zda se příznivý efekt dlouhodobě podávaných kardioprotektivních léků projevuje i u nemocných v terminálním stadiu RI chronicky hemodialyzovaných. Jediná rozsáhlejší prospektivní (nerandomizovaná) studie [60] ukázala u takových nemocných vliv na zvýšení mortality při podávání nitrátů, antitrombotik a warfarinu, neutrální byl vliv podávání ACE-I, BB a statinů a příznivý vliv na snížení mortality vykazovaly pouze Ca blokátory (ale nikoliv na jiné KV příhody).
Kromě klasické HD se začínají i u nás, zvláště na odděleních intenzivní péče pro nemocné s renálním selháním, používat přístroje pracující na podkladě kontinuálních hemoeliminačních metod (CRRT – continuous renal replacement therapy) [61]. Liší se především kontinuální nízkotlakou eliminací a používáním speciálních filtrů. Jsou velmi výhodné tam, kde dochází k retenci tekutin. Jejich velkou předností je, že nemocní, kteří jsou takto léčeni, neopouštějí vlastní intenzivní oddělení (KJ, JIP nebo ARO), což umožňuje podstatně lépe zvládat možné kardiologické komplikace. Proto jsou cenné zvláště u kriticky nemocných pacientů v terénu hemodynamické nestability [62,63].
Ačkoliv doposud nebylo jednoznačně prokázáno snížení mortality ve srovnání s metodou intermitentní HD, umožňují CRRT odstranění většího množství tekutiny v zájmu lepší hemodynamické stability a lepší kontroly vnitřního prostředí [64].
CRRT představuje široké spektrum metod, které se používají kontinuálně po dobu 24 hodin a podporují nebo nahrazují funkce ledvin. Uvádíme je pouze v přehledu, bez podrobnějšího rozboru [65].
- A. Kontinuální arterio-venózní hemofiltrace (CAVH)
- B. Kontinuální veno-venózní hemofiltrace (CVVH)
- C. Pomalá kontinuální ultrafiltrace (slow continuous ultrafiltation - SCUF)
- D. Kontinuální arterio-venózní hemodialýza (CAVHD) a kontinuální veno-venózní hemodialýza (CVVHD)
- E. Kontinuální arterio-venózní hemodiafiltrace (CAVHDF) a kontinuální veno-venózní hemodiafiltrace (CVVHDF)
Mezi kontinuální očišťovací metody, které se dnes užívají nejvíce, patří CVVH, CVVHD, CVVHDF, SCUF a kontinuální HD přes vysoce propustnou membránu, tzv. high-flux dialysis CVVHFD. Od původních arterio-venózních metod (CAVH, CAVHD, CAVHDF) jsme dnes kvůli četným komplikacím a souvisejícím obtížím prakticky upustili.
Principy všech CRRT jsou obdobné. Krev poháněná pumpou proudí přes filtr ze semipermeabilní membrány a během tohoto průchodu jsou látky v ní obsažené odstraňovány buď konvekcí (CVVH), difuzí (CVVHD) či kombinací obou (CVVHDF a částečně i CVVHFD). Difuze se vztahuje na malé molekuly jako urea a ionty, při konvekci jsou malé a střední molekuly mechanizmem solvent drag (tah rozpouštědla) filtrovány přes membránu pomocí filtračního tlaku a odpovídající množství tekutin je nahrazováno ve formě tzv. náhradního roztoku obsahujícího definované množství elektrolytů buď před (prediluce), či za filtr (postdiluce), nebo do obou míst zároveň. Důležitým faktorem je propustnost filtru, kdy v současnosti nejvíce používané jsou tzv. high-flux membrány propouštějící molekuly až do hmotnosti zhruba 30 kDa. To zahrnuje ionty, malé a středně velké molekuly včetně některých zánětlivých mediátorů a léků, při zachování nepropustnosti pro plazmatické bílkoviny a látky na nich navázané. Další možný očišťovací mechanizmus během CRRT je adsorpce na membránu [66].
Podrobnější popis této problematiky přesahuje rozsah tohoto sdělení.
Výhody CRRT ve srovnání s HD
- Kontrola azotemie je velmi dobrá u CRRT, ve srovnání s HD je efektivnější a kontinuální.
- Hemodynamická stabilita je lepší během CRRT.
- Tekutinová bilance je mnohem lépe kontrolovaná při CRRT.
- Při CRRT se snižuje riziko dysekvilibračního syndromu.
- CRRT odstraňuje středně velké molekuly, a proto může mít pozitivní efekt u nemocných v sepsi s multiorgánovým selháním.
Je nutno ovšem vést v patrnosti, že metoda CRRT je pro zdravotnický personál technicky náročnější a je také nákladnější.
Lze jen doporučit, aby se vybavení přístroji umožňujícími CRRT stalo základním běžným vybavením jednotek intenzivní péče včetně KJ a ARO.
Význam stanovení troponinu pro diagnostiku AIM u renální insuficience
Diagnostické potíže vznikají, pokud u nemocných s renálním selháním používáme ke stanovení diagnózy AIM průkaz zvýšené sérové koncentrace troponinů. KV onemocnění jsou zodpovědná přibližně za 50 % úmrtí u pacientů s chronickým selháním ledvin [67] a v této skupině bývá prevalence koronární nemoci vyšší než 70 % [68]. U pacientů se selháním ledvin navíc existuje při akutním koronárním syndromu (AKS) podstatně vyšší riziko němé ischemie a atypických klinických projevů [69,70]. U pacientů s ESRD a s koronární nemocí není často angina pectoris vůbec přítomna; podle jedné studie se vyskytovala pouze u 17 % pacientů [71]. Stejně málo spolehlivý může být EKG-záznam, protože změny ST-segmentu lze často v důsledku hypertrofie levé komory, poruch metabolizmu minerálů, abnormalit ve vedení vzruchů a léků o jen velmi obtížně interpretovat.
Rozsáhlé studie pacientů s AKS prokázaly význam zvýšení kardiálních troponinů I (TnI) a T (TnT) pro přesnou diagnózu, stratifikaci rizika, prognózy a terapeutické využití [72-74] a jsou nyní základem na němž je postavena diagnostika AIM [75-77]. V současnosti již víme, že na rozdíl od vysoké senzitivity troponinů je jejich specifita podstatně nižší.
Zpočátku se na této nižší specifitě podílely i ne zcela dokonalé testy 1. generace, kde zvláště sety určené k detekci TnT reagovaly zkříženě s troponiny kosterních svalů. Ale i když byly tyto testy postupně zdokonaleny až po současnou nejmodernější 3. generaci, byla kromě klasické akutní koronární léze pozitivita troponinu opakovaně zjištěna u celé řady dalších onemocnění, například v některých případech akutní plicní embolie, u myokarditidy, kardiomyopatií, městnavého srdečního selhání, rabdomyolýzy, sepse, výrazné hypertrofie LK srdeční, subarachnoidálního krvácení, eklampsie, amyloidózy, některých agresivních chemoterapií, při kontuzi myokardu, disekci vzestupné aorty i u dermatomyozitidy a polymyozitidy a dalších nemocí [78-83]. Pacienti s RI v této skupině významný podíl.
Při použití těchto nejnovějších testů je u pacientů se selháním ledvin srdeční TnT zvýšen častěji než TnI. Tato nižší incidence zvýšeného TnI a chybějící exprese srdečního TnI v nekardiálních tkáních [84-86], ukazuje na to, že TnI je u pacientů se selháním ledvin specifičtějším diagnostickým a prognostickým markrem ischemické choroby srdeční [87-89]. Zvláště je to zdůrazňováno u nemocných po transplantaci ledvin [90].
Je několik teorií, čím je toto zvýšení troponinů u nemocných s CRI bez akutní léze způsobeno [91]. Dnes je již méně přijímána teorie jejich snížené clearence, větší pozornost se nyní soustřeďuje na remodelaci myokardu, uremickou perimyokarditidu i relativně častý současný výskyt srdečního selhání. I když zatím není definitivní shoda ohledně mechanizmu zvýšených koncentrací troponinů v séru u pacientů se sníženou funkcí ledvin, ukazují údaje z menších skupin pacientů se selháním ledvin, že elevace troponinu jsou spojeny s dalším rizikem, a to včetně zvýšené KV i celkové mortality [92-101].
Platí to nejen pro nemocné s terminálním renálním selháním (stadium 5), ale i pro nemocné ve stadiu 3. a 4. stupně [101].
Zjištění přesného mechanizmu projevujícího se trvale zvýšenými hladinami troponinu v séru u asymptomatických pacientů s chronickým selháním ledvin si vyžádá další studie.
Negativní predikční hodnota troponinu v této populaci je naopak velmi užitečná.
Daleko méně je obecně známo, že dialýza přímo ovlivňuje sérové koncentrace TnT a TnI různě. Bez ohledu na formu clearence nebo typ použité membrány je koncentrace TnI po HD nižší téměř o 90 % vůči výchozímu stavu [102]. Průměrná hodnota TnT po HD se ale zvyšuje [96] a procento pacientů se zvýšenými troponiny bylo po HD vyšší v důsledku hemokoncentrace. I když by membrány použité v jejich studii měly propustit pouze molekuly s maximální hmotností menší než intaktní TnT nebo TnI, domnívají se někteří autoři, že se TnI může adsorbovat na dialyzační membránu díky své hydrofobitě. Několik prací tyto nálezy potvrdilo [104,105], zatímco jiné je popírají [105]. Neznalost dynamiky troponinů způsobené HD tak může vést k stanovení falešné diagnózy AIM.
Lze shrnout, že pouhé zvýšení sérové koncentrace troponinů u nemocných s chronickým selháváním ledvin (CRI) i při použití nejmodernějších diagnostických setů, nelze bez výrazné typické dynamiky považovat za průkaz akutní koronární léze. Stanovení diagnózy ztěžuje skutečnost, že u nemocných s pokročilým CRI je vysoký výskyt němé ischemie i asymptomatického AIM. Při stanovení troponinů u CRI je zapotřebí dát přednost TnI, který se jeví jako specifičtější než TnT pro diagnostiku akutní ischemie i pro prognózu nemocných. I když tedy zvýšení troponinů u nemocných s CRI neznamená jasnou koronární lézi, je ukazatelem nepříznivé prognózy včetně zvýšené celkové i KV mortality.
Zvýšené hodnoty je nutno zvláště pečlivě interpretovat u hemodialyzovaných nemocných. Hemodialýza výrazně ovlivňuje koncentrace jak TnI (snížení), tak TnT (zvýšení), a může tedy imitovat typickou dynamiku při AIM. Negativní prediktivní hodnota troponinu u nemocných s CRI je diagnosticky i prognosticky velmi užitečná.
Závěr
Nemocní s AIM a IR představují i dnes, v době rozvinuté farmakoterapie AKS i nejmodernějších invazivních metod, stále závažný terapeutický problém. Jejich mortalita je stále vysoká, postrádáme především rozsáhlejší randomizované studie věnované této problematice. To však nemůže být důvodem k terapeutickému nihilizmu, který se kromě odmítání intervenčních a revaskularizačních postupů projevuje i nedostatečnou standardní kardioprotektivní léčbou spočívající v podávání ASA, BB a statinů, u lehčích a středně těžkých RI i ACE-I. Intervenční diagnostické a léčebné metody včetně přímé PCI jsou spojeny s rizikem kontrastní nefropatie, která vystavuje nemocné zvýšené mortalitě i nebezpečí závažných komplikací, proto je její komplexní prevence nedílnou součásti takové léčby. Cenným doplňkem léčby pro nemocné s těžším stupněm RI jsou moderní hemoeliminační metody, které by se měly stát nedílnou součásti vybavení KJ a JIP. Pozitivita troponinu u nemocných s chronickou RI představuje zajímavý diagnostický problém ve smyslu možné falešné diagnózy AIM a s touto perspektivou by měla být i tak posuzována. Důležité je, že i neischemická pozitivita troponinu u RI je významným negativním prognostickým faktorem.
Děkuji Daně Bábkové za neocenitelnou pomoc při přípravě a zpracování textu této práce.
doc. MUDr. Stanislav Janoušek, CSc.
Interní
kardiologická klinika, FN Brno, pracoviště
Bohunice
stanislavjanousek@hotmail.com
Sources
1. National Kidney Foundation. Clinical Practice guidelines for chronic kidney disease: Evaluation, classification, and stratification. Am J Kidney Dis 2002; 2(Suppl 1): 1-266.
2. Berger AK, Duval S, Krumholz HM. Aspirin, beta-blocker, angiotensin-converting enzyme inhibitor therapy in patients with end-stage renal diseases and an acute myocardial infarction. J Am Coll Cardiol 2003; 42 : 201-208.
3. Rudnick MR, Berns JS, Cohen RM et al. Nephrotoxic risks of renal angiography: Contrast-media associated nephrotoxicity and atheroembolism A critical review. Am J Kidney Dis 1994; 24 : 713-727.
4. Barrett BJ. Contrast nephrotoxicity. J Am Soc Nephrol 1994; 5 : 125-137.
5. Yoshioka, T, Fogo, A, Beckman, JK. Reduced activity of antioxidant enzymes underlies contrast media-induced renal injury in volume depletion. Kidney Int 1992; 41 : 1008-1015.
6. Agmon Y, Peleg H, Greenfield Z et al. Nitric oxide and prostanoids protect the renal outer medulla from radiocontrast toxicity in the rat. J Clin Invest 1994; 94 : 1069-1075.
7. Kramer BK, Kammerl M, Scheda F et al. A primer in radiocontrast-induced nephropathy. Nephrol Dial Transplant 1999; 14 : 2830-2834.
8. Heyman SN, Rosen S. Dye-induced nephropathy. Semin Nephrol 2003; 23 : 477-485.
9. Lacová K. Kontrastová nefropatie dnes (fenoldapam neuspěl ve studii CONTRAST). Interv Akut Kardiol 2005; 4 : 33-37.
10. Zahálková J. Kontrastová nefropatie. Intern Med pro Praxi 2005; 7 : 24-26.
11 Pannu N, Wiebe N, Tonelli M. Prophylxis Strategies for Contrast-Induced Nephropathy JAMA 2006; 295 : 2765-2779.
12. Aspelin P, Aubry P, Fransson SG et al. Nephrotoxic effects in high-risk patients undergoing angiography. N Engl J Med 2003; 348 : 491-499.
13. Sandler CM. Contrast-agent-induced acute renal dysfunction---is iodixanol the answer? N Engl J Med 2003; 348 : 551-553.
14. Rudnick MR, Goldfarb S, Wexler L et al. Nephrotoxicity of ionic and nonionic contrast media in 1196 patients: A randomized trial. Kidney Int 1995; 47 : 254-261.
15. Barrett BJ, Parfrey PS, Vavasour HM et al. Contrast nephropathy in patients with impaired renal function: High versus low osmolar media. Kidney Int 1992; 41 : 1274-1279.
16. Harris KG, Smith TP, Cragg AH et al. Nephrotoxicity from contrast material in renal insufficiency: Ionic versus nonionic agents. Radiology 1991; 179 : 849-852.
17. Barrett BJ, Carlisle EJ. Metaanalysis of the relative nephrotoxicity of high - and low-osmolality iodinated contrast media. Radiology 1993; 188 : 171-178.
18. Chalmers N, Jackson RW. Comparison of iodixanol and iohexol in renal impairment. Br J Radiol 1999; 72 : 701-703.
19. Conlon PJ, Schwab SJ. Time to abandon nonionic contrast? J Am Soc Nephrol 1994; 5 : 123-124.
20. Carraro M, Malalan F, Antonione, R et al. Effects of a dimeric vs a monomeric nonionic contrast medium on renal function in patients with mild to moderate renal insufficiency: a double-blind, randomized clinical trial. Eur Radiol 1998; 8 : 144-147.
21. Jakobsen JA, Berg KJ, Kjaersgaard, P et al. Angiography with nonionic X-ray contrast media in severe chronic renal failure: renal function and contrast retention. Nephron 1996; 73 : 549-556.
22. Cigarroa RG, Lange RA, Williams RH et al. Dosing of contrast material to prevent contrast nephropathy in patients with renal disease. Am J Med 1989; 86 : 649-652.
23. Lautin EM, Freeman NJ, Schoenfeld AH et al. Radiocontrast-associated renal dysfunction: Incidence and risk factors. AJR Am J Roentgenol 1991; 157 : 49-58.
24. Manske CL, Sprafka JM, Strong JH et al. Contrast nephropathy in azotemic diabetic patients undergoing coronary angiography. Am J Med 1990; 89 : 615-620.
25 Keeley EC, Grines CL. Scraping of aortic debris by coronary guiding catheters: A prospective evaluation of 1,000; cases. J Am Coll Cardiol 1998; 32 : 1861-1865.
26. McCullough PA, Sandberg KR, Borzak S et al. Benefits of aspirin and beta-blockade after myocardial infarction in patients with chronic kidney disease. Am Heart J 2002; 144 : 226-232.
27. Kellum JA, Decker JM. Use of dopamine in acute renal failure? A meta-analysis. Crit Care Med 2001; 29 : 1526-1531.
28. Parfrey PS, Griffiths SM, Barrett BJ et al. Contrast material-induced renal failure in patients with diabetes mellitus, renal insufficiency, or both. A prospective controlled study. N Engl J Med 1989; 320 : 143-149.
29. Rudnick MR, Goldfarb S, Wexler L et al. Neprotoxicity of ionic and nonionic contrast media in 1196 patients: a randomized trial: a lohexol Cooperative Study. Kidney Int 1995; 47 : 254-261.
30. McCarthy CS, Becker JA. Multiple myeloma and contrast media. Radiology 1992; 183 : 519-521.
31. Holland MD, Galla JH, Sanders PW et al. Effect of urinary pH and diatrizoate on Bence Jones protein nephrotoxicity in the rat. Kidney Int 1985; 27 : 46-50.
32. Choyke PL, Cady J, De Pollar Sl et al. Determination of serum creatinine prior to iodinat contrast media: is it necessary in all patients? Tech Urol 1998; 4 : 65-69.
33. Stevens MA, Mc Cullogh PA, Tobin KJ et al. A prospective randomised trial of prevention measures in patient high risk for contrast nephropathy: Results of P.R.I.N.C.E
study. Am J Coll Cardiol 1999; 33 : 403-411.
34. Vogt B, Ferrari P, Schonholzer C et al. Prophylactic hemodialysis after radiocontrast media in patient with renal insufficiency is potentially harmful. Am J Med 2001; 111 : 692-698.
35. Marenzi G, Marana I, Lauri G et al. The prevention of radiocontrast-agent-induced nephropathy by hemofiltration. N Engl J Med 2003; 349 : 1333-1340.
36. Vogt B, Ferrari P, Schonholzer C et al. Prophylactic hemodialysis after radiocontrast media in patients with renal insufficiency is potentially harmful. Am J Med 2001; 111 : 692-698.
37. Marenzi G, Marana I, Lauri G et al. The prevention of radiocontrast-agent-induced nephopathy by hemofiltratioin. N Engl J Med. 2003; 349 : 1333-1340.
38. Shammas KW, Kapalis MJ, Harris M. Aminophylline does not protect against radiocontrast nephropathy in patients undergoing percutaneous angiographic procedures. J Invasive Cardiol 2001; 13 : 735-740.
39. Gami AS, Garovic VD. Contrast Nephropathy After Coronary Angiography. Mayo Clin Proc 2004; 79 : 211-219.
40. Louis BM, Hoch BS, Hernandes C et al. Protection from the nephrotoxicity if contrast dye. Ren Fail 1996; 18 : 639-646.
41. Barrett BJ, Parfrey PS. Prevention of nephrotoxicity induced by radiocontrast agents N Engl J Med 1994; 331 : 1449-1450.
42. Keumaeyr HH, Junge W, Kufner A et al. Prevention of radiocontrast-media-induced nephrotoxicity by the calcium channel blocker nitrendipine. Nephrol Dial Transplant 1989; 4 : 1030-1036.
43. Koch JA, Plum J, Granbensee B et al. Prostaglandin E: a new agent for the prevention of renal dysfunction in high risk patients caused by radiocontrast media. Nephrol Dial Transpl 2000; 15 : 43-49.
44. Stone GW, McCullogh PA, Tumlin JA et al. Fenoldapam mesylate for the prevention of contrast-induced nephropathy: a randomised controlled trial. JAMA 2003; 290 : 2284-2291.
45. Mueller C, Buerkle, G, Buettner, HJ et al. Prevention of contrast media-associated nephropathy: randomized comparison of 2 hydration regimens in 1620 patients undergoing coronary angioplasty. Arch Intern Med 2002; 162 : 329-336.
46. Merten GJ, Burgess WP, Gray LV et al. Prevention of contrast-induced nephropathy with sodium bicarbonate: a randomized controlled trial. JAMA 2004; 291 : 2328-2334.
47. Tepel M, van der Giet M, Schwarzfield C et al. Prevention of radiographic-contrast-agent-induced reductions in renal function by acetylcysteine. N Engl J Med 2000; 343 : 180-184.
48. Diaz-Sandoval LJ, Kosowsky BD, Losordo DW. Acetylcysteine to prevent angiography-related renal tissue injury (the APART trial). Am J Cardiol 2002; 89 : 356-358.
49. Shyu KG, Cheng JJ, Kuan P. Acetylcysteine protects against acute renal damage in patients with abnormal renal function undergoing a coronary procedure. J Am Coll Cardiol 2002; 40 : 1383-1388.
50. Kay J, Chow WH, Chan TM et al. Acetylcysteine for prevention of acute deterioration of renal function following elective coronary angiography and intervention: A randomized controlled trial. JAMA 2003; 289 : 553-558.
51. Durham JD, Caputo C, Dokko J et al. A randomized controlled trial of N-acetylcysteine to prevent contrast nephropathy in cardiac angiography. Kidney Int 2002; 62 : 2202-2207.
52. Briguori C, Manganelli F, Scarpato P et al. Acetylcysteine and contrast agent-associated nephrotoxicity. J Am Coll Cardiol 2002; 40 : 298-303.
53. Allaqaband S, Tumuluri R, Malik AM et al. Prospective randomized study of N-acetylcysteine, fenoldopam, and saline for prevention of radiocontrast-induced nephropathy. Catheter Cardiovasc Interv 2002; 57 : 279-283.
54. Loutrianakis E, Stella D, Hussain A et al. Randomized comparison of fenoldopam and N-acetylcysteine to saline in the prevention of radiocontrast nephropathy. J Am Coll Cardiol 2003; 41 : 327A.
55. Baker CS, Wragg A, Kumar S et al. A rapid protocol for the prevention of contrast-induced renal dysfunction (RAPPID Study). J Am Coll Cardiol 2003; 41 : 39A.
56. Goldenberg I, Jonas M, Matetzki S et al. Contrast-associated nephropathy and clinical outcome of patients with chronic renal insufficiency undergoing cardiac catheterization: Lack of additive benefit of acetylcysteine to saline infusion. J Am Coll Cardiol 2003; 41 : 537A.
57. Tepel M, van der Giet M, Statz M et al. The antioxidant acetylcysteine, reduces cardiovascular events in patients with endstage renal failure - a randomized controlled trial. Circulation 2003; 107 : 992-995.
58. Marenzi G, Assanelli E, Marana I et al. N-acetylcysteine and contrast - induced nephropathy in primary angioplasty. N Engl J Med 2006; 354 : 2773-2782.
59 Stone GW, Tumlin JA, Madyoon H et al. Design and rationale of CONTRAST-A prospective, randomized, placebo-controlled trial of fenoldopam mesylate for the prevention of radiocontrast nephropathy. Rev Cardiovasc Med 2001; 2(Suppl 1): 31-36.
60. Ishani A, Herzog CHA, Collins AJ et al. Cardiac medications and their association with cardiovascular events in incident dialysis patients: Cause or effect? Kidney Intern 2004; 65 : 1017-1025.
61. Lachmanová J. Očišťovací metody krve. Praha: Grada Publishing 1999.
62. Ronco C, Bellomo R, Kellum JA. Continuous Renal Replacement Therapy: Opinions and Evidence. Adv Ren Replace Ther 2002; 9 : 229-244.
63. Silvestr W. Outcome studies of continuous renal replacement therapy in the intensive care. Kidney Int 1998; 53 : 138-141.
64. Ronco C, Brendolan A, Lupi A et al. Effects of different doses in continuous venovenous hemofiltration on outcomes of acute renal failure: A prospective randomised trial. Lancet 2000; 356 : 26-30.
65. Novák I. Manuál CRRT. Plzeň: EU PRESS 2000 s.r.o 2003.
66. Bellomo R, Baldwin I, Ronco C et al. Atlas of Hemofiltration. Philadelpiha: Saunders 2002 : 15-18.
67.Wolfe RA, Port FK, Webb RL et al. Annual data report of the United States renal data system. VI. Causes of death. Am J Kidney Dis 1998 : 32 Suppl: S81-S88.
68. Joki N, Hase H, Nakamura R et al. Onset of coronary artery disease prior to initiation of haemodialysis in patients with end-stage renal disease. Nephrol Dial Transplant 1997; 12 : 718-723.
69. Aronow WS, Ahn C, Mercando AD et al. Prevalence of coronary artery disease, complex ventricular arrhythmias, and silent myocardial ischemia and incidence of new coronary artery events in older persons with chronic renal insufficiency and with normal renal function. Am J Cardiol 2000; 86 : 1142-1143.
70. Nakamura S, Uzu T, Inenaga T et al. Prediction of coronary artery disease and cardiac events using electrocardiographic changes during hemodialysis. Am J Kid Dis 2000; 36 : 592-599.
71. Zawada ET, Stinson JB, Done G. New perspectives on coronary artery disease in hemodialysis patients. South Med J 1982; 75 : 694-696.
72. Antman EM, Tanasijevic MJ, Thompson B et al. Cardiac-specific troponin-I levels to predict the risk of mortality in patients with acute coronary syndromes. N Engl J Med 1996; 335 : 1342-1349.
73. Ohman EM, Armstrong PW, Christenson RH et al. Cardiac troponin-T levels for risk stratification in acute myocardial ischemia. N Engl J Med 1996; 335 : 1333-1341.
74. Hamm CW, Heeschen C, Goldmann B et al. Benefit of abciximab in patients with refractory unstable angina in relation to serum troponin T levels. N Engl J Med 1999; 340 : 1623-1629.
75. The Joint European Society of Cardiology/American College of Cardiology Committee. Myocardial infarction redefined - A consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. Eur Heart J 2000; 21 : 1502-1513.
76. Galvani M, Panteghini M, Ottani F et al. The new definition of myocardial infarction: analysis of the ESC/ACC Consensus Document and reflections on its applicability to the Italian Health System. Ital Heart J 2002; 3 : 543-557.
77. Babuin L. Jaffe AS. Troponin: the biomarker of choice for the detection of cardiac injury. Can Med Assoc J 2005; 173 : 1191-1202.
78. Maeder M, Fehr T, Rickli H et al. Sepsis-associated myocardial dysfunction: diagnostic and prognostic impact of cardiac troponins and natriuretic peptides. Chest 2006; 129 : 1349-1366.
79. Kato T, Sato Y, Nagao K et al. Serum cardiac troponin T in cardiac amyloidosis: serial observations in five patients. Tohoku J Exp Med 2006; 208 : 163-167.
80. Khan IA. Wattanasuwan N. Role of biochemical markers in diagnosis of myocardial infarction. Int J Cardiol 2005; 104 : 238-240.
81. Hamilton JS. Sharpe PC. Two cases of inflammatory muscle disease presenting with raised serum concentrations of troponin T. J Clin Pathol. 2005; 58 : 1323-1324.
82. Bonnefoy E, Godon P, Kirkorian G et al. Significance of serum troponin I elevation in patients with acute aortic dissection of the ascending aorta. Acta Cardiol 2005; 60 : 165-170.
83. Jeremias A, Gibson CM. Narrative review: alternative causes for elevated cardiac troponin levels when acute coronary syndromes are excluded. Ann Intern Med 2005; 142 : 786-791.
84. McLaurin MD, Apple FS, Voss EM et al. Cardiac troponin-I, cardiac troponin-T, and creatine kinase MB in dialysis patients without ischemic heart disease: evidence of cardiac troponin-T expression in skeletal muscle. Clin Chem 1997; 43 : 976-982.
85. Ricchiutti V, Apple FS. RNA expression of cardiac troponin T isoforms in diseased human skeletal muscle. Clin Chem 1999; 45 : 2129-2135.
86. Bodor GS, Porterfield D, Voss EM et al. Cardiac troponin-I is not expressed in fetal and healthy or diseased adult human skeletal muscle tissue. Clin Chem 1995; 41 : 1710-1715.
87. Martin GS, Becker BN, Schulman G. Cardiac troponin-I accurately predicts myocardial injury in renal failure. Nephrol Dial Transplant 1998; 13 : 1709-1712.
88. Apple FS, Sharkey SW, Hoeft P et al. Prognostic value of serum cardiac troponin I and T in chronic dialysis patients: a 1-year outcomes analysis. Am J Kid Dis 1997; 29 : 399-403.
89. McLaurin MD, Apple FS, Falahati A et al. Cardiac troponin I and creatine kinase-MB mass to rule out myocardial injury in hospitalized patients with renal insufficiency. Am J Cardiol 1998; 82 : 973-975.
90. Bozbas H. Yildirir A. Muderrisoglu H. Cardiac enzymes, renal failure and renal transplantation. Clin Med Res 2006; 4 : 79-84.
91. Hojs R. Cardiac troponin T in patients with kidney disease. Ther Apher Dial 2005; 9 : 205-207.
92. Havekes B. van Manen JG. Krediet RT et al. NECOSAD Study Group. Serum troponin T concentration as a predictor of mortality in hemodialysis and peritoneal dialysis patients. Am J Kidney Dis 2006; 47 : 823-829.
93. Sharma R, Gaze DC, Pellerin D et al. Cardiac structural and functional abnormalities in end stage renal disease patients with elevated cardiac troponin T. Heart 2006; 92 : 804-809.
94. Fernandez-Reyes MJ, Heras M, Sanchez R et al. Value of troponin T in patients with advanced chronic kidney failure. Clinical course after beginning hemodialysis. [Spanish] Nefrologia 2005; 25 : 574-575.
95. Buhaescu I, Izzedine H, Covic A. Cardiac troponins in renal failure - time for an optimistic consensus? Int J Clin Pract 2005; 59 : 1317-1325.
96. Conway B, McLaughlin M, Sharpe P et al. Use of cardiac troponin T in diagnosis and prognosis of cardiac events in patients on chronic haemodialysis. Nephrol Dial Transplant 2005; 20 : 2759-2764.
97. Abbas NA, John RI, Webb MC et al. Cardiac troponins and renal function in nondialysis patients with chronic kidney disease. Clin Chem 2005; 51 : 2059-2066.
98. Kontos MC, Garg R, Anderson FP et al. Outcomes in patients admitted for chest pain with renal failure and troponin I elevations. Am Heart J 2005; 150 : 674-680.
99. Han JH, Lindsell CJ, Ryan RJ et al. Changes in cardiac troponin T measurements are associated with adverse cardiac events in patients with chronic kidney disease. Am J Emerg Med; 23 : 468-473.
100. Hojs R, Ekart R, Hojs et al. Cardiac troponin T (cTnT) in hemodialysis patients with asymptomatic and symptomatic atherosclerosis. Arch Med Res; 2005; 36 : 367-371.
101. Goicoechea M, de Vinuesa SG, Gomez-Campdera F et al. Predictive cardiovascular risk factors in patients with chronic kidney disease (CKD). Kidney Int Suppl 2005; 93(Suppl): 35-38.
102. Wayand D, Baum H, Schatzle G et al. Cardiac troponin T and I in end-stage renal failure. Clin Chem 2000; 46 : 1345-1350.
103. Ooi DS, House AA. Cardiac troponin T in hemodialyzed patients. Clin Chem 1998; 44 : 1410-1416.
104. Porter GA, Norton T, Bennett WM. Long term follow up of the utility of troponin T to assess cardiac risk in stable chronic hemodialysis patients. Clin Lab 2000; 46 : 469-476.
105. Mockel M, Schindler R, Knorr L et al. Prognostic value of cardiac troponin T and I elevations in renal disease patients without acute coronary syndromes: a 9-month outcome analysis. Nephrol Dial Transplant 1999; 14 : 1489-1495.
106. Janoušek S. Akutní infarkt myokardu u nemocných s renálním selháním I: prognóza a léčba. Kardiol Rev 2007; 1 : 13-21.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2007 Issue 2
-
All articles in this issue
- Význam echokardiografie pro implantaci biventrikulárního stimulátoru u nemocných se srdečním selháním
- Infarkt myokardu u starších pacientů
- Vstupní hladiny sérové glykemie jako rizikový faktor u pacientů s akutním infarktem myokardu
- Akutní koronární syndromy - terapie hyperglykemie
- Fixní kombinace ezetimibu a simvastatinu (Inegy) v léčbě hypercholesterolemie / kombinace nebo monoterapie?
- Duální antiagregační terapie v prevenci mozkového infarktu
- Akutní infarkt myokardu u nemocných s renálním selháním II: Kontrastová nefropatie, moderní eliminační léčebné metody, význam stanovení troponinu
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Duální antiagregační terapie v prevenci mozkového infarktu
- Akutní koronární syndromy - terapie hyperglykemie
- Infarkt myokardu u starších pacientů
- Akutní infarkt myokardu u nemocných s renálním selháním II: Kontrastová nefropatie, moderní eliminační léčebné metody, význam stanovení troponinu
