Komentovaná zkrácená verze evropských doporučení pro diagnostiku a management akutní plicní embolie z roku 2014
Commented abbreviated 2014 version of ESC guidelines on the diagnosis and management of acute pulmonary embolism
The major innovation of the current European guidelines on the diagnosis and management of acute pulmonary embolism is a new risk stratification, where the most contentious medium risk category was cancelled. According to the size of the right ventricle, function of the right ventricle and the troponin level in this group of patients has now been categorised into the groups with either high risk or low risk. According to this new categorisation, specified diagnostic methods and advanced treatment are presented, including new oral anticoagulants, thrombolysis and embolectomy. The guidelines also update the issues of pulmonary embolism in pregnancy and in connection with cancer.
Keywords:
pulmonary embolism – risk stratification – diagnostic principles – therapeutic strategies
Authors:
P. Heinc; F. Kováčik; J. Látal; J. Přeček; A. Smékal; L. Rec
Authors‘ workplace:
I. interní klinika – kardiologická LF UP a FN Olomouc
Published in:
Kardiol Rev Int Med 2015, 17(3): 234-244
Category:
Cardiology Review
Overview
Zásadní novinkou současných evropských doporučení pro diagnostiku a léčbu akutní plicní embolie je nová stratifikace rizika, kde vymizela původní nejrozporuplnější kategorie středního rizika. Pacienti z této skupiny jsou dle rozměru pravé komory, funkce pravé komory a hladiny troponinu nově kategorizováni do skupiny s vysokým nebo nízkým rizikem. Dle této nové kategorizace je zde specifikována diagnostika i moderní léčba, včetně nových perorálních antikoagulancií, trombolýzy i embolektomie. Je zde zásadně aktualizována problematika plicní embolie v těhotenství a plicní embolie v koincidenci s nádorovým onemocněním.
Klíčová slova:
plicní embolie – stratifikace rizika – diagnostické principy – léčebné strategie
Úvod
Nová evropská doporučení byla publikována v srpnu 2014 (European Heart Journal) a důvodem jejich inovace byla potřeba klinické aplikace nových poznatků, které optimalizují diagnostiku a na základě přesnější stratifikace optimalizují také léčbu akutní plicní embolie (PE). Vzhledem k tomu, že tato nová doporučení jsou příliš podrobná a obsáhlá, komentovaná zkrácená verze, kterou nabízí náš časopis, by měla sloužit hlavně k rychlé orientaci praktické obce lékařů.
Význam epidemiologie a patofyziologie pro nové klasifikace a stratifikace akutní plicní embolie
Hluboká žilní trombóza (HŽT) a PE jsou třetím nejčastějším kardiovaskulárním (KV) onemocněním s roční incidencí 100 – 200/ 100 000 obyvatel a ve vyspělých zemích je PE hlavní příčinou úmrtí matek v souvislosti s těhotenstvím [1]. Nová evropská doporučení uvádějí celou řadu predisponujících faktorů, které rozděluje na silné, střední a slabé. Ke stanovení závažnosti PE je třeba znát patofyziologii. Akutní PE má vliv jak na oběh, tak i na výměnu plynů. Selhání pravé komory (PK) způsobené tlakovým přetížením je považováno za primární příčinu úmrtí při závažné PE. Tlak v plicnici stoupne, pokud se uzavře 30 – 50 % celkové plochy plicního řečiště [2]. Embolizací vyvolaná vazokonstrikce přispívá ke zvýšené plicní rezistenci a také k úměrnému snížení arteriální poddajnosti. Náhlé zvýšení plicní cévní rezistence a tlaku v PK zvyšuje napětí v myocytech, což vede k dilataci PK, která pak mění kontraktilní vlastnosti dle Starlingova zákona. Neurohumorální aktivace vede dále k inotropní a chronotropní stimulaci. Tyto kompenzační mechanizmy zvýší tlak v plicnici, čímž zlepší průtok plicním řečištěm, a dočasně tak stabilizují systémový tlak, ale rozsah těchto kompenzací je limitován, jelikož PK není schopna vytvořit střední tlak v plicnici nad 40 mm Hg. Prodloužení pravokomorové kontrakce do časné diastoly levé komory (LK) vede k vyklenování interventrikulárního septa do LK, čímž brání řádnému plnění LK v časné diastole, a to může přispívat k systémové hypotenzi a k hemodynamické nestabilitě [3]. Desynchronizace komorových kontrakcí vede ke vzniku bloku pravého Tawarova raménka. Spojení mezi zvýšenou hladinou biomarkerů myokardiálního postižení a horšími časnými výsledky ukazuje, že pravokomorová ischemie vede k poškození myocytů s další redukcí kontraktility a je patofyziologickou známkou závažnosti akutní PE [4]. Klinická klasifikace závažnosti akutní PE je založena na časné mortalitě vztažené k akutní embolii – buď hospitalizační nebo třicetidenní. Tyto stratifikace/ klasifikace mají vliv a význam pro diagnostické i léčebné strategie, které jsou pak založeny na klinickém stavu pacienta. Podezření na vysoce rizikovou embolizaci je dáno šokovým stavem nebo perzistentní arteriální hypotenzí. Pokud tyto klinické známky nejsou, pak nejde o vysoce rizikovou akutní PE (obr. 1).
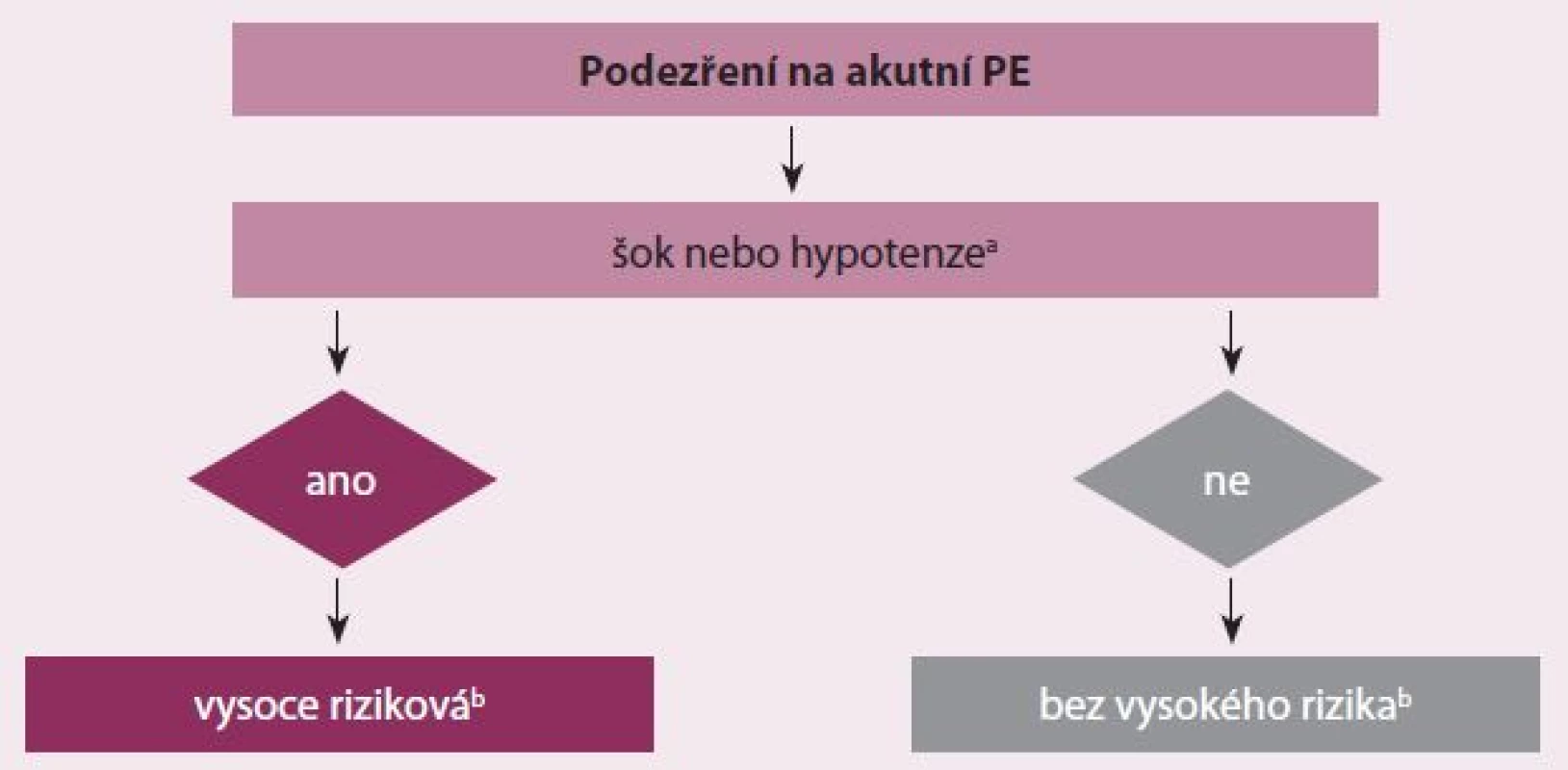
Klinické známky akutní PE
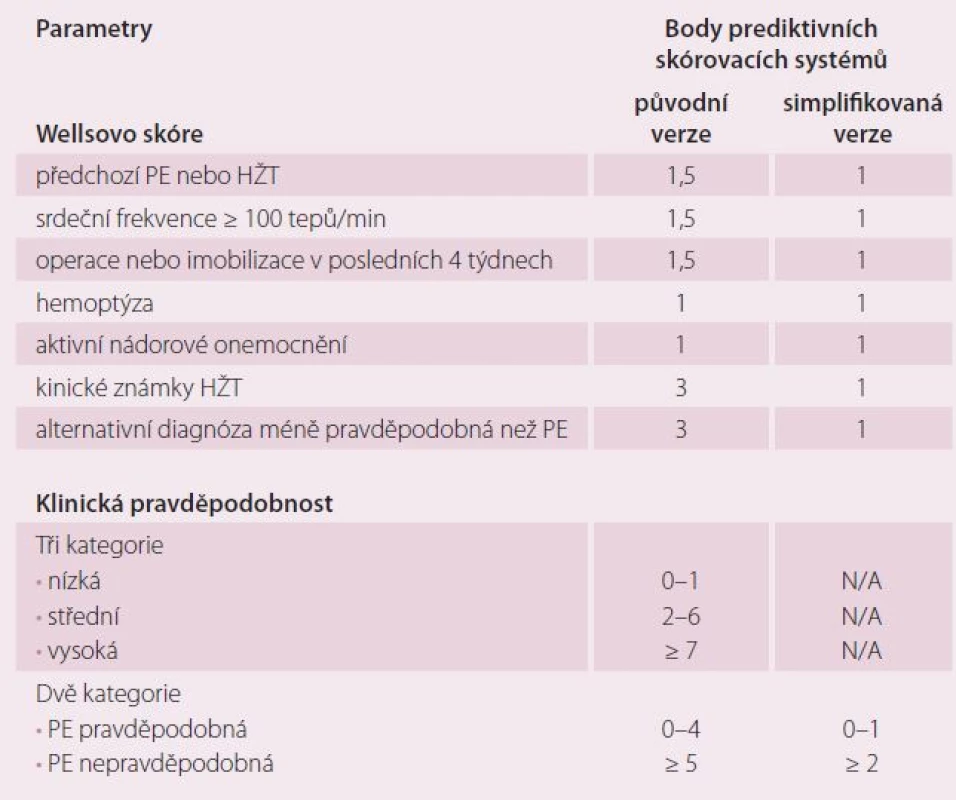
Všeobecně platí, že čím více symptomů je přítomno, tím větší je podezření na akutní PE a tím spíše by měla být provedena specifická vyšetření k potvrzení/ vyloučení akutní PE. K podezření na akutní PE nejčastěji vede symptomatika dušnosti, bolesti na hrudi, synkopy či presynkopy a/ nebo hemoptýza [5]. Doposud se k podezření na akutní PE na základě klinických symptomů používala řada nestandardizovaných schémat, z nichž se v praxi nejvíce používá skórovací systém dle Wellse, včetně jeho zjednodušené verze, kde výsledné rozdělení pravděpodobností ukazuje tab. 1.
Význam jednotlivých vyšetřovacích metod pro diagnostiku PE
D‑dimery
Kvantitativní stanovení D‑dimerů metodou ELISA má diagnostickou senzitivitu 95 % nebo více, a může proto být použito k vyloučení PE u pacientů s nízkou nebo střední pravděpodobností – tříměsíční tromboembolické riziko u neléčených pacientů bylo 1 %. D‑dimery jsou však častěji zvýšeny u starších pacientů, u hospitalizovaných pacientů, u pacientů s neoplazmaty a během těhotenství [6,7].
Počítačová tomografická angiografie (CTA)
Tato metoda se stala metodou volby pro zobrazení plicního cévního řečiště a především u pacientů bez podezření na PE slouží k jejímu definitivnímu vyloučení. Tato metoda umožňuje zobrazení plicního řečiště až na segmentální úroveň [8] a vykazuje senzitivitu 83 % a specificitu 96 % [9]. Pozitivní prediktivní hodnota CTA je vysoká (92 – 96 %) u pacientů se střední či vysokou pravděpodobností akutní PE stanovené na základě klinických příznaků, ale podstatně nižší (58 %) u pacientů s nízkou pravděpodobností akutní PE. Proto bychom měli být velmi opatrní v případech, kdy není soulad klinického hodnocení a CTA.
Scintigrafie plic
Kombinovaná (ventilačně perfuzní) scintigrafie je bezpečná diagnostická metoda při podezření na PE.
Pozitivní nález slouží k potvrzení PE s vysokou pravděpodobností, normální nález perfuze PE vylučuje [10]. Jde o radiačně i kontrastně šetrné vyšetření, které se preferenčně doporučuje ambulantním pacientům s nízkým klinickým podezřením na PE při normálním RTG plic, u mladých pacientů (především u žen), u pacientů s anafylaktickou reakcí na kontrastní látku v anamnéze, polyvalentních alergiků, při renální insuficienci a u pacientů s myelomem a paraproteinemií.
Plicní angiografie
Plicní angiografie byla po desetiletí zlatou diagnostickou standardou akutní PE. Tato metoda však nebyla bez rizika (mortalita 0,5 %, nefatální velké komplikace 1 %, malé komplikace 5 %) [11]. Dnes je vytlačena méně invazivní CTA, která nabízí podobnou diagnostickou přesnost [12]. Plicní angiografie se stále častěji používá jako zobrazovací metoda při katetrovém řešení akutní PE. Digitální subtrakční angiografie (DSA) vyžaduje proti CTA méně kontrastní látky, má výbornou kvalitu zobrazení při zadrženém dechu, ale je méně výtěžná pro zobrazení hlavních plicních arterií při pohybu hrudníku (artefakty při dýchacích pohybech).
Magnetická rezonance
Tato metoda není zatím v klinické praxi využívána především pro malou senzitivitu, velký podíl nepřesvědčivých scanů a nízkou dostupnost na urgentních příjmech.
Echokardiografie
Známky pravokomorového tlakového přetížení a dysfunkce PK v důsledku akutní PE mohou být detekovány echokardiograficky. S ohledem na zvláštní geometrii PK neexistuje individuální echokardiografický parametr, který by poskytoval rychlou a spolehlivou informaci o velikosti a funkci PK. To byl hlavní důvod rozdílných výsledků ve studiích, nicméně negativní prediktivní hodnota 40 – 50 % v těchto studiích určuje, že negativní výsledek nemůže vyloučit akutní PE [13]. Navíc známky pravostranného přetížení můžeme nalézt i u konkomitantních kardiálních či plicních onemocnění v nepřítomnosti akutní PE [14].
Dilatace PK se vyskytuje u nejméně 25 % pacientů s PE a tento parametr je užitečný pro stanovení stratifikačního rizika akutní PE. Echokardiografický nález poškozené funkce PK (snížená ejekční frakce či kontraktilita volné stěny) má vysokou pozitivní prediktivní hodnotu pro PE i v případě přítomnosti koincidujícího kardiorespiračního onemocnění (nutno vyloučit infarkt PK) [15]. Užitečné je změření systolických exkurzí trikuspidálního anulu (tricuspid annulus plane systolic excursion – TAPSE) [16]. Specificita dalších echokardiografických parametrů není optimální k doporučení do rutinní praxe. Echokardiografické vyšetření není doporučováno jako součást diagnostického postupu u hemodynamicky stabilních pacientů s podezřením na akutní PE bez vysokého rizika [13]. V případě podezření na vysoce rizikovou akutní PE, nepřítomnost echokardiografických známek pravokomorového přetížení a dysfunkce PK prakticky vylučuje PE jako příčinu hemodynamické nestability a echokardiografické vyšetření dále v tomto případě slouží k odhalení dalších možných kardiovaskulárních příčin. Na druhou stranu, v případě podezření na vysoce rizikovou akutní PE, kde jsou echokardiografické známky pravokomorového přetížení a dysfunkce PK, je oprávněná indikace emergentní reperfuzní léčby, jestliže bezprostřední CTA není dostupná [17].
Sonografické kompresivní vyšetření žil dolních končetin
Průkaz neúplné kompresibility žil dolních končetin (přítomnost trombu) má vysokou pozitivní prediktivní hodnotu pro PE, přičemž senzitivita tohoto vyšetření je 39 % a specificita 99 %. Vyšetření má význam jen u pacientů bez podezření na vysoce rizikovou embolizaci a nález HŽT u pacientů s podezřením na PE opravňuje k nasazení antikoagulační léčby bez dalšího vyšetřování.
Diagnostické strategie
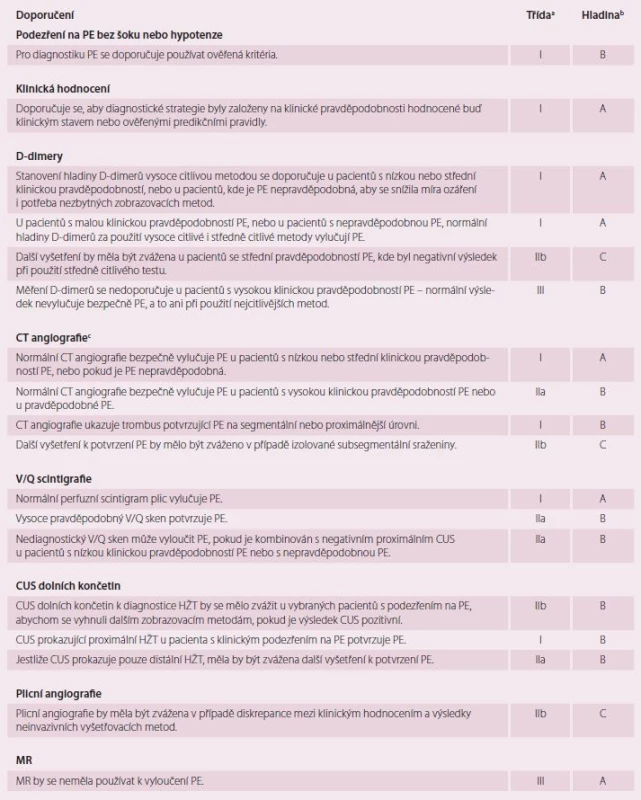
Doposud byla stanovena řada diagnostických postupů při podezření na PE, jejichž přesnost byla testována v zařízeních urgentní medicíny [18]. Nedodržení diagnostických strategií, kde došlo k vysazení antikoagulace, vedlo k signifikantnímu vzestupu tromboembolických příhod ve tříměsíčním sledovacím období. Současné nejpřímější diagnostické algoritmy při podezření na PE s šokem nebo s hypotenzí ukazuje obr. 2 a současné nejpřímější diagnostické algoritmy podezření na PE bez šoku nebo hypotenze ukazuje obr. 3. Tyto diagnostické algoritmy se mohou měnit dle dostupnosti vyšetřovacích metod v jednotlivých nemocnicích i dle specifického klinického stavu. Doporučení pro diagnostiku při podezření na PE s šokem nebo s hypotenzí ukazuje tab. 2 a doporučení pro diagnostiku při podezření na PE bez šoku nebo hypotenze ukazuje tab. 3.
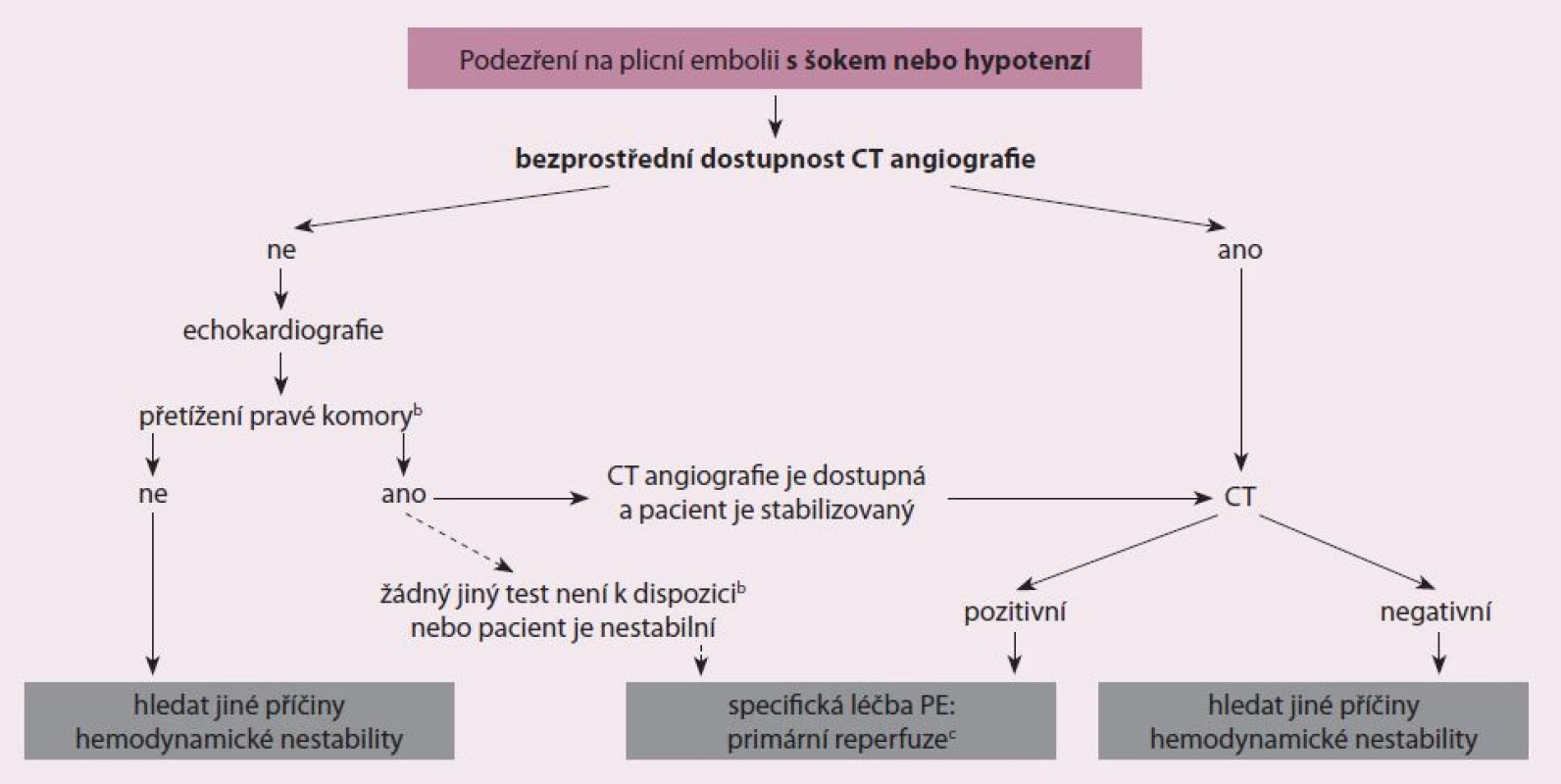
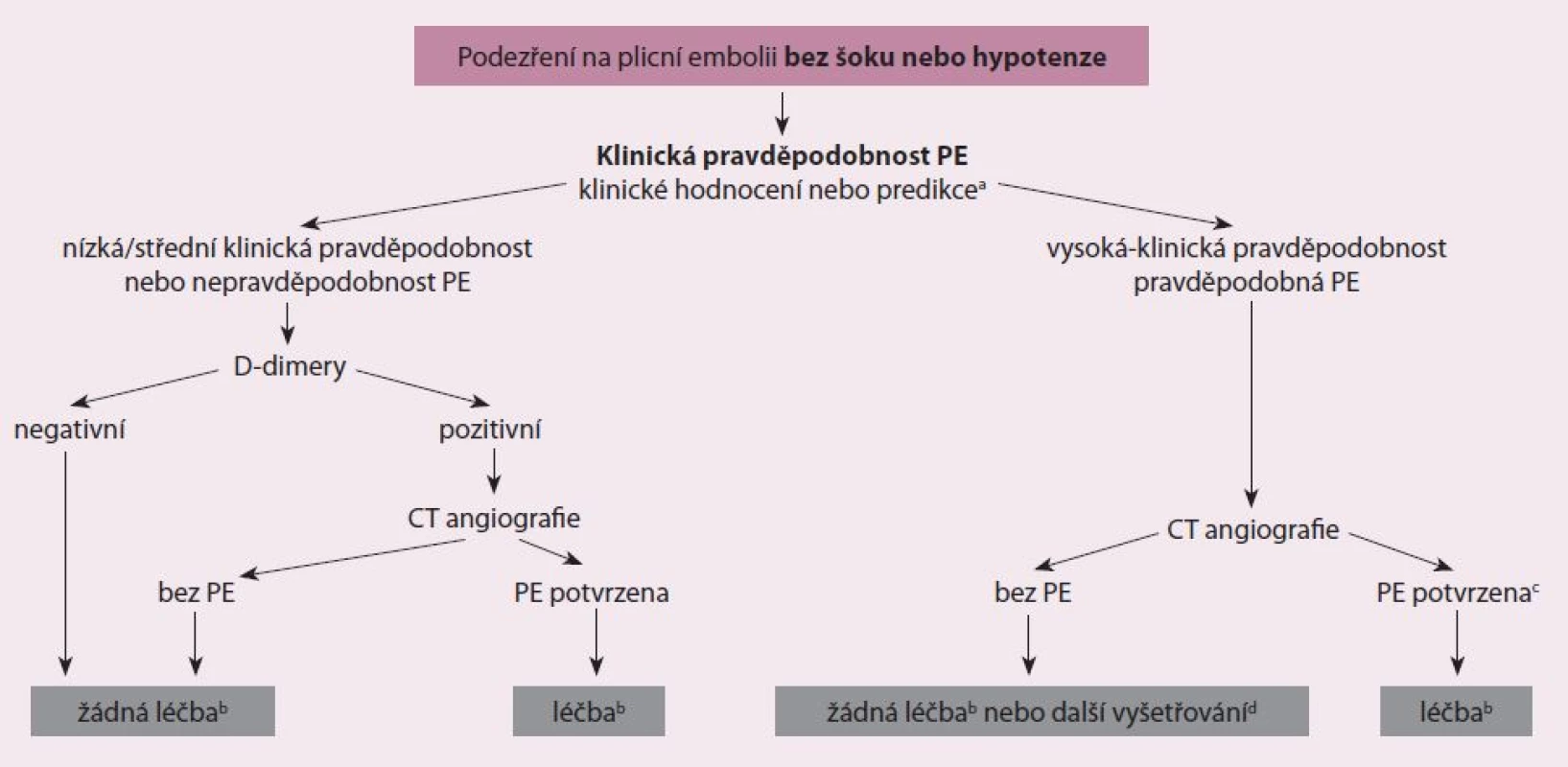

Hodnocení prognózy
Prognostická hodnocení jsou založena na základě klinických parametrů, zobrazovacích metod a laboratorních testů.
Klinické parametry k prognostickému hodnocení
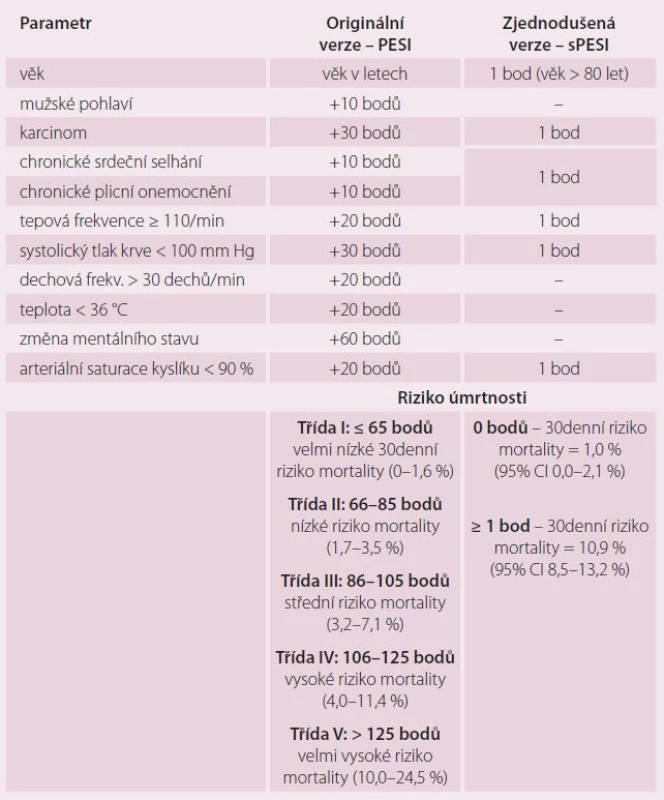
Akutní pravokomorová dysfunkce je stěžejním parametrem, který určuje výsledek akutní PE. Známky akutního pravostranného selhání jako přetrvávající hypotenze a kardiogenní šok ukazují na vysoké riziko časného úmrtí. Synkopa a tachykardie v souvislosti s preexistujícími podmínkami a komorbiditami jsou spojeny s nepříznivou krátkodobou prognózou. Pro dlouhodobější prognostické hodnocení se v praxi nejčastěji používají klinické parametry ve formě tzv. indexu závažnosti plicní embolie (PESI), které ukazuje tab. 4.
Zobrazovací metody k prognostickému hodnocení
Echokardiografické hodnocení morfologie a funkce LK pomáhá při prognostické stratifikaci u hemodynamicky stabilní PE. Echokardiografické parametry, které se používají pro rizikovou stratifikaci PE, zahrnují dilataci PK, což vede ke zvýšenému poměru rozměru PK k LK, hypokinezi volné stěny PK, zvýšené rychlosti proudu při měření trikuspidální regurgitace, zmenšení systolických exkurzí trikuspidálního anulu (TAPSE) nebo ke kombinaci uvedených parametrů. Echokardiograficky zjištěná dysfunkce PK u hemodynamicky stabilních pacientů je spojena se zvýšeným rizikem krátkodobé mortality, nicméně celková pozitivní prediktivní hodnota mortality je nízká [19].
Laboratorní testy k prognostickému hodnocení
Známky pravokomorové dysfunkce
Hemodynamickou závažnost pravokomorové dysfunkce odráží hladina natriuretických peptidů [20].
U normotenzních pacientů s PE je však pozitivní prediktivní hodnota časné mortality u natriuretických peptidů nízká. Za optimální hranici pro identifikaci zvýšeného rizika je považována plazmatická koncentrace NT ‑ proBNP 600 pg/ ml a více [21].
Známky myokardiálního poškození
Myokardiální poškození odráží hladina troponinu. Zvýšené hodnoty troponinu jsou spojeny s horší prognózou a zvýšenou mortalitou.
Význam prognostických strategií
K hodnocení prognózy byly stanoveny různé algoritmy na základě kombinací výše zmíněných parametrů, nicméně jejich významnost pro praxi nebyla objektivně verifikována. Hodnota predikce časné mortality na základě základních parametrů se jevila jako užitečná informace, ale pro praxi bylo podstatně důležitější, že na jejím základě bylo provedeno prognostické hodnocení, které dalo základ pro stanovení optimální léčby. Z uvedených parametrů pro hodnocení prognózy má jedna kombinace zcela zásadní význam pro léčebnou strategii – kombinace pravokomorové dysfunkce (dle echokardiografie či CTA) s pozitivní hodnotou troponinu indikuje podání trombolýzy [22].
Léčba akutní fáze
Hemodynamická a respirační podpora
Jde o vitální léčbu u pacientů s PE a pravokomorovým selháváním. Mírná volumová expanze (500 ml) může zvýšit srdeční index a normalizovat systémový tlak [23]. Agresivní volumová expanze může naopak při větším přetížení PK vést k neúměrnému mechanickému přepětí. V těchto případech jsou vazopresorika nezbytná. Noradrenalin (norepinefrin) dokáže přímým pozitivním inotropním efektem a zvýšenou koronární perfuzí PK zlepšit funkci PK a periferní vazokonstrikcí zvýšit systémový tlak. Dobutamin a/ nebo dopamin se mohou podávat při nízkém srdečním indexu, ale při normálním systémovém tlaku. Hypoxemie a hypokapnie jsou většinou mírné a hypoxemii lze upravit oxygenoterapií. Pokud je třeba mechanické podpory dýchání, pak se musí mít na paměti její nepříznivý hemodynamický efekt v důsledku pozitivního nitrohrudního tlaku, který může redukovat žilní návrat a zhoršit pravokomorové selhání při masivní PE, proto by se mělo opatrně pracovat s nastavením výše tlaku na konci expiria.
Antikoagulace
Parenterální forma
Antikoagulace je indikována k prevenci časného úmrtí a recidiv symptomatické či fatální tromboembolie. V akutní fázi se podává po dobu 5 – 10 dnů parenterální antikoagulační léčba (nefrakcionovaný heparin – UFH, nízkomolekulární heparin – LMWH nebo fondaparinux). Parenterální podání heparinu by se mělo překrývat s inicializací podávání warfarinu nebo dabigatranu/ edoxabanu v případě volby těchto nových antikoagulancií. Pokud se k perorální léčbě použije rivaroxaban nebo apixaban, jejich léčba může být zahájena přímo nebo 1 – 2 dny po zahájení parenterální antikoagulační léčby. Rivaroxaban se podává v akutní fázi ve zvýšené dávce první tři týdny, apixaban sedm dnů. Obecně je dávkování při léčbě akutní PE dáno souhrnem údajů o každém jednotlivém léčivém přípravku (SPC). UFH se doporučuje nasadit při zvažování primární reperfuze, při závažné renální insuficienci (clearance kreatininu < 30 ml/ min) nebo při těžké obezitě. Dávkování UFH se upravuje na základě aktivovaného parciálního tromboplastinového času (aPTT) (tab. 5) [24]. LMWH nevyžaduje rutinní monitorování, ale při těhotenství je vhodné periodické sledování faktoru anti‑Xa [25]. Maximální hodnota faktoru anti‑Xa by měla být měřena 4 hod po poslední aplikaci a průběžná hodnota faktoru anti‑Xa by měla být měřena těsně před aplikací další dávky. Tyto průběžné hodnoty účinné antikoagulace dle faktoru anti‑Xa by měly být v rozmezí 0,6–1,0 IU/ ml pro dávkování 2× denně a 1,0 – 2,0 IU/ ml pro dávkování 1× denně [26].

Perorální forma
Antagonisté vitaminu K – warfarin
Léčba perorálními antikoagulanciemi by měla být zahájena co nejdříve a nejlépe současně s parenterální antikoagulací. Parenterální antikoagulace by měla trvat alespoň pět dnů a až do doby, kdy hladina INR dosáhne hodnot 2,0 – 3,0 při dvou po sobě jdoucích měřeních.
Nová antikoagulancia
Nová antikoagulancia se ukázala jako efektivní a noninferiorní, přitom s menším výskytem velkých krvácivých komplikací proti standardní léčbě LMWH/ warfarin. Proto byla přijata jako adekvátní alternativní medikace ke standardní léčbě akutní PE.
Trombolytická léčba
Trombolytická léčba obnovuje plicní perfuzi podstatně rychleji než antikoagulační léčba samotným UFH. Časné odstranění obstrukce vede k okamžitému snížení rezistence a tlaku v plicnici s doprovodným zlepšením funkce PK [27]. Hemodynamický přínos trombolýzy je omezen jen na prvních pár dnů a nebyl prokázán další přínos po týdenní trombolytické léčbě [28]. Doporučené režimy trombolytické léčby ukazuje tab. 6. V případě streptokinázy a urokinázy jsou preferovány zrychlené režimy s aplikací dávky během 2 hod [29]. Kontraindikace trombolytické léčby ukazuje tab. 7. Infuze UFH by měla být po dobu aplikace streptokinázy a urokinázy zastavena, v případě rtPA (rekombinační aktivátor tkáňového plasminogenu) se infuze UFH zastavovat nemusí. U pacientů, kteří jsou v době podání trombolýzy léčeni LMWH nebo fondaparinuxem, by měla být následná parenterální léčba UFH odložena o 12 hod při režimu LMWH 2× denně a 24 hod při režimu LMWH 1× denně. Vzhledem k tomu, že trombolytická léčba představuje krvácivé riziko, kdy může být potřeba bezprostředního vysazení následné antikoagulační terapie (event. vznikne potřeba antidotové léčby), zdá se optimální po ukončení trombolytické léčby pokračovat několik hodin antikoagulační léčbou UHF a teprve poté pokračovat antikoagulační léčbou LMWH nebo fondaparinuxem. Největší přínos trombolýzy je, pokud je započata do 48 hod po vzniku symptomů, ale může být užitečná i 6 – 14 dnů po vzniku symptomů [30].


Chirurgická embolektomie
Plicní embolektomie je technicky relativně jednoduchý zákrok, proto není třeba tyto pacienty transportovat do speciálních kardiotorakálních center. V současné době je chirurgická embolektomie indikována u vysoce rizikové PE a pro vybrané pacienty se středním rizikem především v případech, kde je kontraindikace trombolýzy nebo tato selhala.
Perkutánní katetrová léčba
Cílem intervenční katetrové léčby je odstranění trombotické obstrukce z hlavní plicní arterie, a tím usnadnění zotavení přetížené PK, zlepšení symptomů a zlepšení přežívání. Je indikována u pacientů s absolutní kontraindikací trombolýzy. Intervence zahrnuje několik možných způsobů. Lze provést rozmělnění trombu a posunutí do periferie, reolytickou trombektomii, sukční trombektomii nebo rotační trombektomii. U pacientů bez absolutní kontraindikace trombolýzy (s relativní kontraindikací) je katetrová léčba často preferovanou alternativou.
Léčebné strategie
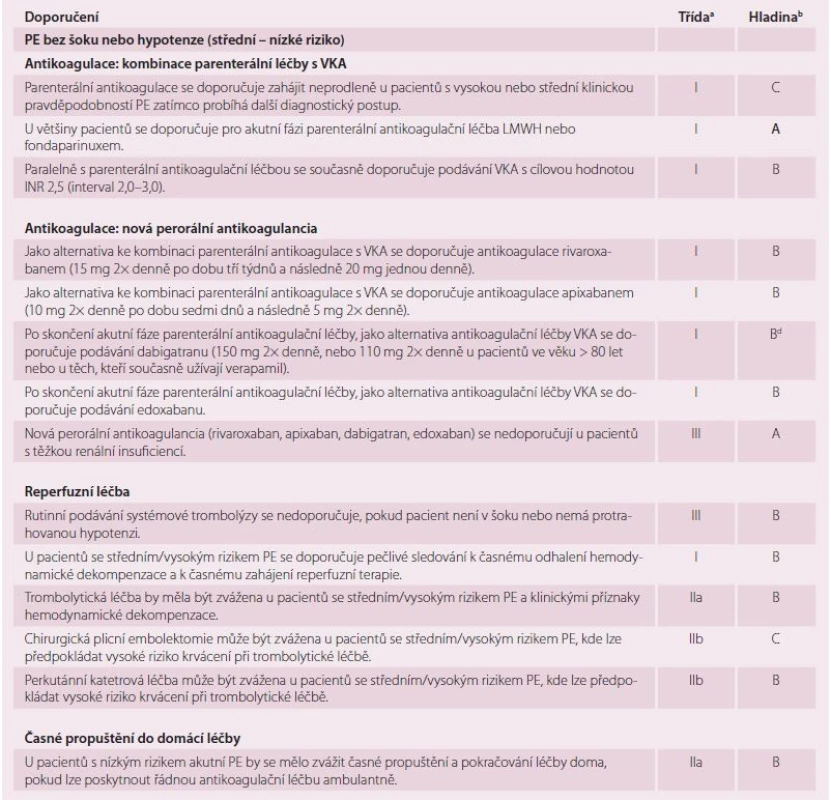
Optimální léčbu PE s šokem nebo hypotenzí (vysoce riziková PE) ukazuje tab. 8 a optimální léčbu PE bez šoku nebo hypotenze (středně riziková a nízko riziková PE) ukazuje tab. 9.

Délka antikoagulace
Cílem antikoagulační léčby pacientů s PE je prevence recidivy tromboembolické příhody. Dominantně se v praxi užívá warfarin a tři nová antikoagulancia, pouze u pacientů s přítomným neoplazmatem je preferován LMWH [31]. Výskyt recidivy tromboembolické příhody nezávisí na primární klinické manifestaci (PE či HŽT) [32]. U pacientů, kde PE vznikla sekundárně, by léčba warfarinem měla trvat do tří měsíců s možným zkrácením dle klinických souvislostí. Léčba delší než tři měsíce není doporučována vzhledem k tomu, že přechodné rizikové faktory, které vedly ke vzniku PE, již neexistují. Poněkud odlišná situace je v případě, že PE vznikla bez zjevné příčiny. Zde existují rizikové faktory, které mohou identifikovat pacienty, u kterých je dlouhodobě vyšší riziko recidivy PE. Jedná se o tromboembolickou příhodu v anamnéze, přetrvávající dysfunkci PK při propuštění z hospitalizace, reziduální HŽT, přítomnost antifosfolipidového syndromu a hereditární trombofilní stavy [33]. Na druhou stranu negativní D‑dimery se měsíc po vysazení antikoagulační léčby jeví jako preventivní faktor recidivy tromboembolické příhody [34]. U pacientů s primární PE by měla antikoagulační léčba trvat nejméně tři měsíce, a to na základě poměru rizika recidivy tromboembolizace a krvácivých komplikací. Po uplynutí této doby je u těchto pacientů s nízkým rizikem krvácení pokračování v antikoagulační léčbě na zváženou a lze se řídit pacientovou preferencí. U pacientů s recidivou primární tromboembolické příhody (PE nebo HŽT) je doporučena trvalá antikoagulace.
Nová antikoagulancia
Pro účinnou protrahovanou antikoagulační léčbu akutní PE dnes máme k dispozici tři nová antikoagulancia jako alternativu k warfarinu – dabigatran, rivaroxaban a apixaban. Randomizované studie s těmito preparáty prokázaly minimálně srovnatelný efekt v prevenci recidivy tromboembolické příhody vůči warfarinu, proto jsou doporučeny jako možná alternativní protrahovaná antikoagulační léčba akutní PE. Pravidla pro protrahovanou léčbu novými antikoagulanciemi jsou stejná jako u warfarinu či antikoagulační léčby obecně, jak je uvedeno výše.
Plicní embolie a těhotenství
Těhotenství nemění klinické známky PE, nicméně častá symptomatika dušnosti v těhotenství by měla být brána s větší opatrností a pozorností. Hladina D‑dimerů se v těhotenství zvyšuje, nicméně hraniční hodnota k vyloučení PE platí pro těhotné stejně jako pro ostatní populaci. Je‑li výsledek D‑dimerů abnormální, pokračuje se diagnosticky sonografickým kompresivním vyšetřením žil dolních končetin, protože nález proximální HŽT indikuje antikoagulační léčbu a další zobrazovací metody jsou již díky tomuto nálezu zbytečné. Pokud je sonografie negativní, mělo by se v diagnostice pokračovat. Všechny radiologické metody jsou pod prahem, který se považuje za nebezpečný pro poškození plodu, nicméně pokud je dostupná plicní scintigrafie, měla by být upřednostněna před CT vyšetřením. Z důvodu co nejmenší radiační zátěže se ventilační scan pokládá za zbytečný, pokud je provedený RTG snímek plic negativní. Diagnostický přínos perfuzní scintigrafie plic je u těhotných žen nejméně tak výtěžný jako CT [35]. Doporučení pro diagnostiku a léčbu PE v těhotenství ukazuje tab. 10.

Léčba
Antikoagulační léčba PE v těhotenství je založena na heparinu, protože heparin neprochází placentou a není v signifikantním množství ani v mateřském mléce. LMWH se rovněž ukázal jako dostatečně bezpečný, proto proti jeho podávání v těhotenství není námitek. Dávka LMWH by měla být upravena dle hmotnosti pacienta bez nutnosti monitorace účinnosti. Úpravu dávky dle monitorace hodnoty anti‑Xa lze zvážit u těhotných žen s extrémní tělesnou hmotností nebo s onemocněním ledvin. UFH není v těhotenství kontraindikován, ale vyžaduje sledování aPTT. Všechna nová perorální antikoagulancia jsou v těhotenství kontraindikována. Zvláštní pozornost vyžaduje vedení porodu. LMWH musí být vysazen nejméně 12 hod před porodem, pokud tento má být veden v epidurální analgezii, a v další antikoagulační léčbě lze pokračovat za 12 – 24 hod po odstranění epidurálního katetru. Po porodu lze heparin nahradit warfarinem, který lze podávat i kojícím matkám. Antikoagulační léčba by měla být podávána nejméně šest týdnů po porodu a celková doba antikoagulační léčby by měla trvat minimálně tři měsíce. Trombolytická léčba by se neměla podávat peripartálně, s výjimkou kritických případů.
Plicní embolie a zhoubné onemocnění
Celkové riziko tromboembolické nemoci u pacientů s rakovinou je čtyřikrát vyšší než v obecné populaci a pacienti léčení chemoterapií mají šestinásobný nárůst tromboembolických příhod proti zdravé populaci. Prvních šest týdnů po operaci karcinomu se riziko tromboembolizmu extrémně zvyšuje a ještě mezi 4. a 12. měsícem zůstává toto riziko extrémně zvýšené (až 30×), což nabádá k pozornosti při vážení délky antikoagulační léčby. Při diagnostice je třeba ze zmíněných důvodů počítat s informací o přítomném karcinomu. Negativní výsledek D‑dimerů má stejně velký význam jako u pacientů bez karcinomu. Na druhou stranu je třeba vědět, že hladina D‑dimerů je u nemocných s karcinomem nespecificky zvýšena. S nárůstem CT vyšetření se u pacientů s karcinomem diagnostikuje vzrůstající počet asymptomatických PE. Jejich závažnost je nejasná, ale dle současných znalostí se doporučuje přistupovat k nim jako k symptomatickým emboliím běžné populace.
Léčba
Za optimální antikoagulační léčbu u pacientů s PE a rakovinou se pokládá LMWH, který se podává v akutní fázi (s výjimkou vysoce rizikové PE) a pokračuje se po dobu prvních 3–6 měsíců. Chronická antikoagulace může pokračovat s LMWH nebo může přejít na warfarin nebo může být ukončena. Při zvažování délky antikoagulace je třeba ke každému pacientovi s rakovinou po PE přistupovat individuálně dle rizika recidivy PE, krvácivých komplikací, typu léčby karcinomu a pereference pacienta.
Závěr
Zásadní novinkou současných evropských doporučení pro diagnostiku a léčbu PE je nová stratifikace rizika, kde vymizela nejrozporuplnější kategorie středního rizika. Pacienti z této skupiny jsou dle rozměru PK, funkce PK a hladiny troponinu odlišeni a nově jsou kategorizováni do vysokého nebo nízkého rizika. Dle této nové stratifikace je zde specifikována diagnostika i moderní léčba včetně nových perorálních antikoagulancií, trombolýzy i embolektomie. Je zde zásadně aktualizována problematika PE v těhotenství a PE v koincidenci s nádorovým onemocněním.
Doručeno do redakce: 3. 8. 2015
Přijato po recenzi: 15. 8. 2015
doc. MU Dr. Petr Heinc, Ph.D.
www.fnol.cz
petr.heinc@fnol.cz
Sources
1. Heit JA. The epidemiology of venous thromboembolism in the community. Arterioscler Thromb Vasc Biol 2008; 28 : 370 – 372. doi: 10.1161/ ATVBAHA. 108.162545.
2. McIntyre KM, Sasahara AA. The hemodynamic response to pulmonary embolism in patients without prior cardiopulmonary disease. Am J Cardiol 1971; 28 : 288 – 294.
3. Marcus JT, Gan CT, Zwanenburg JJ et al. Interventricular mechanical asynchrony in pulmonary arterial hypertension: left ‑ to ‑ right delay in peak shortening is related to right ventricular overload and left ventricular underfilling. J Am Coll Cardiol 2008; 51 : 750 – 757. doi: 10.1016/ j.jacc.2007.10.041.
4. Lankeit M, Jiménez D, Kostrubiec M et al. Predictive value of the high‑sensitivity troponin T assay and the simplified pulmonary embolism severity index in hemodynamically stable patients with acute pulmonary embolism: a prospective validation study. Circulation 2011; 124 : 2716 – 2724. doi: 10.1161/ CIRCULATIONAHA.111.051177.
5. Wells PS, Ginsberg JS, Anderson DR et al. Use of a clinical model for safe management of patients with suspected pulmonary embolism. Ann Intern Med 1998; 129 : 997 – 1005.
6. Douma RA, Mos IC, Erkens PM et al. Performance of 4 clinical decision rules in the diagnostic management of acute pulmonary embolism: a prospective cohort study. Ann Intern Med 2011; 154 : 709 – 718. doi: 10.7326/ 0003 ‑ 4819 ‑ 154 ‑ 11 ‑ 201106070 ‑ 00002.
7. Chabloz P, Reber G, Boehlen F et al. TAFI antigen and D‑dimer levels during normal pregnancy and at delivery. Br J Haematol 2001; 115 : 150 – 152.
8. Ghaye B, Szapiro D, Mastora I et al. Peripheral pulmonary arteries: how far in the lung does multi‑detector row spiral CT allow analysis? Radiology 2001; 219 : 629 – 636.
9. Stein PD, Fowler SE, Goodman LR et al. Multidetector computed tomography for acute pulmonary embolism. N Engl J Med 2006; 354 : 2317 – 2327.
10. Sostman HD, Stein PD, Gottschalk A et al. Acute pulmonary embolism: sensitivity and specificity of ventilation ‑ perfusion scintigraphy in PIOPED II study. Radiology 2008; 246 : 941 – 946. doi: 10.1148/ radiol.2463070270.
11. Stein PD, Athanasoulis C, Alavi A et al. Complications and validity of pulmonary angiography in acute pulmonary embolism. Circulation 1992; 85 : 462 – 468.
12. van Beek EJ, Reekers JA, Batchelor DA et al. Feasibility, safety and clinical utility of angiography in patients with suspected pulmonary embolism. Eur Radiol 1996; 6 : 415 – 419.
13. Roy PM, Colombet I, Durieux P et al. Systematic review and meta‑analysis of strategies for the diagnosis of suspected pulmonary embolism. BMJ 2005; 331 : 259.
14. Bova C, Greco F, Misuraca G et al. Diagnostic utility of echocardiography in patients with suspected pulmonary embolism. Am J Emerg Med 2003; 21 : 180 – 183.
15. Kurzyna M, Torbicki A, Pruszczyk P et al. Disturbed right ventricular ejection pattern as a new Doppler echocardiographic sign of acute pulmonary embolism. Am J Cardiol 2002; 90 : 507 – 511.
16. Pruszczyk P, Goliszek S, Lichodziejewska B et al. Prognostic Value of echocardiography in normotensive patients with acute pulmonary embolism. JACC Cardiovasc Imaging 2014; 7 : 553 – 560.
17. Kucher N, Luder CM, Dörnhöfer T et al. Novel management strategy for patients with suspected pulmonary embolism. Eur Heart J 2003; 24 : 366 – 376.
18. Righini M, Le Gal G, Aujesky D et al. Diagnosis of pulmonary embolism by multidetector CT alone or combined with venous ultrasonography of the leg: a randomised non‑inferiority trial. Lancet 2008; 371 : 1343 – 1352. doi: 10.1016/ S0140 ‑ 6736(08)60594 ‑ 2.
19. Sanchez O, Trinquart L, Colombet I et al. Prognostic value of right ventricular dysfunction in patients with haemodynamically stable pulmonary embolism: a systematic review. Eur Heart J 2008; 29 : 1569 – 1577. doi: 10.1093/ eurheartj/ ehn208.
20. Henzler T, Roeger S, Meyer M et al. Pulmonary embolism: CT signs and cardiac biomarkers for predicting right ventricular dysfunction. Eur Respir J 2012; 39 : 919 – 926. doi: 10.1183/ 09031936.00088711.
21. Lankeit M, Jimenez D, Kostrubiec M et al. Validation of N‑terminal pro‑brain natriuretic peptide cut‑off values for risk stratification of pulmonary embolism. Eur Respir J 2014; 43 : 1669 – 1677. doi: 10.1183/ 09031936.00211613.
22. Binder L, Pieske B, Olschewski M et al. N‑terminal pro‑brain natriuretic peptide or troponin testing followed by echocardiography for risk stratification of acute pulmonary embolism. Circulation 2005; 112 : 1573 – 1579.
23. Mercat A, Diehl JL, Meyer G et al. Hemodynamic effects of fluid loading in acute massive pulmonary embolism. Crit Care Med 1999; 27 : 540 – 544.
24. Raschke RA, Gollihare B, Peirce JC. The effectiveness of implementing the weight‑based heparin nomogram as a practice guideline. Arch Intern Med 1996; 156 : 1645 – 1649.
25. Middeldorp S. How I treat pregnancy‑related venous thromboembolism. Blood 2011; 118 : 5394 – 5400. doi: 10.1182/ blood ‑ 2011 ‑ 04 ‑ 306589.
26. Samama MM, Poller L. Contemporary laboratory monitoring of low molecular weight heparins. Clin Lab Med 1995; 15 : 119 – 123.
27. Goldhaber SZ, Haire WD, Feldstein ML et al. Alteplase versus heparin in acute pulmonary embolism: randomised trial assessing right ‑ ventricular function and pulmonary perfusion. Lancet 1993; 341 : 507 – 511.
28. Konstantinides S, Tiede N, Geibel A et al. Comparison of alteplase versus heparin for resolution of major pulmonary embolism. Am J Cardiol 1998; 82 : 966 – 970.
29. Meneveau N, Schiele F, Metz D et al. Comparative efficacy of a two‑hour regimen of streptokinase versus alteplase in acute massive pulmonary embolism: immediate clinical and hemodynamic outcome and one‑year follow‑up. J Am Coll Cardiol 1998; 31 : 1057 – 1063.
30. Daniels LB, Parker JA, Patel SR et al. Relation of duration of symptoms with response to thrombolytic therapy in pulmonary embolism. Am J Cardiol 1997; 80 : 184 – 188.
31. Lee AY, Rickles FR, Julian JA et al. Randomized comparison of low molecular weight heparin and coumarin derivatives on the survival of patients with cancer and venous thromboembolism. J Clin Oncol 2005; 23 : 2123 – 2129.
32. Murin S, Romano PS, White RH. Comparison of outcomes after hospitalization for deep venous thrombosis or pulmonary embolism. Thromb Haemost 2002; 88 : 407 – 414.
33. Grifoni S, Vanni S, Magazzini S et al. Association of persistent right ventricular dysfunction at hospital discharge after acute pulmonary embolism with recurrent thromboembolic events. Arch Intern Med 2006; 166 : 2151 – 2156.
34. Palareti G, Cosmi B, Legnani C et al. D‑dimer testing to determine the duration of anticoagulation therapy. N Engl J Med 2006; 355 : 1780 – 1789.
35. Ridge CA, McDermott S, Freyne et al. Pulmonary embolism in pregnancy: comparison of pulmonary CT angiography and lung scintigraphy. AJR Am J Roentgenol 2009; 193 : 1223 – 1227. doi: 10.2214/ AJR.09.2360.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2015 Issue 3
-
All articles in this issue
- 25th European Meeting on Hypertension and Cardiovascular Protection, Milan 2015
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
- Novinky v koronárních intervencích
- Mnohočetné postižení věnčitých tepen diagnostikované při pPCI pro STEMI: kompletní revaskularizace nebo konzervativní léčba. Studie Prague‑ 13.
- Farmakologická a nefarmakologická léčba fibrilace síní – současný pohled
- Léčebné postupy u námahové anginy pectoris
- Srdeční zástava a poresuscitační péče
- Komentovaná zkrácená verze evropských doporučení pro diagnostiku a management akutní plicní embolie z roku 2014
- Co přinesla nová evropská guidelines pro trvalou kardiostimulaci a srdeční resynchronizační léčbu (2013) v oblasti diagnostiky arytmií pomocí dlouhodobého monitorování EKG – současné technické aspekty a typy dlouhodobého monitorování EKG
- Fixní trojkombinace antihypertenziv a subklinické orgánové poškození – kazuistika
- Studie IMPROVE‑ IT u pacientů s diabetes mellitus
- Studie TECOS – efekt sitagliptinu na kardiovaskulární příhody u diabetes mellitus 2. typu
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Srdeční zástava a poresuscitační péče
- Léčebné postupy u námahové anginy pectoris
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
