Fixní kombinace v antiagregační léčbě
Fixed-dose combinations of antiplatelet drugs
Fixed-dose combinations of several active substances in one tablet provide advantages in the treatment of diabetes, hypertension and chronic pain. This issue is much more challenging when considering drug combinations that interfere with haemostasis. Indications of antiplatelet drugs vary depending on the duration of therapy required, the degree of aggressiveness of treatment and on the presence of numerous modifying factors influencing drug effectiveness. Combinations of these drugs increase the risk of major bleeding complications. Two fixed-dose antiplatelet pharmaceutical products are currently available: aspirin + dipyridamole and aspirin + clopidogrel. This article discusses the benefits and pitfalls of these combinations and provides an overview and comparison of other antiaggregation drugs and their potential for fixed-dose preparations in the future.
Keywords:
antiplatelet therapy – fixed-dose combination – aspirin resistance – P2Y12 receptor blockers
Authors:
R. Miklík; M. Pavlušová
Authors‘ workplace:
Interní kardiologická klinika LF MU a FN Brno
Published in:
Kardiol Rev Int Med 2016, 18(2): 109-114
Overview
Fixní kombinace několika léčivých substancí v jedné tabletě přináší v léčbě cukrovky, hypertenze nebo třeba chronických bolestí mnoho pozitiv. V případě kombinace léků interferujících s hemostázou je problematika složitější. U jednotlivých onemocnění je vyžadována různá délka terapie, odlišná agresivita léčby, uplatňují se četné modifikující faktory účinnosti léčby a v neposlední řadě se zvyšuje riziko závažných krvácivých komplikací. V současné době jsou k dispozici dva fixní lékové preparáty: aspirin + dipyridamol a aspirin + klopidogrel. Výhody a úskalí těchto kombinací, stejně jako přehled a srovnání ostatních používaných antiagregancií a jejich potenciál pro fixní lékové preparáty v budoucnu, jsou uvedeny a diskutovány v tomto článku.
Klíčová slova:
antiagregační léčba – fixní kombinace – aspirinová rezistence – P2Y12 blokátory
Úvod
U celé řady interních onemocnění se dnes setkáváme s konceptem léčby pomocí fixní kombinace několika léků v jedné tabletě, tzv. polypill. Poprvé byl tento pojem použit v roce 2003 Waldem a Lawem [1]. Tito autoři vytvořili „virtuální polypill“ skládající se ze šesti komponent v polovičních dávkách: statin, betablokátor, thiazidové diuretikum, ACE inhibitor/ sartan, kyselina listová a také aspirin. Výsledkem bylo virtuální snížení rizika srdečního infarktu o 88 % a mozkové příhody o 80 %, kterého bylo dosaženo díky ovlivnění hlavních rizikových faktorů (LDL cholesterolu, krevního tlaku (TK), hladiny homocysteinu a destičkové aktivity) touto tabletou. Od té doby prošlo využívání kombinační terapie s fixními dávkami jednotlivých léčivých komponent výrazným vývojem. Běžně jsou dnes na trhu dostupné dvou - i třísložkové léky na hypertenzi, diabetes mellitus, hyperlipidemii a další nemoci, a to rovnou ve více variantách lišících se gramáží použitých látek.
Následující článek stručně zrekapituluje patofyziologické pochody vzniku trombu v místě ruptury aterosklerotického plátu, což je důležité pro pochopení účinku jednotlivých antiagregancií. Následně čtenáře seznámí se současnou situací v oblasti antiagregační terapie a s výhodami či riziky používání fixních kombinací protidestičkových léků.
Patofyziologie vzniku trombu
Protidestičková léčba zahrnuje široké spektrum možných kombinací léků blokujících aktivaci trombocytů na různých úrovních. Adheze destiček k cévní stěně je zprostředkována von Willebrandovým faktorem, který propojuje obnažený subendoteliální kolagen s destičkovými glykoproteiny. Pomineme-li traumatická poranění cévní stěny, je poté nejčastější a klinicky nejvýznamnější příčinou kontaktu destičky s kolagenem ruptura aterosklerotického plátu postižené tepny. Dojde k aktivaci intracelulárních signálních cest uvnitř krevních destiček, které v důsledku vedou k uvolnění adenozindifosfátu (ADP), serotoninu nebo prostaglandinů (nejvíce tromboxan A2 vytvářený enzymem cyklooxygenáza-1) z denzních granul. Tyto a další četné aktivátory agregace (trombin, adrenalin, destičky aktivující faktor) nachází své receptory na dalších trombocytech, které aktivací mění svůj tvar a spojují rozdělené glykoproteinové receptory ve svých membránách v receptorové komplexy IIb/ IIIa, které vytváří vazebné místo pro fibrinogen. Tyto mezidestičkové můstky jsou dále zpevněny pomocí vazby s trombospondinem, který je uvolňován z alfagranul aktivovaných destiček. Postupně se vytvoří zátka, která je posléze zpevněna sítí fibrinových vláken při současné aktivaci koagulační kaskády (zejména jejího vnitřního systému). Dochází k tvorbě bílého trombu (akutní, čerstvý), který se následně změní v trombus červený, což je způsobeno zachycením červených krvinek ve fibrinové síti. Proces tvorby výsledné sraženiny je usnadněn turbulentním prouděním a třecími silami (shear stress) v místě stenózy, také nepoměrem mezi pro - a antikoagulačními faktory nebo zvýšenou agregabilitou destiček, která doprovází řadu onemocnění (záněty, nádory, diabetes mellitus). Je tedy zřejmé, že adheze, aktivace a agregace destiček spolu s následnou aktivací koagulačních faktorů je složitý a kaskádovitý proces, který lze ovlivnit na mnoha úrovních ve svém sledu, ať už blokádou receptorů nebo jejich ligandů.
Přehled používaných antiagregancií
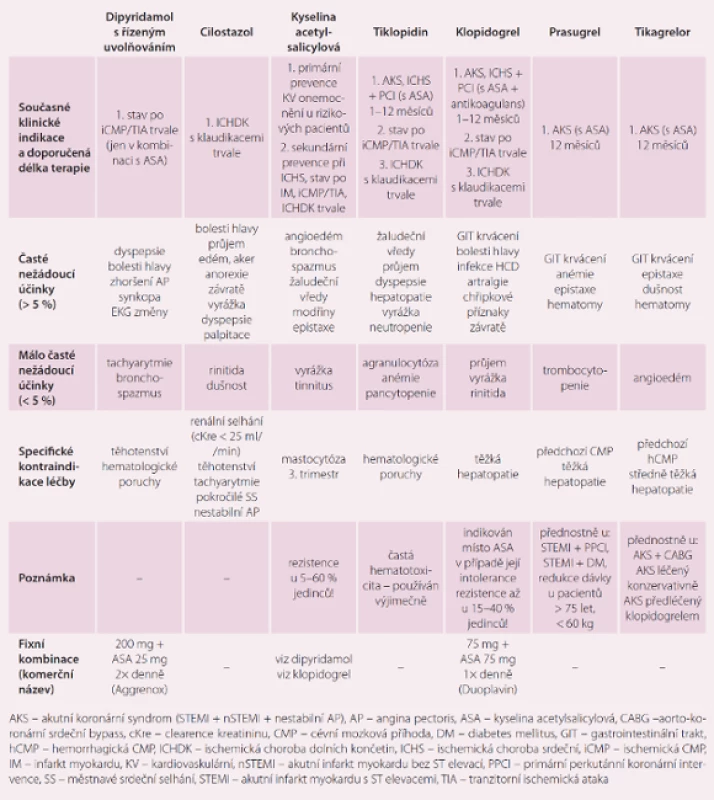
V posledních 25 letech se usilovně studovaly a vyvíjely léky, které by snížily riziko vzniku tepenné trombózy a zlepšily dlouhodobou prognózu jak u jedinců s predisponujícími komorbiditami (primární prevence), tak u pacientů s již rozvinutou ischemickou chorobou srdeční (ICHS), s cévním onemocněním mozku (COM) nebo ischemickým postižením končetinových tepen (ICHDK). Je celkem logické a v mnoha studiích prokázané, že čím více etáží (receptorů, ligandů) zablokujeme, tím dosáhneme silnějšího protidestičkového efektu léčby (klinicky vyjádřeného jako redukce ischemických příhod), ale také více nežádoucích účinků (krvácení, žaludeční potíže, hematologické poruchy aj.). Běžně dnes používáme kombinace více antiagregancií u pacientů s vysokým rizikem vzniku tepenné trombózy nebo také kombinaci antiagregace s antikoagulací u pacientů s přidruženými komorbiditami predisponujícími k žilnímu tromboembolizmu. U jednotlivých pacientů se liší jejich indikace v čase v závislosti na akutnosti onemocnění, tíži postižení, zvoleném terapeutickém postupu, přidružených komorbiditách, výskytu nežádoucích účinků apod. Jednotlivé léky mají různé farmakokinetické (vstřebávání, metabolizmus, vylučování) a farmakodynamické (mechanizmus účinku) vlastnosti (tab. 1). Výčet jednotlivých perorálních antiagregancií, které se v současné době v dlouhodobé prevenci i léčbě ischemických chorob používají, jejich indikace a kontraindikace, zobrazuje tab. 2. Některé se používají samostatně, jiné v kombinacích s kyselinou acetylsalicylovou (ASA). Ta je součástí obou komerčně dostupných preparátů na českém trhu, které si ve stručnosti představíme později.
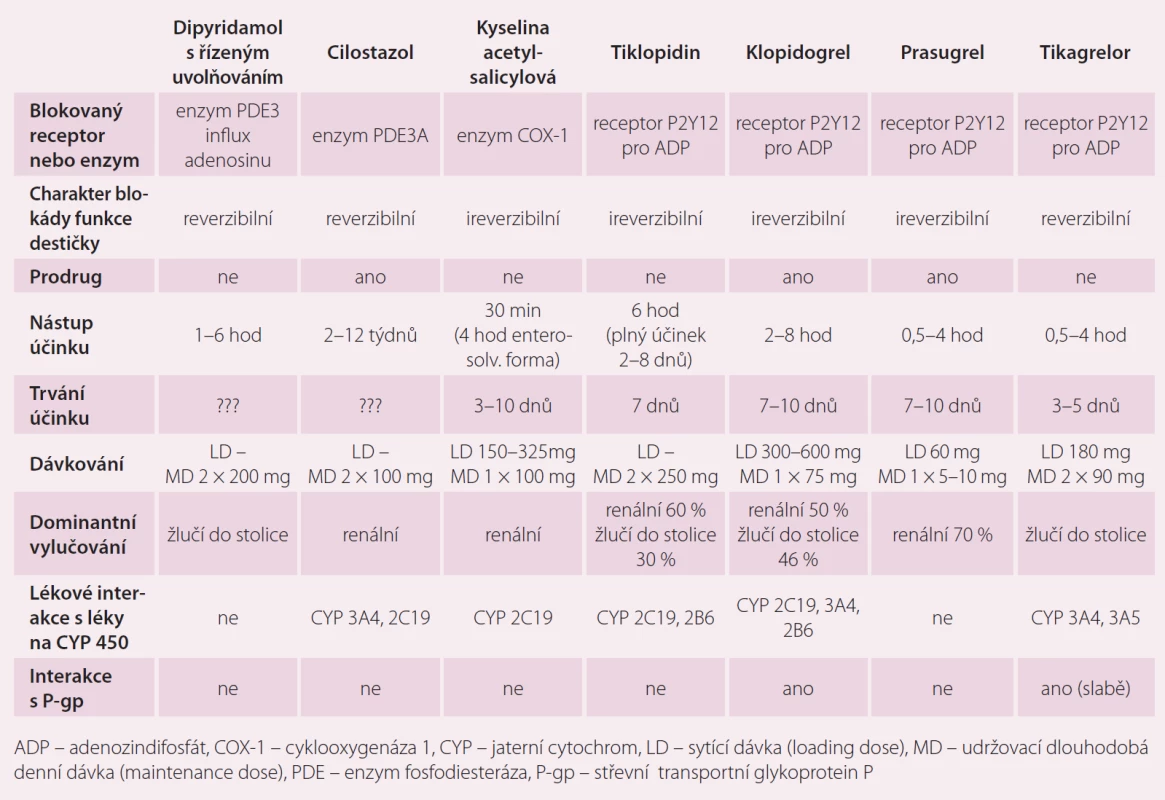
Základní předpoklady úspěšné fixní lékové kombinace
Aby spojení dvou a více léčebných substancí do jedné tablety splnilo svůj účel, měly by být respektovány následující principy [2]:
- Léky v kombinaci by měly mít jiný mechanizmus účinku. Poté je možno použít nižších dávek jednotlivých složek k dosažení stejné nebo vyšší efektivity bez zvýšeného rizika předávkování nebo toxicity při užívání maximální dávky pouze jedné substance.
- Farmakokinetické vlastnosti složek se nesmí výrazně lišit. Není racionální kombinovat složky vstřebatelné nalačno s těmi po jídle nebo léky s odlišným intervalem dávkování.
- Kombinace substancí nesmí mít aditivní riziko toxicity/ nežádoucího účinku. Tato podmínka je asi nejzásadnější v případě antiagregačních nebo antiakoagulačních lékových kombinací.
Fixní kombinace léků se staly uznávanou strategií léčby v mnoha oblastech medicíny. Důvodů je několik:
- Zlepšují průkazně compliance pacientů, a to až o 25 % [3,4]. Je známo, že do šesti měsíců od prodělaného srdečního infarktu vysadí 31 % pacientů alespoň jeden předepsaný lék. Compliance je nejhorší u černošské populace, starších pacientů, dialyzovaných jedinců, depresivních pacientů a nemocných s fibrilací síní (FS) [5].
- Tento přístup je cost-efektivní. Kombinovaná tableta je nejen levnější, ale zvýšená spolupráce pacienta při užívání medikace se v jedné britské studii promítla v redukci kardiovaskulárních (KV) příhod i ušetřených nákladů vynaložených na léčbu [3].
- Nedochází k záměnám léků s různými názvy (generickými preparáty), riziko dublování medikace je nízké.
- Komerčně dostupné preparáty jsou schvalovány úředními orgány, mají nízké riziko interakcí jednotlivých sloučenin, jsou kompatibilní.
Dostupné fixní kombinace protidestičkových léků
V současné době jsou pouze dva dostupné preparáty na trhu, které kombinují vždy malou dávku ASA s dalším antiagreganciem:
- ASA 25 mg + dipyridamole ER 200 mg s postupným uvolňováním (Aggrenox), doporučené dávkování 2 × 1 tbl denně [6].
Tato kombinace je používána v neurologii v sekundární prevenci ischemických mozkových příhod, které nemají kardioembolickou příčinu [7]. Je zajímavé, že lék kombinuje složky s odlišným doporučeným dávkováním (ASA 1× denně, dipyridamole (DIP) ER 2× denně) a také nižší denní dávku ASA, než je běžné. Nicméně ve studii ESPS2 byla prokázána vyšší účinnost právě této kombinace ASA s DIP než jednotlivé monoterapie. Tyto výsledky byly dále podpořeny studií ESPRIT [8,9], proto byl tento preparát donedávna číslem jedna ve své indikaci. V poslední době je ale výrazně na ústupu s uvolněním preskripce klopidogrelu. Vzájemné srovnání bylo cílem studie PRoFESS. Zde se ukázalo, že riziko rekurující mozkové příhody nebo krvácivých komplikací bylo u pacientů užívajících 75 mg klopidogrelu stejné jako u těch na fixní kombinaci ASA + DIP (benefit/ risk analýza 11,4 vs. 11,7 %; HR = 1,03) [10], ale ve větvi s klopidogrelem bylo méně klinicky závažných i život ohrožujících krvácení. Dalším pozitivem klopidogrelu je dávkování 1× denně a také jeho široké uplatnění v léčbě akutních koronárních syndromů (AKS), ICHS po implantaci stentu nebo ICHDK, které se u nemocných s ischemickým mozkovým postižením často vyskytují.
- ASA 100 mg + klopidogrel 75 mg (Duoplavin), doporučené dávkování 1 × 1 tbl denně [11].
Užívání ASA v monoterapii snižuje riziko KV příhod o 12 % v primární prevenci a o 19 % v sekundární prevenci [12]. Pokud není ASA kontraindikována pro svou intoleranci nebo alergii, poté je indikována u nemocných s vysokým (> 10 %) pětiletým rizikem KV příhody a také dle zvážení u jedinců se středním (> 5 %) rizikem, u kterých je velmi nízké riziko krvácivých příhod, zejména z gastrointestinálního traktu. Problémem při užívání ASA je její častá intolerance udávaná až ve 30 % případů a vedoucí v 6,6 % případů k vysazení medikace [13].
Druhá složka v této fixní kombinaci – klopidogrel – má široké, zejména sekundárně preventivní využití u pacientů s ischemickým onemocněním mozku, srdce i končetinových tepen. Monoterapie klopidogrelem je indikována u pacientů v primární prevenci při intoleranci ASA a v sekundární prevenci u nemocných po prodělané ischemické cévní mozkové příhodě (CMP) (lze i v kombinaci s ASA u vysoce rizikových pacientů s recidivami mozkových infarktů) a u pacientů s ICHDK [7,11,14]. V kombinaci s ASA 100 mg denně je stále celosvětově dominantně využíván v rámci duální protidestičkové terapie pacientů s akutním koronárním syndromem a chronickou ICHS léčenou koronární angioplastikou. Klopidogrel je velice dobře snášen. Nejčastějším nežádoucím účinkem je extrakraniální krvácení, většinou nezávažné, a v monoterapii srovnatelné s ASA (studie CAPRIE). Horší je to v případě srovnání duální antiagregace (ASA + klopidogrel) s monoterapií ASA. Přidání klopidogrelu k ASA ve studii ACTIVE A zvýšilo výskyt závažného krvácení z 4,3 na 6,7 % (intrakraniální krvácení 1,4 % a gastrointestinální krvácení 3,5 % na duální terapii) [11]. Vzhledem ke složité farmakokinetice klopidogrelu je nutné počítat s četnými lékovými interakcemi, které nevykazují tzv. class efekt, tedy ne všechny léky stejné skupiny významně interferují s klopidogrelem. Z běžně užívaných léků účinek klopidogrelu snižují omeprazol, amlodipin, morfin, fluoxetin, azolová antimykotika a z neléků grepový džus, naopak destičky inhibující účinek klopidogrelu posilují některé ACE inhibitory (enalapril, trandolapril), cyklosporin, rifampicin, ale také kouření [15]. Závěrem je nutné podotknout, že narozdíl od předchozí kombinace ASA + DIP nebyla fixní kombinace ASA + klopidogrel v jedné tabletě testována v žádné klinické studii.
Úskalí fixních kombinací antiagregancií (a antikoagulancií)
Přehled jednotlivých protidestičkových léků v tab. 1 a 2 a zkušenosti se dvěma fixními kombinacemi antiagregancií již naznačují, že na rozdíl od chronických onemocnění, která léčíme kombinací lékových skupin ovlivňujících více patofyziologických mechanizmů, což ve svém důsledku vede k synergistickým pozitivním účinkům (snížení TK, glykemie apod.), je v případě léčby ischemicko-trombotických příhod situace složitější. Pozitiva jsou podobná jako u jiných fixních kombinací, ale na rozdíl od dvou - nebo třísložkových antidiabetik nebo antihypertenziv zde existují níže uvedená úskalí:
Rezistence na léčbu a měření účinnosti léků
Aspirinová rezistence, která může být laboratorní (tedy nedostatečná inhibice tvorby tromboxanu A2) nebo klinická (KV příhoda při užívání ASA), je udávána v širokém rozmezí 5 – 60 % (průměrně 24 %), v závislosti na použité dávce ASA (2× vyšší výskyt u ASA 100 mg denně než u ASA 300 mg denně) a také na přítomnosti četných komorbidit. Dominující příčinou rezistence na ASA je tzv. pseudorezistence, jednoduše noncompliance pacienta, udávaná až ve 40 % případů [16 – 19]. Příčiny pacientem neovlivnitelné zahrnují např. variabilitu genetických polymorfizmů v kaskádě aktivace destiček, alternativní tvorbu tromboxanu A2, zvýšený obrat trombocytů, předchozí srdeční infarkt, diabetes mellitus aj. [20]. Aspirinová rezistence je spojena s vyšším rizikem KV příhod [21].
Podobně jako u ASA je bohužel vysoké procento pacientů rezistentních na klopidogrel, hodnoceno dle různých laboratorních testů na bázi přidání adenozindifosfátu k destičkám inhibovaným klopidogrelem. Příčiny jsou rovněž klinické (noncompliance, šokový stav, AKS), buněčné (např. variabilní množství P2Y12 receptorů na destičkách, množství uvolňovaného ADP), genetické (různé polymorfizmy jaterních enzymů, zejména CYP2C19, a receptorů P2Y12) a jiné (drcení tablet, lékové interakce) [22]. Důležité je uvědomit si, že destičková odpověď na klopidogrel se výrazně liší u stabilních a nestabilních pacientů. Zatímco stabilních STEMI pacientů (pacientů s infarktem myokardu s ST elevacemi) je rezistentních 35 %, tak pacientů se STEMI vyžadující katecholaminy a intubaci až 85 % [23]! U pacientů se stabilní formou chronického srdečního selhání a nízkou ejekční frakcí levé komory se rezistence na klopidogrel vyskytuje v 50 % případů [24]. Navýšení úvodního bolusu klopidogrelu z 300 na 600 mg výrazně zvýší inhibici trombocytů [25], což se ve studii ARMYDA promítlo ve snížení periprocedurálních komplikací v průběhu koronární intervence [26].
U nových blokátorů P2Y12 receptoru – prasugrelu a tikagreloru – je problematika rezistence zanedbatelná, pokud eliminujeme nespolupráci pacienta při užívání medikace. Polymorfizmy jaterních cytochromů v případě biotransformace prasugrelu pouze zpomalují přeměnu na aktivní metabolit, ale nebrání jí jako v případě klopidogrelu [27]. Tikagrelor není prodrug a metabolickou aktivaci nevyžaduje.
Ačkoli jsou dostupné metody laboratorního testování úrovně inhibice destiček, stejně jako je možné testovat polymorfizmy jaterních cytochromů (zejména CYP 2C19) a „odhadnout“ míru účinku nebo riziko krvácení u aspirinu, klopidogrelu nebo potentnějších P2Y12 blokátorů prasugrelu a tikagreloru, vzhledem k obrovské variabilitě a mnoha ovlivňujícím faktorům není tento postup před zahájením nebo v průběhu jejich užívání běžně doporučen [28].
Problematiku rezistence lze tedy shrnout tak, že je velmi obtížné změřit nebo predikovat účinek protidestičkových léků v monoterapii, o to obtížněji v kombinaci. V případě antiagregancií se léčba klinicky lépe monitoruje v oddělených formách, kdy je možné přechodné přerušení jednotlivých léků, které vzhledem k daným dávkám nelze postupně titrovat jako třeba antihypertenziva. Vzhledem k faktu, že krvácení je relativně častá a klinicky významná komplikace provázející zejména duální terapii, při fixní kombinaci není možné zjistit, který z léků je za krvácení zodpovědný. Pokud uvážíme i častou nutnost kombinace s perorálním antikoagulans, tento problém se dále násobí.
Podobné nežádoucí účinky
Také alergické reakce a jiné nežádoucí účinky se mohou klinicky překrývat (tab. 2). Duální terapie nebo dokonce triple terapie (ASA + klopidogrel + antikoagulans) se většinou nasazují do léčby společně a je malý prostor pro jejich postupnou titraci, o to větší je riziko (nejen krvácivých) nežádoucích reakcí.
Dynamika léčby
Stavy vyžadující antiagregační léčbu jsou dynamické. Ve fázi akutního koronárního syndromu je nutná agresivní protidestičková i antikoagulační léčba vyžadující bolusová podání léků a nasycovací dávky. V dalším průběhu je vyžadována udržovací duální nebo triple terapie, po uplynutí nejrizikovějšího období po fázi AKS (6 – 12 měsíců) ve většině případů jen monoterapie. Prostor pro fixní kombinaci je zde opět velmi omezený. Je ale možné, že výsledky recentních studií (PEGASUS TIMI 54 [29], DAPT [30]) a metaanalýz [31] tuto praxi změní a minimálně pacientům s vysokým rizikem recidivy AKS nebo trombózy ve stentu začneme doporučovat duální antiagregační terapii déle než 12 měsíců. Důležitým předpokladem pro potenciálního výrobce léčiva je jeho rentabilita, která je závislá na velikosti cílové populace a trvání indikace léku (také na množství složek, jejich kompatibilitě apod.) [32].
Různé dávkování
Doporučené dávkování léků je uvedeno v tab. 1. Možnost fixní kombinace je limitovaná odlišným dávkovacím intervalem pro ASA + tikagrelor a ASA + cilostazol (tyto kombinace byly ověřeny v klinických studiích a jsou v kardiologii a neurologii doporučeny), naopak se nabízí lékové spojení ASA + prasugrel (obojí 1× denně). Zde je ovšem úskalí v kontraindikacích prasugrelu (předchozí CMP) a nutnosti redukce dávky u starších pacientů a nemocných s nízkou tělesnou hmotností. Rentabilita takového preparátu by byla otazná. Přípravek Aggrenox nesplňuje princip stejného dávkování složek, ale byl přímo v nabízené kombinaci úspěšně ověřen v klinických studiích a nízkou dávku ASA si obhájil. Stejným způsobem by bylo možné do praxe zavést i kombinace ASA + tikagrelor nebo ASA + cilostazol s rozdělením dávky ASA na 2 × 50 mg.
Možná budoucnost antitrombotických fixních kombinací
V současné době probíhají studie srovnávající triple terapii s warfarinem oproti kombinaci antiagregancií s novým perorálním antikoagulans (apixaban, rivaroxaban, edoxaban, dabigatran) u pacientů s ICHS a FS. Tyto léky se stabilním dávkováním mohou v budoucnu nabídnout potenciální rozšíření možnosti fixních kombinací, např. dabigatran + tikagrelor 2× denně (REDUAL-PCI). Podobně probíhá výzkum u pacientů s AKS, kde je např. zkoušen rivaroxaban 2 × 2,5 mg denně v kombinaci s tikagrelorem 2 × 90 mg denně (GEMINI ACS 1). Se stárnoucí populací a nárůstem prevalence FS, AKS i chronické ICHS se těchto fixních antitrombotických preparátů třeba jednou dočkáme.
Závěr
Fixní léková kombinace dvou a více léčivých substancí s rozdílným mechanizmem účinku se stala osvědčenou volbou u pacientů s chronickým multifaktoriálním onemocněním typu diabetes mellitus nebo hypertenze. Zlepšuje compliance pacientů, snižuje náklady, zamezuje chybám v preskripci. Totéž platí pro fixní kombinace antiagregačních léků, ale s tím rozdílem, že možnosti titrace jsou zde malé, dávkovací intervaly odlišné, indikace striktně vymezené a časově ohraničené, nežádoucí účinky podobné, navzájem se potencující a klinicky mnohdy závažné. Přesto máme k dispozici dva kombinované preparáty: ASA + DIP ER v neurologické indikaci a ASA + klopidogrel v kardiologické indikaci. Oba jsou v praxi zavedené a ověřené, nicméně mají své limitace, které vyplývají z farmakokinetických a farmakodynamických vlastností jednotlivých komponent. Probíhající klinické studie kombinují jednotlivá antiagregancia s novými antikoagulancii, a poskytují tím prostor k budoucímu vývoji dalších fixních antitrombotických preparátů.
Doručeno do redakce: 31. 3. 2016
Přijato po recenzi: 18. 4. 2016
MU Dr. Roman Miklík, Ph.D.
www.fnbrno.cz
romanmiklik@yahoo.com
Sources
1. Wald NJ, Law MR. A strategy to reduce cardiovascular disease by more than 80%. BMJ 2003; 326 : 1419. doi: 10.1136/ bmj.326.7404.1419.
2. Gautam CS, Saha L. Fixed dose drug combinations (FDCs): rational or irrational: a view point. Br J Clin Pharmacol 2008; 65 : 795 – 796. doi: 10.1111/ j.1365-2125.2007.03089.x.
3. Becerra V, Gracia A, Desai K et al. Cost-effectiveness and public health benefit of secondary cardiovascular disease prevention from improved adherence using a polypill in the UK. BMJ Open 2015; 5: e007111. doi: 10.1136/ bmjopen-2014-007111.
4. Bangalore S, Kamalakkannan G, Parkar S et al. Fixed-dose combinations improve medication compliance: a meta-analysis. Am J Med. 2007; 120 : 713 – 719. doi: 10.1016/ j.amjmed.2006.08.033.
5. Mathews R, Wang TY, Honeycutt E et al. Persistence with secondary prevention medications after acute myocardial infarction: insights from the TRANSLATE-ACS study. Am Heart J 2015; 170 : 62 – 69. doi: 10.1016/ j.ahj.2015.03.019.
6. AGGRENOX, POR CPS RDR 60X25MG/ 200MG. Státní ústav pro kontrolu léčiv. Dostupné z: http:/ / www.sukl.cz/ modules/ medication/ detail.php?kod=0057364&tab=texts.
7. European Stroke Organisation (ESO) Executive Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25 : 457 – 507. doi: 10.1159/ 000131083.
8. Halkes PH, van Gijn J, Kappelle LJ et al. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006; 367 : 1665 – 1673. doi: 10.1016/ S0140-6736(06)68734-5.
9. Diener HC, Cunha L, Forbes C et al. European Stroke Prevention Study 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996; 143 : 1 – 13. doi: 10.1016/ S0022-510X(96)00308-5.
10. Diener HC, Sacco RL, Yusuf S et al. Effects of aspirin plus extended-release dipyridamole versus clopidogrel and telmisartan on disability and cognitive function after recurrent stroke in patients with ischaemic stroke in the Prevention Regimen for Effectively Avoiding Second Strokes (PRoFESS) trial: a double-blind, active and placebo-controlled study. Lancet Neurol 2008; 7 : 875 – 884. doi: 10.1016/ S1474-4422(08)70198-4.
11. Duoplavin SPC. Dostupné z: http:/ / www.ema.europa.eu/ docs/ cs_CZ/ document_library/ EPAR-Product_Information/ human/ 001143/ WC500087025.pdf.
12. Baigent C, Blackwell L, Collins R et al. Antithrombotic Trialists’ (ATT) Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373 : 1849 – 1860. doi: 10.1016/ S0140-6736(09)60503-1.
13. Tournoij E, Peters RJ, Langenberg M et al. The prevalence of intolerance for low-dose acetylsalicylacid in the secondary prevention of atherothrombosis. Eur J Vasc Endovasc Surg 2009; 37 : 597 – 603. doi: 10.1016/ j.ejvs.2009.01.009.
14. Tendera M, Aboyans V, Bartelink ML et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases. Eur Heart J 2011; 32 : 2851 – 2906. doi: 10.1093/ eurheartj/ ehr211.
15. Wang ZY, Chen M, Zhu LL et al. Pharmacokinetic drug interactions with clopidogrel: updated review and risk management in combination therapy. Ther Clin Risk Manag 2015; 11 : 449 – 467. doi: 10.2147/ TCRM.S80437.
16. Campbell CL, Steinhubl SR. Variability in response to aspirin: do we understand the clinical relevance? J Thromb Haemost 2005; 3 : 665 – 669. doi: 10.1111/ j.1538-7836.2005.01119.x.
17. Eikelboom JW, Hankey GJ. Failure of aspirin to prevent atherothrombosis: potential mechanisms and implications for clinical practice. Am J Cardiovasc Drugs 2004; 4 : 57 – 67.
18. Hankey GJ, Eikelboom JW. Aspirin resistance. Lancet 2006; 367 : 606 – 617. doi: 10.1016/ S0140-6736(06)68040-9.
19. Carney RM, Freedland KE, Eisen SA et al. Adherence to a prophylactic medication regimen in patients with symptomatic versus asymptomatic ischemic heart disease. Behav Med 1998; 24 : 35 – 39. doi: 10.1080/ 08964289809596379.
20. Larsen SB, Grove EL, Neergaard-Petersen S et al. Determinants of reduced antiplatelet effect of aspirin in patients with stable coronary artery disease. PloS One 2015; 10: e0126767. doi: 10.1371/ journal.pone.0126767.
21. Gum PA, Kottke-Marchant K, Welsh PA et al. A prospective, blinded determination of the natural history of aspirin resistance among stable patients with cardiovascular disease. J Am Coll Cardiol 2003; 41 : 961 – 965. doi: 10.1016/ S0735-1097(02)03014-0.
22. Součková L, Opatřilová R, Suk P et al. Impaired bioavailability and antiplatelet effect of high-dose clopidogrel in patients after cardiopulmonary resuscitation (CPR). Eur J Clin Pharmacol 2013; 69 : 309 – 317. doi: 10.1007/ s00228-012-1360-0.
23. Osmancik P, Jirmar R, Hulikova K et al. A comparison of the VASP index between patients with hemodynamically complicated and uncomplicated acute myocardial infarction. Catheter Cardiovasc Interv 2010; 75 : 158 – 166. doi: 10.1002/ ccd.22248.
24. Motovska Z, Ondrakova M, Doktorova M et al. Severe left ventricular systolic dysfunction is independently associated with high on-clopidogrel platelet reactivity. Am J Cardiovasc Drugs 2014; 14 : 313 – 318. doi: 10.1007/ s40256-014-0074-3.
25. Angiolillo DJ, Fernández-Ortiz A, Bernardo E et al. High clopidogrel loading dose during coronary stenting: effects on drug response and interindividual variability. Eur Heart J 2004; 25 : 1903 – 1910. doi: 10.1016/ j.ehj.2004.07.036.
26. Patti G, Colonna G, Pasceri V et al. Randomized trial of high loading dose of clopidogrel for reduction of periprocedural myocardial infarction in patients undergoing coronary intervention: results from the ARMYDA-2 (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty) study. Circulation 2005; 111 : 2099 – 2106. doi: 10.1161/ 01.CIR.0000161383.06692.D4.
27. Mega JL, Close SL, Wiviott SD et al. Cytochrome P450 genetic polymorphisms and the response to prasugrel relationship to pharmacokinetic, pharmacodynamic, and clinical outcomes. Circulation 2009; 119 : 2553 – 2560. doi: 10.1161/ CIRCULATIONAHA.109.851949.
28. Aradi D, Storey RF, Komócsi A et al. Expert position paper on the role of platelet function testing in patients undergoing percutaneous coronary intervention. Eur Heart J 2014; 35 : 209 – 215. doi: 10.1093/ eurheartj/ eht375.
29. Bonaca MP, Bhatt DL, Cohen M et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015; 372 : 1791 – 1800. doi: 10.1056/ NEJMoa1500857.
30. Mauri L, Kereiakes DJ, Yeh RW et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371 : 2155 – 2166. doi: 10.1056/ NEJMoa1409312.
31. Udell JA, Bonaca MP, Collet JP et al. Long-term dual antiplatelet therapy for secondary prevention of cardiovascular events in the subgroup of patients with previous myocardial infarction: a collaborative meta-analysis of randomized trials. Eur Heart J 2016; 37 : 390 – 399. doi: 10.1093/ eurheartj/ ehv443.
32. Wiley B, Fuster V. The concept of the polypill in the prevention of cardiovascular disease. Ann Glob Health 2014; 80 : 24 – 34. doi: 10.1016/ j.aogh.2013.12.008.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2016 Issue 2
-
All articles in this issue
- Dapagliflozin a studie DECLARE – budoucnost léčby diabetes mellitus?
- Fixní kombinační léčba hypertenze
- Léčba hypertenze z pohledu ambulantního lékaře
- Fixní kombinace s hypolipidemiky
- Fixní kombinace antidiabetik
- Fixní kombinace v antiagregační léčbě
- Fixní kombinace v pneumologii
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Použití rivaroxabanu v prevenci cévní mozkové příhody u pacienta s chronickým srdečním selháním a nevalvulární fibrilací síní – kazuistika
- Vedolizumab v léčbě idiopatických střevních zánětů
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Fixní kombinace s hypolipidemiky
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Fixní kombinační léčba hypertenze
- Fixní kombinace v pneumologii
