Fixní kombinace s hypolipidemiky
Fixed-dose combinations in dyslipidemy treatment
Combination pharmacotherapy is frequently being used in patients at high cardiovascular risk due to an accumulation of risk factors. Potential and real drug-drug interactions represent one of the important barriers to implementing guideline-recommended treatment strategies, but even more important might be decreasing adherence. One of the most feasible options seems to be fixed-dose combinations that have been used for the treatment of arterial hypertension and diabetes for some time. There are a few fixed-dose combinations of lipid lowering drugs currently available, such as the statin + ezetimibe combo and, more recently, statin + fenofibrate. The option of fixed-dose combinations of a lipid lowering agent with another representative drug class will soon become available. This will result in a simplification of drug regime, leading to better adherence to pharmacological treatment and a consequent reduction of residual cardiovascular risk.
Keywords:
statins – fibrates – ezetimibe – antihypertensives – fixed-dose combinations – residual risk – dyslipidemia
Authors:
M. Vráblík
Authors‘ workplace:
Centrum preventivní kardiologie, III. interní klinika 1. LF UK a VFN v Praze
Published in:
Kardiol Rev Int Med 2016, 18(2): 98-103
Overview
Kombinační farmakoterapii volíme u pacientů s vysokým kardiovaskulárním rizikem na podkladě kumulace rizikových faktorů velmi často. Bariérou pro zvyšování tabletové nálože jsou nejen potenciální i skutečné lékové interakce, ale především klesající adherence. Možnost řešení představují fixní kombinace léčiv užívané delší dobu pro terapii arteriální hypertenze či diabetu. Máme k dispozici i fixní kombinace hypolipidemik: delší dobu statin + ezetimib, nověji statin + fibrát. Rozšiřují se použití kombinací účinných látek z více lékových skupin, a tak můžeme indikovat kombinaci antihypertenziva (amlodipinu) a hypolipidemika (statinu). Nejbližší budoucnost přinese rozšíření těchto možností a lze předpokládat další zjednodušení terapie pro pacienty s následným zlepšením adherence k léčbě. Konečným výsledkem těchto snah by mělo být snížení reziduálního kardiovaskulárního rizika.
Klíčová slova:
statiny – fibráty – ezetimib – antihypertenziva – fixní kombinace – reziduální kardiovaskulární riziko – dyslipidemie
Snižování kardiovaskulárního (KV) rizika představuje většinou komplexní snahu o ovlivnění řady současně se vyskytujících rizikových faktorů. Protože se efekt jednotlivých rizikových faktorů na vznik a průběh aterosklerózy nesčítá, ale násobí, představuje kumulace rizik zvláště nebezpečnou situaci. Při zvyšující se prevalenci stavů spojených s inzulinovou rezistencí, která je vždy spojena s několika velkými rizikovými faktory najednou, se nelze divit, že se zvětšuje populace osob, které musí být léčeny komplexní farmakoterapií. Důkazy z klinických studií, guidelines a klinická zkušenost se shodují a při léčbě velmi vysoce rizikového diabetika 2. typu s dyslipidemií a arteriální hypertenzí musíme používat minimálně kombinaci metforminu se statinem, blokátorem systému renin-angiotenzin-aldosteron (RAAS) a ten ještě většinou s dalším antihypertenzivem [1,2]. Tabletová „nálož“ pacienta tak stoupá a s tím klesá i adherence a šance na to, že pacient bude léčbu správně a dlouhodobě užívat.
Možná nejjednodušším opatřením se v kontextu výše popsaného může zdát požadavek na racionální volbu farmakoterapie. Terapie musí být v první řadě účinná, ale neméně důležitým parametrem výběru je také bezpečnost odrážející se v toleranci léčby. Přitom lze využívat synergických vlastností různých lékových skupin tak, abychom toleranci zlepšili. Typickým příkladem jsou kombinace inhibitorů RAAS s blokátory kalciových kanálů (BKK), jejichž současné podávání snižuje výskyt periferního edému provázejícího užívání samotných BKK až o 80 % [3].
Mezi další postupy zlepšující adherenci patří opakovaně komentované použití fixních kombinací. Ty by měly být využívány, kdykoli se vhodná kombinace ve fixní variantě nabízí, což ostatně uvádějí i poslední doporučené postupy pro terapii arteriální hypertenze i prevenci KV onemocnění [2,4]. Jde ale o obecné tvrzení a fixní kombinace, které máme dostupné pro léčbu diabetu, dyslipidemie a dalších onemocnění, by měly být preferovány vždy, když je kombinační léčba indikována. Zlepšení adherence spojené s využitím fixní kombinace se promítá do účinnosti, a fixní kombinace tak v některých studiích prokázaly dokonce lepší účinnost než použití stejných lékových skupin odděleně [5].
Pro léčbu hypertenze jsou již delší dobu k dispozici fixní kombinace dvou účinných látek (např. ACE inhibitory (ACEI)/ AT1 blokátor + thiazidové diuretikum, ACEI + indapamid, ACEI/ AT1 + BKK, betablokátor + BKK). Nedlouho máme k dispozici také první fixní kombinaci tří antihypertenziv, konkrétně inhibitoru ACE perindoprilu s BKK amlodipinem a diuretikem indapamidem. Jedná se o kombinaci nejčastěji předepisovaných antihypertenziv, jejichž použití podporuje řada důkazů z provedených studií i dlouhodobá příznivá klinická zkušenost s jejich podáváním.
Kombinace hypolipidemik
Základním smyslem indikace hypolipidemik zůstává v monoterapii stejně jako v kombinaci snížení rizika aterotrombotických vaskulárních příhod. Shodný je tedy i hlavní důvod pro volbu kombinace hypolipidemik – snížení kardio - (nebo i cerebro-) vaskulárního rizika nad rámec dosažitelný monoterapií. Tento cíl naplňují strategie hypolipidemické terapie snižující hladiny LDL cholesterolu (LDL-c) a non-HDL cholesterolu (non-HDL-c). Zejména druhý jmenovaný, přestože je podle posledních doporučení evropských společností sekundárním léčebným cílem až po dosažení cílové hodnoty LDL-c, se v poslední době dostává do centra naší pozornosti. Non-HDL-c velmi dobře reflektuje množství aterogenních lipoproteinů souhrnně označovaných jako remnantní částice. Ty vznikají intravaskulární přeměnou chylomikronů a VLDL lipoproteinů a typicky se zmnožují v situacích spojených s hypertriglyceridemií, inzulinovou rezistencí a dalšími příbuznými stavy [6]. Při vzestupu triglyceridů stoupá i relativní zastoupení cholesterolu neseného remnantními lipoproteiny. Ten vstupuje do buněk (vč. makrofágů deponovaných v cévní stěně) prostřednictvím tzv. scavengerového receptoru, který na rozdíl od klasického LDL-receptoru nemá schopnost down-regulace při vzestupu intracelulární koncentrace cholesterolu. Proto je zvýšená nabídka cholesterolu v remnantních částicích velmi důležitým předpokladem vzniku pěnových buněk, typických buněčných elementů aterosklerotické cévní léze [7]. V poslední době si uvědomujeme důležitost sledování a ovlivňování koncentrací remnantních lipoproteinů naléhavěji než dříve i protože důkazy naznačují, že remnantní cholesterol je v určitých situacích citlivějším ukazatelem aterogenního rizika než LDL-c [8].
Důvody indikace kombinace lipidy ovlivňujících léčiv
Na druhé straně si připomeňme, že základním cílem terapie zůstává dosažení doporučené hodnoty LDL-c pro danou kategorii rizika. Z uvedeného vyplývá první důvod pro použití kombinačního hypolipidemického režimu: nedosažení cílové hodnoty LDL-c při maximální tolerované dávce statinu. U části nemocných taková situace nastane v důsledku velmi vysokých iniciálních hodnot lipidů před léčbou. Za příklad slouží typicky pacienti s familiární hypercholesterolemií, jejichž LDL-cholesterolemie před léčbou nezřídka dosahují hodnot 8 i více mmol/ l. Vezmeme-li v úvahu maximální efekt statinové léčby (přibližně 50% pokles LDL-c), nelze u těchto nemocných dosažení cílové hodnoty LDL-c při monoterapii očekávat, zejména když poslední doporučení posunuly cílovou hodnotu LDL-c pro nemocné s familiární hypercholesterolemií na méně než 2,5 mmol/ l [9]. Druhou, možná ještě četnější skupinou léčených, u nichž k potřebnému snížení LDL-c potřebujeme kombinaci, jsou pacienti s intolerancí dostatečné dávky statinu. Přestože statiny považujeme nadále za velmi dobře tolerovaná léčiva, s ohledem na jejich rozšiřující se indikace se absolutní počet pacientů nesnášejících dostatečnou dávku statinu k dosažení cílové hodnoty LDL-c zvyšuje. V některých pozorováních z „reálné klinické praxe“ takových nemocných bylo i více než 15 % [10].
Dalším důvodem pro kombinaci hypolipidemik je snaha o komplexní ovlivnění všech složek plazmatického lipoproteinového spektra. Víme, že právě triglyceridemie a koncentrace HDL-c při léčbě statiny rozhoduje o prognóze léčených, což odpovídá současným poznatkům o zmnožení lipoproteinových remnantů spojených s hypertriglyceridemií. Jinými slovy nemocný dosahující velmi nízké hladiny LDL-c (< 1,8 mmol/ l) má při trvající hypertriglyceridemii o polovinu vyšší riziko ve srovnání s pacientem s triglyceridy v normálním rozmezí (obr. 1) [11].
![TG a HDL-c a riziko při terapii statinem [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/74997f03749f2d5b94c281f535ce2bc6.png)
Asi v současnosti nejméně běžný, ale jistě možný důvod pro kombinaci hypolipidemik, představuje využití pleiotropních, mimolipidových účinků jednotlivých léčiv. Příkladem takové indikace může být přidání fibrátu ke statinu u diabetika s mikrovaskulárními komplikacemi [12]. Je pravdou, že v současnosti není tato indikace běžně používána ani schválena, ale představuje možnost, kterou můžeme využívat v individuálních případech.
Fixní kombinace statin + ezetimib
Při volbě vhodného statinu do kombinace se můžeme řídit farmakologickými vlastnostmi jednotlivých molekul určujícími jejich potenciál k lékovým interakcím [13]. Nedůležitější zdroj informací o kombinovatelnosti hypolipidemik nalezneme ale v klinických studiích a v nich dominují ty založené možná překvapivě na simvastatinu, který má větší potenciál pro vznik interakcí ve srovnání s novějšími molekulami. Můžeme tedy říci, že při pečlivé volbě kandidátů pro hypolipidemickou kombinaci a jejich náležitém monitorování (což bývá v klinických hodnoceních pravidlem) není bezpečnost kombinací problém.
Fixní kombinace simvastatinu s ezetimibem je v klinickém použití již delší dobu. Využitím komplementárního mechanizmu účinku (blokáda endogenní syntézy cholesterolu a snížení absorpce exogenního cholesterolu z potravy) se prohlubuje LDL-snižující efekt kteréhokoli statinu o dalších 20 % [14]. Ezetimib se sice vstřebává do portální krve, ale podléhá významnému enterohepatálnímu oběhu, takže systémová expozice účinné látce není vyšší než 5 %. I proto není bezpečnost této kombinace problém.
Ezetimib dlouho čekal na definitivní „verdikt“ o svém působení měřeném počtem zabráněných infarktů, cévních mozkových příhod nebo úmrtí. Teprve výsledky studie IMPROVE-IT, která se poprvé v randomizovaném uspořádání zaměřila na testování hypotézy, zda ezetimib podávaný společně se statinem zlepší prognózu nemocných po prodělaném akutním koronárním syndromu více než léčba statinem v monoterapii u více než 18 000 nemocných randomizovaných k léčbě simvastatinem v dávce 40 mg denně nebo ke kombinaci simvastatinu 40 mg + ezetimib 10 mg denně. Nemocní, kteří nedosáhli při této léčbě hladin LDL-c < 2,0 mmol/ l, byli titrováni k dávce simvastatinu 80 mg denně. Během studie investigátoři zaznamenali 5 250 KV příhod. Průměrná hladina LDL-c dosažená na konci studie u léčených samotným simvastatinem byla 1,8 mmol/ l a u pacientů léčených kombinací 1,38 mmol/ l.
Primárním sledovaným ukazatelem byla kombinace úmrtí z KV příčin, infarktu myokardu, nestabilní anginy pectoris, koronární revaskularizace a cévní mozkové příhody. Ve skupině léčené monoterapií bylo zaznamenáno o 170 příhod více než mezi pacienty léčenými kombinací (34,7 vs. 32,7; %, p = 0,016), což odpovídá poklesu rizika o 6,4 % ve prospěch kombinace simvastatin + ezetimib. Celková mortalita ve studii nebyla ovlivněna. K zabránění jedné příhodě (NNT) bylo nutno léčit 50 pacientů po dobu šesti let (medián sledování ve studii). Léčbu před ukončením studie přerušilo 42 % pacientů shodně v obou léčebných ramenech. Zajímavý byl nález významně většího snížení rizika u diabetiků 2. typu a nemocných starších 65 let. Autoři rovněž dokumentovali příznivý bezpečnostní profil s dobrou tolerancí obou léčebných režimů. Výsledky studie jednoznačně zapadají do kontextu předchozích klinických studií s hypolipidemickou léčbou a odpovídají také dosaženému rozdílu v průměrných koncentracích LDL-c mezi léčebnými rameny. Ukončení studie IMPROVE-IT a její výsledky jsou velmi důležitým mezníkem nejen pro ezetimib, který dosud čekal na potvrzení svého místa v ovlivnění dyslipidemie a především vaskulárního rizika, ale i z hlediska základní teze managementu dyslipidemie: čím nižší LDL-c, tím nižší riziko aterotrombotických příhod (tedy známé „čím níže, tím lépe“). Dosahování hodnot LDL-c dokonce pod 1,5 mmol/ l u nemocným s velmi vysokým rizikem nejen neškodí, ale prospívá. Navíc máme poprvé k dispozici výsledky pro léčbu, která prokázala aditivní efekt při terapii statinem vedené k dosažení v současnosti platných cílových hodnot LDL-c. Vzkazem studie IMPROVE-IT pro každodenní praxi je vhodnost širšího použití ezetimibu u všech vysoce rizikových nemocných nedosahujících při maximální nebo maximálně tolerované dávce statinu cílové hodnoty LDL-c [15].
V současnosti je připravena fixní kombinace ezetimibu s atorvastatinem i rosuvastatinem, které sice ještě nebyly uvedeny na český trh, ale jejich příchod lze očekávat v krátkém časovém horizontu. Kombinace ezetimibu s těmito modernějšími a účinnějšími statiny je již delší dobu používána ve volné kombinaci léčiv, máme s ní dobrou vlastní zkušenost a disponuje i doklady z menších klinických studií [16].
S ohledem na vyšší hypolipidemickou účinnost atorva - a rosuvastatinu lze počítat s tím, že použití těchto fixních kombinací přivede větší procento pacientů k cílovým hodnotám LDL-c, jak naznačily výše komentované práce [16].
Fixní kombinace statin + fenofibrát
Použití kombinace statinu s fibrátem stále nepovažujeme za běžné. Často slyšíme srovnání s oblastí léčby hypertenze, kde kombinační léčba zdomácněla a více než tři čtvrtiny hypertoniků dnes užívá více než jeden lék ke kontrole vysokého krevního tlaku. Podobnost hypolipidemik s antihypertenzivy ale končí u faktu, že tato léčiva používáme k ovlivnění dvou nejdůležitějších rizikových faktorů aterosklerózy a jejích komplikací. V dalších podstatných aspektech najdeme řadu rozdílů. V první řadě, primárním léčebným cílem při ovlivňování dyslipidemie zůstává LDL-c a jeho hladiny spolehlivě ovlivňuje statin [1]. Kombinace s fibrátem tento efekt většinou podstatným způsobem neprohlubuje. Ve srovnání se statiny disponují fibráty menším množstvím „důkazního materiálu“ o benefitu spojeném s jejich podáváním v různých klinických situacích a u různých skupin pacientů. Proto přidání fibrátu k monoterapii statinem zvažujeme ve vybraných případech a rozhodně nejde o univerzálně použitelné schéma. Většímu rozšíření kombinační hypolipidemické strategie zahrnující statin a fibrát brání také opakovaně znějící argument: v situaci, kdy vysoce rizikoví nemocní musí užívat množství „povinné“ medikace, která prokazatelně ovlivňuje jejich prognózu, nezbývá na přidání fibrátu místo. Svou úlohu sehrává obava nemocných (ale i lékařů) z lékových interakcí, většího výskytu nežádoucích účinků, snížení adherence k léčbě při zvýšení počtu tablet.
Co víme o kombinaci statinu s fenofibrátem z klinických studií?
Stále máme k dispozici pouze jedinou klinickou studii, která sledovala výskyt KV příhod při současném podávání statinu a fibrátu. Výsledky lipidové větve studie ACCORD byly mnohokrát prezentovány, publikovány a diskutovány [17,18]. Stejně jako v předchozích fibrátových sledováních nezlepšovalo přidání fenofibrátu k terapii simvastatinem v uvedené studii prognózu nemocných bez aterogenní smíšené dyslipidemie. U podskupiny přibližně 20 % zařazených diabetiků, kteří měli vyšší triglyceridy a nízkou koncentraci HDL-c, dokumentovala studie dva důležité aspekty: za prvé dramatické navýšení KV rizika u této podskupiny ve srovnání s pacienty bez takto charakterizované dyslipidemie (relativní riziko bylo vyšší o 70 %) a za druhé jeho účinné snížení přidáním fenofibrátu (pokles relativního rizika o 31 %) [19]. Studie předložila také důkazy o bezpečnosti a dobré toleranci kombinační léčby a navíc opět v podstudii cílené na mikrovaskulární komplikace prokázala zpomalení progrese diabetické retinopatie a dalších známek mikrovaskulárního poškození [20]. Statiny ve studii ACCORD reprezentoval simvastatin podávaný v dávce 40 mg denně. Tato volba vyvolala řadu otázek a spekulací, proč právě tento a ne některý z modernějších a účinnějších statinů. Zopakujme, že volba simvastatinu v době přípravy návrhu studie představovala nejčastěji používanou alternativu. Navíc simvastatin má důkazy pro řadu klinických situací a patří i dnes mezi nejlépe dokumentované statiny. Účinnost této medikace ve zvolené dávce jistě nedosahuje účinku atorva - či rosuvastatinu, ale u řady nemocných snížení LDL-c o 35 – 40 % dostačuje k dosažení cílové hodnoty LDL-c pro danou kategorii rizika. Relativně horší bezpečnostní profil simvastatinu vedoucí americkou lékovou agenturu k vydání bezpečnostního varování před použitím této molekuly v dávce 80 mg se ve studii ACCORD nijak neprojevil. Naopak, tolerance kombinace simvastatinu s fenofibrátem byla srovnatelná s monoterapií samotným statinem a výskyt závažných nežádoucích účinků byl vzácný (myotoxicita se vzestupem kreatinkinázy na 10násobek horního limitu normy byla pozorovaná u 0,4, resp. 0,3 % sledovaných v aktivní, resp. placebové části studie). Navíc podstudie ACCORD Eye zaměřená na sledování vlivu terapie fenofibrátem na progresi diabetické retinopatie opět dokumentovala významně příznivý vliv fenofibrátu, který snižoval progresi onemocnění o více než třetinu [17,20]. Tento efekt předčil vliv těsné kontroly diabetu v diabetologické části studie a navíc s nesrovnatelně lepším bezpečnostním profilem „fenofibrátového přístupu“ (obr. 2).
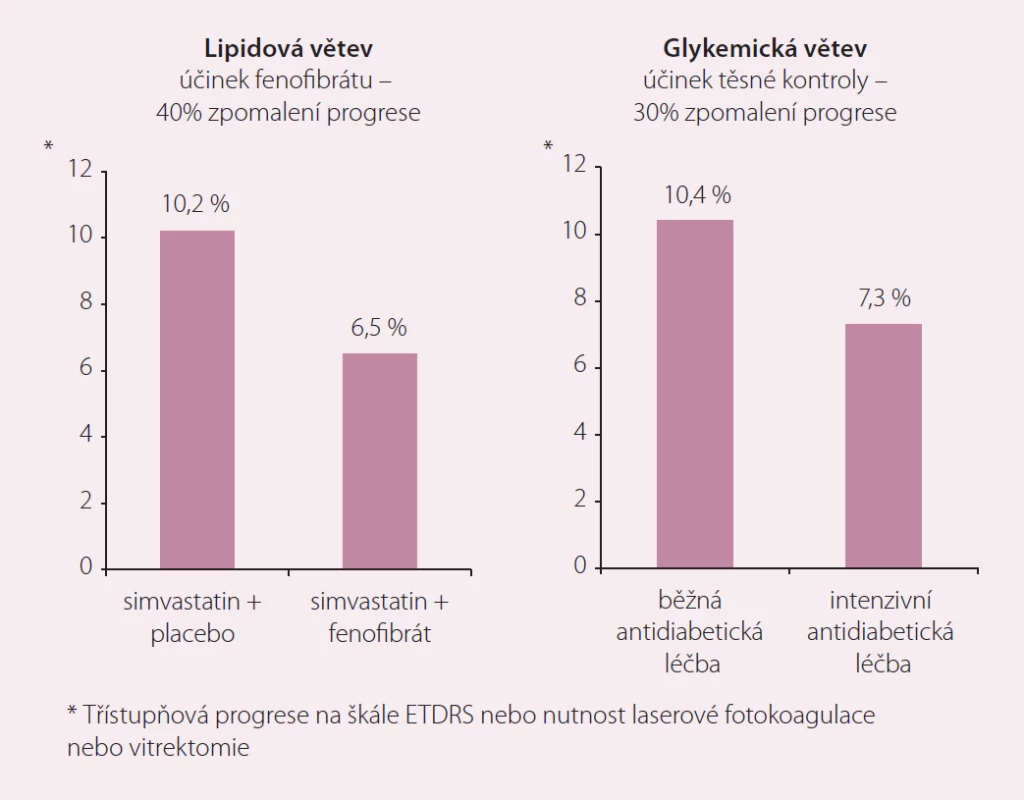
Fibráty tedy mají své místo v terapii zejména u nemocných se smíšenou dyslipidemií v kontextu inzulinové rezistence a diabetu 2. typu. Platí to i v kombinaci se statinem, kde představují možnost, jak snížit reziduální vaskulární riziko nemocných.
Kombinace statinu a fibrátu: jak dále?
Logickým trendem farmakoterapie nejen v KV oblasti jsou v poslední době fixní kombinace. Není divu, že první fixní kombinaci statinu s fenofibrátem máme už k dispozici. Obsahuje simvastatin v dávce 20 nebo 40 mg spolu s uniformní dávkou fenofibrátu ve formě nanočástic v množství 145 mg. Tato poslední léková forma fenofibrátu zlepšila dále biologickou dostupnost léčiva po perorálním podání, a umožnila tak snížení celkového množství podávané látky při zachování efektu odpovídajícímu přibližně 215 mg mikronizovaného fenofibrátu [21]. Navíc byla odbourána závislost na podávání s jídlem, kterou předchozí lékové formy fenofibrátu měly. Tato kombinace byla testována v mezinárodní randomizované placebem kontrolované studii, která prokázala (předpokládanou) účinnost fixní kombinace (obr. 3) [22].
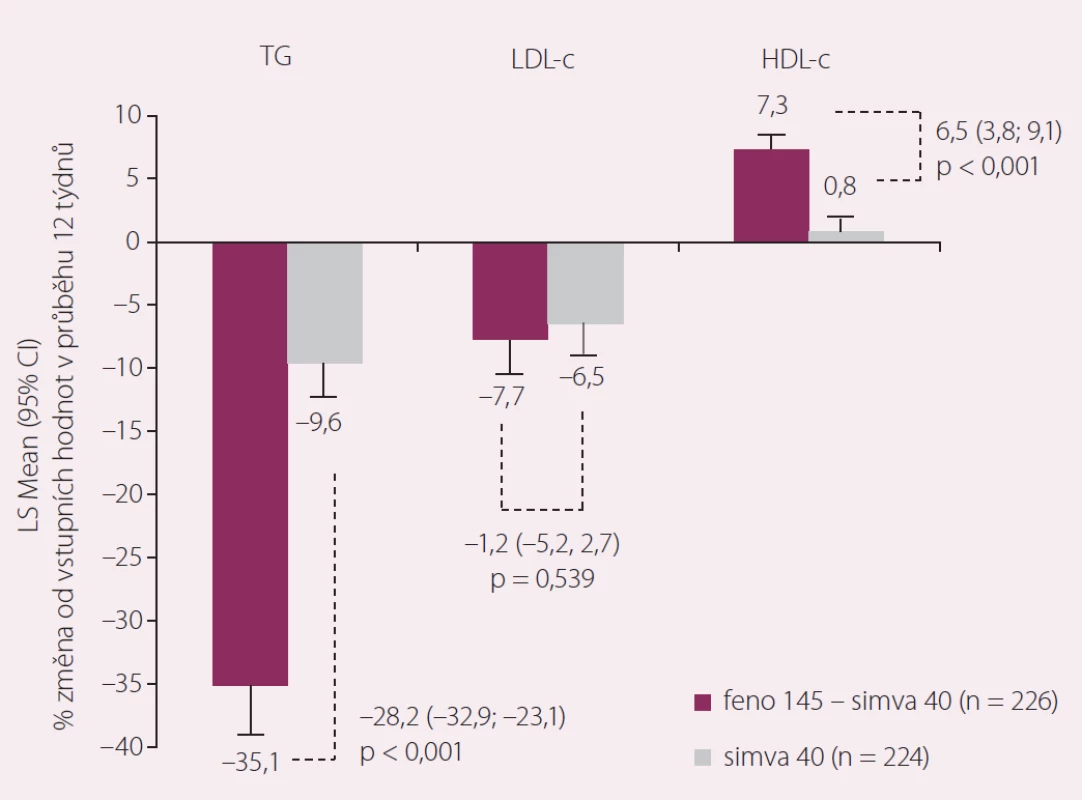
Zařazeni byli nediabetici se smíšenou dyslipidemií nedostatečně kontrolovanou terapií statinem. Použitá kombinace snižovala triglyceridy a vedla k vzestupu hladin HDL-c významně více než monoterapie 40 mg simvastatinu. Přitom výskyt nežádoucích účinků byl řídký a nebyl odlišný mezi monoterapií statinem a kombinační léčbou. Za prakticky důležité musíme považovat zvýšení sérové koncentrace kreatininu, které podávání fenofibrátu pravidelně provází a nebylo tomu jinak ani v testování uvedené kombinace. S tímto efektem musíme počítat, ale není třeba se jej vůbec obávat. Vzestup kreatininu působí dosud ne zcela objasněný extrarenální mechanizmus a nikoli snížení clearance kreatininu. Kromě toho, že se kreatinin vrací při vysazení fenofibrátu k normě, je prokázáno, že efekt fenofibrátu na renální funkci je protektivní – pokles albuminurie pozorovaný ve všech fenofibrátových studiích sledujících tento parametr odráží renální mikrovaskulární ochranu zprostředkovanou fenofibrátem [23].
Argumentace pro použití simvastatinu při tvorbě fixní kombinace se může omezit na konstatování, že právě tato kombinace má jako jediná data z dlouhodobé studie sledující výskyt příhod (výše zmíněná studie ACCORD). Prakticky bude fixní kombinace vhodná u nemocných s přetrvávající hypertriglyceridemií při terapii statinem, typicky u nemocných s metabolickým syndromem, prediabetem nebo diabetem 2. typu. Důležité je, že tito nemocní nemusí mít výrazné zvýšení hladin LDL-c a hypolipidemická potence simvastatinu v dávce 40 mg denně přivede řadu z nich spolehlivě k cílovým hodnotám léčby. Od fenofibrátu sice neočekáváme další pokles LDL-c, ale jistě navozuje změnu distribuce velikosti LDL částic, které posouvá směrem k větším a méně denzním s menším aterogenním potenciálem. Fenofibrát obsažený ve fixní kombinaci s sebou přináší výše probrané mikrovaskulární benefity a navíc snižuje hladinu kyseliny močové, fibrinogenu a redukuje agregační pohotovost trombocytů [24]. Jak ukazují klinické studie, nemocných z uvedených kategorií charakterizovaných inzulinovou rezistencí s potenciálním prospěchem z kombinační hypolipidemické léčby je nejméně 20 %. Fixní kombinace přispěje ke zlepšení výsledků léčby především zlepšením adherence nemocných. Přitom dávkové schéma obou složek je jednoduché a naplňuje klinickou potřebu. Jak shrnují metaanalýzy provedených studií, přináší přidání fibrátu k medikaci u správně vybraných nemocných nejen zlepšení kontroly dyslipidemie, příznivé ovlivnění mikrovaskulatury, ale také snížení rizika především koronárních příhod [25,26].
Brzy se dočkáme nových fixních kombinací fenofibrátu s rosuvastatinem a pravděpodobně i atorvastatinem, které při vyšší účinnosti použitých statinů využijeme i u osob s výraznějšími elevacemi LDL-c, případně non-HDL-c.
Fixní kombinace hypolipidemik a dalších léčiv
Kromě fixních kombinací dvou léčiv ovlivňujících hladiny aterogenních lipoproteinů máme k dispozici i tablety kombinující statin s antihypertenzivem. Několik let využíváme fixní kombinaci atorvastatinu s amlodpinem. Tato kombinace hypolipidemika a antihypertenziva má ověřenou synergickou účinnost v rozsáhlé studii ASCOT, jež dokumentovala pokles relativního rizika KV příhody o více než jednu třetinu právě při použití léčby založené na této (byť ne fixní) kombinaci léčiv, případně „obohacené“ perindoprilem [27]. Fixní kombinace dvou látek z různých lékových skupin přivádí do praxe úvahu z úvodu tohoto článku. Maximální ovlivnění KV rizika je možné při intervenci cílené současně na více rizikových faktorů. Kombinací dvou léčiv s dlouhým biologickým poločasem, klinicky ověřenou dobrou snášenlivostí a účinností, která je v kombinaci dokonce lepší než v monoterapii, představuje fixní kombinace atorvastatinu s amlodipinem vhodnou volbu pro široké spektrum nemocných. Navíc víme, že současné zahájení antihypertenzivní a hypolipidemické terapie zvyšuje šanci na dosažení dobré adherence o jednu třetinu [28].
Dobré zprávy v oblasti vývoje fixních kombinací nekončí. V nejbližší době se dočkáme fixní trojkombinace vycházející ze zkušeností studie ASCOT: tedy kombinace dvou antihypertenziv (amlodipin + perindopril) a hypolipidemika (atorvastatin). S ohledem na velmi širokou indikaci použitých antihypertenziv i statinu zvoleného pro tuto fixní kombinaci jde o trojkombinaci vhodnou pro širokou skupinu pacientů v úvodu léčby i jako její pokračování. Zásadní argument představuje synergie působení zvolených účinných látek z hlediska ovlivnění progrese aterosklerózy doložená poklesem rizika koronárních příhod ve výše zmíněné studii ASCOT o více než 50 % [29].
Dávkování první fixní trojkombinace bude v širokém rozmezí atorvastatinu 10 – 40 mg, perindoprilu i amlodipinu ve shodných gramážích 5 – 10 mg. Budeme tedy mít vhodné dávkování pro pacienty zahajující terapii i pro případnou titraci v rámci pěti dostupných dávkovacích schémat.
Je potěšitelné, že fixní kombinace dvou antihypertenziv se statinem přichází do klinického použití těsně po publikaci další z řady studií, která na velkém souboru pacientů se středním KV rizikem doložila účinnost a bezpečnost současné intervence arteriální hypertenze a dyslipidemie. Studie HOPE 3 publikovaná v březnu letošního roku ukázala, že terapie hypertenze (candesartan + hydrochlorothiazid) a dyslipidemie (rosuvastatin) měla u osob s krevním tlakem v nejvyšším tercilu (tedy u osob, které potřebovaly jeho redukci) synergický vliv na výskyt cévních příhod, jejichž riziko tato kombinace snížila o 40 % (obr. 4) [30].
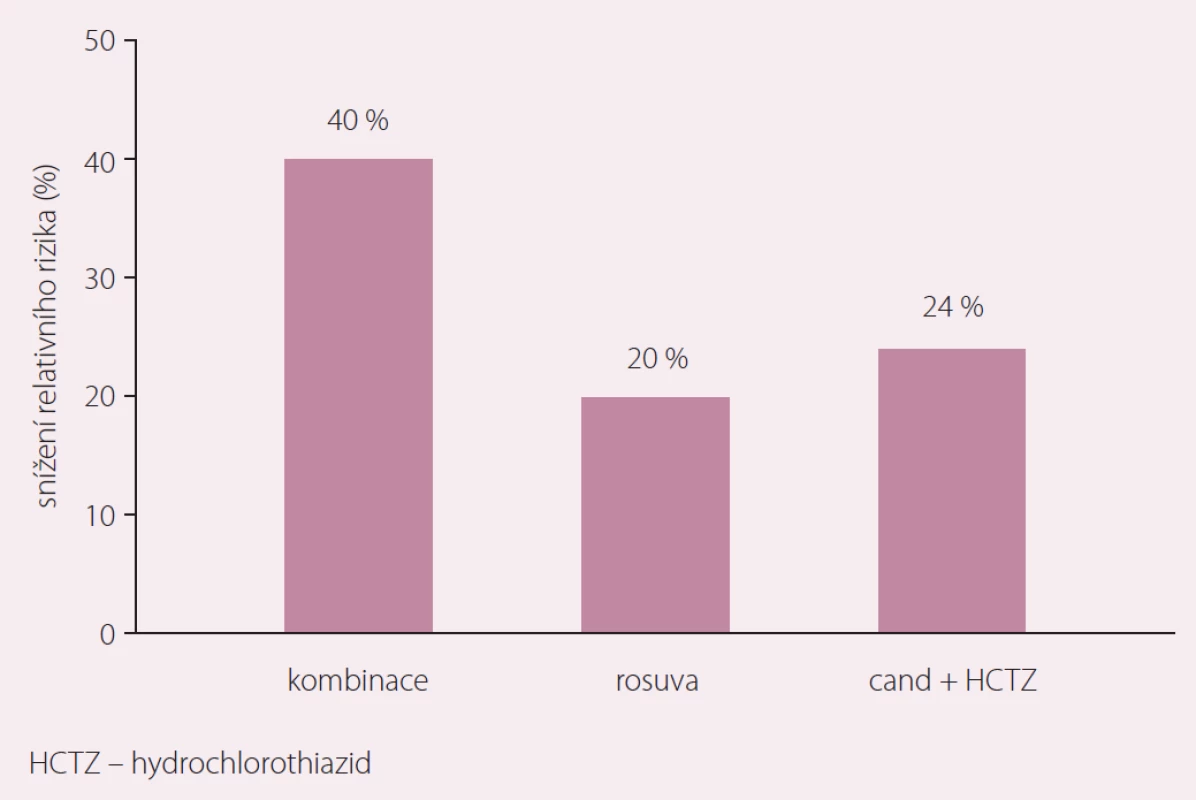
Částečně podpořeno grantem AZV 1528277A.
Doručeno do redakce: 19. 4. 2016
Přijato po recenzi: 28. 4. 2016
doc. MU Dr. Michal Vrablík, Ph.D.
www.vfn.cz
vrablikm@seznam.cz
Sources
1. Catapano AL, Reiner Z, De Backer G et al. ESC/ EAS Guidelines for the management of dyslipidaemias. Atherosclerosis 2011; 217 : 3 – 46.
2. Perk J, De Backer G, Gohlke H et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The fifth joint task force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012; 33 : 1635 – 1701. doi: 10.1093/ eurheartj/ ehs092.
3. Makani H, Bangalore S, Romero J et al. Effect of renin-angiotensin system blockade on calcium channel blocker-associated peripheral edema. Am J Med 2011; 124 : 128 – 135. doi: 10.1016/ j.amjmed.2010.08.007.
4. Filipovský J, Widimský J jr., Ceral J et al. Diagnostické a léčebné postupy u arteriální hypertenze – verze 2012. Doporučení České společnosti pro hypertenzi. Vnitř Lék 2012; 58 : 785 – 801.
5. Hatala R, Pella D, Hatalová K et al. Optimization of blood pressure treatment with fixed-combination perindopril/ amlodipine in patients with arterial hypertension. Clin Drug Investig 2012; 32 : 603 – 612. doi: 10.2165/ 11634530-000000000-00000.
6. Varbo A, Benn M, Nordestgaard BG. Remnant cholesterol as a cause of ischemic heart disease: evidence, definition, measurement, atherogenicity, high risk patients, and present and future treatment. Pharmacol Ther 2014; 141 : 358 – 367. doi: 10.1016/ j.pharmthera.2013.11.008.
7. Nordestgaard BG, Wootton R, Lewis B. Selective retention of VLDL, IDL, and LDL in the arterial intima of genetically hyperlipidemic rabbits in vivo. Molecular size as a determinant of fractional loss from the intima-inner media. Arterioscler Thromb Vasc Biol 1995; 15 : 534 – 542.
8. Varbo A, Benn M, Tybjærg-Hansen A et al. Remnant cholesterol as a causal risk factor for ischemic heart disease. J Am Coll Cardiol 2013; 61 : 427 – 436. doi: 10.1016/ j.jacc.2012.08.1026.
9. Nordestgaard BG, Chapman MJ, Humphries SE et al. Familial hypercholesterolemia is underdiag-nosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease. Eur Heart J 2013; 34 : 3478 – 3890. doi: 10.1093/ eurheartj/ eht273.
10. Bruckert E, Hayem G, Dejager S et al. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients-the PRIMO study. Cardiovasc Drugs Ther 2005; 19 : 403 – 414.
11. Barter P, Gotto AM, LaRosa JC et al. HDL cholesterol, very low levels of LDL cholesterol and cardiovascular events. N Engl J Med 2007; 357 : 1301 – 1310.
12. The ACCORD Study Group and ACCORD Eye Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 363 : 233 – 244. doi: 10.1056/ NEJMoa1001288.
13. Vrablík M. Není statin jako statin aneb jeden dělá to a co ten druhý? Practicus 2012; 6 : 13 – 15.
14. Davidson MH, Ballantyne CM, Kerzner B et al. Efficacy and safety of ezetimibe coadministered with statins: randomised, placebo-controlled, blinded experience in 2382 patients with primary hypercholesterolemia. Int J Clin Pract 2004; 58 : 746 – 755.
15. Cannon CP, Blazing MA, Giugliano RP et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372 : 2387 – 2397. doi: 10.1056/ NEJMoa1410489.
16. Roth EM, Rosenson RS, Jones PH et al. Attainment of goal/ desirable lipid levels in patients with mixed dyslipidemia after 12 weeks of treatment with fenofibric acid and rosuvastatin combination therapy: a pooled analysis of controlled studies. J Clin Lipidol 2012; 6 : 534 – 544. doi: 10.1016/ j.jacl.2012.02.002.
17. Ginsberg HN, Elam MB, Lovato LC et al. ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362 : 1563 – 1574. doi: 10.1056/ NEJMoa1001282.
18. Vrablík M. Studie ACCORD lipid: první data o vlivu kombinace statinu s fibrátem na výskyt příhod. Remedia 2010; 20 : 44 – 46.
19. Scott R, O’Brien R, Fulcher G et al. Effects of fenofibrate treatment on cardiovascular disease risk in 9795 individuals with type 2 diabetes and various components of the metabolic syndrome. Diabetes Care 2009; 32 : 493 – 498. doi: 10.2337/ dc08-1543.
20. Chew EY, Ambrosius WT, Davis MD et al. The ACCORD Study Group and ACCORD Eye Study Group. Effects of combination lipid therapy in type 2diabetes mellitus. N Engl J Med 2010; 363 : 233 – 244. doi: 10.1056/ NEJMoa1001288.
21. Cha KH, Cho KJ, Kim MS et al. Enhancement of the dissolution rate and bioavailability of fenofibrate by a melt-adsorption method using supercritical carbon dioxide. Int J Nanomedicine 2012; 7 : 5565 – 5575. doi: 10.2147/ IJN.S36939.
22. Foucher C, Aubonnet P, Reichert P et al. Cholib study Investigators. New fixed-dose combinations of fenofibrate/ simvastatin therapy significantly improve the lipid profile of high-risk patients with mixed dyslipidemia versus monotherapies. Cardiovasc Ther 2015; 33 : 329 – 337. doi: 10.1111/ 1755-5922.12148.
23. Noonan JE, Jenkins AJ, Ma JX et al. An update on the molecular actions of fenofibrate and its clinical effects on diabetic retinopathy and other microvascular end points in patients with diabetes. Diabetes 2013; 62 : 3968 – 3975. doi: 10.2337/ db13-0800.
24. Saha SA, Arora RR. Fibrates in the prevention of cardiovascular disease in patients with type 2 diabetes mellitus – a pooled metaanalysis of randomized placebo-controlled clinical trials. Int J Cardiol 2010; 141 : 157 – 166. doi: 10.1016/ j.ijcard.2008.11.211.
25. Jun M, Foote C, Lv J et al. Effects of fibrates on cardiovascular outcomes: review and meta-analysis. Lancet 2010; 375 : 1875 – 1884. doi: 10.1016/ S0140-6736(10)60656-3.
26. Vrablík M. Reziduální riziko kardiovaskulárních příhod. Medicína po promoci 2009; 10 : 60 – 64.
27. Sever PS, Dahlöf B, Poulter NR et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial – Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet 2003; 361 : 1149 – 1158.
28. Chapman RH, Benner JS, Petrilla AA et al. Predictors of adherence with antihypertensive and lipid-lowering therapy. Arch Intern Med 2005; 165 : 1147 – 1152.
29. Sever P, Dahlöf B, Poulter N et al. Potential synergy between lipid-lowering and blood-pressure lowering in the Anglo-Scandinavian Cardiac Outcomes Trial. Eur Heart J 2006; 27 : 2982 – 2988.
30. Yusuf S, Lonn E, Pais P et al. HOPE-3 Investigators. Blood-pressure and cholesterol lowering in persons without cardiovascular disease. N Engl J Med 2016. In press.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2016 Issue 2
-
All articles in this issue
- Dapagliflozin a studie DECLARE – budoucnost léčby diabetes mellitus?
- Fixní kombinační léčba hypertenze
- Léčba hypertenze z pohledu ambulantního lékaře
- Fixní kombinace s hypolipidemiky
- Fixní kombinace antidiabetik
- Fixní kombinace v antiagregační léčbě
- Fixní kombinace v pneumologii
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Použití rivaroxabanu v prevenci cévní mozkové příhody u pacienta s chronickým srdečním selháním a nevalvulární fibrilací síní – kazuistika
- Vedolizumab v léčbě idiopatických střevních zánětů
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Fixní kombinace s hypolipidemiky
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Fixní kombinační léčba hypertenze
- Fixní kombinace v pneumologii
