Význam periprocedurálního poklesu tlakového gradientu ve výtokovém traktu levé komory po alkoholové septální ablaci u pacientů s hypertrofickou obstrukční kardiomyopatií
Significance of periprocedural decrease in left ventricular outflow tract gradient after alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy
Introduction:
Alcohol septal ablation (ASA) is one of the non-pharmacological treatment options for highly symptomatic patients with hypertrophic obstructive cardiomyopathy resistant to pharmacotherapy. Objective: The aim of our study was to evaluate the relationship between an intraprocedural decrease in the left ventricular outflow tract gradient (LVOTG) measured invasively during the procedure and the development of clinical and echocardiographic parameters in the early period (3 months) and the later period (12 months) after ASA.
Patients and methods:
Our study included 32 patients, mean age 58.6 ± 12.6 years, who underwent ASA for pharmacoresistant limiting symptoms. The investigated parameters were the following: resting LVOTG, thickness of the interventricular septum and left ventricular posterior wall, left ventricular end-diastolic diameter, left atrium size, left ventricular ejection fraction and NYHA class; evaluated in the 3rd and 12th month after the procedure.
Results:
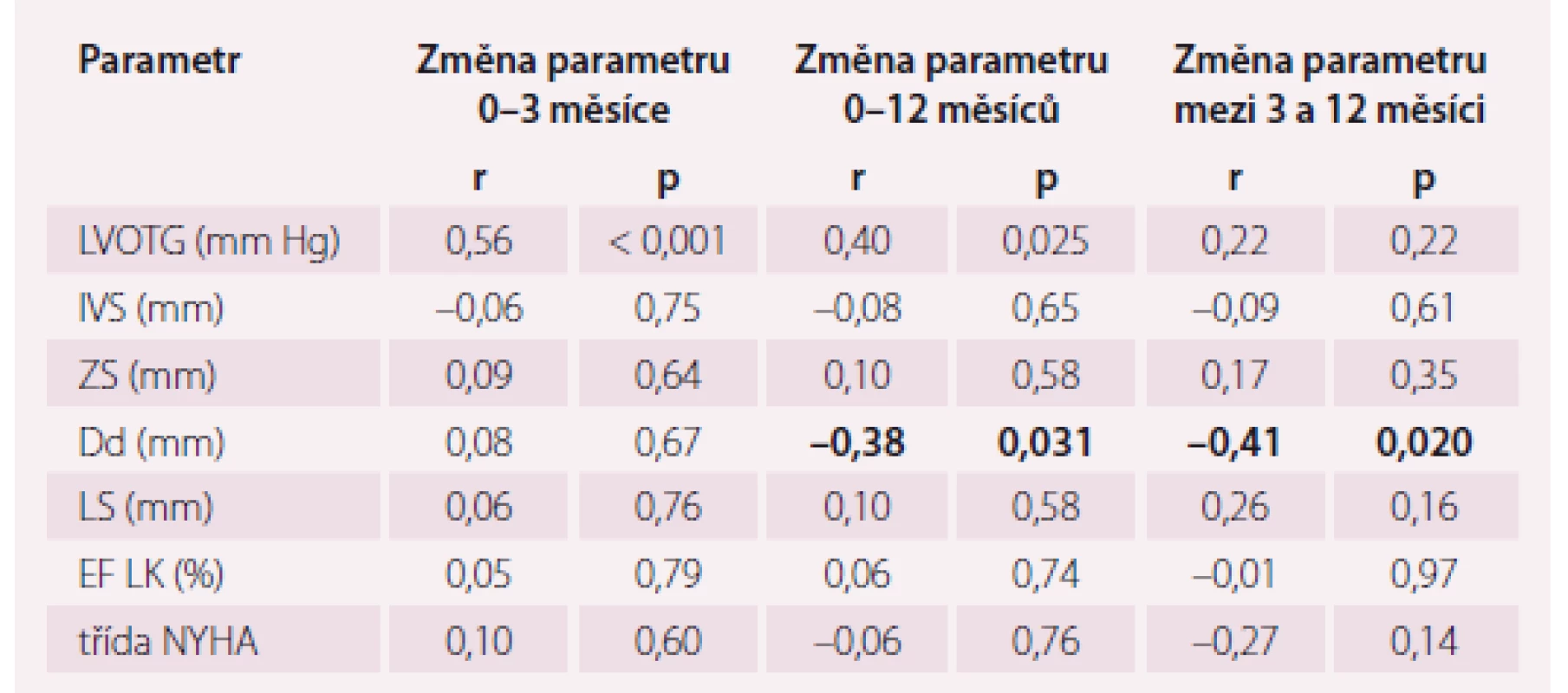
Intraprocedural LVOTG (iLVOTG) change correlated with a change of echocardiographically measured LVOTG during a 0–3-month period (r = 0.56; p < 0.001) and 0–12-month period (r = 0.40; p < 0.05). Correlation between iLVOTG change and change of other echocardiographic parameters and functional status was not found, with the exception of an end-diastolic diameter change in a 0–12-month period (r = –0.39; p < 0.05) and 3–12-month period (r = –0.41; p < 0.05).
Conclusion:
Invasively evaluated intraprocedural decline of LVOTG predicts the later development in LVOTG. The value of LVOTG in the 3rd month can be used to estimate the long-term effect of ASA.
Keywords:
hypertrophic obstructive cardiomyopathy – alcohol septal ablation – echocardiography
Authors:
T. Honěk 1,2; J. Krejčí 1,2; J. Máchal 3,4; L. Groch 1,4; J. Sitár 1,4; J. Meluzín 1,2,4; L. Špinarová 1,2
Authors‘ workplace:
I. interní kardioangiologická klinika FN u sv. Anny v Brně
1; Lékařská fakulta MU, Brno
2; Ústav patologické fyziologie, LF MU, Brno
3; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
4
Published in:
Kardiol Rev Int Med 2016, 18(3): 208-213
Overview
Úvod:
Alkoholová septální ablace (ASA) je jednou z možností nefarmakologické léčby vysoce symptomatických pacientů s hypertrofickou obstrukční kardiomyopatií rezistentních na farmakoterapii.
Cíl:
Cílem práce bylo zhodnotit vztah intraprocedurálního poklesu gradientu ve výtokovém traktu levé komory (LVOTG) měřeného invazivně v průběhu výkonu na vývoj klinických a echokardiografických parametrů v časném (3 měsíce) a pozdějším období (12 měsíců) po ASA.
Soubor a metodika:
Soubor zahrnul 32 pacientů průměrného věku 58,6 ± 12,6 let, kteří podstoupili ASA pro farmakorezistentní limitující symptomy. Sledované parametry byly následující – hodnota klidového LVOTG, tloušťka mezikomorového septa a zadní stěny levé komory, enddiastolický rozměr levé komory, velikost levé síně, ejekční frakce levé komory a třída NYHA klasifikace – hodnocené ve 3. a 12. měsíci po výkonu.
Výsledky:
Intraprocedurální změna LVOTG (iLVOTG) korelovala se změnou echokardiograficky měřeného LVOTG v období 0–3 měsíců (r = 0,56; p < 0,001) a 0–12 měsíců (r = 0,40; p < 0,05). Korelace mezi změnou iLVOTG a změnou ostatních echokardiografických parametrů a funkčního stavu nebyla nalezena, s výjimkou změny enddiastolického rozměru levé komory v období 0–12 měsíců (r = –0,39; p < 0,05) a 3–12 měsíců (r = –0,41; p < 0,05).
Závěr:
Invazivně hodnocený intraprocedurální pokles LVOTG predikuje pozdější vývoj LVOTG. Hodnotu LVOTG dosaženou ve 3. měsíci již můžeme použít pro odhad dlouhodobého efektu ASA.
Klíčová slova:
hypertrofická obstrukční kardiomyopatie – alkoholová septální ablace – echokardiografie
Úvod
Hypertrofická kardiomyopatie (HKMP) je charakterizována hypertrofií myokardu nedilatované levé komory srdeční (LK) bez vysvětlujících hemodynamických příčin (např. hypertenze či chlopenní vady) schopných způsobit danou míru hypertrofie [1,2]. Jedná se o nejčastější geneticky podmíněné onemocnění srdce s prevalencí 1 : 500 v dospělé populaci [1–3]. Na podkladě přítomnosti obstrukce ve výtokovém traktu levé komory (LVOT) rozlišujeme obstrukční a neobstrukční typ HKMP. Obstrukční typ, charakterizovaný hodnotou maximálního gradientu v LVOT ≥ 30 mm Hg, se vyskytuje přibližně u dvou třetin pacientů, z nichž polovina má přítomnu obstrukci v klidu (klidová obstrukce) a druhá polovina po zátěži (latentní obstrukce) [2] (obr. 1). Obstrukce v LVOT je často spojena s přítomností systolického dopředného pohybu předního cípu mitrální chlopně, tzv. SAM (systolic anterior motion) (obr. 2). Klinická diagnóza HKMP je založena na detekci typického fenotypu nejčastěji pomocí echokardiografie, s obrazem hypertrofie stěn LK (nejčastěji mezikomorového septa) a nedilatované dutiny LK [4]. Nitrokomorová obstrukce, způsobená hypertrofií mezikomorového septa (IVS), elongovanými cípy mitrální chlopně a abnormalitami papilárních svalů, je jednou z hlavních příčin klinických potíží pacientů, kterými jsou dušnost, stenokardie, palpitace, zátěží indukovaná synkopa či náhlá srdeční smrt [5–7]. Podle závažnosti symptomů a také podle přítomnosti či absence gradientu v LVOT je volena příslušná farmakoterapie. Základem léčby jsou farmaka s negativně inotropním efektem, která snižují spotřebu kyslíku v myokardu a prodlužují fázi diastolického plnění LK [5]. Léky první volby u pacientů s hypertrofickou obstrukční kardiomyopatií (HOKMP) jsou betablokátory snižující především zátěží indukovaný gradient ve výtokovém traktu levé komory (LVOTG) [8]. Lékem druhé volby je verapamil, non-dihydropyridinový antagonista kalciových kanálů, který obvykle snižuje klidový LVOTG [3], ale vzhledem k jeho vazodilatačnímu efektu může dojít v některých případech k nárůstu gradientu v LVOT. Proto je při jeho podání nutná opatrnost, zejména u jedinců s vysokým LVOTG [9]. U obou skupin léků bylo popsáno zlepšení klinické symptomatologie nemocných. U obstrukčních typů HKMP při přetrvávající symptomatologii i přes maximálně tolerovanou farmakologickou léčbu je možné použít některou z intervenčních metod redukce LVOTG. Vedle chirurgické myektomie [1,2,10,11] a implantace dvoudutinového kardiostimulátoru či defibrilátoru (PM/ICD DDD) s apikální preexcitací [12–14] je při vhodné koronární anatomii možné indikovat alkoholovou septální ablaci (ASA). ASA byla poprvé provedena Ulrichem Sigwartem v roce 1994, jde tedy o „nejmladší“ metodu nefarmakologické léčby HOKMP [15]. Jedná se o intervenčně kardiologickou metodu, při které je nejčastěji do první septální větve zásobující bazální část IVS aplikován absolutní alkohol, čímž je vyvolána nekróza v daném povodí. To má za následek vytvoření jizvy se ztenčením hypertrofického IVS (obr. 3a, b) vedoucí k rozšíření výtokového traktu, snížení gradientu v LVOT, poklesu nitrokomorového tlaku a zlepšení klinického stavu. Dále dochází k remodelaci LK s regresí její hypertrofie, a to i mimo intervenované segmenty LK [3,4,6].
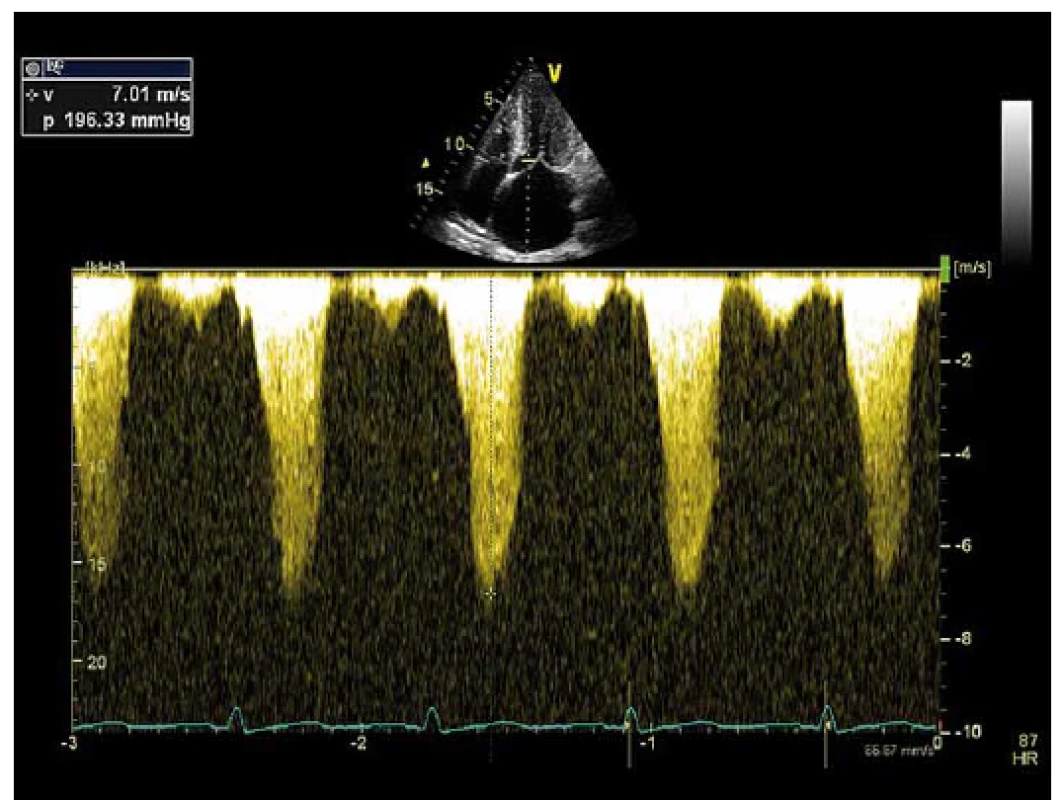
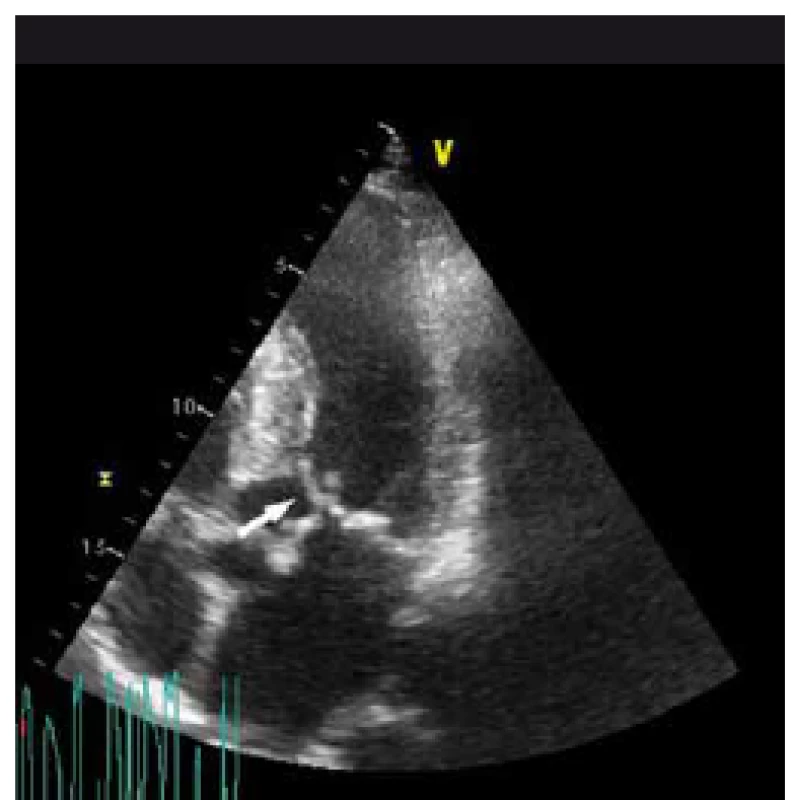
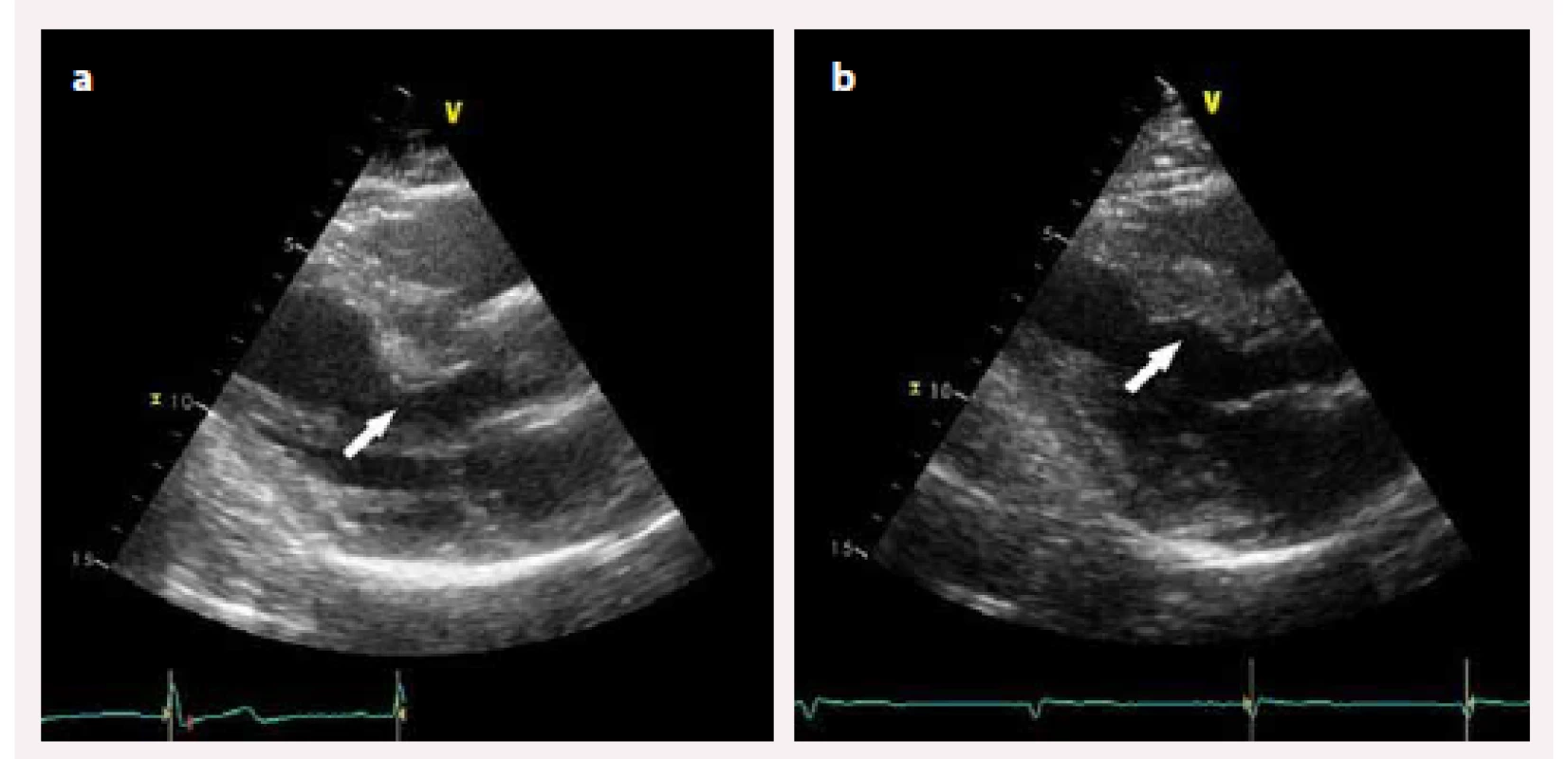
Cíl
Cílem naší práce bylo zjistit, zda intraprocedurální pokles gradientu v LVOT predikuje další vývoj LVOTG, a zhodnotit jeho vliv na další vývoj klinických a echokardiografických parametrů v časném (3 měsíce) a pozdějším období (12 měsíců) po ASA.
Metodika
Soubor pacientů a hodnocené parametry
K vyhodnocení byla použita data z monocentrického registru nemocných s HOKMP léčených pomocí ASA v letech 2001–2013 na I. interní kardioangiologické klinice, FN u sv. Anny v Brně.
Do souboru byli zařazeni pacienti po ASA splňující následující kritéria:
- echokardiografický obraz HOKMP s ejekční frakcí LK ≥ 55 %,
- invazivně měřený klidový LVOTG ≥ 30 mm Hg,
- třída NYHA klasifikace > 2,
- provedené echokardiografické a klinické vyšetření ve 3. a 12. měsíci.
Vyloučeni byli pacienti s přítomností:
- prokázaného střádavého či infiltrativního onemocnění myokardu,
- implantovaného PM/ICD DDD pre - či postprocedurálně,
- provedené chirurgické myektomie.
Soubor zahrnul 32 pacientů (21 mužů a 11 žen) průměrného věku 58,6 ± 12,6 let, kteří podstoupili ASA pro přetrvávající limitující symptomy i přes maximální tolerovanou farmakoterapii. Sledovány byly následující parametry: echokardiograficky měřený maximální klidový LVOTG, tloušťka IVS, tloušťka zadní stěny (ZS) LK, enddiastolický rozměr (Dd) LK, velikost levé síně (LS), ejekční frakce (EF) LK a třída funkční klasifikace NYHA.
Statistika
Změny sledovaných parametrů byly hodnoceny Friedmanovým testem a Nemenyiho post hoc testem (LVOTG, třída NYHA) nebo u parametrů s normálním rozložením analýzou rozptylu (ANOVA) pro opakovaná měření a Tukeyovým post hoc testem (IVS, ZS, Dd, LS, EF). Ke zhodnocení vlivu intraprocedurálního poklesu LVOTG na jeho další vývoj byl vzhledem k rozložení dat použit Spearmanův koeficient pořadové korelace, stejně jako k vyjádření vztahu intraprocedurálního poklesu LVOTG ke změnám ostatních parametrů. Spearmanův korelační koeficient byl rovněž použit ke zhodnocení vlivu dávky alkoholu na sledované parametry. Vliv změny LVOTG a množství použitého alkoholu na výskyt bradyarytmií byl hodnocen Mann-Whitneyovým U-testem. Pro všechny analýzy byla použita hladina statistické významnosti α = 0,05. Statistické analýzy byly provedeny za pomoci programu STATISTICA (StatSoft, verze 12).
Alkoholová septální ablace
Před samotným výkonem byla zavedena dočasná kardiostimulace (DKS) v rámci prevence případných periprocedurálních poruch síňokomorového převodu. Poté byl transfemorálním přístupem proveden selektivní nástřik levé koronární tepny k posouzení anatomie jejich větví. Pigtail katetrem zavedeným do LK byl změřen tlakový gradient mezi hrotem a výtokovým traktem LK (subvalvulární oblastí) v klidu a po provokaci komorovou extrasystolou či Valsalvovým manévrem (obr. 4a), méně často aplikací nitrátů. Poté byl do septální větve zásobující oblast podílející se na zúžení LVOT (nejčastěji bazální IVS) zaveden speciální over-the-wire balonkový katetr uzavírající lumen této cévy a následně byla aplikována echokontrastní látka s echokardiografickým posouzením rozsahu a lokalizace perfuzní oblasti vybrané septální větve [16]. Po identifikaci vhodné septální větve byl do ní aplikován 96% alkohol. Množství aplikovaného alkoholu bylo zvoleno na základě kalibru septální větve a velikosti jí zásobovaného povodí (přibližně 1,0 ml na 10 mm tloušťky IVS). Po 10 min byl balon desuflován, změřen reziduální tlakový gradient mezi hrotem LK a LVOT v klidu a po výše uvedených provokačních manévrech (obr. 4b) a na závěr byl proveden selektivní nástřik levé věnčité tepny k potvrzení ablace septální větve a vyloučení případného ústřiku alkoholu do jiné části koronárního řečiště se vznikem no-reflow fenoménu [5,6]. Elektroda DKS byla ponechána min. 24 hod, v případě bradyarytmií i déle. Pacient zůstával při nekomplikovaném průběhu observován 24–48 hod na koronární jednotce a následně na standardním oddělení do celkové délky alespoň pěti dnů za kontinuální monitorace srdečního rytmu [17].
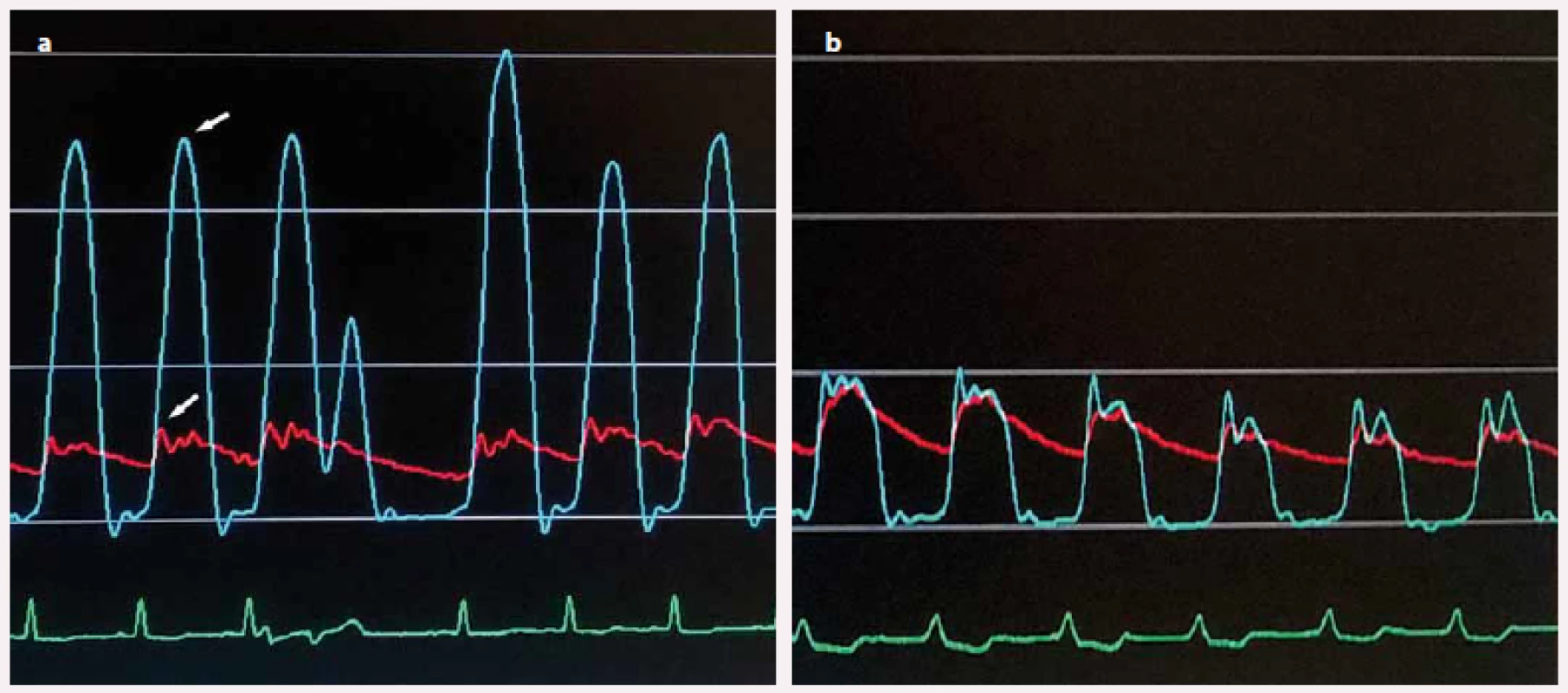
Výsledky
Změna invazivně měřeného intraprocedurálního LVOTG (iLVOTG) korelovala se změnou echokardiograficky měřeného LVOTG v období 0–3 měsíce (r = 0,56; p < 0,001) a 0–12 měsíců (r = 0,40; p < 0,05). Korelace mezi změnou iLVOTG a změnou ostatních echokardiografických parametrů a funkčního stavu nebyla nalezena, s výjimkou změny Dd v období 0–12 měsíců (r = –0,39; p < 0,05) a 3–12 měsíců (r = –0,41; p < 0,05). Kompletní data jsou uvedena v tab. 1.
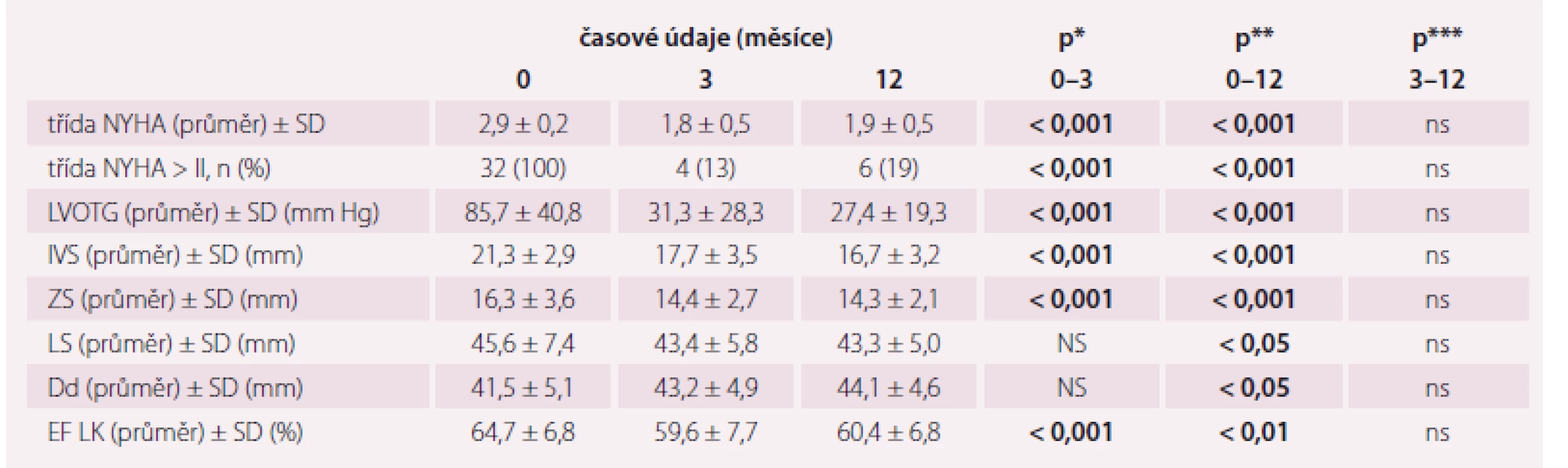
Po ASA došlo k poklesu LVOTG z 85,7 ± ± 40,8 mm Hg na 31,3 ± 28,3 mm Hg ve 3. měsíci (p < 0,001), resp. na 27,4 ± 19,3 mm Hg ve 12. měsíci (p < 0,001), zlepšení třídy NYHA z 2,9 ± 0,2 na 1,8 ± 0,5 ve 3. měsíci (p < 0,001), resp. na 1,9 ± 0,5 ve 12. měsíci (p < 0,001) a ztenčení IVS z 21,3 ± 2,9 mm na 17,7 ± 3,5 mm ve 3. měsíci (p < 0,001), resp. na 16,7 ± 3,2 mm ve 12. měsíci (p < 0,001). Srovnání změn výše uvedených parametrů mezi 3. a 12. měsícem nebylo statisticky významné (p = ns). Vývoj všech sledovaných echokardiografických parametrů a funkčního stavu je uveden v tab. 2.
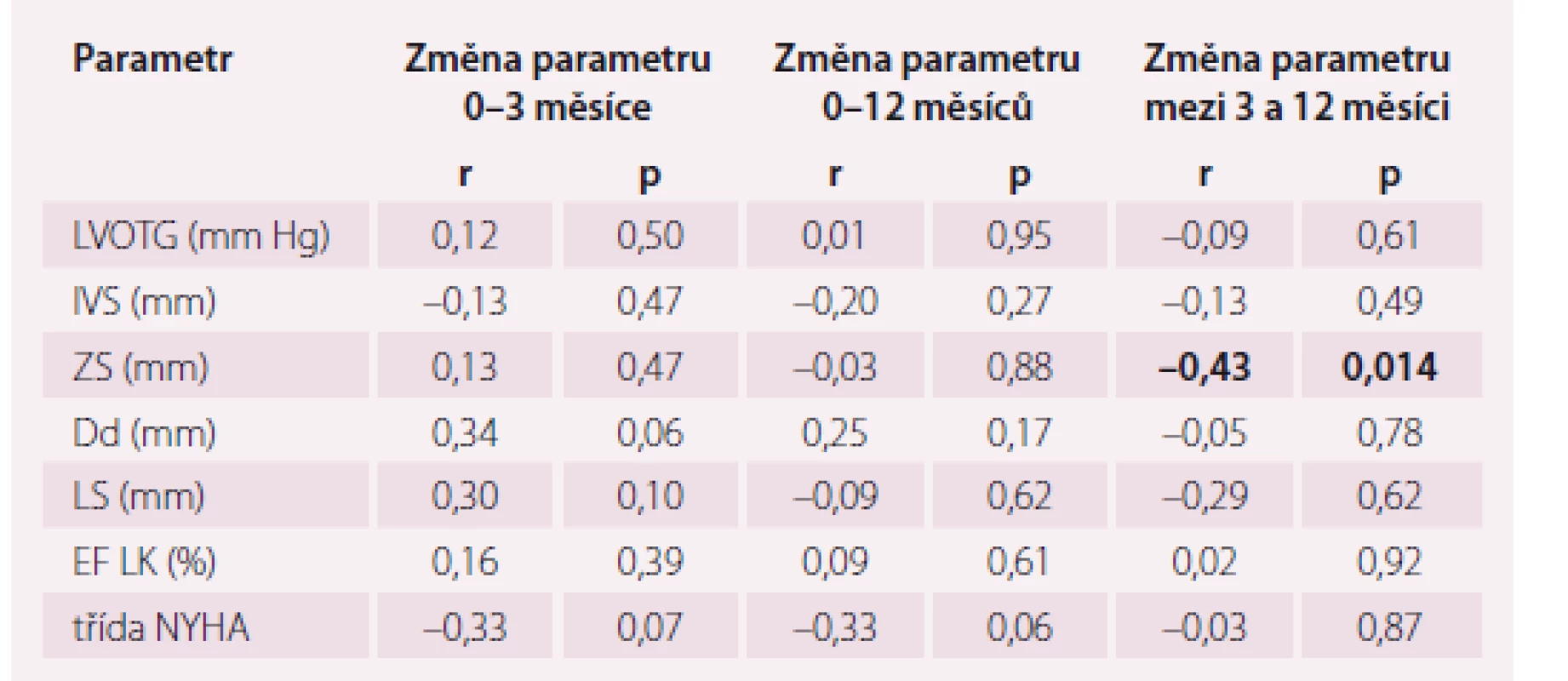
Korelace změn echokardiografických parametrů a NYHA třídy v období před výkonem a 3. měsícem po výkonu a mezi obdobím před výkonem a 12. měsícem po výkonu byla prokázána u všech sledovaných veličin (r > 0,6; p < 0,001). Naproti tomu korelace změn parametrů v období 0–3 měsíců a 3–12 měsíců byla zjištěna pouze u ZS (r = 0,46; p < 0,05) a Dd (r = 0,45; p < 0,05).
Průměrná dávka alkoholu v celém souboru byla 2,3 ± 0,7 ml. U pacientů s výskytem jakýchkoli bradyarytmií po ASA byla průměrná dávka 2,0 ± 0,8 ml, u pacientů bez dokumentovaných bradykardických poruch rytmu 2,4 ± 0,7 ml; p < 0,05. Množství použitého alkoholu nekorelovalo se změnami sledovaných parametrů (p = ns). Kompletní data jsou uvedena v tab. 3.
Diskuze
Pokles LVOTG, zlepšení klinického stavu a remodelace LK jsou hlavními ukazateli, které sledujeme po ASA a které určují úspěšnost této metody. Literární prameny dokládají příznivý vliv ASA na krátkodobý i dlouhodobý vývoj echokardiografických parametrů, klinický stav pacienta a pokles LVOTG [18–21]. Méně jasné je, zda intraprocedurální pokles LVOTG predikuje další vývoj echokardiografických a klinických ukazatelů. V naší práci jsme se proto zaměřili především na zhodnocení vztahu intraprocedurálního poklesu gradientu v LVOT měřeného invazivně v průběhu výkonu a na vývoj klinických a echokardiografických parametrů v časném (3 měsíce) a pozdějším období (12 měsíců) po ASA s cílem predikce pozdějšího efektu již při samotném výkonu.
Zlepšení parametrů ve smyslu poklesu LVOTG a třídy NYHA bylo pozorováno v našem souboru pacientů v časném období s přetrvávajícím zlepšením i v jednoročním sledování. Vyjma zlepšení třídy NYHA došlo po ASA rovněž k vyššímu zastoupení pacientů ve skupině s mírnými symptomy (NYHA ≤ 2), a to v 87 % (3. měsíc), resp. 81 % (12. měsíc) v porovnání se vstupními daty, kde byli všichni pacienti ve skupině s těžkými symptomy (NYHA > 2). V rámci remodelace LK po ASA došlo současně se ztenčením IVS a s tím spojeným rozšířením LVOT s následným poklesem gradientu také ke statisticky signifikantnímu ztenčení ZS v obou sledovaných obdobích. To potvrzuje hypotézu, že dochází k celkové regresi hypertrofie stěn LK i mimo intervenované segmenty LK, nejspíše v důsledku poklesu afterloadu vyplývajícího z odstranění či snížení míry obstrukce v LVOT. V rámci remodelace LK se ztenčením stěn (IVS a ZS) dochází také k nárůstu rozměru její dutiny. Pro pacienty s HKMP je typická normální až supranormální EF LK, diastolická funkce však bývá u těchto pacientů často porušená, což je také příčinou klinických obtíží. Z důvodu nedostupnosti nálezů měření transmitrálního toku a tkáňově dopplerovského zobrazení u všech našich pacientů jsme jako marker odrážející diastolickou funkci zvolili velikost LS [22,23]. Zvětšená LS, stejně jako porucha diastolické funkce, je častým nálezem u pacientů s HOKMP. Příčinou jejího zvětšení může být jednak zmiňovaná diastolická dysfunkce spojená s dlouhodobě zvýšenými plnicími tlaky LK, další možností zejména u obstrukčních typů je přítomnost mitrální regurgitace v důsledku SAM. Velikost LS také koreluje se závažností symptomů, výskytem fibrilace síní, závažností LVOTG a především mortality [24]. Dilatovaná LS byla přítomna také v našem souboru na počátku sledování a během 12měsíčního období po ASA došlo ke statisticky významnému zmenšení jejího diametru. Z výše uvedených výsledků je patrné, že většina sledovaných parametrů zaznamenala statistickou změnu již časně po ASA, která přetrvávala také na konci sledování. Avšak přes pokračující příznivý vývoj parametrů nebyly změny v období 3–12 měsíců již statisticky významné. Převážná část hodnocených parametrů zaznamenala největší změnu během prvních tří měsíců, což je, jak se zdá, již dostatečná doba k posouzení dlouhodobého efektu ASA. Navíc pokles hodnoty parametru, který byl významný ve třetím měsíci, zůstal signifikantní také ve 12. měsíci. Pro indikaci případné reintervence v případě suboptimálního efektu primárního zákroku by měly být tři měsíce dobou, kdy by tato mohla začít být zvažována. V řadě prací, vč. tohoto našeho sledování, dochází po ASA k poklesu EF LK [20,25]. Přestože je tento statisticky významný, zachovalá EF LK na konci sledování dokladuje bezpečnost této metody, a její pokles po ASA tedy nepokládáme za klinicky významný. V naší studii k poklesu EF LK jistě přispěla bezprostřední technická komplikace samotného výkonu u jednoho pacienta, u kterého došlo k pravděpodobnému ústřiku alkoholu do distální části ramus interventricularis anterior s navozením no-reflow fenoménu a vytvořením infarktového ložiska v oblasti hrotu a přilehlé části přední stěny s poklesem EF LK na 40 %. Nicméně i u tohoto nemocného s takto závažnou komplikací bylo zaznamenáno klinické zlepšení.
Periprocedurální pokles invazivně měřeného LVOTG koreloval s poklesem echokardiograficky měřeného LVOTG ve 3. i 12. měsíci, ale již nekoreloval se změnou LVOTG mezi 3. a 12. měsícem. Výraznější periprocedurální pokles LVOTG znamenal větší pokles LVOTG během dalšího sledování, a proto, na rozdíl od některých názorů, naše výsledky naznačují, že má smysl snažit se o co nejvýraznější snížení gradientu již na katetrizačním sále. Nicméně u ostatních echokardiografických parametrů či klinického stavu korelace prokázány nebyly. Výjimkou byl enddiastolický rozměr LK, jehož změna v období 0–12 měsíců a 3–12 měsíců vykázala sice méně těsnou, ale statisticky významnou korelaci.
V současné době je hodně diskutováno optimální množství podaného alkoholu, neboť řada prací potvrzuje spojitost vyšší dávky alkoholu s vyšším počtem síňokomorových blokád vyššího stupně s nutností implantace trvalé kardiostimulace. V současné době je trendem snižovat dávku alkoholu pod 2 ml na ablaci jedné septální větve [26–28]. V našem souboru jsme se proto zaměřili také na výskyt bradykardických poruch rytmu (síňokomorové blokády vyššího stupně či junkční rytmus) a překvapivě jsme pozorovali, že u pacientů s bradyarytmiemi byla nižší průměrná spotřeba alkoholu než u pacientů bez dokumentovaných poruch rytmu. Korelace mezi množstvím podaného alkoholu a změnami sledovaných echokardiografických parametrů a funkčního stavu nebyla prokázána. Větší množství podaného alkoholu nemělo tedy v tomto souboru nemocných vliv na případný výraznější efekt ASA. Nicméně, na hranici statistické významnosti byl pozorován jistý trend výraznějšího zlepšení ve funkční třídě NYHA u pacientů, kteří obdrželi vyšší dávku alkoholu; tento poznatek bude jistě do budoucna nutné verifikovat na větším vzorku pacientů.
Limitace
Hlavní limitací naší studie je fakt, že se jedná o monocentrickou, retrospektivní, nerandomizovanou studii s malým počtem pacientů. Další výraznou limitací je nepřímé posuzování diastolické funkce pomocí velikosti LS, kterou jsme si zvolili jako její korelát i s vědomím jisté nepřesnosti takového postupu, protože u pacientů z počátečního období této studie nebyly vždy k dispozici spolehlivě doložené hodnoty z měření transmitrálního toku či dokonce tkáňově dopplerovské parametry, které používáme v posledních letech. Velikost souboru byla negativně ovlivněna tím, že jsme vyřadili nemocné (celkově sedm), kterým byl implantován dvoudutinový PM/ICD z důvodu poruchy síňokomorového převodu, a byla jim tak navozena apikální preexcitace, která modifikuje další vývoj echokardiografických parametrů nad rámec změn vyvolaných samotnou ASA.
Závěr
Alkoholová septální ablace je efektivní a bezpečná metoda léčby symptomatických pacientů rezistentních na farmakoterapii. Vede k významnému a setrvalému poklesu LVOTG a třídy NYHA klasifikace, stejně jako k příznivé remodelaci LK. Periprocedurální pokles invazivně měřeného LVOTG predikuje pozdější vývoj LVOTG. Hodnotu LVOTG dosaženou ve třetím měsíci již můžeme použít pro odhad dlouhodobého efektu ASA, byť k další remodelaci LK dochází i po tomto časovém období.
Podpořeno Grantem na podporu projektů specifického výzkumu MUNI/A/1270/2015 a projektem číslo LQ1605 z Národního programu udržitelnosti II (MŠMT) a projektem FNUSA-ICRC číslo CZ.1.05/1.1.00/02.0123 (OP VaVpI).
Doručeno do redakce: 30. 5. 2016
Přijato po recenzi: 1. 7. 2016
MUDr. Tomáš Honek
www.fnusa.cz
tomas.honek@fnusa.cz
Sources
1. Gersh BJ, Maron BJ, Bonow RO et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 124: e783–e831. doi: 10.1161/CIR.0b013e318223e2bd.
2. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35 : 2733–2779. doi: 10.1093/eurheartj/ehu284.
3. Enriquez AD, Goldman ME. Management of hypertrophic cardiomyopathy. Ann Glob Health 2014; 80 : 35–45. doi: 10.1016/j.aogh.2013.12.004.
4. Maron BJ, Ommen SR, Semsarian C et al. Hypertrophic cardiomyopathy: present and future, with translation into contemporary cardiovascular medicine. J Am Coll Cardiol 2014; 64 : 83–99. doi: 10.1016/j.jacc.2014.05.003.
5. Veselka J. Twenty years of alcohol septal ablation document more than a history of a single interventional procedure. Cor et Vasa 2015; 57: e16–e27.
6. Seggewiss H. Medical therapy versus interventional therapy in hypertrophic obstructive cardiomyopathy. Curr Control Trials Cardiovasc Med 2000; 1 : 115–119.
7. Zemánek D. Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie. Kardiol Rev Int Med 2015; 17 : 7–10.
8. Harrison DC, Braunwald E, Glick G et al. Effects of beta adrenergic blockade on the circulation, with particular reference to observations in patients with hypertrophic subaortic stenosis. Circulation 1964; 29 : 84–98.
9. Epstein SE, Rosing DR. Verapamil: its potential for causing serious complications in patients with hypertrophic cardiomyopathy. Circulation 1981; 64 : 437–441.
10. Agarwal S, Tuzcu EM, Desai MY et al. Updated meta-analysis of septal alcohol ablation versus myectomy for hypertrophic cardiomyopathy. J Am Coll Cardiol 2010; 55 : 823–834. doi: 10.1016/j.jacc.2009.09.047.
11. Ommen SR, Maron BJ, Olivotto I et al. Long-term effects of surgical septal myectomy on survival in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol 2005; 46 : 470–476.
12. Krejci J, Gregor P, Zemanek D et al. Comparison of long-term effect of dual-chamber pacing and alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy. Scientific World Journal 2013; 2013 : 629–650. doi: 10.1155/2013/ /629650.
13. Kappenberger L, Linde C, Daubert C et al. Pacing in hypertrophic obstructive cardiomyopathy. A randomized crossover study. PIC Study Group. Eur Heart J 1997; 18 : 1249–1256.
14. Maron BJ, Nishimura RA, McKenna WJ et al. Assessment of permanent dual-chamber pacing as a treatment for drug - refractory symptomatic patients with obstructive hypertrophic cardiomyopathy: a randomized, double-blind, crossover study (M-PATHY). Circulation 1999; 99 : 2927–2933.
15. Sigwart U. Non-surgical myocardial reduction for hypertrophic obstructive myocardial infarction. Lancet 1995; 346 : 211–214.
16. Popescu BA, Rosca M, Schwammenthal E et al. Dynamic obstruction in hypertrophic cardiomyopathy. Curr Opin Cardiol 2015; 30 : 468–474. doi: 10.1097/HCO.0000000000000199.
17. Veselka J, Lawrenz T, Stellbrink C et al. Low incidence of procedure-related major adverse cardiac events after alcohol septal ablation for symptomatic hypertrophic obstructive cardiomyopathy. Can J Cardiol 2013; 29 : 1415–1421. doi: 10.1016/j.cjca.2013.04.027.
18. Jensen MK, Almaas VM, Jacobsson L et al. Long-term outcome of percutaneous transluminal septal myocardial ablation in hypertrophic obstructive cardiomyopathy: a Scandinavian multicenter study. Circ Cardiovasc Interv 2011; 4 : 256–265. doi: 10.1161/CIRCINTERVENTIONS.110.959718.
19. Seggewiss H, Gleichmann U, Faber L et al. Percutaneous transluminal septal myocardial ablation in hypertrophic obstructive cardiomyopathy: acute results and 3-month follow-up in 25 patients. J Am Coll Cardiol 1998; 31 : 252–258.
20. Moss TJ, Krantz MJ, Zipse MM et al. Left ventricular systolic function following alcohol septal ablation for symptomatic hypertrophic cardiomyopathy. Am J Cardiol 2014; 113 : 1401–1404. doi: 10.1016/j.amjcard.2014.01.417.
21. Veselka J, Lawrenz T, Stellbrink C et al. Early outcomes of alcohol septal ablation for hypertrophic obstructive cardiomyopathy: a European multicenter and multinational study. Catheter Cardiovasc Interv 2014; 84 : 101–107. doi: 10.1002/ccd.25 236.
22. Jassal DS, Neilan TG, Fifer MA et al. Sustained improvement in left ventricular diastolic function after alcohol septal ablation for hypertrophic obstructive cardiomyopathy. Eur Heart J 2006; 27 : 1805–1810.
23. Sorajja P, Nishimura RA, Ommen SR et al. Effect of septal ablation on myocardial relaxation and left atrial pressure in hypertrophic cardiomyopathy an invasive hemodynamic study. JACC Cardiovasc Interv 2008; 1 : 552–560. doi: 10.1016/j.jcin.2008.07.004.
24. Nistri S, Olivotto I, Betocchi S et al. Prognostic significance of left atrial size in patients with hypertrophic cardiomyopathy (from the Italian Registry for Hypertrophic Cardiomyopathy). Am J Cardiol 2006; 98 : 960–965.
25. Steendijk P, Meliga E, Valgimigli M et al. Acute effects of alcohol septal ablation on systolic and diastolic left ventricular function in patients with hypertrophic obstructive cardiomyopathy. Heart 2008; 94 : 1318–1322. doi: 10.1136/hrt.2007.139535.
26. Veselka J, Tomašov P, Zemánek D. Long-term effects of varying alcohol dosing in percutaneous septal ablation for obstructive hypertrophic cardiomyopathy: a randomized study with a follow-up up to 11 years. Can J Cardiol 2011; 27 : 763–767. doi: 10.1016/j.cjca.2011.09.001.
27. Aqel R, Hage FG, AlJaroudi W et al. How much alcohol should we infuse in the coronary artery of hypertrophic cardiomyopathy patients? J Invasive Cardiol 2010; 22 : 22–26.
28. Kuhn H, Lawrenz T, Lieder F et al. Survival after transcoronary ablation of septal hypertrophy in hypertrophic obstructive cardiomyopathy (TASH): a 10 year experience. Clin Res Cardiol 2008; 97 : 234–243.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2016 Issue 3
-
All articles in this issue
- Komplexní endovaskulární revaskularizace aterotrombotického uzávěru popliteální tepny a bércových tepen u polymorbidního pacienta – kazuistika
- Endovaskulární léčba ileofemorální hluboké žilní trombózy
- Betablokátory, které nejméně negativně ovlivňují kardiorespirační zdatnost u zdravých osob
- Projekt MedPed – pacienti s familiární hypercholesterolemií ve středu pozornosti
- Význam periprocedurálního poklesu tlakového gradientu ve výtokovém traktu levé komory po alkoholové septální ablaci u pacientů s hypertrofickou obstrukční kardiomyopatií
- Endovaskulární léčba ischemické cévní mozkové příhody
- Organizace karotického programu a výsledky endovaskulární léčby karotické stenózy ve Vítkovické nemocnici
- Endovaskulární léčba disekce aorty typ B a ischemických komplikací provázejících aortální disekce
- Disekce aorty typu B s těžkou viscerální a končetinovou ischemií řešená kompletní endovaskulární revaskularizací – kazuistika
- Možnosti endovaskulární léčby akutní končetinové ischemie
- Organizace podiatrické péče u pacientů s kritickou končetinovou ischemií
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Betablokátory, které nejméně negativně ovlivňují kardiorespirační zdatnost u zdravých osob
- Endovaskulární léčba ileofemorální hluboké žilní trombózy
- Možnosti endovaskulární léčby akutní končetinové ischemie
- Disekce aorty typu B s těžkou viscerální a končetinovou ischemií řešená kompletní endovaskulární revaskularizací – kazuistika
