Přínosy a rizika profylaxe tromboembolické nemoci u geriatrického pacienta
Benefits and risks of primary prevention of venous thromboembolism in the elderly
Venous thromboembolism is a relatively common cardiovascular disease with a comparatively high morbidity and mortality. It includes two principal units – deep venous thrombosis and pulmonary embolism. The incidence and prevalence of venous thromboembolism increase exponentially with age. Therefore, there is no doubt about the importance of age as one of the principal risk factors causing this disorder. With increasing life expectancy, the relative and absolute numbers of patients suffering from this illness increases and will increase. Furthermore, geriatric patients show specific clinical signs, frequently suffer from polymorbidity and use polypharmacy. Therefore, they present a vulnerable group tending to develop venous thromboembolism with a higher risk of severe consequences as compared to younger adults. Accordingly, it is of high importance to primarily prevent venous thromboembolism in older patients considering their vulnerability to coagulability as well as to bleeding.
Key words:
venous thromboembolism – deep venous thrombosis – pulmonary embolism – prophylaxis – elderly patients – NOAC – polymorbidity – polypharmacotherapy
Authors:
D. Weberová; H. Matějovská Kubešová; P. Weber
Authors‘ workplace:
Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
Published in:
Kardiol Rev Int Med 2018, 20(1): 36-40
Overview
Tromboembolická nemoc je poměrně často se vyskytující kardiovaskulární onemocnění s relativně vysokou morbiditou a mortalitou. Zahrnuje dvě jednotky – hlubokou žilní trombózu a plicní embolii. Incidence a prevalence tromboembolické nemoci roste exponenciálně s věkem a není pochyb o tom, že věk je jedním ze zásadních rizikových faktorů pro vývoj tohoto onemocnění. S prodlužující se střední délkou života přibývá tedy absolutního i relativního počtu nemocných vyššího věku, u kterých se setkáváme a budeme setkávat s touto diagnózou. Vzhledem k tomu, že geriatričtí pacienti mají odlišné klinické projevy nemocí, nezřídka jsou polymorbidní a užívají více farmak současně, jsou tito více ohroženou skupinou nemocných pro vznik tromboembolie s výrazně těžšími důsledky ve srovnání s mladšími jedinci. Z těchto důvodů je nutné v primární prevenci tromboembolie brát v potaz tuto zvlášť vulnerabilní skupinu nemocných jak směrem ke srážlivosti, tak i proti ní – ke krvácení.
Klíčová slova:
tromboembolická nemoc – hluboká žilní trombóza – plicní embolie – profylaxe – stáří – NOAC – polymorbidita – polyfarmakoterapie
Úvod
Tromboembolická nemoc (TEN) je jednou z nejčastějších příčin morbidity a mortality hospitalizovaných pacientů [1,2]. V populaci se s ní setkáváme přibližně u 1 – 2 % jedinců [3,4]. Zhruba 50 – 70 % symptomatických TEN vzniká u nechirurgických pacientů. Hospitalizace pro akutní interní onemocnění je tedy významným rizikovým faktorem pro vývoj TEN a je spojena s 8násobným zvýšením rizika vzniku TEN [5 – 9]. Nemocní s plicní embolií (PE) obecně jsou ohroženi až 20% mortalitou [10]. Mortalita hospitalizovaných pacientů všeobecně na interních odděleních je asi 10 %, z čehož přibližně 10 % umírá právě na PE [11,12]. Dle jiných zdrojů toto číslo může být i vyšší. U pacienta na interním lůžku bez profylaxe hrozí fatální PE až u 11 – 15 % nemocných [13]. Ve stáří se setkáváme s ještě vyšší mortalitou na PE a její průběh je výrazně těžší než u jedinců mladšího věku [8]. Nezanedbatelné jsou také dlouhodobé následky TEN, které mají ve stáří závažný dopad a delší čas rekonvalescence. Komplikace TEN představují posttrombotický syndrom (až u 40 % jedinců) a chronická tromboembolická plicní hypertenze (až u 1,5 – 4 % nemocných) [10,14].
Všeobecně je větší důraz kladen na chirurgické nemocné, u nichž jsou způsoby profylaxe TEN více propracovány. Ve skutečnosti však pouze jedna čtvrtina úmrtí na TEN v nemocnici připadá na chirurgické nemocné [7]. Ve vnitřním lékařství je situace složitější jednak pro značnou heterogenitu nemocných a dále pro rizikové faktory. Doposud neexistuje jasně daná stratifikace nemocných a jasná doporučení pro profylaxi v interních oborech. U starších nemocných se setkáváme s ještě vyšší heterogenitou obecně a vulnerabilitou k tromboembolii [6].
Přestože jsou rizikové faktory TEN dobře známé, jejich vyhodnocení je složité. Jednotlivé rizikové faktory mají různou váhu, od níž se odvíjí stratifikace rizika. V interní medicíně nelze uplatnit pouze jednoduché schéma kvantifikace rizik, ale je třeba uvážit riziko vyplývající ze samotné aktuální choroby a z léčebných metod [7]. Zatímco v léčbě TEN se řídíme doporučeními odborných společností, tedy American College of Chest Physicians (ACCP) a Evropské kardiologické společnosti (ECP) [10,14,15], jasná schémata pro profylaxi TEN u interních a geriatrických pacientů nejsou dostupná [6,7,16]. V tomto přehledovém článku je rozebírána problematika profylaxe TEN u nechirurgických pacientů vyššího věku.
Specifika TEN ve stáří
Starší nemocní si s ohledem na riziko vzniku TEN zasluhují zvláštní pozornost oproti mladším věkovým skupinám [4,17]. Vzhledem k vyššímu věku mají již sami o sobě větší sklon k vzniku TEN než mladší věkové skupiny [17,18]. Jedná se o nemocné s řadou rizikových faktorů současně, jež lze dobře rozpoznat, a tím předcházet tomuto onemocnění. TEN má ve stáří těžší a fatálnější průběh [19] a bývá spojena s dalšími komorbiditami [20]. Stáří je charakteristické polymorbiditou, užíváním polyfarmakoterapie a vzájemnými interakcemi mezi nemocemi i léky [6,21]. Odhalení diagnózy TEN je složitější pro častý asymptomatický průběh [22]. Při užití antikoagulační léčby je vyšší riziko krvácení [23]. Staří lidé jsou proto skupinou nemocných, kteří jsou výrazněji ohroženi vznikem TEN, a proto by měl být kladen zvláštní důraz na její prevenci ve stáří [4,24].
Rizikové faktory TEN ve stáří
Tromboembolická nemoc je onemocnění multifaktoriální, spojené s mnoha jinými komplexními poruchami, kde se velmi složitě uplatňuje vliv vrozených a získaných rizikových faktorů. Podstatou patofyziologického procesu pro vývoj TEN jsou tři stavy: poškození endotelu, hyperkoagulace a stáza krve, které tvoří tzv. Virchowovo trias [24 – 26]. Až u 75 % pacientů s PE je možné zjistit rizikový faktor, a to získaný a/ nebo dědičný [6,24]. Při přijetí geriatrického pacienta k hospitalizaci je třeba vyhodnotit možná rizika TEN a brát je v úvahu v kontextu stávající diagnózy (tab. 1) [27].
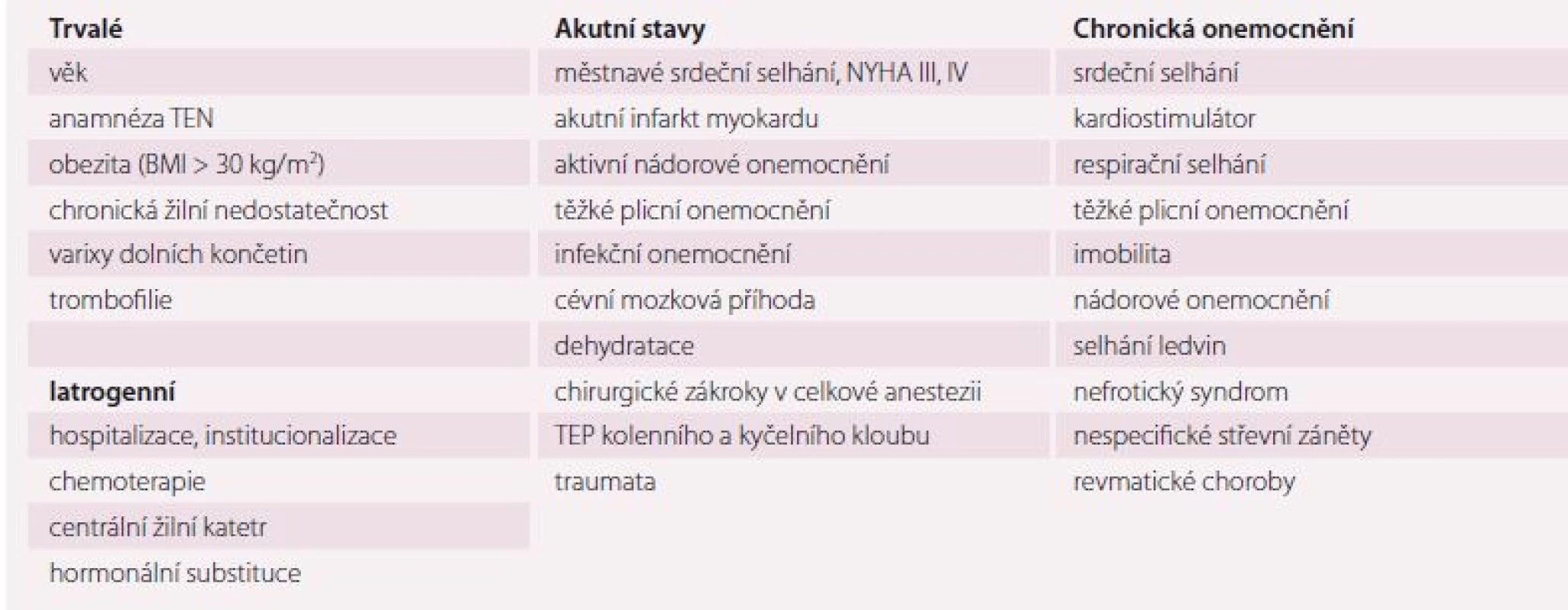
Incidence TEN roste exponenciálně s věkem. U starších nemocných se více uplatňují zevní a získané rizikové faktory. Anamnéza již prodělané tromboembolie a pozitivní rodinná anamnéza patří k nejsilnějším prediktorům TEN [6,28 – 30]. Významným rizikem je také prolongovaná imobilita u hospitalizovaných seniorů nebo v instituci, obezita s BMI (body mass index) > 30 kg/ m2, přítomnost varixů dolních končetin či projevů chronické žilní insuficience. Vrozené trombofilie ustupují ve stáří spíše do pozadí proti ostatním rizikovým faktorům [5,6,31].
Z akutních interních stavů jsou pro vývoj TEN zvláště rizikové: diagnóza srdečního selhání akutního či zhoršeného chronického, zejména městnavá forma, či NYHA III a IV [3,29,31]; maligní nádorová onemocnění, zejm. solidní tumory pankreatu, žaludku, plic, ledvin, mozku, hematologické lymfomy a myelomy [32,33]; neurologická onemocnění, zejm. ischemická forma cévní mozkové příhody (CMP) a poškození míchy. U hemoragických CMP je taktéž riziko TEN, nicméně profylaxe flebotrombózy je komplikována obavami z krvácení do ložiska. Dalšími rizikovými stavy jsou plicní nemoci, zejména pokročilé formy chronické obstrukční plicní nemoci (CHOPN), event. s cor pulmonale, dehydratace, revmatické choroby, méně nespecifické střevní záněty [6,28,30].
Neopomenutelnými rizikovými faktory ve stáří jsou chirurgické intervence a traumata. Vysoké riziko vzniku TEN mají pacienti po totální endoprotéze kyčelního nebo kolenního kloubu či po intervenci v abdominopelvické oblasti [34]. Traumata jsou ve stáří často spojena s pády, kdy dochází zejména k poranění hlavy, hrudníku, stehenní kosti apod. [4,14,21,35].
Skórovací systémy v prevenci TEN
Skórovací systémy (risk-assessment models – RAM) v interních i chirurgických oborech vychází z poměrného zastoupení klinických a laboratorních rizikových faktorů. Jeden z vhodných RAM u interních pacientů je Padua Prediction Score (tab. 2). Tento systém bere v potaz jak získané rizikové faktory (RF) ve smyslu akutních interních stavů, vysokého věku, imobility, probíhající malignity, obezity či probíhající hormonální léčby, tak vrozené. Vysoké riziko vzniku TEN je při ≥ 4 bodech. Pod 4 body je riziko vzniku TEN nízké [31,36,37]. Dalším RAM je modifikovaný algoritmus dle Cohena. Tento hodnotí riziko TEN u hospitalizovaných interních nemocných s omezenou hybností [31,38,39]. U onkologických nemocných lze využít Khoranovu škálu. Ta zahrnuje pět klinických parametrů: lokalizaci primárního nádoru, BMI, hodnoty krevního obrazu (hemoglobin, počet leukocytů a trombocytů) [31,40].
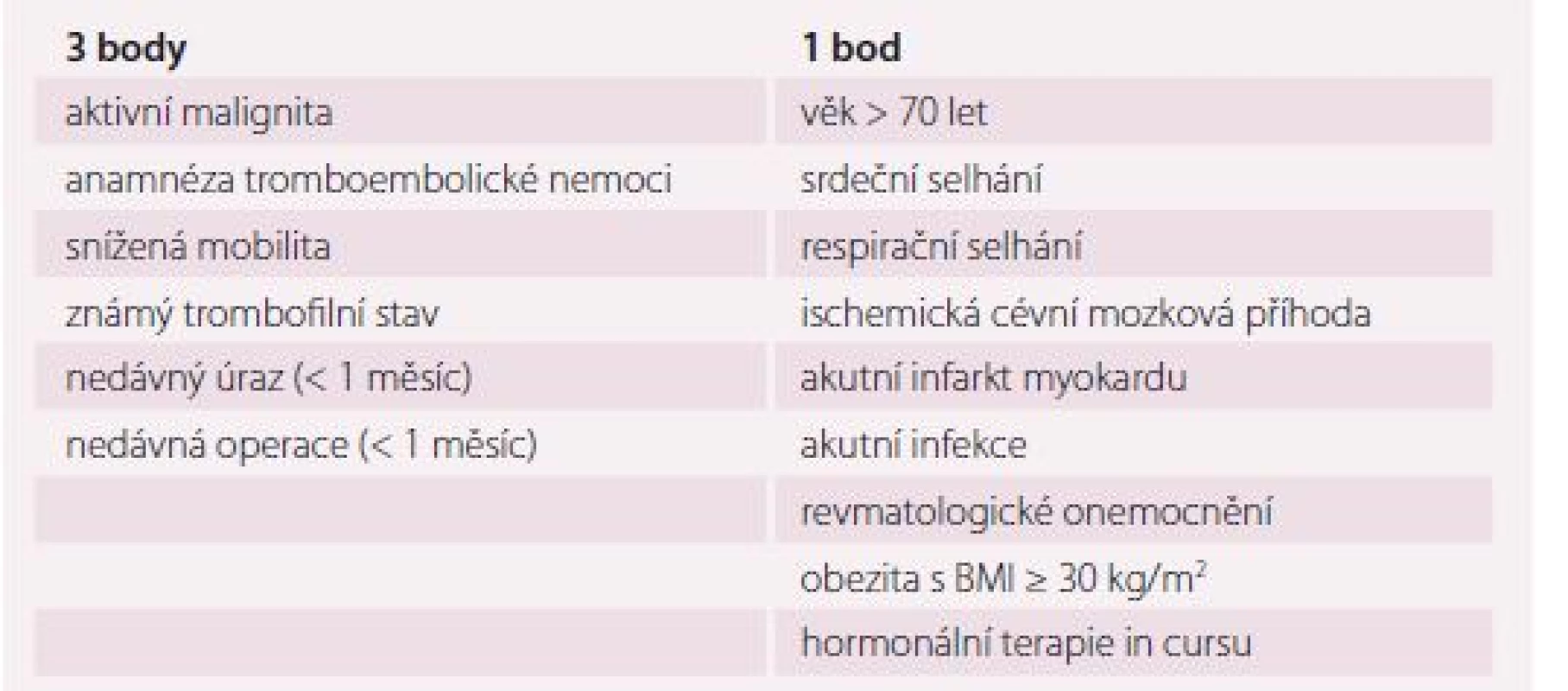
U chirurgických pacientů je užíváno k posouzení rizika TEN v pooperačním období a její profylaxi tzv. Capriniho skóre, kde nacházíme mnoho predisponujících faktorů i pro nechirurgické pacienty. Capriniho skóre zahrnuje rizika jako věk, druh operace, druh traumatu, obezitu, vrozené RF, varixy dolních končetin, hormonální substituci, imobilitu, těhotenství a stavy s ním spojené, některé akutní interní stavy a anamnézu TEN. Toto skóre klasifikuje pacienty do tří skupin dle rizika; pacienti s vysokým rizikem TEN mají ≥ 4 body [39,41,42].
Profylaxe TEN a její rizika ve stáří
U nechirurgických pacientů ve stáří je profylaxe TEN často indikována nesprávně, nedostatečně nebo naopak nadměrně. Ve srovnání s chirurgickými obory není v interních oborech riziko TEN dostatečně doceněno. Odhad rizika u staršího pacienta je obtížný pro heterogenitu nemocí i symptomů [16,17,24].
Farmakologická profylaxe
Při podání farmakologické profylaxe starším pacientům je třeba mít na paměti, že s věkem roste citlivost k antikoagulačním přípravkům. Současně ale také roste riziko krvácení, jeho závažnost a komplikace s ním spojené. Riziko krvácení zvyšují jaterní choroby, demence, pády, úrazy, fragilita cévní stěny. Situace podání profylaxe je navíc komplikována velmi častou polymorbiditou, polyfarmakoterapií a lékovými interakcemi [16,21,24]. Bývá změněna i efektivita medikamentózní terapie, např. při renální či jaterní insuficienci, malnutrici, hypoproteinemii aj. Při indikaci profylaxe TEN přistupujeme ke každému pacientovi vyššího věku individuálně. Zaměřujeme se na známé RF a posuzujeme jejich míru zvyšující pravděpodobnost TEN. Využíváme výše zmíněné skórovací systémy k odhadu rizika flebotrombózy [17,21,22].
Nízkomolekulární hepariny a nefrakcionovaný heparin
Tromboprofylaxe nízkomolekulárními hepariny (LMWH) a nízkými dávkami nefrakcionovaného heparinu (UFH) je lety ověřená, bezpečná a účinná. Nefrakcionovaný heparin zabraňuje přeměně fibrinogenu na fibrin a snižuje koagulační potenciál. Nízkomolekulární heparin působí na úrovni faktoru Xa (fXa) na přeměnu protrombinu na trombin. Výhoda LMWH spočívá v podání 1× denně podkožně a současně u LMWH se setkáváme s nižším počtem komplikací ve smyslu krvácení či heparinem indukované trombocytopenie. V současnosti je LMWH upřednostňováno před UFH i z důvodu předvídatelného účinku bez nutnosti pravidelné monitorace. U LMWH podáváme v profylaxi obvykle enoxaparin 40 mg denně subkutánně nebo dalteparin 5 000 U 1× denně subkutánně. Prakticky lze podat jakýkoli z LMWH, má-li v ČR schválenou indikaci žilního tromboembolizmu. V případě nefrakcionovaného heparinu podáváme profylaktickou dávku 5 000 j. 2 – 3× denně subkutánně [6,43 – 47].
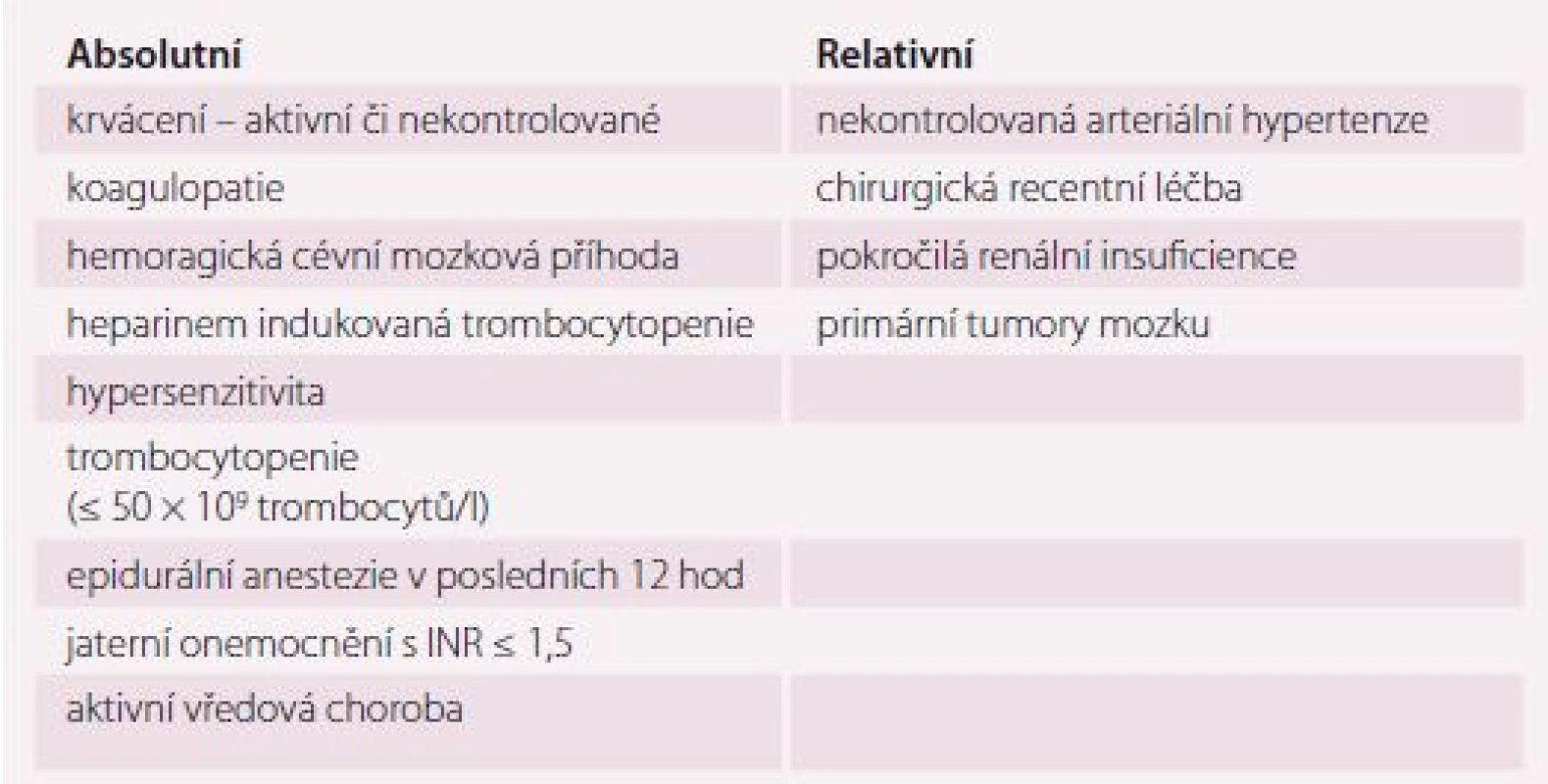
Kontraindikacemi a současně i riziky vyplývajícími z této léčby jsou aktivní či nekontrolované krvácení, koagulopatie, heparinem indukovaná trombocytopenie, hypersenzitivita, aktivní vředová choroba, hemoragická CMP, trombocytopenie (≤ 50 × 109 trombocytů/ l), vážné onemocnění jater (u jaterní cirhózy Child-Pugh C), epidurální anestezie v posledních 12 hod (tab. 3). Pro UFH navíc platí kontraindikace při aktivní tuberkulóze nebo krvácejícím karcinomu. K relativním kontraindikacím této terapie patří nekontrolovaná arteriální hypertenze, recentní chirurgická intervence, pokročilá renální insuficience s clearance kreatininu (CrCl) < 30 ml/ min, primární tumory mozku. Redukce dávky je doporučena u pacientů s renální insuficiencí s CrCl 30 – 50 ml/ min u LMWH o 25 – 30 %. Naopak stavy jako sepse, vazopresorická léčba či extrémní obezita snižují účinnost těchto farmak a obvyklá dávka nemusí být dostatečná. Ve stáří je vhodné zvážit monitoraci antiXa při podávání LMWH 3 – 4 hod po aplikaci s cílovou hodnotou 0,2 – 0,4 IU/ ml [6,43 – 47].
U starších pacientů s aktivním onkologickým onemocněním je lékem první volby LMWH za kontroly anti-Xa a lékem druhé volby UFH. Jedním z nejčastějších nežádoucích účinků protinádorové léčby je právě vliv na hematopoézu, a proto není doporučováno užití nových přímých perorálních antikoagulancií (NOAC) či warfarinu. Warfarin je možno užít až jako lék třetí volby v případě, že není možné podávání LMWH či UFH [48 – 50].
NOAC
Novou naději pro profylaxi TEN u nechirurgických starších pacientů v sobě nesou NOAC. Jejich výhodou je terapeutická účinnost při dobrém bezpečnostním profilu, jednoduché perorální podání bez nutnosti monitorace, jejich rychlý nástup účinku a vysoký poměr mezi účinkem a rizikem krvácení. Dalšími výhodami jsou žádná potravinová omezení a minimální lékové interakce. K NOAC se řadí přímé inhibitory faktoru Xa – rivaroxaban, apixaban a edoxaban – a přímý inhibitor trombinu – dabigatran etexilát [51].
Tato NOAC jsou v současnosti v ČR indikována v prevenci žilního tromboembolizmu u pacientů podstupujících elektivní náhradu kyčelního nebo kolenního kloubu, v prevenci mozkové příhody a systémové embolizace u pacientů s nevalvulární fibrilací síní s alespoň jedním rizikovým faktorem, v léčbě HŽT a PE a v prevenci jejich recidivy [52 – 56].
Výhodou přímých inhibitorů fXa je možnost jejich podání u pacientů s renální insuficiencí. Rivaroxaban se totiž vylučuje z 33 % renálně, apixaban z 25 % a edoxaban z 50 %. Pacientům s těžkou renální insuficiencí < 15 ml/ min není doporučeno tyto léky podávat. Při CrCl 15 – 49 ml/ min by měla být dávka v prevenci redukována dle doporučení v SPC. Dalšími kontraindikacemi je jaterní postižení s koagulopatií a s relevantním rizikem krvácení (u jaterní cirhózy Child-Pugh B a C), klinicky významné aktivní krvácení, stavy spojené s vysokým rizikem vážného krvácení, pacienti s umělými srdečními chlopněmi, při hypersenzitivitě, souběžná léčba jinými antikoagulancii s výjimkou převodu perorálních antikoagulancií, nekontrolovaná těžká hypertenze, těhotenství a kojení. Nedoporučuje se jejich podávání s inhibitory CYP3A4 a P-gp, tedy se systémově podávanými azolovými antimykotiky a inhibitory HIV proteáz. Při podávání NOAC s jinými antitrombotiky či nesteroidními antiflogistiky dochází ke zvýšení rizika krvácení [10,51,53 – 55].
Dabigatran etexilát se vylučuje z 80 % renálně a je kontraindikován u nemocných s CrCl < 30 ml/ min. Dále není indikován u nemocných užívajících systémově podávané interagující léky (např. ketokonazol, cyklosporin, itrakonazol, dronedaron, takrolimus). Jinak pro něj platí stejné kontraindikace jako pro přímé inhibitory fXa. Výhodou dabigatranu je existence specifického antidota – Fab fragment humanizované monoklonální protilátky, idarucizumabu – a možnost eliminace dialyzační metodou [10,51,52].
Výjimkou jsou prozatím onkologičtí pacienti, u nichž se sice NOAC jeví na základě dostupných prací jako účinné a bezpečné, nicméně tyto výsledky je třeba interpretovat v širším kontextu. Tyto práce nebyly primárně zaměřeny na onkologické pacienty, a mají tedy jisté nedostatky a jejich výsledky bude ještě třeba v budoucnu verifikovat [48,49].
V současnosti jsou pro geriatrické pacienty NOAC vhodné v prevenci TEN v jasně dané chirurgické indikaci. Ve stáří najdou v budoucnu tyto léky své místo vzhledem k jejich příznivým vlastnostem zmíněným výše. Indikaci v profylaxi TEN u nechirurgických pacientů zatím můžeme jen očekávat.
Warfarin, fondaparinux a kyselina acetylsalicylová
V případě kontraindikace podání výše zmíněných léků lze zvážit podání warfarinu (antagonista vitaminu K, kumarinový derivát). Toto užití je však vhodnější u chirurgického pacienta než u interního [6,50,57]. Dále existuje přímý inhibitor faktoru Xa fondaparinux (syntetický pentasacharid), jehož význam je jasně vymezen a cena vysoká [5]. U kyseliny acetylsalicylové nejsou dostatečná data potvrzující její účinnost a bezpečnost v prevenci primární flebotrombózy, a není tedy doporučena pro profylaxi TEN [5,35,58].
Nefarmakologická profylaxe
V případě, že je farmakologická profylaxe kontraindikována či je nutné ji při vysokém riziku TEN doplnit, užíváme mechanických metod prevence. K nim se řadí kompresivní graduovaná bandáž dolních končetin, cvičení dolních končetin, hydratace, časná mobilizace nebo intermitentní pneumatické komprese. U extrémně rizikových pacientů lze zvažovat i kavální filtry k zabránění vzniku PE, nicméně doposud není dostatek dat, která by tuto metodu v této indikaci dostatečně podpořila. Mělo by se jednat také o filtr odstranitelný. Samostatně tyto metody nejsou dostatečně účinné v prevenci TEN [5,25,43].
Závěr
Na geriatrického pacienta je třeba pohlížet jako na vulnerabilní a fragilní entitu vzhledem k vzniku tromboembolie. Tito nemocní mají již sami o sobě jeden rizikový faktor – věk; a k němu se přidávají další. Je pro ně charakteristická polymorbidita, polyfarmakoterapie a vzájemné interakce nemocí a léků. Při přijetí k hospitalizaci musíme zvažovat rizika tromboembolizmu v heterogenní skupině pacientů a váhu jednotlivých rizik [6,17,24]. K odhadu rizika je vhodné užití skórovacích systémů, např. Padua Prediction Score [36,37]. Tromboembolii se snažíme včas předcházet individuálně volenou profylaxí s ohledem na možné benefity i rizika, zejména krvácení [4,23,24].
Při podávání profylaxe TEN ve stáří máme na paměti několik zásad:
- citlivost k antikoagulačním lékům roste s věkem;
- polyfarmakoterapie (vč. doplňků stravy) vede ke zvýšení rizika lékových interakcí, které působí na protisrážlivý efekt a mohou zvyšovat riziko krvácení;
- polymorbidita rovněž zvyšuje riziko krvácení (např. renální selhání, krvácení do gastrointestinálního traktu, závažná anémie, krvácivé stavy, hemoragický iktus);
- snížená compliance a možnost monitoringu jsou faktory zvyšující riziko krvácení [4,6,24].
Doručeno do redakce: 25. 12. 2017
Přijato po recenzi: 15. 1. 2018
MU Dr. Dana Weberová
Sources
1. Musil D. Diagnostika a léčba tromboembolické nemoci z pohledu 10. ACCP doporučení. Interní Med 2017; 19(1): 7 – 9.
2. Anderson FA Jr, Wheeler HB, Goldberg RJ et al. A population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT study. Arch Intern Med 1991; 151(5): 933 – 938.
3. Karetová D, Bultas J. Možnosti léčby hluboké žilní trombózy v roce 2014. Kardiol Rev Int Med 2014; 16(4): 330 – 335.
4. Lacut K, Le Gal G, Mottier D. Primary prevention of venous thrombembolism in elderly medical patients. Clin Interv Aging 2008; 3(3): 399 – 411.
5. Hirmerová J. Profylaxe žilních tromboembolických komplikací v interních oborech – rozpor mezi teorií a praxí. Vnitř Lék 2006; 52(4): 379 – 388.
6. Musil D. Žilní tromboembolická nemoc a antikoagulační léčba u seniorů. Interní Med 2013; 15(3 – 4): 94 – 98.
7. Karetová D, Chochola M, Linhart A. Prevence trombembolické nemoci ve vnitřním lékařství. Čas Lék čes 2006; 145 : 353 – 357.
8. Heit JA, O’Fallon WM, Petterson TM et al. Relative impact of risk factors for deep vein thrombosis and pulmonary embolism: a population based study. Arch Intern Med 2002; 162(11): 1245 – 1248.
9. Sandler DA, Martin JF. Autopsy proven pulmonary embolism in hospital patients: Are we detecting enough deep vein thrombosis? J R Soc Med 1989; 82(4): 203 – 205.
10. Ludka O. Antitrombotická léčba tromboembolické žilní nemoci. Interní Med 2016; 18(5): 222 – 225.
11. International Consensus Statement – Prevention and treatment of venous thromboembolism (Guidelines according to scientific evidence). Int Angiol 2006; 25(2): 101 – 161.
12. Lindbald B, Sternby NH, Bergqvist D. Incidence of venous thromboembolism verified by necropsy over 30 years. BMJ 1991; 302(6778): 709 – 711.
13. Leizorovicz A, Cohen AT, Turpie A. Randomized, placebo-controlled trial of dalteparin for the prevention of venous thromboembolism in acutely ill medical patients. Circulation 2004; 110(7): 874 – 879.
14. Rokyta R, Hutyra M, Jansa P. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Summary document prepared by the Czech Society of Cardiology. Cor Vasa 2015; 57 : 275 – 296. doi: 10.1016/ j.crvasa.2015.05.009.
15. Kearon C, Akl EA, Omelas J et al. Antithrombotic therapy for VTE disease. CHEST guideline and expert panel report. Chest 2016; 149(2): 315 – 352. doi: 10.1016/ j.chest.2015.11.026.
16. Musil D. Rizika a prevence tromboembolické choroby. Med Pro Praxi 2009; 6(2): 61 – 65.
17. Shetty HG, Campbell IA, Routledge PA. Venous thromboembolism in the elderly. In: Fillit HM, Rockwood K, Woodhouse K et al. Brocklehurst’s textbook of geriatric medicine and gerontology. 7. vyd. Philadelphia, USA: Elsevier 2010 : 356 – 360.
18. Oger E. EPI-GETBO Study Group. Incidence of venous thrombembolism: a community-based study in Western France. Thromb Haemost 2000; 83(5): 657 – 660.
19. Heit JA, Silverstein MD, Mohr DN et al. The epidemiology of venous thrombembolism in the community. Thromb Haemost 2001; 86(1): 452 – 463.
20. Kniffin WD Jr, Baron JA, Barrett J et al. The epidemiology of diagnosed pulmonary embolism and deep venous thrombosis in the elderly. Arch Intern Med 1994; 154(8): 861 – 866.
21. Weber P, Weberová D, Kubešová H. Pulmonary embolism in the elderly – Significance and particularities. In: Cobanoglu U. Pulmonary embolism. 1. vyd. Rijeka, Chorvatsko: InTech 2012 : 37 – 66.
22. Le Gal G, Righini M, Roy PM et al. Differential value of risk factors and clinical signs for diagnosing pulmonary embolism according to age. J Thromb Haemost 2005; 3(11): 2457 – 2464. doi: 10.1111/ j.1538-7836.2005.01598.x.
23. Lopez-Jimenez L, Montero M, Gonzalez-Fajardo JA et al. RIETE Investigators. Venous thrombembolism in very elderly patients: findings from a prospective registry (RIETE). Haematologica 2006; 91(8): 1046 – 1051.
24. Silverstein RL, Bauer KA, Cushman M et al. Venous thrombosis in the elderly: more questions than answers. Blood 2007; 110(9): 3097 – 3101. doi: 10.1182/ blood-2007-06-096545.
25. White RH. The epidemiology of venous thrombembolism. Circulation 2003; 107 (23 Suppl 1): 14 – 18.
26. Cobanoglu U. Risk factor for pulmonary embolism. In: Cobanoglu U. Pulmonary embolism. 1st ed. Rijeka, Chorvatsko: InTech 2012 : 1 – 18.
27. Weber P, Weberová D, Ambrošová P et al. Hluboká žilní trombóza a plicní embolie v geriatrické medicině – dvě strany jedné mince. Kardiol Rev 2012; 14(1): 17 – 21.
28. Samama MH. An epidiomologic study of risk factors for deep venous thrombosis in medical outpatients: the SIRIUS study. Arch Intern Med 2000; 160(22): 3415 – 3420.
29. Alikhan R, Cohen AT, Combe S et al. MEDENOX study. Risk factors for venous thrombembolism in hospitalized patients with acute medical illness: analysis of the MEDENOX study. Arch Intern Med 2004; 164(9): 963 – 968.
30. Vaitkus PT, Leizorovicz A, Cohen AT et al. PREVENT Medical Thromboprophylaxis Study Group. Mortality rates and risk factors for asymptomatic deep venous thrombosis in medical patients. Thromb Haemost 2005; 93(1): 76 – 79. doi: 10.1160/ TH04-05-0323.
31. Spyropoulos AC. Risk assessment of venous thromboembolism in hospitalized medical patients. Cur Opin Pulm Med 2010; 16(5): 419 – 425. doi: 10.1097/ MCP.0b013e32833b4669.
32. Khorana AA, Carrier M, Garcia DA et al. Guidance for the prevention and treatment of cancer-associated venous thrombembolism. J Thromb Thrombolysis 2016; 41(1): 81 – 91. doi: 10.1007/ s11239-015-1313-4.
33. Garcia Escobar I, Antonio Rebollo M, García Adrián S et al. Cancer and Thrombosis Working Group of the Spanish Society of Medical Oncology (SEOM). Safety and efficacy of primary thromboprophylaxis in cancer patients. Clin Transl Oncol 2017; 19(1): 1 – 11. doi: 10.1007/ s12094-016-1500-6.
34. Krška Z. Prevence TEN v chirurgii, prolongovaná tromboprofylaxe. Rozhl Chir 2012; 91(5): 256 – 261.
35. Goldhaber SZ, Turpie AG. Prevention of venous thromboembolism among hospitalized patients. Circulation 2005; 111(1): e1 – e3. doi: 10.1161/ 01.CIR.0000150393.51958.54.
36. Barbar S, Noventa F, Rossetto V et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost 2010; 8(11): 2450 – 2457. doi: 10.1111/ j.1538-7836.2010.04044.x.
37. Germini F, Agnelli G, Fedele M et al. Padua Prediction Score or clinical judgment for decision making on antithrombotic prophylaxis: a quasi-randomized controlled trial. J Thromb Thrombolysis 2016; 42(3): 336 – 339. doi: 10.1007/ s11239-016-1358-z.
38. Palareti G, Schellong S. Isolated distal deep vein thrombosis: chat we know and chat we are doing. J Thromb Haemost 2012; 10(1): 11 – 19. doi: 10.1111/ j.1538-7836.2011.04564.x.
39. Hlásenský J, Mihalová Z, Špinar J et al. Skórovací systémy u tromboembolické nemoci. Kardiol Rev Int Med 2015; 17(2): 126 – 130.
40. Patell R, Rybicki L, McCrae KR et al. Predicitng risk of venous thromboembolism in hospitalized cancer patients: utility of a risk assessment tool. Am J Haematol 2017; 92(6): 501 – 507. doi: 10.1002/ ajh.24700.
41. Bahl V, Hu HM, Henke PK et al. A validation study of a retrospective venous thromboembolism risk scoring method. Ann Surg 2010; 251(2): 344 – 350. doi: 10.1097/ SLA.0b013e3181b7fca6.
42. Caprini JA. Thrombosis risk assessment as a guide to quality patient care. Dis Mon 2005; 51(2 – 3): 70 – 78.
43. Geerts WH, Pineo GF, Heit JA et al. Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic Therapy. Chest 2004; 126 (3 Suppl): 338S – 400S.
44. Mayer O. Nízkomolekulární hepariny v prevenci a léčbě žilního tromboembolizmu. Interní Med 2007; 1 : 39 – 41.
45. Bultas J, Karetová D. Nízkomolekulární hepariny – jejich význam v současné praxi. Interní Med 2011; 13(11): 440 – 444.
46. Kessler P. Nízkomolekulární hepariny v ambulantní praxi. Interní Med 2010; 12(7 a 8): 361 – 365.
47. Špác J. Nízkomolekulární hepariny v terapii kardiovaskulárních nemocí. Interní Med 2001; 2 : 75 – 79.
48. Palacka P, Hirmerová J. Dva pohľady na venózny tromboembolizmus u onkologických pacientov. Vnitř Lék 2017; 63(6): 431 – 440.
49. Šmrha J, Kessler P, Poul H et al. Dlouhodobá léčba tromboembolické nemoci u pacientů se zhoubným nádorem. Vnitř Lék 2016; 62(6): 449 – 452.
50. Bona RD, Sivjee KY, Hickey AD et al. The efficacy and safety of oral anticoagulation in patients with cancer. Thromb Haemost 1995; 74(4): 1055 – 1058.
51. Michalcová J, Penka M, Bulíková A. Nová – přímá perorální antikoagulancia: aktuální přehled. Vnitř Lék 2016; 62(10): 805 – 813.
52. Janský P. Účinnost a bezpečnost dabigatranu při podávání dle SPC a evropských doporučení. Vnitř Lék 2017; 63(6): 450 – 451.
53. Urbánek K. Rivaroxaban – farmakologický profil. Kardiol Rev Int Med 2017; 19(1): 39 – 44.
54. Špinar J, Špinarová L. Rivaroxaban u rizikových pacientů. Vnitř Lék 2017; 63(6): 424 – 430.
55. Lábrová R, Lábr K. Edoxaban – farmakologický profil. Kardiol Rev Int Med 2017; 19(1): 45 – 50.
56. Kessler P. Nová antitrombotika v prevenci pooperační tromboemolické nemoci. Kardiol Rev 2012; 14(2): 93 – 96.
57. Bern MM, Lokich JJ, Wallach SR et al. Very low doses of warfarin can prevent thrombosis in central venous catheters. A randomized prospective trial. Ann Intern Med 1990; 112(6): 423 – 428.
58. An VV, Phan K, Levy Y et al. Aspirin as thromboprophylaxis in hip and knee arthroplasty: a systemic review and meta-analysis. J Arthroplasty 2016; 31(11): 2608 – 2616. doi: 10.1016/ j.arth.2016.04.004.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2018 Issue 1
-
All articles in this issue
- Srdeční selhání ve stáří
- Specifika diagnostiky a léčby ve stáří
- Léčba arteriální hypertenze u starších osob
- Polyfarmakoterapie ve stáří – lékové interakce nejčastěji předepisovaných lékových skupin v kardiologii
- Chronické srdeční selhání a paliativní péče
- Tyreopatie ve stáří a kardiovaskulární postižení
- Přínosy a rizika profylaxe tromboembolické nemoci u geriatrického pacienta
- Imunosenescence a infekční komplikace vyššího věku
- Duální inhibice AT1 receptoru pro angiotenzin II a neprilysinu nebo inhibice angiotenzin konvertujícího enzymu?
- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
-
Stručný komentář k novým doporučením pro léčbu hypertenze v USA
2017 ACC/ AHA High Blood Pressure Guideline - Závratě a pády jako častá symptomatologie kardiovaskulárního postižení ve vyšším věku
- Dapagliflozin a studie DECLARE – vstupní charakteristika
- Zvýšená hladina NP u stabilních pacientů 3 měsíce po STEMI je jednoduchý nástroj k predikci dlouhodobé nepříznivé prognózy
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
- Specifika diagnostiky a léčby ve stáří
- Srdeční selhání ve stáří
- Tyreopatie ve stáří a kardiovaskulární postižení
