Interakce léčiv se zaměřením na vybrané lékové skupiny v kardiologii
Drug interactions with a focus on selected drug groups in cardiology
The risk of drug interactions increases with the number of drugs used. The numbers vary between studies, however, according to one study, the risk of drug interaction with concomitant use of up to five drugs is only 4%, rising to 10% with 5–10 different drugs, over 28% in the group using 11–15 drugs and up to 54% when taking 16–20 different drugs. There are many reasons and possible explanations and each system has its own specifics. The aim of this article is to summarize the basic types of interactions and to give examples of drug interactions in cardiology.
Keywords:
Anticoagulants – proton pump inhibitors – Drug interactions – Diuretics – hypolipidemics – cardiology – antihypertensives – antiarrhythmics – antiagregation
Authors:
Juřica J.
Authors‘ workplace:
Farmakologický ústav, LF MU, Ústav humánní farmakologie a toxikologie, FarmF MU, Ústavní lékárna, Masarykův onkologický ústav
Published in:
Kardiol Rev Int Med 2020, 22(3): 97-102
Overview
Riziko lékové interakce roste s počtem užívaných léčiv. Čísla se mezi studiemi různí, nicméně dle jedné z prací je riziko lékové interakce při současném užívání do pěti léčiv jen 4 %, při užívání 5–10 různých léčiv stoupá k 10 %, ve skupině užívající 11–15 léčiv dosahuje přes 28 %, při užívání 16–20 různých léčiv vzrůstá až k 54 %. Důvodů a možných vysvětlení je mnoho a každý systém má svá specifika. Cílem tohoto článku je shrnout základní typy interakcí a uvést příklady lékových interakcí v kardiologii.
Klíčová slova:
lékové interakce – kardiologie – antihypertenziva – hypolipidemika – antiarytmika – antikoagulancia – Antiagregancia – diuretika – inhibitory protonové pumpy
Podání léčiv sebou vždy nese i riziko poškození pacienta. Tato obecná pravda je vtisknuta do obecně známého axiomu „primum non nocere!“, jehož autorem nebyl nejspíš Hippokrates, ani Galén, dokonce ani Paracelsus, ale nejspíše anglický lékař Thomas Inman, který tímto latinským aforizmem komentoval v té době nadměrné dávkování kolchicinu (spíše tedy extraktu ocúnu) v léčbě dny. Sám Thomas Inman mylně tento výrok však připisuje jinému anglickému lékaři, známému jako anglický Hippokrates – Thomasi Sydenhamovi (1624–1689) [1]. Nechme však stranou autorství tohoto výroku, jeho význam si uvědomujeme v každodenní praxi. Při kombinaci více léčiv bychom jej měli mít na paměti o to více.
Riziko lékové interakce roste vcelku logicky právě s počtem užívaných léčiv. Čísla se mezi studiemi různí, nicméně dle jedné z prací je riziko lékové interakce při současném užívání do pěti léčiv jen 4 %, při užívání 5–10 různých léčiv stoupá k 10 %, ve skupině užívající 11–15 léčiv dosahuje přes 28 %, při užívání 16–20 různých léčiv vzrůstá až k 54 % [2–5]. Důvodů a možných vysvětlení je mnoho a každý systém má svá specifika – např. při neexistenci, resp. nefunkčnosti elektronického zdravotnictví a lékového záznamu je i vyšší pravděpodobnost duplicit. Přirozeně k interakci může dojít především z nepozornosti nebo někdy (v horším případě) z nevědomosti lékaře nebo lékárníka. Cílem tohoto článku je zopakovat základní typy interakcí a uvést příklady lékových interakcí v kardiologii.
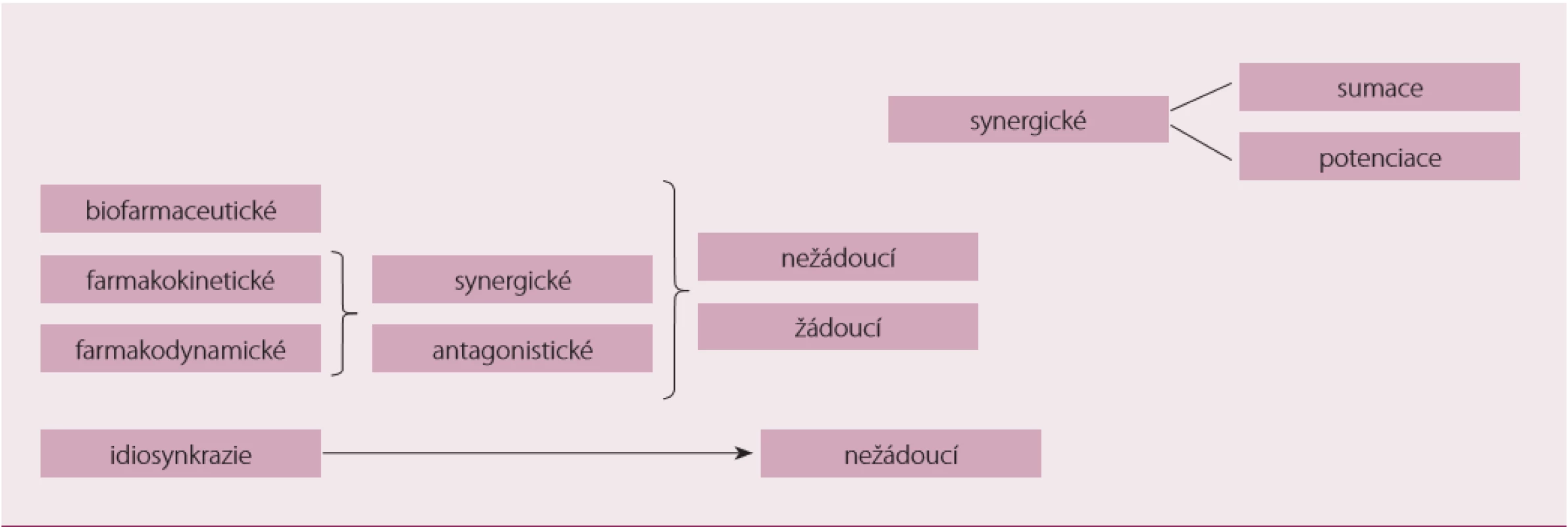
(Bio) farmaceutické lékové interakce
K interakci léčiv může dojít již před aplikací nebo během ní v případě, že léčiva podávaná najednou (nebo materiály, s kterými jsou v kontaktu) nejsou chemicky nebo fyzikálně kompatibilní – hovoříme o biofarmaceutických interakcích neboli inkompatibilitách. K inkompatibilitě může dojít mezi léčivem aplikovaným do roztoku jiných léčiv (např. v infuzi, perorálním roztoku nebo i přímo v žaludku po požití více léčivých přípravků najednou), mezi lékem a obalem či aplikační pomůckou apod. Důsledkem interakce je obvykle vznik sloučeniny, která vypadává z roztoku – pozorujeme zákal, vločkovatění, vznik krystalek nebo změnu barvy. Problém nastává především v případě, kdy není možné tuto změnu zachytit včas a pouhým okem. Parenterální aplikace vysráženého léčiva může způsobit embolii, vznik takové sraženiny či krystalek může být příčinou inaktivace obou léčiv, a tudíž neúčinnosti terapie, v horším případě i intoxikace. Podobně i adsorpce na materiál aplikačních pomůcek může znamenat ztrátu značné části podané dávky a v důsledku pak neúčinnosti. Příkladem nechtěné chemické reakce mezi podanými léčivy může být společná aplikace aminoglykosidů a beta-laktamových antibiotik – léčiva se tímto vzájemně inaktivují; precipitací hrozí příkladně furosemid aplikovaný do roztoků s pH menším než 7; k adsorpci na PVC materiály může dojít u inzulinu nebo diazepamu apod. [6,7].
Farmakodynamické interakce
Dalším typem interakcí jsou farmakodynamické interakce, se kterými v některých případech počítáme a využíváme je. Jedná se zejména o synergie využívané v kombinační terapii – tj. sumace až potenciace účinků např. v antihypertenzní terapii, popř. duální antiagregační terapii (kyselina acetylsalicylová (ASA) + inhibitory P2Y12), terapii chronického srdečního selhání ACE inhibitory + diuretika, valsartan + sakubitril. V jiných případech se snažíme těmto interakcím předejít, ať už se jedná o synergické (inhibitory fosfodiesterázy (PDE) + nitráty, betablokátory + verapamil) nebo antagonistické interakce (nesteroidní antiflogistika (NSAID) + antihypertenziva).
Farmakokinetické interakce
Farmakokinetické interakce jsou patrně nejčetnější, zpravidla vcelku dobře zdokumentované, a mohou mít velmi závažné důsledky. K farmakokinetické interakci může dojít ve všech farmakokinetických fázích (ADME). Patrně nejprostudovanější interakce jsou ty, k nimž dochází při biotransformaci, zejména se jedná o interakce na úrovni cytochromu P450.
Léčiva mohou být substráty, induktory a inhibitory enzymů CYP. Jedno léčivo přitom může být v určitých poměrech metabolizováno několika formami CYP a pro každou z nich může být tato molekula v jiném postavení (např. omeprazol je substrátem a současně inhibitorem CYP2C19, CYP3A4 a zároveň indukuje CYP1A2, diltiazem je substrátem CYP2C9 a zároveň inhibitorem CYP3A4 apod.). Více než polovina klinicky používaných léčiv je metabolizována CYP3A4 a dalších 30 % léčiv prostřednictvím CYP2D6. Další izoformy jsou v játrech zastoupeny méně, ale nelze je přehlížet, např. warfarin nebo široce užívaná NSAID a perorální antidiabetika ze skupiny derivátů sulfonylmočoviny jsou substráty CYP2C9, betablokátory nebo selektivní inhibitory zpětného vychytávání serotoninu (SSRI antidepresiva) typu paroxetinu CYP2D6, bupropion CYP2B6, paracetamol pak CYP2E1, klozapin, olanzapin nebo teofylin CYP1A2 [8].
Pro vyhodnocení závažnosti interakce je vždy důležité brát v potaz faktory, jako jsou dávka inhibitoru/induktoru, terapeutické rozmezí ovlivněného léčiva, délka terapie inhibitorem/induktorem, stav konkrétního pacienta a další okolnosti – např. (ne) možnost vyhnout se interakci a především povaha, resp. míra inhibice/indukce. Inhibitor je označen jako slabý v případě, že zvyšuje expozici substrátem daného enzymu (AUC) na 125–200 %, středně silný v případě, že zvyšuje expozici 2–5×, a silný inhibitor, pokud zvyšuje AUC více než 5× [9,10].
Interakce na úrovni cytochromu P450 jsou sice nejčastější a nejlépe prozkoumané, avšak nejsou to jediné farmakokinetické interakce. K interakci může dojít na každém kroku při pohybu léčiva organizmem – tedy od absorpce, přes distribuci, biotransformaci, až po exkreci (indukce a inhibice transportérů – PgP, MATE1, MATE2K, MRP, OATP, OCT, MDR2, BCRP, NTCP a další, dále ovlivnění glomerulární filtrace, podání vazopresorů, diuretik, nefrotoxických léčiv) [7].
Idiosynkrastické reakce mohou být výsledkem předchozí interakce dvou nebo více léčiv. Výsledkem je těžko předvídatelná, neočekávaná nežádoucí reakce, jejíž síla není závislá na množství podaných látek; jedná se o typ přecitlivělosti, která nevzniká postupně jako alergie opakovaným podáním alergizujícího agens, ale náhle, neočekávaně již při prvním podání – v tomto případě dvou nebo více látek, které spolu interagují. Typickým příkladem může být idiosynkrastická hepatitida po podání fluoxetinu, neuroleptický maligní syndrom u antipsychotik, cerebrální vaskulitida po podání methylfenidátu, myopie nebo akutní glaukomatický záchvat po hydrochlorothiazidu; někdy je za idiosynkrastickou reakci považován i vrozený deficit cholinesterázy s následnou paralýzou po podání suxamethonia [6,7,11].
Přehled inhibitorů a induktorů nejvýznamnějších forem cytochromu P450 je uveden v tab. 1 a 2 [8,10,12].
Rizikové skupiny pacientů
- Polymorbidní (vyšší počet užívaných léčiv – exponenciálně roste riziko interakce).
- Hospitalizovaní (vyšší počet léčiv, horší klinický stav, potvrzeno řadou studií).
- Starší (změny farmakokinetiky, farmakodynamiky, předpoklad vyššího počtu užívaných léčiv).
- Děti do věku cca 6 let (změny farmakokinetiky, farmakodynamiky oproti dospělým).
- Pacienti s orgánovou dysfunkcí (hepatální/renální insuficience).
- Pacienti se srdečním selháním (změny distribuce léčiva, perfuze orgánů).
- Onkologičtí pacienti (kachexie, hypoalbuminemie, chemoterapie poškozující eliminační schopnosti, vyšší počet konkomitantní medikace).
- Diabetici (horší renální funkce, poruchy imunitní odpovědi).
Vybrané skupiny léčiv (častěji užívaná a riziková léčiva) kardiologických pacientů
Antihypertenziva
Mezi nejčastěji zmiňované nevhodné kombinace léčiv patří kombinace betablokátorů (vč. oftalmologik (dochází totiž k signifikantní absorpci) s kalciovými blokátory non-dihydropyridinového typu (verapamil, diltiazem), což může vést k městnavému srdečnímu selhání, těžké hypotenzi a/nebo exacerbaci anginy pectoris. Při této kombinaci byly hlášeny také komorové asystoly, sinusová zástava a srdeční blokáda. Riziko se zvyšuje s dávkou, i. v. podáním, dysfunkcí levé komory nebo abnormalitami AV vedení. Betablokátory se metabolizují často prostřednictvím enzymů CYP (zejména CYP2D6) a tedy kombinace se středně silnými a silnými inhibitory (amiodaron, fluoxetin, sertralin, paroxetin) může zvýšit jejich plazmatické koncentrace a vyústit v bradykardii.
Riziková může být i kombinace betablokátorů s digoxinem, kdy se zvyšuje riziko bradykardie. Při kombinaci dochází ke zpomalení AV převodu a snižuje se srdeční frekvence (aditivní efekty). Karvedilol a esmolol zvyšují biodostupnost a zpomalují eliminaci digoxinu. Důvodem je pravděpodobně inhibice intestinálního a renálního P-glykoproteinového efluxního transportéru.
Kombinace diuretik s jakýmkoli léčivem prodlužujícím QTc (elektrická nestabilita, vyšší riziko arytmie), kombinace antagonistů PDE třídy 5 a nitrátů, což může výrazně snížit krevní tlak a vyústit v synkopu. Kombinace antagonistů aldosteronu a inhibitorů ACE, popř. sartanů může vést k hyperkalemii a facilitovat vznik arytmií.
Naopak kombinace kličkových diuretik, kortikosteroidů nebo metylxantinů (aminofylin, theofylin, kofein) může vést k hypokalemii s podobnými důsledky.
Účinek antihypertenziv je snižován řadou léčiv, mimo jiné NSAID (snížení syntézy prostaglandinů, perfuze ledviny, zadržování Na+) nebo glukokortikoidy (pro svůj mineralokortikoidní efekt).
Hypolipidemika
Mezi nejužívanější hypolipidemika patří statiny. Bohužel se současně jedná o nejrizikovější skupinu hypolipidemik z pohledu lékových interakcí. Většina těchto interakcí je na podkladě farmakokinetiky a je připisována současnému užití inhibitorů hlavních biotransformačních enzymů většiny statinů – jedná se především o CYP3A4, (simvastatin, lovastatin a atorvastatin) [13], popř. CYP2C9 (fluvastatin, rosuvastatin) nebo CYP2C8 (atorvastatin, cerivastatin). Příklady inhibitorů enzymů CYP jsou uvedeny v tab. 1 a 2. Důsledkem této interakce je zvýšení koncentrace a plochy pod křivkou statinů s možným zvýšením rizika rhabdomyolýzy a následné nefropatie. V případě hydrofilních molekul je ve hře ještě případná inhibice efluxního transportéru MRP2. Vzájemná kombinace statinů s fenofibrátem také zvyšuje riziko myopatie. Fenofibrát při kombinaci při kombinaci s ezetimibem zvyšuje jeho plazmatické koncentrace a zvyšuje riziko cholecystolitiázy [11,14].
![Induktory enzymů cytochromu P450 [8,10,12].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/279f274ffc1fec96d882fc25febc3cb3.png)
![Inhibitory enzymů cytochromu P450 [8,10,12].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/b73dc4e184bdc95212228bb4b8e5eb75.png)
Na druhou stranu, statiny mohou ovlivnit efekt jiných léčiv, zejména léčiv s úzkým terapeutickým rozmezím. Např. dle dánské kohortové studie rosuvastatin a atorvastatin při současném podání s warfarinem zvyšují mírně INR (o 0,27, resp. o 0,3); toto zvýšení je nezávislé na dávce statinu, klinická významnost je však diskutabilní [15,16].
Antiarytmika
Mezi léčiva ovlivňující srdeční rytmus patří celá řada léčiv s významným potenciálem lékových interakcí. Jedná se o léčiva s úzkým terapeutickým rozmezím a dále i léčiva, která ovlivňují farmakokinetiku koadministrovaných léčiv. Mezi takové patří např. interakce inhibitorů CYP (citalopram, simvastatin, lovastatin, klaritromycin). a amiodaronu, verapamilu nebo propafenonu.
Další skupinou interakcí antiarytmik jsou farmakodynamické interakce. Obávaným nežádoucím účinkem celé řady léčiv je jejich vliv na repolarizační fázi srdečního cyklu, což se v případě ovlivnění komorového myokardu manifestuje prodloužením QTc intervalu a vznikem závažných komorových tachyarytmií typu Torsade de pointes (TdP), které mohou vyústit do terminální fibrilace komor.
Mezi léčiva s indikací mimo oblast kardiologie a s potenciálem prodloužení QTc patří antiinfektiva (především chinolony, makrolidy, hydroxychlorochin, metronidazol), psychofarmaka (SSRI antidepresiva, celá řada antipsychotik), antiemetika (setrony, metoklopramid, domperidon, thiethylperazin), protinádorová léčiva (epirubicin, doxorubicin, oxaliplatina, alfuzosin), kognitiva (donepezil), bronchodilatancia (indacaterol, salmeterol, formoterol). Zdá se, že riziko tohoto typu interakce je zvýšené u některých genových polymorfizmů draslíkových iontových kanálů typu Iks a Ikr, ale také sodíkových kanálů SCN5A [17]. U predisponovaných osob je seznam léčiv, která by se měla používat obezřetně nebo raději nepoužívat vůbec, velmi obsáhlý [18].
Antikoagulancia
Potenciace účinku mezi léčivy této skupiny je jistě obecně velmi dobře známa (nízkomolekulární hepariny, nefrakcionovaný heparin, fondaparinux, warfarin a přímá perorální antikoagulancia – NOAC/DOAC), podobně dobře je zdokumentována i potenciace efektu protidestičkových léčiv, jako kyselina acetylsalicylová, klopidogrel, prasugrel, ticagrelor, kangrelor nebo NSAID. Antiagregační účinek mají i serotonergní antidepresiva SSRI, SARI a SNRI a i tyto interakce bývají klinicky významné. Zapomenout by se nemělo ani na doplňky stravy, z nichž některé mohou potencovat antiagregační a/nebo antikoagulační účinky (ginkgo, česnek, žen-šen, andělika čínská, šalvěj, medicinální houby – Reishi, Cordyceps) [14,19,21].
Tyto „class“ efekty jsou dobře známé, predikovatelné, preventabilní. Horší situace panuje u farmakokinetických interakcí, kde je situace méně přehledná.
Warfarin
Warfarin je metabolizován stereoselektivně – CYP2C9 metabolizuje (S-warfarin), CYP1A2 a CYP3A4 metabolizují R-warfarin. Jelikož CYP3A4 není polymorfní, pro účinek jsou důležité polymorfizmy především CYP2C9 a VKORC1. Vedle polymorfizmů CYP2C9 a VKORC1 (Vitamin K epOxide Reductase Complex (VKORC) subunit 1) ovlivňují účinek warfarinu i léčiva inhibující nebo indukující především CYP2C9 (amiodaron, omeprazol, propafenon). Menší roli v metabolizmu warfarinu hrají CYP3A4 a CYP1A2. Vedle biotransformace ovšem hladinu volné frakce a účinek warfarinu ovlivňují léčiva se silnou vazbou na plazmatické proteiny (např. některá antidiabetika ze skupiny derivátů sulfonylurey, NSAID).
Bezpečná je kombinace s betablokátory (ojediněle se objevují zmínky o inhibici CYP2C9 propranololem). Naopak nebezpečná je kombinace s amiodaronem, při které dochází ke zvýšení AUC warfarinu. Doporučuje se snižovat dávku o 35–50 % v závislosti na dávce a monitorovat protrombinový čas [19]. V případě statinů velmi záleží na konkrétním zástupci – řada z nich jsou substráty CYP2C9 a/nebo CYP3A4 a mohou metaboliszmus warfarinu kompetitivně inhibovat [15], popř. není mechanizmus interakce plně objasněn [20].
Přímé inhibitory trombinu a faktoru Xa
Apixaban a rivaroxaban – interakce na úrovni CYP3A4 a PgP, v menší míře i 2J2, v případě rivaroxabanu pak i 1A2.
Dabigatran je podáván jako proléčivo, nicméně na hydrolýze esteru se nepodílí enzymy CYP, je však substrátem PgP. Rifampicin, fenytoin nebo fenobarbital (induktory CYP3A a PgP) signifikantně snižují AUC dabigatranu – současné podání induktorů nebo inhibitorů PgP je tedy třeba se vyhnout, protože zvyšují tromboembolické riziko (tab. 3) [21,22].
![Enzymy a transportéry podílející se na eliminaci DOAC [22].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/3fa3c3e384e47b9af964333319958b8e.png)
Heparin a frakcionované hepariny
Zde hrozí interakce především farmakodynamického typu (viz výše), event. s látkami výrazně nefrotoxickými, které prodlouží eliminační poločas a následně je nutné upravovat dávky dle aktuální eGFR.
Antiagregancia
Při chronické terapii inhibitory protonové pumpy (IPP) dochází k poklesu absorpce aktivní formy ASA vlivem zvýšené hodnoty pH a snížení absorpce v žaludku a následné deacetylace střevními esterázami [23–25]. Podle dánského registru nemocných mají pacienti po prvním infarktu myokardu léčení současně IPP a ASA oproti pacientům užívajícím samotnou ASA o více než 40 % vyšší riziko vzniku kardiovaskulárních příhod [26].
Při kombinaci nízkodávkové ASA s mnohými NSAID stoupá riziko kardiovaskulárních příhod. Tento fenomén byl objasněn – NSAID se mohou vázat na argininový zbytek cyklooxygenázy a zamezují tak acetylaci COX acetylsalicylovou kyselinou [23,27–31]. Netýká se to však všech NSAID a tento efekt je dávkově závislý (tab. 4) [32].
![Přehled a srovnání užívaných antiagregancií [32].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/5961c01d1d81eec7888fbf34ce473ff9.png)
Diuretika
Diuretika zvyšují exkreci slabých aniontů (např. i salicylátů), ale i perorálních antidiabetik, a tak vedle negativního metabolického účinku thiazidů hraje při dekompenzaci diabetu roli i prosté urychlení eliminace antidiabetik. Diuretika zvyšují toxicitu digoxinu (svým hypokalemizujícím účinkem – krom kalium šetřících) [33]. Pro pacienty v intenzivní péči je také významná interakce s nedepolarizujícími myorelaxancii – kdy diuretika potencují jejich efekt. Navíc antagonizují účinky noradrenalinu při oběhové podpoře. Kličková diuretika naopak antagonizují efekt sukcinylcholinu a potencují nefrotoxický účinek jiných léčiv (aminoglykosidy, cefalosporiny, vankomycin, inhibitory kalcineurinu). Eplerenon je metabolizován CYP3A4, proto zde můžeme čekat interakce s jeho inhibitory/induktory. Diuretika také zvyšují koncentrace a toxicitu lithia [11,33,34].
Inhibitory protonové pumpy
Inhibitory protonové pumpy jistě patří mezi velmi často užívaná léčiva, zejména u pacientů se zavedenou dlouhodobou antiagregační nebo antikoagulační léčbou. Nejvýraznější jsou farmakokinetické interakce související s vlastním mechanizmem účinku a zamýšlenou indikací – snížení žaludeční kyselosti. Vzestup pH je pak příčinou snížené biodostupnosti slabých kyselin – ASA, dále železa, azolových antimykotik, kapecitabinu, vitamínu B12 aj. [35,36].
K mnoha dalším interakcím dochází na cytochromu P450, tedy během biotransformace. IPP bývají substráty či inhibitory izoforem 2C19 a 3A4, a tudíž mohou být zdrojem skutečně široké palety interakcí. Je třeba vzít v úvahu také kombinaci obou mechanizmů a řídit se platným SPC jednotlivých léčiv, protože zaznamenává především finální ovlivnění plazmatické hladiny společně podávaných, a proto interagujících léčiv, a to bez ohledu na konkrétní mechanizmus interakce či jejich kombinaci. Es/omeprazol je substrátem a zároveň středně silným inhibitorem CYP2C19, čímž zvyšuje expozici látek na něm přeměňovaných na inaktivní metabolity (citalopram, diazepam, propranolol, cilostazol, fenytoin, lansoprazol), ale zároveň snižuje účinnost látek, které jsou jakožto pro-drug na 2C19 teprve aktivovány (klopidogrel). Omeprazol je také substrátem CYP3A4, takže jeho metabolizmus je ovlivněn látkami, které tuto formu inhibují (ketokonazol) nebo indukují (hypericin, dexamethason). Lansoprazol má podobný interakční potenciál, vzhledem ke stejnému biotransformačnímu procesu, nicméně v porovnání s omeprazolem je interakcí zdokumentováno méně. Pantoprazol má k oběma zmíněným izoformám menší afinitu, a proto se ze všech tří hodí do kombinační léčby nejvíce (tab. 5) [6,14,35,36].
![Interakce inhibitorů protonové pumpy [6,14,35,36].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/9ac0e5e4c1debb250b7ac5614927bfa1.png)
Závěrem
Onemocnění kardiovaskulárního systému implikuje použití léčiv s vysokým interakčním potenciálem. Léčiva používaná v kardiologii mají velmi různorodé mechanizmy působení a z principu ovlivňují perfuzi tkání a orgánů – tím potažmo mohou působit změny ve farmakokinetických parametrech souběžně podávaných léčiv – změny dostupnosti, distribuce i eliminace. Často dochází k synergické (ale nežádoucí) interakci a zesílení nežádoucích účinků (např. prodloužení QTc, iontové dysbalance, zvýšení toxicity atd.).
Pro prevenci a identifikaci lékových interakcí lze využít celou řadu nástrojů. Mezi softwarové nástroje patří kontrola interakcí v nemocničních informačních systémech, které využívají oddíl 4.5 z SPC článků. Dále existují další nástroje, a to jak volně dostupné (drugs.com, medscape interaction checker), tak i zpoplatněné (Lexicomp, UpToDate, popř. Kontrolní modul lékových interakcí VADEMECUM DrugAgency, a. s.). V této souvislosti je však nutno podotknout, že se jedná „pouze“ o nástroje – tedy systémy, které nedokážou vždy posoudit např. dávkování (velikost dávky a jejich časový odstup od jiných léčiv) ani celkovou klinickou důležitost (např. relativně nízké celkové riziko plynoucí z prodloužení QTc při dočasné krátkodobé kombinaci některých antibiotik se stávající léčbou, zvláště pokud je pacient monitorován v lůžkovém zařízení). Pomoci identifikovat rizika a rozpoznat jejich závažnost může klinický farmakolog nebo farmaceut – ať už při vstupních kontrolách medikace nebo při vyžádaných konziliích.
Poděkování
Tato publikace vznikla za podpory specifického vysokoškolského výzkumu MUNI/A/1292/2019), kterou poskytlo MŠMT.
Doručeno do redakce: 13. 8. 2020
Přijato po recenzi: 22. 8. 2020
doc. PharmDr. Jan Juřica, Ph.D.
www.med.muni.cz
Sources
1. Smith CM. Origin and uses of primum non nocere – above all, do no harm! J Clin Pharmacol 2005; 45 (4): 371–377. doi: 10.1177/0091270004273680.
2. May FE, Stewart RB, Cluff LE. Drug interactions and multiple drug administration. Clin Pharmacol Ther 1977; 22 (3): 322–328. doi: 10.1002/cpt1977223322.
3. Egan LJ. Drug interactions in gastroenterology: mechanisms, consequences, and how to avoid. Clin Gastroenterol Hepatol 2004; 2 (9): 725–730. doi: 10.1016/s1542-3565 (04) 00343-x.
4. Doligalski CT, Tong Logan A, Silverman A. Drug interactions: a primer for the gastroenterologist. Gastroenterol Hepatol (N Y) 2012; 8 (6): 376–383.
5. Michalets E. Update: clinically significant cytochrome P-450 drug interactions. Pharmacotherapy 1998; 18 (1): 84–112.
6. DynaMed. Ipswich (MA): EBSCO Information Services. 1995–2018; 2019. Available at: https: //connect.ebsco.com/s/article/How-to-Cite-Information-from-DynaMed?language=en_US.
7. Ritter J, Flower R, Henderson G et al. (eds.) Rang & Dale‘s Pharmacology (8th ed.). Edinburgh, New York Elsevier: Churchill Livingstone 2015.
8. Anzenbacher P, Anzenbacherová E. Cytochromes P450 and metabolism of xenobiotics. Cell Mol Life Sci 2001; 58 (5–6): 737–747. doi: 10.1007/pl00000897.
9. Rodrigues AD. Prioritization of clinical drug interaction studies using in vitro cytochrome P450 data: proposed refinement and expansion of the „rank order“ approach. Drug Metab Lett 2007; 1 (1): 31–35. doi: 10.2174/187231207779814247.
10. FDA. Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers. 2020. Available at: https: //www.fda.gov/drugs/drug-interactions-labeling/drug-development-and-drug-interactions-table-substrates-inhibitors-and-inducers.
11. InfoPharm. AISLP. 2019. Dostupné na: https: //www.aislp.cz.
12. Flockhart D. Cytochrome P450 drug-interaction table. 2020. Available at: https: //drug-interactions.medicine.iu.edu/MainTable.aspx.
13. Franco D, Henao Y, Monsalve M et al. Hypolipidemic agents drug interactions: approach to establish and assess its clinical significance. Structured review. Farm Hosp 2013; 37 (6): 539–557. doi: 10.7399/FH.2013.37.6.1077.
14. Drug Interaction Checker. Available at: https: //reference.medscape.com/drug-interactionchecker.
15. Andrus MR. Oral anticoagulant drug interactions with statins: case report of fluvastatin and review of the literature. Pharmacotherapy 2004; 24 (2): 285–290. doi: 10.1592/phco.24.2.285.33137.
16. Engell AE, Svendsen AL, Lind BS et al. Drug-drug interaction between warfarin and statins: A Danish cohort study. Br J Clin Pharmacol 2020. doi: 10.1111/bcp.14428.
17. Kallergis EM, Goudis CA, Simantirakis EN et al. Mechanisms, risk factors, and management of acquired long QT syndrome: a comprehensive review. ScientificWorldJournal 2012; 2012: 212178. doi: 10.1100/2012/212178.
18. Woosley RL, Heise CW, Gallo T et al. QTdrugs List, 2020. AZCERT, Inc. 1822 Innovation Park Dr., Oro Valley, AZ 8575519.
19. Suchý D, Poklopová Z. Lékové interakce warfarinu s kardiovaskulárními léky. Klinická farmakologie a farmacie 2005; 19 (1): 40–42.
20. Doseděl M, Malý J, Vlček J. Lékové interakce statinů, jejich klinická závažnost a management. Remedia 2011; 21: 392–397.
21. Prokeš M, Suchopár J. Lékové interakce warfarinu a nových, přímých orálních antikoagulancií. Medicína pro praxi 2018; 15 (5): 267–275.
22. Wiggins BS, Dixon DL, Neyens RR et al. select drug-drug interactions with direct oral anticoagulants: JACC review topic of the week. J Am Coll Cardiol 2020; 75 (11): 1341–1350. doi: 10.1016/j.jacc.2019.12.068.
23. Wurtz M, Grove EL, Kristensen SD et al. The antiplatelet effect of aspirin is reduced by proton pump inhibitors in patients with coronary artery disease. Heart 2010; 96 (5): 368–371. doi: 10.1136/hrt.2009.181107.
24. Bultas J. Antiplatelet therapy – a pharmacologist’s perspective. Cor Vasa 2013; 55: e86–e94.
25. Bultas J, Karetová D. Rutinní kombinace duální protidestičkové léčby s inhibitory protonové pumpy – nevyléváme vaničku i s dítětem? Intervenční a akutní kardiologie 2013; 12 (1): 34–41.
26. Charlot M, Grove EL, Hansen PR et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. BMJ 2011; 342: d2690. doi: 10.1136/bmj.d2690.
27. Mosorjakova D, Paluch Z, Alusik S. Aspirin resistance. Bratislava Medical Journal. Bratislavske Lekarske Listy 2007; 108 (1): 7–13.
28. Mackenzie IS, Coughtrie MW, MacDonald TM et al. Antiplatelet drug interactions. J Intern Med 2010; 268 (6): 516–529. doi: 10.1111/j.1365-2796.2010.02299.x.
29. Haastrup PF, Gronlykke T, Jarbol DE. Enteric coating can lead to reduced antiplatelet effect of low-dose acetylsalicylic acid. Basic Clin Pharmacol Toxicol 2015; 116 (3): 212–215. doi: 10.1111/bcpt.12362.
30. Patrick J, Dillaha L, Armas D et al. A randomized trial to assess the pharmacodynamics and pharmacokinetics of a single dose of an extended-release aspirin formulation. Postgrad Med 2015; 127 (6): 573–580. doi: 10.1080/00325481.2015.1050341.
31. Bhatt DL, Grosser T, Dong JF et al. Enteric coating and aspirin nonresponsiveness in patients with type 2 diabetes mellitus. J Am Coll Cardiol 2017; 69 (6): 603–612. doi: 10.1016/j.jacc.2016.11.050.
32. Hall R, Mazer CD. Antiplatelet drugs: a review of their pharmacology and management in the perioperative period. Anesth Analg 2011; 112 (2): 292–318. doi: 10.1213/ANE.0b013e318203f38d.
33. Elliott WJ. Drug interactions and drugs that affect blood pressure. J Clin Hypertens (Greenwich) 2006; 8 (10): 731–737. doi: 10.1111/j.1524-6175. 2006.05939.x.
34. Medscape Interaction checker. Elektronická databáze. Dostupné na: https: //reference.medscape.com/drug-interactionchecker.
35. Lukáš M. Polymorbidní senior z pohledu gastroenterologa. Medicína pro praxi 2013; 10 (9–10): 300–303.
36. Rychlíčková J. Consequences of hypoacidity induced by proton pump inhibitors – a practical approach. Klin Onkol 2018; 31 (6): 409–413. doi: 10.14735/amko2018409.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2020 Issue 3
Most read in this issue
- Drug interactions – current and practical
- Selected drug interactions in cardiology
- Drug interactions with a focus on selected drug groups in cardiology
- Quality of life in patients after acute myocardial infarction