Akútna myeloblastová leukémia s alteráciami MLL protoonkogénu (11q23/ MLL+ AML)
Acute Myeloblastic Leukaemia with Alternationsof MLL Proto-Oncogene Protein (11q23/ MLL+ AML)
One of the most common chromosomal breakpoint regions in acute myeloid leukaemia is the chromosome band 11q23. The analysis of this region led to the discovery of the extremely promiscuous MLL gene, in which more than 60 MLL translocation partner genes have been described. Among the most frequent are t(9;11)(p21 – 22;q23)/ MLL ‑ AF9, t(10;11)(p13;q23)/ MLL ‑ AF10, t(11;19)(q23;p13)/ MLL ‑ ELL, ENL and t(6;11)(q27;q23)/ MLL ‑ AF6. The presented work provides an overview of the molecular mechanisms by means of which MLL proto ‑ oncogene can be converted into oncogene. Genetic alternations of the MLL Proto-Oncogene Protein besides translocation are also represented by complex chromosomal rearrangements, deletions, insertions, partial tandem duplications, amplifications and gains. These genetic alterations are described in the work from the diagnostic and prognostic point of view. Abnormalities of the MLL Proto-Oncogene Protein are usually connected with bad prognosis. For that reason, in oncological practice, particular attention is paid to introducing new genetic methods for their identification. The above work gives well arranged information about different types of genetic tests and their outcomes, which can help oncologists in predicting the prognosis, in minimal residual disease monitoring and in modifying oncological patient treatment.
Key words:
acute myeloid leukaemia – MLL Proto-Oncogene Protein – chromosomal translocations
:
Z. Mikulášová 1; D. Ilenčíková 1,2; T. Slamka 1; D. Ďurovčíková 2
:
Oddelenie onkologickej genetiky, Národný onkologický ústav, Bratislava, Slovenská republika
1; Katedra lekárskej genetiky SZU‑ FZŠŠ, Bratislava, Slovenská republika
2
:
Klin Onkol 2010; 23(6): 401-407
:
Reviews
U akútnej myeloblastovej leukémie je chromozómový prúžok 11q23 jedným z najčastejších zlomových regiónov. Analýza tejto oblasti viedla k objavu mimoriadne promiskuitného génu MLL, u ktorého bolo dodnes popísaných viac ako 60 MLL translokačných partnerov. Medzi najčastejšie patria t(9;11)(p21 – 22;q23)/ MLL ‑ AF9, t(10;11)(p13;q23)/ MLL ‑ AF10, t(11;19)(q23;p13)/ MLL ‑ ELL, ENL a t(6;11)(q27;q23)/ MLL ‑ AF6. Predložená práca poskytuje prehľad o molekulárnych mechanizmoch, pri ktorých sa MLL proto - onkogén môže zmeniť na onkogén. Genetické zmeny MLL protoonkogénu predstavujú okrem translokácií aj komplexné chromozómové prestavby, delécie, inzercie, parciálne tandemové duplikácie, amplifikácie a zisky. V práci sú opísané z hľadiska diagnostického a prognostického. Abnormality MLL protoonkogénu sa obvykle spájajú so zlou prognózou. Z tohto dôvodu sa v onkologickej praxi venuje mimoriadna pozornosť zavádzaniu genetických metód na ich identifikáciu. Uvedená práca prehľadne informuje o rozličných typoch a výsledkoch genetických testov, ktoré môžu pomôcť onkológom predikovať prognózu, monitorovať minimálnu reziduálnu chorobu a modifikovať liečbu onkologického pacienta.
Kľúčové slová:
akútna myeloblastová leukémia – MLL protoonkogén – chromozómové translokácie
Úvod
Akútna myeloblastová leukémia (AML) je charakterizovaná malígnou transformáciou myeloidnej bunky, pri ktorej dochádza k vzniku patologického klonu buniek – myeloblastov. Tieto strácajú schopnosť diferenciácie, maturácie, nepodliehajú regulačným mechanizmom a potláčajú ostatné zložky normálnej hemopoézy.
AML nie je jednou nozologickou jednotkou, ale zahŕňa množstvo podtypov, ktoré je možné ďalej klasifikovať podľa FAB a SZO klasifikácie, imunofenotypu a genetického nálezu.
Incidencia ochorenia
Vo všeobecnosti je incidencia AML 2,7 na 100 000 obyvateľov [1]. AML je častejšia u mužov a celkovo v európskej populácii. Vyššia incidencia AML sa vyskytuje u pacientov trpiacich dedičnými ochoreniami asociovanými s fragilitou chromatínu, ako je napr. Bloomov syndróm, Fanconiho anémia, Kostmannov syndróm, Wiskott Aldrichov syndróm alebo Ataxia teleangiectasia. Zvýšený výskyt AML bol zaznamenaný aj u niektorých častých, konštitučne podmienených numerických chromozómových anomálií, ako sú Downov (trizómia 21. chromozómu) a Klinefelterov (XXY a varianty) syndrom [2].
AML s alteráciami MLL protoonko-génu, tzv. 11q23/MLL+ AML, predstavuje 3–4 % zo všetkých AML prípadov a častejšie sa vyskytuje u mladých ľudí s de novo AML (5–7 %) a u terapiou indukovaných AML pacientov t - AML (10–15 %). U starších pacientov (60 a viac - ročných) sa pozoruje zriedkavo [3]. AML s prestavbami MLL protoonkogénu sa častejšie vyskytuje u dojčiat ako u dospelých a zvyčajne sa prejavuje AML M4M5 fenotypom [4]. Celkovo sa incidencia prestavieb MLL protoonkogénu u detí s AML pohybuje v rozmedzí 35–50 % [5]. Percentuálne zastúpenie sa u jednotlivých štúdií mierne odlišuje, pretože zastúpenie 11q23/ MLL+ AML závisí od metódy detekcie. MLL protoonkogén tiež býva relatívne častým cieľom kryptických prestavieb [6].
Etiológia a patogenéza
Príčina vzniku 11q23/ MLL+ AML nie je známa, ale významnú úlohu nepochybne zohráva ionizujúce žiarenie (najvyšší výskyt sa pozoroval päť až sedem rokov po expozícii žiarenia), chemické látky, ako je benzén a rôzne organické rozpúšťadlá, z liekov predovšetkým cytostatiká, z fyzikálnych faktorov elektromagnetické polia a iné. Patogenéza akútnych myeloblastových leukémií (AML) súvisí i s onkogénnymi fúznymi proteínmi, ktoré vznikajú v dôsledku chromozómových translokácií alebo inverzií [7] (tab. 1).
![Časté génové fúzie zapríčinené chromozómovými abnormalitami a asociované s akútnou myeloblastovou leukémiou a myelodysplastickým syndrómom (MDS) [21].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/dd396f1f15729e83c79f4ea387dba2e3.jpeg)
AML s abnormalitami MLL protoonkogénu
Svetová zdravotnícka organizácia (SZO) navrhla v roku 1999 špecifikovať 11q23/ MLL+ AML v rámci ALL ako samostatnú jednotku s opakujúcimi sa cy-togenetickými translokáciami. Táto myšlienka bola ďalej podporená biolo-gickými štúdiami, microarray analýzami, ktoré ukázali, že 11q23/ MLL+ AML má osobitý profil génovej expresie a že MLL+ leukemické blasty sa podobajú veľmi nezrelým progenitorovým bunkám [8]. AML s prestavbami MLL protoonkogénu je charakteristická vysokým stupňom klinickej a imunologickej heterogenity s variabilitou imunofenotypu, zodpovedajúca myleoidnému/ monocytovému pôvodu [9]. Prognóza ochorenia je nepriaznivá, premenlivá podľa typu translokácie, fenotypu a veku pacienta s AML. Prognostický efekt 11q23 aberácií môže závisieť od MLL partnerských génov. Mnohé štúdie dokázali, že translokácie t(6;11)(q27;q23) a t(10;11)(p12;q23) sú asociované so zlou prognózou, avšak translokácia t(9;11)(p22;q23) je spájaná s výrazne dlhším prežívaním pacientov [9,10]. Priaznivú prognózu však nemá žiadna z horeuvedených zmien.
MLL protoonkogén
MLL protoonkogén bol identifikovaný v roku 1991 a následne o rok kompletne charakterizovaný a klonovaný. Pôvod predchádzajúceho označenia ALL1 siaha až do roku 1970, kedy van den Bergh prvýkrát opísal prestavbu jeho oblasti u pacienta s lymfoblastickou leukémiou [9]. Neskôr vedci charakteristiku tohto génu skompletizovali a na základe translokácie 11q23 pozorovanej u myeloblastových i lymfoblastových leukémií dostal názov MLL (mixed lineage leukemia). Má ďaľšie synonymá: HRX (human trithorax) a Htrx1 vyjadrujúce jeho homológiu s trithorax (trx) génom u Drosophila melanogaster.
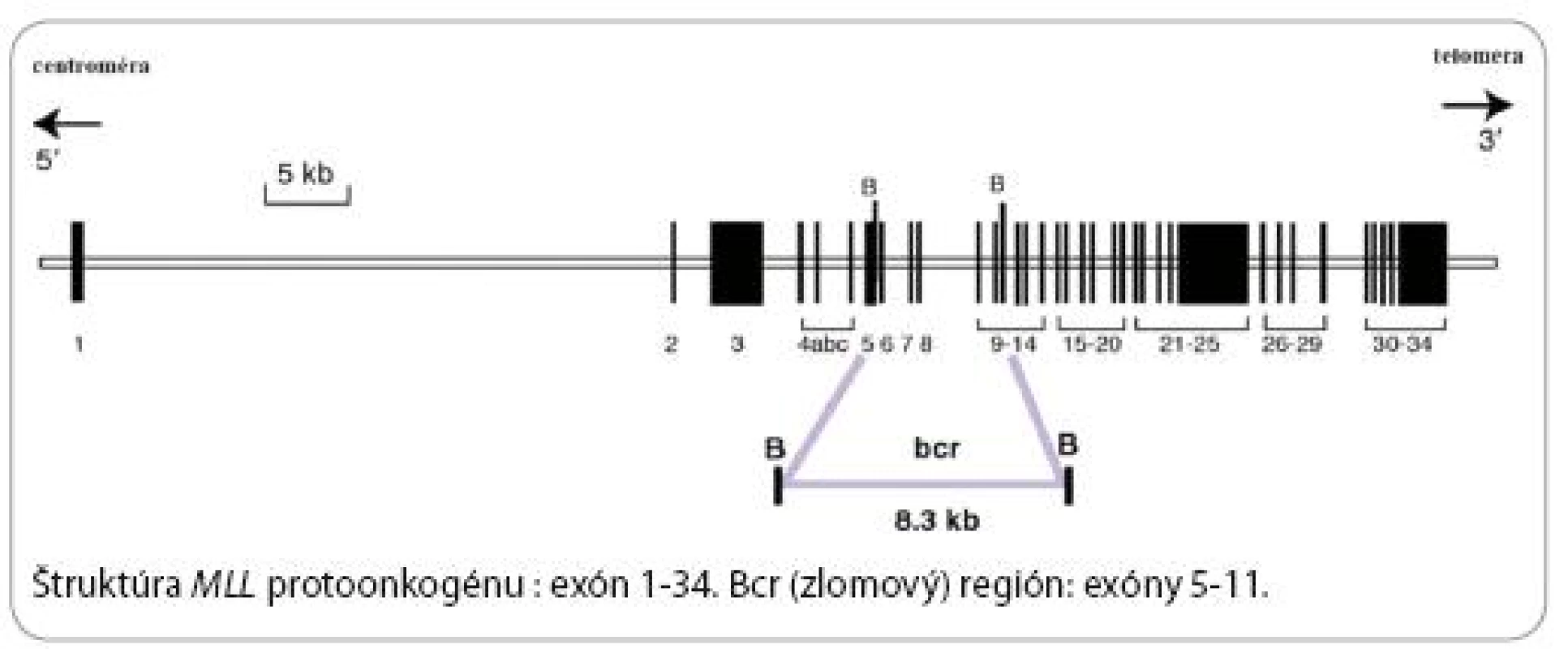
MLL (ALL1, HRX, Htrx) gén je lokalizovaný na dlhom ramienku 11. chromozómu (11q23) telomericky k PLFZ génu a centromericky od RCK génu (obr. 1).
Pozostáva z 36 exónov zaberajúcich veľkosť vyše 100 kb. Produktom 12kb mRNA je proteín s 3 968 aminokyselinami a molekulovou hmotnosťou cca 430 kD. Jeho transkripcia prebieha od centroméry k telomére. Väčšina, ale nie všetky zlomy MLL protoonkogénu sú lokalizované v 8,3 kb zlomovom regióne (bcr – breakpoint cluster region). Bcr región môže byť rozdelený na centromerickú a telomerickú časť. Zlomy MLL protoonkogénu u kojeneckej a t AML leukémie sa vyskytujú prevažne v telomerickej oblasti, kým zlomy u pacientov s de novo AML smerujú do blízkosti centroméry [11] (obr. 2).
MLL proteín
Produktom MLL protoonkogénu je veľký multidoménový jadrový proteín s obsahom 3 968 aminokyselín s predpokladanou molekulovou hmotnosťou 430 kD. MLL proteín sa exprimuje v rôznych tkanivách, napr. v mozgu, v hrubom čreve, v pečeni, v slezine, v týmuse, v obličkách, v mandliach, v srdci, v pľúcach, v testes a v štítnej žľaze. Tento proteín patrí do skupiny tzv. trithorax (trx G) proteínov, ktoré sú zodpovedné za udržiavanie expresie génov počas vývinu. Predpokladá sa, že MLL proteín kontroluje expresiu HOX génov. Viaceré HOX gény sa podieľajú na regulácii normálnej i leukemickej hemopoézy. Produkty HOX génov sú lokalizované v jadre a reprezentujú hlavnú triedu transkripčných faktorov kontrolujúcich bunkovú proliferáciu/ diferenciáciu počas skorého embryonálneho vývinu [12].
Mechanizmy premeny MLL proto onkogénu na onkogén
Rozsiahle cytogenetické a molekulové štúdie odhalili, že 11q23/ MLL je vysoko promiskuitný lokus. Na základe výsledkov súčasného a predchádzajúceho výskumu bolo doposiaľ charakterizovaných 64 MLL translokačných partnerských génov a ich špecifických zlomových regiónov, z čoho 35 chromozómových translokácií MLL protoonkogénu bolo špecifikovaných iba na cytogenetickej úrovni. Nedávno Meyer et al sekvenovaním odhalili 5 nových MLL partnerských lokusov [13]. Tieto lokusy však neobsahovali žiadny doposiaľ známy gén. MLL „rekombinóm“ v súčasnosti pozostáva zo 104 rôznych fúznych oblastí, otázkou zostáva, koľko ich ešte nepoznáme?
MLL proto onkogén sa môže zmeniť na onkogén viacerými mechanizmami, ako sú:
- chromozómové translokácie
- komplexné chromozómové prestavby, delécie, inverzie v oblasti 11q, inzercie MLL protoonkogénu do iných chromozómov alebo inzercia chromatínového materiálu do MLL protoonkogénu
- parciálne tandemové duplikácie
- amplifikácie a zisky (gainy)
A. Translokácie: MLL protoonkogén sa často zapája do chromozómových translokácií s inými génmi, ktoré vedú k zlomu v lokuse MLL a partnerskom géne so vznikom nového fúzneho génu. MLL fúzne proteíny (produkty týchto fúznych génov) sú často asociované s vývojom akútnych myeloblastových leukémií a ich onkogénne charakteristiky boli rozsiahle študované in vitro aj in vivo na myších modeloch [14].
Najčastejšie translokácie u 11q23/ MLL+ AML sú:
- t(9;11)(p22;q23)/ MLL, AF9
- t(10;11)(p12;q23)/ MLL – AF10
- t(6;11)(q27;q23)/ MLL – AF6
- t(11;19)(q23;p13)/ MLL – ELL, ENL(obr. 3, 4)
B. Parciálna tandemová duplikácia (PTD) a amplifikácia MLL
protoonkogénu
Okolo
7,5 %
AML pacientov s normálnym karyotypom ukrýva PTD MLL
protoonkogénu. MLL
PTD je jedinečne odlíšená od ostatných prestavieb MLL
protoonkogénu, ktoré majú za následok chimérické génové
fúzie. Pri MLL
PTD sa zachovávajú všetky proteínové domény kódované MLL
protoonkogénom [15]. MLL
parciálna tandemová duplikácia je častá u dospelých, ale
nie u detských pacientov s AML. Na nízkej úrovni bola
taktiež identifikovaná i u zdravých ľudí [16].
Frekvencia MLL
PTD u kojencov s AML, rovnako ako aj u starších detí
s AML nie je dostatočne objasnená. U dospelých pacientov
s de novo
AML a normálnym karyotypom sa prítomnosť MLL
PTD oproti jej chýbaniu spája so zlou prognózou (kratšia doba
remisie) [17] (obr. 5, 6).
![MLL protoonkogén a MLL PTD [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b2dc2a6e9365305129e1e7ed244fcebc.jpeg)
Predchádzajúce štúdie spájali MLL PTD s AML podtypom M1 a M2. V súčasnosti podľa FAB (najčastejšie používanej klasifikácie AML pochádzajúcej od francúzsko americko britskej skupiny z roku 1976) sa asociácia MLL PTD nepotvrdila so žiadnym špecifickým FAB podtypom AML. Naopak translokácie MLL sa vyskytujú prevažne u myelomonocytového (M4) a monocytového (M5) podtypu AML [18] (obr. 7).
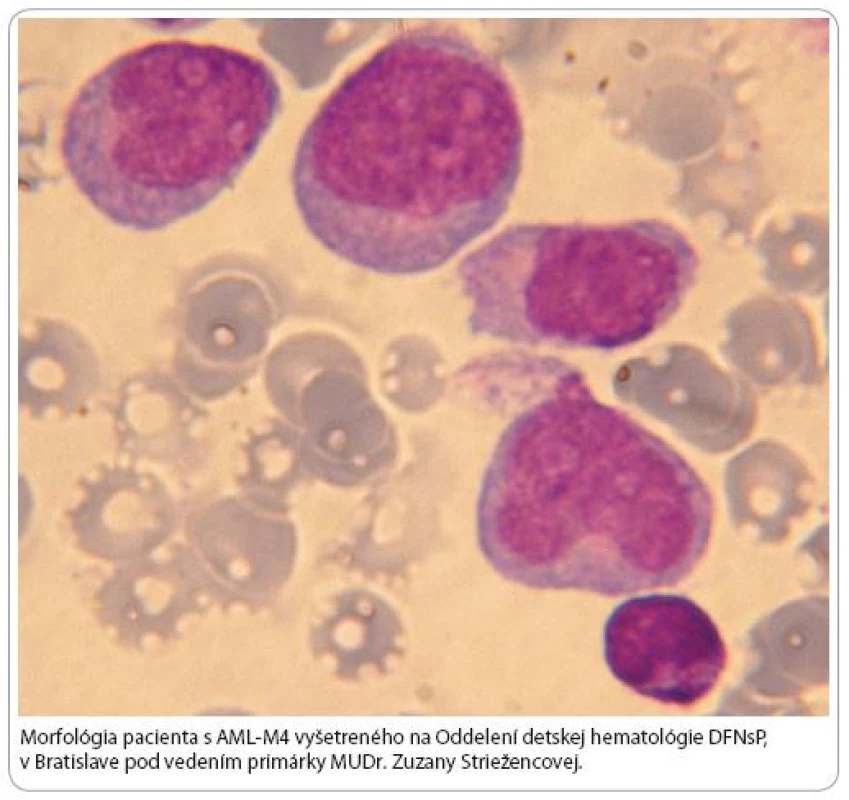
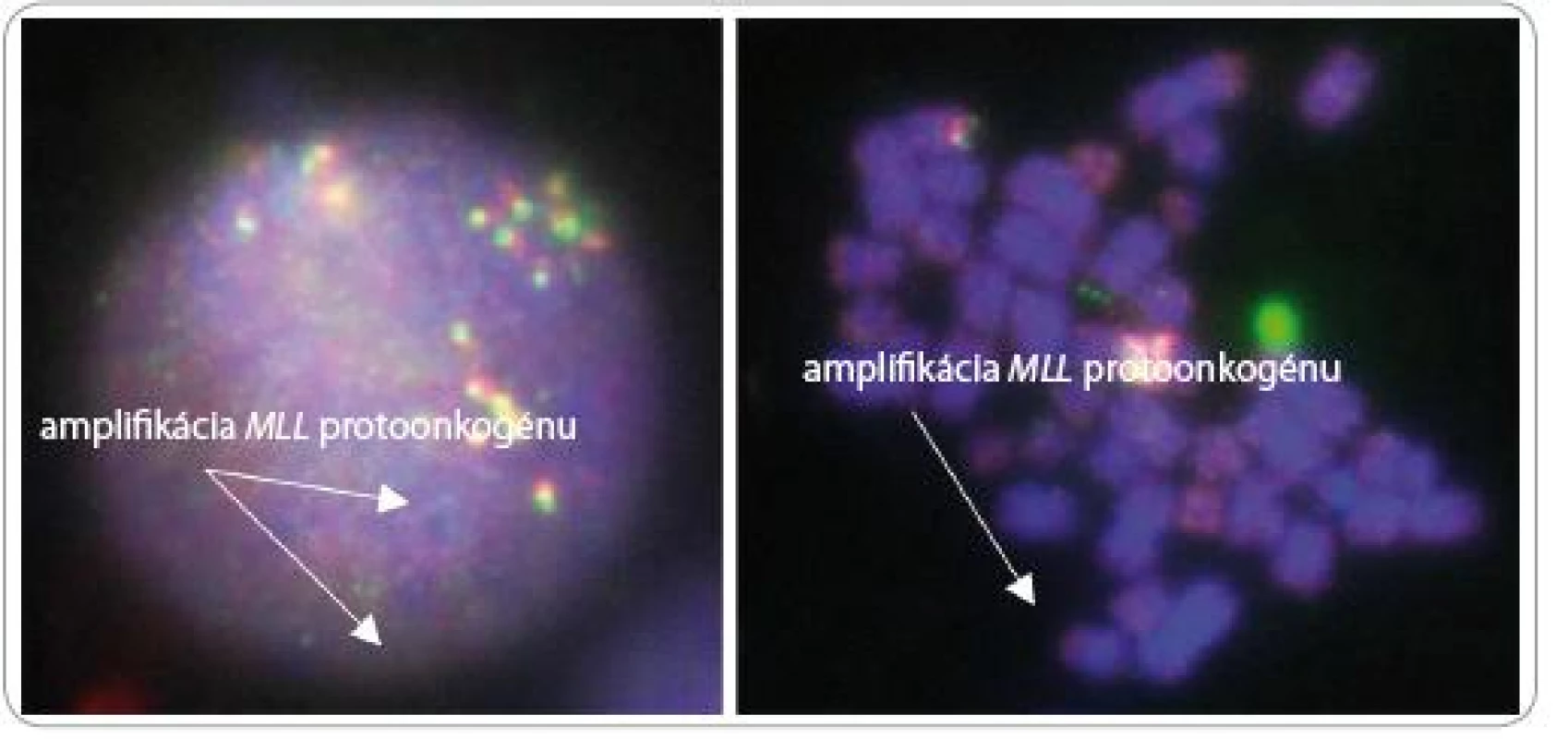
Pre niektorých AML pacientov je charakteristický zvýšený počet kópií MLL protoonkogénu v podobe tzv. „double minute“ chromozómov alebo homogénne sa farbiacich regiónov. Amplifikácia MLL protoonkogénu môže vznikať preskokovými translokáciami, pri ktorých sa amplikón z 11. chromozómu integruje do jedného alebo viacerých iných chromozómov, čím vznikajú mnohonásobné kópie MLL protoonkogénu. Vo všeobecnosti pod amplifikáciou génu rozumieme zmnoženie štruktúrne normálnych kópií génu, ktoré spôsobia nadprodukciu onkogénneho stimulačného proteínu. Tieto nadbytočné kópie protoonkogénu zvyšujú v bunke množstvo génového produktu, čím indukujú neobmedzenú bunkovú proliferáciu. Amplifikácia génu sa cytogeneticky zväčša manifestuje buď intrachromozomálne ako homogénne sa farbiaci región (homogeneously staining region – hsr), alebo extrachromozomálne ako tzv. „double minute“ chromozómy (dmin). Identifikáciu génov v amplifikovanom regióne nám umožňuje fluorescenčná in situ hybridizácia.
Amplifikácia génov, častá u širokého spektra tumorov, je u akútnych leukémií pozorovaná zriedkavo. Cytogenetickou analýzou sa v podobe dmin (oblasť MLL protoonkogénu) zistí približne u 1 % pacientov s AML [19].
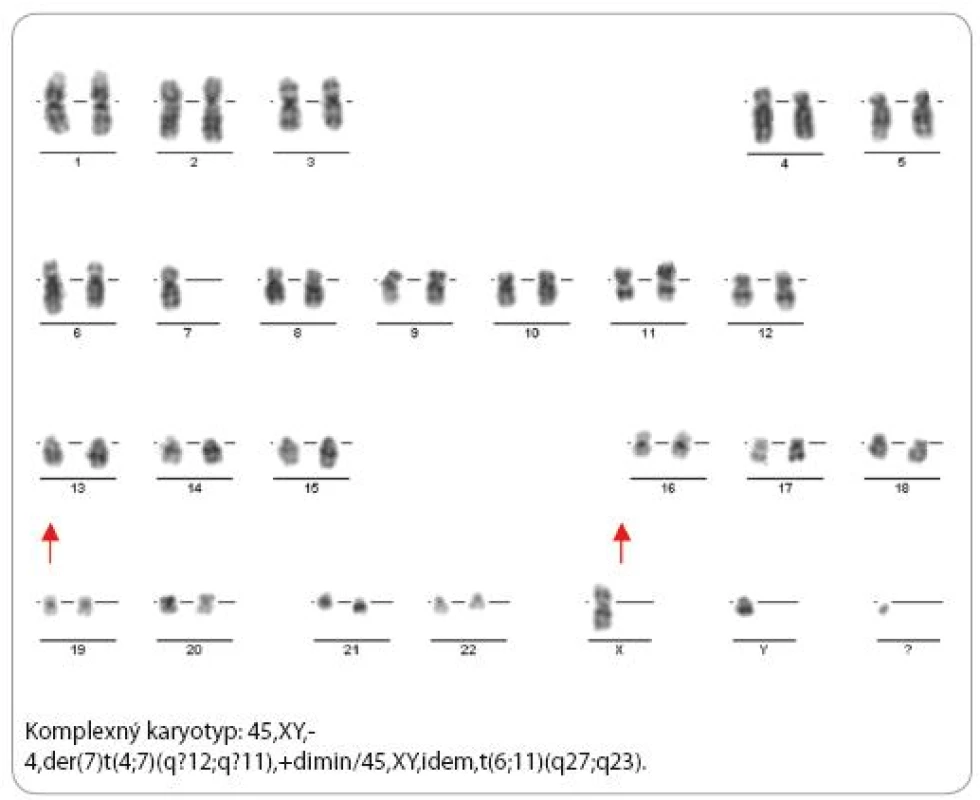
Zistilo sa, že pacienti s amplifikáciou MLL protoonkogénu zdieľajú viacero spoločných charakteristík: sú starší ako 60 rokov, majú de novo AML, komplexný karyotyp, krátku dobu prežívania a 90 % z nich aj deléciu 5q (obr. 8).
Metódy detekcie prestavieb MLL protoonkogénu
V súčasnej dobe cielenej protinádorovej terapie pacienta sa identifikácia genetických aberácií u leukémie stáva čím ďalej významnejšou. Výsledky genetických testov slúžia pre zatriedenie jednotlivých pacientov do príslušných prognostických skupín a umožnia modulovať špecifitu a intenzitu ich terapie. V diagnostike sa na identifikáciu rôznych preskupení MLL protoonkogénu rutinne používa cytogenetická analýza, fluorescenčná in situ hybridizácia (FISH) a reverzne transkriptázová polymerázová reťazová reakcia (RT PCR). Spektrum metód plánujeme v blízkej dobe rozšíriť o LDI PCR (long distance inverse PCR), ktorá slúži na detekciu všetkých preusporiadaní MLL protoonkogénu na molekulovej úrovni.
Klasická cytogenetika slúži na stanovenie celkového karyotypového obrazu ochorenia a monitorovanie priebehu ochorenia. Poskytuje celkový prehľad o kvalitatívnych a kvantitatívnych odchýlkach karyotypu a odhaľuje primárne a sekundárne klonálne zmeny.
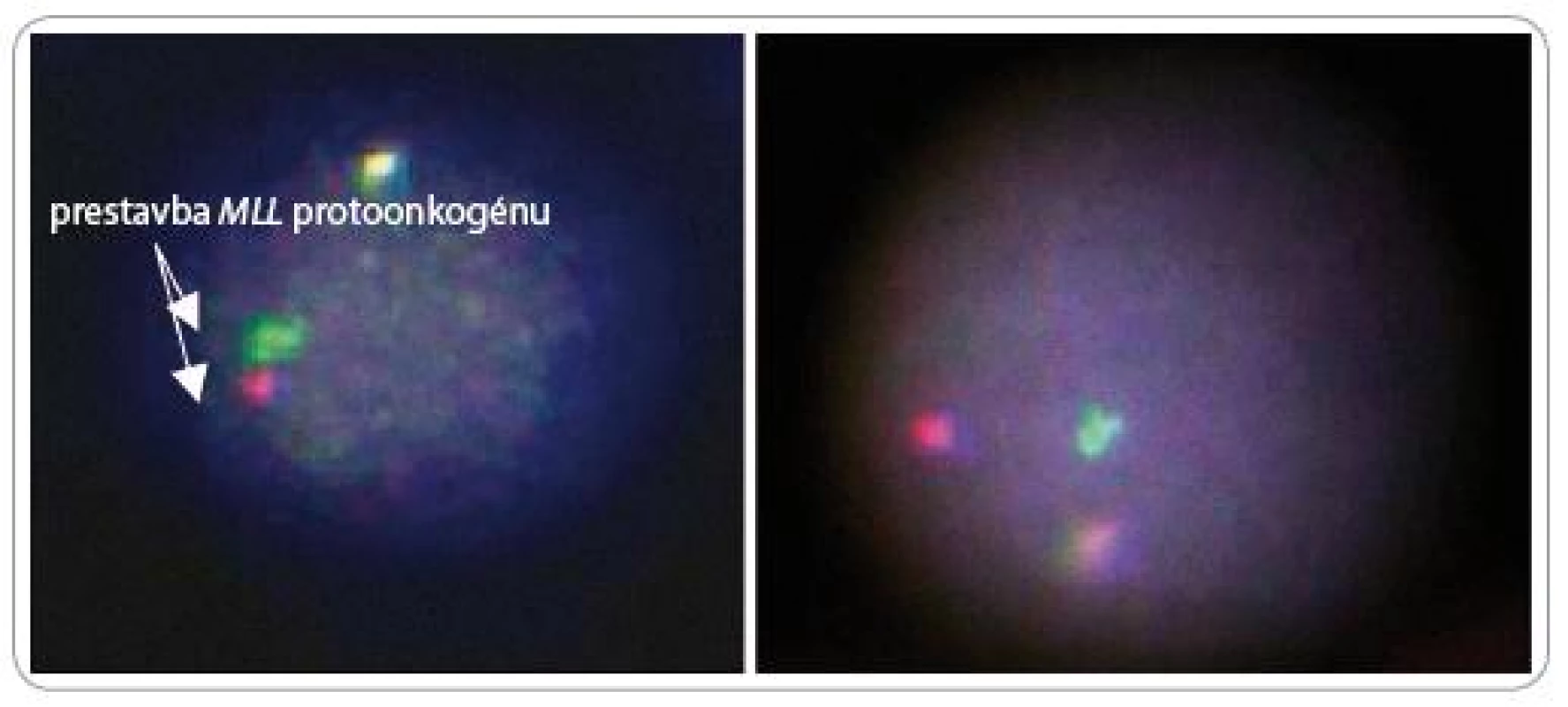
Fluorescenčná in situ hybridizácia (FISH) patrí k metódam molekulovej cytogenetiky a umožňuje detegovať špecifické nukleotidové sekvencie s rozsahom od jednej po niekoľko sto kilobáz. Princíp tejto metódy spočíva v schopnosti jednoreťazcovej DNA sondy viazať sa s komplementárnym úsekom vyšetrovanej jednovláknovej DNA pacienta. Pomocou špecifických sond možno identifikovať počet chromozómov, odlíšiť jednotlivé alebo identifikovať špecifické chromozómové oblasti (lokusy). Tým, že je FISH metóda aplikovateľná na metafázne i interfázne bunky, prekonal sa jeden z najväčších problémov klasickej cytogenetickej analýzy. Na detekciu prestavieb, amplifikácií a delécií MLL protoonkogénu sa využíva prestavbová sonda LSI® MLL Dual Color, Break Apart Rearrangement Probe (Vysis).
RT PCR (reverzne transkriptázová PCR) je vhodná, hlavne ak sa nepozná vnútorná organizácia exónov a intrónov v géne. Prvý krok predstavuje izolácia mRNA príslušného génu z tkaniva. Z mRNA sa za pomoci enzýmu reverznej transkriptázy a oligo dT primeru vytvorí komplementárna DNA (cDNA), ktorá slúži ako templát pre PCR. S využitím vhodných primerov sa potom špecifická sekvencia cDNA amplifikuje prostredníctvom PCR. Výsledný produkt sa následne vizualizuje na agarózovom géli.
MRT PCR (multiplexná reverzne transkriptázová PCR)
Andersson et al vyvinuli túto rýchlu a presnú metódu na identifikáciu šiestich najčastejších translokácií MLL protoonkogénu: MLL/ AF4 (akútna lymfoblastová leukémia), MLL/ AF6, MLL/ AF9, MLL/ AF10, MLL/ ENL, MLL/ ELL [20]. PMRT PCR je založená na dvoch individuálnych krokoch. V prvom kroku sa využíva mix vonkajších („out“) primerov a v druhom kroku mix vnútorných („in“) primerov, čím sa umožňuje detekcia šiestich fúznych génov v dvoch multiplex PCR reakciách. Teda každá vzorka je testovaná na prítomnosť príslušného fúzneho génu hneď dvakrát. Primery sú navrhnuté tak, že v prvom kroku vzniká významne väčší produkt ako v druhom, čo zvyšuje špecificitu tejto metódy. V prípade potreby sa PMRT PCR analýza môže rozšíriť o vyšetrenie ďalších fúznych génov [20].
Záver
Pri AML sa doposiaľ identifikovalo množstvo štruktúrových a numerických chromozómových aberácií. Slúžia nielen ako diagnostické markery pre špecifické podtypy AML, ale predstavujú dôležité prognostické faktory pre dosiahnutie kompletnej remisie, rizika relapsu a celkového prežívania pacienta. Aberácie MLL protoonkogénu u pacientov s AML predikujú nepriaznivú prognózu, čím sa ich identifikácia horeuvedenými molekulovo genetickými vyšetrovacími metódami stala klinicky mimoriadne významnou.
Na Slovensku sa ich detekcii venuje Oddelenie onkologickej genetiky Národného onkologického ústavu v Bratislave. V rámci medzinárodnej spolupráce s Diagnostickým centrom akútnej leukémie Inštitútu farmaceutickej biológie vo Frankfurte zabezpečuje pre detských a dospelých AML pacientov na Slovensku vyšetrenie MLL protoonkogénu v celej šírke uvedených diagnostických metód. Takáto komplexná diagnostika MLL protoonkogénu upresňuje diagnostiku podtypu AML, predikuje prognózu a umožňuje monitorovať liečbu pacienta.
Autoři
deklarují, že v souvislosti s předmětem studie nemají žádné
komerční zájmy.
The
authors declare they have no potential conflicts of interest
concerning drugs, products, or services
used in the study.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do bi omedicínských
časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform
requirements” for biomedical papers.
doc.
MUDr. Denisa Ilenčíková, PhD.
Klinika
lekárskej genetiky SZU a FNsP
Limbová
5
833
05
Bratislava
e-mail:
denisa.ilencikova9@gmail.com
Sources
1. Jabbour EJ, Estey E, Kantarjian HM et al. Adult Acute Myeloid Leukemia. Mayo Clin Proc 2006; 81(2): 247 – 260.
2. Pedersen ‑ Bjergaard J, Christiansen DH, Andersen MK et al. Causality of myelodysplasia and acute myeloid leukemia and their genetic abnormalities. Leukemia 2002; 16(11): 2177 – 2184.
3. Schoch C, Schnittger S, Klaus M et al. AML with 11q23/ MLL abnormalities as defined by the WHO classification: incidence, partner chromosomes, FAB subtype, age distribution, and prognostic impact in an unselected series of 1897 cytogenetically analyzed AML cases. Blood 2003; 102(7): 2395 – 2402.
4. Haferlach T, Schoch C, Schnittger S et al. Distinct genetic patterns can be identified in acute monoblastic and acute monocytic leukaemia (FAB AML M5a and M5b): a study of 124 patients. Br J Haematol 2002; 118(2): 426 – 431.
5. Arnaud B, Douet ‑ Guilbert N, Morel F et al. Screening by fluorescent in situ hybridization for MLL status at diagnosis in 239 unselected patients with acute myeloblastic leukemia. Cancer Genet Cytogenet 2005; 161(2): 110 – 115.
6. Cox MC, Panetta P, Lo ‑ Coco F et al. Chromosomal Aberration of the 11q23 Locus in Acute Leukemia and Frequency of MLL Gene Translocation: results in 378 adult patients. Am J Clin Pathol 2004; 122(2): 298 – 306.
7. Alcalay M, Meani N, Gelmetti V et al. Acute myeloid leukemia fusion proteins deregulate genes involved in stem cell maintenance and DNA repair. J Clin Invest 2003; 112(11): 1751 – 1761.
8. Armstrong SA, Staunton JE, Silverman LB et al. MLL translocations specify a distinct gene expression profile that distinguishes a unique leukemia. Nat Genet 2002; 30(1): 41 – 47.
9. Cimino G, Rapanotti MC, Sprovieri T et al. All1 gene alternations in Acute leukemia: biological and clinical aspects. Haematologica 1998; 83(4): 350 – 357.
10. Wakui M, Kuriyama K, Miyazaki Y et al. Diagnosis of acute myeloid leukemia according to the WHO classification in the Japan Adult Leukemia Study Group AML‑97 protocol. Int J Hematol 2008; 87(2): 144 – 151.
11. Broeker PL, Super HG, Thirman MJ et al. Distribution of 11q23 breakpoints within the MLL breakpoint cluster region in de novo acute leukemia and in treatment‑related acute myeloid leukemia: correlation with scaffold attachment regions and topoisomerase II consensus binding sites. Blood 1996; 87(5): 1912 – 1922.
12. Giampaolo A, Felli N, Diverio D et al. Expression pattern of HOXB6 homeobox gene in myelomonocytic differentiation and acute myeloid leukemia. Leukemia 2002; 16(7): 1293 – 1301.
13. Meyer C, Kowarz E, Hofmann J et al. New insights to the MLL recombinome of acute leukemias. Leukemia 2009; 23(8): 1490 – 1499.
14. Ayton PM, Cleary ML. Molecular mechanisms of leukemogenesis mediated by MLL fusion proteins. Oncogene 2001; 20(40): 5695 – 5707.
15. Whitman SP, Liu S, Vukosavljevic T et al. The MLL partial tandem duplication: evidence for recessive gain‑of ‑ function in acute myeloid leukemia identifies a novel patient subgroup for molecular ‑ targeted therapy. Blood 2005; 106(1): 345 – 352.
16. Libura M, Asnafi V, Tu A et al. FLT3 and MLL intragenic abnormalities in AMLreflect a common category of genotoxic stress. Blood 2003; 102(6): 2198 – 2204.
17. Caligiuri MA, Strout M, Lawrence D et al. Rearrangement of ALL1 (MLL) in acute myeloid leukemia with normal cytogenetics. Cancer Res 1998; 58(1): 55 – 59.
18. Schnittger S, Kinkelin U, Schoch C et al. Screening for MLL tandem duplication in 387 unselected patients with AML identify a prognostically unfavorable subset of AML. Leukemia 2000; 14(5): 796 – 804.
19. Tanaka K, Takechi M, Nishimura S. et al. Amplification of the c ‑ MYC oncogene and point mutation of N ‑ RAS oncogene in acute myelocytic leukemia with double minute chromosomes. Leukemia 1993; 7(3): 469 – 473.
20. Andersson A, Höglund M, Johansson B et al. Paired multiplex reverse ‑ transcriptase polymerase chain reaction (PMRT‑PCR) analysis as a rapid and accurate diagnostic tool for the detection of MLL fusion genes in hematologic malignancies. Leukemia 2001; 15(8): 1293 – 1300.
21. Rego EM. Molecular basis of Acute myelogenous Leukemia. Rev bras hematol hemoter 2002; 24(3): 163.
22. Gene Cards. The Human Gene Compendium. MLL Gene. Dostupné z http://www.genecards.org/cgi-bin/carddisp.pl?gene=MLL&search=MLL.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2010 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- New Therapeutic Options in Therapy of Glioblastoma Multiforme
- Acute Myeloblastic Leukaemia with Alternationsof MLL Proto-Oncogene Protein (11q23/ MLL+ AML)
- Actual Problems in Structure and Orientation of Concise National Cancer Control Programs
- The Problematic of Original and Generic Drugs and Biosimilars – Switching of Drugs Today and Tomorrow with the Main Targeting on Biotechnologies- Associated Risks
- Evaluation of Neoadjuvant Chemo- Radiotherapy with Locally Advanced Rectal Cancer by Comparing Tumour Volume before and after Treatment
- Hormonal Contraceptives and Their Relationship to Breast Cancer
- Postoperative Accelerated Partial Radiotherapy for Breast Cancer
- Economic Evaluation of Targeted Biologic Therapy in Metastatic Renal Cell Carcinoma
- Malignant Subtype of Cystosarcoma Phyllodes with Brain Metastases
- The Variance of Melphalan Doses Related to Kilogram of Body Weight and the Consequences
- Genetic Testing and Prevention of Hereditary Cancer at the MMCI – Over 10 Years of Experience
- Inflammatory Skin Metastasis as a First Sign of Progression of Lung Cancer – a Case Report
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- New Therapeutic Options in Therapy of Glioblastoma Multiforme
- Hormonal Contraceptives and Their Relationship to Breast Cancer
- Acute Myeloblastic Leukaemia with Alternationsof MLL Proto-Oncogene Protein (11q23/ MLL+ AML)
- Postoperative Accelerated Partial Radiotherapy for Breast Cancer

![Chromozóm č. 11 [22].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0cd53a41ffa5f6441ad9d274bf0dcf44.jpeg)