Radiofrekvenční ablace neuroendokrinního nádoru pankreatu
Radiofrequency Ablation of Pancreatic Neuroendocrine Tumor
Backrounds:
Pancreatic neuroendocrine tumors (PNETs) include a broad range of neoplasms spanning from relatively benign to malignant. Radical resection has been advocated as the only curative method. Debulking (R2) resection can be indicated for locally unresectable PNETs. Debulking surgery improves the quality of life and prolongs overall survival. The disadvantages of this approach include bleeding, pancreatic fistula and tumor spread. No alternative method that would eliminate these complications has been published yet. Considering the encouraging results of the studies describing radiofrequency ablation (RFA) of locally advanced pancreatic cancer, a question arises, whether it might be possible to use RFA as a R2 resection alternative in PNETs.
Case:
A 73-year-old gentleman had been admitted due to abdominal pain and hyperglycaemic syndrome. Contrast-enhanced CT showed a tumor of pancreatic head invading portal vein (PV) and superior mesenteric vein (VMS). A surgery was indicated on the basis of EUS-guided FNAB that verified a PNET of uncertain biological behaviour. The surgery confirmed a locally advanced tumor of pancreatic head invading the PV and SMV. Due to the polymorbidity, radical pancreatoduodenectomy with SMV resection was not indicated. Because of the presence of symptoms, RFA of the PNET using ValleyLab generator with cooltip cluster electrode, was performed. Postoperative course was uneventful. Final immunohistochemical examination verified a well-differentiated grade 1 PNET. The patient was regularly monitored during a three-year follow-up. The quality of life was evaluated using standardized EORT QLQ-30 questionnaire. Pain was assessed by a ten-point visual analogue scale (VAS). Ablated area was evaluated annually by contrast-enhanced CT. Postoperatively, abdominal pain ceased (pain decrease from 2 to 0 on VAS). Insulin dose was reduced from 46 IU (international units) to 20 IU of Humulin-R per day. CT verified tumor regression according to RECIST (response evaluation criteria in solid tumors). During the three-year follow-up, no local progression or tumor dissemination was observed.
Conclusion:
We present the first case report of a patient with locally advanced symptomatic pancreatic neuroendocrine tumor successfully treated by intraoperative radiofrequency ablation. More clinical studies are needed to evaluate the clinical relevance of this cytoreductive method in the PNET indication.
Key words
pancreas – neuroendocrine tumor - radiofrequency ablation – debulking resection
This work was supported by grants of IGA of the Ministry of Health NS10419-3/2009 and NS10239-3/2009.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
J. Hlavsa 1; V. Procházka 1
; Z. Kala 1
; M. Man 2; T. Andrašina 3
; M. Číhalová 4; V. Válek 4; M. Crha 5; I. Svobodová 6; L. Urbanová 5
Authors‘ workplace:
Chirurgická klinika, LF MU a FN Brno-Bohunice
1; Chirurgické oddělení Nemocnice TGM, Hodonín
2; Radiologická klinika, LF MU a FN Brno-Bohunice
3; Ústav patologie, LF MU a FN Brno-Bohunice5 Klinika chirurgie malých zvířat, VFU Brno6 Ústav patologie FN u sv. Anny, Brno
4
Published in:
Klin Onkol 2011; 24(3): 209-215
Category:
Case Reports
Overview
Východiska:
Neuroendokrinní nádory pankreatu (PNETs) zahrnují široké spektrum neoplazií od relativně benigních po vysloveně maligní léze. Za jedinou kurativní léčbu je považována radikální resekce. V případě lokálně neresekabilních PNETs lze indikovat debulking (R2) resekci, která může zlepšit kvalitu života a prodloužit celkové přežití. Její nevýhodou je riziko krvácení z ranné plochy pankreatu, možnost vzniku pankreatické píštěle a diseminace nádoru. Alternativní metoda, která by eliminovala nevýhody R2 resekce, dosud publikována nebyla. Vzhledem k povzbudivým výsledkům studií popisujících radiofrekvenční ablaci (RFA) lokálně pokročilého karcinomu pankreatu se nabízí otázka, zda by RFA nebylo možné užít jako alternativy chirurgické R2 resekce u pacientů s PNETs.
Případ:
Představujeme kazuistiku 73letého polymorbidního muže, který byl vyšetřován pro bolesti břicha doprovázené hyperglykemickým syndromem. Kontrastní CT zobrazilo nádor hlavy pankreatu infiltrující vena portae (VP) a vena mesenterica superior (VMS). Na základě EUS (endoskopická ultrasonografie) navigované FNAB (fine needle aspiration biopsy), která prokázala PNET nejasné biologické povahy, byla indikována operační revize. Peroperačně byl nalezen tumor hlavy a krčku pankreatu cirkulárně infiltrující VP i VMS v úseku 8 cm. Pro významnou polymorbiditu pacienta nebyl radikální výkon typu hemipankreatoduodenektomie s resekcí VMS indikován. Vzhledem k přítomnosti symptomů bylo rozhodnuto o provedení RFA. Ablace byla provedena ze třech vpichů „cool-tip“ cluster elektrodou s užitím RFA generátoru firmy Valleylab. Pooperační průběh byl nekomplikovaný. Definitivní histologické vyšetření prokázalo neuroendokrinní nádor pankreatu grade 1 dle WHO klasifikace. Pacient byl během následujících tří let pravidelně sledován. V rámci sledování byla pomocí standardizovaného dotazníku EORT QLQ-30 hodnocena kvalita života. Bolest byla sledována prostřednictvím desetistupňové vizuální analogové škály (VAS). Lokální nález na pankreatu byl hodnocen pomocí kontrastního CT prováděného v intervalech jednoho roku. V pooperačním období došlo k vymizení bolestí břicha (pokles z hodnoty 2 na hodnotu 0 dle VAS). Dávku inzulinu bylo možno z 46 IU (international unit) snížit na 20 IU krystalického inzulinu Humulin-R na den. Kontrastní CT potvrdilo regresi nádoru dle RECIST (Response Evaluation Criteria in Solid Tumors). Během tříletého sledování nedošlo k diseminaci ani lokální progresi nádoru.
Závěr:
Je prezentován v literatuře ojedinělý případ pacienta s lokálně pokročilým neuroendokrinním nádorem pankreatu úspěšně řešeným peroperační radiofrekvenční ablací. K posouzení klinického efektu této cytoredukční metody v indikaci PNET je třeba rozsáhlejších klinických studií.
Klíčová slova:
pankreas – neuroendokrinní nádor – radiofrekvenční ablace – debulking resekce
Východiska
Radikální resekce je považována za jedinou kurativní metodu v léčbě pankreatických neuroendokrinních nádorů (PNETs) [1–3]. Na rozdíl od karcinomu pankreatu může být resekční výkon u nediseminovaného PNET indikován i v případě lokálně pokročilého onemocnění – infiltrace peripankreatických orgánů a cév (žaludek, ledvina, nadledvina, tračník, horní mezenterická žíla a tepna, truncus coeliacus, vena cava inferior, aorta) [4–8]. Resekce primárního PNET může zlepšit prognózu i u pacientů s jaterními metastázami, zejména v případech, kdy jsou metastázy resekabilní [9–14].
U pacientů s neresekabilními jaterními metastázami je metodou volby transarteriální chemoembolizace (TACE), která může být využita i jako přemosťující léčba před eventuální transplantací jater. Tu lze zvažovat pouze v případě absence extrahepatálního postižení, respektive pouze tehdy, je-li možná radikální resekce primárního nádoru. Dalším „inclusion“ kritériem je věk pod 60 let [15–17]. Adjuvantní ani neoadjuvantní chemoterapie není u PNETs, vzhledem k jejich relativní chemorezistenci, indikována.
Lze tedy shrnout, že u všech pacientů s neuroendokrinním nádorem pankreatu je nutné zvážit resekční výkon, který může, a to i v případech lokálně pokročilého nebo metastatického nádoru, přinést benefit pro pacienta. Technicky vzato neexistuje lokálně neresekabilní PNET. S rostoucí radikalitou operačního výkonu ale roste i perioperační morbidita a mortalita. Rozhodnutí o typu resekčního výkonu ve smyslu „superradikální“ (multiorgánové resekce, resekce velkých cévních kmenů), radikální, debulking, spojkové operace nebo konzervativního postupu je proto přísně individuální a je ovlivněno celkovým stavem pacienta, přítomností symptomů, očekávanou prognózou (staging a grading nádoru) a kvalitou života po výkonu. U symptomatických pacientů, u kterých z důvodů nízkého Karnofského indexu nebo lokální pokročilosti nelze nádor radikálně odstranit, připadá v úvahu debulking (R2) resekce. Tato dle některých studií může vést k redukci příznaků hormonální nadprodukce (flush, hyper/hypoglykemie), oddálení duodenální a žlučové obstrukce, redukci bolesti a k prodloužení přežití [8]. Podmínkou R2 resekce je možnost odstranění více než 90 % masy nádoru. V literatuře lze nalézt několik prací popisujících užití radiofrekvenční ablace (RFA) jako paliativní cytoredukční metody v léčbě lokálně pokročilého karcinomu pankreatu [18–24]. Cytoredukční metoda, která by byla alternativou chirurgické R2 resekce u pacientů s PNETs, dosud publikována nebyla. Prvním náznakem možnosti užití některé z termoablačních metod v indikaci PNET je práce Limmera z roku 2009, ve které popisuje případ 80leté ženy s hormonálně aktivním inzulinomem kaudy pankreatu řešeným CT navigovanou perkutánní radiofrekvenční ablací [25].
V námi předkládané práci je popsán případ pacienta s lokálně pokročilým symptomatickým PNET hlavy pankreatu, u kterého byla jako alternativa R2 resekce provedena peroperační radiofrekvenční ablace.
Případ
73letý polymorbidní (CHOPN Gold II, chronická fibrilace síní, hypertenze, anamnéza flebotrombózy pravé dolní končetiny a infarktu myokardu) muž byl přijat pro měsíc trvající bolesti břicha a náhle vzniklý diabetes mellitus projevující se hyperglykemickým syndromem. Byla zavedena inzulinoterapie v dávkování 16 IU (international unit) inzulinu – HMR ráno, 12 IU v poledne a 10 IU večer. Plus 6 IU inzulinu – NPH večer. Vstupní hodnoty sérového bilirubinu a obstrukčních i parenchymových jaterních enzymů byly v normě. Transabdominální ultrasonografie vyjádřila podezření na nádor hlavy pankreatu. Následné kontrastní CT zobrazilo nádor hlavy pankreatu infiltrující vena portae (VP) bez vzdálené diseminace (obr. 5a, 6a, 7a). Sérová koncentrace chromograninu A (CgA) byla 20 ng/ ml (referenční interval 19–98 ng/ ml). EUS navigovanou FNAB (fine needle aspiration biopsy) byl verifikován neuroendokrinní nádor. Biologickou povahu (grade) nebylo možno z aspirátu určit. Vzhledem k očekávané neresekabilitě nádoru a předchozí zkušenosti pracoviště s RFA lokálně pokročilých karcinomů pankreatu byla pacientovi nabídnuta možnost peroperační ablace nádoru. Ten s tímto postupem souhlasil. Jako přístupové cesty bylo užito příčné subkostální laparotomie. Po provedení Kocherova manévru a otevření omentální burzy byl ve shodě s CT nalezen nádor hlavy pankreatu infiltrující vena portae (VP) a vena mesenterica superior (VMS) v úseku cca 6 cm. Radikální resekce by znamenala hemipankreatoduodenektomii s resekcí VMS a její náhradou interpozitem. Vzhledem k polymorbiditě pacienta bylo od takto extenzivního výkonu upuštěno a bylo rozhodnuto o provedení paliativní RFA nádoru s cílem redukce nádorové masy, snížení bolesti a denní dávky inzulinu. Před RFA byla provedena excize nádoru na definitivní histopatologické vyšetření. K ablaci byl použit RFA generátor firmy Valleylab s cluster cool-tip elektrodou (obr. 1). Nádor byl ablován ze čtyř vpichů. Ablační protokol byl stanoven na základě Dateovy práce [26].
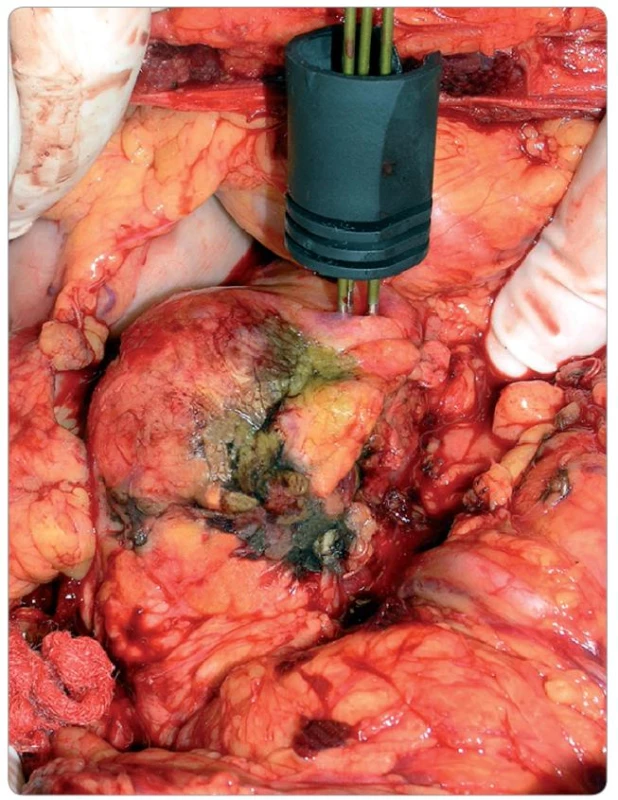
Čas ablace z jednoho vpichu činil 3 minuty s cílovou teplotou v ablovaném ložisku nepřekračující 90 °C. Ablovaná oblast byla drénována dvěma silikonovými drény.
V prvním týdnu po operaci byla denně sledována aktivita sérové AMS, ALP, GGT, AST a ALT. Bylo monitorováno množství a charakter sekretu z břišních drénů. První, sedmý, 30. a 90. pooperační den bylo provedeno kontrastní CT pankreatu ke zhodnocení pooperačních změn v ablované oblasti. Dále byl interval CT kontrol prodloužen na 1 rok. Kvalita života byla sledována pomocí modifikovaného dotazníku EORT QLQ-30 (European Organisation for Research and Treatment of Cancer), který byl pacientem vyplněn jednou ročně. Bolest byla hodnocena pomocí desetistupňové vizuální analogové škály (VAS).
Pooperační průběh byl bez komplikací. Sérové hodnoty sledovaných parametrů (bilirubinemie, AMS, GGT, ALP, AST, ALT) byly v normě. Břišní drény byly vytaženy 4. a 5. pooperační den. Pacient byl 11. pooperační den propuštěn do domácí péče.
Definitivní histopatologické vyšetření potvrdilo dobře diferencovaný neuroendokrinní nádor grade 1 dle WHO klasifikace (obr. 2–4) [27]. Imunohistochemické vyšetření prokázalo pozitivitu NSE (neuron-specifická enoláza), CD56, CK AE1/3 a lehkou pozitivitu chromograninu A. Mitotická aktivita: 1–2 mitózy/10 HPF (high power field). Proliferační index Ki 67 = 1 %. Přítomnost somatostatinových receptorů (SSTR) nebyla hodnocena z důvodu nedostatečného objemu vzorku.
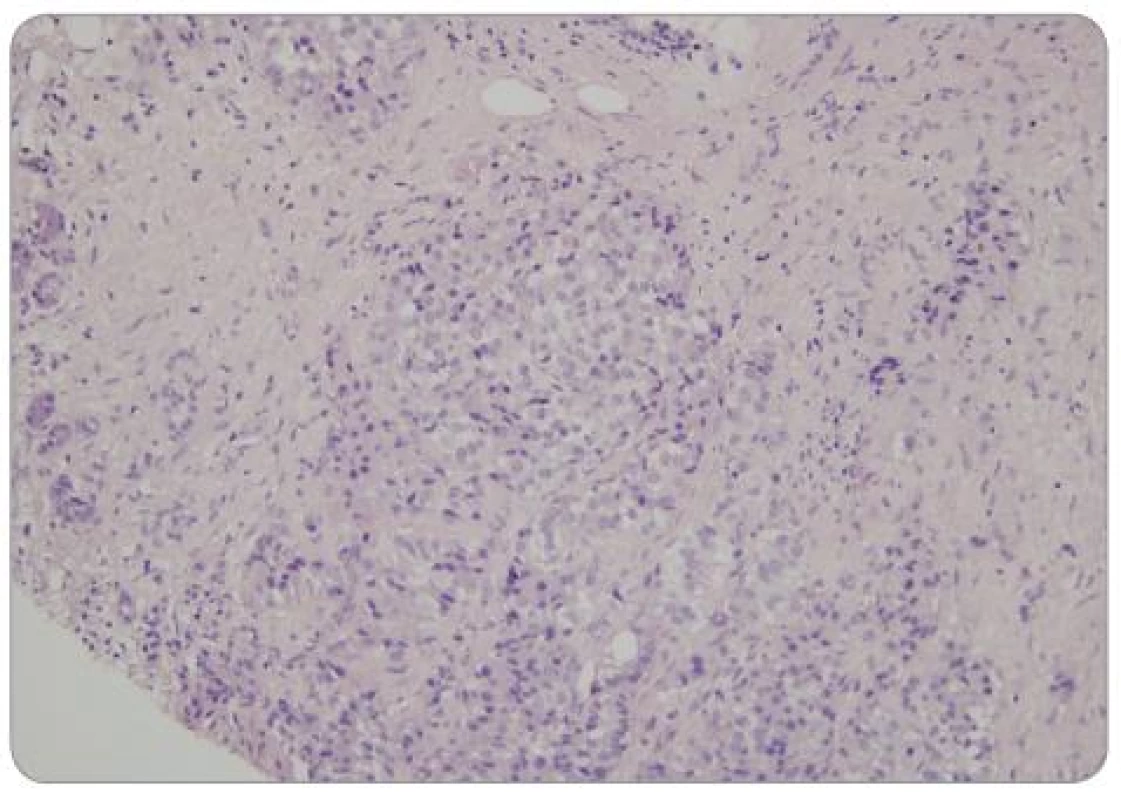
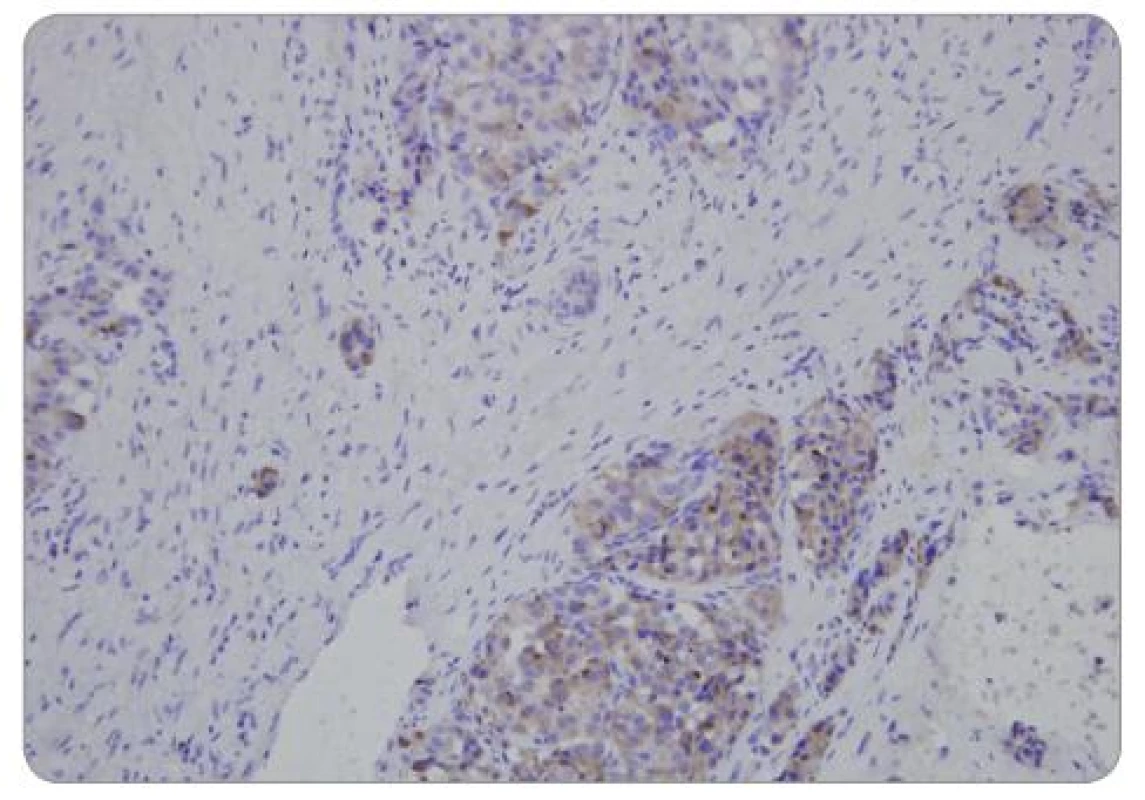
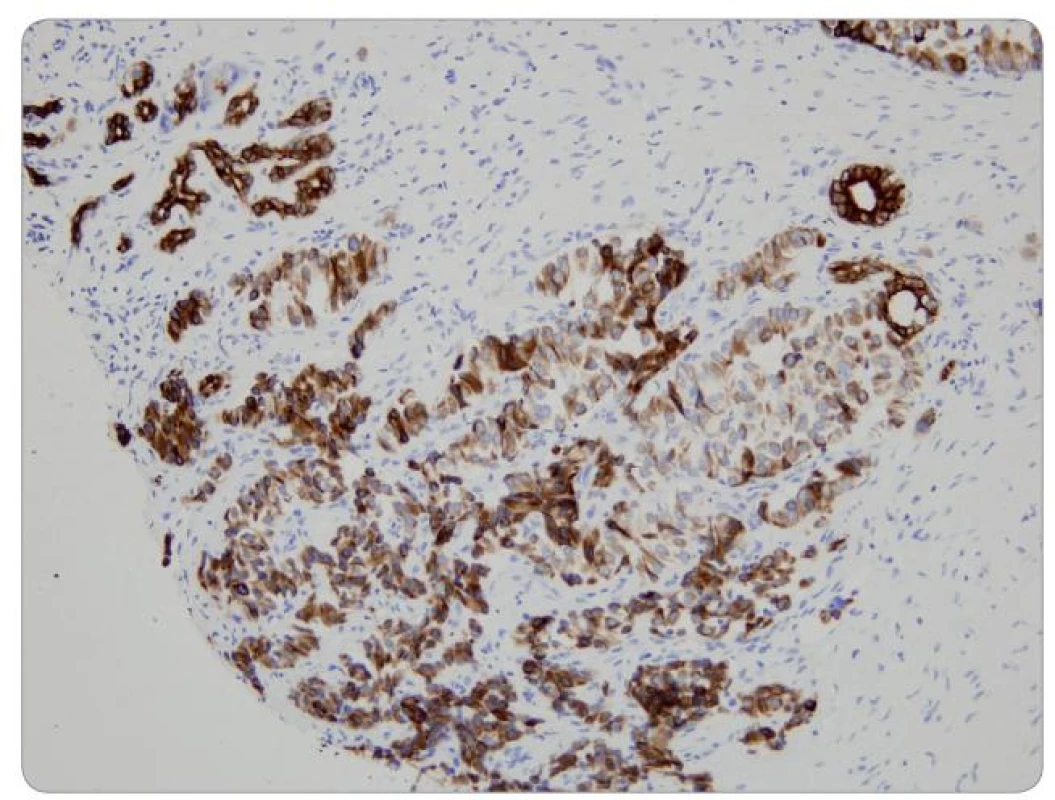
V průběhu tříletého sledování nedošlo bezprostředně po výkonu ani po více než ročním odstupu od operace ke zhoršení psychické (nálada, kognitivní funkce) ani fyzické výkonnosti pacienta. Již v průběhu prvních třech měsíců po operaci vymizela bolest břicha (pokles z hodnoty 2 na hodnotu 0 dle VAS). Dávka inzulinu byla redukována na 16 IU HMR inzulinu na den. Koncentrace chromograninu A byla vyšetřena 1. a 2. rok po operaci a v obou případech byla v normě. Kontrastní CT potvrdilo regresi nádoru dle RECIST (Response Evaluation Criteria in Solid Tumors) – viz obr. 5a, 5b, 6a, 6b, 7a, 7b. Během tříletého sledování nedošlo k diseminaci ani lokální recidivě nádoru. Pacient se cítí dobře, je soběstačný a žije aktivním životem.



Diskuze
Vedle pacientů s biochemicky prokázanými, nelokalizovanými PNETs jsou klinickým problémem také nemocní s lokálně pokročilými nádory. Přístupem volby je v takovýchto případech R2 resekce s ponecháním makroskopicky patrného rezidua nádoru. V literatuře je otázka R2 resekcí u lokálně pokročilých PNETs často diskutována. Hlavním argumentem svědčícím pro debulking resekci je možnost redukce symptomů vyplývajících z hormonální nadprodukce (u hormonálně aktivních nádorů), prevence, respektive oddálení mechanických syndromů (útlak duodena, obstrukční ikterus). Některé práce rovněž referují o prodloužení celkového přežití [28]. Na druhou stranu kvůli hypervaskularizaci PNETs může být jejich částečná resekce spojena s profúzním krvácením. Možnou perioperační komplikaci představuje rovněž pankreatická píštěl. Nevýhodou debulking resekcí je též možnost diseminace tumoru po peritoneální dutině (implantační metastázy) daná transsekcí nádoru.
Obdobný problém představuje lokálně pokročilý karcinom pankreatu. Vzhledem k velmi špatné prognóze pacientů s tímto nádorem (medián přežití 6–10 měsíců) se začaly hledat léčebné alternativy. Jednou z možností bylo užití termoablačních metod. Vedle kryoablace experimentálně rozpracované v roce 1970 Myersem a do klinické praxe uvedené americkými autory v sedmdesátých letech 20. století [29,30] se v indikaci lokálně pokročilého karcinomu pankreatu začalo zvažovat i užití RFA. Tato fyzikálně destrukční metoda byla v klinické praxi dosud využívána k léčbě primárních a sekundárních nádorů jater, plic, prsu, nadledvin, ledvin, prostaty, kostí, mozku a intrahepatálních žlučových cest [31–42]. Počátkem 90. let minulého století se začaly objevovat práce popisující užití RFA i u pacientů s lokálně pokročilým karcinomem pankreatu. Pomineme-li kazuistická sdělení, lze od roku 1990 v literatuře nalézt čtyři rozsáhlejší studie popisující užití radiofrekvenční ablace u pacientů s lokálně pokročilým karcinomem pankreatu [18,22–24].
Podle některých z nich je RFA v této indikaci spojená s významnou perioperační morbiditou a mortalitou danou zejména rizikem krvácení, vznikem biliární, duodenální nebo pankreatické píštěle a rozvojem akutní pankreatitidy. Přitom toto riziko není vyváženo zlepšením celkového přežívání ani kvality života nemocných [22,23]. Studie Spiliotise, Hadjicostase a Girelliho naopak dokladují, že peroperační RFA lokálně pokročilého karcinomu pankreatu ve srovnání T3,T4 tumory, u kterých není žádný výkon na pankreatu proveden, přináší klinicky i statisticky významné prodloužení celkového přežití a pozitivní analgetický efekt s akceptovatelnou perioperační morbiditou a mortalitou [18,24,43].
Inspirováni výsledky výše zmíněných studií, které dokladují možný pozitivní vliv RFA u karcinomu pankreatu, rozhodli jsme se užít RFA jako alternativy R2 resekce u pacienta s lokálně pokročilým PNET. Jedním z důvodů byla také vlastní zkušenost s RFA karcinomu pankreatu, která je na našem pracovišti prováděná od roku 2007. Očekávaným benefitem tohoto přístupu oproti „klasické“ R2 resekci bylo snížení rizika peroperačního krvácení, snížení rizika vzniku pankreatické píštěle a snížení rizika diseminace nádoru cestou implantačních metastáz. Na tomto v literatuře unikátním případu jsme prokázali, že RFA lze bezpečně provést i u pacienta s vaskularizovaným nádorem pankreatu. (Pozn.: Karcinom pankreatu je na rozdíl od PNETs nádor málo vaskularizovaný, s výraznou desmoplastickou reakcí a převahou vaziva v nádorovém stromatu.) Dle našich zkušeností je pro bezpečnost peroperační RFA pankreatu nutné dodržení podmínek, které lze shrnout do 4 hesel:
- Ablační protokol – ve většině prací je užíváno protokolu – teplota v ablovaném ložisku 80–90 °C. Doba ablace z jednoho vpichu nepřevyšující 5 min.
- UZ navigace RFA elektrody – prostřednictvím UZ sondy lze mít přesnou představu o poloze RFA elektrody při jejím zavádění, a lze se tak bezpečně vyhnout velkým cévám a duodenu.
- Chlazení duodena – promýváním lumen chladným fyziologickým roztokem cestou nasogastrické sondy zavedené do bulbu duodena lze předejít termickému poškození stěny.
- Drenáž ablované oblasti – i když peripankreatické kolekce vzniklé v pooperačním období lze drénovat pod CT, hlavní výhodou silikonových drénů aplikovaných peroperačně je možnost jejich přesného umístění a větší průsvit, který snižuje riziko jejich ucpání.
Obecnou limitací RFA nádorů pankreatu je fakt, že na rozdíl od RFA jaterních nádorů, kde je snaha ablovat s minimálním 1cm lemem do zdravé tkáně, u lokálně pokročilých nádorů pankreatu dodržení bezpečnostního lemu není možné. Pokud je totiž provedena ablace celého nádoru včetně jeho kapsuly, je výkon zatížen vysokým rizikem vzniku pankreatické píštěle. Ablační ložisko musí být tedy vždy menší než vlastní nádor. Z výše uvedených důvodů není možné RFA lokálně pokročilých pankreatických nádorů považovat za kurativní výkon! Výjimkou mohou být malé (1–2 cm), v parenchymu pankreatu uložené PNET, u kterých by bylo možné dosáhnout 3–5mm bezpečnostního lemu, viz kazuistika Limmera a kolektivu popisující CT navigovanou RFA inzulinomu kaudy pankreatu. To, zda RFA najde širší uplatnění v léčbě pankreatických neuroendokrinních nádorů, ukáže čas.
Práce
byla podpořena granty Interní grantové agentury MZ ČR
NS10419-3/2009 a NS10239-3//2009.
Autoři
deklarují, že v souvislosti s předmětem studie nemají žádné
komerční zájmy.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do bi omedicínských
časopisů.
MUDr. Jan Hlavsa
Chirurgická
klinika
LF
MU a FN Brno-Bohunice
Jihlavská
20
625
00 Brno
e-mail:
hlavsjan@seznam.cz
Sources
1. Phan GQ, Yeo CJ, Hruban RH et al. Surgical experience with pancreatic and peripancreatic neuroendocrine tumors: review of 125 patients. J Gastrointest Surg 1998; 2(5): 472–482.
2. Jordan PH Jr. A personal experience with pancreatic and duodenal neuroendocrine tumors. J Am Coll Surg 1999; 189(5): 470–482.
3. Dralle H, Krohn SL, Karges W et al. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28(12): 1248–1260.
4. Dial PF, Braasch JW, Rossi RL et al. Management of nonfunctioning islet cell tumors of the pancreas. Surg Clin North Am 1985; 65(2): 291–299.
5. Madura JA, Cummings OW, Wiebke EA et al. Nonfunctioning islet cell tumors of the pancreas: a difficult diagnosis but one worth the effort. Am Surg 1997; 63(7): 573–577.
6. Bartsch DK, Schilling T, Ramaswamy A et al. Management of nonfunctioning islet cell carcinomas. World J Surg 2000; 24(11): 1418–1424.
7. Matthews BD, Heniford BT, Reardon PR et al. Surgical experience with nonfunctioning neuroendocrine tumors of the pancreas. Am Surg 2000; 66(12): 1116–1122.
8. Falconi M, Bettini R, Boninsegna L et al. Surgical strategy in the treatment of pancreatic neuroendocrine tumors. JOP 2006; 7(1): 150–156.
9. Norton JA, Sugarbaker PH, Doppman JL et al. Aggressive resection of metastatic disease in selected patients with malignant gastrinoma. Ann Surg 1986; 203(4): 352–359.
10. McEntee GP, Nagorney DM, Kvols LK et al. Cytoreductive hepatic surgery for neuroendocrine tumors. Surgery 1990; 108(6): 1091–1096.
11. Danforth DN Jr, Gorden P, Brennan MF. Metastatic insulin-secreting carcinoma of the pancreas: clinical course and the role of surgery. Surgery 1984; 96(6): 1027–1037.
12. Carty SE, Jensen RT, Norton JA. Prospective study of aggressive resection of metastatic pancreatic endocrine tumors. Surgery 1992; 112(6): 1024–1031.
13. Chamberlain RS, Canes D, Brown KT et al. Hepatic neuroendocrine metastases: does intervention alter outcomes? J Am Coll Surg 2000; 190(4): 432–445.
14. Chen H, Hardacre JM, Uzar A et al. Isolated liver metastases from neuroendocrine tumors: does resection prolong survival? J Am Coll Surg 1998; 187(1): 88–92.
15. Lang H, Oldhafer KJ, Weimann A et al. Liver transplantation for metastatic neuroendocrine tumors. Ann Surg 1997; 225(4): 347–354.
16. Frilling A, Rogiers X, Malago M et al. Liver transplantation in patients with liver metastases of neuroendocrine tumors. Transplant Proc 1998; 30(7): 3298–3300.
17. Le Treut YP, Delpero JR, Dousset B et al. Results of liver transplantation in the treatment of metastatic neuroendocrine tumors. A 31-case French multicentric report. Ann Surg 1997; 225(4): 355–364.
18. Spiliotis JD, Datsis AC, Michalopoulos NV et al. Radiofrequency ablation combined with palliative surgery may prolong survival of patients with advanced cancer of the pancreas. Langebecks Arch Surg 2007; 392(1): 55–60.
19. Date RS, Siriwardena AK. Radiofrequency ablation of the pancreas. II: Intra-operative ablation of non-resectable pancreatic cancer. A description of technique and initial outcome. JOP 2005; 6(6): 588–592.
20. Varshney S, Sewkani A, Sharma S et al. Radiofrequency ablation of unresectable pancreatic carcinoma: feasibility, efficacy and safety. JOP 2006; 7(1): 74–78.
21. Hlavsa J, Kala Z, Válek V et al. Radiofrequency ablation (RFA) of pancreatic tumors. Rozhl Chir 2008; 87(9): 462–466.
22. Matsui Y, Nakagawa A, Kamiyama Y et al. Selective thermocoagulation of unresectable pancreatic cancers by using radiofrequency capacitive heating. Pancreas 2000; 20(1): 14–20.
23. Tang Z, Wu YL, Fang HQ et al. Treatment of unresectable pancreatic carcinoma by radiofrequency ablation with ‘cool-tip needle’: report of 18 cases. Zhonghua Yi Xue Za Zhi 2008; 88(6): 391–394.
24. Girelli R, Frigerio I, Salvia R et al. Feasibility and safety of radiofrequency ablation for locally advanced pancreatic cancer. Br J Surg 2010; 97(2): 220–225.
25. Limmer S, Huppert PE, Juette V et al. Radiofrequency ablation of solitary pancreatic insulinoma in a patient with episodes of severe hypoglycemia. Eur J Gastroenterol Hepatol 2009; 21(9): 1097–1101.
26. Date RS, McMahon RF, Siriwardena AK. Radiofrequency ablation of the pancreas. I: definition of optimal thermal kinetic parameters and the effect of simulated portal venous circulation in an ex-vivo porcine model. JOP 2005; 6(6): 581–587.
27. Solcia E, Kloppel G, Sobin LH et al. Histologic typing of endocrine tumours. WHO International Histological Classification of Tumours. Heidelberg: Springer Verlag 2000.
28. Pederzoli P, Falconi M, Bonora A et al. Cytoreductive surgery in advanced endocrine tumours of the pancreas. Ital J Gastroenterol Hepatol 1999; 31 (Suppl 2): S207–S212.
29. Myers RS, Hammond WG, Ketcham AS. Cryosurgery of primate pancreas. Cancer 1970; 25(2): 411–414.
30. Patiutko I, Barkanov AI, Kholikov TK et al. The combined treatment of locally disseminated pancreatic cancer using cryosurgery. Vopr Onkol 1991; 37(6): 695–700.
31. Penka I, Kaplan Z, Sefr R et al. Use of radiofrequency ablation in the treatment of malignant liver lesions. Hepatogastroenterology 2008; 55(82–83): 562–567.
32. Simon CJ, Dupuy DE. Current role of image-guided ablative therapies in lung cancer. Expert Rev Anticancer Ther 2005; 5(4): 657–666.
33. Suh RD, Wallace AB, Sheehan RE et al. Unresectable pulmonary malignancies: CT guided percutaneous radiofrequency ablation – preliminary results. Radiology 2003; 229(3): 821–829.
34. Noguchi M. Minimally invasive surgery for small breast cancer. J Surg Oncol 2003; 84(2): 94–101.
35. Singletary ES. Feasibility of radiofrequency ablation for primary breast cancer. Breast Cancer 2003; 10(1): 4–9.
36. Boss A, Clasen S, Kuczyk M et al. Magnetic resonance – guided percutaneous radiofrequency ablation of renal cell carcinoma: a pilot clinical study. Invest Radiol 2005; 40(9): 583–590.
37. Wood BJ, Abraham J, Hvizda JL et al. Radiofrequency ablation of adrenal tumors and adrenocortical carcinoma metastases. Cancer 2003; 97(3): 554–560.
38. Milićević M, Bulajić P, Zuvela M et al. Elective resection of the spleen – overview of resection technics and description of a new technic based on radiofrequency coagulation and dessication. Acta Chir Iugosl 2002; 49(3): 19–24.
39. Shariat SF, Raptidis G, Masotoschi M et al. Pilot study of radiofrequency interstitial tumor ablation (RITA) for the treatment of radio-recurrent prostate cancer. Prostate 2005; 65(3): 260–267.
40. Martel J, Bueno A, Ortiz E. Percutaneous radiofrequency treatment of osteoid osteoma using cool-tip electrodes. Eur J Radiol 2005; 56(3): 403–408.
41. Ganaadha S, Wulf S, Morris DL. Safety and efficacy of radiofrequency ablation of brain: a potentially minimally invasive treatment for brain tumors. Minim Invasive Neurosurg 2004; 47(6): 325–328.
42. Chiou YY, Hwang JI, Chou YH et al. Percutaneous ultrasound guided radiofrequency ablation of intrahepatic cholangiocarcinoma. Kaohsiung J Med Sci 2005; 21(7): 304–309.
43. Hadjicostas P, Malakounides N, Varianos C et al. Radiofrequency ablation in pancreatic cancer. HPB 2006; 8(1): 61–64.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2011 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Selén a rakovina: od prevencie k liečbe
- High-dose interferon alfa v léčbě pacientů s maligním melanomem, sledování prediktivních a prognostických biomarkerů
- Gastrointestinální stromální tumory
- Dynamika vývoja psychosociálnej záťaže prežívajúcich pacientok s karcinómom prsníka: klinický úspech s psychosociálnymi dôsledkami
- Radiofrekvenční ablace neuroendokrinního nádoru pankreatu
- Regrese osteolytického ložiska u pacienta s mnohočetným myelomem léčeného klodronátem po úspěšné terapii režimem s bortezomibem
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
- Paliativní péče v České republice v roce 2011 – několik poznámek
- In vitro hodnocení prostupnosti cytotoxických léčiv přes rekonstruovanou lidskou epidermis a ústní epitel
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Gastrointestinální stromální tumory
- Selén a rakovina: od prevencie k liečbe
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
