Regrese osteolytického ložiska u pacienta s mnohočetným myelomem léčeného klodronátem po úspěšné terapii režimem s bortezomibem
Regression of an Osteolytic Lesion in a Patient with Multiple Myeloma Treated with Clodronate after a Successful Therapy with Bortezomib-based Regimen
Backgrounds:
Osteolytic lesions are a common manifestation of multiple myeloma, though their healing is rare in these patients. Generally, during a complete remission, lesions only stop progressing; radiologically evident recalcification is exceptional.
Case:
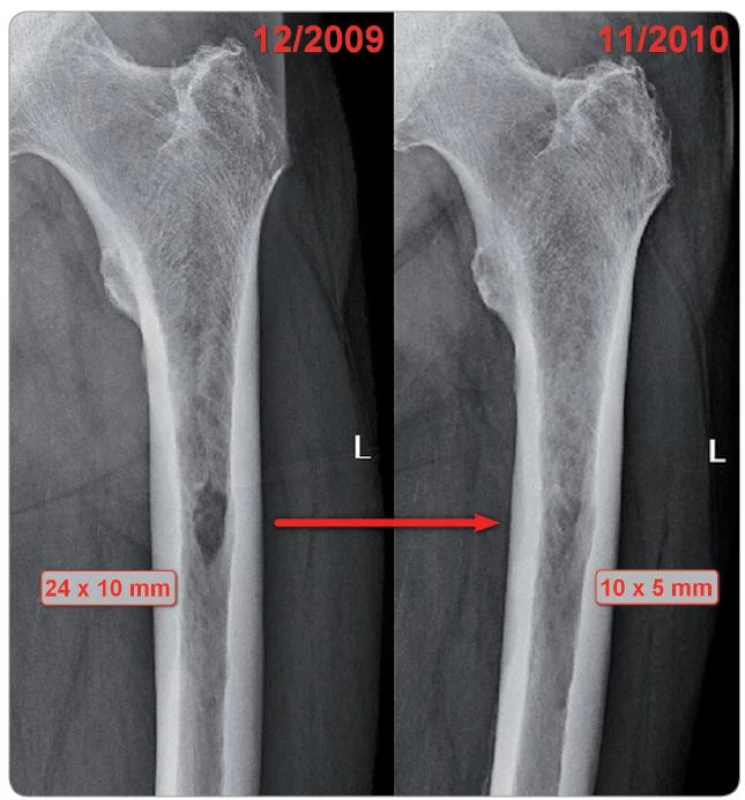
Herein we report a case of a male patient born in 1941 and diagnosed in 2005 with IgA multiple myeloma presenting with multiple osteolytic bone lesions. Administration of 4 cycles of VAD chemotherapy (vincristine, adriamycin, dexamethasone) with subsequent autologous peripheral blood stem cell transplantation and maintenance treatment with interferon alpha had resulted into a very good partial remission. In 2009, the disease relapsed with enlargement of osteolytic lesions evident on skiagrams. The largest lesion, reaching 24 × 10 mm in size, was located in the left femur. A complete remission of the disease was achieved with CVD senior regimen (cyclophosphamide, bortezomib, dexamethasone, 8 cycles in total). Bisphosphonates (zoledronate, ibandronate and, from 2007, clodronate) were administered as a long-term supportive therapy. A one-year follow-up skiagram of the left femur revealed over 50% regression of the osteolytic lesion (10 × 5 mm) documented in a set of pictures herein.
Conclusion:
A complete remission of the disease after an administration of bortezomib (Velcade™)-based regimen in a long-term clodronate (Bonefos™)-treated patient with relapsed multiple myeloma is radiographically apparent by clear healing signs of the osteolytic bone lesion.
Key words:
multiple myeloma – bortezomib – bisphosphonates – osteolysis – osteogenesis – radiography
This publication was prepared as part of the MUNI/A/1012/2009 project entitled “Optimizing diagnostics and therapy of malignant diseases and complications associated with these malignant diseases using new molecular and biological methods” as well as it is a part of activities within the Ministry of Health of the Czech Republic’s Internal Grant Agency grants: NR9225, NS10387 a NS10406.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
P. Szturz 1; R. Jakubcová 2; Z. Adam 1; M. Klincová 3; M. Krejčí 1; L. Pour 1; L. Zahradová 1; R. Hájek 1; J. Mayer 1
Authors‘ workplace:
Interní hematoonkologická klinika, LF MU a FN Brno
1; Radiologická klinika, LF MU a FN Brno
2; Lékařská fakulta Masarykovy Univerzity, Brno
3
Published in:
Klin Onkol 2011; 24(3): 216-220
Category:
Case Reports
Overview
Východiska:
Vznik osteolytických ložisek patří mezi klasické projevy mnohočetného myelomu, jejich hojení však není u těchto pacientů obvyklé. V době kompletní remise většinou dochází pouze k zastavení progrese lézí, radiologicky patrná rekalcifikace je výjimečná.
Případ:
Tato kazuistika popisuje případ muže narozeného 1941, u něhož byla v roce 2005 stanovena diagnóza mnohočetného myelomu typu IgA se vstupně přítomnými mnohočetnými osteolytickými ložisky ve skeletu. Podání 4 cyklů chemoterapie VAD (vinkristin, adriamycin, dexametazon) s následnou autologní transplantací periferních kmenových buněk a udržovací léčbou interferonem alfa uvedlo onemocnění do velmi dobré parciální remise. V roce 2009 došlo k relapsu onemocnění se zvětšením osteolytických ložisek na skiagramu. Největší ložisko se nacházelo v levé stehenní kosti a dosahovalo velikosti 24 × 10 mm. U pacienta bylo režimem CVD senior (cyklofosfamid, bortezomib, dexametazon, celkem 8 cyklů) dosaženo kompletní remise nemoci. Součást podpůrné léčby tvořilo dlouhodobé užívání bisfosfonátů (zoledronát, ibandronát, od roku 2007 pak klodronát). Dle kontrolního skiagrafického vyšetření s odstupem jednoho roku je patrná více než 50% regrese osteolytického ložiska v levém femoru (velikost 10 × 5 mm), kterou dokládá obrazová příloha této kazuistiky.
Závěr:
Kompletní remise onemocnění po podání režimu s bortezomibem (Velcade™) byla u pacienta s relapsem mnohočetného myelomu léčeného dlouhodobě klodronátem (Bonefos™) provázena radiograficky zřetelně patrnými známkami hojení osteolytického postižení skeletu.
Klíčová slova:
mnohočetný myelom – bortezomib – bisfosfonáty – osteolýza – osteogeneze – radiografie
Úvod
Difuzní či ložiskový osteolytický proces a patologické fraktury se řadí mezi klasické příznaky mnohočetného myelomu [1]. Nádorové buňky produkují různé cytokiny stimulující osteoklastickou resorpci, která je hlavním mechanizmem kostní destrukce u těchto pacientů [2]. Radiologicky patrná rekalcifikace skeletu v oblasti předchozích osteolytických ložisek je výjimečná [3,5], popsány však byly případy úspěšné léčby inhibitorem proteazomu bortezomibem (Velcade™), který kromě antimyelomového účinku působí i na aktivitu osteoblastů a podporuje novotvorbu kostí [6–8].
V této kazuistice popisujeme případ muže s relabujícím mnohočetným myelomem na dlouhodobé terapii bisfosfonáty, u kterého došlo k radiograficky prokázanému zmenšení osteolytického ložiska po podání režimu s bortezomibem (Velcade™).
Popis případu
U našeho pacienta, muže narozeného 1941, byla diagnóza mnohočetného myelomu, klinického stadia IIIA s IgA paraproteinem v koncentraci 30,4 g/ l, stanovena v 63 letech. V kostní dřeni bylo přítomno 23 % plazmocytů a na skiagramech skeletu byly popsány osteolytické defekty v kalvě, lumbální páteři, v humerech a femorech. Pacient byl zařazen do klinické studie CMG 2002 a absolvoval 4 cykly chemoterapie VAD (vinkristin, adriamycin, dexametazon) s následnou autologní transplantací periferních kmenových buněk a udržovací léčbou interferonem alfa. Efekt podané terapie byl vyhodnocen jako velmi dobrá parciální remise (přetrvávala pozitivní imunofixace v moči).
V prosinci 2009 však došlo k relapsu myelomu (vzestup monoklonálního imunoglobulinu v séru na 32,8 g/ l, 40 % plazmocytů v kostní dřeni, nález v moči normální). Konvenční radiografie ukázala zvětšení osteolytických ložisek, největší se nacházelo v levé kosti stehenní a dosahovalo velikosti 24 × 10 mm, bez usurace kortikalis. U pacienta byla zahájena léčba režimem CVD senior (cyklofosfamid 50 mg tbl. p.o. den 1–28, bortezomib 1,3 mg/m2 den 1, 8, 15, dexametazon 20 mg cps. p.o. den 1–4 a 15–18, celkem 8 cyklů), která vedla k prudkému poklesu koncentrace monoklonálního imunoglobulinu IgA ihned po prvním cyklu (5,8 g/ l) a k negativní imunofixaci po 3 cyklech. Léčba byla dobře tolerována pouze s nutností redukce kortikoterapie od 5. cyklu pro retenci tekutin (dexametazon 20 mg cps. p.o. den 2, 3, 15, 16), projevy neuropatie pozorovány nebyly. Dle kontrolního skiagrafického vyšetření z listopadu 2010 je patrná více než 50% regrese osteolytického ložiska v levém femoru (obr. 1), ostatní skiagrafické nálezy byly beze změny.
Součástí podpůrné léčby bylo rovněž dlouhodobé užívání bisfosfonátů. Podpůrná léčba bisfosfonáty byla zahájena v červenci 2005 podáváním zoledronátu (4 mg i.v. v intervalu 1 měsíc) a změněna v září 2006 za ibandronát (6 mg i.v. v intervalu 1 měsíc). Podávání dusíkatých bisfosfonátů však bylo v listopadu 2006 přerušeno pro výskyt osteonekrózy dolní čelisti s nutností antibiotické léčby a stomatologického ošetření. Od března 2007 je pacient na pravidelné medikaci klodronátem (Bonefos™, 1 600 mg p.o. denně), která je pacientem velmi dobře tolerována.
Diskuze
Patofyziologii osteolytických ložisek u mnohočetného myelomu bylo věnováno mnoho publikací [1–4]. Myelomové buňky produkují poměrně hodně působků (interleukin-1, interleukin-6, macrophage inflammatory protein 1α), které stimulují osteoklasty ke zvýšené aktivitě a ty pak vytvářejí obraz difuzní osteoporózy nebo osteolytických ložisek. Osteolýza je zřejmě nejvíce ovlivněna dysregulací dvojice osteoprotegerin-RANKL (receptor activator of nuclear factor kappaB ligand, ligand vázající se na receptor aktivující nukleární faktor kappaB). Myelomové buňky mohou zvyšovat tvorbu RANKL a snižovat produkci osteoprotegerinu ve stromálních buňkách.
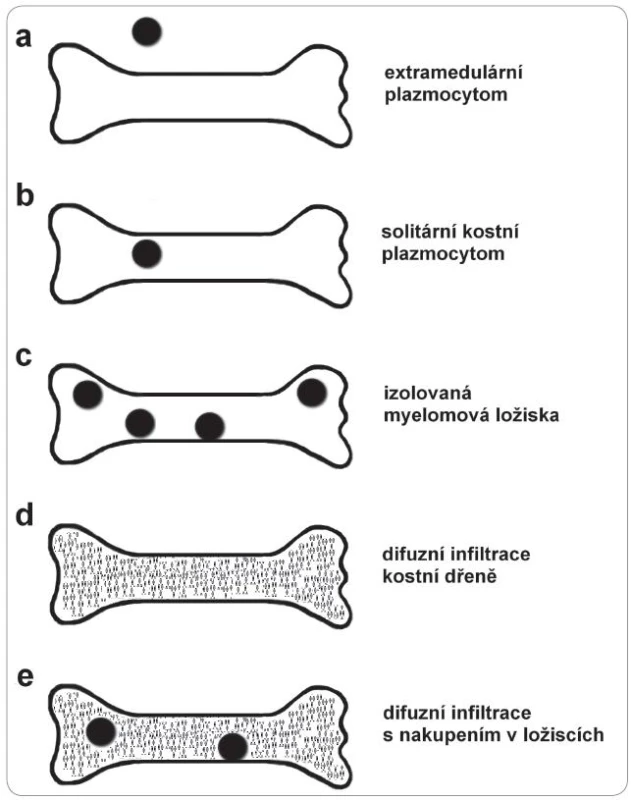
Zda se objeví difuzní osteoporóza, nebo osteoporóza s ložisky osteolýzy, či jen ložiska osteolýzy, závisí na rozložení myelomových buněk ve skeletu. Jsou-li myelomové buňky ve skeletu rozesety difuzně, pak je odbourávání kostí difuzní a výsledkem je osteoporóza. Nejčastěji však dochází k difuznímu rozptýlení s tvorbou milimetrových ložisek, což se projeví vznikem difuzní osteoporózy s disperzními osteolytickými ložisky. Zcela výjimečně má rozložení myelomových buněk v kosti ložiskový charakter vedoucí k tvorbě izolovaných osteolytických ložisek bez osteoporotizace skeletu mezi ložisky. Způsob uložení myelomových buněk ve skeletu má dopad i na diagnostiku, kdy v některých případech je necílená biopsie nevýtěžná a nutný je odběr tkáně přímo z ložiska. Schematicky je postižení skeletu myelomovými buňkami znázorněno na obr. 2.
Od 80. let minulého století je známa skupina léků, která fyzikálně chemickým působením blokuje odbourávání vápníku z kostí a selektivně inhibuje osteoklasty, a tou jsou bisfosfonáty [3,9]. Bylo prokázáno (tab. 1), že pacienti s mnohočetným myelomem, kteří jsou dlouhodobě léčeni bisfosfonáty, mají oproti kontrolní skupině, která je neužívá, (I) nižší počet patologických fraktur, (II) nižší počet spinálních komplikací (zákroky pro míšní kompresi), (III) méně epizod hyperkalcemie a (IV) menší konzumpci analgetik, včetně analgetické radioterapie [10,11]. Při podávání těchto léků se rovněž zvyšuje hustota kostní tkáně měřená denzitometricky [12].
![Výsledky metaanalýzy účinku bisfosfonátů [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f267adbe00b2ba70d3055886188f98cd.jpeg)
U většiny pacientů s mnohočetným myelomem nedochází po dosažení kompletní remise onemocnění ke zmenšování osteolytického ložiska, tedy k novotvorbě hydroxyapatitových struktur. Uvedené účinky bisfosfonátů pouze brání progresi osteolýzy. Při ozáření velké léze v nosném skeletu je sice zřetelná reparace, která se projeví jako sklerotizace okrajů osteolytické dutiny, ale vede jen k mírnému zvýšení pevnosti kosti. Ke skutečnému zhojení osteolytického ložiska dochází u pacientů výjimečně [3,5].
Jedním z nových, vysoce účinných, moderních prostředků cílené biologické léčby pro mnohočetný myelom je bortezomib, první inhibitor proteazomu zavedený do klinické praxe, který v kombinovaných režimech s cytostatiky a kortikoidy nalézá své uplatnění jak v rámci léčby první linie, tak i u pacientů s relapsem onemocnění [8,13,14]. Kromě svého antimyelomového působení stimuluje bortezomib rovněž novotvorbu kostí tím, že aktivuje diferenciaci osteoblastů. Popsán byl vzestup sérových koncentrací kostního izoenzymu alkalické fosfatázy, osteokalcinu a N-terminálního propeptidu prokolagenu typu I (PINP) u pacientů léčených bortezomibem, a to i v kombinovaných režimech s dexametazonem, který má na osteoblasty opačný, inhibiční efekt [6–8]. Tento účinek na budování kostí se projevil i bez podpůrné léčby bisfosfonáty [8]. Zprávy o radiograficky patrném hojení osteolytických defektů jsou však méně časté a obrazovou dokumentaci se nám podařilo nalézt pouze v práci autorů Ozaki et al [7], jimž se pomocí vyšetření výpočetní tomografií podařilo zachytit výrazné zmenšení kostních lézí u dvou pacientů, kteří dosáhli velmi dobré parciální remise po 1 a 3 cyklech léčby s bortezomibem a dexametazonem.
Původní tvrzení, že osteolytická myelomová ložiska zůstávají beze změny i po dosažení kompletní remise, nemusí v éře nových léků platit, což dokládá náš popis případu. Tyto zkušenosti nelze generalizovat, mohou však signalizovat skutečnost, že něco podobného je při kombinaci bisfosfonátů a bortezomibového režimu při dosažení kompletní remise možné a že je třeba věnovat tomuto tématu více pozornosti.
Závěr
U mnohočetného myelomu většinou v době kompletní remise dochází pouze k zastavení progrese osteolytických ložisek. Hojení osteolytického ložiska není u mnohočetného myelomu obvyklé. Reparační projevy se většinou omezí na sklerotizaci stěn osteolytické dutinky viditelné na rentgenovém snímku jako zesílení kontury osteolytického ložiska [3].
Tento případ je výjimečný v tom, že pozorujeme na rentgenových snímcích rekalcifikaci a hojení osteolytického ložiska, tedy výrazné zmenšování jeho rozměrů. Domníváme se, že k němu přispěla jednak kompletní remise nemoci docílená režimem s bortezomibem a jednak dlouhodobá systematická léčba bisfosfonáty a zřejmě také v literatuře popisovaný stimulační vliv bortezomibu na aktivitu osteoblastů. Tímto příkladem dokladujeme, že jen účinná léčba mnohočetného myelomu může vést nejen k zastavení osteolýzy, ale také že může stimulovat reosifikaci původního osteolytického ložiska.
Tato
publikace byla připravena v rámci projektu MUNI/A/1012/2009 s názvem „Optimalizace diagnostiky a terapie maligních
chorob a komplikací, které tyto maligní nemoci provázejí,
s využitím nových molekulárně biologických metod“,
a také je součástí aktivit v rámci grantů IGA MZ:
NR9225, NS10387 a NS10406.
Autoři
deklarují, že v souvislosti s předmětem studie nemají
žádné komerční zájmy.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do bi omedicínských
časopisů.
MUDr. Petr Szturz
Interní
hematoonkologická klinika
LF
MU a FN Brno
Jihlavská
20
625
00 Brno
e-mail:
petr.szturz@fnbrno.cz
Sources
1. Adam Z, Mayer J, Hájek R et al. Terapie mnohočetného myelomu: zhodnocení přínosu vysokodávkované chemoterapie, interferonu alfa a bisfosfonátů. Klin Onkol 1999; 12(2): 35–44.
2. Roodman GD. Mechanisms of bone lesions in multiple myeloma and lymphoma. Cancer 1997; 80 (Suppl 8): 1557–1563.
3. Adam Z, Ševčík P, Vorlíček J et al. Kostní nádorová choroba. Praha: Grada 2005.
4. Ščudla V, Budíková M, Petrová P et al. Analýza sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu. Klin Onkol 2010; 23(3): 171–181.
5. Bačovský J, Ščudla V. Současné možnosti vyšetření skeletu u mnohočetného myelomu. Int Med pro Praxi 2004; 6(8): 385–388.
6. Heider U, Kaiser M, Müller C et ak. Bortezomib increases osteoblast activity in myeloma patients irrespective of response to treatment. Eur J Haematol 2006; 77(3): 233–238.
7. Ozaki S, Tanaka O, Fujii S et al. Therapy with bortezomib plus dexamethasone induces osteoblast activation in responsive patients with multiple myeloma. Int J Hematol 2007; 86(2): 180–185.
8. Lund T, Søe K, Abildgaard N et al. First-line treatment with bortezomib rapidly stimulates both osteoblast activity and bone matrix deposition in patients with multiple myeloma, and stimulates osteoblast proliferation and differentiation in vitro. Eur J Haematol 2010; 85(4): 290–299.
9. Pour L, Hájek R, Adam Z. Výběr bisfosfonátu k léčbě kostního postižení u pacientů s prokázanou malignitou. Klin Onkol 2005; 18(5): 172–177.
10. Ross JR, Saunders Y, Edmonds PM et al. A systematic review of the role of bisphosphonates in metastatic disease. Health Technol Assess 2004; 8(4): 1–176.
11. Wong R, Wiffen PJ. Bisphosphonates for the relief of pain secondary to bone metastases. Cochrane Database Syst Rev 2002; 2: CD002068.
12. Adam Z, Prokeš B, Hájek D et al. Vzestup kostní denzity u nemocných s mnohočetným myelomem léčených clodronátem. Vnitř Lék 1994; 40(11): 726–729.
13. Vokurka S. Bortezomib v léčbě mnohočetného myelomu u pacientů po alogenní transplantaci krvetvorných buněk. Klin Onkol 2010; 23(4): 242–244.
14. Špička I. Bortezomib v 1. linii terapie – další zlepšení výsledků léčby mnohočetného myelomu. Farmakoterapie 2009; 5(2): 113–248.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2011 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Selén a rakovina: od prevencie k liečbe
- High-dose interferon alfa v léčbě pacientů s maligním melanomem, sledování prediktivních a prognostických biomarkerů
- Gastrointestinální stromální tumory
- Dynamika vývoja psychosociálnej záťaže prežívajúcich pacientok s karcinómom prsníka: klinický úspech s psychosociálnymi dôsledkami
- Radiofrekvenční ablace neuroendokrinního nádoru pankreatu
- Regrese osteolytického ložiska u pacienta s mnohočetným myelomem léčeného klodronátem po úspěšné terapii režimem s bortezomibem
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
- Paliativní péče v České republice v roce 2011 – několik poznámek
- In vitro hodnocení prostupnosti cytotoxických léčiv přes rekonstruovanou lidskou epidermis a ústní epitel
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Gastrointestinální stromální tumory
- Selén a rakovina: od prevencie k liečbe
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
