Selén a rakovina: od prevencie k liečbe
Selenium and Cancer: from Prevention to Treatment
Selenium (Se) is an essential dietary component for all animals, including human beings, that is regarded as a protective agent against cancer. Although the mode of its anticancer action is not yet fully understood, several mechanisms, such as antioxidant protection through selenoenzymes, stimulation of DNA repair, and apoptosis in tumor prestages have all been proposed. Despite the unsupported results of the last ”SELECT“ trial, the cancer-preventing activity of Se has been demonstrated in a majority of epidemiological studies. Moreover, recent studies suggest that Se has a potential to be used not only in cancer prevention but also in cancer treatment, where in combination with other anticancer drugs or radiation it may increase the efficacy of cancer therapy. In combating cancer cells, Se acts as a prooxidant rather than an antioxidant, inducing apoptosis through the generation of oxidative stress. Thus, inorganic Se compounds, having high redox potency, represent a promising option in cancer therapy.
Key words:
selenium – cancer prevention – selenoproteins – cancer treatment – oxidative stress
This study was supported by the VEGA grant agency of the Slovak Republic (No. 2/6082/26).
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
J. Brozmanová
Authors‘ workplace:
Laboratórium molekulárnej genetiky, Ústav experimentálnej onkológie SAV, Bratislava, Slovenská republika
Published in:
Klin Onkol 2011; 24(3): 171-179
Category:
Reviews
Overview
Selén (Se) je esenciálny výživový doplnok pre živočíchov, vrátane človeka, u ktorého sa predpokladá, že znižuje riziko vzniku rakoviny. Hoci podstata tohto javu nie je zatiaľ objasnená, boli navrhnuté viaceré mechanizmy jeho protirakovinného účinku. Tie zahŕňajú ochranu pred oxidačným stresom, stimuláciu opravy DNA a indukciu apoptózy v predrakoviných štádiách. Napriek negatívnym výsledkom poslednej epidemiologickej štúdie „SELECT“, väčšina predchádzajúcich štúdií demonštrovala selénom sprostredkované zníženie výskytu rakovinných ochorení. Navyše poznatky z posledného obdobia naznačujú, že Se má potenciál byť využitý okrem prevencie aj v liečbe rakoviny. Bolo pozorované, že Se buď samotný, alebo v kombinácii s inými liekmi alebo žiarením zvyšuje účinnosť protirakovinnej liečby. V boji s rakovinovými bunkami pôsobí Se skôr ako prooxidant než ako antioxidant, indukujúc apoptózu prostredníctvom oxidačného stresu. Preto sú anorganické formy Se, ktoré majú vysoký redox potenciál, sľubnou alternatívou pre ich perspektívne využitie v nádorovej terapii.
Kľúčové slová:
selén – prevencia rakoviny – selenoproteíny – liečba rakoviny – oxidačný stres
Úvod
Selén (Se) je esenciálny výživový doplnok dôležitý pre ľudské zdravie. Hoci je významný pre udržanie viacerých životných funkcií v organizme, veľký záujem vedeckej, ako aj laickej verejnosti vzbudzuje hlavne preto, že disponuje aj takými aktivitami, u ktorých sa predpokladá, nielenže môžu znížiť riziko vzniku rakoviny, ale môžu sa podieľať aj na procesoch špecificky inhibujúcich rast nádorových buniek a pozitívne modulovať liečbu onkologických pacientov.
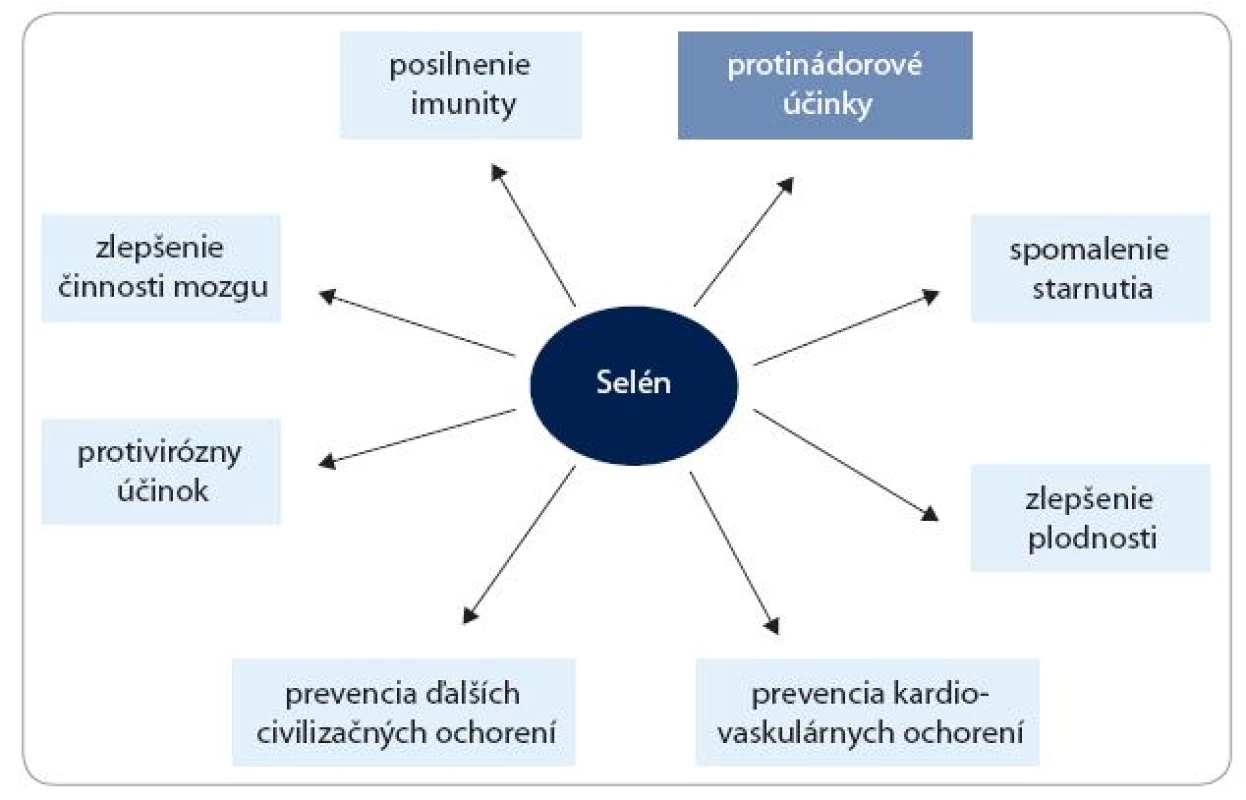
Okrem protinádorových účinkov môžu nízke dietetické hladiny Se pozitívne vplývať aj na mnohé iné funkcie v organizme, hlavne redukciou zápalových procesov, srdcových ochorení, krvného tlaku a mnohých ďalších civilizačných ochorení [1]. Predpokladané účinky Se na ľudské zdravie sú schematicky znázornené na obr. 1. Zdravotné efekty vyšších dávok Se sú však menej zrejmé. Výsledky z posledných pozorovaní, robených v USA, naznačujú, že v dôsledku užívania vysokých dávok môže u Se-presýtenej populácie hroziť riziko vzniku cukrovky [2,3]. Cieľom tohto článku je však poukázať na tie aktivity Se, ktoré súvisia s rakovinou.
Se bol objavený v r. 1818 švédskym chemikom Berzeliusom, ktorý ho pomenoval podľa gréckej bohyne mesiaca Selene. V prvej polovici 20. storočia bol Se pre jeho toxicitu považovaný za nežiaduci element. Jeho toxicita bola prvýkrát potvrdená v r. 1933 u dobytka, ktorý konzumoval rastliny rodov Astragalus, Xylorrhiza, Oonopsis a Stanleya v západnej oblasti USA. Tieto rastliny sú schopné akumulovať veľké kvantum Se z pôdy, a preto sú označované ako Se akumulátorové alebo indikátorové rastliny [4]. V druhej polovici 20. storočia sa názory na Se zmenili. Se začal byť považovaný za významný výživový komponent. Bolo to najmä na základe zistenia, že pri veľmi nízkych koncentráciách je Se výživový doplnok a zabraňuje vzniku nekrózy pečene u potkanov [5]. Že Se môže byť tiež antikarcinogénny, bolo zverejnené o 10 rokov neskoršie na základe nepriamej korelácie medzi nádorovou mortalitou a obsahom Se v krmive dobytka v USA [6]. Následne sa Se a jeho antikarcinogénny efekt stali stredobodom rozsiahlych vedeckých výskumov na in vitro modeloch tkanivových kultúr, pokusoch na zvieratách, epidemiologických, preklinických a v poslednej dobe aj klinických štúdií. Z výsledkov veľmi rozvetveného výskumu, zameraného na objasnenie úlohy Se v prevencii a liečbe rakoviny, možno predbežne zhrnúť, že za určitých okolností, pri splnení vhodných podmienok, by mohla Se suplementácia predstavovať potenciálne benefity pre zdravých jedincov, ako aj pre pacientov s nádorovým ochorením.
Efekt selénu je závislý od jeho koncentrácie
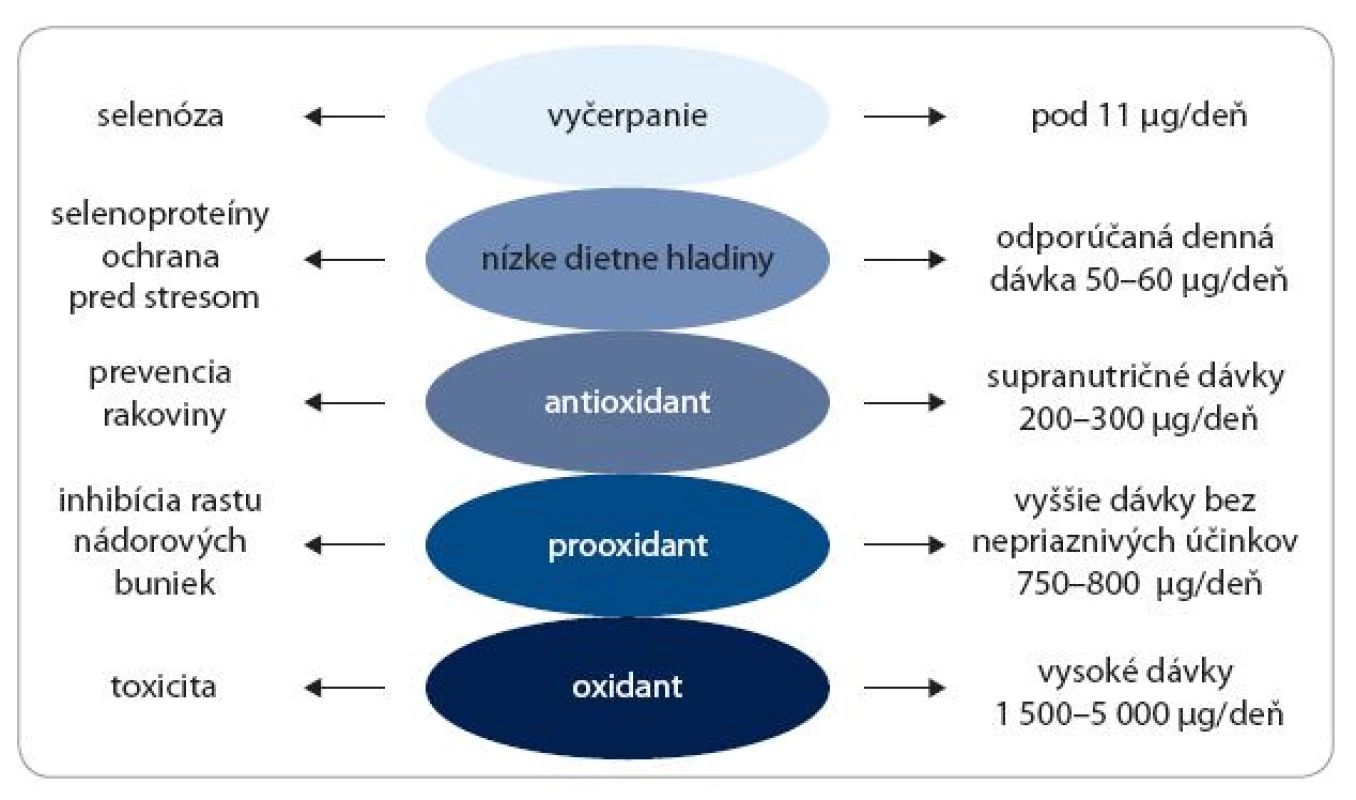
Doterajšie výskumy ukázali, že biologické efekty Se sú striktne závislé od jeho koncentrácie. Veľmi nízke hladiny Se pod prahovú hodnotu 11 μg/deň môžu vyvolať vážne zdravotné problémy označované ako selenóza, ktorá sa však vyskytuje veľmi zriedkavo v ľudskej populácii. Denná dávka, ktorá by mala zaistiť optimálny ochranný efekt, sa udáva v rozmedzí 50–60 μg/deň. Pri stredne vysokých koncentráciách, v rozmedzí 200–300 μg/deň, vykazuje Se antioxidačné a rakovinu inhibujúce aktivity. Pri vyšších dávkach – 700–800 μg/deň – sa Se postupne prejavuje ako prooxidant a následne ako silný oxidant inhibujúci bunkový rast. Veľmi vysoké dávky – 1 500–5 000 μg/deň – indukujú poškodenie DNA a bunkovú smrť (obr. 2).
Formy selénu
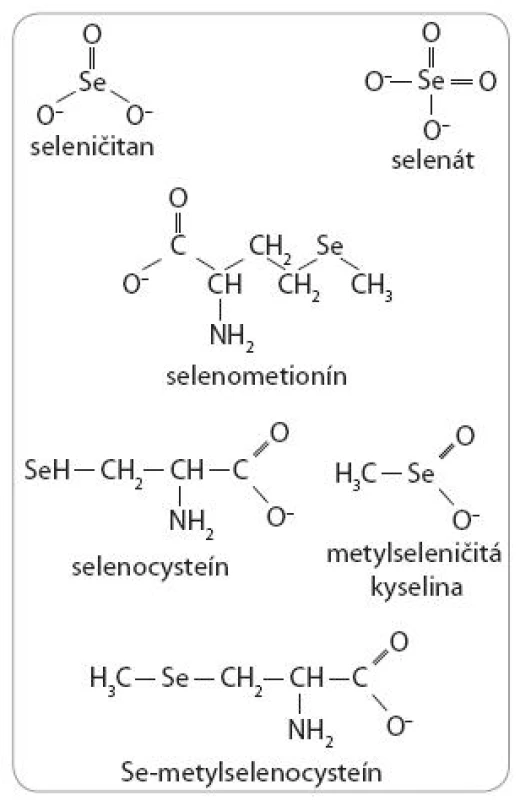
Biologické aktivity Se sú však okrem dávky závislé aj od jeho chemickej formy. V prírode je Se dostupný v dvoch hlavných formách, a to anorganickej a organickej. Medzi anorganické formy patrí seleničitan (SeO32-) a selenát (SeO42-). Hlavnými organickými formami sú selenoaminokyseliny, selenocysteín (SeCys) a selenometionín (SeMet), ako aj metylovaná selenoaminokyselina Se-metylselenocysteín (MSeCys). Okrem spomínaných foriem Se sa v experimentálnej praxi, hlavne pre in vitro štúdie, využíva stabilný monometylovaný selénový produkt – metylseleničitá kyselina (MSA) (obr. 3).
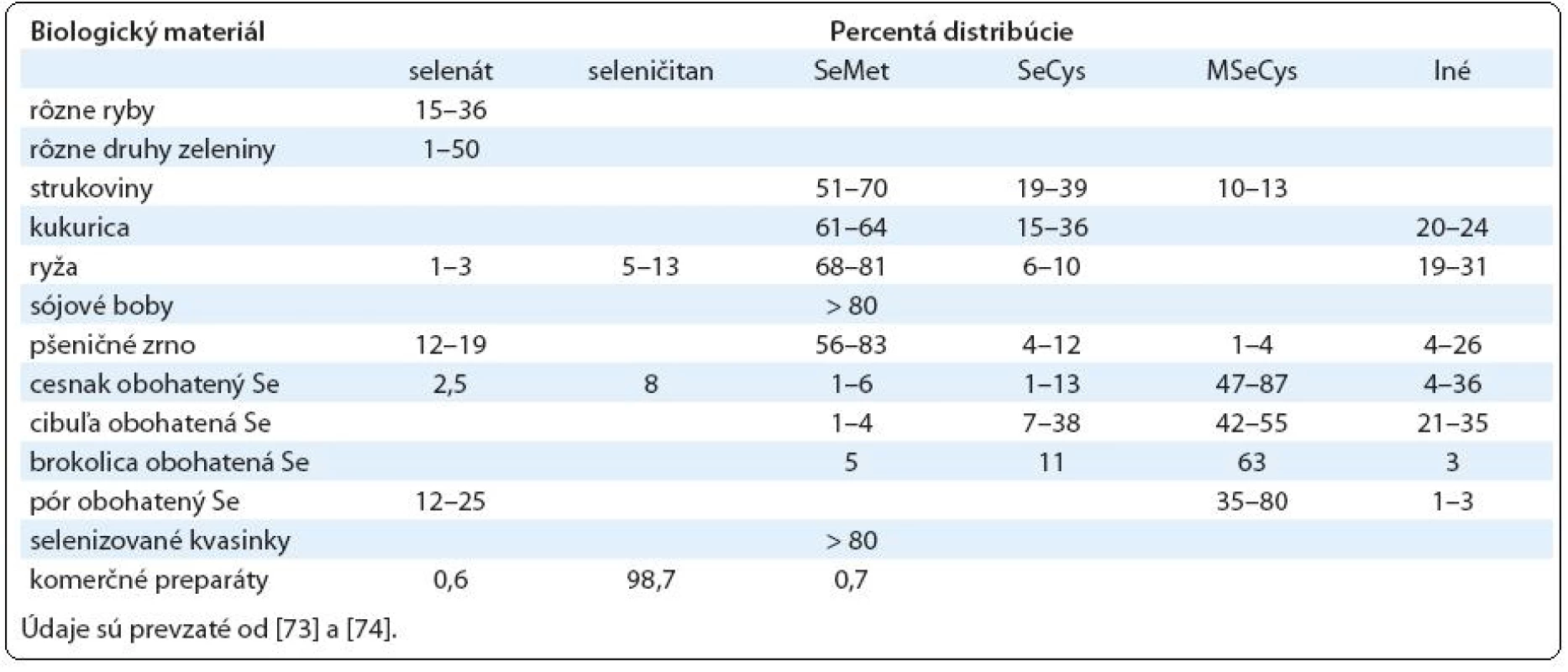
Človek prijíma Se hlavne v jeho organickej podobe vo forme rastlinnej a živočíšnej potravy, do ktorej sa Se dostáva z pôdy. Keďže sú veľké rozdiely v obsahu Se v pôde v jednotlivých častiach sveta, pre doplnenie jeho deficitu ponúka farmaceutický trh širokú škálu rôznych preparátov. Tieto obsahujú hlavne dve formy Se. Hlavnou dietetickou formou vo väčšine jednozložkových preparátov obsahujúcich Se je SeMet, ktorý sa získava prevažne z anorganického seleničitanu sodného (SeL) rastom kvasiniek Saccharomyces cerevisiae na pôdach obsahujúcich túto formu Se. Získaný produkt, tzv. selenizované kvasinky, obsahuje prevažne SeMet. Vo viaczložkových komerčných doplnkoch stravy sa Se vyskytuje hlavne vo forme SeL (tab. 1).
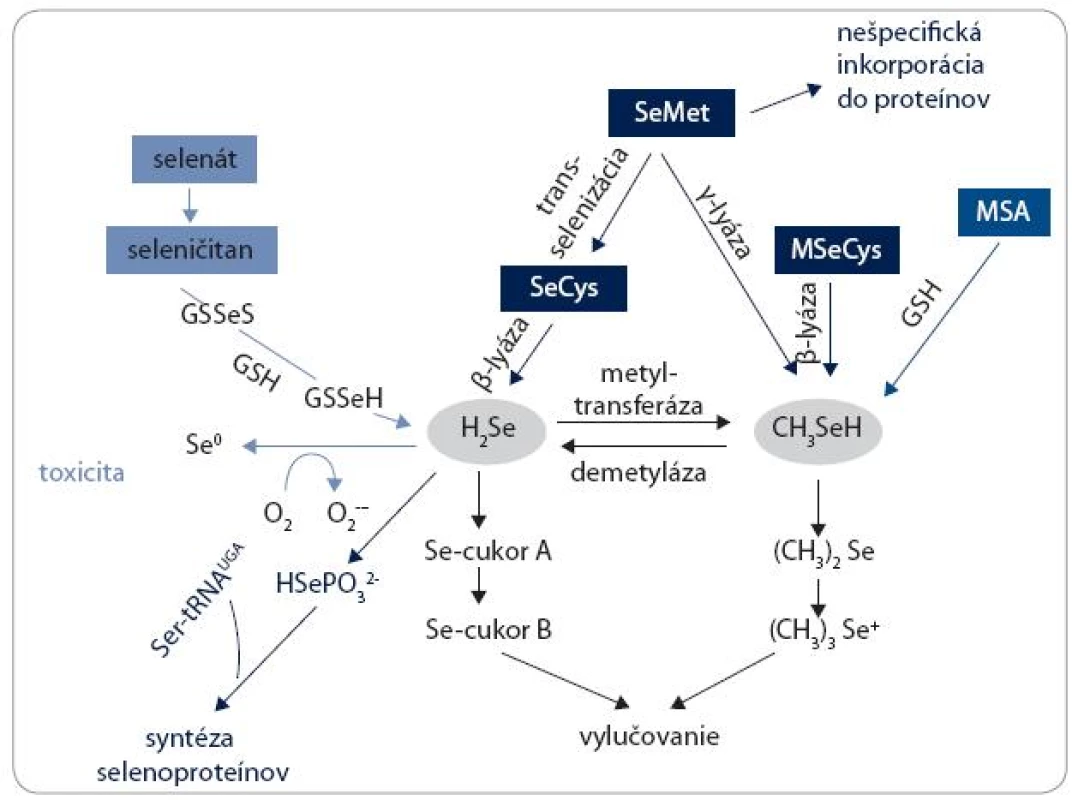
Metabolizmus selénových foriem
Väčšina poznatkov o metabolizme Se u človeka je odvodená zo štúdií robených na potkanoch a myšiach. Zjednodušená schéma metabolických dráh Se je znázornená na obr. 4. SeMet môže byť nešpecificky inkorporovaný do proteínov, takých ako albumín a hemoglobín, na miesto metionínu. Alternatívne môže byť trans-selenovaný na SeCys. SeCys buď z tohto zdroja, alebo priamo z prijatej potravy a diéty, je potom konvertovaný na selenovodík (H2Se) β-lyázou. H2Se má centrálnu úlohu v metabolizme Se látok a je využívaný na tvorbu selenoproteínov. H2Se je konvertovaný na selenofosfát (HSePO32-) selenofosfát syntetázou a následnými krokmi prostredníctvom Ser-tRNA vzniká tRNA viažúca SeCys, z ktorej je SeCys insertovaný v mieste špecifického UGA kodónu v selenoproteínovej mRNA. SeMet sa môže podrobiť ďalšej reakcii katalyzovanej γ-lyázou a vytvoriť metylselenol (CH3SeH). CH3SeH je tiež produkovaný β-lyázou z rastlinných zdrojov obsahujúcich MSeCys. V závislosti od aktivity demetylázy môže byť aj CH3SeH konvertovaný na H2Se, a preto CH3SeH a jeho prekurzory môžu byť ďalším zdrojom syntézy selenoproteínov. Využitie anorganických foriem (selenátu a seleničitanu) pre syntézu selenoproteínov vyžaduje ich redukciu na centrálny metabolit H2Se. V prítomnosti glutatiónu (GSH) je seleničitan redukovaný na H2Se. Oxidácia nadbytku H2Se vedie k produkcii superoxidu a iných reaktívnych foriem kyslíka (ROS), čo je spojené s toxicitou. Vylučovanie Se je buď z H2Se prostredníctvom metylovaných selenocukrov (cukor A a cukor B) močom, alebo ďalšou metyláciou CH3SeH vznikne dimetyl selenid ((CH3)2Se), ktorý sa vylučuje dychom, a trimetylselenóniový ión ((CH3)3Se+) je vylučovaný močom.
Od prevencie k inhibícii rastu tumorových buniek – selénový paradox v rakovine
V poslednom desaťročí sa nahromadilo veľa poznatkov, ktoré ukazujú, že Se má potenciál byť využitý nielen v prevencii, ale aj v liečbe rakoviny. Se moduluje bunkový rast v závislosti od jeho koncentrácie. Nízke koncentrácie Se sú potrebné pre prežívanie a rast buniek, ale vysoké koncentrácie účinne inhibujú ich rast.
Z preventívneho hľadiska je Se najznámejší ako antioxidant a táto jeho aktivita je sprostredkovaná selenoproteínmi, ako sú napr. glutatión peroxidázy a tioredoxín reduktázy a iné. Takéto aktivity chránia normálne bunky pred následkami oxidačného stresu, ktorého zvýšená hladina môže vyvolať rôzne patologické konsekvencie, vrátane indukcie rakoviny. Avšak v nádorových bunkách sa situácia paradoxne mení a Se, ktorý je v normálnych bunkách antioxidant, sa stáva v nádorovej bunke prooxidantom a môže zvýšiť hladinu oxidačného stresu. Predpokladá sa, že nádorové bunky majú vyššie hladiny ROS a ďalšie zvýšenie oxidačných radikálov sprostredkované Se by sa mohlo podieľať na procesoch spojených s preferenčnou inhibíciou rastu rezistentných preneoplastických a neoplastických buniek. Schematické znázornenie procesov, ktoré by sa mohli podieľať na prevencii a inhibícii rakoviny v závislosti od dávky, je na obr. 5.
![Selén a rakovina. Prebraté z práce [45].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b2776dbf5d0d881ca759338b39c0b1d2.jpeg)
Selén a prevencia rakoviny
Epidemiologické štúdie
Prvá správa o pozitívnom účinku Se na zníženie rizika vzniku rakovinných ochorení u dobytka sa objavila už pred 40 rokmi [6]. Výsledky neskorších epidemiologických štúdií boli niekedy kontroverzné, väčšina z nich však potvrdzovala nepriamu koreláciu medzi dietnym príjmom Se a rizikom vzniku rakoviny u ľudí. Skoršie štúdie ukázali geografickú koreláciu medzi nízkym Se statusom a vysokým výskytom určitých typov rakoviny [7,8]. Bola zistená nepriama významná korelácia medzi príjmom Se a úmrtiami na rakovinu čriev, prostaty, prsníkov, vaječníkov, pľúc a krvi a slabá korelácia pre rakovinu kože, pankreasu a močového mechúra. Takéto výsledky boli publikované vo viac ako 100 experimentálnych štúdiách používajúc rôzne formy a dávky Se [9]. Aj keď nie všetky výsledky ukazovali pozitívnu koreláciu medzi výskytom rakoviny a Se statusom, boli stimulom pre testovanie chemopreventívnych aktivít Se v ľudských klinických pokusoch. Získali sa viaceré výsledky, ktoré naznačovali, že dostatočný príjem Se u človeka je efektívny v znižovaní rizika k určitým typom rakoviny [10].
Jedna takáto klinická štúdia bola robená v Číne na súbore 130 000 ľudí v oblasti vysokého výskytu hepatocelulárneho karcinómu (HCC), pri ktorej bol použitý Se vo forme SeL. Jedna skupina užívala SeL (15 mg/ kg), druhá kontrolná neobohatenú soľ. Po 6 rokoch sa výskyt HCC znížil o 35 % v skupine konzumujúcej Se v porovnaní s kontrolnou [11]. V ďalšej štúdii sa sledoval efekt nízkej koncentrácie Se v krvnom sére na výskyt rôznych foriem rakoviny. Bola potvrdená nepriama korelácia medzi nízkou hladinou Se v sére a vysokým úmrtím rakoviny žalúdka a pažeráka [12]. Za najpozoruhodnejšiu klinickú štúdiu sa považuje štúdia uskutočnená v USA [13]. Jej cieľom bolo testovať hypotézu, či by dietárne doplnenie Se mohlo redukovať výskyt rakoviny kože. 1312 jedincov, ktorí v predošlom období prekonali rakovinu kože, buď prijímali orálne 200 μg Se denne vo forme selenizovaných kvasiniek, alebo boli v kontrolnej skupine bez Se. Orálne prijímaný Se neovplyvnil riziko návratu rakoviny kože. Avšak takáto Se kúra za obdobie 4,5 roka významne redukovala primárny výskyt rakoviny pľúc (46 %), čriev (58 %) a prostaty (64 %). Na základe jasného benefitu Se suplementácie v redukovaní výskytu rakoviny prostaty boli v ďalšom období uskutočňované klinické testovania na potvrdenie tejto skutočnosti. Najznámejšia z nedávnej minulosti je klinická štúdia označená ako „SELECT“ (Selenium-Vitamin E Cancer Trial), zahájená v r. 2001 na súbore 35 535 jedincov, vo veku 50 rokov a viac, z USA, Kanady a Puerta Rica rozdelených do 4 skupín (Se, Se + vitamín E, vitamín E, placebo) s plánovaným dátumom ukončenia v r. 2013. Se a vitamín E boli podávané orálne v množstve 200 μg L-SeMet/deň a 400 IU vitamínu E/deň [14]. Štúdia však bola predčasne ukončená po piatich rokoch z dôvodu, že Se a vitamín E buď jednotlivo, alebo v kombináciách pri použitých formách a koncentráciách neznižoval riziko vzniku rakoviny prostaty u zdravých jedincov [15]. Aj keď tieto posledné výsledky oslabujú všeobecne prijímaný názor, že dostatočný prísun Se znižuje riziko rakoviny prostaty u mužov, sú výzvou pre hlbšiu analýzu procesov spojených s objasnením Se-prostredkovanej prevencie rakoviny. Udáva sa, že jedným z dôvodov negatívnych výsledkov SELECT štúdie by mohla byť použitá forma Se. Čistý SeMet v porovnaní so selenizovanými kvasinkami, použitými v predchádzajúcich testoch, má podľa niektorých zistení nižší antikarcinogénny potenciál ako iné formy Se [16]. Ďalším dôvodom by mohli byť rozdielna genetická výbava a Se status testovaných jedincov. V tejto súvislosti bola predložená hypotéza, že iba Se-deficitní, no inak zdraví jedinci, môžu využiť pozitívny vplyv Se suplementácie pre zníženie rizika vzniku rakoviny. Na druhej strane u zdravých jedincov s nadbytkom Se môže dodatočná suplementácia týmto prvkom dokonca zvýšiť riziko vzniku rakoviny. Z tohto dôvodu sa javí naliehavá potreba personalizovať individuálne riziká spojené so Se suplementáciou s ohľadom na Se status u testovaných jedincov [17].
Úloha selenoproteínov v prevencii
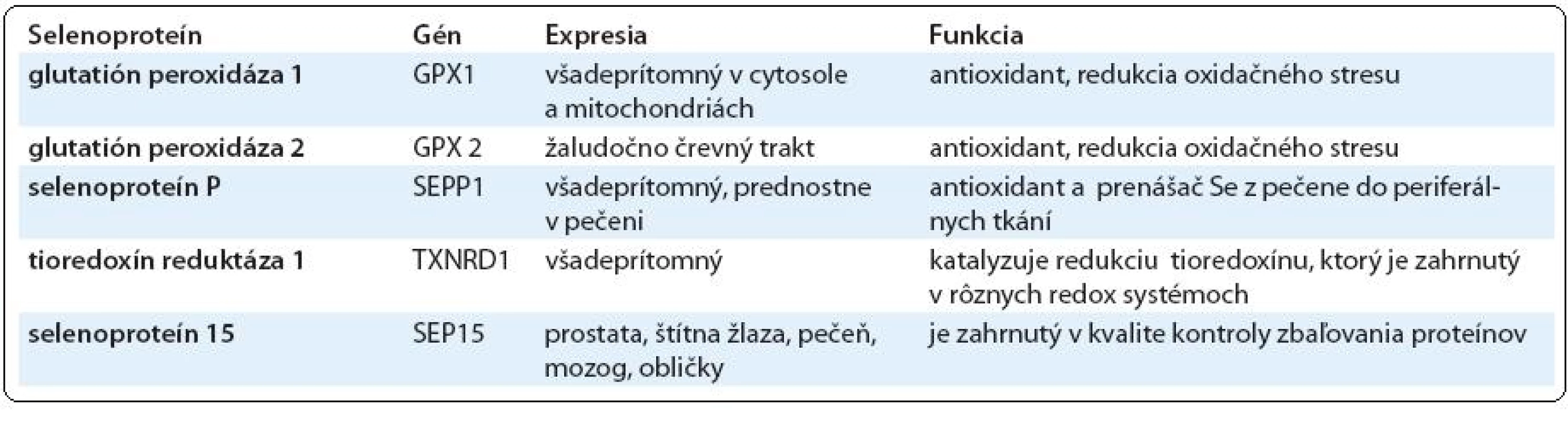
Predpokladá sa, že preventívne aktivity nízkych dietnych hladín Se sú sprotredkované selenoproteínmi. Se je inkorporovaný do selenoproteínov vo forme SeCys. U ľudí bolo identifikovaných 25 selenoproteínov, z ktorých len niektoré boli doteraz funkčne charakterizované. Vzájomný vzťah medzi selenoproteínmi a rizikom rakoviny je odvodený od skutočností, že niektoré selenoproteíny, ako sú enzýmy glutatión-peroxidázovej rodiny a selenoproteín P (SelP), poskytujú antioxidačnú ochranu pred škodlivými účinkami ROS. Mutagénny oxidačný stres je významným faktorom vedúcim k iniciácii rakoviny. Tvorba ROS radikálov, takých ako sú superoxid (O2-), singletový kyslík (1O2), hydroxylový radikál (OH), ako aj peroxid vodíka (H2O2) indukuje stály oxidačný stres, ktorý prispieva k expresii maligného fenotypu rakovinných buniek genetickými zmenami v onkogénoch a tumor supresorových génoch [18]. Ďalšia skupina selenoproteínov s potenciálnou funkciou v prevencii rakoviny sú tioredoxín reduktázy, ktoré okrem priamej redukcie hydroxyperoxidov prejavujú antioxidačnú aktivitu prostredníctvom regenerácie nízkomolekulárnych antioxidantov. Nedávne zistenia však naznačujú, že pre účinnú syntézu niektorých selenoproteínov sa vyžaduje vyšší ako dietny príjem Se [19]. Jeden z takýchto selenoproteínov je SelP, ktorého funkciou je transport Se z pečene do jednotlivých tkanív. Ďalším je selenoproteín 15 (Sep15), ktorého alelická strata sa zdá byť zahrnutá v progresii rakoviny prsníka. Selenoproteíny s predpokladanými funkciami v prevencii rakoviny sú uvedené v tab. 2.
Iné mechanizmy
Viaceré štúdie naznačovali, že Se prejavuje preventívne účinky v skorých štádiách procesu karcinogenézy prostredníctvom apoptózy predrakovinných buniek. Se suplementácia inhibovala proces karcinogenézy aj vo fáze promócie a progresie [20]. Ďalej bolo demonštrované, že terčom Se sú transkripčné faktory a niektoré enzýmy. Se zvyšuje aktivitu p53 a indukuje opravný proces DNA [21]. Okrem toho interferuje s transkripčnými faktormi dôležitými pre proliferáciu a rast, ako sú NF-κB a AP-1 [22]. Predpokladá sa tiež, že Se môže pôsobiť protektívne v počiatočných fázach karcinogenézy znížením tvorby reaktívnych foriem karcinogénov [23]. Komplexný obraz mechanizmov Se-sprostredkovanej prevencie rakoviny bol testovaný genetickou analýzou ľudských subjektov po Se suplementácii. Uskutočnené boli dve ľudské štúdie, ktoré ukázali, že Se ovplyvňuje expresiu veľkého počtu génov, medzi ktorými sú ribozomálne proteíny, transkripčné faktory a detoxifikačné enzýmy II. fázy [24,25].
Selén a liečba rakoviny
Doterajšie poznatky naznačujú, že Se má perspektívu uplatniť sa aj v terapii nádorových ochorení. Viaceré výsledky demonštrujú inhibíciu bunkového rastu s preferenciou pre nádorové verzus normálne bunky. Analýza profilu génovej expresie v niektorých nádorových bunkách ukázala, že rast nádorových buniek inhibovaný Se je spojený s moduláciou bunkového cyklu, apoptózy a signalizácie [26].
Hlavnými mechanizmami uplatňujúcimi sa v Se-sprostredkovanej rastovej inhibícii sa javia byť redox efekty. Chemiluminescentnými testami in vitro bolo demonštrované, že toxicita redox aktívnych Se zlúčenín, medzi ktoré patrí hlavne SeL, je sprostredkovaná katalytickou povahou selenovodíkového aniónu (RSe–) a následnou tvorbou O2- a oxidačného stresu v prítomnosti redukovaného GSH (obr. 6) [27]. Na druhej strane dve selenoaminokyseliny – SeMet a MeSeCys – nemôžu priamo formovať metylselenidový anión (CH3Se–) prostredníctvom redukcie GSH. Pre ich konverziu na CH3Se– anión bunky musia disponovať dostatočnými hladinami metabolických enzýmov, a to γ-lyázou v prípade SeMet a β-lyázou v prípade MeSeCys. Ďalšia Se forma, MSA, využívaná hlavne pre experimentálne in vitro štúdie sa radí medzi redox aktívne Se formy, pretože prostredníctvom redukcie GSH môže priamo vytvárať CH3Se–.
![Redox cyklovanie a tvorba ROS. Prebraté z práce [27].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5707966dc8c7abab43dc1c26ecc42b35.jpeg)
Najčastejšími Se formami, u ktorých tumor-inhibujúci potenciál bol testovaný na modeli bunkových kultúr v preklinických a klinických štúdiách sú SeMet, MSA a SeL. SeMet sa javí byť menej vhodný pre klinické použite z dôvodu potreby jeho metabolickej aktivácie v pečeni, kde v závislosti od aktivity β-lyázy vzniká monometylovaný Se metabolit. Okrem toho z dôvodov nešpecifickej inkorporácie SeMet na miesto metionínu môže byť obsah Se v jednotlivých tkanivách oveľa vyšší po podaní SeMet v porovnaní s inými formami Se. Väčšie šance pre použitie v nádorovej terapii má SeL. Vyplýva to hlavne z jeho prooxidačnej povahy a z nízkeho hromadenia v jednotlivých tkanivách.
Vo viacerých štúdiách bolo pozorované, že rakovinné bunky produkujú vyššie hladiny ROS než normálne bunky [28–31]. V normálnych bunkách je fyziologická hladina oxidačného stresu zodpovedná za reguláciu dôležitých bunkových funkcií, ako sú vnútrobunková signalizácia, transkripčná aktivácia, rozmnožovanie a prežívanie. Predpokladá sa, že zvýšená hladina ROS v nádorových bunkách by mohla byť zodpovedná za anomálnu signalizáciu a expresiu génov potrebných pre preferenčnú indukciu apoptózy [32]. Ďalšie zvýšenie hladiny oxidačného stresu nad prahové hodnoty chemopreventívnymi látkami by mohlo byť mechanizmom, ktorým tieto látky selektívne pôsobia na rakovinné bunky [33,34]. V poslednej dobe sa vynorilo mnoho dôkazov získaných prevažne na in vitro experimenálnych modeloch, ktoré ukazujú, že aj redox aktívne Se látky, medzi ktorými je najviac zastúpený SeL, by mohli mať chemoterapeutický potenciál, a to indukovať apoptózu rakovinných buniek s minimálnym efektom na normálne bunky. Predpokladá sa, že tento potenciál Se látok je spojený s ich prooxidačným charakterom [35,36], no presný mechanizmus, ktorým by Se látky selektívne stimulovali apoptotickú mašinériu rakovinných buniek, je zatiaľ málo známy. Nedávne zistenia na molekulárnej úrovni naznačujú, že kľúčovým faktorom špecifickej toxicity SeL je vstup Se do buniek. Tento je závislý na hladine extracelulárnych tiolov, ktorá je kontrolovaná transportnými proteínmi, ktorých expresia je pravdepodobne zvýšená v jednotlivých líniách rakovinných buniek [37]. Ďalšie výsledky ukazujú, že SeL prostredníctvom redox--závislej aktivácie iniciuje konformačné zmeny proapoptotického proteínu BAX, a tým stimuluje apoptózu rakovinných buniek [38].
Štúdie na bunkových líniách
Najviac in vitro štúdií bolo orientovaných na bunkové línie ľudských rakovinných buniek prostaty. SeL bol schopný indukovať na dávke závislú inhibíciu rastu a apoptózu ľudských LNCaP, PC-3 a DU145 línií rakovinných buniek prostaty [39,40]. In vivo efekt bol potvrdený na xenografickom myšom modeli s LAPC-4 tumormi. SeL inhiboval androgen-dependentný rast LAPC-4 tumorov v samčích myšiach a táto inhibícia korešpondovala s výrazným znížením sérovej hladiny prostatického špecifického antigénu (PSA) [41]. PSA je ukazovateľ používaný v klinike pre určenie diagnózy rakoviny prostaty, ako aj pre monitorovanie účinnosti terapie. Okrem toho vznik rakoviny prostaty a jej progresia do hormonálne odolného štádia sú závislé aj od expresie androgenového receptoru (AR). SeL inhiboval tiež expresiu a aktivitu AR v LAPC-4 a LNCaP líniách, hlavne prostredníctvom redox mechanizmu [42,43].
Niektoré štúdie ukazujú, že prooxidačná povaha SeL sa môže uplatniť tiež v selektívnom hynutí sarkomatoidných malígnych mesoteliómových buniek. Malígny mesotelióm je tumor, ktorý vzniká z mesoteliálnych buniek po azbestovej expozícii. Tumor je agresívny a mimoriadne rezistentný k chemoterapii. Pozoruhodné bolo zistenie, že mesoteliomové bunky majú neobvykle vysokú hladinu tioredoxín reduktázy (Trx1). SeL v koncentráciách, ktoré by potenciálne mohli byť aplikované pacientom, nielenže inhiboval rast sarkomatoidných mesoteliómových buniek prostredníctvom oxidačného stresu, ale aj znižoval významne vysokú hladinu Trx1 [44]. Trx1 aktivita v rakovinných bunkách sa javí byť zahrnutá v procese karcinogenézy a mohla by sa uplatniť ako vhodný terapeutický marker [45]. Efekt SeL na reguláciu hladiny Trx1 bol demonštrovaný tiež na líniách odvodených z ľudských pľúcnych tumorov [46]. SeL bol cez tvorbu ROS selektívne cytotoxický aj na rôzne ľudské gliomové nádory [47]. V nedávnej ex vivo štúdii s 39 pacientmi boli primárne myeloidné leukemické bunky (AML) exponované buď k bežným cytotoxickým látkam, alebo ku klinicky vhodnej koncentrácii SeL. Expozícia k SeL spôsobila najnižšie prežívanie primárnych tumorových buniek v súbore všetkých testovaných látok. Výsledky naznačili, že SeL má potenciál pre liečbu foriem AML s mnohopočetnou rezistenciou [48]. Selektívna toxicita SeL bola tiež pozorovaná aj na líniách rakovinných buniek hrubého čreva [38].
Modulácia účinnosti chemoterapie a rádioterapie Se látkami
Zlúčeniny Se by mohli byť prospešné v liečbe onkologických ochorení tým, že zvyšujú účinnosť bežných chemostatík. Takéto efekty boli pozorované in vitro s tumorovými bunkovými líniami hrubého čreva, pľúc, prostaty a prsníka. Prídavok Se vo forme kyseliny seleničitej zvyšoval terapeutické efekty taxolu a doxorubicínu nad úroveň účinnosti samotných látok [49]. Podobné výsledky boli publikované pre kombinovaný účinok SeL a kampotecínu na líniách rakovinných buniek hrdla [50]. V ďalšej štúdii bolo zistené, že chemoterapeutické efekty doxorubicínu, etopoxidu, 4-hydroxyperoxycyklofosfamidu, metafalanu a 1-β-D arabinofuranozylcytozínu boli až 2,5krát zvýšené, keď sa kombinovali s minimálne toxickou koncentráciou MSA na líniách ľudských B-lymfómových buniek. Táto koncentrácia MSA znižovala aktivitu nukleárneho faktora NF-κB, čo naznačuje, že NF-κB by mohol byť zahrnutý v mechanizme, ktorým MSA moduluje aktivitu cytotoxických látok [51]. Nedostatočná citlivosť k 5-fluorouracilu (5-FU) určitých línií rakovinných buniek hrubého čreva bola zvýšená kombináciou s kyselinou seleničitou. Výsledky naznačujú perspektívnu stratégiu pre prekonanie rezistencie k 5-FU u určitých typov rakoviny hrubého čreva [52].
Se látky môžu tiež modulovať terapeutické efekty ionizujúceho žiarenia (IR) v tumorových líniách a tkanivách. SeL scitlivoval línie ľudských rakovinných buniek prostaty ku klinicky odpovedajúcim dávkam IR [53]. Ďalej bolo ukázané, že SeMet selektívne zvyšoval citlivosť k IR v líniách rakovinných pľúcnych buniek, zatiaľ čo bola bez efektu na línie normálnych pľúcnych buniek [54].
Predbežné klinické výsledky
Aj keď sú klinické štúdie zatiaľ menej početné, z dosiaľ uverejnených údajov možno povedať, že Se samotný, alebo v kombinácii s inými liekmi môže u onkologických pacientov zlepšiť klinické výsledky a zmierniť nepriaznivé efekty chemoterapie, rádioterapie alebo chirurgickej liečby [55,56]. Užívanie Se v množstve 200 μg denne zvyšovalo normálnu hladinu imunitných funkcií u pacientov s karcinómom hlavy a hrdla [57]. Orálny príjem Se (200 μg/deň vo forme tabletiek) za obdobie 50 dní zlepšoval klinický priebeh a všeobecnú kondíciu u pacientov s malignitami žalúdočného traktu [58]. V iných klinických testoch užívanie Se vo forme selenizovaných kvasiniek v množstve 200 μg/deň za obdobie 2–3 mesiacov znižovalo negatívne dôsledky chemoterapie, ako je strata vlasov, bolesť brucha, slabosť a strata apetítu u žien s rakovinou vaječníkov [59]. Suplementácia s vysokými dávkami SeL stimulovala apoptózu v lymfatických bunkách pacientov s non-Hodgkin lymfómami [60]. Pacienti, ktorí popri chemoterapii užívali Se (0,2 mg/ kg/deň) za obdobie 7 dní prejavovali nielen významné zvýšenie percenta apoptotických lymfómových buniek, ale tiež redukciu krčných a podpazušných lymfoadenopatií, zníženie veľkosti sleziny a infiltrácie kostnej drene. SeL mal tiež pozitívny efekt na sekundárne vznikajúce lymfedémy vyvolané radiačnou terapiou samotnou, alebo ožiarením po chirurgickom zákroku [61]. Na druhej strane žiadne benefity nízkych Se dávok (20 μg/deň vo forme tabliet) neboli pozorované v priebehu chemoterapie a radiačnej terapie u pacientov s rakovinou prsníka [62]. Pravdepodobne sa Se pri takejto nízkej koncentrácii chová skôr ako antioxidant než prooxidant, a preto redukuje hladinu ROS v tumorových tkanivách, a tým negatívne vplýva na hynutie buniek [63]. Predpokladá sa, že účinnosť antitumorových terapií závisí na ROS produkcii a ich zníženie pod prahovú hodnotu antioxidantmi môže favorizovať rast nádorových buniek.
Okrem toho sa v posledných rokoch objavili klinické štúdie, na základe ktorých sa konštatuje, že veľmi vysoké dávky Se môžu spôsobiť zníženie mortality u kriticky chorých pacientov trpiacich systematickými zápalovými procesmi, alebo silnými sepsami [64,65]. Aj keď výsledky týchto štúdií nie sú vždy jednoznačné, ukazujú, že čím vyššia je Se suplementácia, tým lepší je klinický výsledok. Se dávky pre kriticky chorých pacientov sa pohybovali v rozmedzí od 2 000 do 4 000 μg prvý deň s postupným znižovaním dávky v priebehu ďalších 9–14 dní.
Toxicita
Se je toxický pri vysokých koncentráciách. Tento fakt treba mať na zreteli pri dietetickom, ako aj farmakologickom užívaní Se látok. Vysoký príjem Se môže pôsobiť toxicky v jednotlivých tkanivách a orgánoch a negatívne ovplyvňovať integritu DNA [66]. Avšak Medzinárodná agentúra pre výskum rakoviny (IARC) uzavrela, že nie sú dôvody zaradiť Se medzi ľudské karcinogény [67]. Aj keď mechanizmy zodpovedné za škodlivé účinky veľkých dávok Se nie sú celkom objasnené, bolo demonštrované, že je v nich zahrnuté poškodenie DNA [68–69] a indukcia oxidačného stresu [70]. Z dôvodu perspektívneho použitia Se v klinickej praxi sú však nevyhnutné ďalšie štúdie pre bližšie objasnenie mechanizmov jeho toxicity.
Záver
Doterajšie výsledky experimentálneho výskumu naznačujú, že Se sa v boji s rakovinným ochorením chová ako dvojsečná zbraň [71]. Na jednej strane zabraňuje vzniku ochorenia prostredníctvom rôznych protirakovinných aktivít, na druhej strane selektívne zabíja nádorové bunky cez mechanizmy, ktoré pravdepodobne využívajú zvýšenú tvorbu ROS, indukciu poškodenia DNA a aktiváciu apoptózy. Preventívna úloha Se bola potvrdená vo väčšine epidemiologických štúdií, hoci negatívne výsledky poslednej SELECT štúdie vniesli určité pochybnosti. Vyvolali však rozsiahlu polemiku, ktorá ukázala, že chemická forma Se, genetická výbava a Se status testovaných jedincov sú faktormi, ktoré môžu významne ovplyvňovať konečný výsledok. V súvislosti s prevenciou rakoviny prostaty bola vyslovená hypotéza [17], že Se suplementácia je prospešná hlavne u Se-deficitných jedincov. Na druhej strane by u Se-presýtených jedincov ďalšie podávanie Se mohlo zvýšiť riziko vzniku rakoviny. Preto sa požiadavka predpovedať personalizované riziko preventívnych dávok Se javí mimoriadne naliehavá.
Schopnosť Se selektívne inhibovať rast nádorových buniek bola pôvodne objavená v in vitro štúdiách, v ktorých bolo demonštrované, že nádorové bunkové línie sú oveľa citlivejšie k Se než línie normálnych buniek. Tieto výsledky naznačili, že by Se mohol byť perspektívne využitý v antirakovinnej terapii. Neskoršie klinické výsledky sa javia byť sľubné, pretože postupne potvrdzujú niektoré benefity adjuvantnej Se terapie, a to modulácia terapeutickej účinnosti antirakovinných liečiv a žiarenia, ako aj zlepšenie celkového klinického výsledku onkologických pacientov. V súčasnosti sú však poznatky a úvahy o použití Se v klinickej praxi v teoretickej rovine. Hoci prevažujú názory o možnom priaznivom účinku Se v prevencii a liečbe rakoviny, existujúce údaje nie sú natoľko presvedčivé, aby sa Se mohol používať v blízkej budúcnosti v praxi ako efektívna látka v chemoprevencii rakoviny [72].
Poďakovanie
Autorka ďakuje Mgr. Miroslavovi Chovancovi, PhD., vedúcemu laboratória molekulárnej genetiky Ústavu experimentálnej onkológie SAV, za podnetné návrhy a odborné rady pri písaní tohto článku.
Práca bola podporená VEGA grantovou agentúrou Slovenskej republiky (číslo grantu 2/6082/26).
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Ing. Jela Brozmanová, DrSc.
Laboratórium
molekulárnej genetiky
Ústav
experimentálnej onkológie SAV
Vlárska
7
833
91 Bratislava
Slovenská
republika
e-mail:
jela.brozmanova@savba.sk
Sources
1. Rayman MP. The importance of selenium to human health. Lancet 2000; 356(9225): 233–241.
2. Stranges S, Marshall JR, Natarajan R et al. Effects of long-term selenium supplementation on the incidence of type 2 diabetes: a randomized trial. Ann Intern Med 2007; 147(4): 217–223.
3. Laclaustra M, Navas-Acien A, Stranges S et al. Serum selenium concentrations and diabetes in U.S. adults: National Health and Nutrition Examination Survey (NHANES) 2003–2004. Environ Health Perspect 2009; 117(9): 1409–1413.
4. Oldfield JE. The two faces of selenium. J Nutr 1987; 117(12): 2002–2008.
5. Schwarz K, Foltz CM. Selenium as an integral part of factor 3 against dietary necrotic liver degeneration. J Am Chem Soc 1957; 79(12): 3292–3293.
6. Shamberger RJ, Frost DV. Possible protective effect of selenium against human cancer. Can Med.Assoc J 1969; 100(14): 682.
7. Schrauzer GN, White DA, Schneider CJ. Cancer mortality correlation studies III: statistical associations with dietary selenium intakes. Bioinorg Chem 1977; 7(1): 23–31.
8. Schrauzer GN, White DA, Schneider CJ. Cancer mortality correlation studies IV: associations with dietary intakes and blood levels of certain trace elements, notably Se-antagonists. Bioinorg Chem 1977; 7(1): 35–56.
9. Combs GF Jr, Gray WP. Chemopreventive agents: selenium. Pharmacol Ther 1998; 79(3): 179–192.
10. Whanger PD. Selenium and its relationship to cancer: an update. Br J Nutr 2004; 91(1): 11–28.
11. Yu SY, Zhu YJ, Li WG. Protective role of selenium against hepatitis B virus and primary liver cancer in Qidong. Biol Trace Elem Res 1997; 56(1): 117–124.
12. Wei WQ, Abnet CC, Qiao YL et al. Prospective study of serum selenium concentrations and esophageal and gastric cardia cancer, heart disease, stroke, and total death. Am J Clin Nutr 2004; 79(1): 80–85.
13. Clark LC, Combs GF Jr, Turnbull BW et al. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin. A randomized controlled trial. Nutritional Prevention of Cancer Study Group. JAMA 1996; 276(24): 1957–1963.
14. Klein EA, Thompson IM, Lippman SM et al. SELECT: the Selenium and Vitamin E Cancer Prevention Trial: rationale and design. Prostate Cancer Prostatic Dis 2000; 3(3): 145–151.
15. Lippman SM, Klein EA, Goodman PJ et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA 2009; 301(1): 39–51.
16. Rayman MP, Combs GF Jr, Waters DJ. Selenium and vitamin E supplementation for cancer prevention. JAMA 2009; 301(18): 1876.
17. Platz EA, Lippman SM. Selenium, genetic variation, and prostate cancer risk: epidemiology reflects back on selenium and vitamin E cancer prevention trial. J Clin Oncol 2009; 27(22): 3569–3572.
18. Valko M, Leibfritz D, Moncol J et al. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol 2007; 39(1): 44–84.
19. Rayman MP. Selenoproteins and human health: insights from epidemiological data. Biochim Biophys Acta 2009; 1790(11): 1533–1540.
20. Björkhem-Bergman L, Torndal UB, Eken S et al. Selenium prevents tumor development in a rat model for chemical carcinogenesis. Carcinogenesis 2005; 26(1): 125–131.
21. Seo YR, Kelley MR, Smith ML. Selenomethionine regulation of p53 by a ref1-dependent redox mechanism. Proc Natl Acad Sci USA 2002; 99(22): 14548–4553.
22. Gopee NV, Johnson VJ, Sharma RP. Sodium selenite-induced apoptosis in murine B-lymphoma cells is associated with inhibition of protein kinase C-delta, nuclear factor kappaB, and inhibitor of apoptosis protein. Toxicol Sci 2004; 78(2): 204–214.
23. el-Bayoumy K, Chae YH, Upadhyaya P et al. Inhibition of 7,12-dimethylbenz(a)anthracene-induced tumors and DNA adduct formation in the mammary glands of female Sprague-Dawley rats by the synthetic organoselenium compound, 1,4-phenylenebis(methylene)selenocyanate. Cancer Res 1992; 52(9): 2402–2407.
24. Pagmantidis V, Méplan C, van Schothorst EM et al. Supplementation of healthy volunteers with nutritionally relevant amounts of selenium increases the expression of lymphocyte protein biosynthesis genes. Am J Clin Nutr 2008; 87(1): 181–189.
25. Ravn-Haren G, Krath BN, Overvad K et al. Effect of long-term selenium yeast intervention on activity and gene expression of antioxidant and xenobiotic metabolising enzymes in healthy elderly volunteers from the Danish Prevention of Cancer by Intervention by Selenium (PRECISE) pilot study. Br J Nutr 2008; 99(6): 1190–1198.
26. Narayanan BA. Chemopreventive agents alters global gene expression pattern: predicting their mode of action and targets. Curr Cancer Drug Targets 2006; 6(8): 711–727.
27. Spallholz JE, Palace VP, Reid TW. Methioninase and selenomethionine but not Se-methylselenocysteine generate methylselenol and superoxide in an in vitro chemiluminescent assay: implications for the nutritional carcinostatic activity of selenoamino acids. Biochem Pharmacol 2004; 67(3): 547–554.
28. Szatrowski TP, Nathan CF. Production of large amounts of hydrogen peroxide by human tumor cells. Cancer Res 1991; 51(3): 794–798.
29. Kong Q, Beel JA, Lillehei KO. A threshold concept for cancer therapy. Med Hypotheses 2000; 55(1): 29–35.
30. Trachootham D, Zhou Y, Zhang H et al. Selective killing of oncogenically transformed cells through a ROS-mediated mechanism by beta-phenylethyl isothiocyanate. Cancer Cell 2006; 10(3): 241–252.
31. Trachootham D, Alexandre J, Huang P. Targeting cancer cells by ROS-mediated mechanisms: a radical therapeutic approach? Nat Rev Drug Discov 2009; 8(7): 579–591.
32. Pan JS, Hong MZ, Ren JL. Reactive oxygen species: a double-edged sword in oncogenesis. World J Gastroenterol 2009; 15(14): 1702–1707.
33. Hail N Jr, Cortes M, Drake EN et al. Cancer chemoprevention: a radical perspective. Free Radic Biol Med 2008; 45(2): 97–110.
34. Trachootham D, Lu W, Ogasawara MA et al. Redox regulation of cell survival. Antioxid Redox Signal 2008; 10(8): 1343–1374.
35. Drake EN. Cancer chemoprevention: selenium as a prooxidant, not an antioxidant. Med Hypotheses 2006; 67(2): 318–322.
36. Lipinski B. Rationale for the treatment of cancer with sodium selenite. Med Hypotheses 2005; 64(4): 806–810.
37. Olm E, Fernandes AP, Hebert C et al. Extracellular thiol-assisted selenium uptake dependent on the x(c) - cystine transporter explains the cancer-specific cytotoxicity of selenite. Proc Natl Acad Sci USA 2009; 106(27): 11400–11405.
38. Huang F, Nie C, Yang Y et al. Selenite induces redox-dependent Bax activation and apoptosis in colorectal cancer cells. Free Radic Biol Med 2009; 46(8): 1186–1196.
39. Menter DG, Sabichi AL, Lippman SM. Selenium effects on prostate cell growth. Cancer Epidemiol Biomarkers Prev 2000; 9(11): 1171–1182.
40. Ghosh J. Rapid induction of apoptosis in prostate cancer cells by selenium: reversal by metabolites of arachidonate 5-lipoxygenase. Biochem Biophys Res Commun 2004; 315(3): 624–635.
41. Bhattacharyya RS, Husbeck B, Feldman D et al. Selenite treatment inhibits LAPC-4 tumor growth and prostate-Specific antigen secretion in a xenograft model of human prostate cancer. Int J Radiat Oncol Biol Phys 2008; 72(3): 935–940.
42. Husbeck B, Bhattacharyya RS, Feldman D et al. Inhibition of androgen receptor signaling by selenite and methylseleninic acid in prostate cancer cells: two distinct mechanisms of action. Mol Cancer Ther 2006; 5(8): 2078–2085.
43. Husbeck B, Nonn L, Peehl DM et al. Tumor-selective killing by selenite in patient-matched pairs of normal and malignant prostate cells. Prostate 2006; 66(2): 218–225.
44. Nilsonne G, Sun X, Nyström C et al. Selenite induces apoptosis in sarcomatoid malignant mesothelioma cells through oxidative stress. Free Radic Biol Med 2006; 41(6):874–885.
45. Selenius M, Rundlöf AK, Olm E et al. Selenium and the selenoprotein thioredoxin reductase in the prevention, treatment and diagnostics of cancer. Antioxid Redox Signal 2010; 12(7): 867–880.
46. Selenius M, Fernandes AP, Brodin O et al. Treatment of lung cancer cells with cytotoxic levels of sodium selenite: effects on the thioredoxin system. Biochem Pharmacol 2008; 75(11): 2092–2099.
47. Kim EH, Sohn S, Kwon HJ et al. Sodium selenite induces superoxide-mediated mitochondrial damage and subsequent autophagic cell death in malignant glioma cells. Cancer Res 2007; 67(13): 6314–6324.
48. Olm E, Jönsson-Videsäter K, Ribera-Cortada I et al. Selenite is a potent cytotoxic agent for human primary AML cells. Cancer Lett 2009; 282(1): 116–123.
49. Vadgama JV, Wu Y, Shen D et al. Effect of selenium in combination with Adriamycin or Taxol on several different cancer cells. Anticancer Res 2000; 20(3A): 1391–1414.
50. Rudolf E, Radocha J, Cervinka M et al. Combined effect of sodium selenite and campthotecin on cervical carcinoma cells. Neoplasma 2004; 51(2): 127–135.
51. Jüliger S, Goenaga-Infante H, Lister TA et al. Chemosensitization of B-cell lymphomas by methylseleninic acid involves nuclear factor-kappaB inhibition and the rapid generation of other selenium species. Cancer Res 2007; 67(22): 10984–10992.
52. Thant AA, Wu Y, Lee J et al. Role of caspases in 5-FU and selenium-induced growth inhibition of colorectal cancer cells. Anticancer Res 2008; 28(6A): 3579–3592.
53. Husbeck B, Peehl DM, Knox SJ. Redox modulation of human prostate carcinoma cells by selenite increases radiation-induced cell killing. Free Radic Biol Med 2005; 38(1): 50–57.
54. Shin SH, Yoon MJ, Kim M et al. Enhanced lung cancer cell killing by the combination of selenium and ionizing radiation. Oncol Rep 2007; 17(1): 209–216.
55. Dennert G, Horneber M. Selenium for alleviating the side effects of chemotherapy, radiotherapy and surgery in cancer patients. Cochrane Database Syst Rev 2006; 3: CD005037.
56. Micke O, Schomburg L, Buentzel J et al. Selenium in oncology: from chemistry to clinics. Molecules 2009; 14(10): 3975–3988.
57. Kiremidjian-Schumacher L, Roy M, Glickman R et al. Selenium and immunocompetence in patients with head and neck cancer. Biol Trace Elem Res 2000; 73(2): 97–111.
58. Federico A, Iodice P, Federico P et al. Effects of selenium and zinc supplementation on nutritional status in patients with cancer of digestive tract. Eur J Clin Nutr 2001; 55(4): 293–297.
59. Sieja K, Talerczyk M. Selenium as an element in the treatment of ovarian cancer in women receiving chemotherapy. Gynecol Oncol 2004; 93(2): 320–327.
60. Asfour IA, El-Tehewi MM, Ahmed MH et al. High-dose sodium selenite can induce apoptosis of lymphoma cells in adult patients with non-Hodgkin’s lymphoma. Biol Trace Elem Res 2008; 127(3): 200–210.
61. Micke O, Bruns F, Mücke R et al. Selenium in the treatment of radiation-associated secondary lymphedema. Int J Radiat Oncol Biol Phys 2003; 56(1): 40–49.
62. Greenlee H, Gammon MD, Abrahamson PE et al. Prevalence and predictors of antioxidant supplement use during breast cancer treatment: the Long Island Breast Cancer Study Project. Cancer 2009; 115(14): 3271–3282.
63. Tabassum A, Bristow RG, Venkateswaran V. Ingestion of selenium and other antioxidants during prostate cancer radiotherapy: a good thing? Cancer Treat Rev 2010; 36(3): 230–234.
64. Manzanares W, Hardy G. Selenium supplementation in the critically ill: posology and pharmacokinetics. Curr Opin Clin Nutr Metab Care 2009; 12(3): 273–280.
65. Vincent JL, Forceville X. Critically elucidating the role of selenium. Curr Opin Anaesthesiol 2008; 21(2): 148–154.
66. Letavayova L, Vlckova V, Brozmanova J. Selenium: from cancer prevention to DNA damage. Toxicology 2006; 227(1–2): 1–14.
67. Overall evaluations of carcinogenicity: an updating of IARC Monographs volumes 1 to 42. IARC Monogr Eval Carcinog Risks Hum Suppl 1987; 7 : 1–440.
68. Biswas S, Talukder G, Sharma A. Chromosome damage induced by selenium salts in human peripheral lymphocytes. Toxicol In Vitro 2000; 14(5): 405–408.
69. Letavayova L, Vlasakova D, Spallholz JE et al. Toxicity and mutagenicity of selenium compounds in Saccharomyces cerevisiae. Mutat Res 2008; 638(1–2): 1–10.
70. Wycherly BJ, Moak MA, Christensen MJ. High dietary intake of sodium selenite induces oxidative DNA damage in rat liver. Nutr Cancer 2004; 48(1): 78–83.
71. Brozmanova J, Manikova D, Vlckova V et al Selenium: a double-edged sword for defense and offence in cancer. Arch Toxicol 2010; 84(12): 919–938.
72. Novotny L, Rauko P, Kombian SB et al. Selenium as a chemoprotective anti-cancer agent: reality or wishful thinking? Neoplasma 2010; 57(5): 383–391.
73. Whanger PD. Selenocompounds in plants and animals and their biological significance. J Am Coll Nutr 2002; 21(3): 223–232.
75. Połatajko A, Banaś B, Encinar JR et al. Investigation of the recovery of selenomethionine from selenized yeast by two-dimensional LC-ICP MS. Anal Bioanal Chem 2005; 381(4): 844–849.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2011 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Selén a rakovina: od prevencie k liečbe
- High-dose interferon alfa v léčbě pacientů s maligním melanomem, sledování prediktivních a prognostických biomarkerů
- Gastrointestinální stromální tumory
- Dynamika vývoja psychosociálnej záťaže prežívajúcich pacientok s karcinómom prsníka: klinický úspech s psychosociálnymi dôsledkami
- Radiofrekvenční ablace neuroendokrinního nádoru pankreatu
- Regrese osteolytického ložiska u pacienta s mnohočetným myelomem léčeného klodronátem po úspěšné terapii režimem s bortezomibem
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
- Paliativní péče v České republice v roce 2011 – několik poznámek
- In vitro hodnocení prostupnosti cytotoxických léčiv přes rekonstruovanou lidskou epidermis a ústní epitel
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Gastrointestinální stromální tumory
- Selén a rakovina: od prevencie k liečbe
- Může pacient v terminálním stadiu onkologického onemocnění důstojně zemřít doma? A za jakých podmínek?
- Informační systémy v radioterapii
