Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
Treatment For Volume Upgrading of the Low-Grade Supratentorial Glioma After the Subtotal Neurosurgical Resection
Background:
Low-grade gliomas WHO II (LGG) are mostly detected in patients with neurological symptomatology between 20 and 45 years of age very often as secondary epilepsy. We present two cases in which low-grade gliomas attacked neurological zones. Neurosurgical resection was subtotal because of the risk of the damage in neurocognitive functions in both these patients. After the operation, both patients were followed at neurosurgery department in regular intervals using different imaging methods (MRI, MRS and PET). After resections, the MRI detected the enlargement of the volumes of the tumor residua in both patients.
Patients and methods:
Owing to the risk of up-grading to high-grades glial tumors (overexpression of EGFR and VEGF), both patients were indicated for curative treatment by external beam radiotherapy combined with chemotherapy (Temodal®) and adjuvant chemotherapy.
Results:
After the end of this treatment, the MRI proved considerable partial regressions in both patients. Moreover, three months later, the MRI did not prove any residual disease.
Conclusion:
Radiotherapy combined with the administration of Temodal should prolong the OS and TTP in patients with a high risk of up-grading of low-grade gliomas of the brain. Both the patients are in a follow-up program, also because of the risk of duplicite brain tumor.
Key words:
brain tumor – glioma – tumor grading – chemotherapy – temozolomide – radiotherapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
7. 12. 2011
Accepted:
27. 7. 2012
:
F. Třebický 1; J. Kubeš 1; R. Bartoš 2; A. Malucelli 2; M. Sameš 2; M. Navrátil 3; V. Vondráček 3; S. Medková 3; M. Mašek 4; J. Zárubová 5
:
Ústav radiační onkologie, 1. LF UK a Nemocnice Na Bulovce, Praha
1; Neurochirurgická klinika, UJEP a Masarykova nemocnice v Ústí nad Labem
2; Radiofyzikální oddělení, 1. LF UK a Nemocnice Na Bulovce, Praha
3; Radiodiagnostická klinika, 1. LF UK a Nemocnice Na Bulovce, Praha
4; Neurologická klinika, Thomayerova nemocnice, Praha
5
:
Klin Onkol 2012; 25(4): 294-298
:
Case Reports
Východiska:
Nízkostupňové gliomy WHO grade II (LGG) se v dospělé populaci nejčastěji projevují mezi 20. a 45. rokem života epileptickým záchvatem. Prezentujeme kazuistiky 2 pacientů, u kterých ložiska LGG zasahovala do elokventních oblastí, v nichž by další pokračování neurochirurgického resekčního výkonu znamenalo poškození kognitivních a neurologických funkcí pacienta. Po operaci byli pacienti sledováni v pravidelných intervalech klinických kontrol na neurochirurgické ambulanci a pomocí zobrazovacích vyšetření (MRI, MRS a PET). U obou pacientů došlo k objemové progresi ložisek bez možnosti další neurochirurgické intervence, která by zajistila radikalitu výkonu.
Soubor pacientů a metody:
Vzhledem k riziku i up-gradingu nádoru (overexprese EGFR a VEGF) byli oba pacienti indikováni ke kurativní kombinované léčbě zevní radioterapií s potenciací temozolomidem (Temodal®) a následné adjuvantní chemoterapii.
Výsledky:
U obou pacientů po dokončení kombinované léčby došlo na MRI k výrazné objemové regresi ložisek nádorů a v dalším odstupu 3 měsíců byly na MRI oba případy hodnocené bez známek nádorového rezidua.
Závěr:
Indikace kombinované léčby může stabilizovat progresi LGG, uchránit pacienta od up-gradingu nádoru mozku do stupně IV, a může tak výrazně prodloužit celkové přežití pacienta (OS) i dobu do progrese (TTP). Oba pacienti jsou nadále sledováni i z hlediska prevence duplicitního nádorového onemocnění nervové tkáně.
Klíčová slova:
nádorové onemocnění nervové tkáně – gliomy – grading nádoru – chemoterapie – temozolomid – radioterapie
Úvodem
Nízkostupňové gliomy WHO grade II [1,2] jsou diagnostikovány nejčastěji v období mezi 20. a 45. rokem života, nejčastějším projevem bývá epileptický záchvat. Pacienti jsou nejčastěji indikováni k neurochirurgické resekci s cílem dosáhnout maximální objemové radikality [3] nebo k léčbě antiepileptiky s cílem dosáhnout remise epileptických obtíží a poté následuje sledování pacienta. Rizikem je u těchto pacientů rychlá progrese objemu nádoru s potenciální verzí onemocnění na vyšší grade gliálního nádoru (anaplastický gliální nádor nebo glioblastom) s podstatně nižší lokální kontrolou nemoci po léčbě a kratším intervalem přežití pacienta [4–6]. Postup na vyšší grade nemoci je vždy spojený s genetickými mutacemi na 10., 17. a 22. chromozomu s následky overexprese receptorů EGFR a VEGFR. Cílem léčby je u těchto případů snížení rizika verze nemoci na vyšší grade, prodloužení celkové doby přežití pacienta, navýšení lokální kontroly nemoci a stabilizace jeho neurologických obtíží. Pacienti musejí být následně sledováni z důvodu rizika stimulace duplicitního nádorového onemocnění nervové tkáně.
Souhrn pacientů
Na ambulanci onkologického oddělení byli v období dubna až července 2011 konzultováni dva pacienti, muž 33 let a žena 45 let. Muž byl v roce 2003 operovaný v celkové anestezii pro smíšený difuzní oligoastrocytom gr. II frontálně vlevo, byla provedena radiograficky radikální resekce. V roce 2008 byla pro progresi nádoru provedena awake resekce s monitorací řečových funkcí [7], vzhledem k infiltraci elokventní oblasti již pouze subtotální, histologicky byl verifikovaný identický grade nádoru. Pacient byl sledovaný v pravidelných intervalech, na MRI v roce 2011 se známkami objemového zvětšení ložiska bez sycení kontrastní látkou. Byla provedena MRS multivoxel technikou; Volume of Interest byl zvolen tak, aby obsahoval celou postresekční dutinu a její okolí. Spektra z oblasti rezidua neukázala jasné známky malignity, samotné zvýšení cholinu bez výrazného poklesu N-acetyl aspartátu odpovídalo původní histologické diagnóze expanze nižšího stupně. Neurochirurgický výkon by nebyl radikální, případně by s sebou nesl velké riziko poruchy řečových funkcí. Pacientovi byla pro riziko up-gradingu nádoru nabídnuta kurativní chemoradioterapie, se kterou vyjádřil souhlas. V době indikace byl pacient bez jakékoli poruchy neurokognitivních funkcí.
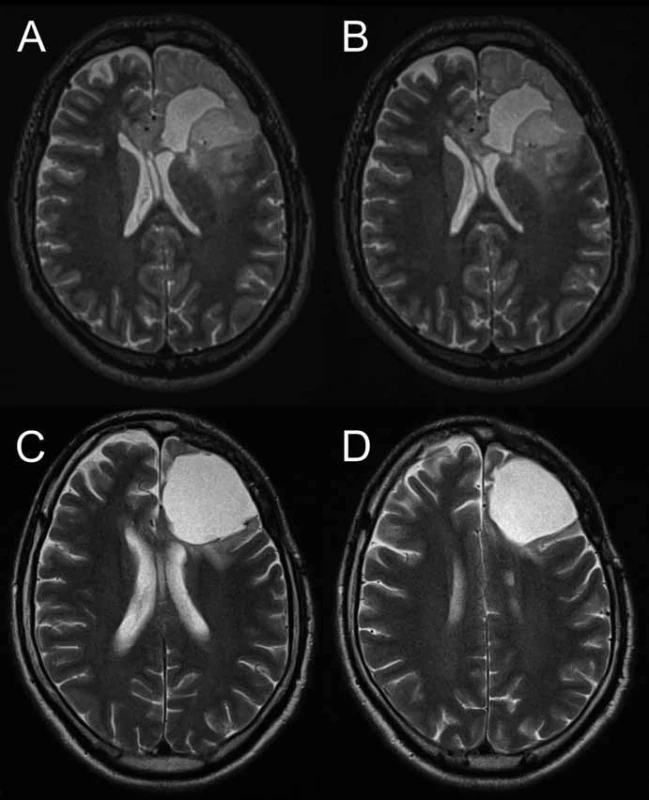
Ženě ve věku 45 let sledované po subtotální resekci fibrilárního astrocytomu inzuly vpravo, gr. II, byla již v roce 2010 pro riziko objemové progrese nabídnuta možnost radioterapie, pacientka souhlasila pouze se sledováním ložiska. V roce 2011 došlo na MRI k další objemové progresi, bez známek patologického sycení kontrastní látkou, pacientka byla bez neurologického deficitu. Pro další progresi objemu nádoru jí opět byla nabídnuta kurativní chemoradioterapie, se kterou již vyjádřila souhlas.
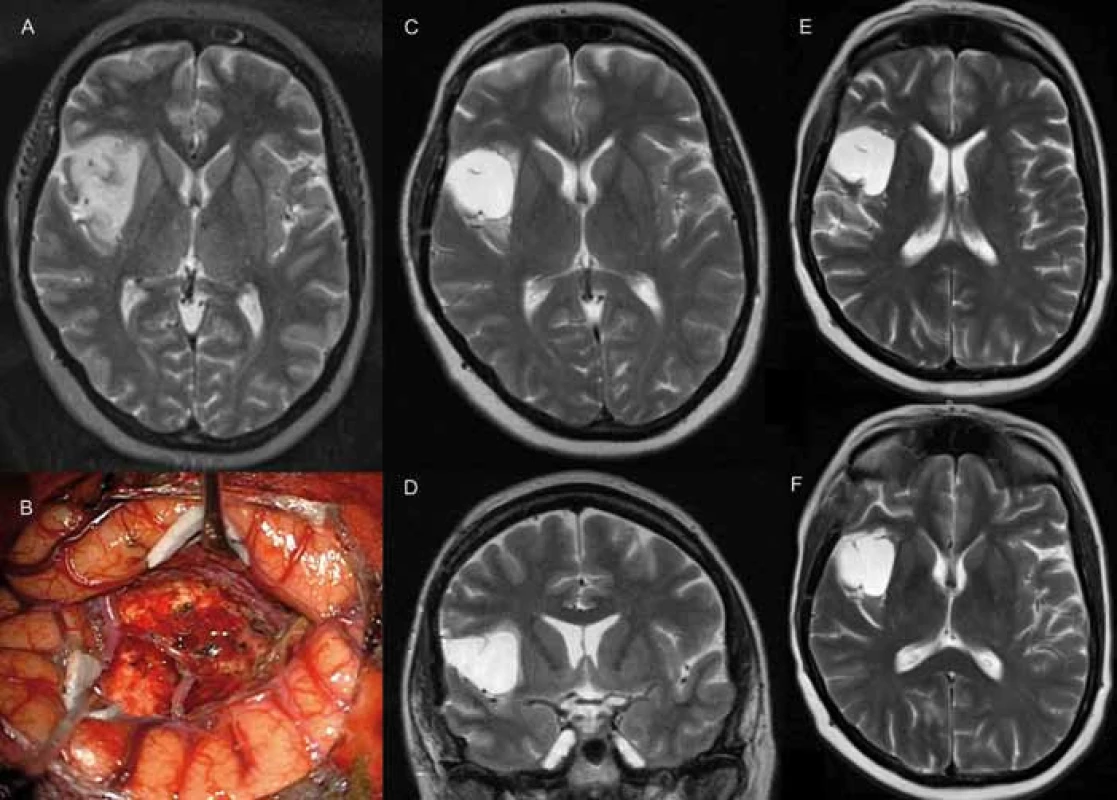
Léčba pacientů
Oba pacienti indikovaní k léčbě zevní aktinoterapií [7–9] z důvodu rizika up-gradingu nízkostupňového nádoru a byli zařazeni do skupiny léčby gliálních nádorů gr. III (anaplastické nádory gliální). Plánování léčby zevní aktinoterapií bylo zahájeno dle standardu léčby mozkových nádorů vyššího stupně (gr. III–IV) v Ústavu radiační onkologie, FNB Praha. Uložení pacientů proběhlo v supinační poloze, fixace hlavy byla provedena pomocí fixačního můstku pro ozáření lokality hlavy a krku (Agmecolt, a. s.) a byly použity fixační termoplastové masky (Orfit®). Konturace objemů byla zajištěna pomocí plánovacího CT (Siemens) s užitím kontrastní látky a fúzí s aktuálním obrazem T1 s kontrastní látkou na MRI. Byly stanoveny objemy [3] GTV (nádorové reziduum a resekční dutina), CTV1 (expanze 5 mm + 20 mm zevně od okraje GTV pro přítomnost úzkého lemu perifokálního edemu) a CTV2 (expanze 5 + 5 mm od zevního okraje GTV), PTV1 (5mm expanze od zevního okraje objemu CTV1) a PTV2 (5 mm od zevního okraje objemu CTV2). Dále byly provedeny konturace rizikových orgánů (kmen mozku, optické chiasma, oba optické nervy, pomocné struktury oka – retina, oční čočka oboustranně, struktury očnic – slzné žlázy, sluchový aparát oboustranně, proximální mícha a parotické žlázy, vedlejší dutiny nosní a ústní dutiny).
Parametry k plánování byly předány na oddělení plánování léčby, kde na plánovacím systému Eclipse Varian® byly stanoveny ozařovací techniky. Pro muže z důvodu anatomického uložení GTV a z důvodu expanze objemů byla užita izocentrická technika ozáření pomocí svazků s modulovanou intenzitou (IMRT), dodaná pomocí sliding windows MLC, pro ženu byla stanovena izocentrická koplanární ozařovací technika stacionárních svazků s klínovými filtry. Dávky pro PTV1 byly stanoveny v rozsahu 4 600 a 5 000 cGy a pro PTV2 1 400 a 1 000 cGy normofrakcionačním režimem. Dávky byly předepsané na 90% izodozu při normalizaci do maxima v cílovém objemu. Dávkové limity u rizikových orgánů byly dodrženy, pouze u muže byl překročen limit pro sluchový aparát na postižené straně.
Pro chemoterapii [10,11] byla stanovena volená medikace Temodal® v dávce 75 mg/m² p.o. denně po celý průběh léčby, oba pacienti splnili indikační kritéria pro podání chemoterapie temozolomidem.
Průběh léčby
V průběhu léčby pacientů nedošlo k projevům poškození kognitivních funkcí ani k projevům epileptickým. U pacientky jsme pozorovali retardaci psychomotorického tempa, jehož porucha se upravila do 3 měsíců po dokončení chemoradioterapie. Hematologická toxicita nebyla u muže přítomna po celou dobu léčby, u ženy byla léčba ukončena posledním týdnem chemoradioterapie pro hraniční leukopenii v souladu s projevy zpomalení psychomotorického tempa. Objevily se projevy standardní epilace vlasové pokrývky, reakce na spojivkách nepřesáhla grading II dle škály akutních reakcí dle RTOG a byla kompenzována lokálními antibiotiky a umělými slzami. Pacienti byli sledováni v pravidelných intervalech na oční ambulanci. Jiné toxické projevy léčby nebyly přítomny. Oba pacienti dokončili radioterapii do stanovené dávky 6 000 cGy a byli konzultováni na ambulanci s odstupem 4 týdnů s výsledky hematologickými, biochemickými a nálezy MRI.
Výsledky léčby pacientů
Oba pacienti byli vyšetřeni na pracovištích MRI, kde jsou pravidelně sledováni, muž 5 měsíců od první konzultace a žena 4 měsíce od konzultace. U obou pacientů došlo k výrazné objemové regresi nádorového rezidua. U žádného z pacientů nedošlo k poruše kognitivních funkcí, muž pokračuje v [11,12] adjuvantní chemoterapii Temodalem® dle protokolu v standardní dávce 200 mg/m² p.o. D 1–5 v intervalu 28 dnů, žena pro trvající hraniční hodnoty bílé krevní řady adjuvantní chemoterapii odmítla a je nadále sledována.
Diskuze
Gliální nádory mozku nízkého stupně u pacientů středního věku jsou velmi kontroverzním tématem [12]. Věková hranice maligního zvratu nízkostupňového gliálního nádoru mozku nebo období projevů vysokostupňových nádorů mozku se pohybují v rozmezí 45. až 55. roku života pacientů dle dat Národního onkologického registru [6,7]. Kontroverznost a obtížnost rozhodování o léčbě u těchto pacientů může být ztížena samotnou pozicí nádoru nebo případnými komorbiditami pacienta [4] znemožňujícími kompletní resekci tumoru při známkách grafické objemové progrese [3] a histologickou verifikaci nádoru.
Vzhledem k objemové, graficky verifikované progresi nádorů u zmiňovaných pacientů a k věku pacientů byl volen radikální přístup léčby jako u pacientů s projevy a diagnózou vysokostupňového gliálního nádoru mozku. U obou pacientů došlo k výrazné léčebné odpovědi nádorových ložisek bez projevů poruch kognitivních funkcí.
Pro zkvalitnění rozhodovacího procesu o léčbě nebo pouhé dispenzarizaci pacientů s projevy nízkostupňového gliálního nádoru mozku, zvlášť u pacientů bez přítomnosti projevů epilepsie před chirurgickým výkonem [5] nebo u pacientů s nepříznivým uložením nádoru, může být výhodou jejich pravidelná monitorace zobrazovacími metodami (MRI, MRI + spektroskopie, FLT + FDG PET/CT). K diskuzi o dalším zkvalitnění rozhodovacího procesu a prognóze pacientů by mohlo přispět i klinické sledování skupiny pacientů s objemovou progresí nízkostupňových gliálních nádorů mozku.
Závěr
U obou pacientů s diagnózou LGG se známkami objemové progrese neindikované vzhledem k elokvenci k neurochirurgické resekci došlo po kombinované léčbě radioterapií a potenciací chemoterapií k výrazné regresi nádoru až ke stupni kompletní remise nádorového rezidua. Chemoradioterapie indikovaná u objemových progresí nízkostupňových gliálních nádorů může mít vliv na stabilizaci onemocnění a zablokovat verzi nádoru [6] na vyšší grade s nepříznivou prognózou OS a TTP. Pacient pokračuje v léčbě adjuvantní chemoterapií a pacientka je v programu sledování po onkologické léčbě. Oba pacienti jsou sledováni pomocí MRI a u obou je plánováno vyšetření zobrazující metabolické funkce (FDG-FLT-PET/CT). Oba pacienti musejí být i v případě dosažení kompletní remise a stabilizace onemocnění dlouhodobě onkologicky sledováni kvůli riziku duplicitního nádorového onemocnění nervové tkáně mozku, obalů mozku a oblasti hlavy a krku.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ferdinand Třebický
Ústav radiační onkologie 1. LF UK a FN Na Bulovce
Na Truhlářce 100
180 00 Praha 8
ferdinand.trebicky@fnb.cz
Obdrženo: 7. 12. 2011
Přijato: 27. 7. 2012
Sources
1. Grier J, Batchelor T. Low-Grade Gliomas in Adults. The Oncologist 2006; 11(6): 681–693.
2. Pignatti F, van den Bent M, Curran D. European Organization for Research and Treatment of Cancer Brain Tumor Cooperative Group; European Organization for Research and Treatment of Cancer Radiotherapy Cooperative Group. Prognostic Factors for Survival in Adult Patients With Cerebral Low-Grade Glioma. J Clin Oncol 2002; 15(20): 2076–2084.
3. Combs SE, Thilmann C, Edler L et al. Efficacy of Fractionated Stereotactic Reirradiation in Recurrent Gliomas: Long-Therm Results in 172 Patients Treated in a Single Institution. J Clin Oncol 2005; 23(34): 8863–8869.
4. Shaw E, Arusell R, Scheithauer B et al. Prospetive Randomized Trial of Low – Versus High-Dose Radiation Therapy in Adults With Supratentorial Low-Grade Glioma: Initial Report of a North Central Cancer Tratment Group//Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group Study. J Clin Oncol 2002; 20(9): 2267–2276.
5. van Veelen M L, Averzaat CJ, Kros JM et al. Supratentorial low grade astrocytoma: prognostic factors, dedifferentiation, and the issue of early versus late surgery. J Neurol Neurosurg Psychiatry 1998; 64(5): 581–587.
6. Shafgat S, Hedley-Whyte ET, Henson JW. Age-dependent rate of anaplatic transformation in low-grade astrocytoma. Neurology 1999; 52(4): 867–869.
7. Bauman G, Fisher B, Watling C. Adult Supratentorial Low-Grade Glioma: Long-Therm Experience at a Single Institution. Int J Radiat Biol Phys 2009; 75(5): 1401–1407.
8. Perez CA, Brady LW (eds). Priciples and practice of radiation oncology. Philadelphia: JB Lippincott Williams & Wilkins 2008 : 737–740.
9. van den Bent MJ, Afra D, de Witte O et al. EORTC Radiotherapy and Brain Tumor Groups and the UK Medical Research Council. Long-term efficacy of early versus delayed radiotherapy fo low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 2005; 366(9490): 985–990.
10. Stupp R, Hegi E, Gilbert MR et al. Chemoradiotherapy in Malignant Glioma: Standard of Care and Future Directions. J Clin Oncol 2007; 25(26): 4127–4136.
11. Stupp R, Gander M, Leyvraz S et al. Current and future development in the use temozolomide for the treatment of brain tumors. Lancet Oncol 2001; 2(9): 552–560.
12. Pace A, Vidiri A, Galiè E et al. Temozolomide chemotherapy for progressive low-grade glioma: clinical benefits and radiolobiological response. Ann Oncol 2003; 14(12): 1722–1726.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2012 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Implication of Bone Marrow Microenvironment in Pathogenesis of Multiple Myeloma
- CT Colonography – Evolution of Methodology and Indications
- Long Non-Coding RNAs And Their Relevance in Cancer
- Treatment of Langerhans Cells Histiocytosis by Cladribin Reached Long-Term Complete Remission in 9 out of 10 Adult Patients
- EGFR Mutations in Patients with Advanced NSCLC
- HARDROCK Project: Parametric Data Collection and Analysis of Patients with Head and Neck Cancer in the Comprehensive Cancer Centre of Ostrava – Role of Fractionation and Target Volume Definition in Radiotherapy
- What is the Prognostic Importance of Molecular Genetic Factors in Endometrial Carcinoma?
- Hepatocellular Carcinoma – Long-Term Treatable Disease
- Treatment For Volume Upgrading of the Low-Grade Supratentorial Glioma After the Subtotal Neurosurgical Resection
- Comparision of Histological Types of Primary and Subsequent Relapsing Basal Cell Carcinomas of the Skin
- Paratesticular Mesothelioma in Young Age. Case Report
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hepatocellular Carcinoma – Long-Term Treatable Disease
- Treatment For Volume Upgrading of the Low-Grade Supratentorial Glioma After the Subtotal Neurosurgical Resection
- EGFR Mutations in Patients with Advanced NSCLC
- CT Colonography – Evolution of Methodology and Indications
