Vyšetření párů těžkých/ lehkých řetězců imunoglobulinu (Hevylite™ assay) – přínos pro stratifikaci mnohočetného myelomu?
Assessment of Heavy/ Light Chain Pairs of Immunoglobulin (Hevylite™ assay) – Benefit for Stratification of Multiple Myeloma?
Background:
The aim of the study was the comparison of two novel stratification models in multiple myeloma (MM), ie. according to Avet‑ Loiseau (A‑ L) and according to Ludwig (L), based on the HLC‑ r index (ratio of serum levels of involved‑ HLC/ uninvolved‑ HLC, ie. HLC‑ κ/ HLC‑ λ assessed using ie. nephelometric/turbidimetric technique using specific polyclonal antibodies on a Binding Site SPAPLUS) technique) and β2‑ microglobulin (β2‑ M) with selected prognostic factors (PF) of MM and staging systems according to Durie‑ Salmon (D‑ S) and International Staging System (ISS).
Patients and Methods:
In a cohort of 132 patients (94 with IgG and 38 with IgA type of MM) at the time of diagnosis, we assessed HLC‑ r, selected PF and D‑ S, ISS, A‑ L and L stratification systems.
Results:
Unlike in IgA isotype, in IgG isotype we found a significant relationship of HLC‑ r to stratification according to D‑ S and ISS with the difference between A and B substages according to D‑ S (p = 0.049) and between ISS stages 1 vs. 3 (p = 0.001). In the IgG group, there was highly significant relationship of the depth of Hb and albumin decrease and β2‑ M increase to the results of stratification according to ISS, A‑ L and L model (p < 0.0001), increase of LDH in the ISS system and A‑ L, and creatinine according to ISS and L but not the relationship of the stages according to any of the stratification systems to the values of FLC‑ r (ratio of serum free light chains κ/ λ of immunoglobulin), thrombocytes and Ca. In the IgA type, there was a significant relationship of the depth of the decrease of Hb, thrombocytes, albumin and increase of β2‑ M to the results of stratification according to ISS, A‑ L and L and increase of creatinine in the case of ISS, but not of the values of FLC‑ r, Ca and LDH in the case of any of the stratification systems. The degree of correlation of selected PF, especially of Hb, albumin and β2‑ M, event. of thrombocytes, LDH and creatinine to the stages according to ISS and to stage 1–3 according to A‑ L and L model was in IgG vs IgA isotype significantly different (p < 0.0001– 0.030). Staging system according to ISS had proportional distribution of stages 1– 3, whereas in the A‑ L model prevailed in IgA and IgG isotype risk category 2, ie. intermediate-risk (47.3 and 44.7%) and in the L model prevailed risk category 3, ie. high‑risk (41.5 and 52.6%) with low count of category 1, ie. low‑ risk category (23.4 and 10.5%). McNemar‑ Bowker test of symmetry showed in both types of MM the highest concordance between the stratification according to D‑ S and L in category 3, ie. high‑risk (31.9 vs. 28.9%) with overall accord only in 53.2 and 42.1% and with significant shift in the case of IgG isotype only (p = 0.036). In IgG and IgA isotype there was an overall concordance in the distribution of categories 1– 3 according to ISS vs. A‑ L (62.4 and 63.2%) but with significant shift of the stratification (p = 0.002 and 0.028). In the case of IgG and IgA isotype there was a close relationship between the models A‑ L and L (64.5 and 81.6%) with significant stratification shift (p < 0.0001 and 0.030).
Conclusion:
The new stratification models for MM according to A‑ L and L are easily practically applicable, with close relationship to principal PF but they need separate assessment of IgG and IgA isotypes of MM. The choice of optimal model for routine practice needs a validation study aimed at progression free survival and overall survival.
Key words:
multiple myeloma – immunoglobulin – free light chain – heavy/light chain – prognosis – stratification
This study was supported by Internal Grant Agency of the Czech Ministry of Health NT/12451-5.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
16. 6. 2015
Accepted:
25. 6. 2015
Authors:
V. Ščudla 1; P. Lochaman 2; T. Pika 3; J. Zapletalová 4; J. Minařík 3; J. Bačovský 3
Authors‘ workplace:
III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
1; Oddělení klinické biochemie, FN Olomouc
2; Hemato‑ onkologická klinika LF UP a FN Olomouc
3; Ústav lékařské biofyziky, LF UP v Olomouci
4
Published in:
Klin Onkol 2015; 28(5): 359-369
Category:
Original Articles
doi:
https://doi.org/10.14735/amko2015359
Overview
Východiska:
Cílem bylo srovnání dvou nových stratifikačních modelů mnohočetného myelomu (multiple myeloma – MM), tj. podle Avet‑ Loisiaua (A‑ L) a podle Ludwiga (L) založených na indexu HLC‑ r (poměr sérových hladin involved‑ HLC/ uninvolved‑ HLC tj. HLC‑ κ/ HLC‑ λ vyšetřených metodou Hevylite™, tj. nefelometrickou/turbidimetrickou technikou s pomocí specifických polyklonálních protilátek na přístroji Binding Site SPAPLUS) a β2‑ mikroglobulinu (β2‑ M) s vybranými prognostickými faktory (PF) MM a stážovacími systémy dle Durieho‑ Salmona (D‑ S) a International Staging System (ISS).
Soubor pacientů a metody:
V 132členné sestavě nemocných (94 IgG a 38 IgA typ MM) byl vyšetřen při diagnóze HLC‑ r, vybrané PF a byla provedena stratifikace souboru podle D‑ S, ISS, A‑ L a L.
Výsledky:
Na rozdíl od IgA byl u IgG izotypu zjištěn signifikantní vztah HLC‑ r k stratifikaci dle D‑ S a ISS s rozdílností podstadií A vs. B dle D‑ S (p = 0,049) a mezi ISS stadii 1 vs. 3 (p = 0,001). V souboru IgG byl vysoce signifikantní souhrnný vztah hloubky poklesu Hb i albuminu a vzestupu β2‑ M k výsledkům stratifikace dle ISS, A‑ L a L modelu (p < 0,0001), vzestupu LDH v systému dle ISS a A‑ L a kreatininu dle ISS a L, nikoliv ale vztah stadií vyhodnocených podle kteréhokoliv stratifikačního systému k hodnotám FLC‑ r (poměr volných lehkých řetězců imunonoglobulinu κ/ λ), trombocytů a Ca. V souboru IgA byl signifikantní souhrnný vztah hloubky poklesu Hb, trombocytů, albuminu a vzestupu β2‑ M k výsledkům stratifikace dle ISS, A‑ L a L, k vzestupu kreatininu v případě ISS, nikoliv ale hodnot FLC‑ r, Ca a LDH při použití kteréhokoliv stratifikačního modelu. Stupeň korelace vybraných PF, zejména Hb, albuminu a β2‑ M, případně i trombocytů, LDH a kreatininu ke stadiím dle ISS a k 1.– 3. rizikové kategorii podle modelu A‑ L a L byl u IgG vs. IgA izotypu značně proměnlivě rozdílný (p < 0,0001– 0,030). Stážovací systém dle ISS se vyznačoval proporcionálním zastoupením stadií 1– 3, zatímco v A‑ L modelu převažovala u IgG i IgA izotypu riziková kategorie 2, tj. intermediate risk (47,3 a 44,7 %) a v modelu dle L riziková kategorie 3, tj. high‑risk (41,5 a 52,6 %) s nízkým zastoupením kategorie 1, tj. low‑ risk (23,4 a 10,5 %). McNemar‑ Bowkerův test symetrie prokázal v obou izotypech MM nejvyšší shodu mezi stratifikací dle D‑ S a L v kategorii 3, tj. high‑risk (31,9 a 28,9 %) s celkovou shodou pouze v 53,2 a 42,1 % a se signifikantním posunem v případě IgG izotypu (p = 0,036). U IgG i IgA izotypu byla souhrnná shoda v zastoupení kategorií 1– 3 dle ISS vs. A‑ L (62,4 a 63,2 %), ale se signifikantním posunem stratifikace (p = 0,002 a 0,028). V případě IgG i IgA izotypu byla úzká shoda mezi modely dle A‑ L a L (64,5 a 81,6 %) se signifikantně významným vzájemným stratifikačním posunem (p < 0,0001 a 0,030).
Závěr:
Nové stratifikační modely MM dle A‑ L a L jsou snadno prakticky použitelné, podložené úzkým vztahem k stěžejním PF MM, vyžadují ale separátní hodnocení u IgG a IgA izotypu MM. Výběr optimálního modelu pro potřeby klinické praxe vyžaduje validační studii zaměřenou na přežití do progrese a celkové přežívání.
Klíčová slova:
mnohočetný myelom – volné lehké řetězce imunoglobulinu – těžké/lehké řetězce imunoglobulinu – prognóza – stratifikace
Úvod
Pokroky v diagnostice a léčbě mnohočetného myelomu (multiple myeloma – MM) přinášejí stále vyšší nároky na precizní stratifikaci, stěžejní východisko individuálně pojaté léčby a odhadu prognózy. Charakteristickým rysem MM je tvorba monoklonálního imunoglobulinu (MIg) myelomovými/ monoklonálními plazmocyty provázená sníženou produkcí normálních/ polyklonálních imunoglobulinů (PIg) normálními plazmocyty [1,2]. Vzhledem k závažným limitacím standardních metod analýzy sérových bílkovin u MM v případě nízké hladiny MIg, IgA izotypu MIg, při změnách objemu plazmy, hematokritu a v důsledku odlišné intenzity katabolizmu jednotlivých tříd Ig byla vyvinuta technika Hevylite™ umožňující s pomocí specifických protilátek proti junkčním epitopům umístěným mezi těžkým a lehkým řetězcem Ig vyšetření párů těžkých/ lehkých řetězců Ig κ a λ (HLC‑ κ a HLC‑ λ) [3– 9]. Hevylite™ turbidimetrická nebo nefelometrická technika umožňuje současné separátní stanovení sérových hladin MIg vytvářeného myelomovými plazmocyty („nádorový“, involved HLC – i‑ HLC) a PIg („polyklonální/ normální“, uninvolved HLC – u‑ HLC) stejné třídy produkovaného normálními plazmocyty. Vedle současného stanovení i‑ HLC a u‑ HLC izotypů IgG‑ κ, IgG‑λ nebo IgA‑ κ a IgA‑λ je v případě MM využíváno rovněž stanovení indexu HLC‑ r vyjadřujícího vzájemný poměr dominantního i‑ HLC a alternativního u‑ HLC [3,4]. Na rozdíl od dosavadních studií využívajících ke stanovení HLC‑ r vždy poměr HLC‑ κ/ HLC‑ λ, což vede v případě i‑ HLC typu λ k získání velmi nízkých a obtížně interpretovatelných hodnot [3,6], byl v naší studii v případě analýzy vztahu vybraných prognostických ukazatelů MM k výsledkům stratifikace myelomu (kategorie 1– 3) použit pro výpočet indexu HLC‑ r v případě izotypu IgG‑ λ a IgA‑ λ poměr HLC‑ λ/ HLC‑ κ, tj. obdobný princip jako pro výpočet indexu monoklonality sFLC κ/ λ nebo λ/ κ [1,3,4] vedoucí k získání kladných, snadno použitelných hodnot. V posledních čtyřech desetiletích bylo zkoncipováno > 40 stratifikačních systémů rozdělujících nemocné s MM obvykle do tří stadií nebo rizikových skupin s odlišnou prognózou. Standardní stratifikační systémy dle Durieho‑ Salmona (D‑ S) a International Staging System (ISS) používané doposud v klinické praxi nejsou optimální, neboť bezprostředně nevyjadřují biologické vlastnosti myelomových buněk a mikroprostředí kostní dřeně (KD) [2,10], zatímco molekulárně‑biologické stratifikační modely založené na cytogenetické analýze a hodnotách cyklinu, tj. systém TC 1– 5 [11], a na výsledcích genové expresní analýzy [12] se pro vysokou metodickou náročnost v klinické praxi neprosadily. V roce 2009 Avet‑ Loisiau (A‑ L) a v roce 2013 Ludwig (L) zkoncipovali nově pojaté třístupňové stratifikační modely založené na hodnotách β2‑ M (β2‑ mikroglobulin) a indexu HLC‑ r, vyznačující se v pilotních studiích významným vztahem k přežití bez progrese (progression free survival – PFS) a celkovému přežití (overall survival – OS) [13– 15].
Náplní sdělení je posouzení vztahu stratifikačních modelů dle A‑ L a podle Lke klasickým prognostickým faktorům (PF) MM a ke stážovacím systémům dle D‑ S a ISS [2,10,13– 16]. Vzhledem k biologické rozdílnosti IgG a IgA izotypu MM, prokázané mj. i v rámci předchozích Hevylite™ studií, byla použita separátní analýza souborů s IgG a IgA izotypem MM [3,17– 21].
Soubor nemocných a metody
Základem prospektivní studie byla 163členná sestava nemocných s MM splňujících diagnostická kritéria International Myeloma Working Group (IMWG); medián věku byl 68 (29– 89) let, poměr M/ Ž 0,91 [2,10,22]. Pro nepřítomnost intaktní molekuly MIg (Bence‑ Jonesův a nesekreční typ MM) a omezené spektrum specifických Hevylite™ souprav (nikoliv pro IgD a biklonální typ MM) bylo z analýzy vyloučeno 31 (19 %) jedinců. Hevylite™ analýza sér zmražených na – 78 °C, deponovaných v biobance Oddělení klinické biochemie a Hemato‑ onkologické kliniky FN Olomouc, se zaměřila na 132členný soubor složený z 94 nemocných třídy IgG (71,2 %) a 38 nemocných (28,8 %) třídy IgA (poměr κ/ λ 1,9) vyšetřených při diagnóze MM. Koncentrace MIg byla vyšetřena přístrojem Sebia Hydrasy (souprava Sebia Hydragel 30 Protein) s kvantifikací M‑ gradientu s pomocí skeneru Epson 1680, IFE byla prováděna soupravou Hydragel 4 IF.Hladiny volných lehkých řetězců (FLC) v séru byly vyšetřeny soupravami Freelite SPA Plus κ free (normální rozmezí 3,3– 19,4 mg/ l) a Freelite SPA Plus λ free (5,7– 26,3 mg/ l) a vyšetření bylo doplněné výpočtem indexu monoklonality FLC‑ r (0,26– 1,65) [3,4]. Koncentrace HLC v séru byla vyšetřena turbidimetrem SPA Plus (the Binding Site) soupravami Hevylite Human s hodnotami normálního rozmezí: IgG‑ κ 3,84– 12,07 g/ l, IgG‑ λ 1,91– 6,74 g/ l, poměr IgG‑ κ/ IgG‑ λ 1,12– 3,21, IgA‑ κ 0,57– 2,08 g/ l, IgA‑ λ 0,44– 2,04 g/ l a poměr IgA‑ κ/ IgA‑ λ 0,78– 1,98. Část vzorků vyžadovala vzhledem k vysoké koncentraci HLC převyšující měřicí rozsah přístroje manuální předředění. Sérové hladiny β2‑ M byly vyšetřeny metodou ELISA (< 2,3 mg/ l), hodnoty Hb a trombocytů v krvi, Ca, albuminu, kreatininu a LDH v séru byly vyšetřeny standardními postupy. K základní stratifikaci MM byl použit stážovací systém dle D‑ S a ISS [2,22], ke stratifikaci do rizikových skupin byly použity modely dle A‑ L a L. Dle A‑ L se vyznačovala riziková skupina 1 (low‑ risk) přítomností β2‑ M < 3,5 a hodnotou HLC‑ r v rozmezí 0,01– 200, skupina 2 (intermediate-risk) buď hodnotou β2‑ M ≥ 3,5, nebo HLC‑ r < 0,01 nebo > 200 a skupina 3 (high‑risk) současnou přítomností hodnoty β2‑ M ≥ 3,5 a HLC‑ r < 0,01 nebo > 200 [13,14,16]. Ve stratifikačním modelu MM dle L se vyznačovala riziková skupina 1 (low‑ risk) přítomností hodnoty β2‑ M < 3,5 a HLC‑ r v rozmezí 0,022– 45, riziková kategorie 2 (intermediate-risk) hodnotou β2‑ M ≥ 3,5 nebo HLC‑ r < 0,022 nebo > 45, zatímco riziková kategorie 3 (high‑risk) současnou přítomností hodnot β2‑ M ≥ 3,5 a HLC‑ r << 0,022 nebo > 45 [15]. Nemocní zařazení do studie podepsali informovaný souhlas, design studie byl schválen etickou komisí FN Olomouc.
Získaná data byla analyzována pomocí statistického software SPSS verze 15(SPSS Inc., Chicago, USA). K analýze byl použit test dle Kruskala‑ Wallise, Mann‑ Whitneyův post hoc test s Bonferroniho korekcí signifikance na mnohonásobné porovnávání a McNemarův‑ Bowkerův test symetrie. Normalita dat byla posouzena pomocí Shapiro‑Wilk testu. Všechny testy byly prováděny na hladině signifikance 0,05.
Výsledky
Základní charakteristiky (mediány a rozmezí analyzovaných hodnot) celého 132členného souboru nemocných s MM a dvou podsouborů IgG a IgA jsou shrnuty v tab. 1. Abnormální hodnoty jednotlivých laboratorních parametrů měly v celkové sestavě MM podstatně rozdílné zastoupení: patologické hodnoty indexu HLC‑ r 98 % a FLC‑ r 96,2 % souboru, hodnota Hb < 120 g/ l 80,3 % a trombocytů < 150 × 109/ l pouze 19,6 %, hodnota Ca > 2,9 mmol/ l 7,5 %, albuminu < 35 g/ l 47,7 %, β2‑ M > 2,3 mg/ l 81 %, LDH > 3,6 µkat/ l 16,6 % a kreatininu séra > 104 µmol/ l 39,3 %. Rozbor vztahu mezi abnormální hodnotou indexu xHLC‑ r a stupněm pokročilosti MM vyhodnoceném s pomocí stážovacího systému dle D‑ S a ISS v souboru IgG prokázal na rozdíl od souboru IgA zvyšování hodnot mediánů xHLC‑ r s pokročilostí nemoci, statistická analýza proto vyzněla u obou izotypů MM zřetelně rozdílně. V IgG souboru byla na rozdíl od souboru IgA zjištěna při souhrnné analýze celé stratifikace metodou dle Kruskala‑ Wallise statisticky významná rozdílnost hodnot xHLC‑ r (tab. 2). Hlubší analýza s pomocí U testu dle Mann‑ Whitneye prokázala signifikantně vyšší hodnoty xHLC‑ r v podstadiu B vs. A (dle D‑ S) a při použití stratifikace dle ISS ve stadiu 3 nežli stadiu 1.
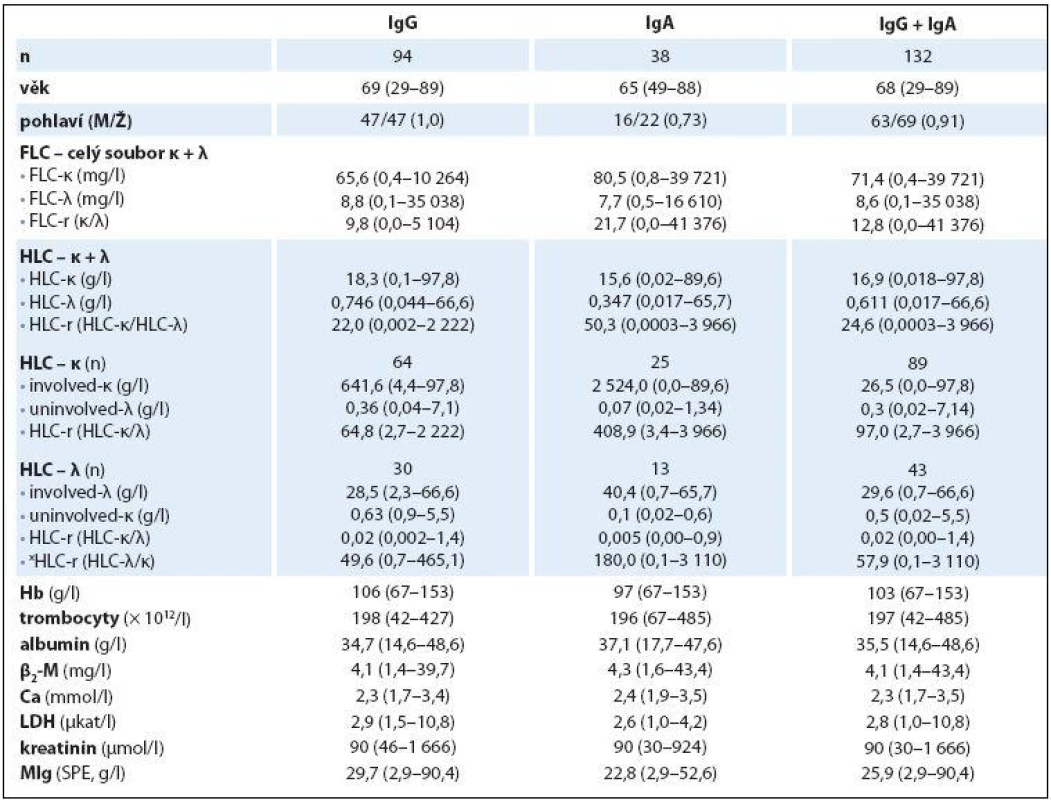
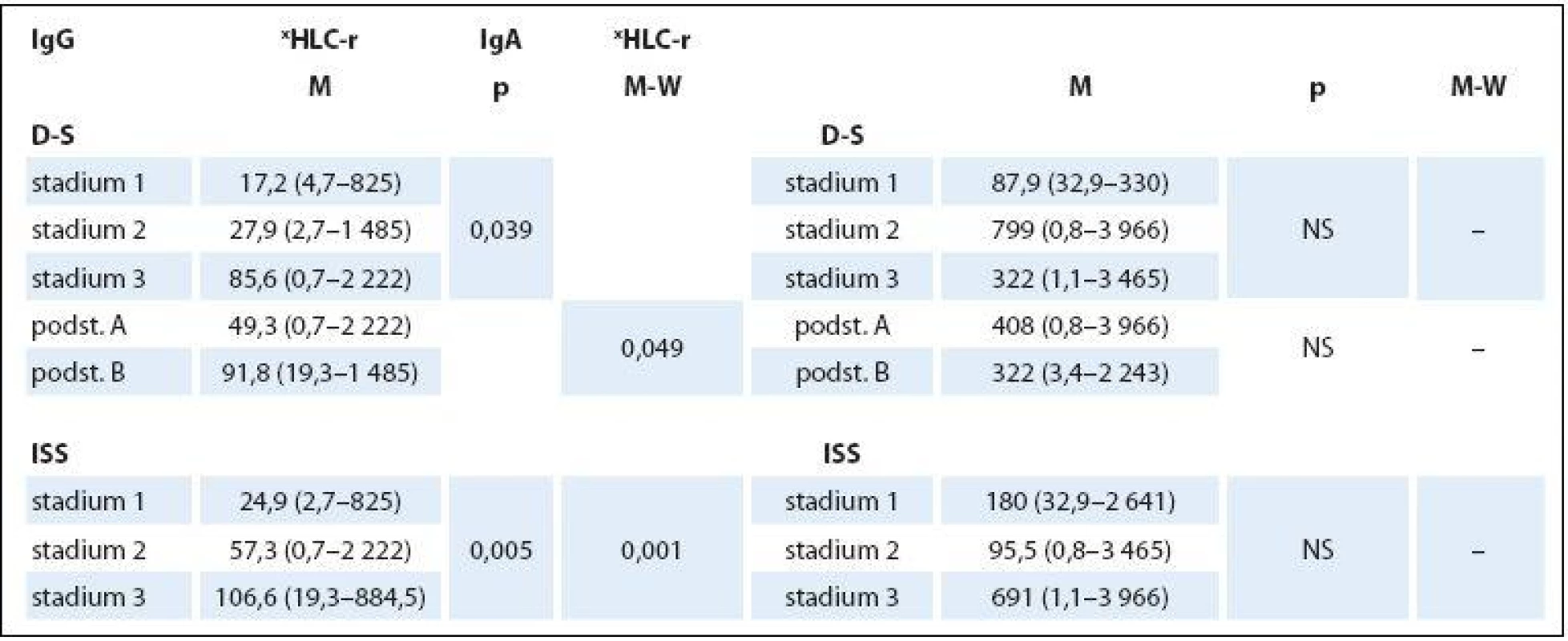
Analýza vztahu hodnot vybraných laboratorních PF k rizikovým skupinám MM 1– 3 vyhodnocených s pomocí stratifikačního modelu dle A‑ L, podle L a se standardně zavedeným stážovacím systémem dle ISS prokázala u jednotlivých PF, stratifikačních systémů a izotypů MM rozdílné výsledky (tab. 3). V souboru IgG byla zjištěna při souborné analýze rizikových skupin 1– 3 s pomocí testu dle Kruskala‑ Wallise shodně u všech tří stratifikací (ISS, A‑ L a L) vysoce signifikantní rozdílnost hodnot Hb, albuminu a β2‑ M (< 0,0001), signifikantní rozdílnost hodnot LDH při použití systému dle ISS a A‑ L a kreatininu v případě ISS a L. Vyhodnocení indexu monoklonality FLC‑ r, počtu trombocytů a hodnot Ca v séru vyznělo nesignifikantně. Hlubší analýza IgG souboru s použitím U post hoc testu dle Mann‑ Whitneye prokázala různě výraznou signifikantní rozdílnost hodnot Hb mezi všemi stadii (1, 2 a 3) při použití stratifikačního modelu dle ISS, A‑ L a L a s výjimkou stadií 2 vs. 3 i v případě β2‑ M. V případě kreatininu byly významně odlišné hodnoty ve všech stadiích dle ISS, nikoliv ale mezi rizikovými skupinami 2 vs. 3 dle A‑ L a L. V případě albuminu nebyla v případě stratifikace dle ISS a A‑ L signifikantní rozdílnost mezi kategoriemi 2 vs. 3, v případě modelu dle L mezi 1 vs. 2. Na rozdíl od stratifikace dle A‑ L a L byl zaznamenán významný rozdíl hladin LDH mezi stadii 2 vs. 1 a vs. 3 v případě stážování dle ISS, nikoliv ale při vyhodnocení počtu krevních destiček (tab. 4). V souboru IgA byla zjištěna při souborné analýze všech tří stadií/ rizikových skupin s pomocí testu dle Kruskala‑ Wallise s použitím stratifikace dle ISS, A‑ L a L signifikantní rozdílnost hodnot Hb, trombocytů, albuminu a β2‑ M a v případě ISS i kreatininu, zatímco hodnocení FLC‑ r, Ca a LDH vyznělo ve všech stratifikacích nevýznamně (tab. 5). Hlubší analýza souboru IgA s použitím U post hoc testu dle Mann‑ Whit-neye prokázala signifikantně nižší hodnoty Hb při použití ISS stratifikace pouze mezi stadii 1 vs. 3, zatímco v případě aplikace modelu dle A‑ L v rizikových skupinách 2 a 3 vs. 1, v modelu dle L nižší hodnoty Hb v rizikové skupině 3 vs. 1 i 2 (tab. 6). V případě β2‑ M byla rozdílnost hladin s výjimkou rizikových kategorií 2 vs. 3 dle A‑ L signifikantní mezi všemi kategoriemi dle ISS, A‑ L a L. V případě počtu krevních destiček a hladiny albuminu byly patrny signifikantně nižší hodnoty v kategoriích 3 vs. 1 dle ISS i A‑ L a 3 vs. 2 dle L, v případě albuminu navíc i ve stadiu 2 vs. 1 dle ISS a trombocytů ve stadiu 3 vs. 2 dle A‑ L. V případě kreatininu byla odhalena signifikantně vyšší hodnota ve stadiu 3 vs. 2 a vs. 1 dle ISS. V případě hladin FLC‑ r, Ca a LDH nebyl zaznamenán v IgA souboru mezi dílčími kategoriemi 1– 3 vyčleněnými podle ISS, A‑ L a L žádný signifikantní vztah. Doplňková analýza věnovaná stážovacímu systému dle D‑ S prokázala v souboru IgG s pomocí Mann‑ Whitneyho testu signifikantně vyšší hodnoty Hb, albuminu a β2‑ M ve stadiích 3 vs. 1 a vs. 2 s absencí rozdílnosti FLC‑ r, trombocytů, Ca, LDH a kreatininu (tab. 4). V souboru IgA byly shledány s pomocí Mann‑ Whitneyho testu v případě stratifikace dle D‑ S signifikantně vyšší hodnoty Hb a nižší β2‑ M ve stadiu 1 vs. 2 i 3 a nižší hodnoty albuminu ve stadiu 3 vs. 1, zatímco v případě FLC‑ r, trombocytů, Ca, LDH a kreatininu nebyly signifikantně významné rozdíly zachyceny (tab. 6).
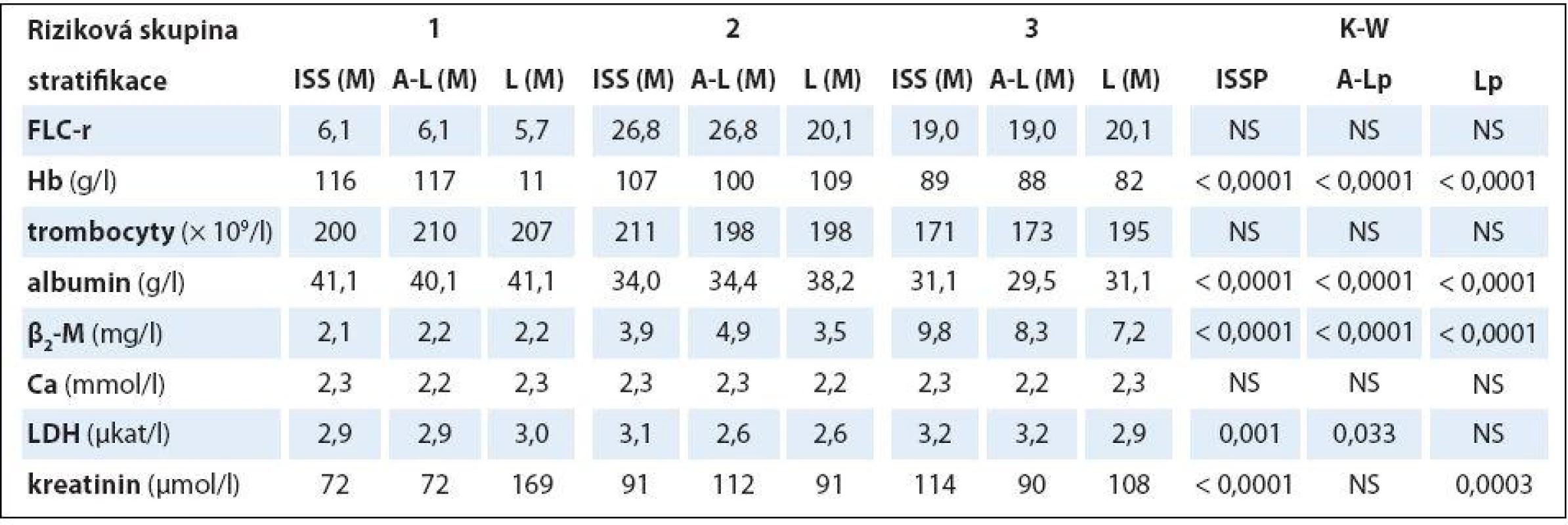
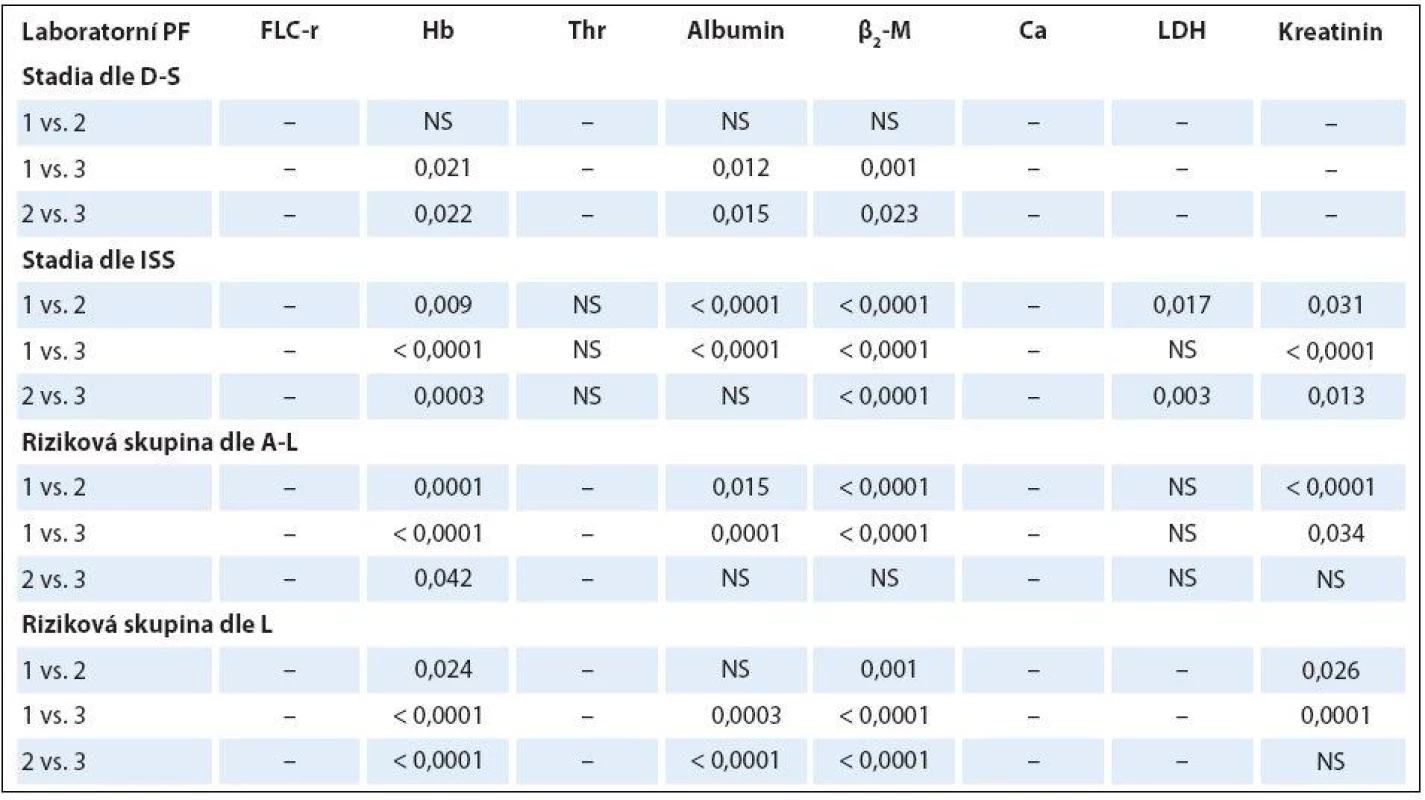
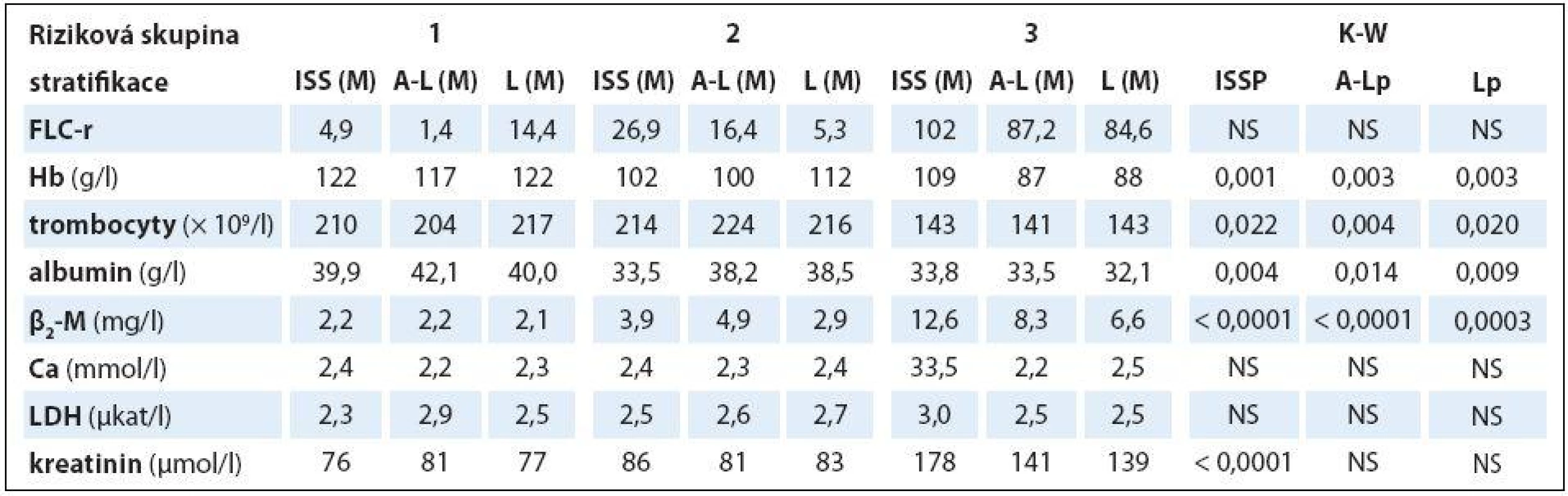
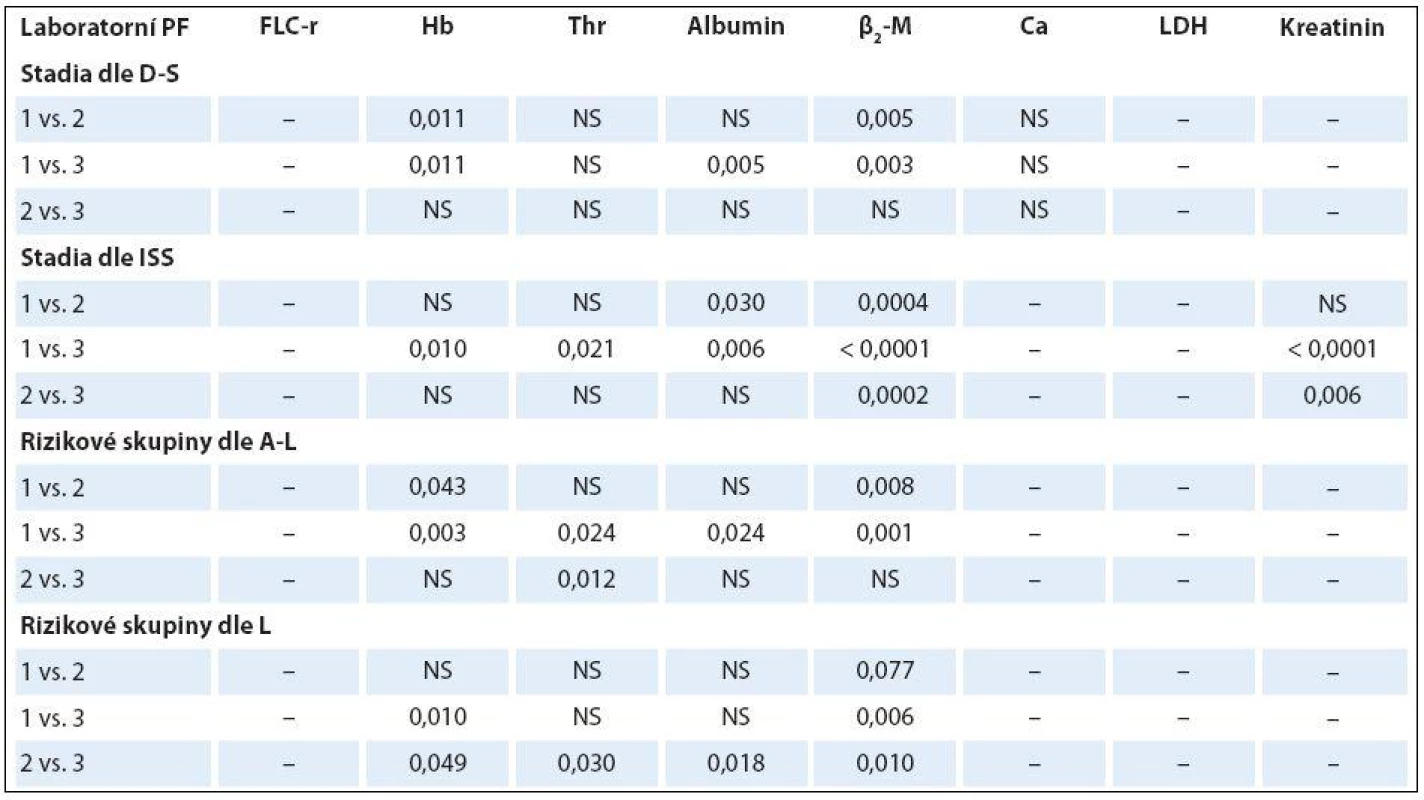
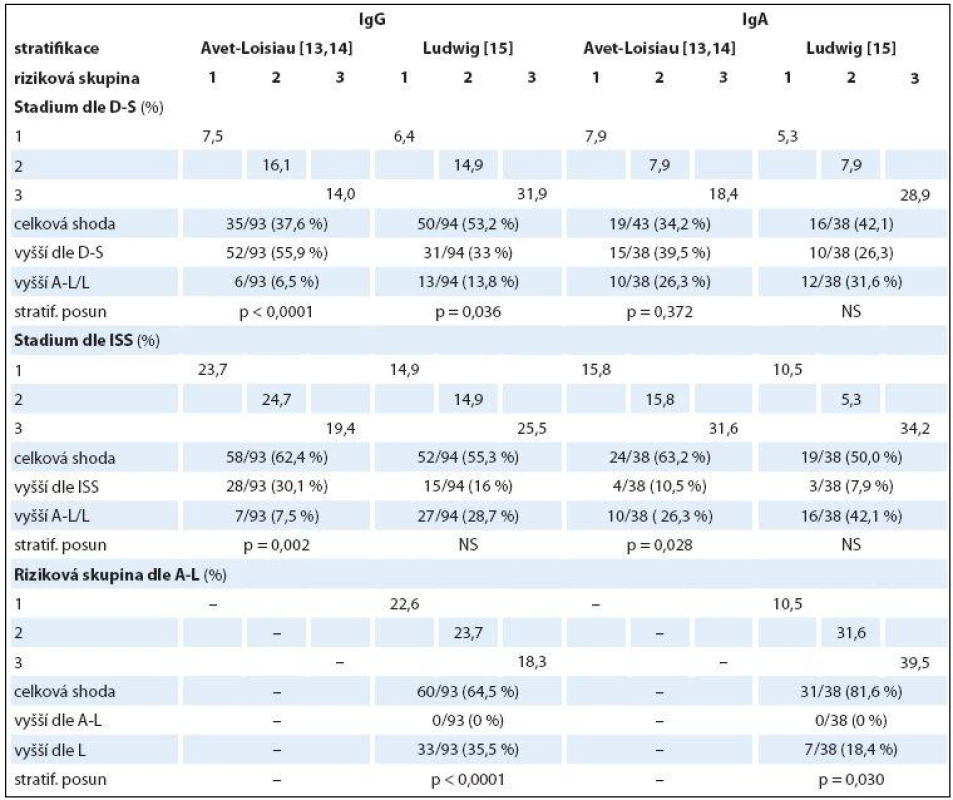
Rozdílné zastoupení klinických stadií 1– 3 vyhodnocených s pomocí stážovacích systémů dle D‑ S a ISS a rizikových skupin vyčleněných s pomocí modelů dle A‑ L a podle L v souborech IgG a IgA vyplývá z grafu 1. Výsledky srovnávací analýzy stratifikace IgG a IgA souborů MM provedené s pomocí McNemar‑ Bowkerova testu symetrie jsou zachyceny v tab. 7. Srovnáním stratifikačního modelu dle A‑ L se standardním stážováním dle D‑ S byla u IgG a IgA typu MM zaznamenána klasifikační shoda v 37,6 a 34,2 %, s ISS v 62,4 a 63,2 % a s modelem dle L v 64,5 a 81,6 %, zatímco v případě stratifikačního modelu dle L s D‑ S systémem v 53,2 a 42,1 %, s ISS v 55,3 a 50,0 %. Posun do vyššího stadia byl při srovnání stratifikačního modelu dle A‑ L se stážováním dle D‑ S v IgG a IgA souboru MM zaznamenán pouze v 6,5 a 26,3 %, s ISS v 7,5 a 26,3 % a s modelem dle L u žádného nemocného, zatímco v případě modelu dle L vůči D‑ S v 13,8 a 31,6 % oproti ISS v 28,7 a 42,1 % a vůči A‑ L v 35,5 %. Z tabelárního přehledu (tab. 7) jednoznačně vyplývá, že posun do vyššího stadia byl zaznamenán u IgG a IgA typu MM v případě srovnání systémů D‑ S vs. A‑ L (55,9 a 26,3 %) a ISS (30,1 a 10,5 %), systému dle L vs. D‑ S (33 a 26,3 %) a ISS (16 a 7,9 %). Stratifikační posun byl statisticky vysoce významný v případě IgG typu MM při srovnání systému dle D‑ S i ISS oproti modelu dle A‑ L a méně významně D‑ S vůči modelu dle L, zato stratifikační posun systémů dle ISS vs. L byl nesignifikantní. Stratifikační posun do vyššího stadia zjištěný v případě modelu dle L oproti modelu dle A‑ L lišících se navzájem odlišnými hodnotami cut-offHLC‑ r (< 0,022 nebo > 45 vs. < 0,01 nebo > 200) byl vysoce signifikantní v případě IgG (p < 0,0001), méně významný u IgA typu MM (p = 0,030) (tab. 7).

Diskuze
Index HLC‑ r vyšetřený pomocí metody Hevylite™ je ve srovnání s hodnotou MIg stanovenou s pomocí elektroforézy séra (SPE) neinvazivním, i když nepřímým ukazatelem výskytu myelomových (monoklonálních) vs. reziduálních normálních (polyklonálních) plazmocytů v KD [3,4]. Vzhledem k eliminaci zkreslení hodnot MIg a albuminu v důsledku změn krevního objemu a hematokritu i variability katabolického poločasu MIg závislého na saturaci neonatálních FcRn je Hevylite™ taktéž citlivější metodou v hodnocení rozsahu nádorové masy nežli SPE [3,4,16,19,20,22– 26]. Izotypově specifická suprese PIg (u‑ HLC) nasvědčuje, že v případě IgG izotypu MM „niche“ mikroprostředí KD je selektivně postiženo v důsledku proliferace myelomových buněk secernujících především IgG typ paraproteinu [16]. Statisticky signifikantní, obecně platný vztah výše indexu xHLC‑ r k stadiím a s rozdílností v podstadiích A vs. B dle D‑ S a stadií 1– 3 dle ISS u IgG, nikoliv u IgA typu MM nasvědčuje platnosti vztahu výše indexu xHLC‑ r k pokročilosti nemoci pouze u IgG izotypu MM. Signifikantní vztah xHLC‑ r u IgG, nikoliv u IgA typu MM k tíži anémie, hypoalbuminemie a k hladinám β2‑ M, byl zaznamenán již v naší předchozí studii [18]. U IgA typu MM se hodnoty indexu xHLC‑ r nechovaly v stadiích MM vyčleněných s pomocí D‑ S a ISS konzistentně zřejmě v důsledku biologické odlišnosti IgG a IgA izotypu MM, podložené odlišnou syntézou a katabolizmem obou Ig a albuminu v organizmu [16,27]. Molekuly FcRn ochraňují IgG Ig a albumin před digescí v důsledku interference s recyklací a uvolňováním z povrchu buněk zpět do krevní cirkulace, což vede k prodloužení poločasu života IgG. V případě funkční insuficience FcRn receptorů a/ nebo vysoké koncentrace IgG Ig může být poločas života IgG a albuminu zkrácen až na tři dny, zatímco v případě normální koncentrace IgG Ig v rámci úplné protekce FcRn poločas prodloužen až na cca 21 dnů a v případě velmi nízkých hladin IgG může dosáhnout poločas života v důsledku maximální FcRn protekce až několika týdnů [3,23– 25]. Vzhledem k tomu, že polyklonální i monoklonální frakce IgG jsou těmito ději postiženy obdobně, nejsou hodnoty HLC‑ r podstatně ovlivněny a vyjadřují stupeň nádorové produkce přesněji nežli koncentrace M‑ proteinu vyšetřená SPE [16]. Vzhledem k tomu, že β2‑ M je jednou z komponent lehkého řetězce heterodimerické FcRn, je i jeho molekula ovlivněna v procesu recyklace [3,23– 26]. Biologická variabilita IgG a IgA izotypu Ig byla potvrzena výsledky prognosticky zaměřené studie L prokazující signifikantně významněji spojení mezi supresí u‑ HLC a délkou OS u IgG nežli u IgA typu MM [19]. Biologickou odlišnost IgG a IgA izotopu HLC demonstruje rovněž prediktivní role zvýšené hodnoty indexu HLC‑ r k rozvoji maligní transformace MGUS, určená především supresí u‑ HLC opačného typu (např. supresí IgG‑ λ u IgG‑ κ typu MGUS), validní pro IgG, nikoliv pro IgA typ MGUS [28]. Absence predikčního potenciálu u IgA typu MGUS je zřejmě determinována absencí „niche“ efektu specifického pouze pro IgG typ MGUS [28]. Východiskem využití HLC‑ r jako jednoho z kritérií nově navržených stratifikačních modelů dle A‑ L a L je zřejmě jeho role markeru imunoparézy s prokázaným vztahem k PFS a OS [3,16,19,29,30]. S pomocí multivariantní Coxovy regresní analýzy bylo zjištěno, že hodnoty HLC‑ r a β2‑ M mají ve srovnání s albuminem, FLC‑ r a cytogenetickými nálezy typu del 13,t(4;14) a del 17p signifikantně významnější vztah k prognóze MM [14,16]. Vzhledem k tomu, že index HLC‑ r je prediktorem kratší délky PFS na albuminu a β2‑ M, byl použit jako jedno z kritérií u obou nových stratifikačních modelů [3,13,14,16,31].
Nově sestavený stratifikační model vypracovaný A‑ L [13,14], alternativní k ISS stážovacímu systému a vyznačující se záměnou albuminu za index HLC‑ r se ve studii Bradwella [16], a to zejména v kategorii high‑risk, projevil prognosticky podstatně silnějším vztahem k PFS [16,32,33]. Dokladem obecné vhodnosti indexu HLC‑ r pro prognostickou stratifikaci MG je rovněž jeho uplatnění spolu s β2‑ M a LDH v třístupňové stratifikaci Waldenströmovy choroby [34,35]. Chybějící signifikance vztahu hodnot indexu FLC‑ r ke stadiím dle D‑ S a ISS a zejména k rizikovým skupinám MM vyhodnoceným dle A‑ L a L založených na hodnotě indexu HLC‑ r vyplývá z odlišného metabolizmu a kinetiky FLC a HLC, a tím i indexů FLC‑ r a HLC‑ r, [15] a z diferentních biologických charakteristik FLC‑ κ a FLC‑ λ vyznačujících se odlišným syntetickým i katabolickým poločasem, vedoucím k rozdílnosti jejich přirozených sérových hladin [3,4]. Přestože s narůstající „rizikovostí“ kategorií MM vyhodnocenou podle A‑ L a L byla v naší analýze IgG a IgA izotypu zřejmá tendence k vzestupu hodnot indexu FLC‑ r, nedosáhla statistické signifikance.
Dokladem obecně platného biologického zázemí A‑ L a L stratifikace k rizikovosti MM je většinou signifikantně vyjádřený vztah rizikových kategorií (low‑ , intermediate‑ a high‑risk) k laboratorním PF vyznačujícím se úzkým vztahem k náloži nádorové masy, tj. Hb, albuminu a kreatininu u IgG a poněkud méně významně se totéž týká Hb, trombocytů a albuminu v méně početném souboru s IgA izotypem MM. Převážně nesignifikantní vztah Ca a LDH, případně i trombocytů u IgG izotypu je vysvětlitelný nejen jejich přirozeně nižším prognostickým potenciálem, ale i nízkým zastoupením abnormálních hodnot v analyzované sestavě (7,5, 16,6 a 16,6 %), relativizující dosažené výsledky. Vysoká signifikance mezi hladinou β2‑ M a rizikovými skupinami dle A‑ L a L v IgG a IgA souborech MM je logická a vyplývá z okolnosti, že jde o jedno z kritérií obou stratifikačních modelů. Naše zjištění, že oba stratifikační modely založené na indexu HLC‑ r významně rezonují s klíčovými PF MM (Hb, albumin a kreatinin), je do značné míry kompatibilní se závěry jediné obdobně zkoncipované studie popisující signifikantní vztah vysokých, medián převyšujících hladin IgG, nikoliv IgA i‑ HLC k tíži anémie (Hb < 100 g/ l), k hodnotám FLC‑ r a albuminu převyšujícím vypočtený medián i > 50% infiltraci KD a v případě korelace s HLC‑ r i s hodnotou β2‑ M > 3,5 mg/ l [7].
Z porovnání výsledků stratifikace souborů s odlišným izotypem MIg, tj. IgG a IgA s pomocí standardních stážovacích systémů (D‑ S a ISS) a stratifikačních modelů založených na vyšetření HLC‑ r (A‑ L a L) vyplynula značná rozdílnost, patrná zejména v zastoupení stadií 1 a 3. Na rozdíl od vysoce proporciální stratifikace dle ISS s cca 30% zastoupením stadií 1– 3 se vyznačoval stážovací systém dle D‑ S dobře známou nerovnoměrností s malým zastoupením nemocných s nízkou (stadium 1) oproti nemocným s velkou nádorovou masou (stadium 3). Ve stratifikaci dle A‑ L převažovala u IgG i IgA izotypu riziková kategorie 2 (intermediate‑ risk), zatímco v modelu dle L dominovala kategorie 3 (high‑risk) s nízkým zastoupením kategorie 1 (low‑ risk).
S pomocí McNemar‑ Bowkerova testu byla zjištěna u IgG i IgA typu MM nejvyšší shoda mezi stratifikačními modely dle D‑ S a L v kategorii 3 (high‑risk). Nápadnější shoda v rozprostření všech stadií (1– 3), resp. rizikových kategorií (low‑ , intermediate‑ a high‑risk) byla zjištěna při srovnání stážování dle ISS se stratifikací dle A‑ L, v menší míře i podle L především v souboru IgG. Při srovnání výsledků stratifikace modelů založených na hodnocení HLC‑ r bylo zřejmé vyšší zastoupení kategorie 3 (high‑risk) v modelu dle L nežli podle A‑ L u IgG i IgA typu MM (42 vs. 18 % a 53 vs. 39 %). V obou izotypech MM, zejména ale u IgA typu, byla zjištěna nejužší celková shoda ze všech stratifikací mezi oběma novými modely, tj. podle A‑ L a L (IgG 64,5, IgA 81,6 %). Nutno připomenout, že kritéria rizikové skupiny 1 (low‑ risk) v stratifikačním modelu dle A‑ L i L se vyznačují hodnotou indexu HLC‑ r, blížící se hodnotám normálního rozmezí a zahrnující převážně nemocné s normální hladinou u‑ HLC, odpovídající dobrému zastoupení normálních/ polyklonálních plazmocytů a nízké hladině monoklonálního i‑ HLC jako výrazu relativně nízkého zastoupení monoklonálních/ myelomových buněk [36].
Závěr
Ze studie vyplývá, že oba nově sestavené stratifikační modely MM založené na stanovení poměru párů i‑ HLC/ u‑ HLC (HLC‑ κ/ HLC‑ λ) imunoglobulinu, tj. HLC‑ r, jsou snadno prakticky použitelné a podložené signifikantním vztahem ke stěžejním prognostickým ukazatelům MM. Určitým nedostatkem je doposud stále omezená dostupnost Hevylite™ metody v běžné klinické praxi a odlišnost výsledků zjištěná u IgG a IgA izotypu MM omezující jejich univerzální využití a vyvolávající potřebu separátní aplikace. K definitivnímu zhodnocení potenciálního přínosu a výběru jednoho z modelů, tj. podle A‑ L, nebo L pro klinickou praxi, je nezbytné vyčkání výsledku připravené validační studie zaměřené na ověření pilotně popsaného signifikantního vztahu A‑ L i L stratifikace k PFS a OS. Příznivou vlastností obou stratifikačních modelů je jejich nepochybná pružnost, umožňující průběžnou aktualizaci „rizikovosti“ nemocných v průběhu nemoci jako východiska případné změny aktuální léčby.
Práce byla podpořena IGA MZ ČR, NT/12451-5.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Vlastimil Ščudla, CSc.
III. interní klinika – nefrologická, revmatologická a endokrinologická
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: vlastimil.scudla@fnol.cz
Obdrženo: 16. 6. 2015
Přijato: 25. 6. 2015
Sources
1. Rajkumar SV, Dimopoulos MA, Palumbo A et al. International myeloma working group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15(12): e538– e548. doi: 10.1016/ S1470‑ 2045(14)70442‑ 5.
2. Hajek R, Adam Z, Scudla V et al. Guidelines of Czech Myeloma Group 2012: diagnosis and treatment of multiple myeloma. Transf Hematol 2012; 18: 5– 89.
3. Bradwell AR. Analysis of immunoglobulin heavy chain/ light chain pairs (HevyliteTM). In: Bradwell AR (ed.). Serum free light chain analysis (plus Hevylite). 6th ed. Birmingham: the Binding Site Ltd 2010: 301– 320.
4. Bradwell AR, Harding SJ, Fourrier NJ et al. Assessment of monoclonal gammopathies by nephelometric measurement of individual immunoglobulin κ/ λ ratios. Clin Chem 2009; 55(9): 1646– 1655. doi: 10.1373/ clinchem.2009.123828.
5. Keren DF. Heavy/ light‑chain analysis of monoclonal gammopathies. Clin Chem 2009; 55(9): 1606– 1608.
6. Katzmann JA, Kyle RA, Benson J et al. Screening panels for detection of monoclonal gammopathies. Clin Chem 2009; 55(8): 1517– 1522. doi: 10.1373/ clinchem.2009.126664.
7. Koulieris E, Panayiotidis P, Harding SJ et al. Ratio of involved/ unilvolved immunoglobulin quantification by HevyliteTM assay: clinical and prognostic impact in multiple myeloma. Exp Hematol Oncol 2012; 1: 9. Available from: http:/ / www.enhoonline.org/ content/ 1/ 1/ 9.
8. The Binding Site Group Ltd. Practical consideration of Hevylite immunoassays. In: The Binding Site Group Ltd. Serum free light chain analysis plus Hevylite. 7th ed. Birmingham: the Binding Site Ltd 2015: 95– 121.
9. Vavrova J. Assessment of free light chains and HevyliteTM in monoclonal gammopathies. In: Maisnar V, Tichy M (eds). Monoclonal immunoglobulins – occurrence, significance and possibilities of their detection. 1st ed. Praha: Nucleus Hradec Kralove 2012: 55– 60.
10. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121(5): 749– 757.
11. Bergsagel PL, Kuehl WM, Zhan F et al. Cyclin D dysregulation: an early and unifying pathogenetic event in multiple myeloma. Blood 2005; 106(1): 296– 303.
12. Shaughessy JD Jr, Zhan F, Burington BE et al. A validated gene expression model of high‑risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109(6): 2276– 2284.
13. Avet‑ Loiseau H, Harousseau JL, Moreau P et al. Heavy/ light chain specific immunoglobulin ratios at presentation are prognostic for progression free survival in the IFM 2005– 01 myeloma trial. Blood 2009; 114: 722: abstr. 1818.
14. Avet‑ Loiseau H, Mirbahai L,Harousseau JL et al. Serum immunoglobulin heavy/ light chain ratios are independent risk factors for predict progression free survival in multiple myeloma. Haematologica 2010; 95: 395.
15. Ludwig H, Milosavljevic D, Zojer N et al. Immunoglobulin heavy/ light chain ratios improve paraprotein detection and monitoring, identify residual disease and correlate with survival in multiple myeloma patients. Leukemia 2013; 27(1): 213– 219. doi: 10.1038/ leu.2012.197.
16. Bradwell AR, Harding S, Fourrier N et al. Prognostic utility of intact immunoglobulin Ig’kappa/ Ig’lambda ratios in multiple myeloma patients. Leukemia 2013; 27(1): 202– 207. doi: 10.1038/ leu.2012.159.
17. Ščudla V, Lochman P, Pika T et al. Analýza vztahu párů těžkých/ lehkých řetězců imunoglobulinu (HevyliteTM) k výsledkům gelové elektroforézy a nefelometrickému vyšetření proteinů séra při diagnóze mnohočetného myelomu. Čas Lék Čes. In press 2015.
18. Scudla V, Lochman P, Pika T et al. Differences in relationship between immunoglobulin heavy/ light chain pairs (HevyliteTM) and selected laboratory parameters and stratification systems in different immunochemical types of multiple myeloma. Biomedical Papers. In press 2015.
19. Ludwig H, Milosavljevic D, Zojer N et al. Supression of the non‑involved HLC pair correlates with survival in newly diagnosed and relapsed/ refractory patients with myeloma. Congres of European Haematology Association, Milano 2014: abstr. 980.
20. Katzmann JA, Rajkumar SV. A windows into immunoglobulin quantitation and plasma cell disease: antigen epitopes defined by the junction of immunoglobulin heavy and light chains. Leukemia 2013; 27(1): 1– 2. doi: 10.1038/ leu.2012.201.
21. Greipp PR, San Miguel J, Durie BG et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23(15): 3412– 3420.
22. Alexanian R. Blood volume in monoclonal gammopathy. Blood 1997; 49(2): 301– 307.
23. Kim J, Hayton WL, Robinson JM et al. Kinetics of FcRn‑ mediated recycling of IgG and albumin in human: pathophysiology and therapeutic implications using a simplified mechanism‑based model. Clin Immunol 2007; 122(2): 146– 155.
24. Akilesh S, Christianson GJ, Roopenian DC et al. Neonatal FcR expression in bone marrow‑ derived cell functions to protect serum IgG from catabolism. J Immunol 2007; 179(7): 4580– 4588.
25. Anderson CL, Chandhury C, Kim J et al. Perspective FcRn transports albumin: relevance to immunology and medicine. Trends Immunol 2006; 27(7): 343– 348.
26. Chandhury C, Brooks C, Carter D et al. Albumin binding to FcRn: distinct from the FcRn‑ IgG interaction. Biochemistry 2006; 45(15): 4983– 4990.
27. Pika T, Hermanova Z, Lochman P et al. System HevyLiteTM and IgA monoclonal gammopathy – first experience. Klin Biochem Metab 2011; 19: 86– 91.
28. Katzmann JA, Clark R, Kyle RA et al. Supression of uninvolved immunoglobulins defined by heavy/ light chain pair suppression is a risk factor for progression of MGUS. Leukemia 2013; 27(1): 208– 212. doi: 10.1038/ leu.2012.189.
29. Murillo‑ Florez I, Andrade‑ Campos M, Montes‑ Limon A et al. Predictive value of light and heavy chain analysis in multiple myeloma patients treated with bortezomib. Haematologica 2013; 98: 1519a.
30. Koulieris E, Maltezas D, Eytychia N et al. Impact of novel M‑ component based biomarkers on to progression free survival after treatment in intact immunoglobulin multiple myeloma. Blood 2012; 120: 121.
31. Ludwig H, Faint J, Zojer N et al. Serum heavy/ light chain and free light chain measurements provide prognostic informatic, alow creation of a prognostic model and identify clonal changes (clonal tiding) through the course of multiple myeloma. Blood 2011; 118: 1244.
32. Avet‑ Loiseau H, Mirbahai L, Mathiot C et al. Nephelometric assays Ig’kappa and Ig’lambda used for diagnosing and monitoring multiple myeloma. Haematologica 2011; 96: 393a.
33. Kraj M. Immunoglobulin heavy chain/ light chain pairs (HLC, HevyliteTM) assays for diagnosing and monitoring monoclonal gammopathies. Adv Clin Exp Med 2014; 23(1): 127– 133.
34. Koulieris MW, Kyrtsonis MC, Maltezas D et al. Quantification of serum IgM‑ kappa and IgM‑ lambda in patients with Waldenströms macroglobulinemia (WM) at diagnosis and during disease course. Clinical correlations. Blood 2010; 1116: 1238.
35. Leleu X, Koulieris E, Maltezas D et al. Novel M‑ component based biomarkers in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11(1): 164– 167. doi: 10.3816/ CLML.2011.n.039.
36. Lakomy D, Lemaire‑Ewing S, Denimal D et al. Evaluation of the new Hevylite TM IgA assay for the diagnosis and follow‑up of monoclonal gammopathies. Ann Biol Clin 2013; 71(2): 157– 163. doi: 10.1684/ abc.2013.0805.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2015 Issue 5
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Current Insights into the Antispasmodic and Analgesic Effects of Metamizole on the Gastrointestinal Tract
- Spasmolytic Effect of Metamizole
Most read in this issue
- Metody hodnocení kvality života u žen s karcinomem prsu – přehled a základní charakteristika
- Chirurgická liečba pľúcnych metastáz kolorektálneho karcinómu – prežívanie a prognostické faktory
- Zákaz řízení – nový vedlejší účinek chemoterapie
- Kombinace systematických terapií s radiací u nemalobuněčného karcinomu plic
