Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
Zinc-modified Nanotransporter for Target Drug Therapy of Breast Cancer
Background:
In the centre of nanomedical interest stands the nanotechnological modification of anthracycline antibiotics, which are often used in antitumor treatment of hematological malignancies and solid tumors. Chitosan nanoparticles are gaining more attention in the field of targeted transport of drugs because of their stability, low toxicity and simple preparation. The main objective of the project, was the design of chitosan nanotransporter of anthracycline antibiotics with zinc modified surface, for a specific interaction with metallothionein.
Material and Methods:
The chitosan nanoparticles with encapsulated doxorubicin were prepared by a dissolution of 5 g of chitosan in 3% solution of acetic acid and TPP (0.25% w/v) and doxorubicin (0.5 mg/ml). Fe2O3-NPs were prepared by a reduction with borohydride and using ammonia. Thereafter Fe2O3-AuNPs were prepared by thermal synthesis. The amount of doxorubicin and Zn2+ was determined using DPV.
Results:
Chitosan nanotransporter with anthracycline antibiotics (CHIT-Zn-DOXO-Fe2O3-AuNPs) was designed and subsequently studied by biophysical methods. Inside of the nanometric structure is electrostatically bound doxorubicin (concentration 10 µM, CHIT-DOXO). Moreover metallothionein is a molecule rich in cysteine and thanks to its free sulphhydryl groups is capable of bonding with the zinc ions. We have decided to use this ability for a construction of the nanotransporter for its targeted direction towards the tumor tissue (CHIT-Zn-DOXO). We have shown significant increases of a metallothionein (MT) level in malignant tumors in many of our previous experiments. MT into its domains binds heavy metal ions (naturally zinc ions) and keeps the homeostasis in equilibrium this way. Therefore we have decided to observe the ability of modified chitosan nanoparticles (CHIT-Zn-DOXO, 100 µg/ml) for MT protein binding (magnetic gold nanoparticles were modified by MT, 100 µg/ml, Fe2O3-AuNPs) in the other part of our experiment. The efficiency of the chitosan nanoparticle bond modified by zinc ions (CHIT-Zn-DOXO) to the MT (CHIT-Zn-DOXO-Fe2O3-AuNPs-MT) increased by more than 30% compared with the unmodified nanoparticle (CHIT-DOXO).
Conclusion:
We assume that the new nanotransporter is specific for its bioavailability, increased uptake of the drug from bloodstream in the tumor tissue area and low toxicity for an untargeted tissue.
Key words:
chitosan – magnetic gold nanoparticles – breast cancer – doxorubicin
The work was realized with the support of the project NANODRUGS 328/2017/FaF and The European Technology Platform for Nanomedicine.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
6. 3. 2017
Accepted:
26. 3. 2017
Authors:
S. Skaličková 1; M. Gargulák 2; M. Löffelmann 2; B. Ruttkay-Nedecký 2; M. Kepinská 3; T. Parák 1; Kizek R. 1–3
Authors‘ workplace:
Ústav humánní farmakologie a toxikologie, Farmaceutická fakulta, Veterinární a farmaceutická univerzita Brno
1; Centrální laboratoře, Farmaceutická fakulta, Veterinární a farmaceutická univerzita Brno
2; Ústav biomedicínských a environmentálních analýz, Wroclaw Medical University, Wroclaw, Polsko
3
Published in:
Klin Onkol 2017; 30(Supplementum1): 174-176
Category:
Article
Overview
Východiska:
V popředí zájmu nanomedicíny je nanotechnologická úprava antracyklinových antibiotik, která se často využívají v protinádorové léčbě hematologických malignit a solidních nádorů. Chitosanové nanočástice získávají více pozornosti v oblasti cíleného transportu léčiv díky své stabilitě, nízké toxicitě a jednoduché přípravě. Cílem práce bylo navrhnout chitosanový nanotransportér antracyklinového antibiotika s modifikací povrchu zinkem, pro specifickou interakci s metalothioneinem (MT).
Materiál a metody:
Chitosanové nanočástice s enkapsulovaným doxorubicinem byly připraveny rozpuštěním 5 g chitosanu v 3% kyselině octové a Trifenylfosfinu (TPP) (0,25 % w/v) a doxorubicinem (0,5 mg/ml). Fe2O3-NPs byly připraveny redukcí s borohydridem a amoniakem. Poté byly připraveny Fe2O3-AuNPs termální syntézou. Množství doxorubicinu a Zn2+ bylo určeno pomocí DPV.
Výsledky:
V experimentu byl navržen a následně studován biofyzikálními metodami chitosanový nanotransportér antracyklinových antibiotik (CHIT-Zn-DOXO-Fe2O3-AuNPs). Uvnitř vytvořené nanometrické struktury je elektrostaticky navázán doxorubicin (o koncentraci kolem 10 µm, CHIT-DOXO). Navíc MT je molekula bohatá na cystein a díky svým volným sulfhydrylovým skupinám je schopen vázat ionty zinku. Této vlastnosti jsme se rozhodli využít v konstrukci nanotransportéru pro jeho cílené směřování k nádorové tkáni (CHIT-Zn-DOXO). V řadě našich předchozích experimentů jsme ukázali výrazné vzestupy hladiny MT ve zhoubných nádorech. MT do svých domén váže ionty těžkých kovů (přirozeně ionty zinku), a tak udržuje jejich homeostázu v organizmu. Proto jsme se v další části experimentu rozhodli sledovat schopnost modifikovaných chitosanových nanočástic (100 mg/ml, (CHIT-Zn-DOXO) vázat se k proteinu MT (magnetické zlaté nanočástice byly modifikovány MT, 100 µg/ml, Fe2O3-AuNPs). Efektivita vazby chitosanové nanočástice modifikovaná zinečnatými ionty (CHIT-Zn-DOXO) k MT (CHIT-Zn-DOXO-Fe2O3-AuNPs-MT) vzrostla o více než 30 % v porovnání s nemodifikovanou nanočásticí (CHIT-DOXO).
Závěr:
Předpokládáme, že nový nanotransportér je specifický svojí biodostupností, zvýšeným vychytáváním léčiva z krevního řečiště v místě nádorové tkáně a nízkou toxicitou pro necílové tkáně.
Klíčová slova:
chitosan – magnetické zlaté nanočástice – rakovina prsu – doxorubicin
Úvod
V popředí zájmu nanomedicíny je nanotechnologická úprava antracyklinových antibiotik, která se často využívají v protinádorové léčbě hematologických malignit a solidních nádorů [1,2]. Nanotechnologická modifikace léčiva zlepšuje jeho zacílení primárně k nádorové buňce. Modifikované nanočástice dokáží zvýšit koncentraci protinádorového léčiva v cílovém místě bez navýšení nežádoucích účinků a také chrání léčiva před intracelulární enzymovou degradací nebo endozomální translokací. Z publikovaných prací je zřejmé, že chitosanové nanočástice získávají více pozornosti v oblasti cíleného transportu léčiv díky jejich stabilitě, nízké toxicitě a jednoduché přípravě [3]. Deacetylovaná chitosanová kostra glukosaminových jednotek má vysokou hustotu nabitých aminoskupin, které umožňují silné elektrostatické interakce s biomolekulami, přechodnými kovy (Zn, Se) a peptidy [4,5]. Bylo zjištěno, že významnou molekulou vázající těžké ionty je metalothionein a jeho hladina je u nádoru prsu také významně změněná [6–8]. Cílem práce bylo navrhnout chitosanový nanotransportér antracyklinového antibiotika s modifikací povrchu zinkem, pro specifickou interakci s metalothioneinem.
Materiál a metody
Chitosanové nanočástice s enkapsulovaným doxorubicinem byly připraveny rozpuštěním 5 g chitosanu v 3% kyselině octové a TPP (0,25 % w/v) a doxorubicinem (0,5 mg/ml). Ke stanovení doxorubicinu a Zn2+ pomocí diferenční pulzní voltametrie (DPV) byl použit AUTOLAB Analyzer (Metrohm, Švýcarsko). Stanovení probíhalo pomocí adsorptivní přenosové techniky a standardní cely se třemi elektrodami. Elektroda ze skelného uhlíku byla pracovní elektroda, Ag/AgCl/3M KCl elektroda byla referenční a platinová elektroda byla pomocná. Pro zpracování dat byl použit software NOVA (Metrohm, Švýcarsko). Analyzované vzorky byly před měřením zbaveny kyslíku probubláním argonem (99,999 %). Pro analýzu Doxo a Zn2+ byl použit acetátový pufr (0,2 M acetát sodný a 0,2 M kyselina octová) při pH 5, který byl použit jako pomocný elektrolyt. Parametry měření Doxo byly následující: počáteční potenciál –0,8 V, konečný potenciál –0,4 V, doba akumulace 120 s, krok potenciální 5 mV, modulační amplituda 25 mV, objem vzorku 10 µl, objem měřicí cely 2 ml. Parametry pro měření Zn2+: počáteční potenciál –1,2 V, konečný potenciál –0,7 V, doba akumulace 60 s, krok potenciální 5 mV, modulační amplituda 25 mV, objem vzorku 10 µl, objem měřicí cely 2 ml. Fe2O3-NPs byly připraveny redukcí s borohydridem a amoniakem. Poté byly Fe2O3-AuNPs připravené termální syntézou. Množství doxorubicinu a Zn2+ bylo určeno pomocí DPV.
Výsledky
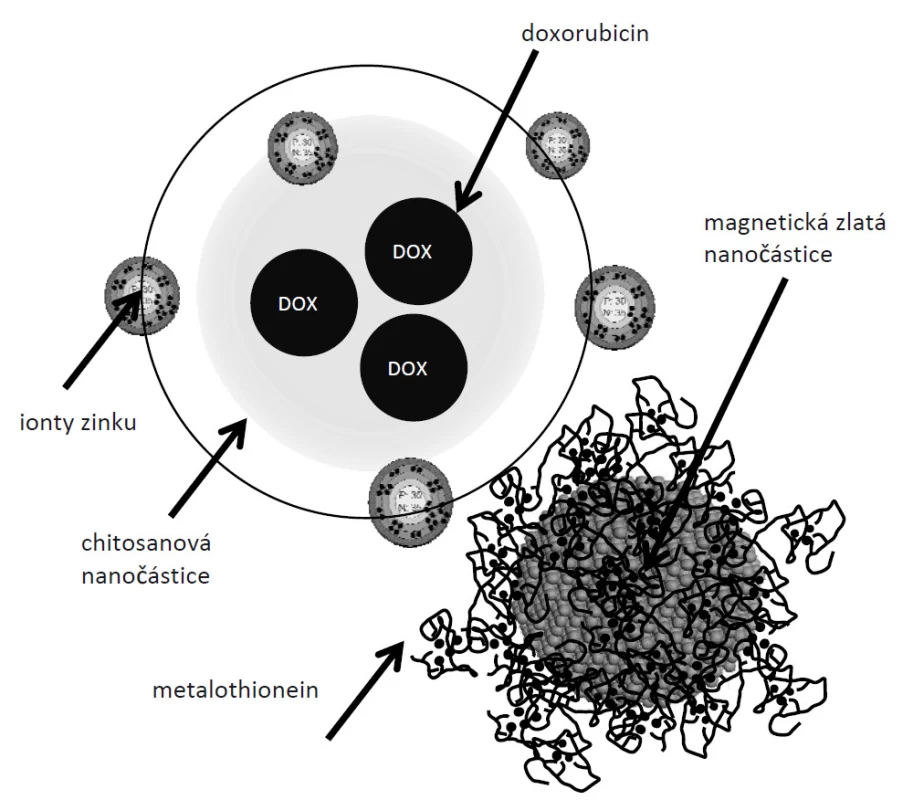
V experimentu byl navržen a následně studován biofyzikálními metodami chitosanový nanotransportér antracyklinových antibiotik (CHIT-Zn-DOXO-Fe2O3-AuNPs) jak je ukázáno na obr. 1. Uvnitř vytvořené nanometrické struktury je elektrostaticky navázán doxorubicin (o koncentraci kolem 10 µM, CHIT-DOXO). Navíc metalothionein je molekula bohatá na cystein a díky svým volným sulfhydrylovým skupinám je schopen vázat ionty zinku. Této vlastnosti jsme se rozhodli využít v konstrukci nanotransportéru pro jeho cílené směřování k nádorové tkáni (CHIT-Zn-DOXO). V řadě našich předchozích experimentů jsme ukázali výrazné vzestupy hladiny MT ve zhoubných nádorech [9–11]. MT do svých domén váže ionty těžkých kovů (přirozeně ionty zinku), a tak udržuje jejich homeostázu v organizmu. Proto jsme se v další části experimentu rozhodli sledovat schopnost modifikovaných chitosanových nanočástic (100 mg/ml, (CHIT-Zn-DOXO) vázat se k proteinu MT (magnetické zlaté nanočástice byly modifikovány MT, 100 µg/ml, Fe2O3-AuNPs)). Efektivita vazby chitosanové nanočástice modifikovaná zinečnatými ionty (CHIT-Zn-DOXO) k MT (CHIT-Zn-DOXO-Fe2O3-AuNPs-MT) vzrostla o více jak 30 % v porovnání s nemodifikovanou nanočásticí (CHIT-DOXO). Námi navržený koncept nanotransportéru DOXO potencionálně ukazuje na jeho možné zacílení do tkání se zvýšenou hladinou MT.
Závěr
Předpokládáme, že nový nanotransportér je specifický svojí biodostupností, zvýšeným vychytáváním léčiva z krevního řečiště v místě nádorové tkáně a nízkou toxicitou pro necílové tkáně. Z výsledků je patrné, že je nanočástice formována a ve své struktuře uzavírá doxorubicin a na povrchu jsou vázány ionty Zn2+. Získané výsledky vypovídají o formaci chitosanových nanočástic a jejich schopnosti vázat se na protein MT, který hraje důležitou roli u nádoru prsu.
Práce byla realizována za podpory projektu NANODRUGS 328/2017/FaF a The European Technology Platform for Nanomedicine.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Ing. Sylvie Skaličková, Ph.D.
Ústav humánní farmakologie a toxikologie
Farmaceutická fakulta
Veterinární a farmaceutická univerzita Brno
Palackého třída 1946/1
612 42 Brno
e-mail: sylvie.skalickova@gmail.com
Obdrženo: 6. 3. 2017
Přijato: 26. 3. 2017
Sources
1. Shi JJ, Kantoff PW, Wooster R et al. Cancer nanomedicine: progress, challenges and opportunities. Nat Rev Cancer 2017; 17 (1): 20–37. doi: 10.1038/nrc.2016.108.
2. Yaari Z, da Silva D, Zinger A et al. Theranostic barcoded nanoparticles for personalized cancer medicine. Nat Commun 2016; 7 : 13325. doi: 10.1038/ncomms13325.
3. Kamaly N, He JC, Ausiello DA et al. Nanomedicines for renal disease: current status and future applications. Nat Rev Nephrol 2016; 12 (12): 738–753. doi: 10.1038/ nrneph.2016.156.
4. Zhao HY, Lv P, Huo D et al. Doxorubicin loaded chitosan-ZnO hybrid nanospheres combining cell imaging and cancer therapy. RSC Adv 2015; 5 (74): 60549–60551.
5. Esmaeili A, Hadad NA. Preparation of ZnFe2O4-chitosan-doxorubicin hydrochloride nanoparticles and investigation of their hyperthermic heat-generating characteristics. Ceram Int 2015; 41 (6): 7529–7535.
6. Gomulkiewicz A, Jablonska K, Pula B et al. Expression of metallothionein 3 in ductal breast cancer. Int J Oncol 2016; 49 (6): 2487–2497. doi: 10.3892/ijo.2016.3759.
7. Burton C, Dan YB, Donovan A et al. Urinary metallomics as a novel biomarker discovery platform: breast cancer as a case study. Clin Chim Acta 2016; 452 : 142–148. doi: 10.1016/j.cca.2015.11.014.
8. Chandler P, Kochupurakkal BS, Alam S et al. Subtype-specific accumulation of intracellular zinc pools is associated with the malignant phenotype in breast cancer. Mol Cancer 2016; 15 : 2. doi: 10.1186/s12943-015-0486-y.
9. Gumulec J, Masarik M, Adam V et al. Serum and tissue zinc in epithelial malignancies: a meta-analysis. PLoS One 2014; 9 (6): e99790. doi: 10.1371/journal.pone.0099790.
10. Gumulec J, Raudenska M, Adam V et al. Metallothionein – immunohistochemical cancer biomarker: a meta-analysis. PLoS One 2014; 9 (1): e85346. doi: 10.1371/journal.pone.0085346.
11. Adam V, Petrlova J, Wang J et al. Zeptomole electrochemical detection of metallothioneins. PLoS One 2010; 5 (7): e11441. doi: 10.1371/journal.pone.0011441.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2017 Issue Supplementum1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Analýza mikroRNA u epiteliálního karcinomu vaječníku
- Využití porózního hydrogelu jako 3D scaffoldu pro růst leukemických B lymfocytů
- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Diagnostický a terapeutický potenciál membránového HSP90
- Everolimus v denní klinické praxi se zaměřením na problematiku postižení sliznice dutiny ústní – zkušenost onkologického centra v průběhu roku 2016
- Stanovení DNA metylace v BRCA2 genu na elektrodových biočipech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Využití metody PLA pro detekci komplexů p53/p63/p73 in situ v nádorových buňkách a nádorové tkáni
- Význam deregulace mikroRNA v molekulární patogenezi a histologické transformaci folikulárního lymfomu
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
- Je možné pozorovat etnickou diferenci v základních krevních testech? Údaje z programu onkologické prevence v komplexním onkologickém centru v České republice
- Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
- Fullerenový nanotransportér doxorubicinu pro cílenou interakci s mutovaným genem BRCA2
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
