Prediktivní hodnota ultrasenzitivního C-reaktivního proteinu u cévní mozkové příhody a jeho vztah k ateroskleróze karotid
Predictive Value of Ultrasensitive C-Reactive Protein in Ischemic Cerebrovascular Accident and Its Relation to Atherosclerosis of Carotid Arteries
Introduction:
Atherosclerosis plays an essential role in the etiopathogenesis of ischemic cerebrovascular accident (iCVA). A chronic inflammatory process shares significantly in its development. Among the inflammation indices, ultrasensitive C-reactive protein (hsCRP) has been considered an independent risk factor of ictus, predictor of a more severe affection, relapses as well as other cardiovascular disorders. The research aimed at judging the effects of hsCRP on the severity of iCVA in the acute phase, the relation to the iCVA subtypes, atherosclerosis of carotid arteries, and its possible predictive value.
A set of patients and methods:
The plasma hsCRP levels were determined in 110 probands (66 men, 44 women, mean age 61.5 ± 9.9 years) in the acute phase of iCVA. The accident severity was evaluated according to NIHSS criteria. A set was divided, according to etiology, into three groups (atherothrombotic – AT, embolic arterio-arterial – EA, cardioembolic – EC ictuses) and according to the degree of atherosclerotic affection of carotid arteries (≤ 30 %, 30 – 69 %, ≥ 70 %). Three months after the acute phase of the disease hsCRP was examined in 78 probands (44 men, 34 women). A control set (CS) consisted of 58 healthy subjects (32 men, 26 women, mean age 57.1 ± 9.9 years).
Results:
If compared with CS, higher levels of hsCRP were revealed in: (1) probands in the acute phase (p < 0.0001), (2) patients with NIHS < 10 (p = 0.001) as well as NIHSS ≥ 10 (p < 0.0001), (3) subtype of AT ictus (p < 0.0001), less in EC (p = 0.01) and EA (p = 0.01), (4) degrees of carotid stenoses ≤ 30 % (p = 0.008), 30 – 69 % (p = 0.004) and ≥ 70 % (p = 0.001), (5) probands after three months (p < 0.0001). No difference was found with regard to the Glasgow Outcome Scale (GOS).
Conclusion:
The study has confirmed the connection of higher hsCRP levels in the acute phase of iCVA and severity of a neurological deficit as well as that of higher hsCRP levels and carotid artery atherosclerosis.
Key-words:
ischemic ictus, atherosclerosis, ultrasensitive CRP, carotid stenosis
Authors:
I. Vlachová 1; R. Herzig 1; H. Vaverková 2; D. Novotný 3; V. Krčová⁴; A. Bártková 1; B. Křupka 1; D. Šaňák 1; K. Urbánek 1
; M. Budíková⁵; E. Sovová⁶; P. Kaňovský 1
Authors‘ workplace:
Neurologická klinika LF UP a FN v Olomouci
1; III. Interní klinika LF UP a FN v Olomouci
2; Oddělení klinické biochemie FN v Olomouci
⁴Hemato-onkologická klinika LF UP a FN v Olomouci
⁵Klinika nukleární medicíny LF UP v FN v Olomouc
⁶I. interní klinika LF UP a FN v Olomouci
3
Published in:
Cesk Slov Neurol N 2007; 70/103(1): 49-55
Category:
Original Paper
Vytvořeno za podpory grantu IGA MZ ČR NF7492-3/2003.
Overview
Úvod:
V etiopatogenezi ischemické cévní mozkové příhody (iCMP) hraje podstatnou roli ateroskleróza. Na jejím rozvoji má významný podíl chronický zánětlivý proces. Mezi ukazateli zánětu byl ultrasenzitivní C-reaktivní protein (hsCRP) uznán nezávislým rizikovým faktorem iktu, prediktorem horšího postižení, recidiv i dalších kardiovaskulárních postižení. Cílem studie bylo posouzení vlivu hsCRP na tíži iCMP v akutní fázi, vztahu k subtypům iCMP, ateroskleróze karotid a posouzení jeho možné prediktivní hodnoty.
Soubor pacientů a metodika:
Stanovení plazmatických hladin hsCRP bylo provedeno u 110 probandů (66 mužů a 44 žen, průměrného věku 61,5±9,9) v akutní fázi iCMP. Tíže příhody byla hodnocena podle kriterií NIHSS. Soubor byl rozdělen podle etiologie do 3 skupin (ikty aterotrombotické-AT, embolické arterio-arteriální-EA, kardioembolické-EK) a stupně aterosklerotického postižení karotid (≤30 %; 30-69 %; ≥70 %). Za 3 měsíce od akutní fáze onemocnění byl hsCRP vyšetřen u 78 probandů (44 mužů a 34 žen). Kontrolní skupinu (KS) tvořilo 58 zdravých osob (32 mužů a 26 žen, průměrného věku 57,1±9,9 let).
Výsledky:
Ve srovnání s KS byly zjištěny vyšší hodnoty hsCRP u: (1) probandů v akutní fázi (p<0,0001); (2) nemocných s NIHSS <10 (p=0,001) i NIHSS≥10 (p<0,0001); (3) subtypu iktu AT (p<0,0001), méně i EK (p=0,01) a EA (p=0,01); (4)stupňů karotických stenóz≤30 % (p=0,008), 30-69 % (p=0,004) i ≥70 % (p=0,001); (5) probandů za 3 měsíce (p<0,0001). Ve vztahu ke Glasgow Outcome Scale (GOS) nebyl zjištěn rozdíl.
Závěr:
Studie potvrdila souvislost vyšších hladin hsCRP v akutní fázi iCMP a tíže neurologického deficitu, jakož souvislost vyšších hladin hsCRP s aterosklerózou karotid.
Klíčová slova:
ischemický iktus, ateroskleróza, ultrasenzitivní CRP, karotická stenóza.
Úvod
V etiopatogenezi ischemické cévní mozkové příhody (iCMP), která je jednou z hlavních příčin morbidity a mortality ve vyspělých zemích, hraje podstatnou roli ateroskleróza (AS).
Arteroskleróza je multifaktoriální, postupně probíhající onemocnění, které není způsobeno pouze pasivní akumulací lipidů v cévní stěně. Významný podíl při rozvoji AS a jejich komplikací má chronický zánětlivý proces, který ovlivňuje všechny fáze jejího vývoje od endoteliální dysfunkce až po rupturu ateromového plátu [1]. Mezi zánětlivými markery je, s ohledem ke vztahu rizika rozvoje AS, nejintenzivněji věnována pozornost C-reaktivnímu proteinu (CRP), sérovému amyloidu A a neopterinu, tedy ukazatelům aktivace makrofágů. Markery aktivace endotelu jsou VCAM, ICAM, E-selektin a proteiny regulující akutní fázi – jako interleukin-6 (IL-6) a tumor necrosis factor-α (TNF-α) [2]. Zejména v posledním desetiletí je CRP intenzivně zkoumán v souvislosti s rizikem cerebrovaskulárních (CV) a kardiovakulárních (KV) onemocnění i u nemocných po akutní fázi iCMP [3-7]. Zvýšená plazmatická koncentrace CRP je spojená s karotickou a koronární AS, AS tepen dolních končetin i progresí těchto onemocnění [8]. CRP byl uznán nezávislým rizikovým faktorem KV onemocnění, prediktorem horšího postižení i jejich recidiv.
V roce 2003 doporučila American Heart Association (AHA) používat v klinické praxi stanovení plazmatických hladin ultrasenzitivního CRP – hsCRP (high sensitive CRP), který lépe vystihuje základní zánětlivý status jednotlivých osob. Dovoluje stanovit již koncentrace CRP od 0,1 mg/l s přesností na 0,01 mg/l . Dospělou populaci lze podle hodnot plazmatické hladiny hsCRP rozdělit do 3 skupin. Osoby s nízkým rizikem rozvoje AS a jejich komplikací mají koncentraci hsCRP<l.0 mg/l, střední riziko představuje hladina hsCRP mezi 1-3 mg/l, vysoké riziko představuje koncentrace >3 mg/l [9]. Poprvé byl vztah hsCRP a KV onemocnění zmíněn v r. 1996 [10]. V roce 1997 byly zveřejněny výsledky velké prospektivní Physicians Health Study, ve které bylo sledováno přes 15 000 mužů po dobu 14 let. Muži v kvartilu s nejvyššími koncentracemi hsCRP měli 2,9krát vyšší riziko vzniku prvního infarktu myokardu (IM) než muži s nejnižšími koncentracemi. Obdobné výsledky u žen přinesla v roce 2000 publikovaná prospektivní studie Woman’s Health Study [11].
Cílem naší práce bylo stanovení hodnot hsCRP a posouzení jeho vlivu na stav nemocných v prvních 24 hodinách od vzniku iCMP, zhodnocení jeho vztahu k subtypu iCMP, stupni AS postižení extrakraniálního úseku karotického řečiště a zhodnocení jeho případné prediktivní hodnoty ve vztahu k Glasgow Outcome Scale (GOS) za 3 měsíce od vzniku příhody.
Soubor a metodika
V rámci studie bylo v akutní fázi iCMP vyšetřeno 110 nemocných (66 mužů a 44 žen průměrného věku 61,5±9,9 let) léčených na iktovém centru Neurologické kliniky FN v Olomouci. V tomto souboru bylo 83 nemocných s arteriální hypertenzí (AH) a 5l osob s diabetes mellitus (DM) 2. typu či sníženou glukózovou tolerancí (IGT). Za 3 měsíce od akutní fáze bylo vyšetřeno 78 probandů (44 mužů a 34 žen) (tab. 1). Do souboru byli zařazeni nemocní s tranzitorní ischemickou atakou (TIA), reverzibilním ischemickým neurologickým deficitem (RIND) a kompletním iktem (CS). Tíže vstupního neurologického postižení byla hodnocena podle National Institutes of Helalth Stroke Scale (NIHSS), Bethesda Maryland, USA, stav nemocných za 3 měsíce od akutní fáze byl hodnocen pomocí GOS. Zásadním kriteriem pro zařazení do studie byla diagnóza mozkové ischemie a horní věková hranice 75 let. Odběry hsCRP byly v akutní fázi onemocnění provedeny ihned po přijetí (tj. nejpozději 24 hodin od vzniku prvních příznaků), tedy ještě před zahájením komplexní léčby iktu. Vyloučeni byli nemocní s klinickými známkami zánětu, nebo osoby léčené dlouhodobě nesteroidními antiflogistiky či antibiotiky. KS tvořilo 58 osob (32 mužů a 26 žen, průměrný věk 57,2±9,8let) (tab.1).

Pro potřeby porovnání vlivu sledovaných faktorů u jednotlivých subtypů byl soubor rozdělen na ikty aterotrombotické (AT), embolické arterio-arteriální (EA) se sonograficky verifikovaným nálezem AS postižení v symptomatické magistrální mozkové tepně a kardioembolické (EK) s nonvalvulární fibrilací síní či průkazem intrakardiálního trombu. Pro zhodnocení vlivu hsCRP na tíži neurologického postižení byl soubor rozdělen do 2 skupin. Jednu tvoří probandi s méně závažným postižením (NIHSS<10), druhou probandi se závažným postižením (NIHSS≥10). Pro zhodnocení možné prediktivní hodnoty hsCRP byl soubor probandů v akutní fázi rozdělen na skupinu s hodnotou hsCRP<l, skupinu s hsCRP 1-3 a skupinu s hsCRP >3. Diagnóza mozkové ischemie byla stanovena pomocí počítačové tomografie (CT) či magnetické rezonance (MR) mozku. Všichni probandi měli provedeno duplexní sonografické vyšetření magistrálních i intrakraniálních mozkových tepen na ultrazvukovám přístroji Hewlett-Packard Sonos 4500 Agilent. Podle stupně postižení extrakraniálního úseku karotického řečiště byli rozděleni do 3 skupin. První skupinu tvoří probandi se stenózou arteria carotis interna (ACI) <30 %, druhou skupinu probandi s nálezem 30-69% stenózy a třetí skupinu probandi se stenózou ≥70%. 86 osob bylo vyšetřeno transezofageální echokardiografií na přístroji Toshiba Power Vision 8000.
Hs-CRP byl vyšetřen latexem podporovanou imunoturbidimetrickou metodou, diagnostickou soupravou Tina-quant CRP (Latex) HS, výrobce Roche, kalibrátor C.f.P. (Roche).
Ke statistickému vyhodnocení rozdílu sledovaných parametrů mezi probandy a KS v akutní fázi onemocnění a po 3 měsících byl použit Studentův dvouvýběrový
t-test jehož výsledky byly ověřovány i neparametrickým testem Mann-Whitney. Pro zhodnocení možné prediktivní hodnoty rozdílných hladin hsCRP v akutní fázi onemocnění ke GOS po 3 měsících byl použit χ2 test. χ2 test byl použit při srovnání hodnot hsCRP u probandů i kontrolní skupiny s distribucí tohoto markeru v české populaci.
Nemocní i osoby KS byli do studie zařazeni na základě vlastního podpisu informovaného souhlasu. Studie je součástí výzkumného úkolu ministerstva zdravotnictví ČR, který byl předem posouzen a schválen etickou komisí. Celá studie proběhla v souladu s Helsinskou deklarací z roku 1975, revidovanou v roce 1983.
Výsledky
V akutní fázi onemocnění byly prokázány statisticky významně vyšší hodnoty hsCRP u sledovaného souboru proti KS, p<0,0001 (graf l). Při hodnocení vztahu hladin hsCRP k tíži neurologického deficitu byly u nemocných s NIHSS <10 v porovnání s KS hladiny hsCRP statisticky významně vyšší (p=0,001), ještě výrazněji se lišila skupina s NIHSS≥10 (p<0,0001) (graf 2). Pokud byl hodnocen vliv hsCRP k subtypu iCMP, vyznělo primární hodnocení 2výběrovým Studentovým t-testem statisticky nevýznamně, po ověření neparametrickým testem Mann-Whitney se objevily statisticky významné rozdíly u všech 3 skupin, EK (p=0,01), EA (p=0,01) i AT (p<0,0001), a to s výraznou prevalencí právě u subtytu AT (graf 3). Při hodnocení vztahu hsCRP k AS změnám extrakraniálního úseku karotického řečiště byla prokázána u všech 3 skupin statisticky významně vyšší hodnota, především ve skupině s hemodynamicky významnou stenózou (l. p=0,008; 2. p=0,004; 3. p=0,00l) (graf 4).




Za 3 měsíce od akutní fáze iCMP byl hodnocen soubor 78 probandů. Při srovnání s KS přetrvávala statisticky významně vyšší hladina hsCRP u probandů (p<0,0001) (graf 5). Ve vztahu ke GOS po 3 měsících od akutní fáze nebyl nalezen statisticky významný rozdíl mezi hodnotami akutní a konvalescentní fáze onemocnění ani po rozdělení souboru na skupiny s nízkým, středním a vysokým rizikem podle hladiny hsCRP.

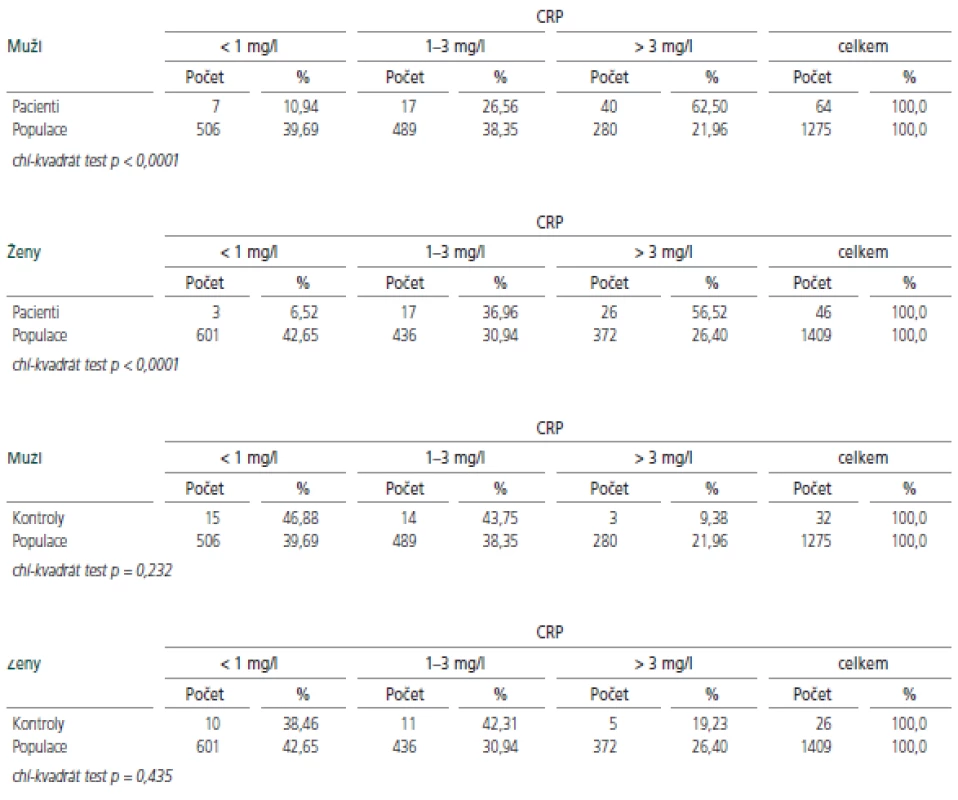
Hodnoty hsCRP u probandů v akutní fázi onemocnění i u KS byly porovnány s reprezentativním vzorkem české populace [12]. I při tomto srovnání se sledovaný soubor jak u mužů, tak u žen, statisticky významně lišil ve všech 3 podskupinách (p<0,0001), kontrolní skupina se od české populace podstatně nelišila (tab.2).
Diskuse
CRP je relativně nespecifickým zánětlivým markerem. Může však být využit ke sledování závažnosti a progrese některých dobře definovaných KV onemocnění. CRP je stopový protein cirkulující u zdravých osob v koncentraci okolo l mg/l. V akutní fázi infekcí či zánětů se jeho koncentrace zvyšuje více než 100násobně. Středně zvýšené hodnoty plazmatického CRP jsou pozorovány u stavů spojených s AS, psychickým stresem, u kuřáků a starších osob [13]. Logicky doprovázejí zvýšené koncentrace CRP chronická zánětlivá a autoimunní onemocnění jako revmatoidní artritidu a systémový lupus erythematosus. Tito nemocní mají také zvýšené riziko KV komplikací [14,15]. Vyšší hodnoty CRP mají osoby obézní [16], osoby se zvýšeným krevním tlakem, jsou také prediktorem rozvoje arteriální hypertenze [14,15]. Již zmíněná Woman’s Health Study ukázala, že hladina CRP je významným prediktorem výskytu DM 2. typu a metabolického syndromu [11]. Ukazuje se, že subklinický zánět měřený jako zvýšení koncentrace hsCRP je součástí syndromu inzulinové rezistence [2].
CRP je produkován nejvíce hepatocyty. Jeho tvorba je indukována především IL-6, který produkují makrofágy v místě poškození či infekce. Méně významný podíl při regulaci syntézy mají interleukin 1-β a TNF-α [17]. Recentní práce prokazují jeho tvorbu v AS lézích – zejména v buňkách hladkého svalstva cévní stěny a makrofázích, ale také v ledvinách, neuronech a alveolárních makrofázích. Jeho fyziologická role je méně známá než jeho prozánětlivý efekt. Hlavní funkcí CRP je schopnost rozeznávat patogeny a vlastní poškození buňky a facilitovat jejich odstranění makrofágy a komplementovým systémem [2]. CRP nejen aktivuje komplement s dopadem na rozvoj AS, současně má i vlastní ochranné účinky, které jsou založeny na ochraně zejména endotelových buněk před účinky aktivovaného komplementu [18]. Patofyziologické mechanizmy vedoucí ke zvýšeným koncentracím CRP jsou stále předmětem rozsáhlého výzkumu, pozornost je věnována již zmíněným faktorům metabolickým, zvýšené aktivaci imunitního systému i zkoumání genetických vlivů.
Jak již bylo řečeno výše, je v hodnocení vztahu koncentrací CRP a KV onemocnění využíváno laboratorní stanovení tzv. hsCRP. Využití této metody je oproti ostatním reaktantům akutní fáze výhodné. Jednak jde o dostupnou laboratorní metodiku, hodnoty hsCRP vykazují malé intraindividuální rozdíly během roku a mají téměř nulovou cirkadiální variabilitu [2]. Jak vyplývá z předešlého, vztah zánětlivých markerů a kardiovakulárních onemocnění je úzký. Vyšší koncentrace jsou prediktorem vzniku IM včetně náhlé smrti z kardiálních příčin, jejich koncentrace dobře korelují s rozsahem AS postižení stanoveným koronarografií, měření koncentrací hsCRP se využívá při hodnocení prognózy onemocnění již probíhajícího i hodnocení rizika provedených revaskularizačních operací i koronárních angioplastik [2]. Ve vztahu k CMP nejsou výsledky celé řady prací tak konzistentní. Je to jistě dáno tím, že iCMP nejsou homogenní skupinou a v profilu rizikových faktorů se od ischemické choroby srdeční do jisté míry liší. Aterotrombóza je jistě nejzávažnější, ale ne jedinou příčinou. V souladu s výsledky ostatních studií [19,20] vykazuje i naše studie přetrvávající zvýšenou hladinu CRP v akutní i konvalescentní fázi iCMP. Naproti tomu Di Napoli et al [6] pozoroval snížení CRP po akutní fázi. Beamer et al [21] pozorovali pokles plazmatické hladiny CRP v průběhu l roku pouze u osob, které neprodělaly recidivu iktu.
Při analýze jsou výsledky sledování značně variabilní [19]. V naší studii shledáváme statisticky nejpřesvědčivější zvýšení hsCRP u aterotrombotických iktů. V české literatuře se vztahem zánětlivých markerů zabýval Chlumský et al, kteří srovnávali kardioembolické a trombotické ikty. I zde byly statisticky významně vyšší hodnoty zánětlivých markerů ve skupině iktů trombotických [22].
Tíže iCMP pozitivně koreluje s plazmatickou hladinou CRP [19,23]. Vyšší hladiny markerů zánětu po větších infarktech jsou zapříčiněny nejen vstupními hodnotami CRP, ale také následkem rozsáhlejšího poškození mozkové tkáně. Obdobně je tomu v naší studii, významně vyšší plazmatickou hladinu hsCRP v porovnání s KS mají probandi s těžším iktem. Rovněž ve vztahu k AS karotid, až na výjimky [24], se potvrzuje pozitivní korelace zvýšených plazmatických koncentrací CRP s intimo-mediálním ztluštěním [25], rozvojem a progresí AS plátů a následující iCMP, se k symptomatickou či asymptomatickou stenózou [8,26,27]. Vztah zvýšených plazmatických hladin hsCRP k AS postižením karotid se odráží i v našich výsledcích. Hodnotu hsCRP jako prediktora horšího outcome či recidivu iktu výsledky naší studie v kratším časovém odstupu 3 měsíců nepotvrzují ani po rozdělení souboru probandů podle hodnot plazmatických hladin hsCRP a stupně rizika. Přesto i v tomto období přetrvává u našich nemocných významně vyšší hladina sledovaného markeru v porovnání s kontrolní skupinou. Zajímavé z tohoto pohledu bude dlouhodobější sledování.
Závěr
Přes jistě pozitivní výsledky studie, které podporují postavení hsCRP v roli ukazatele CV rizika, je potřeba si uvědomovat, že cesta od výzkumných projektů do praktické medicíny není jednoduchá. Jistěže by nebylo smysluplné hodnotit z tohoto pohledu riziko KV i CV onemocnění, kdyby nebyla možnost výsledky použít léčebně či v rámci preventivních opatření. Vzhledem k tomu, co již bylo napsáno, je evidentní, že jde nejen o zásadní režimové změny v životním stylu, ale také možné ovlivnění medikamentózní. Výsledky studií zkoumajících vliv kyseliny acetysalicylové se dosud různí, avšak efekt podávání statinů, zejména u KV onemocnění, je jednoznačný. Podobně příznivý účinek na hladinu hsCRP mají fibráty a ACE inhibitory. Z pohledu primární i sekundární prevence ischemického iktu vyhodnocuje dosavadní situaci recentní zpráva členů CRP Pooling Project z roku 2005 [28]. Podle jejích závěrů dosud neexistují zcela přesvědčivé důkazy pro doporučení měření CRP pro vyhodnocení primárního rizika CV onemocnění v rutinní praxi. V sekundární prevenci iktu je zvýšená hladina CRP prognostickým markerem, ale dosud zbývá stanovit specifický terapeutický postup pro tato onemocnění.
doc.MUDr. Ivanka Vlachová
Neurologická klinika LF UP a FN
I.P. Pavlova 6
775 20 Olomouc
e-mail: olaf.olomouc@seznam.cz
Přijato k recenzi: 16. 1. 2006
Přijato do tisku: 6. 11. 2006
Sources
1. Libby P, Ridker PM, Maseri A. Inflammation and atherosclerosis. Circulation 2002; 105 : 1135-43.
2. Dvořáková A, Poledne R. Ultrasenzitivně měřený C-reaktivní protein – nový parametr kardiovaskulárního rizika. Vnitř lék 2004; 11 : 852-7.
3. Ridker PM, Buring JE, Shih J et al. Prospective study of C-reactive protein and the risk of future cardiovascular events among apparently healthy woman. Ciculation 1998; 98 : 731-3.
4. Rost NS, Wolf PA, Kase CS at al. Plasma concentration of C-reactive protein and risk of ischemic stroke and transient ischemic attack: the Framingham study. Stroke 2001; 32 : 2575-9.
5. Van Exel E, Gussekloo J, de Crean AJ et al. Inflammation and stroke: the Leiden 85-plus Study. Stroke 2002; 33 : 1135-8.
6. Di Napoli M, Papa F, Bocola V. C-reactive protein in ischemic stroke an independent prognostic factor. Stroke 2001; 32 : 917-24.
7. Anuk T, Assayag EB, Rotstein R et al. Prognostic implications of admission inflammatory profile in acute ischemic neurological events. Acta Neurol Scand 2002; 106 : 196-9.
8. Van DM, I, De Maat MP, Hak AE et al. C-reactive protein predicts progression of atherosclerosis measured at various sites in the arterial tree: the Rotterdam Study. Stroke 2002; 33 : 2750-5.
9. Pearson TA, Mensah GA, Alexander RW et al. Markers od inflammation and cardiovascular disease: application to clinical and public healt practice: a statement for healtcare professionals from the Centers for Disease Control and Prevention and the Am Heart Association. Circulation 2003; 107 : 499-511.
10. Mendal MA, Patel P, Ballam L et al. C-reactive protein and its relation to cardiovascular risk factors: a population based cross-sectional study. BMJ 1996; 312 : 1061-5.
11. Ridker PM, Buring JE, Cook NR et al. C-reactive protein, the metabolic syndrome and risk of incident cardiovascular events: an 8-year follow-up of 14 719 initially healthy American woman. Circulation 2003; 107 : 391-7.
12. Cífková R. Rizikové faktory kardiovaskulárních onemocnění v české populaci [habilitace]. Praha: Karlova Universita 2003.
13. Erren M, Reinecke H, Junker R et al. Systemic inflammatory parameters in patients with atherosclerosis of the coronary and peripheral arteries. Arterioscler Tromb Vasc Biol 1999; 19 : 2355-63.
14. Solomon DH, Karlson EW, Rimm EB et al. Cardiovascular morbidity and mortality in woman diagnosed with rheumatoid arthritis. Circulation 2003; 107 : 1202-7.
15. Manzi S, Meilahn EN, Rairie JE et al. Age-specific rates of myocardial infarction and angina in woman with systemic lupus erytematosus: comparison with the Framingham Study. Am J Epidemiol 1997; 145 : 408-15.
16. Yudkin JS, Stenhower CD, Emeis JJ et al. C-reactive protein in healthy subjects: associacions with obesity, insulin resistence, and endotelial dysfunction: a potential role for cytokines originating from adipose tissue? Arterioscler Thromb Vasc Biol 1999; 19 : 972-8.
17. Baumann H, Morella KK, Wong GH. TNF-alpha, IL-1 beta and hepatocyte growth factor cooperate in stimulating specific acute phase plasma protein genes in rat hepatoma cells. J Immunol 1993; 151 : 4248-57.
18. Kuneš P. Krejsek J. Ateroskleróza a přirozené autoprotilátky. 2. část: Přirozené autoprotilátky a C-reaktivní protein. Cor Vasa 2004; 46(10): 484-91.
19. Marquardt L, Ruf A, Mansmann U et al. Inflammatory response after acute ischemic stroke. J Neurol Aci 2005; 236(1-2): 65-71.
20. Emsley HC, Smith CJ, Gavin CM et al. An early and substained peripheral inflammatory response in acute ischaemic stroke: relationship with infection and atherosclerosis. J Neuroimmunol 2003; 139 : 93-101.
21. Beamer NB, Coull BM, Clark WM et al. Persistent inflammatory response in stroke survivors. Neurology 1998; 50 : 1722-8.
22. Chlumský J, Holá D, Kratochvílová R. Zánětlivé parametry u nemocných s cévní mozkovou příhodou. Vnitř lék 2002; 10 : 956-8.
23. Smith CJ, Emsley HC, GavinCM et al. Peak plasma interleukin-6 and other peripheral markers of inflammation in the first week od ischaemic stroke correlate with brain volume, stroke severity and long-term outcome. BMC Neurol 2004; 4 : 2.
24. Chapman CM, Beilby JP, McQuillan BM et al. Monocyte count, bat not C-reactive protein or interleukin-6, is as independent risk marker for subclinical carotid atherosclerosis. Stroke 2004; 35 : 1619-24.
25. Cao JJ, Manolio TA,Psaty BM et al. C-reactive protein, carotid intima-media thickeness, and incidence of ischemic stroke in the elderly: the Cardiovascular Health Study. Circulation 2003; 108 : 166-70.
26. Sitzer M, Markus HS, Mendal MA et al. C-reactive protein and carotid intimal media thickness in a community population. J Cardiovasc Risk 2002; 9 : 97-103.
27. Rerkasem K, Sherman CP, Williams JA et al. C-reactive protein is elevated in symptomatic compared with asymptomatic patients with carotid artery disease. Eur J Vasc Endovasc Surg 2002; 23 : 505-9.
28. Di Napoli M, Schwaninger M, Cappelli R et al. Evaluation of C-reactive protein measurment for assesing the risk and prognosis in ischemic stroke. A statement for health care professionals from the CRP pooling project members. Stroke 2005; 36 : 1316-29.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2007 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine Eases Daily Life for Patients and Caregivers
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
-
All articles in this issue
- Diagnostika a léčba karcinózy mening u solidních nádorů
- Tau protein a beta amyloid v likvoru u Alzheimerovy choroby a normy odvozené od kognitivně zdravých kontrol
- Intravenózní trombolytická terapie rekombinantním tkáňovým aktivátorem plazminogenu rt-PA (Actilyse®) – naše první zkušenosti z praxe
- Využití stanovení klusterinu v séru a likvoru v diagnostice postižení CNS – pilotní studie
- Vliv oboustranného zúžení vnitřní krkavice na cerebrovaskulární rezervní kapacitu zadního mozkového povodí
- Huntingtonova nemoc: zkušenosti s genetickým testováním v letech 1994-2005
- Vyšetření vizuálních evokovaných potenciálů a sonografické vyhodnocení orbitální hemodynamiky u akutní unilaterální optické neuritidy
- Neuroendoskopie a matematický model dynamiky mozkových komor
- Syndrom kývavé panenky u supraselárních cyst: výsledky neuroendoskopické léčby u čtyř dětí
- Krvácení do glioblastomu při dopravní nehodě
- Panická porucha – Neuropsychiatrický profil
- Chirurgická léčba metastatického postižení krční páteře
- Kognitivní deficit po léčbě intrakraniálních aneuryzmat
- Využití transkraniálního doppleru k průkazu intrakraniální hypertenze u dětí se skafocefalií
- Prediktivní hodnota ultrasenzitivního C-reaktivního proteinu u cévní mozkové příhody a jeho vztah k ateroskleróze karotid
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Panická porucha – Neuropsychiatrický profil
- Tau protein a beta amyloid v likvoru u Alzheimerovy choroby a normy odvozené od kognitivně zdravých kontrol
- Diagnostika a léčba karcinózy mening u solidních nádorů
- Chirurgická léčba metastatického postižení krční páteře
