Tau protein a beta amyloid v likvoru u Alzheimerovy choroby a normy odvozené od kognitivně zdravých kontrol
The Liquor Tau Protein and Beta Amyloid in Alzheimer’s Disease
The authors present a Czech population based study on CSF biomarkers – total tau protein, phosphorylated tau protein and beta amyloid were examined in the group of patients with Alzheimer´s disease (AD), Frontotemporal dementia (FTD) and an age-matched cognitively intact control group. All subjects underwent brain MR and extended neuropsychological examinations to make it possible to classify the patients according to NINCDS-ADRDA criteria for probable AD and Neary criteria for FTD. There is no consensus in generally accepted normal values for all the three markers according to the published papers as the results of various studies differ. Due to this fact we assessed the normal values for our laboratory (average +-2 standard deviations) and ROC (receiver operating characteristic) curve to measure the best sensitivity and specificity for a given marker: total tau protein 355 pg/ml, phosphorylated tau protein 55 pg/ml and beta amyloid 458 pg/ml. The highest specificity provides determination of total tau protein and phosphorylated tau protein in AD, lower in FTD. The less reliable is beta amyloid. The authors have discussed these results with those yielded in other studies including the only study done on the Czech population.
Key words:
beta amyloid, total tau protein, phosphorylated tau protein, controls, Alzheimer´s disease, Frontotemporal dementi, norms, biomarkers, CSF
Authors:
J. Hort 1; L. Glosová 1; M. Vyhnálek 1; M. Bojar 1; D. Škoda; M. Hladíková 1 2
Authors‘ workplace:
1. Neurologická klinika 2. LF UK, Praha, 2. Ústav lékařské informatiky UK, 2. LF, Praha
Published in:
Cesk Slov Neurol N 2007; 70/103(1): 30-36
Category:
Original Paper
Podpořeno grantem GAČR 309/05/0693.
Overview
Autoři předkládají soubor pacientů s Alzheimerovou chorobou (ACH), frontotemporální demencí (FTD) a věkově vázaných kognitivně intaktních kontrol, u kterých byla stanovena hladina celkového tau proteinu, fosforylovaného tau proteinu a beta amyloidu v mozkomíšním moku. Všichni pacienti měli provedenou MR mozku a byli podrobně neuropsychologicky vyšetřeni tak, aby splnili kritéria NINCDS-ADRDA pro pravděpodobnou ACH a Nearyho kritéria pro FTD. V literatuře není plná shoda v obecně platných normách pro jednotlivá vyšetření. Výsledky různých prací se částečně liší. Byly proto stanoveny normy pro naši laboratoř (jako průměr +-2 směrodatné odchylky) a ROC (receiver operating characteristic) křivka, vyjadřující nejlepší senzitivitu a specificitu pro daný marker: celkový tau protein 355 pg/ml, fosforylovaný tau protein 55 pg/ml a beta amyloid 458 pg/ml. Nejvíce specifické je stanovení celkového tau proteinu a fosforylovaného tau proteinu pro ACH, méně pro FTD. Nejméně spolehlivým se jeví stanovení beta amyloidu. Autoři diskutují výsledky s hodnotami zjištěnými v dalších studiích, včetně dosud jediné publikované studie provedené na české populaci.
Klíčová slova:
beta amyloid, celkový tau protein, fosforylovaný tau protein, kontroly, Alzheimerova choroba, frontotemporální demence, norma, biomarkery, mozkomíšní mok
Úvod
V diagnostice neurodegenerativních onemocnění mozku se v poslední době stále více uplatňuje likvorologická diagnostika využívající možnosti stanovení biomarkerů beta amyloidu, celkového tau proteinu a fosforylovaného tau proteinu. Její největší význam je v odlišení Alzheimerovy choroby (ACH) od ostatních demencí. Přínos je zkoumán rovněž u dalších druhů demencí – vaskulární demence (VaD), demence s Lewyho tělísky (LBD), Jakobovy-Creutzfeldtovy choroby (JCD), Parkinsonovy nemoci s demencí (PND) a skupiny tauopatií - frontotemporální demence (FTD), progresivní supranukleární obrny (PSO) a kortikobazální degenerace (CBD). Specifické nálezy jsou popsány rovněž po akutní ischemické cévní mozkové příhodě (CMP), u amyotrofické laterální sklerózy (ALS), multisystémové atrofie (MSA) nebo při depresi [1].
Tau protein se fyziologicky podílí na stabilizaci sítě cytoskeletu neuronu a vazbou na mikrotubuly udržuje funkční transportní systém axonu. Do likvoru se zvýšeně uvolňuje při masivním akutním (například po CMP) nebo při zvýšeném subakutním i chronickém rozpadu neuronů při atroficko-degenerativním procesu, často v závislosti na rychlosti progrese onemocnění (extrémně vysoké hodnoty u rychle progredujících demencí, jako je JCD). K hyperfosforylaci tau proteinu dochází během vývoje nervového systému a je průvodním jevem několika neurodegenerativních onemocnění. Není zatím shoda, zda existuje fosforylační místo (dosud jich bylo identifikováno asi 30), které by bylo specifické pro ACH a nevyskytovalo se tedy u ostatních tauopatií. Fosforylovaný tau protein je přínosný například v odlišení ACH od LBD [2]. Byl uveden do klinického vyšetřování nejpozději a jeho přínos byl hodnocen zejména na evropských pracovištích, neboť v USA byl registrován až v roce 2004. Množství prací, které se zabývají tímto markerem, je proto menší než u celkového tau proteinu a beta amyloidu [3].
Beta amyloid vzniká z amyloidového prekurzorového proteinu, který je fyziologickou součástí buněčné membrány. Rozlišují se dvě hlavní izoformy: kratší forma končící valinem 40 (Ab-40) a delší forma končící na alaninu 42 (Ab-42). Forma Ab-40 za normálních okolností převažuje, je solubilní a tělem vylučována. Naproti tomu Ab-42 agreguje rychleji než Ab-40 a je počáteční a dominující formou beta amyloidu uloženého v placích. Hladina amyloidu b-42 (Ab) bývá u ACH snížená, což se vysvětluje právě jeho zvýšenou adherencí v perineuronálních neuritických placích. To je důvodem, proč se v klinické praxi rutinně vyšetřuje Ab-42, který je proto rovněž komerčně dostupnější. Mnoho prací zjistilo jeho pokles u ACH, až na jednu výjimku, kde byly hodnoty zvýšeny. Obdobný nález byl popsán u deprese [1]. Řada prací poukázala na velký přesah hodnot u pacientů s ACH a kontrol. Některé práce proto doporučují hodnotit poměr Ab-42/Ab-40 v případě jeho poklesu jako více specifický pro ACH než pokles Ab-42 samotného.
Citlivější je rovněž stanovení dvojkombinace Ab-42 a celkového tau proteinu. Kombinovaným vyšetřením se dosahuje větší přesnosti diagnózy, která je jinak založena podle kritérií National Institute of Neurological and Communicative Disorders and Stroke and Alzheimer Disease and Related Disorders Association (NINCDS – ADRDA) [4] zejména na anamnéze a klinickém obrazu v kombinaci se zobrazovací metodou. Vyšetření biomarkerů může mít však význam nejen v diagnostice, ale rovněž i přínos pro monitoraci průběhu onemocnění. Další možností je hodnocení efektu léčby a ověření možných mechanizmů působení léku, například ovlivnění metabolizmu beta amyloidu statiny [5]. Má rovněž význam v počátku onemocnění, kdy pomáhá předpovědět, kteří pacienti s mírnou kognitivní poruchou (MCI) mají zvýšené riziko konverze v ACH. Elevace biomarkerů může klinickou manifestaci ACH předcházet o 1-2 roky [6]. Senzitivita a specificita vyšetření fosforylovaného tau proteinu je vyšší než u výše zmíněných dvou markerů samotných.
Cílem námi předkládané práce je stanovení normálních hodnot celkového tau proteinu, fosforylovaného tau proteinu a beta amyloidu v mozkomíšním moku na kontrolním souboru osob bez postižení kognice a stanovení hranice, která rozliší s největší senzitivitou a specificitou kontroly od pacientů s ACH a FTD. Tímto způsobem je možné ověřit vhodnost metodiky pro diferenciální diagnostiku demencí. Získané výsledky jsou srovnávány s nálezy u dosud publikovaných zahraničních a domácích prací.
Metodika
Na Neurologické klinice 2. LF UK a FN Motol byl shromážděn soubor mozkomíšních moků odebraných lumbální punkcí u 102 pacientů s neurodegenerativním onemocněním centrálního nervového systému: 2 ACH definitivní, 15 ACH pravděpodobná, 10 ACH možná, 15 MCI, 10 FTD (z toho 3 definitivní diagnózy), 3 JCD definitivní, 5 LBD, 3 PSO (z toho 1 definitivní), 2 MSA ( z toho 1 definitivní), 4 PND, 6 VaD, 10 smíšená demence a 6 ALS bez kognitivního deficitu (z toho 1 definitivní). Všichni pacienti byli české národnosti a podepsali informovaný souhlas s vyšetřením moku. Vzorky byly zpracovány v laboratoři, která je součástí neurologické kliniky a vyšetřeny sety ELISA od firmy Innogenetics. Prostředky pro nákup setů byly získány z grantu GAČR 309/05/0693. Pro další zpracování byly vybrány skupiny pacientů s pravděpodobnou a definitivní ACH (n=17) a FTD (n=10) a porovnány se skupinou kognitivně zdravých věkově vázaných kontrol (n=30) (tab. 1).
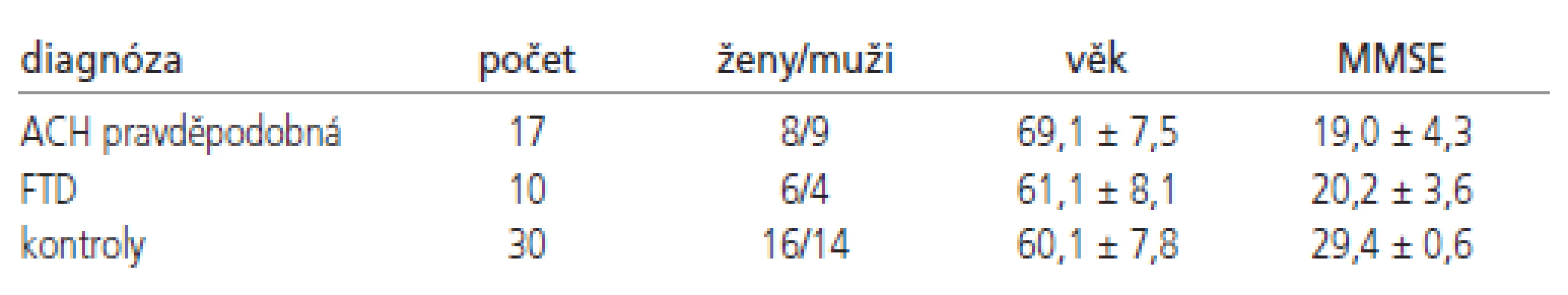
Vyšetření moku u kontrol bylo indikováno z jiného důvodu než kognitivní deficit. Jednalo se o pacienty s periferní parézou lícního nervu (n-28), u nichž vyšetření likvoru vyloučilo zánětlivou etiologii, a dále o pacienty s bolestí hlavy vyšetřené pro podezření na subarachnoidální krvácení (n-2), které nakonec nebylo spektrofotometricky prokázáno. Všechny kontroly měly vyšetřen MMSE ( 29+-0,6), kdy normální hodnoty jsou nad 26 bodů, a dále Addenbrooke‘s Cognitive Examination (ACE) test (95+-3), kdy hranice 88 bodů ze 100 možných má senzitivitu 93 % pro kognitivní deficit [16]. Dále měly provedenu geriatrickou škálu deprese (maximálně 5 bodů) a MR mozku. Pacienti s vaskulárním postižením mozku byli ze souboru vyloučeni, Hachinského ischemické skóre bylo maximálně 4 body. Do kontrolního souboru nebyl zařazen žádný pacient s roztroušenou sklerózou.
Diagnóza pacientů s ACH a FTD byla výsledkem podrobného neuropsychologického vyšetření: všichni pacienti měli proveden Bentonův vizuální retenční test, test číselné řady, Auditory verbal learning test, test hodin, Reyovu figuru, Trail Making Test, geriatrickou škálu deprese a CDR škálu k odlišení MCI od demence. Jako dementní byli hodnoceni pacienti s CDR rovno nebo větší 1,0, pacienti s CDR 0,5 byli hodnoceni jako MCI [17]. U 2 pacientů s ACH byla diagnóza definitivní. Diagnóza ACH byla stanovena pomocí NINCDS-ADRDA kritérií a diagnóza FTD pomocí Nearyho kritérií [18]. Z 10 pacientů byl potvrzen histologicky Morbus Pick (n-1) a obraz nespecifické frontotemporální lobární degenerace bez nálezu charakteristických inkluzí (n-2). Z klinického hlediska se jednalo o 1 pacienta se sémantickou demencí (převažující syndrom temporálního laloku), 2 pacienty s primární progresivní afázií (převažující syndrom frontotemporálního pomezí) a 7 pacientů s FTD s behaviorálními příznaky (syndrom prefrontálního a předního temporálního laloku). Do této poslední skupiny patřily všechny 3 histologicky potvrzené nálezy a u dalších 2 bylo současně přítomno elektrofyziologicky prokázané postižení motoneuronu.
Vzhledem ke gaussovskému rozložení hodnot byly normy stanoveny jako průměr + - 2 směrodatné odchylky. Pomocí korelační analýzy byla sledována závislost hladiny celkového tau proteinu na věku u normální populace. Vzhledem k neparametrickému rozložení hodnot biomarkerů u pacientů byl pro porovnání mezi skupinami použit Mann-Whitneyův U test. Pro každý z markerů byla pomocí ROC křivky stanovena hraniční hodnota markeru, při které bylo dosaženo nejlepší specificity a senzitivity pro odlišení pacientů s Alzheimerovou chorobou od zdravých kontrol. V případě celkového i fosforylovaného tau proteinu byla stanovena horní mez normy (patologické hodnoty, např. u ACH jsou zvýšené), v případě beta amyloidu byla určena dolní mez normy (patologické hodnoty u ACH jsou snížené).
Výsledky
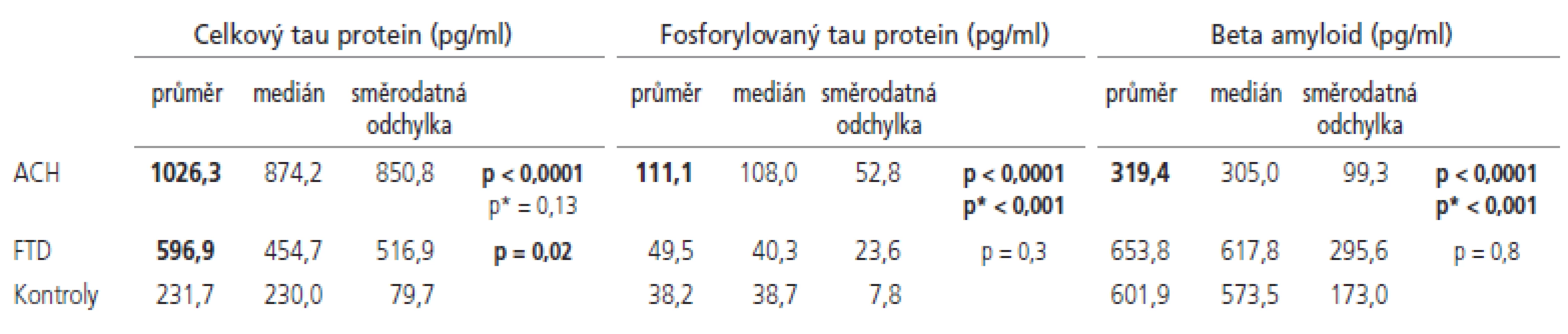
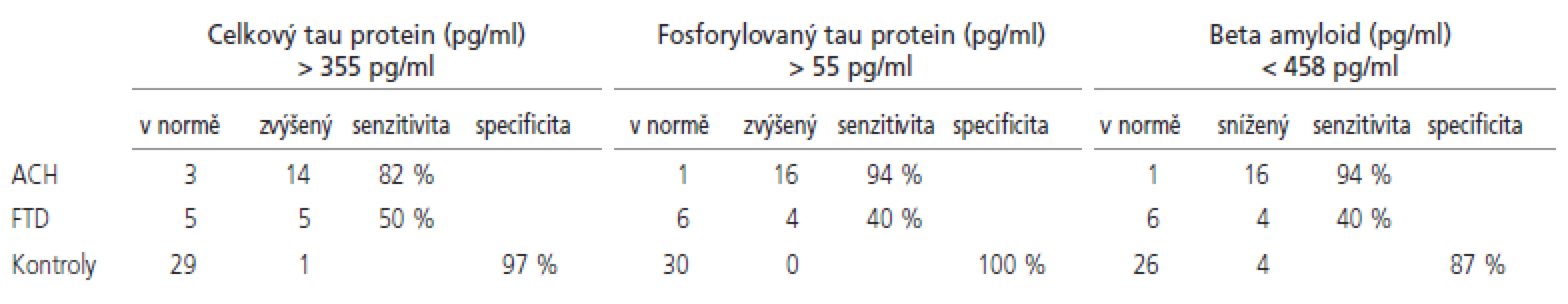
Naměřené hodnoty a výsledky statistického porovnání se souborem norem jsou shrnuty v tab. 2 a znázorněny v grafech 1-3. Senzitivity a specificity testů při cut off hodnotách zvolených dle ROC křivky jsou shrnuty v tab. 3.

Celkový tau protein
Horní mez normy pro celkový tau protein byla stanovena jako průměr + 2 směrodatné odchylky a byla 389 pg/ml. Hodnoty celkového tau proteinu byly signifikantně zvýšeny jak u pacientů s ACH, tak u pacientů s FTD.
Rozdíl mezi oběma skupinami dementních pacientů nebyl signifikantní. Dle ROC křivky jsme stanovili cut off hodnotu 355 pg/ml, při které dojde s největší senzitivitou a specificitou k oddělení pacientů s ACH od zdravých norem. Při použití této hodnoty jsme dosáhli 82% senzitivity pro ACH, 50% senzitivity pro FTD při zachování 97% specificity. I když existuje určitá tendence k lineárnímu zvyšování hladiny tau proteinu s věkem, nedokázali jsme statisticky signifikantní korelaci (p=0,23, r=0,21).
Fosforylovaný tau protein
Horní mez normy pro hladinu fosforylovaného tau proteinu byla stanovena jako průměr + 2 směrodatné odchylky a byla 53,8 pg/ml. Hodnoty fosforylovaného tau proteinu byly signifikantně zvýšeny u pacientů s ACH, a toto zvýšení bylo signifikantní i vůči skupině pacientů s FTD. Dle ROC křivky jsme stanovili cut off hodnotu 55 pg/ml, při které dojde s největší senzitivitou a specificitou k oddělení pacientů s ACH od zdravých norem. Při použití této hodnoty jsme dosáhli 94% senzitivity pro ACH, 40% senzitivity pro FTD při zachování 100% specificity.
Beta amyloid
Dolní mez normy pro hladinu beta amyloidu byla stanovena jako průměr - 2 směrodatné odchylky a byla 255 pg/ml. Hodnoty beta amyloidu byly signifikantně sníženy u pacientů ACH, a toto snížení bylo signifikantní i vůči skupině pacientů s FTD. Dle ROC křivky jsme stanovili cut off hodnotu 458 pg/ml, při které dojde s největší senzitivitou a specificitou k oddělení pacientů s ACH od zdravých norem. Při použití této hodnoty jsme dosáhli 94% senzitivity pro ACH, 40% senzitivity pro FTD při zachování 87% specificity.
Diskuse
Pro bližší statistické vyhodnocení jsme použili kontrolní skupinu, skupinu ACH a skupinu FTD. Důvodem tohoto výběru byl dostatečně velký počet vzorků ve skupině kontrol a ACH a snaha stanovit diskriminační přínos pro nejčastější indikaci stanovení biomarkerů, diagnostiku ACH. Skupina FTD byla vybrána za účelem ověření přínosu biomarkerů pro diferenciální diagnostiku atroficko-degenerativních demencí. Jedince s VaD nebo se smíšenou demencí jsme do souboru nezařadili, neboť vaskulární změny se mohou vyskytovat v kombinaci s ACH a bez pitevního nálezu nelze přítomnost alzheimerovských změn vyloučit. Bowler et al [19] prokázali, že rozdíl mezi ACH a smíšenou demencí je větší než mezi smíšenou demencí a VaD. To potvrzuje důležitou roli ischemické komponenty u smíšené demence.
Naše výsledky korelují s výsledky jiných autorů ve smyslu poklesu nebo zvýšení hladiny daného markeru, ale současně se liší v absolutních hodnotách, stejně jako se liší další práce navzájem [1,3,7]. Může to být způsobeno věkovou odlišností jednotlivých souborů, populačními rozdíly i stupněm postižení podmíněným odlišnou fází onemocnění.
Nejrozsáhlejší studii provedli Hulstaert et al [7] na souboru 150 pacientů s ACH, 79 ostatních demencí, 84 jiných neurologických diagnóz a kontrolním souboru 100 dobrovolníků nebo nemocných bez postižení nervového systému. Byly zjištěny následující hodnoty: celkový tau protein u ACH 425 (274-713) pg/ml, u kontrol 219 (134-318) pg/ml a 220 (122-426) pg/ml u nealzheimerovských demencí. Hodnoty beta amyloidu: u ACH 487 (394-622) pg/ml, u kontrol 1001 (797-1214) pg/ml a u ostatních demencí 603 (430-744) pg/ml. Při použití ROC (receiver operating characteristic) křivky byla stanovena hranice, která je nejlepší pro odlišení kontrol od ACH: beta amyloid 643 pg/ml (senzitivita 78 %, specificita 81 %) a celkový tau protein 252 pg/ml (senzitivita 79 %, specificita 70 %). Při kombinaci těchto dvou markerů pak vychází specificita 86 % a senzitivita 85 %. Na Hulstaertově studii je založeno doporučení v příbalovém letáku společnosti Innogenetics, která je výrobcem komerčních setů pro vyšetření. Například Maeck [8] své výsledky vztahuje k hranici 463 pg/ml pro beta amyloid a 252 pg/ml pro celkový tau protein. Andreasen [9] udává hodnoty u kontrolního souboru 286+-141pg/ml pro celkový tau protein a 773+-233 pg/ml pro beta amyloid. Sjogren et al [10] prokázali závislost hladiny celkového tau proteinu na věku. Pro věkovou skupinu 21-50 let udává normální hodnoty do 300 pg/ml, pro 51-70 let do 450 pg/ml a pro 71-93 do 500 pg/ml. U beta amyloidu závislost na věku neprokázal a normální hodnoty udává nad 500 pg/ml. Jiná studie provedená Sunderlandem provedená na 131 pacientech s ACH a 72 kontrolách zjistila sníženou hladinu beta amyloidu u ACH – 183 (+-121) pg/ml a u kontrol – 491 (+-245) pg/ml. Hladina celkového tau proteinu byla u ACH zvýšena – 587 (+-365) pg/ml vs. 244 (+-156) u kontrol. Nejlepší senzitivity 92 % a specificity 89 % pro odlišení ACH a kontrol bylo dosaženo při stanovení hranice 444 pg/ml pro beta amyloid a 195 pg/ml pro celkový tau protein [3]. Na základě metaanalytického zhodnocení většiny studií se uvádí senzitivita pro odlišení od zdravých kontrol 89 % a specificita pro ACH 90 % [1]. Pro kombinaci beta amyloid + fosforylovaný tau protein se udává senzitivita 86 % a specificita 97 % [11]. Pro kombinaci fosforylovaný tau protein + celkový tau protein se udává senzitivita 96 % a specificita 100 % [12]. Jako nejlépe diskriminující hladina fosforylovaného tau proteinu se uvádí 61 pg/ml. Na české populaci byly provedeny pouze dvě studie na souboru 21 pacientů s demencí [13,14]. Autoři převzali pro interpretaci výsledků rozmezí z Hulstaertovy studie [7], (134-318 pg/ml pro celkový tau protein a 797-1214 pg/ml pro beta amyloid), které udávají jako normy. Jako vlastní kontrolní soubor použili výsledky pacientů s roztroušenou sklerózou, kteří měli hodnoty odlišné: celkového tau proteinu 145-329 pg/ml a beta amyloidu 603-849 pg/ml.
Z výše uvedených prací vyplývá, že rozmezí normálních hodnot udávané různými autory se liší. Neexistuje tedy přesně stanovená hranice a je nutné stanovit normy pro každou laboratoř a populaci, na které se vyšetření provádí. Právě kontrolní soubor, ke kterému se výsledky vztahují, je pro interpretaci výsledků rozhodující. Dalším metodickým problémem všech prací provedených s biomarkery je skutečnost, že jen u malého vzorku pacientů byla ověřena diagnóza histologicky post mortem. Z výsledků studií korelujících klinickou diagnózu s diagnózou pitevní vyplývá, že i ve specializovaných centrech není správnost klinické diagnózy větší než 80 % a mimo tato centra dále klesá [15]. To zpochybňuje některé práce hodnotící přínos biomarkerů, ve kterých nejsou likvorové nálezy potvrzeny pitevní diagnózou. Konečným cílem těchto prací je přitom právě snaha omyly v klinické diagnostice omezit pomocí spolehlivých biomarkerů. To však není možné bez předchozího průkazu jejich spolehlivosti.
Dosud není zcela dořešena otázka, jak souvisí výše hladiny celkového tau proteinu s rychlostí progrese neurodegenerace. Hampel et al [20] prokázali souvislost mezi hladinou fosforylovaného tau proteinu a hipokampální atrofií u ACH. U CMP je akutně zvýšen celkový tau protein a nezměněný fosforylovaný tau protein [21]. Jiné studie však příliš rychlost progrese onemocnění nezohledňují [1]. Perry et al [22] přitom udávají, že pokud denně odumře 1 buňka ze 100, k 50% úbytku dojde během 10 týdnů. Pokud to je 1 z 1000, pak 50% redukce nastává za 2 roky, pokud odumře 1 z 10000, pak redukce nastává za 20 let.
Náš kontrolní soubor a tím i výsledky u pacientů s demencí jsou odlišné od předchozího sdělení v domácím tisku [13,14]. Prokázali jsme sice shodný trend (zvýšení celkového tau proteinu a snížení beta amyloidu u ACH), avšak významně se liší absolutní hladina u kontrol. Tím dochází k odlišné interpretaci výsledků u pacientů s demencí. Při aplikaci našich norem by některé výsledky publikované těmito autory nesplňovaly kritérium pro diagnózu ACH, neboť by měly příliš vysokou hladinu beta anuloidu, a někteří i příliš nízkou hladinu celkového tau proteinu. Rozdíly jsou dle našeho názoru způsobeny následujícími metodologickými odlišnostmi:
- Při převzetí norem z Hulstaertovy studie autoři nepoužili doporučené hodnoty podle ROC křivky, ale celkové rozmezí, čímž došlo k zkreslení nálezů.
- Použili shodně jako my NINCDS –ADRDA kritéria pro ACH. Bylo však vyšetřeno pouze CT mozku, což mohlo způsobit nedostatečný záchyt cévních změn, které by se na vzniku demence mohly podílet. Likvorové nálezy u ACH a VaD jsou přitom odlišné. VaD může mít likvorologický nález normální [1].
- Soubor je malý: z celkového počtu 21 pacientů s demencí má pouze 6 ACH.
- Neuvádí průměrnou hodnotu MMSE, takže není zřejmé, o jak těžce postižené pacienty se jednalo.
- Hlavní metodologický nedostatek spatřujeme v převzetí literárních údajů a nevytvoření kvalitního kontrolního souboru. Za kontroly byli vybráni pacienti s roztroušenou sklerózou. Pacienti s roztroušenou sklerózou za kontrolní soubor vybíráni ve většině prací nebývají, neboť se jedná o onemocnění primárně postihující centrální nervový systém, kde kromě demyelinizačních změn dochází i k axonální ztrátě a zániku neuronů. Elevace celkového tau proteinu je některými autory dokonce navržena jako marker predikující horší outcome u pacientů s roztroušenou sklerózou [23].
- Tento kontrolní soubor měl navíc významně nižší věkový průměr 41,4 +-7,9 let, oproti skupině demencí - 77,0+-9,9 let. I za fyziologických okolností se stoupajícím věkem dochází ke zrychlování úbytku neuronů. Výsledky některých prací prokazují zřetelnou věkovou závislost celkového tau proteinu na věku [24]. V našem souboru existuje určitá tendence k lineárnímu zvyšování hladiny tau proteinu s věkem, výsledky však nejsou statisticky signifikantní. To může být způsobeno vyšším věkovým průměrem našeho kontrolního souboru.
Vzhledem k věkové prevalenci v populaci se vyznačuje naše skupina FTD statisticky významně nižším věkem (p<0,05) než skupina ACH. Vyšší MMSE u této skupiny nemusí znamenat mírnější postižení vzhledem k tomu, že MMSE nevyšetřuje frontální exekutivní funkce. Hladiny beta amyloidu a fosforylovaného tau proteinu ve skupině FTD se statisticky signifikantně nelišily od norem, respektive lišily se ve vztahu k ACH. Soubor FTD je malý a heterogenní, přesto naše výsledky naznačují, že by stanovení biomarkerů v moku mohlo být přínosné pro odlišení ACH od FTD. Heterogennost skupiny onemocnění FTD je spíše obecným problémem, kdy je zřejmé, že jednotlivé případy zařazené do této diagnostické jednotky se mohou histologicky velmi lišit. Do budoucna nelze vyloučit, že bude rozčleněna na více samostatných onemocnění podle patogenetického mechanizmu. Maeck et al [8] popsali 3 případy s primární progresivní afázií s obdobnými nálezy v moku, jaké jsme zjistili u našeho souboru. Skupina FTD však není těžištěm našeho sdělení a byla zařazena spíše pro srovnání. Náš soubor není dostatečně početný, abychom mohli výsledky FTD publikovat samostatně. Bylo by rovněž žádoucí mít k dispozici pitevní nálezy u všech jedinců v této skupině.
Existuje velké množství prací zabývajících se hodnotami daných markerů u FTD. Riemenschneider et al [25] uvádějí elevaci celkového tau proteinu a pokles beta amyloidu u FTD. Hampel et al [26] zjistili u FTD normální nebo mírně zvýšený celkový tau protein a normální nebo mírně snížený beta amyloid. Zjistil, že nejprůkaznější pro odlišení ACH je nezvýšená hladina fosforylovaného tau proteinu u FTD. Dosud se však nepodařilo jednoznačně určit charakteristické nálezy pro ALS s kognitivním deficitem. V našem souboru mají 2 pacienti s FTD současně postižení motoneuronu. Sjogren [27] uvádí na souboru 14 FTD a 11 ALS, že hodnota beta amyloidu je znatelně snížena u ACH a ALS, a lehce snížena u FTD ve srovnání s kontrolami. Podle Sussmutha et al [28] je hodnota celkového tau proteinu zvýšena u 70 % pacientů, a to spíše v počátečních stadiích onemocnění.
Závěr
Kombinované vyšetření všech tří markerů je vhodnou metodikou, která zpřesňuje diferenciální diagnostiku jednotlivých druhů demencí. Pro její klinické využití však doporučujeme v nově zaváděných laboratořích vytvoření vlastního kontrolního souboru pacientů, nebo vycházet z námi navržených kontrolních hodnot, které byly stanoveny na české populaci u kognitivně zdravých jedinců. Největší senzitivity a specificity pro Alzheimerovu chorobu je možné dosáhnout při využití hraničních hodnot celkového tau proteinu 355 pg/ml, fosforylovaného tau proteinu 55 pg/ml a beta amyloidu 458 pg/ml. FTD je heterogenní skupina onemocnění a menší průkaznost výsledků může být proto způsobena disproporčním zastoupením jednotlivých podskupin tohoto souboru.
MUDr. Jakub Hort, Ph.D.
Neurologická klinika dospělých 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha
e-mail: jakub.hort@seznam.cz
Přijato k recenzi: 9. 3. 2006
Přijato do tisku: 27. 6. 2006
Sources
1. Blennow K. Cerebrospinal fluid protein biomarkers for Alzheimer's disease. NeuroRx 2004; 1 : 213-25.
2. Vanmechelen E, Vanderstichele H, Hulstaert F, Andreasen N, Minthon L, Winblad B et al. Cerebrospinal fluid tau and beta-amyloid(1-42) in dementia disorders. Mech Ageing Dev 2001; 122 : 2005-11.
3. Sunderland T, Linker G, Mirza N, Putnam KT, Friedman DL, Kimmel LH et al. Decreased beta-amyloid1-42 and increased tau levels in cerebrospinal fluid of patients with Alzheimer disease. JAMA 2003; 289 : 2094-103.
4. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology 1984; 34 : 939-44.
5. Hoglund K, Thelen KM, Syversen S, Sjogren M, von Bergmann K, Wallin A et al. The effect of simvastatin treatment on the amyloid precursor protein and brain cholesterol metabolism in patients with Alzheimer's disease. Dement Geriatr Cogn Disord. 2005; 19 : 256-65.
6. Andreasen N, Sjogren M, Blennow K. CSF markers for Alzheimer´s disease: total tau, phospho-tau a Abeta42. World J Biol Psychiatry 2003; 4 : 147-55.
7. Hulstaert F, Blennow K, Ivanoiu A, Schoonderwaldt HC, Riemenschneider M, De Deyn PP et al. Improved discrimination of AD patients using beta-amyloid(1-42) and tau levels in CSF. Neurology 1999; 52 : 1555-62.
8. Maeck L, Meller J, Otto M, Stiens G, Wiltfang J, Stoppe G. Abeta peptide 1-42, Tau protein and S-100B protein level in cerebrospinal fluid of three patients with primary progressive aphasia. Neurosci Lett 2002; 333 : 33-6.
9. Andreasen N, Minthon L, Vanmechelen E, Vanderstichele H, Davidsson P, Winblad B et al. Cerebrospinal fluid tau and amyloid beta42 as predictors of development of Alzheimer´s disease in patients with mild cognitive impairment. Neurosci Lett 1999; 273 : 5-8.
10. Sjogren M, Davidsson P, Tullberg M, Minthon L, Wallin A, Wikkelso C et al. Both total and phosphorylated tau are increased in Alzheimer´s disease. J Neurol Neurosurg Psychiatry 2001; 70 : 624-30.
11. Maddalena A, Papassotiropoulos A, Muller-Tillmanns B, Jung HH, Hegi T, Nitsch RM et al. Biochemical diagnosis of Alzheimer disease by measuring the cerebrospinal fluid ratio of phosphorylated tau protein to beta-amyloid peptide42. Arch Neurol 2003; 60 : 1202-6.
12. Hu YY, He SS, Wang X, Duan QH, Grundke-Iqbal I, Iqbal K et al. Levels of nonphosphorylated and phosphorylated tau in cerebrospinal fluid of Alzheimer’s disease patients: an ultrasensitive bienzyme-substrate-recycle enzyme-linked immunosorbent assay. Am J Pathol. 2002; 160 : 1269–78.
13. Pidrman V, Látalová K, Mareš J, Urbánek K, Herzig R, Bekárek V et al. Stanovení tau proteinu a beta-amyloidu jako možných diagnostických markerů demencí. Česk Slov Neurol N 2004; 5 : 330-4.
14. Mareš J, Herzig R, Pidrman V, Urbánek K, Bekárek V, Schneiderka P, et al. Tau protein a beta-amyloid jako diagnostické markery Alzheimerovy demence. Čes a Slov Psychiat 2004; 1 : 31-5.
15. Petrovitch H, White LR, Ross GW, Steinhorn SC, Li CY, Masaki KH et al. Accuracy of clinical criteria for AD in the Honolulu-Asia Aging Study, a population-based study. Neurology 2001; 57 : 226-34.
16. Mathuranath PS, Nestor PJ, Berrios GE, Rakowicz W, Hodges JR. A brief cognitive test battery to differentiate Alzheimer's disease and frontotemporal dementia. Neurology 2000; 55 : 1613-20.
17. Morris JC. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology 1993; 43 : 2412-4.
18. Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S et al. Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria. Neurology 1998; 51 : 1546–54.
19. Bowler JV, Eliasziw M, Steenhuis R, Munoz DG, Fry R, Merskey H et al. Comparative evolution of Alzheimer disease, vascular dementia, and mixed dementia. Arch Neurol. 1997; 54 : 697-703.
20. Hampel H, Burger K, Preussner JC, Zinkowski R, DeBernardis J, Kerkman D et al. Correlation of cerebrospinal fluid levels of tau protein phosphorylated at threonine 231 with rates of hippocampal atrophy in Alzheimer disease. Arch Neurol 2005; 62 : 770-3.
21. Hesse C, Rosengren L, Vanmechelen E, Vanderstichele H, Jensen C, Davidsson P et al. Cerebrospinal fluid markers for Alzheimer's disease evaluated after acute ischemic stroke. J Alzheimers Dis 2000; 2 : 199-206.
22. Perry EK, Morris CM, Court JA, Cheng A, Fairbairn AF, McKeith IG et al. Alteration in nicotine binding sites in Parkinson´s disease, Lewy body dementia and Alzheimer´s disease: possible index of early neuropathology. Neuroscience 1995; 64 : 385-95.
23. Martinez-Yelamos A, Saiz A, Bas J, Hernandez JJ, Graus F, Arbizu T. Tau protein in cerebrospinal fluid: a possible marker of poor outcome in patients with early relapsing-remitting multiple sclerosis. Neurosci Lett 2004; 363 : 14-7.
24. Sjogren M, Vanderstichele H, Agren H, Zachrisson O, Edsbagge M, Wikkelso C et al. Tau and Abeta42 in cerebrospinal fluid from healthy adults 21-93 years of age: establishment of reference values. Clin Chem 2001; 47 : 1776-81.
25. Riemenschneider M, Wagenpfeil S, Diehl J, Lautenschlager N, Theml T, Heldmann B et al. Tau and Abeta42 protein in CSF of patients with frontotemporal degeneration. Neurology 2002; 58 : 1622-8.
26. Hampel H, Teipel SJ. Total and phosphorylated tau proteins: evaluation as core biomarker candidates in frontotemporal dementia. Dement Geriatr Cogn Disord 2004; 17 : 350-4.
27. Sjogren M, Davidsson P, Wallin A, Granerus AK, Grundstrom E, Askmark H et al. Decreased CSF-beta-amyloid 42 in Alzheimer's disease and amyotrophic lateral sclerosis may reflect mismetabolism of beta-amyloid induced by disparate mechanisms. Dement Geriatr Cogn Disord 2002; 13 : 112-8.
28. Sussmuth SD, Tumani H, Ecker D, Ludolph AC. Amyotrophic lateral sclerosis: disease stage related changes of tau protein and S100 beta in cerebrospinal fluid and creatine kinase in serum. Neurosci Lett 2003; 353 : 57-60.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2007 Issue 1
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Diagnostika a léčba karcinózy mening u solidních nádorů
- Tau protein a beta amyloid v likvoru u Alzheimerovy choroby a normy odvozené od kognitivně zdravých kontrol
- Intravenózní trombolytická terapie rekombinantním tkáňovým aktivátorem plazminogenu rt-PA (Actilyse®) – naše první zkušenosti z praxe
- Využití stanovení klusterinu v séru a likvoru v diagnostice postižení CNS – pilotní studie
- Vliv oboustranného zúžení vnitřní krkavice na cerebrovaskulární rezervní kapacitu zadního mozkového povodí
- Huntingtonova nemoc: zkušenosti s genetickým testováním v letech 1994-2005
- Vyšetření vizuálních evokovaných potenciálů a sonografické vyhodnocení orbitální hemodynamiky u akutní unilaterální optické neuritidy
- Neuroendoskopie a matematický model dynamiky mozkových komor
- Syndrom kývavé panenky u supraselárních cyst: výsledky neuroendoskopické léčby u čtyř dětí
- Krvácení do glioblastomu při dopravní nehodě
- Panická porucha – Neuropsychiatrický profil
- Chirurgická léčba metastatického postižení krční páteře
- Kognitivní deficit po léčbě intrakraniálních aneuryzmat
- Využití transkraniálního doppleru k průkazu intrakraniální hypertenze u dětí se skafocefalií
- Prediktivní hodnota ultrasenzitivního C-reaktivního proteinu u cévní mozkové příhody a jeho vztah k ateroskleróze karotid
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Panická porucha – Neuropsychiatrický profil
- Tau protein a beta amyloid v likvoru u Alzheimerovy choroby a normy odvozené od kognitivně zdravých kontrol
- Diagnostika a léčba karcinózy mening u solidních nádorů
- Chirurgická léčba metastatického postižení krční páteře
