Pohybové aktivity pacientů trpících dědičnou polyneuropatií
Movement Activities in Patients with Inherited Polyneuropathy
Inherited polyneuropathy is currently an incurable disease with progressive symptoms affecting young individuals. Complex case management must include education and instruction in appropriate movement and sporting activities. Moderate strengthening exercises have not been found to be harmful and may reduce the progression of muscle paresis while increasing strength and improve the performance of activities of daily living. Customized exercise plans must be regularly rechecked and updated in order to avoid overuse weakness, pain and extreme post-exercise fatigue. The current literature suggests that exercise may be more beneficial if creatine monohydrate peroral supplementation is added to the diet. Current clinical management requires the application of appropriate movement activities for every individual with inherited polyneuropathy, even those whose conditions have progressed to present with extreme disabilities.
Key words:
inherited polyneuropathy – strengthening exercises – sport – creatin monohydrate
:
A. Kobesová 1; R. Mazanec 2
:
Klinika rehabilitace 2. LF UK a FN V Motole, Praha
1; Neurologická klinika dospělých 2. LF UK a FN v Motole, Praha
2
:
Cesk Slov Neurol N 2008; 71/104(3): 277-284
:
Review Article
Dědičná polyneuropatie se manifestuje nejčastěji v dětství nebo dospívání, má progresivní charakter a zatím je kauzálně neléčitelná. V rámci komplexní péče je nutné věnovat dostatečnou pozornost pohybovým a sportovním aktivitám těchto jedinců. Vhodně volená posilovací cvičení a další typy pohybových aktivit nevedou ke zhoršení svalového oslabení, ale naopak mohou zpomalit progresi či dokonce zmírnit stupeň paréz a zlepšit výkon běžných denních činností u pacientů s tímto onemocněním. Nutné je stanovit individuální cvičební plán dle aktuálního stavu, aby cvičení nevedlo k přetížení se zhoršením svalového oslabení, bolestem a prohloubení únavy. Literatura naznačuje, že cvičení může mít lepší efekt při současném perorálním příjmu kreatin monohydrátu. Přiměřený typ pohybových aktivit by měl být doporučen všem pacientům s dědičnou polyneuropatií s různým stupněm postižení.
Klíčová slova:
dědičná polyneuropatie – posilování – sport – kreatin monohydrát
Úvod
Hereditární motorická a senzitivní neuropatie (HMSN) se projevuje pomalu progredujícím svalovým oslabením s predilekcí na dolních končetinách, začíná v dětství či v době dospívání a často je spojena s deformitou nohy [1]. Název HMSN nebo choroba Charcot-Marie-Tooth (CMT), podle autorů, kteří onemocnění jako první popsali [2], dnes označuje skupinu klinicky podobných nemocí, které se odlišují geneticky, elektrofyziologicky a biopticky. Přesná patogeneze ani kauzální terapie dosud není známa [3,4]. HMSN patří mezi nejčastější dědičná nervosvalová onemocnění s prevalencí 1 : 2 500. Odhaduje se, že v České republice žijí přibližně 4 000 osob trpících nějakou formou dědičné neuropatie [5]. Klinický obraz [1–6] je velmi heterogenní, postižení kolísá od rozsáhlého oslabení horních i dolních končetin spojeného s těžkou deformitou nohy, přes mírné oslabení, až po asymptomatické jedince. V objektivním nálezu dominuje postižení motorické, a to hlavně na dolních končetinách, typické jsou atrofie bércového svalstva a deformita nohy, která se projevuje vysokým nártem a zhroucenou příčnou klenbou, kladívkovými prsty, stočením nohy do supinace a varozitou paty. Mění se stereotyp chůze, pacientům přepadává špička (stepáž), což kompenzují zvedáním kolen při chůzi (čapí chůze). Časté jsou distorze kotníků. U necelé poloviny pacientů dochází v důsledku sekundární axonální degenerace k rozvoji oslabení i proximálních svalů se zhoršením motoriky, stability a celkové lokomoce. Dynamiku progrese svalového postižení popisuje funkční klasifikace dle Vinciho do 7 stadií (tab. 1) [7,8]. Jen minimální počet pacientů je postižen do té míry, že nejsou schopni samostatné lokomoce či sebeobsluhy. Poruchy stability jsou následkem senzitivní polyneuropatie (porucha propriocepce i exterocepce), paréz a deformit nohy a jsou přítomny u většiny pacientů [9]. Bolesti páteře jsou velmi časté, výrazně četnější než v normální populaci jsou i strukturální deformity páteře ve smyslu skoliózy či hyperkyfózy [10,11]. Pro atrofii drobných svalů na akru horních končetin vznikají rychle poruchy jemné motoriky [12]. Vzhledem k tomu, že se dědičná neuropatie projevuje často již u mladých pacientů, v rámci rehabilitace a komplexní péče je nutné věnovat dostatečnou pozornost jejich pohybovým a sportovním aktivitám. Přehledný referát shrnuje efekt posilování a aerobních typů cvičení na svalovou sílu, histologické změny ve svalu postiženém polyneuropatií, kardiovaskulární aparát, únavu a kvalitu života jedinců s HMSN.
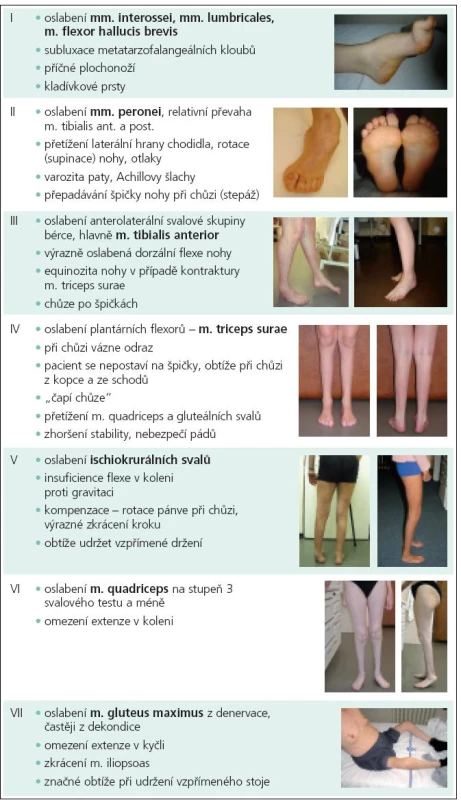
Pohybové aktivity pacientů s HMSN
V literatuře se většinou dočteme, že u svalů primárně oslabených v důsledku denervace, kdy je povaha onemocnění taková, že není pravděpodobný proces reinervace (do této skupiny patří i HMSN), a tedy ani návrat funkce, není posilování proti odporu indikováno [7]. Vzhledem k chronicko-progresivní povaze HMSN nelze očekávat ani částečnou restituci, naopak je pravděpodobné pozvolné zhoršování stavu [1,3,6,7]. Při intenzivním zatěžování paretických svalů dochází k vyčerpání a přetížení, což vede ke zhoršení atrofií a oslabení. Typicky to lze pozorovat na horních končetinách. Pravák automaticky používá více pravou ruku a během let svalové atrofie na pravé ruce progredují rychleji než na ruce levé [13]. Vzniká tzv. overuse weakness, s kterou se setkáváme i u jiných neurologických chorob (poliomyelitis, Duchenneova choroba). Vinci vyšetřil sílu m. abductor pollicis brevis a m. interosseus dorsalis primus u 106 pacientů s HMSN a 48 zdravých jedinců. Porovnával sílu těchto svalů na pravé a levé ruce. U 65,57 % HMSN pacientů byla síla uvedených svalů vyšší na nedominantní ruce, zatímco v kontrolní skupině zdravých jedinců pozoroval tento jev pouze u 1,04 % [13]. Přetěžováním pacient oslabuje svaly již tak paretické a navíc je i ohrožen úrazy mnohem víc než zdravý sportovec. V případě úrazu primárně oslabené svaly hůře regenerují a stav se dále zhoršuje [14]. Naopak řada pacientů má tendenci jakémukoliv cvičení se vyhýbat a inklinuje k sedavému způsobu života. Vzniká tak oslabení a atrofie svalů, které zatím nejsou základní chorobou postiženy, tzv. disuse atrophy, a dochází tak k celkovému zhoršení fyzické kondice.
Řada studií sleduje změnu síly a trofiky neurogenně oslabených svalů po pravidelném posilování. Výsledky se výrazně odlišují. Signifikantní nárůst svalové síly prokazuje studie zaměřená na trénink a posilování proximálních svalů dolních končetin (DK) [15]. Po pravidelném posilování proti odporu po dobu 24 týdnů došlo u skupiny 29 pacientů s HMSN k nárůstu síly maximální volní kontrakce při extenzi v koleni o 25 %. To je v souladu se skutečností, že u HMSN jsou nejdříve a nejvíce postiženy dlouhé nervy DK zásobující distální svaly končetin. Postižení kořenového svalstva je podstatně vzácnější, a pokud se dostavuje, tak až v pozdějších fázích nemoci [7,8]. Proto lze očekávat zlepšení trofiky a síly při posilování proximálních svalů, na rozdíl od svalů bérce a nohy. U většiny pacientů s HMSN je ale síla proximálních svalů dostatečná a není proto nutné jejich posilování. Pokud klinicky zjistíme oslabení kořenových svalů, např. časté bývá oslabení m. gluteus maximus a medius, není to obvykle v důsledku neuropatie samé, ale jedná se o parézu funkční, tj. v důsledku vadných pohybových stereotypů, které jsou odpovědí na staticko-dynamickou poruchu distálně. K normalizaci svalové síly gluteálního svalstva většinou dojde, jakmile zlepšíme poměry na periferii, například stabilizujeme hlezno ortézou nebo adekvátní úpravou obuvi [16]. Milner-Brown a Miller uvádějí hypotézu, že efekt cvičení je závislý na síle svalu před započetím tréninku [17]. Pokud je sval již oslaben do té míry, že zvládání běžných denních aktivit je pro něj maximální zátěž (méně než 15 % normy svalové síly pro daný sval), nemůžeme očekávat zlepšení po pravidelném cvičení proti odporu. Zlepšení ale může nastat u svalů, které jsou před tréninkem oslabeny pouze mírně. Svalová vlákna, která zatím nejsou postižena denervací, reagují na posílení hypertrofií a to se projeví zvýšením svalové síly. V úvahu musíme brát fakt, že excentrické cvičení (sval se během kontrakce prodlužuje) je náročnější než koncentrická kontrakce (při aktivní činnosti svalu dochází k jeho zkracování). V případě příliš velké zátěže může mít opakovaná excentrická kontrakce i na zdravý sval devastující účinek [18–20]. Během nadměrné excentrické kontrakce dochází i u zdravého svalu k mikrotraumatizaci sarkolemy [21] s následnou infiltrací svalu albuminem [22]. Sarkolema netrénovaného svalu je mnohem více citlivá na mikrotraumatizaci než sarkolema svalu trénovaného. Reparativní procesy u zdravého svalu probíhají automaticky, při závažné mikrotraumatizaci může dojít k nekróze svalových vláken se spuštěním zánětlivé kaskády a následnou postupnou plnou regenerací poškozených svalových vláken. Proces autoreparace ale nemusí být dokonalý u svalů primárně postižených patologickým procesem. Zvýšená citlivost k nadměrné mechanické zátěži byla též pozorována u svalů jedinců v dekondici v důsledku sedavého stylu života [23], což je u pacientů s HMSN častý jev.
Chetlin et al sledovali efekt domácího progresivního posilování o nižší až střední intenzitě 3krát týdně po dobu 12 týdnů [24]. Zajímalo je, zda takový pohybový program ovlivní svalovou sílu a výkon ADL (activities of daily living – běžné denní činnosti) u 20 pacientů s HMSN. Autoři vycházeli z výsledků podobných studií [25,26], které naznačují, že progresivní posilování o nižší až střední intenzitě má minimální riziko úrazu, nezpůsobuje svalové bolesti ani diskomfort a zaručuje maximální spolupráci pacienta. Pacienti 3krát týdně posilovali extenzory a flexory kolene proti odporu odpovídajícímu 40–50 % maximální izometrické síly a extenzi a flexi v lokti oproti 20–30 %. Dále posilovali ruce pomocí opakovaných stisků měkkých terapeutických míčků. Kompliance pacientů ve studii byla 87% bez ohledu na pohlaví. Po ukončení cvičebního programu se zlepšila síla u sledovaných svalových skupin, stejně jako výkon ADL (měřeno jako rychlost vstávání ze sedu a z polohy vleže). Stejný kolektiv autorů později sledoval efekt 12týdenního posilování o stejném protokolu se současným perorálním příjmem kreatin monohydrátu [27]. Kreatin monohydrát je fyziologická substance, která hraje důležitou roli v energetickém metabolizmu svalu, jeho perorální příjem u zdravých jedinců zvyšuje sílu maximální svalové kontrakce a urychluje svalovou restituci po zátěži. Řada studií naznačuje, že perorální příjem kreatin monohydrátu může mít pozitivní terapeutický efekt u pacientů trpících neuromuskulárními chorobami včetně HMSN [28–31]. Naopak ale studie Dohertyho et al konstatuje, že samotná suplementace kreatinem bez současného pohybového režimu svalovou sílu u pacientů s HMSN neovlivňuje [32]. Cílem studie Chetlina et al bylo zjistit, zda kombinace pravidelného cvičení a současné suplementace kreatinem zlepší svalovou sílu, morfologii svalového vlákna (zjišťováno svalovou biopsií z oblasti dolní třetiny m. vastus lat) a výkon ADL. Do dvojitě slepé kontrolované studie bylo zařazeno 20 pacientů s HMSN. 10 pacientů denně užívalo 5 g kreatin monohydrátu p.o. po dobu 12 týdnů a současně 3krát týdně cvičili dle předepsaného protokolu. Pacienti v kontrolní skupině 3krát týdně cvičili podle stejného protokolu a užívali placebo. V histologickém obrazu fyziologického svalu nacházíme vlákna hypertrofická, atrofická a hlavně normální, tj. přiměřené trofiky [33]. U HMSN pacientů je typická změna histologického obrazu s větším zastoupením vláken atrofických. Takový nález udávají i autoři této studie před započetím tréninku. Po ukončení tréninku byla zjištěna hypertrofie vláken typu I v obou skupinách, počet atrofických vláken se snížil a byl stejného procentuálního zastoupení jako v normálním svalu. Užívání kreatinu nemělo celkově žádný vliv na svalovou sílu, i když v této skupině některé testy prokázaly výraznější zvýšení svalové síly než ve skupině beroucí placebo. Výsledky ale nebyly statisticky signifikantní. U obou skupin bylo zjištěno signifikantní zlepšení v testech ADL. Autoři konstatují, že program pravidelného domácího posilování oproti malým odporům signifikantně zlepšil svalovou sílu a výkon běžných denních činností. Během cvičení žádný z pacientů neudával výraznější subjektivní obtíže, např. bolesti pohybového aparátu či extrémní únavu. Histologicky se adaptace svalových vláken na trénink projevila hypertrofií vláken typu I, což je typické i pro normální sval [34]. Tato adaptace je spíše závislá na počtu opakování než na odporu, proti kterému je sval posilován. Taktéž v oblasti ruky došlo po cvičení ke zlepšení svalové síly (hand-grip), což autoři uvádí jako důležitý důkaz toho, že i atrofický sval může být u HMSN pacientů posílen, pokud je cvičen adekvátně. To, že kreatin neměl vliv na zlepšení svalové práce, autoři vysvětlují tím, že dávka 5 g p.o. za den nemusí mít dostatečný terapeutický efekt a doporučují v příštích studiích vyšší dávky (10 g/den). Histologickou adaptaci svalových vláken na stejný protokol posilování v domácím prostředí a současný perorální příjem kreatinu sledovala studie Smithe et al [35]. Před započetím programu a po jeho ukončení byla provedena biopsie z m. vastus lat. Autory zajímalo, zda se po kombinovaném 12týdenním programu změní histologický obraz svalu ve smyslu hypertrofie svalových vláken typu I a zda se změní zastoupení různých izoforem kontraktilních proteinů, konkrétně těžkých myozinových řetězců (MHC - Myosin Heavy Chains). Myozin je hlavní kontraktilní protein, který hraje důležitou roli v procesu svalové kontrakce. Proces adaptace na trénink se projevuje fyziologicky změnou poměrného zastoupení jednotlivých izoforem MHC. Do dvojité slepé randomizované studie Smith et al zařadili 18 pacientů. Ve skupině, která užívala 5 g kreatinu denně, zjistili po ukončení studie snížení obsahu MHC typu I a zvýšení MHC typu II, což byl výsledek, který koreloval s rychlejším vstáváním ze židle, a to autoři považují za důkaz zlepšení svalové práce. Uzavírají, že kombinace cvičení a užívání kreatinu potenciálně ovlivňuje syntézu proteinů ve svalu a hraje důležitou roli v zastoupení jednotlivých MHC izoforem ve svalu, jejichž složení může pozitivně ovlivnit svalovou funkci jedinců trpících HMSN.
Dále bude mít na kvalitu a efekt pohybových aktivit pacienta s polyneuropatií vliv, zda provozuje typ pohybu či sporty, které se naučil v časném mládí, dříve než se svalové atrofie a poruchy koordinace objevily. Flexibilita centrálního nervového systému i motorického systému je u člověka obrovská. Při progresivním pomalém zhoršování jak somatosenzorických vstupů, tak vlastní svalové práce, zůstává kvalita zafixovaných motorických stereotypů dlouho zachována v téměř optimální formě. Tento jev nazýváme procesem adaptace. Prokazuje to i studie Muldera et al [36]. U 10 pacientů s HMSN posuzovali kvalitu různě náročných pohybových stereotypů. Zjistili, že kvalita je zachována, pokud se jedná o dobře známé, dávno naučené a často opakované, třebaže koordinačně náročné stereotypy. Výkon se však rapidně zhoršoval, pokud byli pacienti vyzváni, aby předvedli nějaký nový pohybový vzor. Kupodivu na kvalitu zažitých pohybových vzorů neměla zásadní vliv ani optická deprivace. Pacienti s nedostatkem senzorických vstupů v důsledku neuropatie typicky kompenzují tento deficit vizuální kontrolou. Zejména stabilita se proto zhoršuje za šera či ve tmě. V uvedené studii se však kvalita naučených stereotypů nezhoršila, ani když měl pacient zavřené oči. V praxi z toho plyne, že je vhodnější pacienta nechat rekreačně sportovat třeba i koordinačně náročnější typ sportu, pokud je na něj dlouhodobě zvyklý a provozuje ho pravidelně, než ho přesvědčovat ke změně a k tomu, aby začal se sportem novým, který se nám zdá z medicínského hlediska vhodnější (např. cyklistika, plavání). Další práce, která se zabývá otázkou pohybového režimu u pacientů trpících neuromuskulárním onemocněním (NMD - Neuro-Muscular Disease) je práce Kilmera [37]. Excesivní zátěž zdravého svalu zprvu vede ke katabolickým reakcím s porušením (drobnými trhlinami) svalových vláken. Zdravý sval se na tento stav adaptuje syntézou nových myofibrilárních proteinů, změnou v transportním systému kyslíku a zvýšením počtu mitochondrií. Výsledkem je hypertrofie svalových vláken se schopností odolávat zvýšené zátěži. Otázkou samozřejmě je, zda má cvičení stejný pozitivní efekt u pacientů trpících neuromuskulárními chorobami, mezi které HMSN patří. Ačkoliv se svalová hypertrofie jeví jako rozhodující mechanizmus zvýšení svalové síly v důsledku dlouhodobého posilování (zátěže), zvýšení svalové síly se objevuje záhy po započetí pravidelného tréninku, dříve než může k hypertrofii svalových vláken dojít. Toto zvýšení svalové síly bez adekvátní strukturální změny je připisováno neurální adaptaci, tj. efektivnějšímu náboru motorických jednotek, zlepšení intra - i intersvalové koordinace a lepší aktivaci svalů, které jsou pro daný pohyb primární. Důležitou roli hraje také proces učení. Jsou to mechanizmy zahrnující i centrální řízení motoriky, které není u HMSN pacientů poškozeno. Pro důležitou roli aktivace na centrální úrovni svědčí též studie Lindemana et al [38]. Pomocí povrchové elektromyografie sledovali efekt cvičení proti odporu u proximálních svalů DK u 29 HMSN pacientů. Kontrolní měření prokázala postupný nárůst hodnoty maximální izometrické kontrakce celkem o 21 % za dobu 24 týdnů. K největšímu nárůstu svalové síly ovšem došlo během prvních 8 týdnů (o 20 %) cvičení, což autoři přisuzují právě neurální adaptaci. Zbylý, již minimální nárůst svalové síly je pak nejspíše v důsledku hypertrofie svalové tkáně.
Jedinci s NMD mají často sedavý styl života, tendenci k obezitě, větší riziko rozvoje kardiovaskulárních chorob, hypertenze a diabetu [39]. Jednou z příčin takového životního stylu může být u pacientů s HMSN to, že první symptomy onemocnění se objevují v dětství a časném mládí, což je doba, kdy většina zdravých jedinců začíná sportovat a osvojuje si pravidelnou fyzickou aktivitu jako návyk. Rodiče, učitelé i lékaři mohou dítě odradit od sportovních aktivit v dobrém úmyslu, aby se nezranilo nebo si nezhoršilo příznaky choroby. Důsledkem pak může být progrese svalového oslabení z inaktivity, ale také nedostatek motorických dovoleností a poruchy koordinace, které se automaticky při sportu v dětství a mládí učíme. Další příčinou nedostatku pohybových aktivit může být i to, že jedinci s NMD jsou častěji nezaměstnaní, mají nižší finanční příjem než zdravá populace, čímž mohou mít limitovaný přístup k některým druhům sportů [40].
Na základě dalších studií [41,42] Kilmer [37] doporučuje HMSN pacientům domácí program cvičení proti mírnému odporu, kdy není signifikantně zvýšené riziko úrazu a nebyl pozorován žádný nežádoucí vedlejší efekt cvičení. Rytmické, repetitivní aerobní cvičení o mírné až střední intenzitě je dostatečný stimulus pro oslabený svalový systém i systém kardiopulmonální. Za jeden z nejdůležitějších efektů cvičení proti mírnému odporu Kilmer považuje snížený pocit únavy, který má vliv na zvýšení pracovní kapacity, zlepšení výkonu ADL a kvalitu života. Literatura udává, že více než 64 % pacientů trpících nějakou formou NMD trpí únavovým syndromem [43]. Příčinou mohou být změny jak na centrální, tak i periferní úrovni. Používá se termínu experienced fatigue a physiological fatigue. Experienced fatigue označuje obtíže při iniciaci volní svalové kontrakce [44]. Krupp a Pollina tento druh únavy definují jako zdrcující pocit únavy, nedostatek energie a pocit celkové exhausce. Tento fenomén neznačí svalovou slabost a nemusí korelovat se známkami únavy fyziologické [45]. Physiological fatigue je fyziologickým projevem cvičení a je definována jako redukce svalové síly při maximální volní svalové kontrakci [46]. Tento typ únavy má periferní a centrální komponentu podle toho, zda ztráta schopnosti generovat maximální svalovou sílu vzniká na úrovni svalové tkáně nebo nervového systému. Během udržované maximální svalové kontrakce u zdravých jedinců pozorujeme jak periferní, tak centrální únavu [47]. Výskyt centrální únavy znamená, že se během kontrakce zhoršuje centrální aktivace. V poslední době byla u řady NMD zjištěna právě porucha na úrovni centrální, souvislost s únavou ale nebyla zatím potvrzena [48–51]. Redukovat vysokou úroveň centrální únavy lze pomocí pravidelného aerobního tréninku [52,53], je ale třeba nastavit úroveň tréninku individuálně tak, abychom excesivní fyzickou aktivitou nezhoršili svalové atrofie a slabost [54]. Porucha centrální aktivace během maximální volní kontrakce může být pro pacienta problém, ale na druhou stranu může mít i pozitivní efekt v tom, že brání excesivní svalové aktivaci, která by mohla již tak oslabený a atrofický sval poškodit. Proto je třeba únavu tolerovat. Zpočátku kratší cvičební jednotky s menším počtem opakování jednotlivých cviků a proti nižšímu odporu postupně prodlužujeme, zvyšujeme počet opakování v každé cvičební jednotce, ev. i stupeň zátěže. Správně „nastavený“, graduovaný cvičební plán pacienti dobře tolerují a v řadě studií udávají, že pravidelné cvičení snižuje celkový subjektivní pocit únavy [37,52,53].
Otázce konkrétních typů sportů, které jsou, či naopak nejsou pro pacienty s HMSN vhodné, se odborná literatura a výzkum bohužel příliš nevěnuje. Sledujeme-li však internetové stránky či literaturu určenou pacientům trpícím dědičnou neuropatií, zjistíme, že otázka výběru sportu je pro ně velmi důležitá. V roce 1994 zpracoval Sampson 400 dotazníků, které hodnotily pohybové a sportovní aktivity u pacientů s HMSN [55]. Více než 50 % respondentů uvedlo, že se aktivně podílejí na nějakém sportovním programu. Většina preferovala cvičení v interiéru a cvičební program měli pacienti obvykle individuálně upravený, hromadným sportům, jako je např. basketbal, se vyhýbali. Drtivá většina sportovně aktivních jedinců uvedla, že cvičení je pro ně přínosem a pomáhá jim udržovat svalovou sílu a zlepšuje kvalitu jejich života. Jen minimum respondentů naopak vnímalo cvičení jako škodlivé vzhledem k jejich diagnóze. Otázkou ovšem zůstává, zda tito jedinci provozovali vhodný cvičební program. Menší část respondentů provozovala pravidelně nějaký druh sportu, zcela nejpopulárnějším typem bylo plavání, dále převažovaly méně dynamické sporty jako je bowling, rybaření či golf. Téměř 100 % respondentů uvedlo, že by je zajímal edukační sportovní program zaměřený na jejich základní diagnózu, tj. takový, který by jim pomáhal udržet pocit zdraví a nebyl vyčerpávající. Většina dotazovaných uvedla, že má obtíže při chůzi a nemůže běhat, pouze několik jedinců mohlo pomalu klusat a ještě méně pravidelně běhalo. Většina pacientů se obávala sportu zejména proto, že mají nestabilní kotníky, poruchu citlivosti na DK a poruchy stability, což by mohlo vést ke zranění. Nikdo z dotazovaných neměl pocit výborné stability. Autor diskutoval výsledky této dotazníkové studie s neurology a ortopedy. Ti jednoznačně považovali pohybový program pro pacienty s dědičnou neuropatií za přínosný či dokonce nutný, s tím, že musí být individuálně přizpůsoben schopnostem daného jedince. Internetové stránky určené pacientům s HMSN doporučují cvičení všem [56]. Netrénovaným jedincům s mírným stupněm postižení doporučují pravidelné plavání a jízdu na rotopedu. Pravidelné aerobní cvičení je důležité v prevenci obezity, v prevenci progrese svalových atrofií z inaktivity, osteoporózy, napomůže v udržení či zlepšení kardiálních a plicních funkcí, prodlouží vytrvalost ve fyzických aktivitách, zmírní pocit chronické únavy, zlepší kvalitu spánku, apetit, psychický stav a snižuje incidenci některých typů nádorových onemocnění. Jako základní orientační ukazatel adekvátní zátěže při aerobním cvičení doporučují pacientovi kontrolu pulzu. Za ideální je považován výsledek vzorce 60–70 % z 220 - věk (příklad: je-li pacientovi 50 let: 220 - 50 = 170 × 0,6 = 102 pulzů). Pokud tuto úroveň zátěže jedinec zvládá bez obtíží, může ji postupně zvýšit na 80 %. Za účelem zvýšení svalové síly doporučují submaximální posilování, které pro pacienty definují jako posilování oproti takové zátěži, kterou je pacient schopen zvednout minimálně 15 až 20krát. Set 15–20 opakování by pro každý segment měl cvičenec provádět nejprve jednou, postupně může počet setů pro každý segment zvyšovat, ale jen do úrovně, kdy ještě po cvičení nemá pocit vyčerpání. Pokud druhý den pocítí svalovou bolest či dokonce oslabení, je to známka příliš vysoké zátěže a na intenzitě je nutné ubrat. I pacient na vozíku by měl mít cílený pohybový režim. Těžce postižení pacienti mohou zvládat cvičení v bazénu, prvky jógy nebo tai-chi, které lze cvičit i vsedě. Pacientům je doporučováno, aby se nevyhýbali ani posilování oblastí, kde byla provedena transpozice šlach [57]. Nejčastěji se transponuje úpon m. tibialis anterior nebo m. tibialis posterior tak, aby substituovaly nedostatečnou dorzální flexi a everzi při oslabení peroneálních svalů [58]. Při provozování pohybových aktivit je nutné zajistit adekvátní protetické vybavení, které může výrazně zlepšit postavení nohy, a tím stabilitu hlezna i stabilitu celkovou, stejně jako kvalitu pohybových vzorů [9] Proteticky správně zajištěný pacient (obr. 1, 2) pak může být schopen i podstatně náročnějších pohybových a sportovních aktivit.
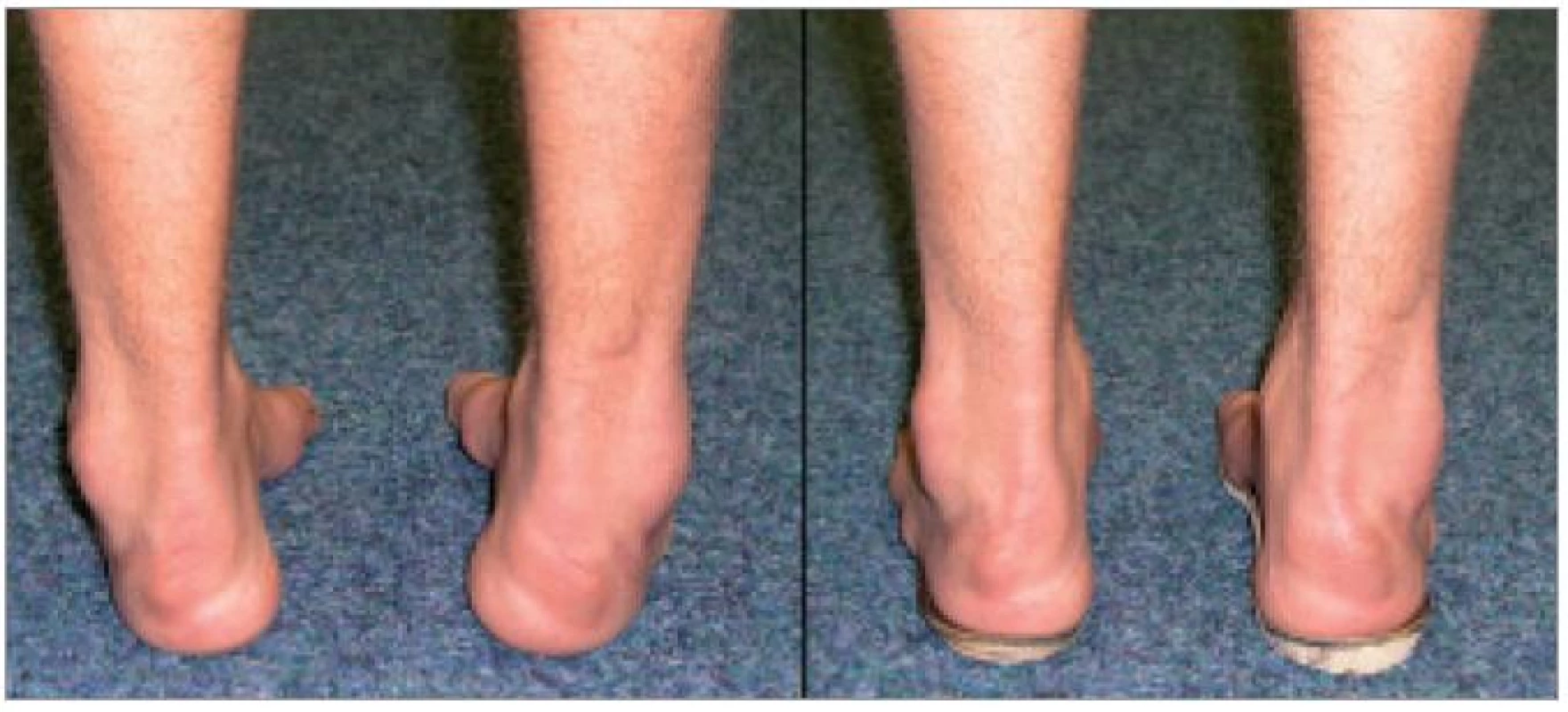
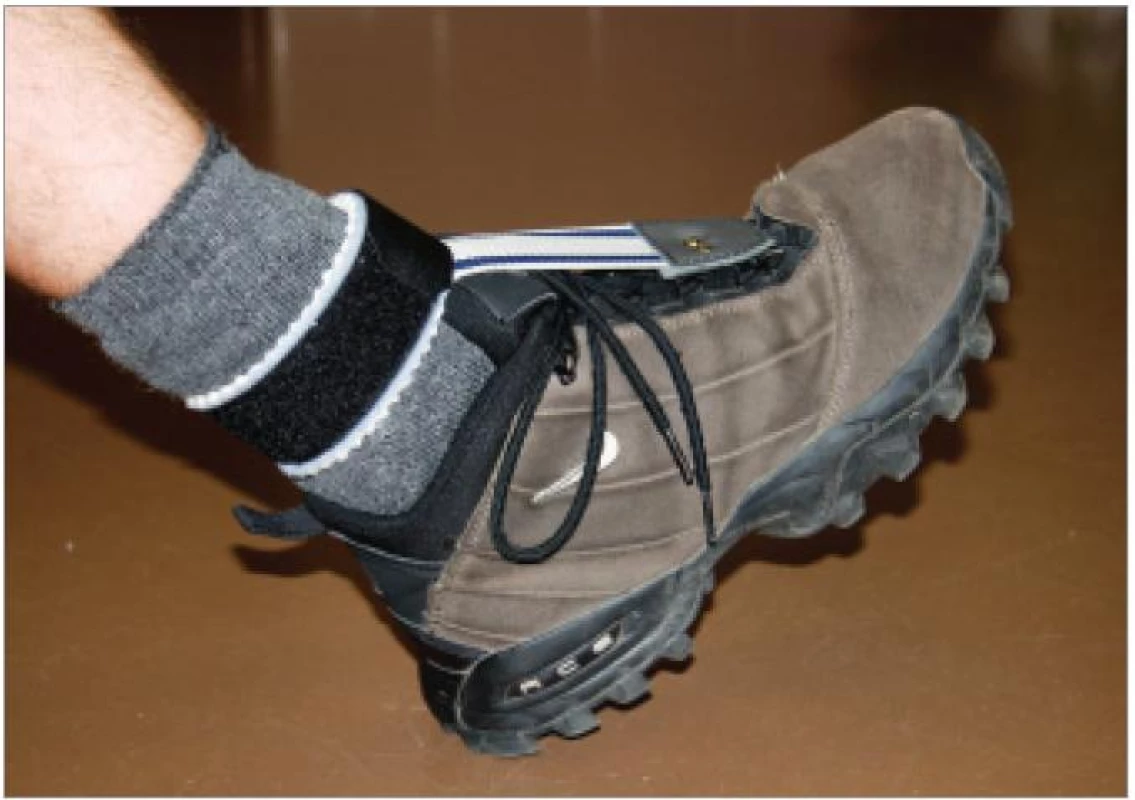
Závěr
Otázka sportovních aktivit a adekvátní zátěže je u pacientů s dědičnou neuropatií velmi diskutabilní. Vědecké práce, kterých není mnoho, se věnují téměř výhradně vlivu posilování na svalovou trofiku. Většina těchto studií svědčí pro pozitivní efekt adekvátního posilovacího programu, některé naznačují větší účinnost při současném perorálním užívání kreatin monohydrátu. Otázkou výběru sportu se vědecké studie příliš nezabývají, i když z literatury určené pacientům je zřejmé, že pro pacienty je to téma velmi důležité a aktuální. Při prostudování dostupné literatury lze shrnout, že přiměřený stupeň posilování či jiných sportovních pohybových aktivit by měl být doporučen všem pacientům s HMSN, a to i těm, kteří jsou výrazně postiženi. Pacienta je nutné pro sport odborně proteticky vybavit. Preferovány jsou spíše aerobní typy sportů a takové sporty (plavání, jízda na kole), které minimalizují riziko úrazu (distorze kotníků), ke kterým jsou pacienti s HMSN náchylní. Další výzkum zabývající se sportovními aktivitami pacientů s dědičnou neuropatií je nezbytný.
Vytvořeno s podporou výzkumného záměru VZ 00064203/6506 a grantu IGA - NR/9517-3.
MUDr. Alena Kobesová
Klinika rehabilitace 2. LF UK a FN V Motole
V Úvalu 84
150 06 Praha 5
e-mail: alenamudr@klakson.cz
Přijato k recenzi: 7. 2. 2008
Přijato do tisku: 8. 4. 2008
Sources
1. Dyck PJ, Chance P, Lebo R. Hereditary motor and sensory neuropathies. In: Dyck PJ, Thomas PK, Griffin JW (Eds). Peripheral Neuropathy. 3rd ed. Philadelphia: W.B. Saunders Company 1993 : 1094–1136.
2. Smith AG. Charcot-Marie-tooth disease. Arch Neurol 2001; 58(6): 1014–1016.
3. Shy ME. Charcot-Marie-Tooth disease: an update. Curr Opin Neurol 2004; 17(5): 579–585.
4. Züchner S, Vance JM. Mechanisms of disease: a molecular genetic update on hereditary axonal neuropathies. Nat Clin Pract Neurol 2006; 2(1): 45–53.
5. Haberlová J, Mazanec R, Seeman P. Dědičné periferní neuropatie. Neurol pro Praxi 2006; 3 : 147–152.
6. Harding AE, Thomas PK. The clinical features of hereditary motor and sensory neuropathy types I and II. Brain 1980; 103(2): 259–280.
7. Vinci P. Rehabilitation management of Charcot-Marie-Tooth disease. Italy: Spazio Immagine Editore 2001.
8. Kobesová A, Horáček O. Možnosti rehabilitace u pacientů s chorobou Charcot-Marie-Tooth. Rehab Fyz Lék 2002; 9(1): 23–30.
9. Kobesová A, Smetana P, Suzan J, Smetana V, Baránková L, Horáček O. Zásady protetické péče u pacientů s hereditární motoricko-senzorickou neuropatií (HMSN). Rehab Fyz Lék 2004; 11(4): 169–175.
10. Horacek O, Mazanec R, Morris CE, Kobesova A. Spinal deformities in hereditary motor and sensory neuropathy: a retrospective qualitative, quantitative, genotypical, and familial analysis of 175 patients. Spine 2007; 32(22): 2502–2508.
11. Horáček O, Mazanec R, Kobesová A, Seeman P. Deformity páteře u hereditární motoricko-senzitivní neuropatie. Cesk Slov Neurol N 2005; 68/101(2): 109–115.
12. Vinci P, Villa LM, Castagnoli L, Marconi C, Lattanzi A, Manini MP et al. Handgrip impairment in Charcot-Marie-Tooth disease. Eura Medicophys 2005; 41(2): 131–134.
13. Vinci P, Esposito C, Perelli SL, Antenor JA, Thomas FP. Overwork weakness in Charcot-Marie-Tooth disease. Arch Phys Med Rehabil 2003; 84(6): 825–827.
14. Quintart C, Baillon JM, Libotte M. Pathologic fracture of the tibia associated with Charcot-Marie-Tooth Disease. Acta Orthop Belg 1999; 65(1):105–108.
15. Lindeman E, Spaans F, Reulen J, Leffers P, Drukker J. Progressive resistance training in neuromuscular patients. Effects on force and surface EMG. J Electromyogr Kinesiol 1999; 9(6): 379–384.
16. Vinci P. Strengthening of the proximal muscles in Charcot-Marie-Tooth disease. Arch Phys Med Rehabil 2001; 82(4): 563.
17. Milner-Brown HS, Miller RG. Muscle strengthening through high-resistance weight training in patients with neuromuscular disorders. Arch Phys Med Rehabil 1988; 69(1): 4–9.
18. Kilmer DD. The role of exercise in neuromuscular disease. Phys Med Rehabil Clin N Am 1998; 9(1): 115–125.
19. Clarkson PM. Exercise-induced muscle damage-animal and human models. Med Sci Sports Exerc 1992; 24(5): 510–511.
20. Clarkson PM, Sayers SP. Etiology of exercise-induced muscle damage. Can J Appl Physiol 1999; 24(3): 234–248.
21. McNeil PL, Ito S. Molecular traffic through plasma membrane disruptions of cells in vivo. J Cell Sci 1990; 96(Pt 3): 549–556.
22. McNeil PL, Khakee R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. Am J Pathol 1992; 140(5): 1097–1109.
23. Carter GT, Abresch RT, Fowler WM jr. Adaptations to exercise training and contraction-induced muscle injury in animal models of muscular dystrophy. Am J Phys Med Rehabil 2002; 81(Suppl 11): S151–S161.
24. Chetlin RD, Gutmann L, Tarnopolsky M, Ullrich IH, Yeater RA. Resistance training effectiveness in patients with Charcot-Marie-Tooth disease: recommendations for exercise prescription. Arch Phys Med Rehabil 2004; 85(8): 1217–1223.
25. Aitkens SG, McCrory MA, Kilmer DD, Bernauer EM. Moderate resistance exercise program: its effect in slowly progressive neuromuscular disease. Arch Phys Med Rehabil 1993; 74(7): 711–715.
26. Kilmer DD. Response to resistive strengthening exercise training in humans with neuromuscular disease. Am J Phys Med Rehabil 2002; 81(Suppl 11): S121–S126.
27. Chetlin RD, Gutmann L, Tarnopolsky MA, Ullrich IH, Yeater RA. Resistance training exercise and creatine in patients with Charcot-Marie-Tooth disease. Muscle Nerve 2004; 30(1): 69–76.
28. Klivenyi P, Ferrante RJ, Matthews RT, Bogdanov MB, Klein AM, Andreassen OA et al. Neuroprotective effects of creatine in a transgenic animal model of amyotrophic lateral sclerosis. Nat Med 1999; 5(3): 347–350.
29. Matthews RT, Yang L, Jenkins BG, Ferrante RJ, Rosen BR, Kaddurah-Daouk R et al. Neuroprotective effects of creatine and cyclocreatine in animal models of Huntington's disease. J Neurosci 1998; 18(1): 156–163.
30. Tarnopolsky M, Martin J. Creatine monohydrate increases strength in patients with neuromuscular disease. Neurology 1999; 52(4): 854–857.
31. Wyss M, Felber S, Skladal D, Koller A, Kremser C, Sperl W. The therapeutic potential of oral creatine supplementation in muscle disease. Med Hypotheses 1998; 51(4): 333–336.
32. Doherty TJ, Lougheed K, Markez J, Tarnopolsky MA. Creatine monohydrate does not increase strength in patients with hereditary neuropathy. Neurology 2001; 57(3): 559–560.
33. Silbernagl S, Despopoulos A. Atlas fyziologie člověka. 6th ed. Praha: Grada 2004.
34. Taaffe DR, Pruitt L, Pyka G, Guido D, Marcus R. Comparative effects of high - and low-intensity resistance training on thigh muscle strength, fiber area, and tissue composition in elderly women. Clin Physiol 1996; 16(4): 381–392.
35. Smith CA, Chetlin RD, Gutmann L, Yeater RA, Alway SE. Effects of exercise and creatine on myosin heavy chain isoform composition in patients with Charcot-Marie-Tooth disease. Muscle Nerve 2006; 34(5): 586–594.
36. Mulder T, den Otter R, van Engelen B. The regulation of fine movements in patients with Charcot Marie Tooth, type Ia: some ideas about continuous adaptation. Motor Control 2001; 5(2): 200–214.
37. Kilmer DD. The role of exercise in neuromuscular disease. Phys Med Rehabil Clin N Am 1998; 9(1): 115–125.
38. Lindeman E, Spaans F, Reulen J, Leffers P, Drukker J. Progressive resistance training in neuromuscular patients. Effects on force and surface EMG. J Electromyogr Kinesiol 1999; 9(6): 379–384.
39. McCrory MA, Kim HR, Wright NC, Lovelady CA, Aitkens S, Kilmer DD. Energy expenditure, physical activity, and body composition of ambulatory adults with hereditary neuromuscular disease. Am J Clin Nutr 1998; 67(6): 1162–1169.
40. Fowler WM Jr, Abresch RT, Koch TR, Brewer ML, Bowden RK, Wanlass RL. Employment profiles in neuromuscular diseases. Am J Phys Med Rehabil 1997; 76(1): 26–37.
41. Vignos PJ jr. Physical models of rehabilitation in neuromuscular disease. Muscle Nerve 1983; 6(5): 323–338.
42 Aitkens SG, McCrory MA, Kilmer DD, Bernauer EM. Moderate resistance exercise program: its effect in slowly progressive neuromuscular disease. Arch Phys Med Rehabil 1993; 74(7): 711–715.
43. Van Engelen BG, Kalkman JS, Schillings ML, Van Der Werf SP, Bleijenberg G, Zwarts MJ. Fatigue in neuromuscular disease. Ned Tijdschr Geneeskd 2004; 148(27): 1336–1341.
44. Chaudhuri A, Behan PO. Fatigue in neurological disorders. Lancet 2004; 363(9413): 978–988.
45. Krupp LB, Pollina DA. Mechanisms and management of fatigue in progressive neurological disorders. Curr Opin Neurol 1996; 9(6): 456–460.
46. Gandevia SC. Spinal and supraspinal factors in human muscle fatigue. Physiol Rev 2001; 81(4): 1725–1789.
47. Schillings ML, Hoefsloot W, Stegeman DF, Zwarts MJ. Relative contributions of central and peripheral factors to fatigue during a maximal sustained effort. Eur J Appl Physiol 2003; 90(5–6): 562–568.
48. Di Lazzaro V, Oliviero A, Tonali PA, Felicetti L, De Marco MB, Saturno E et al. Changes in motor cortex excitability in facioscapulohumeral muscular dystrophy. Neuromuscul Disord 2004; 14(1): 39–45.
49. Liepert J, Schoser BG, Weiller C. Motor excitability in myopathy. Clin Neurophysiol 2004; 115(1): 85–89.
50. Oliveri M, Brighina F, La Bua V, Aloisio A, Buffa D, Fierro B. Magnetic stimulation study in patients with myotonic dystrophy. Electroencephalogr Clin Neurophysiol 1997; 105(4): 297–301.
51. Lee MJ, Nelson I, Houlden H, Sweeney MG, Hilton-Jones D, Blake J et al. Six novel connexin32 (GJB1) mutations in X-linked Charcot-Marie-Tooth disease. J Neurol Neurosurg Psychiatry 2002; 73(3): 304–306.
52. Shield A, Zhou S. Assessing voluntary muscle activation with the twitch interpolation technique. Sports Med 2004; 34(4): 253–267.
53. Lindeman E, Spaans F, Reulen J, Leffers P, Drukker J. Progressive resistance training in neuromuscular patients. Effects on force and surface EMG. J Electromyogr Kinesiol 1999; 9(6): 379–384.
54. Fowler WM jr. Role of physical activity and exercise training in neuromuscular diseases. Am J Phys Med Rehabil 2002; 81(Suppl 11): S187–S195.
55. Sampson R. CMT and Exercise. Lindacrabtree [online]. 2006. Dostupné z: <http://www.lindacrabtree.com/cmtnews/Exercise/Sampson%20questionnaire.htm>.
56.Crabtree L, Carter G. Exercise, weight loss and CMT. Lindacrabtree [online]. 2006. Dostupné z: <http://www.lindacrabtree.com/cmtnews/Exercise/Dr.%20Carter%20interview.html>.
57. Rugo PE. Charcot-Marie-Tooth Disease and Exercise. Lindacrabtree [online]. 2006. Dostupné z: <http://www.lindacrabtree.com/cmtnews/Exercise/Exercise%20Methods.htm>.
58. Kobesová A, Horáček O, Mazanec R, Smetana P, Truc M, Bojar M. Dědičné neuropatie – mezioborová diagnóza. Postgraduální medicína 2007; 9(2): 139–147.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2008 Issue 3
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Smell Perception Testing in Early Diagnosis of Neurodegenerative Dementia
- Pulse Wave Analysis in Objective Evaluation of Pain – a Preliminary Communication
- Quality of Life in Patients after Subarachnoid Haemorrhage – Follow-up after One Year
- Retrospective Analysis of Visual Evoked Potentials Findings in Acute Retrobulbar Neuritis
- Laboratory Markers of Neurodegneration in Cerebrospinal Fluid and Degree of Motor Involvement in Parkinson Disease: A Correlation Study
- Guidelines for Secondary Prevention of Recurrence after an Acute Cerebral Stroke: Cerebral Infarction/Transitory Ischaemic Attack and Haemorrhagic Stroke
- Cervical Intervertebral Disc Degeneration – Surgical Treatment Indications and Options
- Depersonalization and Derealization – Contemporary Findings
- Sexual Dysfunction in Women with Epilepsy and their Causes
- Movement Activities in Patients with Inherited Polyneuropathy
- Association of Selected Risk Factors with the Severity of Atherosclerotic Disease at the Carotid Bifurcation
- The Function of the Right Ventricle and the Incidence of Pulmonary Hypertension in Patients with Obstructive Sleep Apnoea Syndrome
- Total and Phosphorylated Tau-protein and Beta-Amyloid42 in Cerebrospinal Fluid in Dementias and Multiple Sclerosis
- Migraine in Pregnancy
- Sporadic Guam Parkinsonian Complex or the Co-incidence of Several Neurodegenerative Conditions?
- The Use of Diffusion Tensor Imaging in Neuronavigation during Brain Tumor Surgery: Case Reports
- Management of Ischaemic Stroke and Transient Ischaemic Attack – Guidelines of the European Stroke Organisation (ESO) 2008 – Abbreviated Czech Version
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Depersonalization and Derealization – Contemporary Findings
- Cervical Intervertebral Disc Degeneration – Surgical Treatment Indications and Options
- Migraine in Pregnancy
- Movement Activities in Patients with Inherited Polyneuropathy
