Přesnost farmakogenetických algoritmů pro výpočet denní dávky warfarinu
Accuracy of Pharmacogenetic Algorithms in Predicting Warfarin Daily Dose
Introduction:
Warfarin is used in a wide range of doses and requires frequent INR monitoring with respective dose adjustment. Intra - individual variability of warfarin dose is determined by the individual genotype and CYP2C9 and VKORC1 gene polymorphisms. Pharmacogenetic algorithms could be used to predict the daily dose of warfarin even before the initiation of warfarin treatment.
Aim of study:
To assess frequency of CYP2C9 and VKORC1 polymorphism in the Czech population and to compare empirical daily dose of warfarin with the dose predicted by three previously published pharmacogenetic algorithms.
Methods:
CYP2C9 (alleles *1, *2 and *3) and VKORC1 (haplotypes A and B) genotyping was performed in 1,972 patients. Accuracy of warfarin daily dose prediction was assessed in a cohort of 280 patients with complete relevant clinical data and on a stable dose of warfarin.
Results:
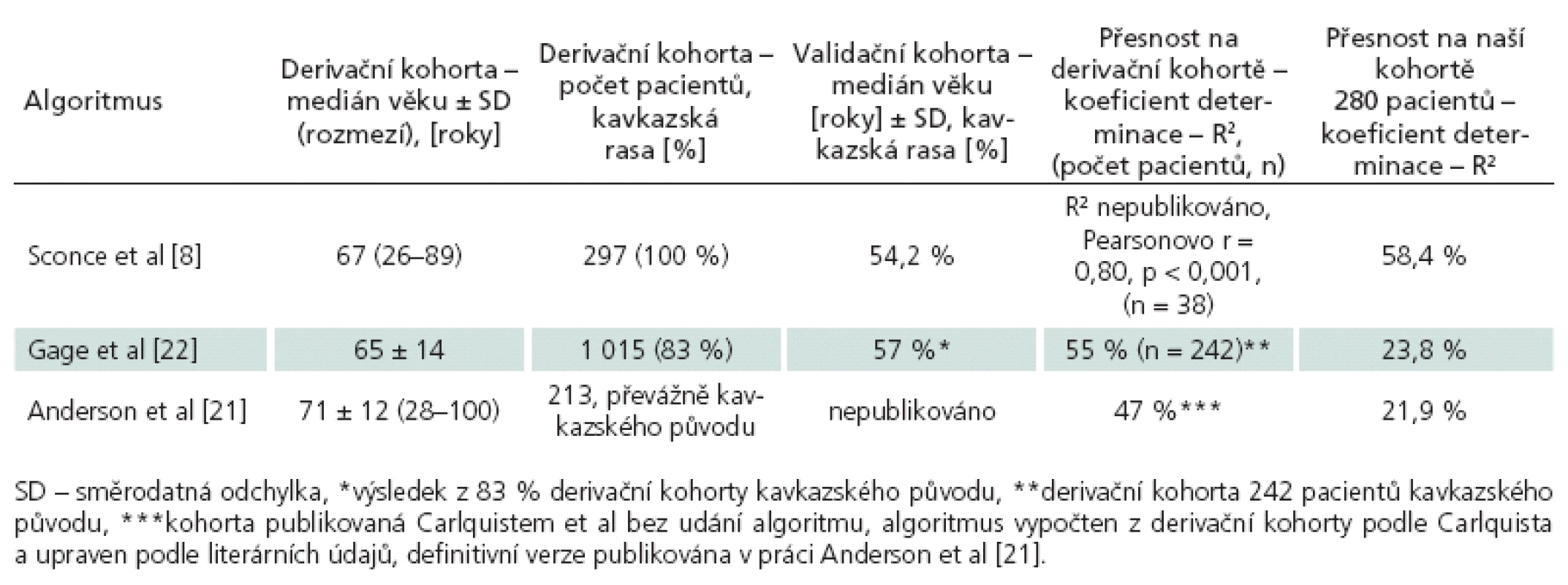
The heterozygous form of the variant genotype of CYP2C9 (reduced warfarin metabolism) was present in 11.6% of patients in our cohort, the homozygous form was found in 1.1%. VKORC1 haplotype A/ A (lower sensitivity for warfarin) was present in 14% of the cohort. Standard expected mean dose of warfarin was used by patients with no (29.2%) or 1 variant allele (41.5%). Coefficients of determination (R2) of the respective assessed algorithms were: Anderson 21.9%, Gage 23.8% and Sconce 58.4%.
Conclusion:
The algorithm by Sconce et al provided the highest agreement between the predicted and empirical daily dose, with 4 - fold higher probability that the predicted dose will be ±20% of the empirical dose compared to other assessed algorithms. Pharmacogenetic algorithms were found to be useful in patients of all body weight categories and in patients older than 80 years but not in patients younger than 40 years.
Key words:
warfarin – pharmacogenetics – CYP2C9 protein – VKORC1 protein
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
A. Tomek 1,2; T. Kolářová 2; Z. Lacinová 2; S. Martinková 2; M. Šrámek 1; I. Šarbochová 1; J. Neumann 3; L. Táborský 2; V. Maťoška 2
Authors‘ workplace:
Neurologická klinika 2. LF UK a FN v Motole, Praha
1; Laboratoř molekulární genetiky, OKBHI, Nemocnice Na Homolce, Praha
2; Neurologické oddělení, Krajská zdravotní, a. s. – Nemocnice Chomutov, o. z.
3
Published in:
Cesk Slov Neurol N 2013; 76/109(5): 596-602
Category:
Original Paper
Podpora: rezortní program TIP Ministerstva průmyslu a obchodu ČR – FR-TI 1/399.
Overview
Úvod:
Při léčbě warfarinem je zapotřebí užívat široké rozpětí dávky k udržení terapeutického INR s nutností častých kontrol a následných korekcí. Na individuální senzitivitě se mimo negenetických faktorů podílí individuální genetická výbava – polymorfizmy genů CYP2C9 a VKORC1. Na základě farmakogenetiky je možné před zahájením terapie odhadnout výpočtem individuální dávku warfarinu.
Cíl:
Ověřit rozložení polymorfizmů genů CYP2C9 a VKORC1 v české populaci a srovnat skutečnou denní dávku warfarinu s dávkou vypočtenou pomocí tří publikovaných farmakogenetických algoritmů.
Soubor a metodika:
Genotypizace CYP2C9 a VKORC1 byla provedena u 1 972 pacientů. Přesnost výpočtu dávky byla ověřena na souboru 280 pacientů se známou stabilizovanou dávkou warfarinu. Byla provedena genotypizace polymorfizmů ovlivňujících dávku warfarinu (alely *1, *2 a *3 CYP2C9, haplotypy A a B genu VKORC1). Od pacientů byly získány údaje relevantní pro výpočet dávky warfarinu podle porovnávaných algoritmů a skutečně užívaná dávka warfarinu.
Výsledky:
Variantní genotyp CYP2C9 spojený se sníženou metabolizací warfarinu byl v populační kohortě přítomen následovně: heterozygoti 11,6 %, homozygoti 1,1 %. Haplotyp A/ A VKORC1 spojený s vyšší citlivostí na warfarin byl zastoupen ve 14 %. Standardní očekávatelnou dávku warfarinu mají pacienti s žádnou (29,2 %) nebo jednou variantní alelou (41,5 %). Hodnoty koeficientu determinace (R2) jednotlivých algoritmů byly: podle Andersona 21,9 %, Gage 23,8 % a Sconceové 58,4 %.
Závěr:
Největší přesnosti dosahuje na naší kohortě algoritmus Sconceové, kdy má pacient 4krát větší šanci, že vypočtená dávka bude ± 20 % skutečné dávky proti ostatním algoritmům. Použití farmakogenetických algoritmů je přesné u pacientů všech váhových kategorií, pacientů nad 80 let, není však výhodné u pacientů do 40 let věku.
Klíčová slova:
warfarin – farmakogenetika – protein CYP2C9 – protein VKORC1
Úvod
Warfarin zůstává v ČR první volbou mezi antikoagulačními léky u pacientů s kardioembolickým iktem. Tuto pozici si u nás, i přes rapidní nástup nových antikoagulancií (dabigatran, rivaroxaban, v tomto roce výhledově i apixaban), udrží ještě nejméně několik let. Důvodem jsou aktuálně platná pravidla úhrady dabigatranu a rivaroxabanu zdravotními pojišťovnami, kdy je nejdříve nutné vyzkoušet warfarin a teprve po jeho selhání je možné nasadit nové antikoagulans. Nutnou podmínkou je vždy pečlivá klinická praxe se snahou o vysoký čas v terapeutickém rozmezí, adekvátní zahajovací dávka, správná frekvence kontrol INR a optimálně i využití pokročilejších technik – selfmonitoringu INR a farmakogenetiky. Navíc pokud dosáhneme nejméně 70 % času v terapeutickém rozmezí (2,0 až 3,0), pak je efektivita warfarinu shodná s novými perorálními antikoagulancii [1].
Klíčový moment warfarinizace, kdy je velký prostor pro zásadní komplikace, představuje právě okamžik hledání správné dávky warfarinu a její stabilizace. Denní dávka warfarinu se u jednotlivých pacientů velmi liší (od 0,5 do 25 mg). Podkladem odlišností jsou za prvé faktory negenetické (věk, pohlaví, výška, váha, renální a hepatální funkce, lékové interakce, aktuální vyladění koagulační kaskády a další), které vysvětlují 30 – 50 % variability, a za druhé faktory genetické. Vliv genetiky na denní dávku byl studován u nejméně 40 genů, největší vliv je však přisuzován genům CYP2C9 a VKORC1, které vysvětlí asi 40 až 60 % variability dávky.
CYP2C9
Gen CYP2C9 kóduje jeden z enzymů systému cytochromu P450, izoenzymu 2C9, který určuje rychlost odbourávání warfarinu (farmakokinetika). V naší populaci převládá alela *1 v homozygotní formě *1/ *1. Variantní alely *2 a *3 genu CYP2C9 jsou signifikantně spojeny s nižší než obvyklou dávkou warfarinu [2,3], častějším INR nad terapeutickým rozmezím, vyšší pravděpodobností předávkování [2,4], delším časem nad terapeutickým rozmezím [5], delším časem k dosažení stabilizace dávky [2] a vyšším rizikem krvácivých komplikací [2,6,7].
VKORC1
Gen VKORC1, který kóduje podjednotku 1 enzymového komplexu vitamin‑K - epoxidreduktázy (cílový enzym blokovaný warfarinem), a určuje tak individuální „citlivost“ na podaný warfarin (farmakodynamika). Variantní haplotyp genu VKORC1 (haplotyp A, vysoká senzitivita na warfarin) je významně spojen s nižší dávkou warfarinu [8 – 11] a méně významně s kratším časem k dosažení terapeutického rozmezí s pravděpodobnějším předávkováním [5,12]. Riziko krvácivých komplikací pro nosiče haplotypu A je v různých studiích nevýznamně vyšší nebo shodné oproti nosičům nejčastějšího haplotypu indoevropské populace AB [5,12,13]. Vzácné bodové mutace v genu VKORC1 (kodony 29, 45, 58, 66, 128) jsou odpovědné za farmakodynamický typ rezistence na warfarin, který je obyčejně definován jako denní dávka vyšší než 25 mg a současně zvýšená sérová koncentrace warfarinu pro dosažení terapeutického rozmezí [14,15]. Populační frekvence těchto mutací není přesně známa, ale jedná se o velmi vzácný stav popsaný jen v individuálních případech.
Celkově můžeme najít v populaci 18 různých kombinací polymorfizmů CYP2C9 (*1, *2 a *3) a haplotypů VKORC1 (AA, A/ B a B/ B). Toto rozdělení na 18 podskupin je však dosti nepraktické, a je tak snaha o zjednodušení využitelné v klinické praxi. Podíváme‑li se na počet variantních alel obou genů (CYP2C9 a VKORC1), současně pak můžeme rozdělit všechny pacienty podle celkového počtu variantních alel obou genů. Logicky tak má každý pacient nula až čtyři variantní alely (dvě kopie každého genu od obou rodičů). Nejvíce redukovanou dávku warfarinu – typicky kolem 1 mg denně – mají nosiči čtyř variantních alel.
Můžeme použít tři základní strategie nasazení warfarinu:
- empirické nasazení základní dávkou (2,5 či 5 nebo 10 mg) v prvních dnech s následnými korekcemi podle INR,
- odhad dávky podle algoritmu využívajícího klinická data pacienta (věk, komorbidity atp.) a
- odhad dávky podle individuálního farmakogenetického profilu pacienta.
Hlavním cílem farmakogenetického vyšetření je stanovení odhadu denní dávky warfarinu ještě před zahájením vlastní léčby. K tomuto cíli lze použít tři základní postupy. Prvním jsou dávkovací tabulky, v nichž pokud známe genotyp pacienta, najdeme rozmezí, kde se s různě vysokou pravděpodobností bude nacházet denní dávka individuálního pacienta (např. pro genotyp CYP2C9 *1/ *1 a VKORC A/ B: 5 až 7 mg denně). Tento postup (včetně dávkovací tabulky) doporučuje např. americká FDA. Přesnost této predikce však patří k nejnižším z uvedených postupů, např. v práci Finkelmana et al [16] dosáhla tabulka úspěšné predikce (± 20 % denní dávky) jen u 43 % pacientů.
Druhým postupem je využití farmakogenetického algoritmu, tj. regresní analýzou vytvořeného komplexního vzorce, kde pro výpočet odhadované denní dávky dosazujeme klinická a genetická data jednotlivého pacienta. Takovýchto algoritmů byla publikována celá řada a používají odlišné vstupní parametry. Mezi nejčastěji užívané vstupní klinické charakteristiky pacientů patří dobře kvantifikovatelné parametry, jako jsou pohlaví, věk, výška a váha. V různé míře byly zkoušeny i další, již hůře kvantifikovatelné parametry, jako jen např. přítomnost renálního či hepatálního onemocnění nebo užívání léků ovlivňujících dávku warfarinu (induktory nebo inhibitory jaterního cytochromu P450). Přesnost predikce jednotlivých algoritmů je udávána hodnotou koeficientu determinace (R2), která může nabývat hodnoty od 0 % (absolutní chyba) do 100 % (zcela přesný odhad). U publikovaných vzorců se hodnota R2 pohybuje od 31 do 62 % [17].
Třetím postupem, který však ztrácí hlavní půvab metodiky (tj. predikce ještě před zahájením léčby), ale zato dosahuje nejvyšší přesnosti, je provedení výpočtu farmakogenetickým algoritmem až po několika dnech od zahájení léčby. Dosazujeme do výpočtu „průběžný mezivýsledek INR“ (např. po třech dnech podávání warfarinu), což nám umožní započítat aktuální reakci pacienta na podaný warfarin ještě před dosažením stabilizace dávky. Tento postup obejde problém špatně kvantifikovatelných vstupních charakteristik pacienta: celkové aktuální naladění stavu koagulace, dietární obsah vitaminu K, úroveň jaterního metabolizmu, individuální vstupní hladiny koagulačních faktorů a jiné. Znalost průběžného INR vede k vyšší přesnosti výpočtu, R2 se pohybuje od 69 do 72 % [18,19], ale nezabrání významnému předávkování pacientů s velmi nízkou dávkou v prvních dnech léčby.
Cíl práce
Cílem naší studie bylo:
- ověřit populační rozložení variant genů odpovědných za denní dávku warfarinu, tj. alel genu CYP2C9 a haplotypů genu VKORC1 v české populaci a
- porovnat přesnost a klinický přínos vybraných publikovaných farmakogenetických algoritmů na našem souboru pacientů se známou, empiricky získanou a stabilizovanou dávkou warfarinu.
Soubor a metodika
V roce 2007 jsme zavedli molekulárně genetické vyšetření genů CYP2C9 a VKORC1. Genomová DNA byla izolována z žilního náběru pomocí izolačního kitu (PUREGENE – Blood Kit, Qiagen Inc., Chatsworth, California, USA). Genomová DNA byla amplifikována polymerázovou řetězovou reakcí (MultiGene, Labnet International, Inc., New Jersey, USA) s využitím kitového master mixu (katalogové č. HRLS ‑ ASY ‑ 0006, Idaho Technology Inc., Utah, USA), primerů a sond námi vyvinutých specificky pro detekci alel *2 a *3 genu CYP2C9 a komerčně dostupného kitu pro detekci polymorfizmu – 1639 - A>G (kat. č. HRLS ‑ ASY ‑ 007, HRLS ‑ ASY ‑ 0010, HRLS ‑ ASY ‑ 0011, Idaho Technology Inc., Utah, USA). Genotypizace byla provedena technikou HRM (High Resolution DNA Melting) na systému LightScanner (Idaho Technology Inc., Utah, USA). Pacienti, u nichž byl nasazován warfarin, byli indikováni k vyšetření ze zúčastněných pracovišť (FN v Motole, Nemocnice Na Homolce, Nemocnice Chomutov, o. z.).
Byla vytvořena počítačová databáze pro zadávání klinických dat pacientů. Klinické údaje (celkem více než 150 položek) zahrnovaly mj. věk, výšku, váhu, indikace léčby, komorbidity – např. hypertenze, DM, onkologická onemocnění, renální a hepatální onemocnění aj., souběžnou další medikaci, dotazník na příjem vitaminu K v potravě, veškeré údaje spojené s léčbou warfarinem – denní dávku, počet změn této dávky, výsledky INR. Klinická data byla získávána při pravidelných kontrolách, procházením nemocničních informačních systémů anebo strukturovaným telefonickým dotazníkem.
Soubor pro vstupní analýzu čítal 1 972 pacientů s provedeným testem DNA. Do souboru pro vlastní analýzu přesnosti algoritmů bylo zařazeno 280 pacientů s kompletními klinickými údaji, kteří navíc splňovali kritérium stabilizace na léčbě. Stabilita byla definována jako léčba nejméně 90 dnů a zároveň poslední dva následné náběry INR v terapeutickém rozmezí (pro laboratorní chybu definováno jako 1,8 až 3,2) v odstupu nejméně 30 dnů na stejné denní dávce warfarinu. Jiná selekce nebyla uplatněna.
Volba mezi nám dostupnými publikovanými farmakogenetickými algoritmy (celkem 16 algoritmů) byla učiněna na základě jejich publikované přesnosti na daném validizačním souboru (co nejvyšší hodnota R2) a také podle etnicity validizačního souboru, kdy pro významnou odlišnost mezi jednotlivými etniky byly vybrány jen algoritmy pro populaci kavkazského typu. Pro porovnání přesnosti byly zvoleny tři následující algoritmy využívající pouze vstupní data dostupná ještě před zahájením vlastní warfarinizace:
- podle Sconceové et al [8]: √denní dávka, mg = (0,628 – (0,0135 × [věk, roky]) – (0,24 × [CYP2C9*2, počet alel 0 – 2]) – (0,37 × [CYP2C9*3, počet alel 0 – 2]) – (0,241 × [VKORC, 1 – 3 podle haplotypu]) + (0,0162 × [výška, cm]))
- podle Gage et al [20]: denní dávka, mg = exp (0,9751 − 0,3238 × [VKORC, haplotyp 0 – 2 podle haplotypu] + 0,4317 × [povrch těla, m2] −0,4008 × [CYP2C9*3, počet alel 0 – 2] – 0,00745 × věk [roky] – 0,2066 × [CYP2C9*2, počet alel 0 – 2] + 0,2029 × cílové INR – 0,2538 × [amiodaron, 0 nebo 1] + + 0,0922 × [kouření, 0 nebo 1] – – 0,0901 × [afroamerická rasa, 0 nebo 1] + 0,0644 × [DVT/ PE, 0 nebo 1]
- podle Andersona et al [21]: týdenní dávka, mg = 1,64 × expe [3,984 ++ CYP2C9*1/ *2 × ( – 0,197) + + CYP2C9*1/ *3 × ( – 0,360) + + CYP2C9*2/ *3 × ( – 0,947) + + CYP2C9*2/ *2 * ( – 0,265) + + CYP2C9*3/ *3 * ( – 1,892) + + VKORC1 - CT × ( – 0,304) + + VKORC1 - TT × ( – 0,569) + věk, roky × ( – 0,009) + mužské pohlaví (0,094) + váha, kg (0,003)]
Vlastní porovnání algoritmů jsme provedli následujícími způsoby:
- lineární regresní analýzou s výpočtem koeficientu determinace (R2) mezi hodnotami dávky warfarinu skutečně užívanými a vypočtenými jednotlivými algoritmy,
- porovnáním počtu pacientů s odchylkou dávky skutečně užívané a predikované algoritmem, která byla menší nebo větší než 20 % užívané dávky s využitím McNemarovy modifikace chí ‑ kvadrát testu s výpočtem poměru šancí (OR, Odds Ratio) jednotlivých pacientů na přítomnost jejich predikované hodnoty v takto definovaných pásmech. V případě odchylky mimo pásma nás zajímal poměr pacientů poddávkovaných či předávkovaných podle algoritmu,
- porovnáním přítomnosti skutečně užívané dávky v pásmu predikovaném na základě výpočtu pro dávku warfarinu pro INR rozmezí 1,7 až 3,3 (porovnání viz bod 2). Toto pásmo uvádíme i v klinické praxi pro lékaře používající farmakogenetické algoritmy k nasazení warfarinu a jeho výpočet je založen na korekci podle Gage et al [20].
Mimo porovnání pro celý soubor jsme provedli dále arbitrárně definované podskupinové analýzy přesnosti jednotlivých algoritmů pro pacienty s obecně obtížnou warfarinizací v klinické praxi – do 40 let věku, starší 80 let, lehčích než 60 kg a těžších než 100 kg a pro skupiny pacientů s atypicky nízkou a vysokou dávkou warfarinu (< 2,5 mg a > 10 mg denně).
Všechny dávky byly porovnávány na základě vypočtené denní dávky – u pacientů užívajících nestejnou denní dávku a v případě Andersonova algoritmu, kdy je vypočtena týdenní dávka. Pro adekvátní srovnání mezi algoritmy byly upraveny algoritmy podle Sconceové a Andersona na základě výsledků Gage et al [22] o korekci pro dopočet cílového INR, které je jinak těmito vzorci počítáno pro INR 2,5. Pokud však pacient má jiné cílové INR (např. při mechanické chlopenní náhradě), byl výpočet navýšen o 11 % dávky pro vzestup INR o 0,5 podle Gage et al [20].
Statistické analýzy byly provedeny v softwaru GraphPad Prism, v.4.0 (GraphPad Software, La Jolla, California, USA) a SPSS Statistics, v.18.0 (SPSS, Inc., Chicago, Illinois, USA).
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v r. 2000.
Výsledky
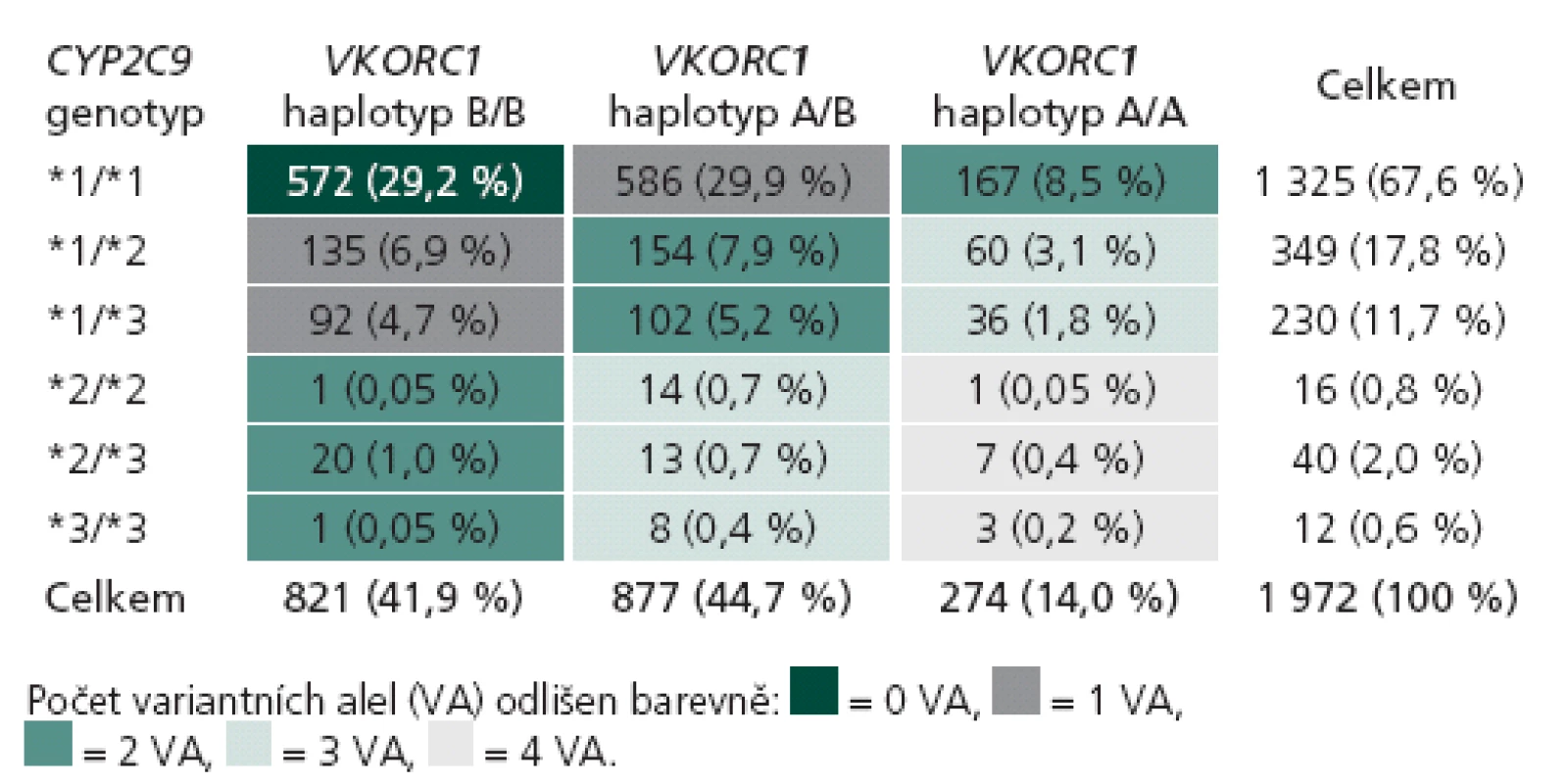
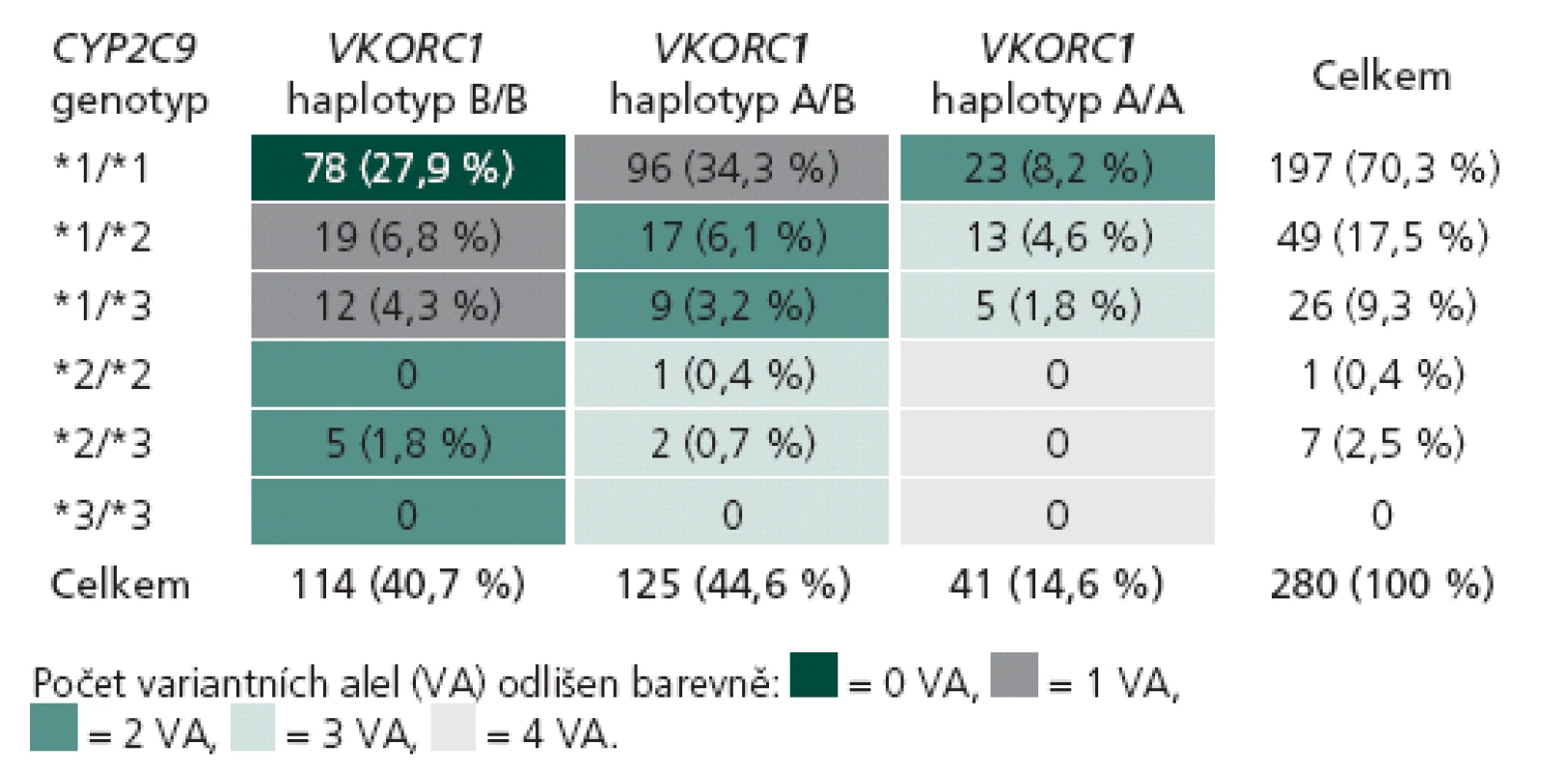
Rozložení genotypů CYP2C9 a VKORC1 v české populaci získané analýzou 1 972 pacientů je uvedeno v tab. 1. V genu CYP2C9 je nejčastější nosičství alely *1 v homozygotní formě (67,6 %), které odpovídá standardní metabolizaci warfarinu. Variantní alely *2 a *3 (se sníženou schopností metabolizovat warfarin) jsou nejčastější v heterozygotní formě jako *1/ *2 (6,9 %) a *1/ *3 (4,7 %). Homozygoti pro variantní alely genu CYP2C9 (*2/ *2, *2/ *3 a *3/ *3) jsou zastoupeni jen v 1,1 %. Nejčastějším haplotypem genu VKORC1 je v české populaci haplotyp A/ B, který nese 44,7 % populace s intermediární citlivostí na warfarin. Druhým nejčastějším je haplotyp B/ B (41,9 %), jenž je odpovědný za sníženou citlivost na warfarin. Haplotyp A/ A je zastoupen ve 14 % a je spojen s vyšší citlivostí na podaný warfarin. Klíčovým údajem je dále individuální kombinace variant obou genů, kterou můžeme vyjádřit počtem variantních alel (VA) od žádné do čtyř. Standardní očekávatelnou dávku warfarinu mají pacienti s žádnou nebo jednou variantní alelou, kterých je v české populaci 29,2 % (0 VA) a 41,5 % (1 VA). V naší kohortě 280 pacientů se stabilní dávkou užívali pacienti bez variantního genotypu průměrně 6,7 ± 0,3 mg warfarinu denně, pacienti s 1 VA užívali 4,9 ± 0,2 mg denně. Nižší než obvyklou denní dávku užívali pacienti se 2 VA (3,8 ± 0,3 mg) a 3 VA (2,9 ± 0,3 mg). V naší populační kohortě bylo 22,7 % pacientů se 2 VA, 6,7 % se 3 VA a pouze 0,65 % se 4 VA. Žádný pacient se 4 VA nebyl zařazen do kohorty pro porovnání algoritmů, ale jejich obvyklá denní dávka warfarinu se podle našich zkušeností pohybuje kolem 1 mg denně (pro detaily tab. 2).
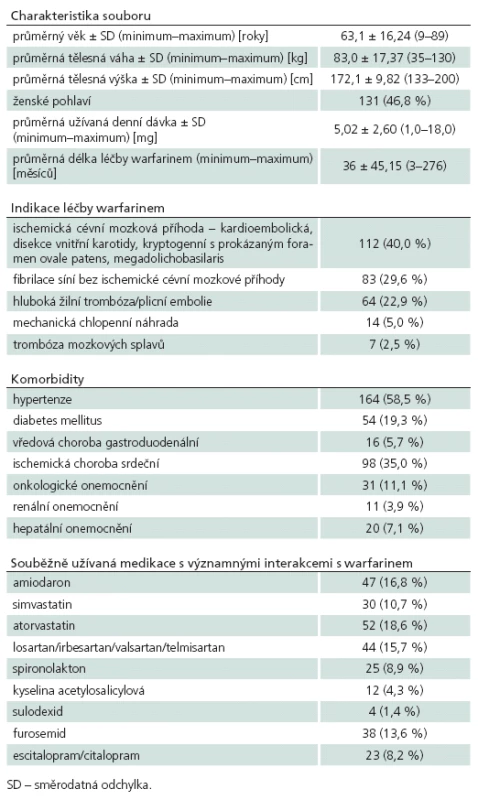
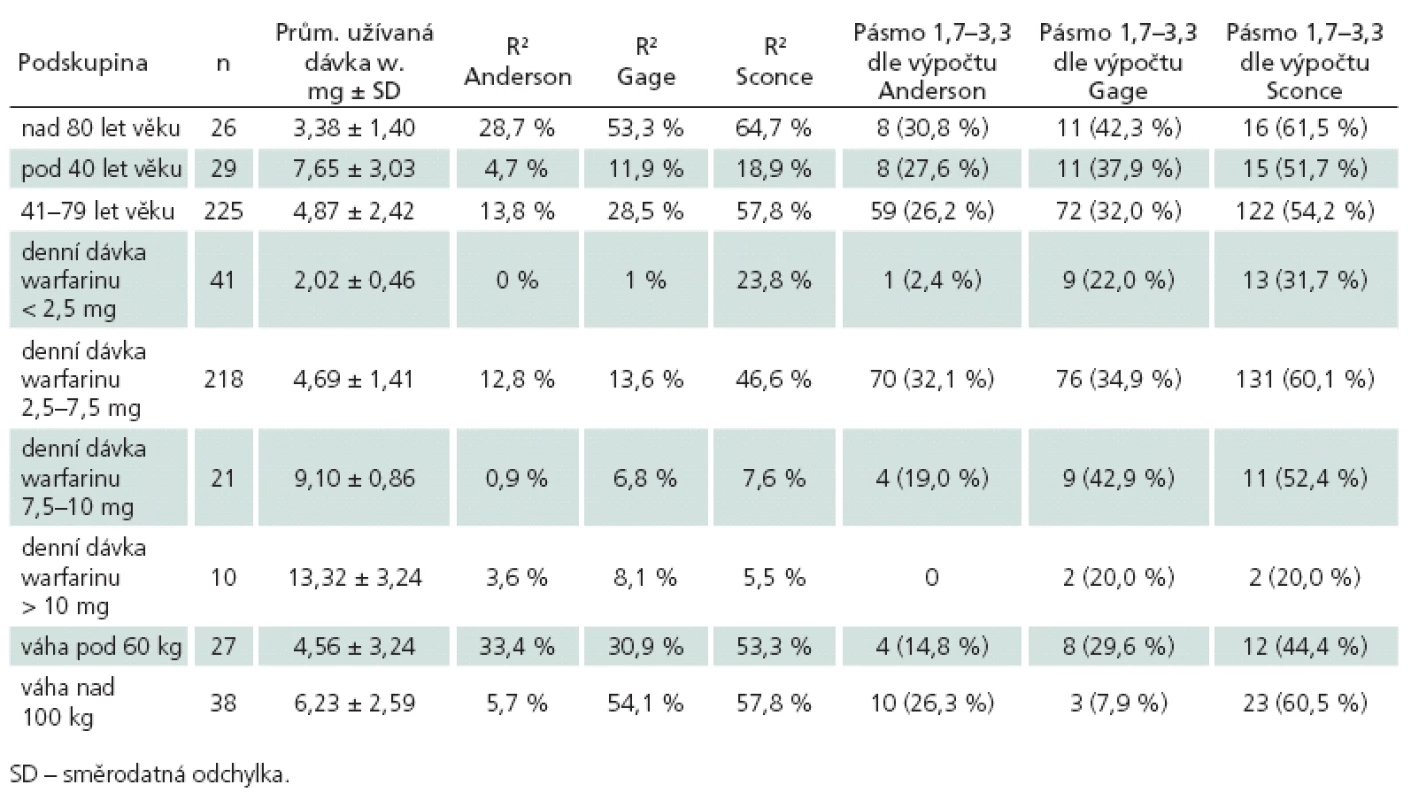
Porovnání přesnosti jednotlivých farmakogenetických algoritmů bylo provedeno na kohortě 280 pacientů se známou stabilní dávkou warfarinu, jejich klinické charakteristiky jsou uvedeny v tab. 3. Hlavním parametrem porovnání přesnosti predikce je hodnota koeficientu determinace R2, kde nejvyšší přesnosti dosáhl algoritmus podle Sconceové (58,4 %). Oba zbylé algoritmy měly jasně nižší přesnost predikce – podle Andersona 21,9 % a podle Gage 23,8 %. Druhým parametrem srovnání byla přítomnost algoritmem predikované dávky v pásmu vymezeném ± 20 % skutečně užívané denní dávky. Nejpřesnější algoritmus podle Sconceové správně predikoval u 168 (60,0 %) pacientů. Předávkováno by bylo 71 (25,4 %) pacientů, tj. vypočtená dávka byla větší než skutečně užívaná. Průměrná chyba byla 1,53 ± 0,83 mg, chyba do 2 mg byla u 87,5 % předávkovaných. Genotyp předávkovaných pacientů byl následující: 0 VA 15 (21,1 %), 1 VA 31 (43,7 %), 2 VA 18 (25,4 %) a 3 VA 7 (9,9 %). Poddávkováno (vypočtená nižší než skutečně užívaná) bylo 41 (14,6 %) pacientů, a to průměrně 2,79 ± 2,18 mg. U 46,3 % poddávkovaných byla chyba do 2 mg. Genotyp poddávkovaných pacientů byl: 0 VA 15 (36,6 %), 1 VA 15 (36,6 %), 2 VA 8 (19,5 %) a 3 VA 3 (7,3 %). Algoritmus podle Andersona správně předpověděl dávku u 91 (32,5 %) pacientů, předávkoval 152 (54,3 %) pacientů, a to o průměrných 2,3 ± 0,99 mg. U 45,4 % předávkovaných pacientů byla chyba do 2 mg. Poddávkováno bylo 37 (13,2 %) pacientů o průměrných 3,4 ± 2,5 mg, z toho 35,1 % do 2 mg. Algoritmus podle Gage správně předpověděl dávku u 103 (36,7 %) pacientů. Předávkováno bylo 144 (51,4 %) pacientů o průměrných 3,0 ± 2,5 mg (do 2 mg byla chyba u 38,2 % předávkovaných). Poddávkováno bylo 33 pacientů o průměrných 3,3 ± 2,8 mg. Srovnání jednotlivých algoritmů proti sobě pomocí McNemarovy modifikace chí ‑ kvadrát testu – ohledně pravděpodobnosti, že se pacientova skutečně užívaná dávka bude nacházet v pásmu vypočteném podle algoritmu, prokázalo jasnou nadřazenost algoritmu Sconceové proti oběma zbylým algoritmům na našem souboru. Pacient má podle algoritmu Sconceové (oproti algoritmu Andersona) 4krát větší šanci, že vypočtená dávka bude uvnitř pásma ± 20 % od skutečně užívané (Odds Ratio, OR 4,013; 95% CI 2,226 – 7,234; p < 0,001). Obdobně algoritmus podle Sconceové dává 1,8krát větší šanci na správný výsledek proti algoritmu podle Gage (OR 1,830; 95% CI 1,097 – 3,052; p = 0,020). Druhým signifikantním výsledkem byla superiorita algoritmu podle Gage proti algoritmu podle Andersona (OR 2,063; 95% CI1,234 – 3,447; p = 0,005), ostatní srovnání nebyla signifikantní. Výsledky analýz přesnosti predikce pro jednotlivé podskupiny jsou uvedeny v tab. 4. Nejvyšší přesnosti dosahoval i v těchto srovnáních algoritmus podle Sconceové. Vysoká přesnost byla u pacientů s nízkou (< 50 kg) i vysokou (> 100 kg) tělesnou hmotností. Nejvyšší přesnost predikce byla dosažena u pacientů užívajících denní dávku 2,5 až 7,5 mg, vyhovující predikce byla u pacientů s nízkou dávkou (< 2,5 mg) a naopak nepřesné byly výpočty pro pacienty s vyšší než obvyklou dávkou (7,5 až 10 mg a > 10 mg). Zcela nepřesné jsou však všechny algoritmy pro pacienty mladší 40 let věku, nejvyššího R2 sice opět dosáhl algoritmus Sconceové, ale přesnost predikce byla celkově nízká (18,9 %). Naopak u pacientů nad 80 let věku dosahovaly algoritmy podle Sconceové a Gage vyšší přesnost než u pacientů od 41 do 79 let věku (64,7 vs 57,8 % a 53,3 % vs 28,5 %).
Diskuze
Námi zjištěná přesnost jednotlivých algoritmů na vzorku české populace odpovídala publikované přesnosti v případě vzorce podle Sconceové. Vzorec byl vytvořen multivariátní lineární regresní analýzou klinických dat 297 pacientů (derivační kohorta) a byl ověřen na souboru dalších 38 pacientů (validační kohorta). Udávaná hodnota R2 byla 54,2 % pro derivační kohortu, validační soubor dobře koreloval s predikovanou hodnotou – Pearsonovo rbylo 0,80 (p < 0,001). Náš soubor dosáhl podobného výsledku (R2 = 58,4 %; Pearsonovo r = 0,76, p < 0,001) jako publikovaný soubor derivační i validační. Naopak v případě algoritmů podle Gage a Andersona se naše výsledky posouzení přesnosti významně liší (23,8 % a 21,9 % proti 55 % a 47 %), více v tab. 5. Rozdíl mezi algoritmy v přesnosti lze vysvětlit zřejmě kvalitou tvorby algoritmu, rozsahem sledovaných klinických parametrů jednotlivých souborů a také odlišnostmi v etnickém zastoupení kohort. Vyšší přesnost algoritmu Sconceové lze vysvětlit možná i preciznějším mechanizmem tvorby algoritmu. Mezi analyzované údaje souboru patřilo i měření plazmatické hladiny warfarinu a výpočet clearance obou enanciomerů warfarinu, což jistě snížilo vliv non‑compliance a zpřesnilo selekci pacientů i údajů pro regresní analýzu. Vzorec podle Andersona byl vytvořen literárně blíže autory neupřesněným způsobem – kombinací dat z derivační kohorty z práce Carlquista et al [23] a literárních údajů, což jistě může přispět k horší replikovatelnosti dat. Vzhledem k velmi vysoké závislosti denní dávky warfarinu na etnickém původu pro odlišnou distribuci variantních polymorfizmů mezi jednotlivými etniky je také klíčový původ derivační kohorty. Česká populace vykazuje z populačního hlediska obdobné parametry jako všechny dosud publikované kohorty populací indoevropských etnik. Z hlediska složení kohort stran etnického původu, na kterých byly jednotlivé algoritmy vytvořeny, byla anglická (100 % kavkazská populace) Sconceové nejbližší naší české kohortě. V případě Gage et al bylo jen 83 % kohorty kavkazské etnicity a Anderson přesně vůbec etnicitu neuvedl. Obdobná práce amerických autorů na souboru 71 pacientů (z toho jen 66 % bylo kavkazského původu) [24] dospěla k obdobným výsledkům v případě algoritmu podle Sconceové (R2 = 54 %). Nejlepší přesnosti dosáhl v této práci algoritmus podle Gage (R2 = 66 %), který na našem souboru dosahoval jen 23,8 %. Odlišné výsledky mohou být způsobeny opět zejména etnickými rozdíly účinku warfarinu. Z toho jasně plyne potřeba ověření, popřípadě vývoj nového algoritmu pro každou lokální populaci. Je smutné, že jedna z nejcitovanějších zaslepených randomizovaných studií porovnávajících farmakogenetické a klasické empirické dávkování používala právě algoritmus podle Andersona a její negativní výsledky, spolu s nástupem nových léčiv, vedly ke snížení zájmu o tuto oblast [21]. Nicméně přesná predikce dávky warfarinu a možnost selekce pro warfarin rizikových pacientů (tři nebo čtyři variantní alely nebo variantní homozygot CYP2C9) jsou jistě pro klinickou praxi přínosem i na základě dostupných publikovaných dat. Rozdíly mezi warfarinem a antikoagulačními léky nové generace tak lze díky farmakogenetice minimalizovat, a tudíž léčit pacienty efektivně a bezpečně v omezených ekonomických poměrech našeho zdravotnictví.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prim. MUDr. Aleš Tomek
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: ales.tomek@fnmotol.cz
Přijato k recenzi: 15. 2. 2013
Přijato do tisku: 13. 5. 2013
Sources
1. Wallentin L, Yusuf S, Ezekowitz MD, Alings M, Flather M, Franzosi MG et al. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE ‑ LY trial. Lancet 2010; 376(9745): 975 – 983.
2. Higashi MK, Veenstra DL, Kondo LM, Wittkovsky AK, Srinouanprachanhto SL, Farin FM et al. Association between CYP2C9 genetic variants and anticoagulation‑related outcomes during warfarin therapy. JAMA 2002; 287(13): 1690 – 1698.
3. International Warfarin Pharmacogenetics Consortium, Klein TE, Altman RB, Eriksson N, Gage BF, Kimmel SE, Lee MT et al. Estimation of the warfarin dose with clinical and pharmacogenetic data. N Engl J Med 2009; 360(8): 753 – 764.
4. Joffe HV, Xu R, Johnson FB, Longtine J, Kucher N,Goldhaber SZ. Warfarin dosing and cytochrome P450 2C9 polymorphisms. Thromb Haemost 2004; 91(6): 1123 – 1128.
5. Meckley LM, Wittkowsky AK, Rieder MJ, Rettie AE, Veenstra DL. An analysis of the relative effects of VKORC1 and CYP2C9 variants on anticoagulation related outcomes in warfarin patients. Thromb Haemost 2008; 100(2): 229 – 239.
6. Aithal GP, Day CP, Kesteven PJ, Daly AK. Association of polymorphisms in the cytochrome P450 CYP2C9 with warfarin dose requirement and risk of bleeding complications. Lancet 1999; 353(9154): 717 – 719.
7. Margaglione M, Colaizzo D, D’Andrea G, Brancaccio V, Ciampa A, Grandone E et al. Genetic modulation of oral anticoagulation with warfarin. Thromb Haemost 2000; 84(5): 775 – 778.
8. Sconce EA, Khan TI, Wynne HA, Avery P, Monkhouse L,King BP et al. The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements: proposal for a new dosing regimen. Blood 2005; 106(7): 2329 – 2333.
9. Rieder MJ, Reiner AP, Gage BF, Nickerson DA, Eby CS, McLeod HL et al. Effect of VKORC1 haplotypes on transcriptional regulation and warfarin dose. N Engl J Med 2005; 352(22): 2285 – 2293.
10. Veenstra DL, Blough DK, Higashi MK, Farin FM, Srinouanprachan S, Rieder M et al. CYP2C9 haplotype structure in European American warfarin patients and association with clinical outcomes. Clin Pharmacol Ther 2005; 77(5): 353 – 364.
11. Wadelius M, Chen LY, Downes K, Ghori J, Hunt S, Eriksson N et al. Common VKORC1 and GGCX polymorphisms associated with warfarin dose. Pharmacogenomics J 2005; 5(4): 262 – 270.
12. Schwarz UI, Ritchie MD, Bradford Y, Li C, Dudek SM, Frye ‑ Anderson A et al. Genetic determinants of response to warfarin during initial anticoagulation. N Engl J Med 2008; 358(10): 999 – 1008.
13. Limdi NA, McGwin G, Goldstein JA, Beasley TM, Arnett DK, Adler BK et al. Influence of CYP2C9 and VKORC1 1173C/ T genotype on the risk of hemorrhagic complications in African ‑ American and European ‑ American patients on warfarin. Clin Pharmacol Ther 2008; 83(2): 312 – 321.
14. Rost S, Fregin A, Ivaskevicius V, Conzelmann E, Hörtnagel K, Pelz H et al. Mutations in VKORC1 cause warfarin resistance and multiple coagulation factor deficiency type 2. Nature 2004; 427(6974): 537 – 541.
15. Oldenburg J, Bevans CG, Fregin A, Geisen C, Müller ‑ Reible C, Watzka M. Current pharmacogenetic developments in oral anticoagulation therapy: the influence of variant VKORC1 and CYP2C9 alleles. Thromb Haemost 2007; 98(3): 570 – 578.
16. Finkelman BS, Gage BF, Johnson JA, Brensinger CM, Kimmel SE. Genetic warfarin dosing: tables versus algorithms. J Am Coll Cardiol 2011; 57(5): 612 – 618.
17. Tomek A, Matoska V, Eisert C, Serebruany VL. Optimization of anticoagulation with warfarin for stroke prevention: pharmacogenetic considerations. Am J Ther 2011; 18(3): e55 – e66.
18. Millican EA, Lenzini PA, Milligan PE, Grosso L, Eby C,Deych E et al. Genetic‑based dosing in orthopedic patients beginning warfarin therapy. Blood 2007; 110(5): 1511 – 1515.
19. Horne BD, Lenzini PA, Wadelius M, Jorgensen AL, Kimmel SE, Ridker PM et al. Pharmacogenetic warfarin dose refinements remain significantly influenced by genetic factors after one week of therapy. Thromb Haemost 2012; 107(2): 232 – 240.
20. Gage BF, Eby C, Johnson JA, Deych E, Rieder MJ, Ridker PM et al. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin. Clin Pharmacol Ther 2008; 84(3): 326 – 331.
21. Anderson JL, Horne BD, Stevens SM, Grove AS, Barton S, Nicholas ZP et al. Randomized trial of genotype ‑ guided versus standard warfarin dosing in patients initiating oral anticoagulation. Circulation 2007; 116(22): 2563 – 2570.
22. Gage BF, Eby C, Milligan PE, Banet GA, Duncan JR, McLeod HL. Use of pharmacogenetics and clinical factors to predict the maintenance dose of warfarin. Thromb Haemost 2004; 91(1): 87 – 94.
23. Carlquist JF, Horne BD, Muhlestein JB, Lappé DL, Whiting BM, Kolek MJ et al. Genotypes of the cytochrome p450 isoform, CYP2C9, and the vitamin Kepoxide reductase complex subunit 1 conjointly determine stable warfarin dose: a prospective study. J Thromb Thrombolysis 2006; 22(3): 191 – 197.
24. Shaw PB, Donovan JL, Tran MT, Lemon SC, Burgwinkle P, Gore J. Accuracy assessment of pharmacogenetically predictive warfarin dosing algorithms in patients of an academic medical center anticoagulation clinic. J Thromb Thrombolysis 2010; 30(2): 220 – 225.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 5
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Wilsonova nemoc
- Nová antikoagulancia v prevenci kardioembolických iktů u pacientů s nevalvulární fibrilací síní
- Homocysteín a sclerosis multiplex
- Kvantifikace postižení u pacientů s lumbální spinální stenózou
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Současné možnosti využití magnetické rezonance v diagnostice normotenzního hydrocefalu
- Neurologické komplikace dengue – možné nebezpečí pro střední Evropu
- Přesnost farmakogenetických algoritmů pro výpočet denní dávky warfarinu
- Interrater variabilita v hodnocení míry atrofie hipokampů pomocí Scheltensovy škály
- Porovnání peroperační radiační expozice při otevřené a miniinvazivní transpedikulární fixaci hrudní a bederní páteře
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
- Operační léčba syndromu supinátorového kanálu
- Strategie diagnostiky, terapie a dispenzarizace pacientů s hemangioblastomy v CNS z pohledu neurochirurga
- Synkopy, hluchota a slepota u karcinomu prsu – kazuistika
- Gitelmanův syndrom provázený manifestní tetanií – kazuistika
- Konzumace marihuany jako rizikový faktor ischemické cévní mozkové příhody – kazuistika
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Souběžný výskyt mutace v genu ZNF9 (myotonická dystrofie typu 2) a v genu CLCN1 (myotonia congenita) v jedné rodině – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Wilsonova nemoc
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
