Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
Cerebral Vasospasms Following Subarachnoid Bleeding – Diagnosis, Monitoring and Treatment Options
Despite availability of sophisticated surgical procedures, endovascular techniques and new trends in neuro-intensive care, treatment outcomes in patients with subarachnoid bleeding from a ruptured aneurysm are still very unsatisfactory. The first step in patient management, i.e. treating the source of bleeding, is followed by close patient monitoring, taking into account the natural course of the disease. Cerebral vasospasms are among the most severe complications, identified in 40–70% of patients after subarachnoid bleeding. In patients in whom the source of bleeding has been treated, cerebral vasospasms are responsible for the development of delayed cerebral ischemia, the most common cause of high morbidity rates or deaths (15–20%). Effective prevention of such complications is based on detailed clinical observation. Invasive monitoring of cerebral metabolism and intracranial pressure is to be applied in patients with impaired consciousness in order to detect a threatening cerebral ischemia as early as possible. Current knowledge and technology enable more aggressive treatment that concentrates on normalising perfusion in the brain.
Key words:
cerebral vasospasms – subarachnoid haemorrhage – delayed cerebral ischemia
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
J. Adamkov 1; J. Náhlovský 1; J. Habalová 1; A. Krajina 2; S. Řehák 1; M. Kanta 1; T. Česák 1
Authors‘ workplace:
LF UK a FN Hradec Králové
Neurochirurgická klinika
1; LF UK a FN Hradec Králové
Radiologická klinika
2
Published in:
Cesk Slov Neurol N 2014; 77/110(2): 158-167
Category:
Review Article
Podpořeno MZ ČR – RVO (FNHK). Podpořeno programem PRVOUK P37/ 4.
Overview
Výsledky léčby pacientů se subarachnoidálním krvácením z prasklého aneuryzmatu jsou i v dnešní době propracovaných operačních postupů, endovaskulárních technik a nových trendů v neurointenzivní péči nadále neuspokojivé. Ošetření zdroje krvácení představuje první krok, na který musí navazovat monitorování pacienta zohledňující přirozený průběh tohoto onemocnění. Cerebrální vazospazmy (CVS), jež patří mezi nejzávažnější komplikace po subarachnoidálním krvácení, jsou přítomny u 40 – 70 % pacientů. Participují na vzniku mozkové ischemie, která je nejčastější příčinou těžké morbidity nebo úmrtí (15 – 20 %). Účinná prevence těchto komplikací se opírá o detailní klinické sledování. U pacientů s poruchou vědomí je nutný invazivní monitoring mozkového metabolizmu a nitrolebního tlaku s cílem časné detekce hrozící ischemické příhody. Současné znalosti a technologické možnosti umožňují vést agresivnější léčbu zaměřenou na normalizaci perfuzních poměrů mozku.
Klíčová slova:
cerebrální vazospazmy – subarachnoidální krvácení – pozdní mozková ischemie
Patogeneze cerebrálních vazospazmů (CVS)
Oxid dusnatý (NO)
Důležitým faktorem v patogenezi CVS je nižší biologická dostupnost NO po subarachnoidálním krvácení (SAK). Deplece tohoto silného vazodilatans je způsobena několika faktory:
- NO má silnou afinitu k hemoglobinu, který se po krvácení hromadí v subarachnoidálním prostoru [1].
- K nízké hladině NO přispívá inhibice endoteliální a neuronální NO syntetázy [2]. Toto tvrzení podporují nálezy nižší aktivity těchto enzymů ve spastických cévách po SAK [3].
- Nižší koncentrací NO ztrácí vazokonstriktor endotelin‑1 (ET ‑ 1) přirozeného antagonistu [4].
Endotelin 1 (ET ‑ 1)
Endotelin 1 je extrémně silná vazokonstrikční substance produkovaná cévním endotelem [5]. Jeho sérová a likvorová koncentrace stoupá v přítomnosti CVS a naopak je nízká při jejich absenci [6,7]. ET ‑ 1 indukuje expresi nikotinamidadenindinukleotidfosfát (NADPH) oxidázy, která potencuje oxidační stres v lidských endoteliálních buňkách [8].
Zánět
Vyšší sérové koncentrace leukocytů a neutrofilů poukazují na možnou roli zánětu v patogenezi CVS a sekundárního mozkového poškození [9]. Spouštěčem zánětlivé reakce s leukocytární infiltrací cévní stěny je přítomnost krve v subarachnoidálním prostoru [9]. Shlukování leukocytů v endotelu potencují tzv. adhezivní molekuly (ICAM‑1, VCAM‑1, e ‑ selektin). Koncentrace těchto molekul v mozkomíšním moku (CSF) stoupá právě v období CVS [9]. Leukocyty participují na rozvoji cévního spazmu několika způsoby. Indukují vznik volných kyslíkových radikálů, které poškozují endotel a způsobují influx Ca2+ do buněk [10]. Dále produkují molekuly se silným vazokonstrikčním účinkem (ET ‑ 1) a snižují koncentraci NO [11].Na spoluúčast zánětu v patogenezi ukazuje také vyšší koncentrace IL‑6 v CSF pacientů v období vazospazmů [12]. Produktem leukocytů ‑ neutrofilů je rovněž matrixmetaloproteináza 9 (MMP ‑ 9), jež způsobuje disrupci extracelulární matrix a rozpad endotelinu ‑ 1 na aktivní vazokonstrikční fragmenty [13]. Aktivace MMP ‑ 9 je spojena s endoteliální apoptózou a degradací kolagenu IV (hlavní složka lamina basalis mozkových cév) s následnou poruchou hematoencefalické bariéry [13,14]. Nárůst počtu neutrofilů je doprovázen vyšší koncentrací MMP ‑ 9 v séru a CSF [15]. Vyšší koncentrace MMP ‑ 9 v CSF korelují s neuspokojivým klinickým výsledkem tři měsíce po SAK, nikoliv však s CVS. Je tedy předpoklad, že se MMP ‑ 9 spíše účastní řetězce dějů způsobujících sekundární mozkový inzult než samotných vazospazmů [15].
Neuropeptidy
Calcitonin Gene Related Peptide (CGRP) je molekula se silným vazodilatačním účinkem zprostředkovaným přes NO a cyklický adenozinmonofosfát (cAMP) [16]. Cerebrální vazospazmy jsou doprovázeny úbytkem CGRP v perivaskulárních nervových vláknech a naopak, koncentrace této molekuly stoupá v krvi uvnitř cév postižených spazmy [16,17]. Recentní studie potvrzuje určitou roli neuropeptidu Y (NPY) v patogenezi CVS [18]. NPY je akumulován v nervových vláknech periadventicie mozkových arterií a účastní se regulace mozkového průtoku ovlivňováním velikosti cévního lumina. Jeví se jako nadějný marker predikce CVS (senzitivita 82 %, specifita 72 %) [19].
Oxidativní stres
Přítomnost oxyhemoglobinu může iniciovat tvorbu volných kyslíkových radikálů, které prostřednictvím procesu lipidové peroxidace destruují cévní stěnu a způsobují hromadění vazokonstrikčně působících substancí [20]. Dalším faktorem potencujícím již přítomné CVS jsou metabolity vznikající oxidací bilirubinu. Jejich koncentrace dosahuje maxima právě mezi 4. až 11. dnem po SAK [21].
Klinická manifestace CVS
Cerebrální vazospazmy po subarachnoidálním krvácení rozdělujeme na angiografické a symptomatické. Při angiografických spazmech arterií Willisova okruhu, jeho větvení nebo periferních arteriol nacházíme segmentální stenózy se sníženou regionální perfuzí. CVS projevující se kromě angiografického nálezu také klinickou manifestací označujeme jako symptomatické. Podle lokalizace rozlišujeme:
- tzv. proximální vazospazmy – postižení cév Willisova okruhu a jeho větvení (např. arteria cerebri media, arteria cerebri anterior apod.);
- stenotizaci subkortikálních nebo kortikálních arteriol označujeme jako tzv. periferní cerebrální vazospazmy.
Podle rozsahu mohou být vazospazmy fokální nebo difuzní. Mezi nezávislé faktory předpovídající vznik CVS patří množství krve v subarachnoidálním prostoru, časný nárůst rychlosti toku krve v arteria cerebri media (ACM) při vyšetření transkraniálním ultrazvukem (TCD), Glasgow Coma Scale (GCS) 14 a méně v době přijetí, SAK z aneuryzmatu (AN) na arteria cerebri anterior (ACA) nebo arteria carotis interna (ICA) [22].
Patofyziologie pozdní mozkové ischemie
Pozdní mozková ischemie (Delayed Cerebral Ischemia, DCI) je klinický syndrom projevující se kognitivními změnami a/ nebo fokální neurologickou symptomatologií. Je patrný u 30 % pacientů po SAK [22]. Současné poznatky poukazují na multifaktoriální etiologii DCI, ve které kromě CVS hrají důležitou roli další lokální a systémové procesy. Časné poranění mozku zahrnuje změny odehrávající se po iniciálním SAK (do 72 hod), jež ovlivňují vznik a modifikují průběh nastupující ischemie. Patří sem počáteční nitrolební hypertenze, mozkový edém a porucha cévní autoregulace. Poslední výzkumy popisují také přítomnost tzv. kortikálního útlumu (cortical spreading depression), který představuje depolarizační vlnu šířící se mozkovou kůrou jako odpověď na mechanické či elektrické podráždění. Tato vlna může být doprovázena hyper ‑ nebo hypoperfuzí. Nakupení takových vln může vyústit do mikrovaskulární dysfunkce a parenchymové ischemie [23]. Další důležitý děj odehrávající se na periferii mozkového řečiště jsou mikrotrombózy. Sérologické studie prováděné v časném stadiu po SAK poukazují na aktivaci koagulační a inhibici fibrinolytické kaskády [24]. Tuto hypotézu potvrzují TCD nálezy mikroembolů u 70 % pacientů po SAK [25].
Klinický obraz
V případě, že jsou CVS detekovány do tří dnů po SAK, lze předpokládat vícedobé krvácení s dřívější epizodou extravazace krve [26]. Kulminace nastává mezi 7. a 10. dnem po krvácení s pozvolným ústupem v dalších dvou týdnech. Většina CVS po SAK se projevuje pouze nálezy při angiografickém vyšetření nebo zrychlenými toky při vyšetření TCD. V tomto období jsou detekovány rychlosti častokrát překračující fyziologické hodnoty 2 - až 4násobně. Při těžkých CVS jsou registrovány rychlosti toků nad 200 cm/ s. Pro klinickou manifestaci CVS je důležitý nepoměr mezi poptávkou a nabídkou regionálního mozkového průtoku (rCBF). Nezanedbatelnou roli hrají individuální rozdíly ve vulnerabilitě mozkové tkáně na hypoxii a sníženou regionální perfuzi. Asi u poloviny pacientů se symptomatickými CVS lze prokázat mozkovou ischemii pomocí CT či MR [27]. Symptomatické CVS se nejčastěji projeví jako neočekávané změny kvality/ kvantity vědomí nebo nově přítomný neurologický deficit v kombinaci s pozitivním nálezem stenózy na DSA (popř. zrychlenými toky při vyšetření TCD). Vždy musí být vyloučena jiná příčina změny klinického stavu (nová ataka SAK, hydrocefalus apod.). Na přítomnost CVS mohou upozornit též „nevysvětlitelné“ elevace středního arteriálního tlaku (MAP) jako autonomní odpověď na porušenou cévní autoregulaci. V roce 2010 byla multidisciplinární skupinou odborníků navržena definice klinické deteriorace na podkladě pozdní mozkové ischemie a mozkového infarktu po SAK (tab. 1). Sjednocení v terminologii má za cíl usnadnit společnou komunikaci expertů věnujících se dané problematice a standardizovat výstupy klinických studií pro potřeby metaanalýz [27].
![Návrh definice pozdní mozkové ischemie (Delayed Cerebral Ischemia, DCI) a mozkového infarktu po subarachnoideálním krvácení pro hodnocení klinických studií [48].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/3338b1d268a0f37037c7c663fcafcd79.png)
Diagnostika a monitorování
Diagnostika a monitorování CVS jsou u pacienta při vědomí založeny na klinickém sledování. Transkraniální dopplerovský ultrazvuk (TCD) nebo duplexní sonografie (TCCS) jsou v diagnostice a monitoringu nejrozšířenější. Senzitivita a specifita vyšetření se mění v závislosti od měřené cévy (nejčastěji uváděné hodnoty 84, resp. 89 %) [28]. Přes temporální kost (tzv. temporální okno) lze detekovat rychlost krevního průtoku v cévách Willisova okruhu (např. ACM, bifurkace ACI/ ACM, ACA). Výhoda TCD je jeho neinvazivita a možnost vyšetření u lůžka pacienta. Nevýhoda je závislost dosažených výsledků na zkušenosti lékaře provádějícího ultrazvukové vyšetření. V 5 – 10 % případů nelze vyšetření provést pro nepříznivé anatomické poměry (mohutná temporální kost). Stupeň CVS můžeme stanovit na základě poměru rychlostí v místě stenózy a před ní nebo za ní (PSV poměr, Peak Systolic Velocity, tab. 2). Rychlost toku překračující 120 cm/ s je přítomna u lehkých až středně těžkých vazospazmů, těžké stupně CVS se projeví rychlostí nad 200 cm/ s. Pacienti s těžkými CVS mohou být asymptomatičtí, proto může být predikce symptomatických CVS na základě TCD nespolehlivá (falešná pozitivita) [29]. Někteří autoři zastávají názor, že pouze hodnoty rychlosti toků pod 120 cm/ s a nad 200 cm/ s negativně (94 %) nebo pozitivně (87 %) předpovídají klinickou manifestaci. Rychlosti v rozmezí 120 až 200 cm/ s mají podle nich nízkou prediktivní hodnotu [30]. Studie, jež retrospektivně srovnává rychlosti proudění krve v cévách Willisova okruhu a regionální průtok pomocí perfuzního CT vyšetření ve skupině pacientů po SAK, zpochybnila předpoklad, že vyšší rychlosti toků musí nutně vést k redukci rCBF. Vyšší rychlosti toků na proximálních cévách byly doprovázeny v této studii vyšším rCBF. Podle autorů se jedná pravděpodobně o kompenzační mechanizmus při porušené periferní vazoreaktivitě. V případě přítomnosti vazospazmů na periferii a proximálně nebyla pozorována žádná kompenzační akcelerace regionálního průtoku [31]. Další skutečnost upozorňující na limity TCD je měření rychlostí toků v mozkových cévách v průběhu hypervolemicko‑hypertenzní léčby (tzv. 3H terapie). V těchto situacích je užitečné stanovení Lindegaardova indexu, což je poměr rychlostí proudění krve ve stenotizované cévě a v krčním úseku ACI. Hodnoty indexu nad 3 potvrzují přítomnost CVS [32]. I když senzitivita a specifita vyšetření závisí na vyšetřované cévě, podle Americké neurologické akademie je detekce těžkých CVS za pomocí TCD spolehlivá [33]. Data získaná pomocí TCD je nutno interpretovat v kontextu dalších monitorovacích modalit. Terapie CVS založená pouze na sledování jednoho parametru (rychlost krevního toku) je postup, který nelze doporučit [31].
![Hodnocení stupně intrakranálních stenóz. PSV (Peak Systolic Velocity) poměr [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cd2813610dbb0cf2639084db5b950552.png)
Digitální subtrakční angiografie (DSA)
DSA je považována za „zlatý standard“ v diagnostice CVS. Hodnocení CVS při DSA je založeno na identifikaci zúženého arteriálního lumen a jeho srovnání se vstupním vyšetřením bezprostředně po SAK (období bez CVS). Limitující faktorem pro DSA zůstává hlavně detekce vazospazmů na periferních, hůře zobrazitelných cévách [34]. Ve srovnání s TCD má DSA vyšší specifitu pro predikci DCI na podkladě CVS (0,63 vs 0,53) [35]. Monitoring cerebrálních vazospazmů u pacientů s poruchou vědomí zaznamenala v poslední dekádě velký rozvoj. Jedná se o invazivní sledování vlastností mozkové tkáně v období alterovaných perfuzních poměrů na podkladě CVS. Sledují se parametry potenciálně související se zúženým cévním luminem (intrakraniální tlak, rCBF, parciální tlak O2, energetické metabolity).
ICP, CPP
K nejrozšířenějším parametrům patří měření intrakraniálního tlaku (ICP) a mozkového perfuzního tlaku (CPP). Teorie, že ischemická léze vede nutně k nárůstu ICP a k poklesu CPP, byla zpochybněna řadou autorů [36,37]. Klinické studie se simultánním měřením ICP, parciálního tlaku O2 v mozku (PbtiO2) a jugulární oxymetrie prokázaly, že mozková ischemie se může rozvinout i při fyziologických hodnotách ICP a CPP. Snaha o normalizaci těchto parametrů tedy nemusí nutně vést ke snížení rizika vzniku mozkové ischemie [36,37]. Specifita ICP monitorování pro detekci těžké mozkové hypoxie (ICP > 20, PbtiO2 < 10 mmHg) je 90,1 %. Senzitivita vyšetření dosahuje pouhých 19,7 % [38].
PbtiO2
Invazivní měření parciálního tlaku mozkového kyslíku (PbtiO2) je další způsob sledování možného ischemického postižení při probíhajících CVS. Práce Vätha et al popisuje silnou korelaci hladin PbtiO2 a rizika vzniku ischemického inzultu [39]. Zajímavá je souvislost mezi nižší koncentrací hemoglobinu (< 9 mg/ dl) a vyšším rizikem vzniku mozkové ischemie a dysfunkce energetického metabolizmu u pacientů po SAK v období CVS [40]. Ďuriš et al prokázali, že při zvyšování inhalované frakce kyslíku (FiO2) je nárůst PbtiO2 menší ve skupině pacientů s CVS než ve skupině pacientů bez CVS. Určité terapeutické kroky (zvyšování FiO2) tak mohou být neúčinné právě v nejvíce ohrožené skupině pacientů [41]. Smrčka et al konstatují, že monitoring PbtiO2 je spolehlivý ukazatel hrozící ischemie u pacientů se SAK (Hunt ‑ Hess 3, 4, 5 st.) při respektování vlastností místa inzerce [42].
Optická spektrometrie (Near InfraRed Spectroscopy, NIRS)
Představuje neinvazivní metodu měření saturace hemoglobinu kyslíkem v mozkovém parenchymu (rSO2) frontálních oblastí. Ohmae et al potvrdili spolehlivost této metody při detekci sníženého CBF [43]. Habalová et al uvádějí, že i když dochází při řízené hypertenzi k významnému vzestupu rSO2 (o 27 %), tyto hodnoty nelze využít k predikci výsledného stavu po léčbě CVS [44]. Nevýhoda metody je, že získaná hodnota představuje saturaci kyslíku nejenom mozkového parenchymu (venózní i arteriální složky), ale také kůže a podkoží v místě pod sondou.
Regionální krevní průtok (rCBF)
Invazivní měření rCBF je další možnost monitorování mozkové tkáně ohrožené ischemií. Vajkoczy et al ověřili spolehlivost měření rCBF při predikci vazospazmů, přičemž postupnou redukci rCBF zaznamenali již 2 – 3 dny před konvenčním způsobem detekce vazospazmů (TCD). Index vaskulární rezistence (CPP/ rCBF) koreloval se začátkem a koncem periody CVS [45]. Studie od Jaegera, čítající menší počet pacientů, prokázala silnou korelaci (90 %) mezi rCBF a PbtiO2 [46].
Mozková mikrodialýza
Monitoring metabolitů mozkového intersticia za použití mikrodialýzy se prosadil do klinické praxe v 90. letech 20. století. Nejdůležitějším poznatkem jedné z prvních prací byla korelace mezi poměrem laktát/ pyruvát a hladinou glutamátu s hrozícím ischemickým inzultem na podkladě CVS [47]. Autoři upozornili na fakt, že hladiny energetických metabolitů a excitatorních aminokyselin mohou odrážet různou etiologii energetické dysfunkce mozku (hypoxie, různé stupně ischemie) [47]. Nilsson et al potvrdili souvislost zvýšených hladin glycerolu v mikrodialyzátu a těžkého ischemického postižení mozku [48]. Unterberg et al sledovali metabolické změny u 60 pacientů po SAK z prasklého aneuryzmatu. U 30 % z nich se rozvinula DCI. S časovým předstihem byla touto metodou detekována hrozící ischemie v 55 % případů. Autoři uvádějí, že mikrodialýza má vyšší specificitu pro detekci DCI než DSA a TCD (0,89 vs 0,63 vs 0,53) a nejvyšší pozitivní prediktivní hodnotu pro rozvoj DCI u pacientů po SAK [35]. S tímto závěrem se ztotožňují i další studie [49,50]. Mozková mikrodialýza představuje v současnosti metodu s nejvyšší specificitou detekce hrozícího DCI na podkladě CVS po SAK. Tento „metabolický alarm“ většinou předchází klinické manifestaci o 8 – 12 hod [47]. V tuzemské literatuře nalézáme první zmínky o využití mozkové mikrodialýzy u pacientů po SAK z neurochirurgie v Ústí nad Labem [51]. Všechny zmíněné metody měření tkáňové kondice mozku (rCBF, PbtiO2, mozková mikrodialýza) nabízí kromě nových možností monitorování prostor pro lepší pochopení metabolizmu a perfuzních poměrů v mozku za patologických podmínek. Jsou to metody lokální, jež monitorují malý okrsek mozkové tkáně. Informace, které nabízejí, je potřeba zohlednit ve světle dalších dostupných dat (TCD, ICP, DSA) a případná změna léčebné strategie musí být výsledkem komplexního posouzení dané situace.
Léčba
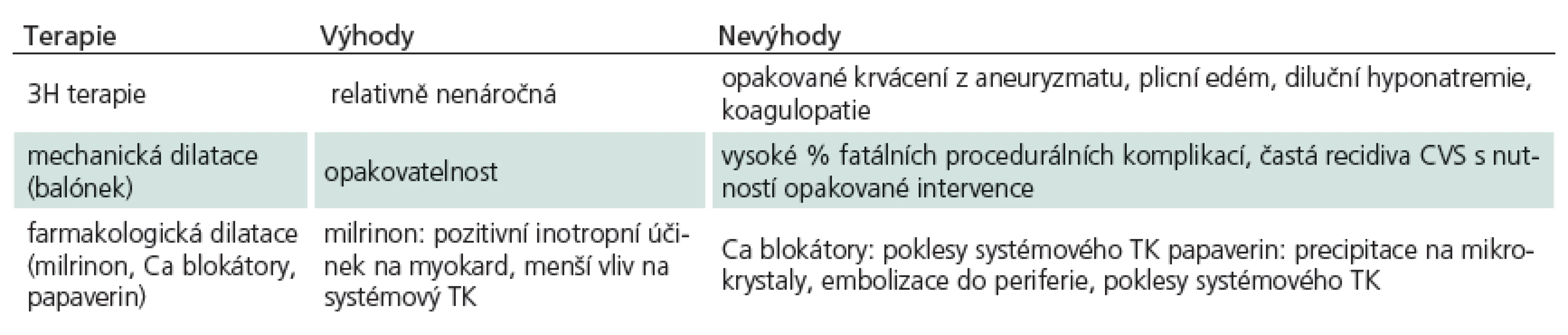
Cílem léčby pacientů s CVS je navodit podmínky, které minimalizují riziko vzniku sekundárního mozkového poškození. Snahou je zlepšit mozkovou perfuzi a snížit vulnerabilitu mozkové tkáně k ischemickému inzultu. Přehled výhod a nevýhod nejčastěji užívaných modalit v léčbě CVS nabízí tab. 3.
Prevence CVS
Odstranění krve ze subarachnoidálních prostor
Na preventivní účinek redukce krevního depa v subarachnoidálním (SA) prostoru není jednotný názor. Podle některých autorů se snižuje incidence vazospazmů derivací CSF (lumbální drenáž) [52] nebo instilací rekombinantního tkáňového aktivátoru plazminogenu (rtPA) do SA prostor [53]. Hypoteticky by po endovaskulárním ošetření krvácejícího aneuryzmatu (nemožnost odstranění krve ze SA prostoru) mělo být vyšší riziko CVS. Studie srovnávající frekvenci angiografických a symptomatických CVS po ošetření zdroje krvácení chirurgicky nebo endovaskulárně [54] tyto rozdíly nepotvrdila. Jiní autoři paradoxně uvádějí nižší incidenci CVS po endovaskulárním ošetření [55]. V současnosti nelze tedy jednoznačně najít souvislost mezi způsobem ošetření a vznikem CVS.
Blokáda svalové kontrakce v cévní stěně
Blokátory kalciových kanálů
Nimodipin patří v současnosti mezi akceptované medikace v prevenci a léčbě CVS. Jeho podávání po dobu 21 dnů po iniciálním SAK zlepšuje klinické výsledky [56]. Předpokládá se jeho neuroprotektivní účinek na úrovni mikrocirkulace (nepotvrdila se nižší incidence CVS po podávání nimodipinu) [56]. V roce 2002 Kasuya et al jako první publikovali výsledky preventivního použití nikardipinových pelet po chirurgickém ošetření aneuryzmatu. Peletami obložili cévní kmeny nebo je uložili do bazálních cisteren [57]. Účinek preventivního, lokálního podávání nikardipinu byl pak prokázán také dalšími autory [58]. V České republice není tato forma kalciových blokátorů k dispozici. Van der Bergh uvádí snížení rizika vzniku DCI o 34 % při současném podávání magnezia [59]. I když další studie tento závěr nepotvrdily [61], je udržování vyšších hladin magnezia u pacientů po SAK akceptováno na mnoha pracovištích [60].
Inhibice zánětlivé odpovědi
Předpokládá se vliv statinů na sníženou produkci zánětlivých substancí a podpora produkce oxidu dusnatého (NO). Tseng et al ve své randomizované, kontrolované studii uvádějí nižší frekvenci CVS a DCI po podávání statinů [61]. Naproti tomu Kramer et al efekt statinů na CVS neshledali [62]. Validní závěry zatím nelze na základě dostupných dat stanovit.
Dilatace stenózy
Endovaskulární léčba by měla být rezervována pro případy rezistentní ke konzervativní léčbě. Podle dostupných dat je pro asi 40 % pacientů se symptomatickými CVS konzervativní léčba nedostatečná [63]. Zlepšení mozkové perfuze lze dosáhnout mechanicky nebo farmakologicky.
Mechanická dilatace
Podle původních představ dilatace transluminální balónkovou angioplastikou (TBA) způsobí disrupcí a dysfunkcí buněk hladké svaloviny cévní stěny a jejich bazálních membrán [64]. MacDonald et al uvádějí, že mozkové cévy po TBA ztrácejí autoregulaci a stávají se méně citlivé na vazokonstrikční a vazodilatační stimuly [65]. TBA je použitelná pouze v případě proximálních CVS (supraklinoidní úsek ACI, ACM1, ACA1, intrakraniální segment VA, AB a P1). Nelze ji doporučit pro vysoké riziko hemoragické reperfuzní příhody při dokonané ischemii většího rozsahu [66]. Účinnost TBA v léčbě CVS zkoumala prospektivní studie BPAV (Balloon Prophylaxis of Aneurysmal Vasospasm study). Soubor čítal 29 pacientů, u kterých bylo ošetřeno 109 spastických cév. Angiografické zlepšení bylo dosaženo v 97 %, klinické zlepšení ve 38 %. Kontroly TCD prokázaly v 80 % případů nižší rychlosti toků, ve 13 % byly toky paradoxně rychlejší [67]. K těmto poměrně optimistickým výsledkům se nekloní práce Jestaedta et al z roku 2008. Autoři hodnotili skupinu pacientů s CVS, kteří podstoupili TBA. Procedurální komplikace zaznamenali u více než poloviny případů [68]. Častý výskyt závažných komplikací je hlavní limitací širšího použití TBA v léčbě CVS.
Farmakologická dilatace
V případě periferně lokalizovaných (distálních) CVS nebo vazospazmů refrakterních ke konzervativní léčbě je alternativou intraarteriální podávání vazodilatancií. Historicky první látkou, která byla použita za tímto účelem v klinické praxi, byl papaverin. Toto silné vazodilatans s krátkým biologickým poločasem má ale závažné nedostatky – vyvolává systémovou hypotenzi, v roztoku s heparinem precipituje a je příčinou mikroembolizací [69]. Dalším závažným průvodním jevem je nárůst nitrolebního tlaku [70]. Papaverin se v současnosti již nepoužívá. Skutečnost, že Ca ionty hrají důležitou roli v patogenezi CVS, vedla k léčebnému využití blokátorů kalciových kanálů. Předpokládá se, že kromě vazodilatačního efektu mají také neuroprotektivní účinek [71]. Biondi et al zaznamenali po intraarteriálním podání nimodipinu klinické zlepšení v 76 % a angiograficky potvrzenou vazodilataci ve 43 %. Systémová hypotenze byla krátkodobá a neklesla o víc než 40 mmHg [72]. Vliv bolusu vysokých dávek verapamilu (rozpětí 15 – 55 mg) na CVS, systémovou a lokální hemodynamiku mozku byl předmětem další studie. I když po podání verapamilu byla pozorována regrese CVS (DSA), důležitým zjištěním byl signifikantní pokles MAP s nutností podpory oběhu vazopresory [73]. První práce hodnotící intraarteriální podávání inhibitoru fosfodiesterázy milrinonu u pacientů s těžkými CVS uvádí regresi vazospazmů při vyšetření DSA se současným dobrým klinickým výsledkem (obr. 1 – 3). Výhodou milrinonu, jenž se používá v terapii kardiálního selhání, je jeho inotropní účinek na myokard a výrazně nižší výskyt systémové hypotenze po intraarteriálním podání ve srovnání s kalciovými blokátory [74].
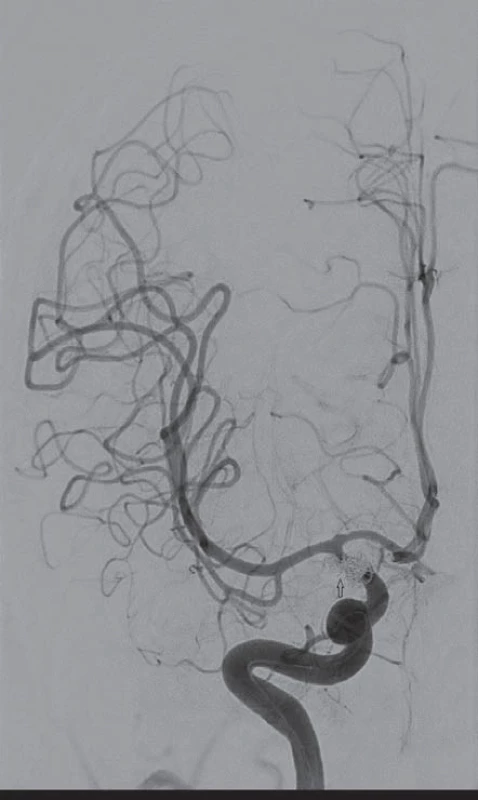
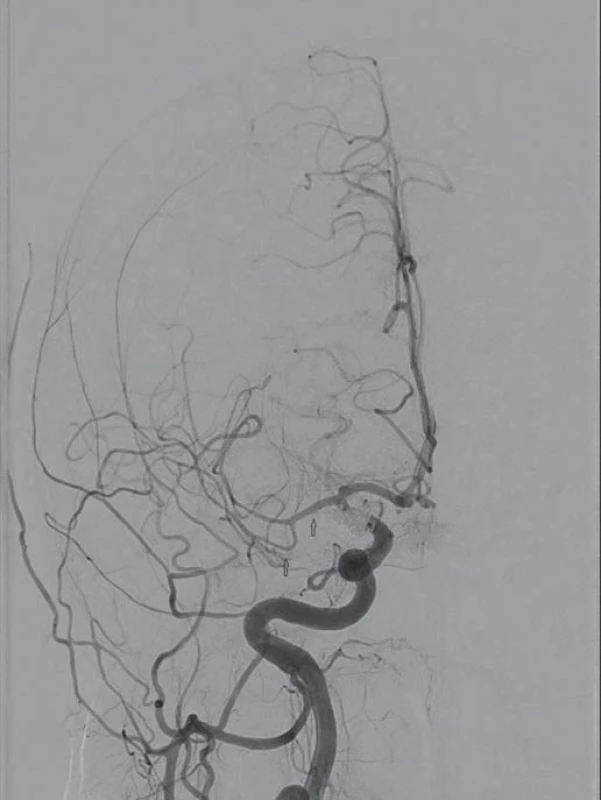
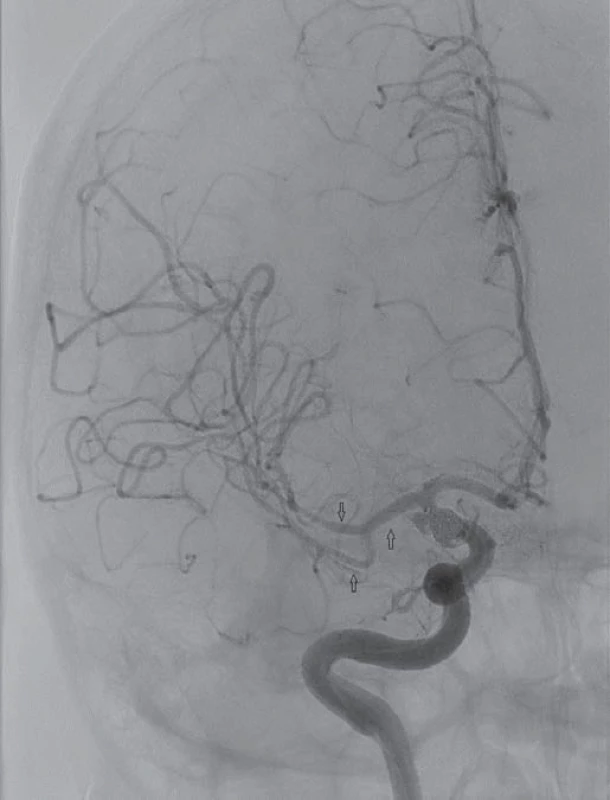
Zlepšení mozkové perfuze
V průběhu CVS se přesouvá cerebrovaskulární rezistence z periferních arteriol na cévy Willisova okruhu a jeho větvení. Narušení cévní autoregulace způsobí závislost krevního průtoku na arteriálním tlaku a viskozitě (hematokrit). V této situaci je udržování tlakového gradientu (arteriální tlak) jediný způsob, jak zachovat potřebnou mozkovou perfuzi. Zjevná škodlivost hypovolemie, hypotenze a hemokoncentrace u pacientů s CVS měla vliv na poměrně rozšířené využití hypertenzní, hypervolemické léčby v klinické praxi. Práce srovnávající dopad profylaktické hypervolemie s postupy upřednostňujícími normovolemii neprokázaly rozdíly v regionálním a globálním mozkovém průtoku [75,76]. Ve shodě s tímto tvrzením jsou další studie, které nepotvrdily rozdíl v četnosti výskytu, průběhu a klinickém dopadu CVS po obou typech profylaktické léčby [77,78]. V současnosti tedy platí, že benefit profylaktické hypervolemie u pacientů po SAK není prokázán. I když byl efekt řízené hypertenze u pacientů s DCI na podkladě CVS opakovaně klinicky ověřen, nejsou zatím k dispozici relevantní data potvrzující opodstatněnost této léčby při profylaxii CVS. Dankbaar et al shrnuli výsledky 11 studií hodnotících vliv tzv. 3H terapie a jejich jednotlivých komponent (indukována hypertenze, hypervolemie, hemodiluce) na mozkový průtok u pacientů po SAK. Vzhledem k heterogenitě hodnocených souborů a použitých technik měření CBF nebylo možné provést metaanalýzu. Nejdůležitější informace lze shrnout do dvou bodů:
- nejsou důkazy, že v iniciální fázi po SAK (do 24 hod) izovolemická hemodiluce nebo hypervolemie zvyšuje CBF,
- indukovaná hypertenze sama nebo v kombinaci s hypervolemií zlepšuje CBF ve srovnání s výchozími hodno-tami [79,80].
I když tato kombinace vychází jako nejslibnější, výsledky nebyly srovnány s kontrolní skupinou. Nelze tedy s jistotou vyloučit, že sledované změny reflektují přirozený vývoj mozkového průtoku po SAK [81]. Tyto studie hledaly souvislosti mezi 3H terapií a CBF. V současnosti však není jasné, jestli elevace CBF má pozitivní vliv na konečný klinický stav pacientů po SAK. Studium vlivu indukované hypertenze u pacientů s DCI by mohlo poskytnout odpověď na tuto otázku.
Další terapeutické možnosti
NO
Souvislost nízké hladiny NO s cévním spazmem vedla k myšlence zvýšit jeho koncentraci v rámci léčby CVS. Thomas et al aplikovali nitroprusid sodný, přímého donora NO, intratékálně pacientům po SAK. Angiografické zlepšení zaznamenali u pěti ze šesti pacientů [82]. Agrawal et al zdokumentovali snížení rychlostí toků krve ve spastických cévách po intraventrikulární aplikaci nitroprusidu sodného [83]. Skutečnost, že reakcí nitrátů s deoxyhemoglobinem vzniká NO, staví nitráty do role potenciálního terapeutického nástroje. Fathi et al demonstrovali na opicích regresi CVS po podání nitrátu sodného (NaNO2) [84]. V současnosti probíhající klinická studie zkoumající účinnost, bezpečnost podávání a farmakokinetiku NaNO2(fáze IIA) ve skupině pacientů po SAK nezaznamenala žádné nežádoucí účinky nebo hypotenzi během 14denní kontinuální aplikace [85].
Antagonisté ET ‑ 1
Antagonisté ET ‑ 1 blokují receptory tohoto silného vazokonstriktora na povrchu cévních myocytů. Testovány byly dvě substance – TAK ‑ 044 a klazosentan. Velká randomizovaná kontrolovaná studie zkoumala účinek TAK ‑ 044 a placeba na 402 pacientech s CVS. I když byl zaznamenán méně častý výskyt mozkové ischemie ve skupině s TAK ‑ 044 (29,5 vs 36,6 %), nebyl patrný rozdíl ve výsledném Glasgow Outcome Score (GOS) tři měsíce po krvácení [86]. Randomizovaná studie CONSCIOUS ‑ 1 (The Clazosentan to Overcome Neurological Ischemia and Infarction Occurring after Subarachnoid Hemorrhage) prokázala signifikantní redukci středně těžkých a těžkých angiografických vazospazmů ve skupině pacientů s klazosentanem 9. den po SAK. Ve stejné skupině byl zaznamenán nesignifikantně nižší počet infarktů [87]. Podávání klazosentanu bylo doprovázeno hypotenzí, anémií a plicními komplikacemi [87]. Následné sledování pacientů prokázalo, že podávání klazosentanu nemá vliv na morbiditu, mortalitu a na funkční výsledek ve skupině pacientů po chirurgickém ošetření zdroje krvácení (CONSCIOUS ‑ 2) [88]. Další randomizovaná studie (CONSCIOUS ‑ 3) nepotvrdila benefit podávání klazosentanu ve skupině pacientů po SAK, u kterých byl ošetřen zdroj krvácení endovaskulárně [89]. Metaanalýza hodnotící vliv klazosentanu u 2 601 pacientů konstatuje, že i když byla zaznamenána regrese v angiografických vazospazmech, léčba vede k horším funkčním výsledkům a vyvolává vážné komplikace (plicní edém, anémie, hypotenze). Autoři ji proto nedoporučují [90].
Protizánětlivá léčba
V akutní fázi po krvácení nastává proteázou indukovaná aktivace komplementu. Nafomastat mesilat (FUT ‑ 175) je inhibitor proteáz, který suprimuje tvorbu trombinu a plazminu, a tím tlumí zánětlivou odpověď po SAK [91]. Yanamoto et al retrospektivně hodnotili soubor 23 pacientů s CVS po intravenózní aplikaci FUT ‑ 175 s nálezem nižší incidence mozkové ischemie ve srovnání s kontrolní skupinou (13 vs 55 %) [91]. Účast celulární složky na zánětlivé odpovědi vedla k testování potenciálního vlivu kortikoidů na klinický průběh a výsledný stav po CVS. Retrospektivní studie hodnotící vliv vysokých dávek metylprednizolonu na souboru 21 pacientů prokázala nesignifikantní pokles symptomatických CVS a signifikantní nárůst výborných výsledků po léčbě (71 vs 29 %) [92].
Antioxidanty
Tirilazad je 21 - aminosteroid, který inhibuje lipidovou peroxidaci a snižuje koncentraci volných O2 radikálů. Metaanalýza hodnotící vliv této látky na souboru 3 821 pacientů s CVS prokázala snížení počtu symptomatických CVS, ovšem bez ovlivnění morbidity a mortality [93].
Hypotermie
Hypotermie u potkanů potlačuje cytotoxický edém a tlumí metabolický stres po SAK [94]. Wang et al uvádějí přímou souvislost mezi hypotermií a méně častým výskytem CVS po SAK. Účinek vysvětlují nižší koncentrací endotelinu ‑ 1 a inhibicí poklesu NO v CSF a krvi [95]. Kawamura et al demonstrovali na PET studii redukci CBF a sníženou konsumpci kyslíku u pacientů po SAK v režimu řízené hypotermie [96]. Další studie hodnotící vliv hypotermie u 100 pacientů po SAK s intrakraniální hypertenzi nebo CVS uvádí dobrý klinický výsledek (Glasgow Outcome Score 4,5) u 35,6 % pacientů při poměrně častém výskytu nežádoucích účinků (elektrolytová dysbalance, pneumonie, trombocytopenie). Závěrem studie připomíná, že hypotermie by měla být zvažována jako „poslední možnost“ léčby, protože doprovodné komplikace jsou časté a mají vážný klinický dopad [97].
Závěr
Cílem článku je přiblížit problematiku cerebrálních vazospazmů optikou současných znalostí, zejména v oblasti diagnostiky a monitorování. Zásadní je časná identifikace CVS a schopnost rychle terapeuticky zasáhnout při rozvoji DCI. Absence větších randomizovaných studií, častá ambivalence dostupných dat a obtížnost jejich interpretace jsou důvody určitého stupně nejistoty při řešení reálných klinických situací. Velký pokrok pro časnou identifikaci pozdní mozkové ischemie a pro správné nastavení léčby je multimodální invazivní monitoring. Kromě již zmíněného klinického významu nabízí také podklady pro lepší pochopení metabolických pochodů v lidském mozku za patologických podmínek.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 4. 4. 2013
Přijato do tisku: 6. 2. 2014
MUDr. Jaroslav Adamkov
Neurochirurgická klinika
LF UK a FN Hradec Králové
Sokolská 5
50005 Hradec Králové
e-mail: jaroslav.adamkov@fnhk.cz
Sources
1. Ignarro LJ. Biosynthesis and metabolism of endothelium ‑ derived nitric oxide. Annu Rev Pharmacol Toxicol 1990; 30 : 535 – 560.
2. Pluta RM. Delayed cerebral vasospasm and nitric oxide: review, new hypothesis, and proposed treatment. Pharmacol Ther 2005; 105(1): 23 – 56.
3. Jung CS, Iuliano BA, Harvey ‑ White J, Espey MG, Oldfield EH, Pluta RM. Association between cerebrospinal fluid levels of asymmetric dimethyl ‑ L ‑ arginine, an endogenous inhibitor of endothelial nitric oxide synthase, and cerebral vasospasm inaprimate model of subarachnoid hemorrhage. J Neurosurg 2004; 101(5): 836 – 842.
4. Thomas JE, Nemirovsky A, Zelman V, Giannotta SL. Rapid reversal of endothelin ‑ 1‑induced cerebral vasoconstriction by intrathecal administration of nitric oxide donors. Neurosurgery 1997; 40(6): 1245 – 1249.
5. Chow M, Dumont AS, Kassell NF. Endothelin receptor antagonists and cerebral vasospasm: an update. Neurosurgery 2002; 51(6): 1333 – 1341.
6. Juvela S. Plasma endothelin concentrations after aneurysmal subarachnoid hemorrhage. J Neurosurg 2000; 92(3): 390 – 400.
7. Seifert V, Löffler BM, Zimmermann M, Roux S, Stolke D. Endothelin concentrations in patients with aneurysmal subarachnoid hemorrhage. Correlation with cerebral vasospasm, delayed ischemic neurological deficits, and volume of hematoma. J Neurosurg 1995; 82(1): 55 – 62.
8. Duerrschmidt N, Wippich N, Goettsch W, Broemme HJ, Morawietz H. Endothelin‑1 induces NAD(P)H oxidase in human endothelial cells. Biochem Biophys Res Commun 2000; 269(3): 713 – 717.
9. Dumont AS, Dumont RJ, Chow MM, Lin CL, Calisaneller T, Ley KF et al. Cerebral vasospasm after subarachnoid hemorrhage: putative role of inflammation. Neurosurgery 2003; 53(1): 123 – 135.
10. Grisham MB, Granger DN, Lefer DJ. Modulation of leukocyte ‑ endothelial interactions by reactive metabolites of oxygen and nitrogen: relevance to ischemic heart disease. Free Radic Biol Med 1998; 25(4 – 5): 404 – 433.
11. Fassbender K, Hodapp B, Rossol S, Bertsch T, Schmeck J, Schütt S et al. Endothelin‑1 in subarachnoid hemorrhage: An acute ‑ phase reactant produced by cerebrospinal fluid leukocytes. Stroke 2000; 31(12): 2971 – 2975.
12. Ni W, Gu XY, Song DL, Leng B, Li PL, Mao Y. The relationship between IL‑6 in CSF and occurrence of vasospasm after subarachnoid hemorrhage. Acta Neurochir Suppl 2011; 110(1): 203 – 208.
13. Ostrowski RP, Colohan AR, Zhang JH. Molecular mechanisms of early brain injury after subarachnoid hemorrhage. Neurol Res 2006; 28(4): 399 – 414.
14. Sehba FA, Mostafa G, Knopman J, Friedrich V jr, Bederson JB. Acute alterations in microvascular basal lamina after subarachnoid hemorrhage. J Neurosurg 2004; 101(4): 633 – 640.
15. Chou SH, Feske SK, Simmons SL. Elevated peripheral neutrophils and matrix metalloproteinase 9 as biomarkers of functional outcome following subarachnoid hemorrhage. Transl Stroke Res 2011; 2(4): 600 – 607.
16. Juul R, Hara H, Gisvold SE, Brubakk AO, Fredriksen TA, Waldemar G et al. Alterations in perivascular dilatory neuropeptides (CGRP, SP, VIP) in the external jugular vein and in the cerebrospinal fluid following subarachnoid hemorrhage. Acta Neurochir 1995; 132(1 – 3): 32 – 41.
17. Edvinsson L, Ekman R, Jansen I, McCulloch J, Mortensen A, Uddman R. Reduced levels of calcitonin gene‑related peptide‑like immunoreactivity in human brain vessels after subarachnoid haemorrhage. Neurosci Lett 1991; 121(1 – 2): 151 – 154.
18. Schebesch KM, Brawanski A, Kagerbauer SM, Martin J, Bele S, Herbst A et al. The possible role of neuropeptide Y after spontaneous subarachnoid hemorrhage. Acta Neurochir 2011; 153(8): 1663 – 1668.
19. Schebesch KM, Brawanski A, Bele S, Schödel P, Herbst A, Bründl E et al. Neuropeptide Y – an early biomarker for cerebral vasospasm after aneurysmal subarachnoid hemorrhage. Neurol Res 2013; 35(10): 1038 – 1043.
20. Lin CL, Hsu YT, Lin TK, Morrow JD, Hsu JC, Hsu YHet al. Increased levels of F2 – isoprostanes following aneurysmal subarachnoid hemorrhage in humans. Free Radic Biol Med 2006; 40(8): 1466 – 1473.
21. Clark JF, Sharp FR. Bilirubin oxidation products (BOXes) and their role in cerebral vasospasm after subarachnoid hemorrhage. J Cereb Blood Flow Metab 2006; 26(10): 1223 – 1233.
22. Qureshi AI, Sung GY, Razumovsky AY, Lane K, Straw RN, Ulatowski JA. Early identification of patiens at risk for symptomatic vasospasm after aneurysmal subarachnoid haemorrhage. Crit Care Med 2000; 28(4): 984 – 990.
23. Rowland MJ, Hadjipavlou G, Kelly M, Westbrook J, Pattinson KTS. Delayed cerebral ischaemia after subarachnoid haemorrhage: looking beyond vasospasm. Br J Anaesth 2012; 109(3): 315 – 329.
24. Hirashima Y, Nakamura S, Endo S, Kuwayama N,Naruse Y, Takaku A. Elevation of platelet activating factor, inflammatory cytokines, and coagulation factors in the internal jugular vein of patients with subarachnoid haemorrhage. Neurochem Res 1997; 22(10): 1249 – 1255.
25. Romano JG, Forteza AM, Concha M, Koch S, Heros RC, Morcos JJ et al. Detection of microemboli by transcranial Doppler ultrasonography in aneurysmal subarachnoid hemorrhage. Neurosurgery 2002; 50(5): 1026 – 1030.
26. Weir B. Aneurysms affecting the nervous system. Baltimore: Williams & Wilkins 1987 : 323 – 324.
27. Vergouwen MD, Vermeulen M, van Gijn J, Rinkel GJ,Wijdicks EF, Muizelaar JP et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid haemorrhage as an outcome event in clinical trials and observational studies: proposal of a multidisciplinary research group. Stroke 2010; 41(10): 2391 – 2395.
28. Okada Y, Shima T, Nishida M, Yamane K, Hatayama T, Yamanaka C, Yoshida A. Comparison of transcranial Doppler investigation of aneurysma vasospasm with digital subtraction angiographic and clinical findings. Neurosurgery 1999; 45(3): 443 – 450.
29. Laumer R, Steinmeier R, Gonner F, Vogtmann T,Priem R, Fahlbusch R. Cerebral hemodynamics in subarachnoid hemorrhage evaluated by transcranial Doppler sonography: Part 1. Reliability of flow velocities in clinical management. Neurosurgery 1993; 33(1): 1 – 9.
30. Vora YY, Suarez ‑ Almazor M, Steinke DE, Martin ML, Findlay JM. Role of transcranial Doppler monitoring in the diagnosis of cerebral vasospasm after subarachnoid hemorrhage. Neurosurgery 1999; 44(6): 1237 – 1248.
31. Clyde BL, Resnick DK, Yonas H, Smith HA, Kaufmann AM. The relationship of blood velocity as measured by transcranial Doppler ultrasonography to cerebral blood flow as determined by stable xenon computed topographic studies after aneurysmal subarachnoid hemorrhage. Neurosurgery 1996; 38(5): 896 – 905.
32. Lindegaard KF, Nornes H, Bakke SJ et al. Cerebral casospasm after aubarachnoid hemorrhage investigated by means of transcranial Doppler ultrasound. Acta Neurochir Suppl (Wien) 1988; 42 : 81 – 84.
33. Sloan MA, Alexandrov AV, Tegeler CV, Spencer MP,Caplan LR, Feldmann E et al. Transcranial Doppler ultrasonography: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2004; 62(9): 1468 – 1481.
34. Dorsch NW. Therapeutic approaches to vasospasm in subarachnoid hemorrhage. Review. Curr Opin Crit Care 2002; 8(2): 128 – 133.
35. Unterberg AW, Sakowitz OW, Sarrafzadeh AS, Benndorf G, Lanksch WR. Role of bedside microdialysis in the diagnosis of cerebral vasospasm following aneurysmal subarachnoid hemorrhage. J Neurosurg 2001; 94(5): 740 – 749.
36. van Santbrink H, vd Brink WA, Steyerberg EW, Carmona Suazo JA, Avezaar CJ, Maas AI. Brain tissue oxygen response in severe traumatic brain injury. Acta Neurochir (Wien) 2003; 145(6): 429 – 438.
37. Steifel MF, Udoetuk JD, Spiotta AM. Conventional neurocritical care and cerebral oxygenation after traumatic brain injury. J Neurosurg 2006; 105(4): 568 – 575.
38. Chen H, Stiefel M, Oddo M, Milby AH, Maloney ‑ Wilensky E, Frangos S et al. Detection of cerebral compromise with multimodality monitoring in patients with subarachnoid hemorrhage. Neurosurgery 2011; 69(1): 53 – 63.
39. Väth A, Kunze E, Roosen K, Meixensberger J. Therapeutic aspects of brain tissue pO2 monitoring after subarachnoid hemorrhage. Acta Neurochir Suppl 2002; 81 : 307 – 309.
40. Oddo M, Milby A, Chen, Frangos S, MacMurtrie E, Maloney ‑ Wilensky E et al. Hemoglobin concentration and cerebral metabolism in patients with aneurysmal subarachnoid hemorrhage. Stroke 2009; 40(4): 1275 – 1281.
41. Ďuriš K, Smrčka M, Ševčík P, Gál R, Juráň V, Neuman E et al. Možnosti využití mozkové tkáňové oxymetrie v detekci vazospazmů u pacientů po subarachnoideálním krvácení. Anest Intenziv Med 2009; 20(2): 102 – 106.
42. Smrčka M, Neuman E, Ďuriš K, Svoboda T, Duba M. Monitoring PtiO2 a změny frakce kyslíku ve vdechované směsi u pacientů po těžkém subarachnoideálním krvácení. Cesk Slov Neurol N 2010; 73/ 106(6): 694 – 700.
43. Ohmae E, Ouchi Y, Oda M, Suzuki T, Nobesawa S,Kanno T et al. Cerebral hemodynamic evaluation by near ‑ infared time ‑ resolved spectroscopy: correlation with simultaneous positron emission tomography measurements. Neuroimage 2006; 29(3): 697 – 705.
44. Habalová J, Kanta M, Ehler E, Náhlovsky J, Bartoš M.Využití regionální mozkové oxymetrie jako neinvazivní metody ke sledování pacientů v neurointenzivní péči. Cesk Slov Neurol N 2010; 73/ 106(3): 285 – 293.
45. Vajkoczy P, Horn P, Thome C, Munch E, Schmiedek P. Regional cerebral blood flow monitoring in diagnosis of delayed ischemia following aneurysmal subarachnoid hemorrhage. J Neurosurg 2003; 98(6): 1227 – 1234.
46. Jaeger M, Soehle M, Schuhmann MU, Winkler D, Meixensberger J. Correlation of continuously monitored regional cerebral blood flow and brain tissue oxygen. Acta Neurochir (Wien) 2005; 147(1): 51 – 56.
47. Persson L, Valtysson J, Enblad P, Warme PE, Cesarini K, Lewen A et al. Neurochemical monitoring using intracerebral microdialysis in patients with subarachnoid hemorrhage. J Neurosurg 1996; 84(4): 606 – 616.
48. Nilsson OG, Brandt L, Ungersted U, Säveland H. Bedside detection of brain ischemia using intracerebral microdialysis:subarachnoid hemorrhage and delayed ischemic deterioration. Neurosurgery 1999; 45(5): 1176 – 1185.
49. Skjøth ‑ Rasmussen J, Schulz M, Kristensen SR, Bjerre P. Delayed neurological deficits detected by an ischemic pattern in the extracellular cerebral metabolites in patients with aneurysmal subarachnoid hemorrhage. J Neurosurg 2004; 100(1): 8 – 15.
50. Schulz MK, Wang LP, Tange M, Bjerre P. Cerebral microdialysis monitoring: determination of normal and ischemic cerebral metabolism in patients with aneurysmal subarachnoid hemorrhage. J Neurosurg 2000; 93(5): 808 – 814.
51. Hejčl A, Bolcha M, Procházka J, Sameš M. Multimodální monitorování mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neurointenzivní péči. Cesk Slov Neurol N 2009; 72/ 105(4): 383 – 387.
52. Klimo P jr, Kestle JR, MacDonald JD, Schmidt RH. Marked reduction of cerebral vasospasm with lumbar drainage of cerebrospinal fluid after subarachnoid hemorrhage. J Neurosurg 2004; 100(2): 215 – 224.
53. Kinouchi H, Ogasawara K, Shimizu H, Mizoi K, Yoshimoto T. Prevention of symptomatic vasospasm after aneurysmal subarachnoid hemorrhage by intraoperative cisternal fibrinolysis using tissue‑type plasminogen activator combined with continuous cisternal drainage. Neurol Med Chir (Tokyo) 2004; 44(11): 569 – 577.
54. Hoh BL, Topcuoglu MA, Singhal AB, Pryor JC, Rabinov JD, Rordorf GA et al. Effect of clipping, craniotomy, or intravascular coiling on cerebral vasospasm and patient outcome after aneurysmal subarachnoid hemorrhage. Neurosurgery 2004; 55(4): 779 – 786.
55. Dumont AS, Crowley RW, Monteith SJ, Ilodigwe D,Kassel NF, Mayer S et al. Endovascular treatment or neurosurgical clipping of ruptured intracranial aneurysms: effect on angiographic vasospasm, delayed ischemic neurological deficit, cerebral infarction, and clinical outcome. Stroke 2010; 41(11): 2519 – 2524.
56. Allen GS, Ahn HS, Preziosi TJ, Battye R, Boone SC, Boone SC et al. Cerebral arterial spasm – a controlled trial of nimodipine in patients with subarachnoid hemorrhage. N Engl J Med 1983; 308(11): 619 – 624.
57. Kasuya H, Hideaki O, Mikihiko T, Yoshikazu O, Tomokastu O. Efficacy and safety of nicardipine prolonged ‑ release implants for preventing vasospasm in humans. Stroke 2002; 33(4): 1011 – 1015.
58. Thomé C, Seiz M, Schubert A, Barth M, Vajkoczy P, Kasuya H et al. Nicardipine pellets for the prevention of cerebral vasospasm. Acta Neurochir Suppl 2011; 110(2): 209 – 211.
59. van den Bergh WM, Algra A, van Kooten F, Dirven CM, van Gijn J, Vermeulen M. Magnesium sulfate in aneurysmal subarachnoid haemorrhage: a randomised controlled trial. Stroke 2005; 36(5): 1011 – 1015.
60. Akdemir H, Kulakszoğlu E, Tucer B, Menkü A, Postalc L, Günald Ö. Magnesium sulfate therapy for cerebral vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurg Q 2009; 19(1): 35 – 39.
61. Tseng MY, Czosnyka M, Richards H, Pickard JD, Kirkpatrick PJ. Effects of acute treatment with pravastatin on cerebral vasospasm, autoregulation, and delayed ischemic deficits after aneurysmal subarachnoid hemorrhage: a phase II randomised placebo ‑ controlled trial. Stroke 2005; 36(8): 1627 – 1632.
62. Kramer AH, Gurka MJ, Nathan B, Dumont AS, Kassel NF, Bleck TP. Statins use was not associated with less vasospasm or improved outcome after subarachnoid hemorrhage. Neurosurgery 2008; 62(2): 422 – 427.
63. Haley EC jr, Kassell NF, Torner JC, Truskowski LL, Germanson TP. A randomised trial of two doses of nicardipin in aneurysmal subarachnoid hemorrhage: A report of the Cooperative Aneurysm Study. J Neurosurg 1994; 80(5): 788 – 796.
64. Honma Y, Fujiwara T, Irie K, Ohkawa M, Nagao S. Morphological changes in human cerebral arteries after percutaneous transluminal angioplasty for vasospasm caused by subarachnoid hemorrhage. Neurosurgery 1995; 36(6): 1073 – 1080.
65. MacDonald RL, Zhang J, Han H. Angioplasty reduces pharmacologically mediated vasoconstriction in rabbit carotid arteries with and without vasospasm. Stroke 1995; 26(6): 1053 – 1060.
66. Newell DW, Elliott JP, Eskridge JM, Aaslid R. Current indications and results of cerebral angioplasty. Acta Neurochir Suppl 2001; 77 : 181 – 183.
67. Zwienenberg ‑ Lee M, Hartman J, Rudisill N, Kennedy LM, Smith K, Eskridge J et al. Effect of prophylactic transluminal balloon angioplasty on cerebral vasospasm and outcome in patients with Fisher grade III subarachnoid hemorrhage: results of a phase II multicenter, randomized, clinical trial. Stroke 2008; 39(6): 1759 – 1765.
68. Jestaedt L, Pham M, Bartsch AJ, Kunze E, Roosen K,Solymosi L et al. The impact of balkon angioplasty on the evolution of vasospasm‑related infarction after aneurysmal subarachnoid hemorrhage. Neurosurgery 2008; 62(3): 610 – 617.
69. Clyde BL, Firlik AD, Kaufmann AM, Spearman MP, Yonas H. Paradoxical aggravation of vasospasm with papaverine infusion following aneurysmal subarachnoid hemorrhage. Case report. J Neurosurg 1996; 84(4): 690 – 695.
70. Andaluz N, Tomsick TA, Tew JM jr, van Loveren HR,YehHS, Zuccarello M. Indications for endovascular therapy for refraktory vasospasm after aneurysmal subarrachnoid hemorrhage: experience at the University of Cincinnati. Surg Neurol 2002; 58(2): 131 – 138.
71. Korenkov AI, Pahnke J, Frei K, Warzok R, Schroeder HW, Frick R et al. Treatment with nimodipine or mannitol reduces programmed cell death and infarct size following focal cerebral ischemia. Neurosurg Rev 2000; 23(3): 145 – 150.
72. Biondi A, Ricciardi GK, Puybasset L, Abdennour L, Longo M, Chiras J et al. Intra ‑ arterial nimodipine for the treatment of symptomatic cerebral vasospasm after aneurysmal subarachnoid hemorrhage: preliminary results. Am J Neuroradiol 2004; 25(6): 1067 – 1076.
73. Stuart RM, Helbok R, Kurtz P, Schmidt M, Fernandez L, Lee K et al. High‑dose intra ‑ arterial verapamil for the treatment of cerebral vasospasm after subarachnoid hemorrhage: prolonged effects on hemodynamic parameters and brain metabolism. Neurosurgery 2011; 68(2): 337 – 345.
74. Fraticelli AT, Cholley BP, Losser BP, Saint Maurice JP,Payen D. Milrinone for the treatment of cerebral vasospasm after aneurysmal subarachnoid hemorrhage. Stroke 2008; 39(3): 893 – 898.
75. Lennihan L, Mayer SA, Fink ME, Beckford A, Paik MC,Zhang H et al. Effect of hypervolemic therapy on cerebral blood flow after subarachnoid hemorrhage: a randomized controlled trial. Stroke 2000; 31(2): 383 – 391.
76. Yamakami I, Isobe K, Yamaura A. Effects of intravascular volume expansion on cerebral blood flow in patients with ruptured cerebral aneurysms. Neurosurgery 1987; 21(3): 303 – 309.
77. Solomon RA, Fink ME, Lennihan L. Prophylactic volume expansion therapy for the prevention of delayed cerebral ischemia after early aneurysm surgery. Results of a preliminary trial. Arch Neurol 1988; 45(3): 325 – 332.
78. Treggiari MM, Walder B, Suter PM, Romand JA. Systematic review of the prevention of delayed ischemic neurological deficits with hypertension, hypervolemia, and haemodilution therapy following subarachnoid haemorrhage. J Neurosurg 2003; 98(5): 78 – 84.
79. Darby JM, Yonas H, Marks EC, Durham S, Snyder RW, Nemoto EM. Acute cerebral blood flow response to dopamine‑induced hypertension after subarachnoid hemorrhage. J Neurosurg 1994; 80(5): 857 – 864.
80. Muizelaar JP, Becker DP. Induced hypertension for the treatment of cerebral ischemia after subarachnoid hemorrhage. Direct effect on cerebral blood flow. Surg Neurol 1986; 25(4): 317 – 325.
81. Dankbaar JW, Slooter AJC, Rinkel GJ, Schaaf IC. Effect of different components of triple ‑ H therapy on cerebral perfusion in patients with aneurysmal subarachnoid haemorrhage: a systematic review. Crit Care 2010; 14(1): R23.
82. Thomas JE, Rosenwasser RH, Armonda RA, Harrop J, Mitchell W, Galaria I. Safety of intrathecal sodium nitroprusside for the treatment and prevention of refractory cerebral vasospasm and ischemia in humus. Stroke 1999; 30(7): 1409 – 1416.
83. Agrawal A, Patir R, Kato Y, Chopra S, Sano H, Kanno T. Role of intraventricular sodium nitroprusside in vasospasm secondary to aneurysmal subarachnoid haemorrhage: a 5‑year prospective study with review of the literature. Minim Invasive Neurosurg 2009; 52(1): 5 – 8.
84. Fathi AR, Pluta RM, Bakhtian KD, Qi M, Lonser RR. Reversal of cerebral vasospasm via intravenous sodium nitrite after subarachnoid hemorrhage in primates. J Neurosurg 2011; 115(6): 1213 – 1220.
85. Oldfield EH, Loomba JJ, Monteith SJ, Crowley RW, Medel R, Gress DR. Safety and pharmacokinetics of sodium nitrite in patients with subarachnoid hemorrhage: a Phase IIA study. Clinical article. J Neurosurg 2013; 119(3): 634 – 641.
86. Shaw M, Vermeulen M, Murray GD, Pickard JD, Bell BA, Teasdale GM. Efficacy and safety of the endothelin, receptor antagonist TAK ‑ 044 in treating subarachnoid hemorrhage: a report by the Steering Committee on behalf of the UK/ Netherlands/ Eire TAK ‑ 044 Subarachnoid Haemorrhage Study Group. J Neurosurg 2000; 93(6): 992 – 997.
87. Macdonald RL, Kassell NF, Mayer S. Clazosentan after subarachnoid hemorrhage (CONSCIOUS ‑ 1): randomized, to overcome neurological ischemia and infarction occurring double‑blind, placebo ‑ controlled phase 2 dose‑finding trial. Stroke 2008; 39(11): 3015 – 3021.
88. Macdonald RL, Higashida RT, Keller E, Mayer SA, Molyneux A, Raabe A et al. Clazosentan, an endothelin receptor antagonist, in patients with aneurysma subarachnoid haemorrhage undergoing surgical clipping: a randomised, double‑blind, placebo ‑ controlled phase 3 trial (CONSCIOUS ‑ 2). Lancet Neurol 2011; 10(7): 618 – 625.
89. Macdonald RL, Higashida RT, Keller E, Mayer SA, Molyneux A, Raabe A et al. Randomized trial of clazosentan in patients with aneurysmal subarachnoid hemorrhage undergoing endovascular coiling. Stroke 2012; 43(7): 1463 – 1469.
90. Vergouwen MD, Algra A, Rinkel GJ. Endothelin receptor antagonists for aneurysmal subarachnoid hemorrhage: a systematic review and meta‑analysis update. Stroke 2012; 43(10): 2671 – 2676.
91. Yanamoto H, Kikuchi H, Sato M, Shimizu Y, Yoneda S, Okamoto S. Therapeutic trial of cerebral vasospasm with the serine protease inhibitor, FUT ‑ 175, administered in the acute stage after subarachnoid hemorrhage. Neurosurgery 1992; 30(3): 358 – 363.
92. Chyatte D, Fode NC, Nichols DA, Sundt TM jr. Preliminary report: effects of high dose methylprednisolone on delayed cerebral ischemia in patients at high risk for vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurgery 1987; 21(2): 157 – 160.
93. Zhang S, Wang L, Liu M, Wu B. Tirilazad for aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev 2010; 2: CD006778.
94. Schubert GA, Poli S, Schilling L, Heiland S, Thomé C.Hypothermia reduces cytotoxic edema and metabolic alterations during the acute phase of massive SAH: a diffusion weighted imaging and spectroscopy study in rats. J Neurotrauma 2008; 25(7): 841 – 852.
95. Wang ZP, Chen HS, Wang FX. Influence of plasma and cerebrospinal fluid levels of ednothelin‑1 and NO in reducing cerebral vasospasm after subarachnoid hemorrhage during treatment with mild hypothermia, in a dog model. Cell Biochem Biophys 2011; 61(1): 137 – 143.
96. Kawamura S, Suzuki A, Hadeishi H, Yasui N, Hatazawa J. Cerebral blood flow and oxygen metabolism during mild hypothermia in patients with subarachnoid haemorrhage. Acta Neurochir 2000; 142(10): 1117 – 1121.
97. Seule MA, Muroi C, Mink S, Yonekawa Y, Keller E.Therapeutic hypothermia in patients with aneurysmal subarachnoid hemorrhage, refractory intracranial hypertension, or cerebral vasospasm. Neurosurgery 2009; 64(1): 86 – 92.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2014 Issue 2
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy
- Porovnanie validity diagnostických kritérií sclerosis multiplex 2005 vs 2010 s aspektom včasnej diagnostiky
- Vývoj neurologického a funkčního obrazu po poranění míchy
- Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
- Posuzování gramatičnosti v Brocově afázii – příklad dvou pacientů
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
- Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- REaDY – český registr svalových dystrofií
- Intoxikace metanolem v obraze magnetické rezonance – kazuistiky
- Krční epidurální absces – dvě kazuistiky
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Nemalinová myopatie asociovaná s monoklonální gamapatií – kazuistika
- Neuromodulace
- Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
- Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Neuromodulace
