Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
Evaluation of Volume Response of Low Grade Glioma to Radiochemotherapy treated for Inoperable Progression or Residual Tumor
Aim:
Evaluation of low-grade glioma clinical and volume response to concomitant and adjuvant chemo-radiotherapy.
Material and methods:
We describe a series of seven patients (five men and two women) with defined progression or an inoperable residual tumor after low-grade glioma surgery. Tumor volume regression was evaluated by means of manual computer volumetry.
Results:
Using computerized volumetric quantification in our pilot set of patients, we observed mean 90% (73–100%) reduction in tumor volume on T1W MRIs and 73% (41–100%) reduction of tumor volume on T2W MRIs. Following cancer treatment, regression of epileptic seizures occurred in three patients, Jacksonian sensory epileptic seizures stayed stable in one patient.
Conclusion:
Combined cancer treatment in patients with inoperable low-grade glioma WHO grade II with low proliferation activity could lead to substantial tumor volume regression in a significant proportion of patients.
Key words:
low-grade glioma – chemotherapy – radiotherapy – temozolomide – computer volumetry
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
R. Bartoš 1,2; F. Třebický 3; A. Malucelli 1,2; A. Hejčl 1,2; J. Zárubová 4; D. Hořínek 1,2; R. Peter 2; M. Sameš 1
Authors‘ workplace:
Neurochirugická klinika Masarykovy nemocnice, Ústí nad Labem
1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
2; Ústav radiační onkologie, Nemocnice Na Bulovce, Praha
3; Neurologické oddělení, Thomayerova nemocnice, Praha
4
Published in:
Cesk Slov Neurol N 2014; 77/110(2): 216-222
Category:
Short Communication
Overview
Cíl:
Vyhodnocení klinické a objemové odpovědi nízkostupňového gliomu na konkomitantní a adjuvantní chemoradioterapii.
Soubor a metodika:
Popisujeme soubor sedmi pacientů (pět žen a dva muži) po operaci nízkostupňového gliomu s potvrzenou progresí či inoperabilním reziduem nádoru. Objemová regrese nádoru byla vyhodnocena metodou manuální počítačové volumetrie.
Výsledky:
V našem pilotním souboru jsme pomocí volumetrické kvantifikace pozorovali průměrnou 90% (73 až 100%) redukci objemu nádoru v T1 vážených obrazech a 73% (41 až 100%) redukci objemu nádoru v T2 vážených obrazech. U tří pacientů došlo po onkologické léčbě k vymizení epileptických záchvatů, u jednoho pacienta zůstaly jacksonské senzitivní epileptické paroxyzmy beze změny.
Závěr:
Kombinovaná onkologická léčba u pacientů s inoperabilním nízkostupňovým gliomem WHO grade II indikovaná přes známky nízké proliferační aktivity může vést u signifikantní části pacientů k významné objemové regresi nádoru.
Klíčová slova:
nízkostupňový gliom – chemoterapie – radioterapie – temozolomid – počítačová volumetrie
Úvod
Kromě prokázaného pozitivního přínosu resekce je význam adjuvantní onkologické léčby u nízkostupňového gliomu WHO grade II stále kontroverzní.
V naší pilotní studii hodnotíme grafický vývoj komplexně onkologicky léčených pacientů po operaci nízkostupňového gliomu s projevy objemové progrese bez známek grafického up ‑ gradingu v průběhu dispenzarizace, kteří podstoupili onkologickou léčbu – radioterapii a chemoterapii.
Materiál a metodika
Soubor
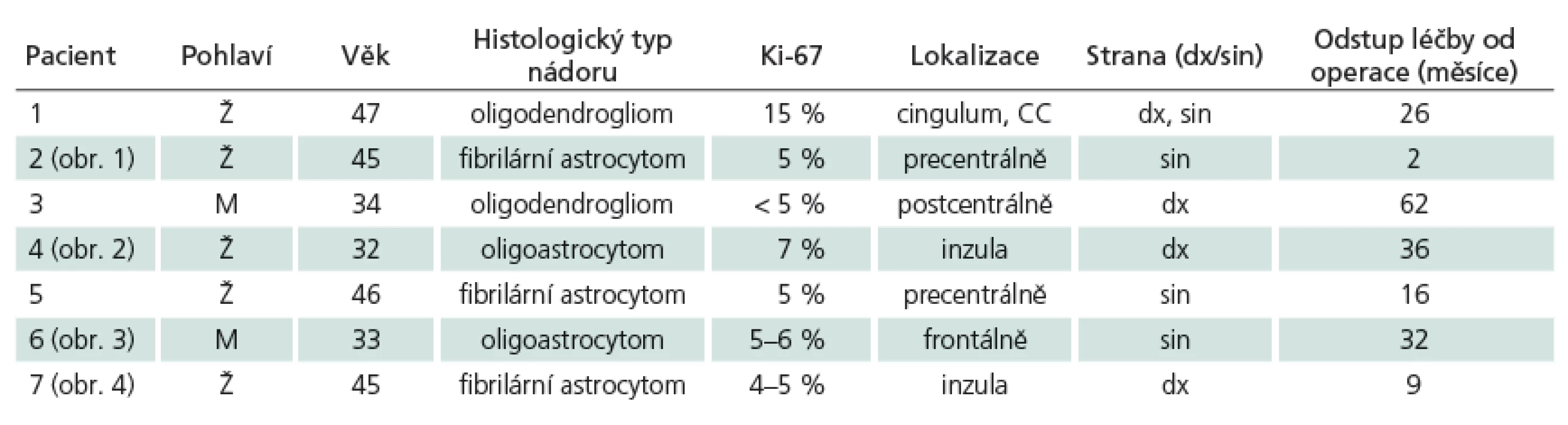
Náš sledovaný soubor tvoří sedm pacientů, pět žen a dva muži, ve věkovém rozmezí 32 až 47 let (průměr 40 let). U všech byl základní typ tumoru určen histologickým vyšetřením po resekci tumoru se snahou o radikalitu (tab. 1).
Hlavní vstupní kritérium byla nepřítomnost známek up ‑ grade gliomu – absence enhancující složky nádoru a výsledek poměru cholinu a N ‑ acetylaspartátu (Cho/ NAA) v tumoru verifikovaný MR spektroskopií, event. PET.
U šesti pacientů se jednalo o objemovou progresi nádoru, která nemohla být z důvodu elokvence řešena další resekcí, u jedné pacientky byla léčba zahájena ihned po operaci pro signifikantní reziduum nádoru difuzně infiltrující primární motorickou kůru.
Léčba
Onkologická léčba spočívala v:
1. Radioterapii
Pacient byl uložen ve standardní supinační poloze s fixací hlavy trojbodovou maskou (Orfit©), bylo provedeno grafické zobrazení skeletu hlavy a mozku na CT přístroji Siemens Somatom s aplikací kontrastní látky v 3mm intervalu CT řezů od vertexu hlavy po skelet obratlů C4/ 5. Do grafického CT zobrazení nekontrastní fáze byla fúzována diagnostická zobrazení T1 a T2 váženými obrazy MR na plánovacím systému Eclips Varian. Do grafického zobrazení byly definovány rizikové orgány (OAR – mozkový kmen, chiazma a optické nervy) a oblasti zájmu: nádorové ložisko (GTV), klinický objem (CTV), plánovaný objem pro iniciální dávku (PTV1 – dávka kumulativní 46 – 50 Gy v referenční izodóze 90 – 95 %) a plánovaný objem pro dávku doplňovací (PTV2 – dávka 10 – 14 Gy v referenční izodóze 92 – 95 % po dokončení fáze léčby pro objem PTV1). Definitivní radiační dávka pro nádorové ložisko (GTV) se v našem souboru pohybovala mezi Dmax 62,9 a 66,5 Gy.
2. Chemoterapii
- a) Potenciační léčba při radioterapii – temozolomid (Temodal®, event. generiky) v dávce 75 mg/ m2 p.o. podání po celou dobu léčby, včetně víkendů (7krát týdně), chemoterapie byla zahájena první den radioterapie v podání 30 min před snídaní na lačno v kombinaci se setrony a ukončena posledním dnem radioterapie.
- b) Systémová adjuvantní léčba – temozolomid v dávce 200 mg/ m2 p.o. D1 – 5 v intervalu 28 dnů, celkem šest cyklů. První cyklus chemoterapie byl zahájen za 30 – 31 dnů od ukončení chemoradioterapie dle klinického stavu pacientů.
Vyšší radiační dávka (Dmax 62,9 – 66,5 Gy) byla indikována specialistou (F. T.), a to z důvodů rizika malignizace nádoru u inoperabilní objemově progredující léze po konvenční radioterapii dávkou 50 – 54 Gy. Dle našeho názoru gliomy potenciálně bez kodelece 1p19q, exprese p53, bez mutace IDH a metylace MGMT budou více směřovat k biologické akceleraci proliferace. V budoucnu se hodláme soustředit na indikaci intenzity onkologické léčby právě na základě výsledku onkocytogenetického vyšetření. Chemoradioterapie a adjuvantní chemoterapie je dle našeho protokolu prováděna s cílem likvidace a stabilizace kmenů buněk, které by při pouhé chemoterapii nastoupily biologickou selekci k chemorezistenci (paralela s malobuněčným plicním karcinomem).
U všech pacientů byl léčebný protokol schválen etickými komisemi obou klinických pracovišť.
V průběhu aplikace chemoradioterapie byli pacienti sledováni hematologicky v intervalu sedmi dnů a dále byly vyhodnocovány biochemické funkce při zahájení a ukončení léčby. U systémové léčby byla hematologická toxicita sledována v intervalu 14 dnů a biochemické parametry po 3. a 6. cyklu. Profylaktické použití antibiotik nebylo u žádného z pacientů indikováno.
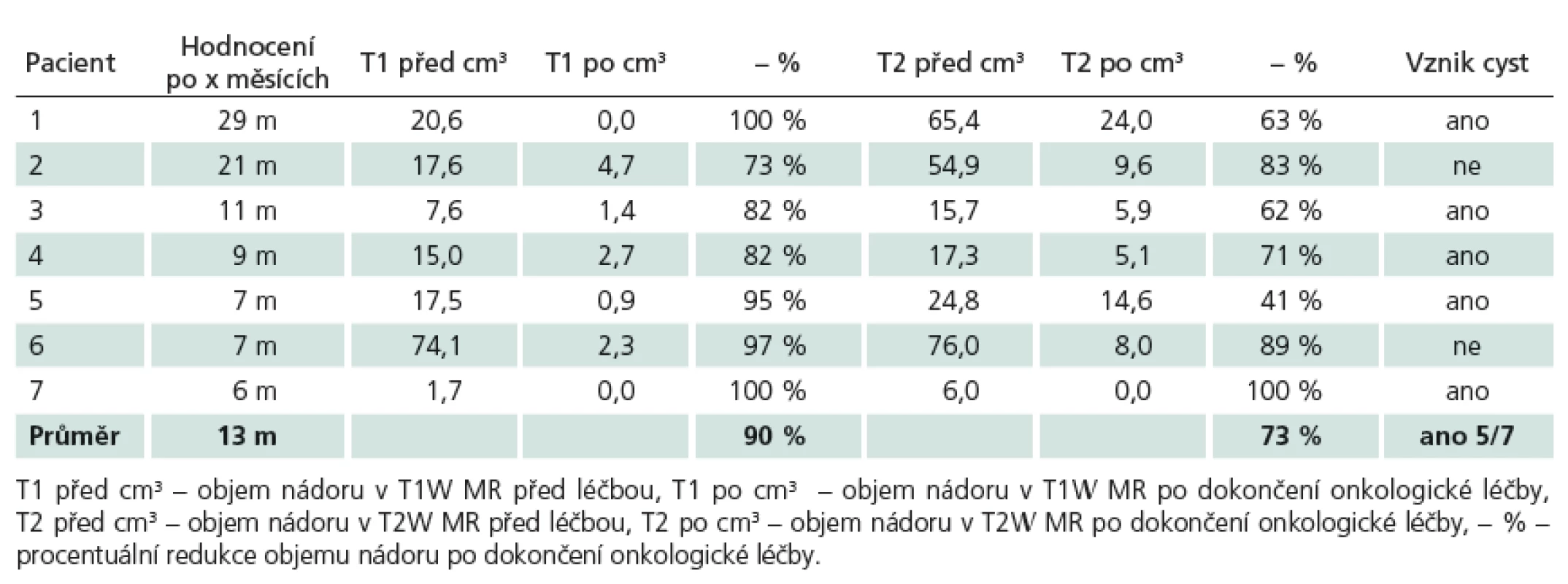
Volumetrické hodnocení efektu léčby
Jako metodu objemového výpočtu výsledku léčby jsme použili objemovou analýzu manuální konturací T1 hypointenzity a T2 hyperintenzity vstupního stavu nádoru a snímků s 6 - až 29měsíčním odstupem po ukončení onkologické léčby. Pro stanovení objemu nádoru jsme použili software StealthDTI (Medtronic, Minneapolis, USA), pro analýzu byly využity axiální T1 a T2 vážené obrazy s vysokým rozlišením vhodné pro použití v módu multiplanar reconstruction (MPR). Pro náběr těchto obrazů byl použit přístroj Symphony 1.5T (Siemens, Erlangen, Německo).
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy etické komise Masarykovy nemocnice odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1974, revidovanou v roce 2000.
Výsledky
Volumetrické hodnocení efektu léčby
Výsledky jsou uvedeny v tab. 2.
Epileptologické výsledky léčby
U tří pacientů došlo po onkologické léčbě k vymizení epileptických záchvatů, u jednoho pacienta zůstaly jacksonské senzitivní epileptické paroxyzmy beze změny a tři pacienti byli i vstupně bez záchvatů.
Nežádoucí účinky
V průběhu radioterapie byly zaznamenány standardní kožní projevy (epilace), u dvou pacientů došlo k přechodnému zpomalení psychomotorického tempa. U žádného pacienta v průběhu radioterapie neproběhl epileptický záchvat.
V průběhu potenciační fáze chemoterapie nebyly pozorovány alergické projevy, gastrointestinální toxicita byla plně sanována setrony (Zofran Zydis 8 mg), v jednom případě byla potenciace zastavena pro projevy hematotoxicity (leukopenie a trombopenie).
Pacientka 7 systémovou adjuvantní léčbu odmítla a je dále sledována. U pacientky 4 došlo v průběhu systémové léčby k projevům dřeňového útlumu s nutností snížení dávky na 150 mg/ m2, její další průběh byl nekomplikovaný. U pacienta 6 byla léčba komplikována pneumonií bez projevů hematologické toxicity.
Diskuze
V českém onkologickém písemnictví toto téma již kazuisticky zpracovali Třebický et al [1], v našem sdělení rozšiřujeme soubor pacientů a zejména odpověď kvantifikujeme pomocí manuální počítačové volumetrie.
Všechny nám dostupné práce používají modifikovaná Macdonaldova kritéria kvantifikace odpovědi nádoru na léčbu [2]. Ta spočívají v měření dvou či tří na sebe kolmých rozměrů nádoru a výpočtu průměrného rozměru nádoru (MTD, Mean Tumor Diameter). Jako kompletní odpověď je hodnocena úplná regrese nádoru ve T2 či flair vážené MR, jako částečná odpověď > 50% regrese, jako méně významná „minor“ odpověď 25 až 50% regrese nádoru, jako progrese > 25% nárůst průměrné velikosti tumoru a stabilní nález zahrnující všechny eventuality mimo výše definované.
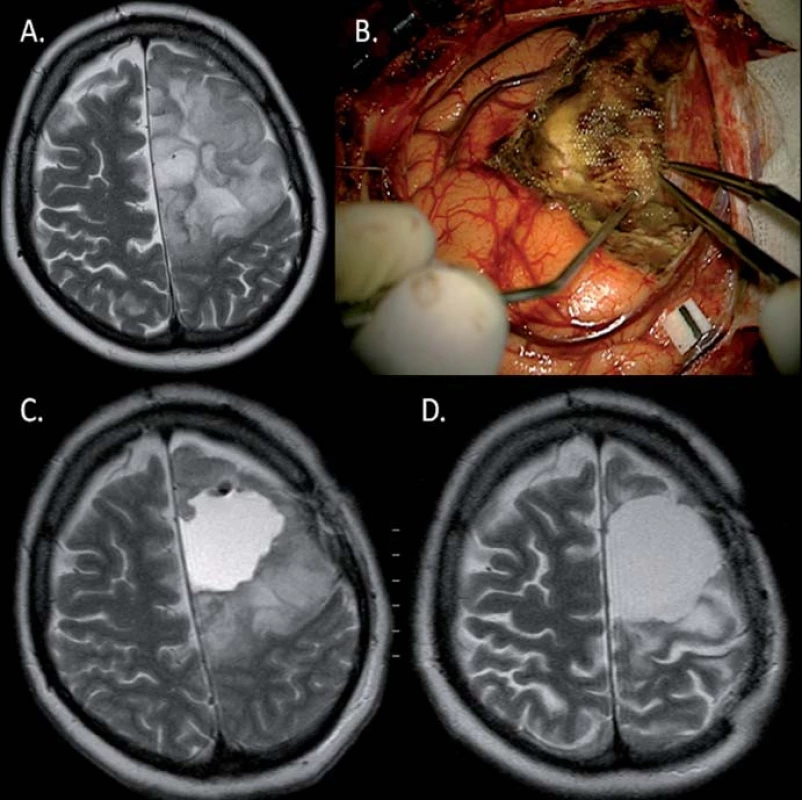
Naše práce na rozdíl od níže citovaných hodnotí efekt léčby přesnější volumetrickou metodou v kubických centimetrech, její větší přesnost oproti měření průměrů nádoru jsme prokázali v naší předchozí práci o inzulárních gliomech [3]. Rádi bychom v českém a slovenském neurochirurgickém prostředí upozornili na doposud opomíjenou metodu léčby progredujících či neresekabilních nízkostupňových gliomů WHO grade II (LGG). V našich podmínkách převažuje jako metoda volby observace a vyčkávání známek malignizace nádoru či izolovaná radioterapie bez potenciační a adjuvantní chemoterapie temozolomidem. Nutno však doplnit, že o následné onkologické léčbě uvažujeme až po objektivním vyloučení dalšího resekčního výkonu.
V našem malém volumetricky hodnoceném souboru jsme zaznamenali v T2 vážené MR jednu kompletní odpověď (14 %), v pěti případech (71%) částečnou odpověď a v jednom případě „minor“ odpověď (14 %). V 71 % došlo ke vzniku drobných intratumorálních cyst, nezjistili jsme lineární závislost mezi dobou od započetí onkologické léčby a objemovou odpovědí.
Velice zajímavý je článek francouzských autorů [4], jenž hodnotí vývoj LGG před používáním temozolomidu v léčbě a během ní – na velkém souboru 107 pacientů. Autoři si všímají přirozeného vývoje LGG a stanovují průměrný přírůstek střední velikosti nádoru (MTD) 4,76 mm/ rok, růst závisí na stavu 1p19q kodelece; pokud je tato přítomna, růst je pomalejší (3,4 mm/ rok), naopak nepřítomnost 1p19q kodelece je prognosticky nepříznivý znak s průměrnou rychlostí nárůstu MTD o 5,9 mm/ rok.
Po léčbě temozolomidem došlo v citovaném souboru během celkové doby sledování u 20 pacientů (18,6 %) k částečné odpovědi, u 45 pacientů (42 %) k málo významné „minor“ odpovědi, u 35 pacientů (32,7 %) zůstal nádor stabilní a u sedmi pacientů (6,5 %) došlo k jeho progresi. K častější objektivní odpovědi docházelo u pacientů s 1p19q kodelecí (73 vs 50 %). U 98 ze 107 pacientů (92 %) došlo alespoň k dočasné odpovědi, u 77 z nich bezprostředně po podání léčby a u 21 opožděně v mediánu 116 dní (48 – 206). Došlo k průměrnému zmenšení MTD o 9,2 mm/ rok ( – 0,5 až – 39,1 mm/ rok).
Ale 36 pacientů navzdory kontinuálnímu podávání temozolomidu zaznamenalo po střední době 367 dní (98 – 756) opětovný růst nádoru, riziko opětovného růstu bylo signifikantně větší při nepřítomnosti kodelece 1p19q (60,6 vs 16,6 %) nebo při detekovatelnosti p53 (70,5 vs 25 %). Získaná chemorezistence se tedy vyvíjí daleko častěji a rychleji u pacientů, kteří exprimují p53 a nenesou 1p19q kodeleci.
Zajímavou otázku v sobě nese přerušení léčby. Většina nádorů začne poté růst znovu, v 59 % vzniká riziko opětovného růstu po střední době sledování 200 dní (60 – 630). Ideální je dle autorů tedy hodnocení efektu léčby za kontinuálního volumetrického sledování a její přerušení eventuálně až po obrácení růstové křivky, ke kterému ve většině případů dochází.
Další možností kvantifikace je měření nádoru pouze ve dvou na sebe kolmých rovinách na transverzálním řezu o největším rozměru nádoru ve flair sekvenci tak, jak to činí ve svém menším souboru Brada et al [5]. V souboru 30 pacientů s fibrilárními astrocytomy, oligodendrogliomy a smíšenými gliomy zaznamenali parciální odpověď u tří pacientů, „minor“ odpověď u 14 pacientů, stabilní onemocnění u 11 pacientů a progresi u jednoho. Tříletý Progression Free Survival (PFS)byl 66 % a přežití bylo v tomto období 82 %. Autoři vyzdvihují pozitivum klinic-kého dopadu – kompenzaci epileptických záchvatů; 15 pacientů z 28 s epilepsií (54 %) zaznamenalo redukci frekvence záchvatů a šest z nich bylo zcela bez záchvatů. V našem malém souboru jsme pozorovali tento příznivý klinický efekt léčby u tří ze čtyř pacientů s epileptickými záchvaty.
Další francouzská práce, jež rovněž vyzdvihuje příznivý klinický dopad pro pacienty s oligodendrogliomy a oligoastrocytomy, hodnotí 60 pacientů [6]. Ke klinickému zlepšení došlo v 51 % (u 30 pacientů) s refrakterní epilepsií, včetně 12 pacientů z 36 radiologicky stabilních. K objektivní radiologické odpovědi došlo v 31 % (17 % částečná a 14 % „minor“), onemocnění bylo u 61 % pacientů graficky stabilní a v 8 % nádor progredoval. Důležité je hodnocení střední doby do maximální odpovědi – ta byla 12 měsíců v rozmezí od 5 do 20.
Výše uvedená práce byla definitivně publikována po rozšíření na 149 pacientů, tedy se jedná o početně nejsilnější soubor pacientů [7]. Temozolomid byl podáván v konvenčním dávkování, střední počet cyklů čítal 14. Celkem 77 pacientů (53 %) zaznamenalo objektivní odpověď, u 22 (15 %) byla částečná, u 55 pacientů (38 %) se jednalo o „minor“ odpověď, u 55 pacientů (37 %) se onemocnění stabilizovalo a u 14 pacientů (10 %) došlo k progresi. Střední čas do maximální odpovědi trval shodně s pilotní prací 12 měsíců (3 – 30). Genotypizace byla provedena u 86 pacientů, kodelece 1p19q byla přítomna u 42 % a byla spojena s vyšší četností (72 vs 46 %) a delší dobou odpovědi, delším PFS a dobou přežití. Trend příznivého působení na kompenzaci epileptických záchvatů trval, k > 50% snížení četnosti epileptických záchvatů došlo u 87 pacientů (58 %).
Opačný výsledek stran vlivu onkogenetických faktorů na efekt léčby měla kooperativní holandská studie zahrnující 58 pacientů [8]. Zkoumala však efekt temozolomidu při progresi po radioterapii a vysoké procento pacientů mělo enhancující lézi. Hodnotila přítomnost mutací v IDH1, IDH2, TP53 genech, metylaci promotoru MGMT, trizomii 7. chromozomu a kodeleci 1p19q. Objektivní radiologická odpověď nastala v 54 %. Nebyla však zjištěna vazba výše uvedených genetických faktorů na PFS či celkové přežití po léčbě temozolomidem. Autoři uvádějí, že mutace promotoru MGMT a IDH1 mají vliv na dobu přežití od doby diagnózy, nikoliv na výsledek po léčbě temozolomidem při progresi.
Některé studie hodnotí význam intenzifikovaného denního podávání temozolomidu oproti standardnímu 5dennímu cyklu [9,10]. Primárním účelem pilotní práce [9] čítající 25 pacientů bylo určení toxicity léčby. Intenzifikované dávkování (75 mg/ m2/ den při podávání ve dnech 1 – 21 z 28denního cyklu) by mělo mít oproti standardnímu dávkování (200 mg/ m2/ den při podávání ve dnech 1 – 5 z 28denního cyklu) výhodu větší kumulativní expozice léku a deplece hladiny O6 - alkylguanine DNA alkyltransferázy, a tím by mělo překonávat intrinsickou chemorezistenci. Nejčastějšími vedlejšími nežádoucími účinky byly únava (76 %), lymfocytopenie (72 – 48 %, vysokého stupně), zácpa (56 %) a nauzea (52 %). Vysokostupňové toxicity (jiné než lymfocytopenie) zahrnovaly sekundární malignitu – difuzní velkobuněčný B lymfom, pruritus, hyponatremii, neutropenii, leukocytopenii a kognitivní pokles, každá z nich nastala v jednom případě. Lymfocytopenie nejčastěji vznikala po 6. cyklu podávání temozolomidu. Výhodou temozolomidu oproti PCV (prokarbazin‑lomustin‑vinkristin) je absence kumulativní toxicity, jež umožňuje dlouhodobé podávání.
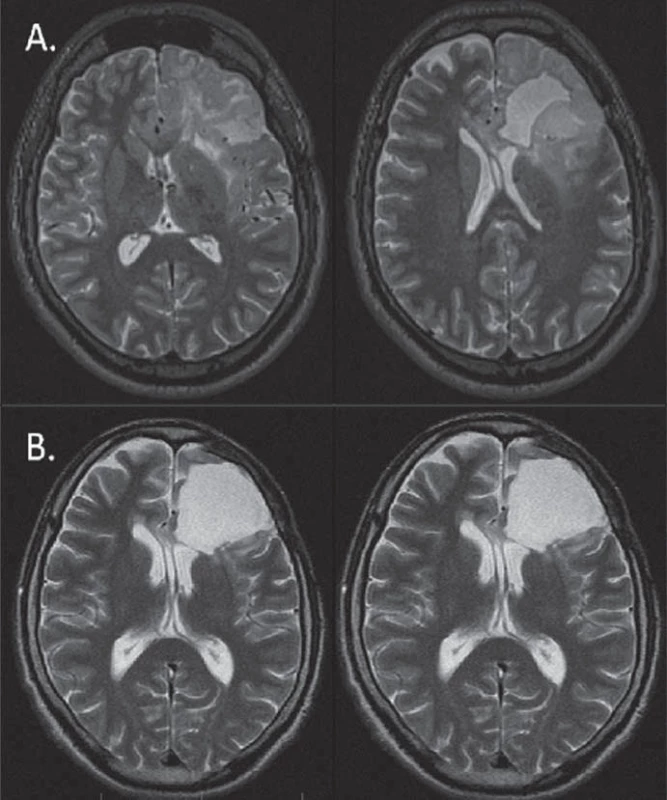
V další klinické studii, čítající 30 pacientů [10] nastala objektivní odpověď v 30 %, kontrola onemocnění v 86 %, PFS jeden, resp. dva roky byl 73 % a 43 %. Výsledky se tedy podobaly konvenčnímu dávkování, ke snížení frekvence epileptických záchvatů došlo u 62 % symptomatických pacientů. V této práci kodelece 1p19q nekorelovala s PFS ani s dobou přežití, což však autoři vysvětlují možnou vyšší citlivostí intenzifikovaného režimu chemoterapie i na 1p19q intaktní tumory.
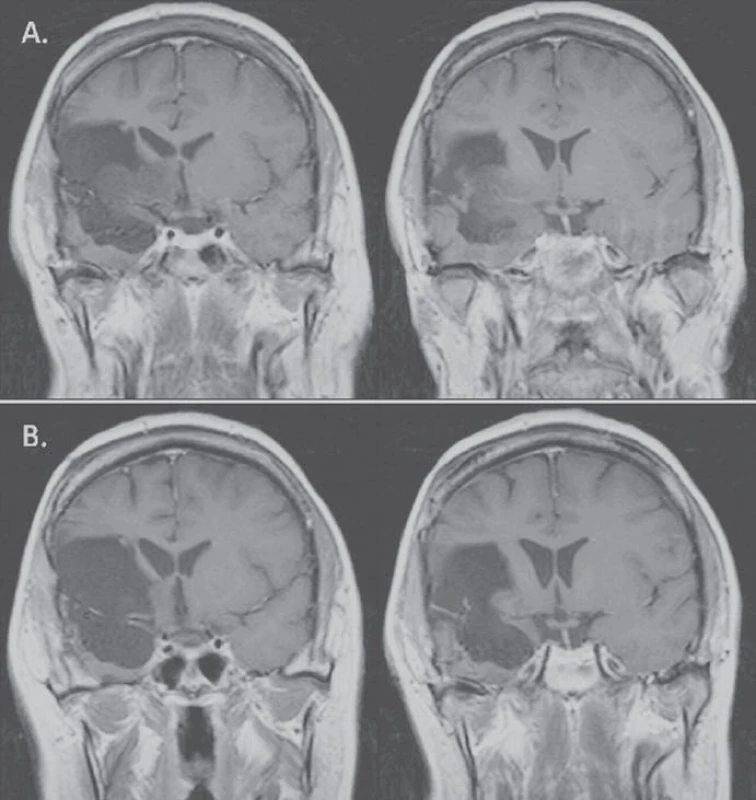
V naší práci jsme zaznamenali v jednom případě kompletní odpověď v T1 i T2 vážené MR. To je v rešerši literatury spíše výjimka. Práce, která taktéž popisuje kompletní odpověď, hodnotí léčbu progredujících LGG u 46 pacientů [11], bias však představuje zařazení pěti pilocytických astrocytomů a dětských pacientů, navíc v 70 % se jednalo o enhancující léze, tedy potenciálně gliomy vyššího grade. Kompletní odpověď nastala u čtyř pacientů, objektivní odpověď nastala v 61 %, u 35 % pacientů zůstalo onemocnění stabilní, 6 a 12měsíční PFS byla 98 %, resp. 76 %. V našem souboru se jednalo ve všech případech o neenhancující léze, v případě kompletní odpovědi o velice drobné reziduum 6 cm3 inzulárního gliomu (obr. 4).
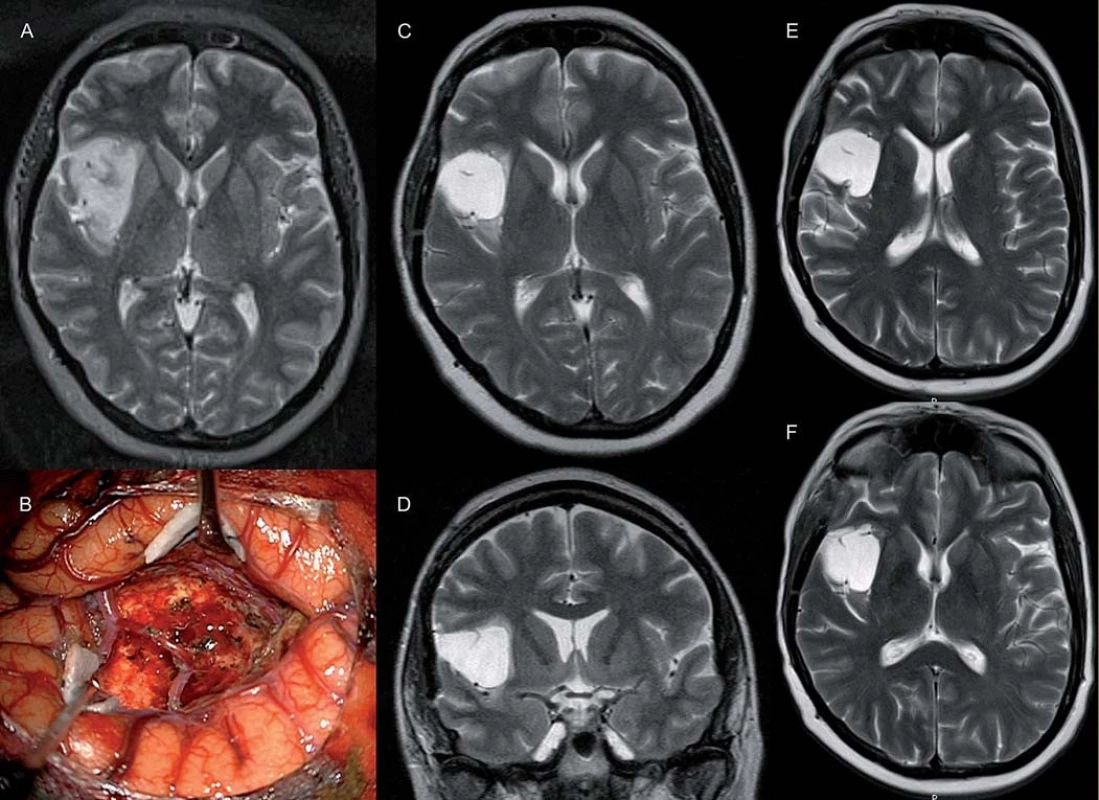
Závěr
Kombinovaná onkologická léčba u pacientů s neresekovatelným nízkostupňovým gliomem WHO grade II indikovaná přes známky nízké proliferační aktivity může vést u signifikantní části pacientů k významné objemové regresi nádoru. Příznivý je taktéž antiepileptogenní potenciál objemové redukce nádoru. Léčba by měla být volumetricky kvantifikována a k jejímu přerušení by měl onkolog přistoupit až po obrácení růstové křivky nádoru.
V našem pilotním souboru jsme po chemoradioterapii s aplikací vyšší radiační dávky (Dmax 62,9 – 66,5 Gy) pomocí volumetrické kvantifikace pozorovali průměrnou 90% (73 až 100%) redukci objemu nádoru v T1 vážených obrazech a 73% (41 až 100%) redukci objemu nádoru v T2 vážených obrazech. U pěti ze sedmi pacientů taktéž došlo po léčbě ke vzniku drobných (cca 5mm) intratumorálních cyst. Všechny vedlejší nežádoucí účinky byly předpokládatelné, vážnější korigovatelné a neohrozily celkový stav pacienta.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 11. 4. 2013
Přijato do tisku: 5. 11. 2013
MUDr. Robert Bartoš Ph.D.
Neurochirurgie
Masarykova nemocnice
Sociální péče 12A
400 11 Ústí nad Labem
e-mail: robert.bartos@kzcr.eu
Sources
1. Třebický F, Kubeš J, Bartoš R, Malucelli A, Sameš M et al. Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up ‑ gradingu. Klin Onkol 2012; 25(4): 294 – 298.
2. Macdonald DR, Cascino TL, Schold SC jr, Cairncross JG.Response criteria for phase II studies of supratentorial malignant glioma. J Clin Oncol 1990; 8(7): 1277 – 1280.
3. Bartoš R, Sameš M, Zolal A, Radovnický T, Hejčl A, Vachata P et al. Resekce insulárních gliomů – volumetrické hodnocení radikality. Cesk Slov Neurol N 2009; 72/ 105(6): 534 – 541.
4. Ricard D, Kaloshi G, Amiel ‑ Benouaich A, Lejeune, Marie Y, Mandonnet E et al. Dynamic history of low ‑ grade gliomas before and after temozolomide treatment. Ann Neurol 2007; 61(5): 484 – 490.
5. Brada M, Viviers L, Abson C, Hines F, Britton J,Ashley S et al. Phase II study of primary temozolomide chemotherapy in patients with WHO grade II gliomas. Ann Oncol 2003; 14(12): 1715 – 1721.
6. Hoang ‑ Xuan K, Capelle L, Kujas M, Taillibert S, Duffau H, Lejeune J et al. Temozolomide as initial treatment for adults with low ‑ grade oligodendrogliomas or oligoastrocytomas and correlation with chromosome 1p deletions. J Clin Oncol 2004; 22(15): 3133 – 3137.
7. Kaloshi G, Benouaich ‑ Amiel A, Diakite F, Taillibert S,Lejeune J, Laigle ‑ Donadey F et al. Temozolomide for low ‑ grade gliomas: predictive impact of 1p/ 19q loss on response and outcome. Neurology 2007; 68(21); 1831 – 1836.
8. Taal W, Dubbink HJ, Zonnenberg CB, Zonnenberg BA, Postma TJ et al. First‑line temozolomide chemotherapy in progressive low ‑ grade astrocytomas after radiotherapy: molecular characteristics in relation to response. Neuro Oncol 2011; 13(2): 235 – 241.
9. Pouratian N, Gasco J, Sherman JH, Shaffrey ME, Schiff D. Toxicity and efficacy of protracted low dose temozolomide for the treatment of low grade gliomas. J Neurooncol 2007; 82(3): 281 – 288.
10. Tosoni A, Franceschi E, Ermani M, Bertorelle R, Bonaldi L, Blatt V et al. Temozolomide three weeks on and one week off as first line therapy for patients with recurrent or progressive low grade gliomas. J Neurooncol 2008; 89(2): 179 – 185.
11. Pace A, Vidiri A, Galiè E, Carosi M, Telera S, Cianciulli AM et al. Temozolomide chemotherapy for progressive low ‑ grade glioma: clinical benefits and radiological response. Ann Oncol 2003; 14(12): 1722 – 1726.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2014 Issue 2
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Ortostatická hypotenze jako autonomní dysregulační porucha po poranění krční míchy
- Porovnanie validity diagnostických kritérií sclerosis multiplex 2005 vs 2010 s aspektom včasnej diagnostiky
- Vývoj neurologického a funkčního obrazu po poranění míchy
- Vztah mezi parametry transkraniální dopplerometrie a tkáňovou oxymetrií u pacientů s těžkým subarachnoidálním krvácením
- Posuzování gramatičnosti v Brocově afázii – příklad dvou pacientů
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Volumetrické vyhodnocení efektu následné onkologické léčby při inoperabilní progresi či reziduu nízkostupňového gliomu
- Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- REaDY – český registr svalových dystrofií
- Intoxikace metanolem v obraze magnetické rezonance – kazuistiky
- Krční epidurální absces – dvě kazuistiky
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Nemalinová myopatie asociovaná s monoklonální gamapatií – kazuistika
- Neuromodulace
- Alkoholový odvykací stav a delirium – od patofyziologie k léčbě
- Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy
- Syndrom Dravetové: těžká myoklonická epilepsie v časném dětství – kazuistiky
- Normativní hodnoty parametrů vedení pro nervus ulnaris a nervus medianus měřené standardizovaným způsobem
- Neuromodulace