Rozdíly v postižení prostorové orientace u demencí neurodegenerativní etiologie
Differences in Spatial Navigation Impairment in Neurodegenerative Dementias
Impairment of multiple cognitive domains, including spatial navigation, leads to deterioration of self-sufficiency, a characteristic feature of patients with dementia. Spatial navigation is divided into three basic components that depend on different brain structures – navigation using a close orientation cue (cued), starting position of the body (egocentric) and distant orientation cue (allocentric). The aim of the study was to compare differences in impairment of these spatial navigation components in patients with the most common types of neurodegenerative dementias. In total, 78 patients with neurodegenerative dementias of various etiologies were divided into three groups: Alzheimer’s disease (AD, n = 61), frontotemporal lobar degeneration (FTLD, n = 9) and dementia with Lewy bodies (DLB, n = 8). All subjects were examined in an experimental device called the Blue Velvet Arena that allows researchers to measure performance in each of the three navigation components. The results of the different tests were subsequently compared. In the cued navigation test, the FTLD group performed better than the AD (p = 0.03) and DLB (p = 0.006) groups. Furthermore, in the egocentric navigation test, the DLB group was outperformed by AD (p = 0.012) and FTLD (p = 0.012) groups. Finally, in the allocentric navigation test there were no differences among the groups (p = 0.069). Our results show that spatial navigation impairment may be least pronounced in FTLD patients and most pronounced in DLB patients. There are specific differences in spatial navigation impairment among patients with AD, FTLD and DLB that can be measured with the Blue Velvet Arena device.
Key words:
Alzheimer’s disease – frontotemporal lobar degeneration – dementia with Lewy bodies – spatial orientation
Authors:
J. Cerman 1; J. Laczó 1,2; M. Vyhnálek 1; K. Vlček 3; O. Lerch 1; K. Sheardová 2; J. Hort 1,2
Authors‘ workplace:
Neurologická klinika 2. LF UK a FN v Motole, Praha
1; ICRC, Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
2; Oddělení neurofyziologie paměti, Fyziologický ústav AV ČR, v. v. i., Praha
3
Published in:
Cesk Slov Neurol N 2014; 77/110(4): 449-455
Category:
Original Paper
Overview
Pro pacienty s demencí je charakteristická porucha soběstačnosti v důsledku postižení více kognitivních domén zahrnujících i prostorovou orientaci, která se dělí na tři základní komponenty závisející na odlišných mozkových strukturách: orientaci podle blízké značky, orientaci podle výchozí pozice těla a orientaci podle vzdálené značky. Cílem této studie bylo porovnat rozdíly v postižení těchto tří základních komponent prostorové orientace u nejčastějších demencí neurodegenerativní etiologie. Studie se zúčastnilo celkem 78 pacientů s degenerativními demencemi různé etiologie: s Alzheimerovou chorobou (n = 61), frontotemporální lobární degenerací (n = 9) a demencí s Lewyho tělísky (n = 8). Pacienti byli vyšetřeni v experimentálním zařízení Blue Velvet Arena, které umožňuje měřit výkon v každé ze tří základních komponent prostorové orientace, a následně byly jejich výsledky v jednotlivých testech vzájemně porovnávány. V testu orientace podle blízké orientační značky měla skupina pacientů s frontotemporální lobární degenerací lepší výkon než skupina s Alzheimerovou chorobou (p = 0,03) a demencí s Lewyho tělísky (p = 0,006). V testu orientace podle výchozí pozice měla skupina s demencí s Lewyho tělísky horší výkon než skupina s Alzheimerovou chorobou (p = 0,012) a pacienti s frontotemporální lobární degenerací (p = 0,012). V testu orientace podle vzdálené orientační značky jsme mezi skupinami nenalezli signifikatní rozdíly (p = 0,069). Naše výsledky ukazují nejmírnější postižení prostorové orientace u pacientů s frontotemporální lobární degenerací a nejvýraznější u pacientů s demencí s Lewyho tělísky. V postižení prostorové orientace u pacientů s Alzheimerovou chorobou, frontotemporální lobární degenerací a demencí s Lewyho tělísky existují specifické rozdíly, které lze změřit v experimentálním zařízení Blue Velvet Arena.
Klíčová slova:
Alzheimerova choroba – frontotemporální lobární degenerace – demence s Lewyho tělísky – prostorová orientace
Úvod
Pacienti s demencí mají postižení více kognitivních funkcí, které vede k postupné ztrátě soběstačnosti. Na zhoršení jejich soběstačnosti se často také podílejí poruchy orientace v prostoru, což je dobře patrno i v klinické praxi. Postižení prostorové orientace se projevuje klinicky nejprve v neznámých či méně známých prostředích, jež pacient nenavštěvuje příliš často (cesta k příbuzným v jiném městě či na druhém konci města) nebo v prostředích, která kladou na prostorovou orientaci zvýšené nároky (velké obchodní domy, parkoviště). Až v pozdějších stadiích onemocnění může být narušena i orientace postiženého v dlouhodobě a důvěrně známém prostředí. Poruchy prostorové orientace bývají typické a často se vyskytují u pacientů s demencí v důsledku Alzheimerovy choroby (ACH) [1,2]. Poruchu prostorové orientace nebo alespoň epizody prostorové dezorientace lze pozorovat také u jiných demencí, především u demence s Lewyho tělísky (DLB) a v pozdějších stadiích i u frontotemporální lobární degenerace (FTLD) [3], avšak tíže a frekvence postižení bývá u těchto typů demencí dle klinických zkušeností rozdílná.
Prostorová orientace se podle způsobu využívání informací z okolního prostředí člení na tři základní komponenty, které závisejí na odlišných mozkových strukturách a vyznačují se různým stupněm náročnosti [4]. První a nejjednodušší z nich je orientace podle blízké orientační značky, která umožňuje najít cíl cesty, jenž je v bezprostřední blízkosti viditelného orientačního bodu (značky). Pro tento typ orientace je nezbytné neporušené zrakové vnímání a zachovalá funkce striata. Další komponentou orientace je orientace egocentrická neboli orientace podle výchozí pozice svého těla, jež vyžaduje tvorbu složitějších prostorových vztahů vzhledem k vlastnímu tělu (např. kterým směrem je třeba se vydat a kolik kroků je nutné potom ujít). Tento typ orientace závisí na správné funkci zadního parietálního laloku a její postižení se může mimo jiné projevit poruchou pravolevé orientace. Nejpokročilejší komponentou prostorové orientace je orientace alocentrická, která umožňuje najít požadovaný vzdálený cíl nezávisle na momentální vlastní poloze subjektu, i z dosud neznámého místa. Pro její správnou funkci je nezbytné vytvoření si vzájemných složitých prostorových vztahů mezi polohou cíle a orientačních bodů. Tento typ orientace je závislý na meziotemporálních strukturách.
V posledních letech vzrůstá počet studií, které se zabývají postižením prostorové orientace u pacientů s ACH. Tyto studie prokázaly postižení všech komponent prostorové orientace, především egocentrické a alocentrické [5 – 8], a to nejen u pacientů s plně rozvinutou formou demence v důsledku ACH, ale dokonce i u pacientů ve velmi časných stadiích, ještě před rozvojem samotného syndromu demence – ve stadiu mírné kognitivní poruchy, kdy jsou pacienti i přes své objektivní kognitivní obtíže stále ještě soběstační. Rovněž se ukazuje, že tíže postižení prostorové orientace u nich úzce souvisí s objemem hipokampu [9] a narušením funkce parietálního laloku a striata [10,11], tedy struktur, které jsou pro tyto tři základní komponenty prostorové orientace klíčové.
Množství studií zaměřených na prostorovou orientaci u pacientů s demencí v důsledku ACH kontrastuje s množstvím studií zkoumajících pacienty s jinými druhy demence. Ačkoli je například u pacientů s DLB dlouhodobě známo, že mají již v časných stadiích postiženy vizuo ‑ konstruktivní funkce (obkreslení křížících se pentagramů) [12], studie na prostorovou orientaci u nich nebyly zatím prováděny. Vzhledem k tomu, že u DLB dominuje výraznější postižení parietálního laloku než u pacientů s ACH, dá se u nich předpokládat horší výkon v prostorové orientaci vázané na tento lalok, tedy v orientaci egocentrické. U pacientů s FTLD dominují zpočátku poruchy chování a exekutivních funkcí nebo poruchy řečových funkcí, přičemž ostatní kognitivní funkce bývají dlouho zachovány. Podobně vyznívají ojedinělé studie naznačující ušetření prostorové orientace u pacientů s FTLD, ve srovnání s pacienty s ACH [13,14]. S progresí onemocnění, především s jeho propagací dále do temporálního laloku a také prohlubujícím se postižením exekutivních funkcí, které jsou důležité pro plánování trasy a volbu různých strategií včetně strategií prostorové orientace, lze ale předpokládat postupný rozvoj mírného postižení prostorové orientace. Studie, jež by přímo srovnávaly rozsah a charakter narušení prostorové orientace u jednotlivých typů demencí, dosud nebyly prováděny.
Cílem naší práce bylo porovnat rozdíly v postižení tří základních komponent prostorové orientace u nejčastějších demencí neurodegenerativní etiologie – ACH, DLB a FTLD. Pokud by se potvrdila hypotéza, že mezi těmito demencemi existují specifické rozdíly v postižení prostorové orientace a že tyto rozdíly lze účinně měřit, mohlo by testování prostorové orientace napomoci v diferenciální diagnostice syndromu demence neurodegenerativní etiologie.
Soubor a metodika
Studie se zúčastnilo 78 pacientů s lehkou demencí, kteří byli vyšetřeni v Kognitivním centru při Neurologické klinice 2. LF UK a FN v Motole a podepsali informovaný souhlas s vyšetřením. Všichni pacienti prošli standardním protokolem, jenž se skládá z neurologického a laboratorního vyšetření, magnetické rezonance (MR) mozku a specializovaného neuropsychologického vyšetření obsahujícího následující testy: Mini Mental State Examination (MMSE), paměťový test učení (AVLT), zkrácená verze Grober ‑ Bushkeho testu 16 slov – Enhanced cued recall (ECR), Digit span – dopředný a obrácený, test verbální fluence (FAS), test cesty A a B (TMT A a B), Reyovu ‑ Osterriethovu komplexní figuru a Bostonský test pojmenování. Všichni pacienti navíc podstoupili vyšetření prostorové orientace v experimentálním zařízení zvaném Blue Velvet Arena (BVA). Do studie nebyli zařazeni pacienti s anamnézou nebo známkami cévní mozkové příhody na MR mozku a středně těžkými nebo těžkými cévními změnami na MR, které odpovídaly skóre ≥ 2 bodů dle Fazekase et al [15]. Dále do studie nebyli zahrnuti pacienti, kteří nebyli schopni podstoupit či dokončit experimentální vyšetření nebo s tímto vyšetřením neprojevili souhlas.
Testované osoby byly podle publikovaných kritérií rozděleny do tří skupin: pacienti s ACH (n = 61), FTLD (n = 9) a DLB (n = 8). Základní charakteristika vyšetřených skupin je uvedena v tab. 1. U pacientů s ACH a DLB byla diagnóza demence stanovena pomocí DSM IV ‑ TR kritérií – pacienti měli objektivizovanou poruchu paměti a minimálně jedné další složky kognice a měli narušeny aktivity denního života. Diagnóza ACH (n = 61) byla stanovena pomocí National Institute of Neurological and Communicative Disorders and Stroke and Alzheimer Disease and Related Disorders Association (NINCDS ‑ ADRDA) kritérií [16] a do souboru byli zařazeni pouze pacienti s pravděpodobnou ACH. U 12 pacientů byla diagnóza dále podpořena vyšetřením biomarkerů v likvoru (zvýšený fosforylovaný i celkový tau protein a snížený beta amyloid) [17]. Diagnóza DLB (n = 8) byla stanovena pomocí DLB Consortium diagnostických kritérií [18] a do souboru byli zařazeni pouze pacienti s pravděpodobnou DLB. Diagnóza FTLD (n = 9) byla stanovena pomocí Nearyho kritérií [19]. Do této skupiny byli zařazeni pacienti s behaviorální variantou FTLD (n = 5) a primární progresivní afázií (n = 4) – jak se sémantickou (n = 3), tak i non‑fluentní (n = 1) variantou. Žádný pacient neměl variantu logopenickou.
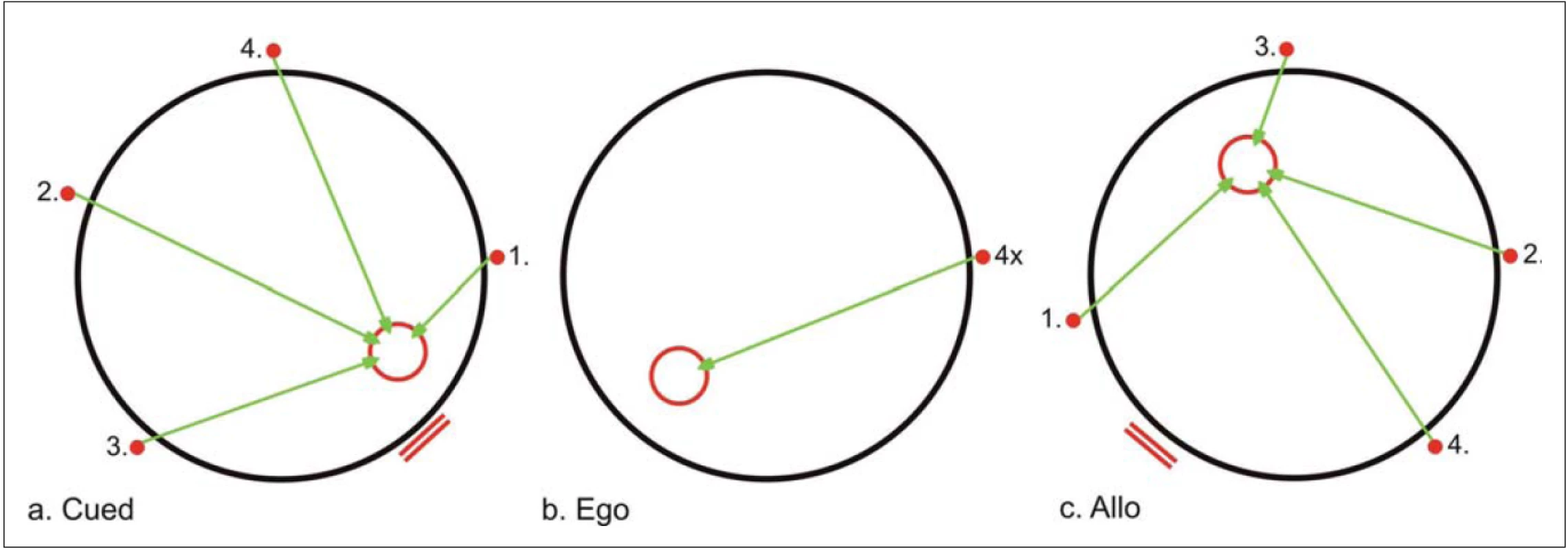
Testování prostorové orientace
Vyšetřování prostorové orientace probíhalo v jeden den v rámci standardního protokolu trvajícího cca 2,5 hod v experimentálním zařízení zvaném Blue Velvet Arena (BVA), což je kruhová aréna o průměru 2,8 m, jejíž 3 m vysokou stěnu tvoří plátno z modrého sametu, který zabraňuje přístupu denního světla. Na stěně arény, na každém z osmi digitálních panelů, je umístěn startovní bod (malé kolečko) a orientační značka (dvě vodorovné čárky), jež se postupně zapínají a vypínají v přesně definovaném pořadí za pomoci počítačového programu. V jednu chvíli může být rozsvícena maximálně jedna orientační značka spolu s jedním startovním bodem. Na podlahu arény se pomocí manuálně ovládaného laserového zdroje promítá cíl v podobě červeného kolečka. K určení pozice vyšetřovaného subjektu uvnitř arény se používá infračervená dioda připevněná na sluchátkách, která nosí subjekt po celou dobu testování na hlavě. Poloha a dráha subjektu je snímána LCD kamerou umístěnou ve stropě arény a je ukládána do počítače k dalšímu zpracování a vyhodnocení.
Ve výše zmíněném experimentálním prostředí byl každý subjekt vyšetřen testem zvaným „Test jednoduché navigace“ [4]. Tento test vyšetřuje tři základní komponenty prostorové orientace, které jsou různě náročné a závisí na odlišných mozkových strukturách. Jedná se o orientaci k blízké orientační značce (cued; C), orientaci podle vzdálené orientační značky (allocentrická; A) a orientaci podle startovní pozice (egocentrická; E). Před začátkem každého testování bylo subjektu podáno jednoduché vysvětlení o účelu a průběhu tohoto testu, které je v rámci našeho experimentálního prostředí standardizováno. Následně každý subjekt absolvoval zácvik nejprve na papíře a později i nanečisto na počítači. Samotný test se skládá ze tří subtestů (C, A a E), z nichž každý je zaměřen na jeden ze základních typů prostorové orientace. V každém ze subtestů jsou čtyři pokusy. Úkolem subjektu bylo určit polohu skrytého cíle na podlaze arény (reprezentovaného kolečkem), jehož pozice se mezi jednotlivými pokusy nemění, a to buď podle blízké orientační značky (subtest C), vzdálené orientační značky (subtest A) nebo podle vlastní počáteční (startovní) pozice (subtest E) (obr. 1). Správná pozice cíle byla subjektu promítnuta pomocí laserového zdroje na podlahu stanu před prvním pokusem každého z těchto tří subtestů a dále po skončení každého pokusu. Přesnost orientace v každém ze subtestů byla určena jako celková chyba odhadu, tedy jako průměr vzdáleností mezi správnou a subjektem udanou polohou cíle v průběhu čtyř pokusů.
Statistická analýza dat
Pro zjištění rozdílů mezi jednotlivými skupinami ve věku, vzdělání, MMSE, neuropsychologických testech a testech prostorové orientace jsme použili test ANOVA s jedním faktorem skupiny pacientů následovaný post‑hoc Tukeyho HSD testem. Test dobré shody (Chí ‑ kvadrát test) jsme použili ke zhodnocení rozdílů v zastoupení mužů a žen mezi jednotlivými skupinami. Pro statistické vyhodnocení jsme použili softwarový balík IBM SPSS pro Windows, verze 20.0.
Výsledky
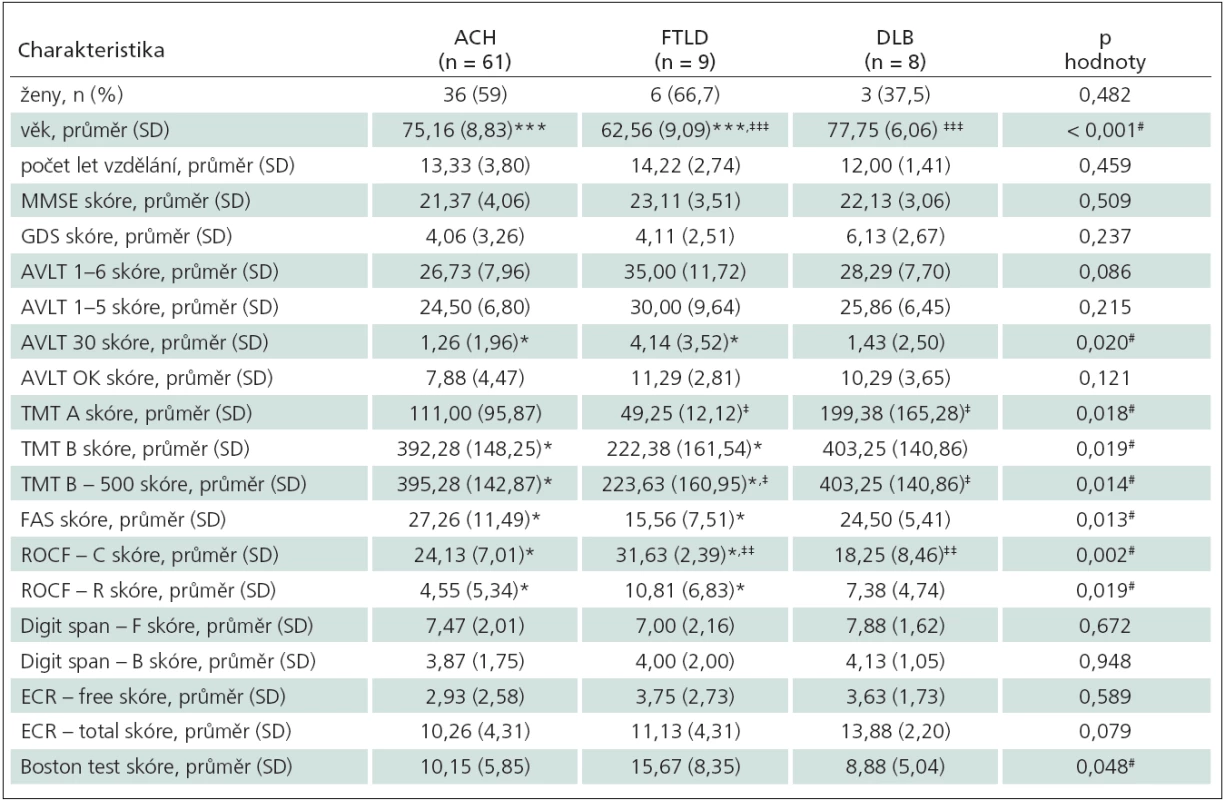
V základní charakteristice souboru se skupiny mezi sebou nelišily ve vzdělání, skóre v MMSE testu ani v poměru zastoupení mužů a žen. Skupiny se lišily pouze ve věku (F2,75 = 17,64; p < 0,001), kdy skupina FTLD byla mladší než skupina ACH (p < 0,001) a DLB (p < 0,001). Rozdíly mezi jednotlivými skupinami v základních charakteristikách souboru a v neuropsychologických testech jsou uvedeny v tab. 1.
V experimentálním testu prostorové orientace se skupiny mezi sebou lišily v subtestech zaměřených na orientaci k blízké orientační značce – cued (F2,75 = 5,92; p = 0,005) a orientaci podle startovní pozice – egocentrické (F2,75 = 5,17; p = 0,01); ale nikoliv v orientaci podle vzdálené orientační značky – alocentrické (F2,75 = 2,84; p = 0,069). Konkrétně v subtestu orientace k blízké orientační značce měla skupina FTLD lepší výkon než skupina ACH (p = 0,03) a skupina DLB (p = 0,006). Rozdíl mezi skupinami ACH a DLB v tomto subtestu nebyl signifikantní (p = 0,203). V subtestu orientace podle startovní pozice měla skupina DLB horší výkon než skupina ACH (p = 0,012) a skupina FTLD (p = 0,012). Rozdíl mezi skupinami ACH a FTLD v tomto subtestu nebyl signifikantní (p = 0,814). Grafické zobrazení výsledků prostorové orientace je prezentováno v grafu 1.

Diskuze
V klinické praxi je známo, že pacienti trpící demencí se často ztrácejí nejprve v neznámých či pro orientaci náročných místech (nemocnice, obchodní dům) a v pozdější fázi onemocnění se pacienti ztrácejí i na místech dobře známých (bydliště, vlastní byt, dům) [1,2]. Samotnému výzkumu prostorové kognice u pacientů s demencí však zatím tolik prostoru věnováno není, což kontrastuje s extenzivním výzkumem v oblasti jiných kognitivních domén. Dosud provedené práce většinou vysvětlují prostorovou dezorientaci u pacientů s demencí v důsledku ACH postižením vyššího zrakového vnímání nebo paměti pro topografické údaje [20 – 22]. Menší počet studií u pacientů s ACH se věnuje poruchám jednotlivých komponent orientace – především orientace alocentrické a egocentrické) [5 – 8]. Studie, které by se podrobněji zabývaly prostorovou dezorientací u pacientů trpících jinými druhy demence, především DLB a FTLD, však dosud prováděny nebyly.
V naší práci jsme se blíže zaměřili na tuto problematiku s cílem porovnat rozdíly v postižení prostorové orientace, především jejích tří základních komponent, u nejčastěji se vyskytujících demencí neurodegenerativní etiologie – ACH, DLB a FTLD.
Naše výsledky ukazují, že mezi skupinami pacientů s demencí v důsledku ACH, LBD a FTLD existují rozdíly v nejjednodušším typu prostorové orientace pomocí blízké značky (cued) a v orientaci pomocí startovní pozice (egocentrické), ale nikoliv v orientaci pomocí vzdálené orientační značky (alocentrické). Konkrétně v testu orientace pomocí blízké orientační značky měla skupina pacientů s FTLD výrazně lepší výkon než obě skupiny pacientů s ACH a DLB, které se mezi sebou nelišily. V testu egocentrické orientace měli pacienti s DLB nejhorší výkon ze všech skupin. Mezi výsledky pacientů s FTLD a ACH nebyl v tomto testu významný rozdíl.
V nejjednodušším testu prostorové orientace podle blízké značky (cued) dosahovali pacienti s FTLD nejlepšího výsledku ze všech tří skupin. Pro tento typ orientace je důležité striatum a vyšší zrakové vnímání [4], jež je u pacientů s FTLD neporušeno [23]. U pacientů s ACH bývá narušeno vyšší zrakové vnímání [20,21], které je postiženo i u pacientů s DLB [24,25], kde navíc nacházíme i dysfunkci striata [26]. Naše výsledky jsou tedy v souladu s výše uvedenými nálezy.
Dominující postižení egocentrické orientace u skupiny pacientů s DLB souvisí pravděpodobně s postižením parietálního laloku. Význam parietálního laloku pro egocentrickou orientaci byl dokumentován v řadě animálních studií [27,28], studiích na pacientech s fokální lézí parietálního laloku a studiích prováděných ve funkční magnetické rezonanci [29,30]. Výrazná porucha funkce parietálního laloku je pro pacienty s DLB charakteristická a v klinické praxi se projevuje především postižením vizuospaciálních funkcí (například obtížemi s kreslením zkřížených pentagramů v testu MMSE) [12]. V souladu s tímto klinickým pozorováním jsou studie ukazující výraznou hypoperfuzi parietálního laloku u pacientů s DLB ve srovnání s kontrolní skupinou [31].
Naše výsledky neprokazují výraznější postižení egocentrické orientace u pacientů s ACH ve srovnání s pacienty s FTLD. Pro demence v důsledku FTLD, na rozdíl od ACH, není dysfunkce parietálního laloku typická [32,33]. Naše studie však zahrnovala pouze devět pacientů s FTLD, a je tedy možné, že nesignifikantní rozdíl v egocentrické orientaci mezi ACH a FTLD může být způsoben právě menším počtem pacientů v FTLD skupině.
V testu alocentrické orientace, který je nejflexibilnější, ale zároveň nejkomplexnější strategií, si všechny skupiny vedly srovnatelně. Porucha alocentrické prostorové orientace je typický nález u pacientů s ACH [6,8] a je způsobena postižením hipokampu a meziotemporálních struktur [9]. Recentní studie ukazují, že hipokampus je postižen i u pacientů s DLB [34,35] a jeho atrofie (především přední části) je typická i pro pacienty s FTLD [36,37]. Lze tedy předpokládat, že tato nejnáročnější komponenta orientační strategie bude postižena u všech tří typů demence.
Průměrný věk pacientů s FTLD v našem souboru byl nižší než u pacientů s ACH nebo DLB, což je v souladu se světovou literaturou popisující rozvoj demence v důsledku FTLD u mladších pacientů (kolem 55. roku věku) [38] ve srovnání s pacienty s demencí v důsledku ACH či DLB. Vliv věku na prostorovou orientaci byl podrobněji zkoumán v našich předchozích studiích zahrnujících soubory mladých a starých dobrovolníků, které naznačují, že v průběhu stárnutí dochází k selektivnímu poklesu výkonu v alocentrické orientaci, ale nikoli v orientaci egocentrické [39]. Tento nález je v souladu se studiemi ukazujícími, že v průběhu stárnutí se dějí strukturální a funkční změny v prefrontální kůře a hipokampu, které se mohou projevit právě změnami ve schopnosti alocentrické prostorové orientace [40]. V naší práci byly prokázány rozdíly mezi jednotlivými demencemi v postižení orientace podle blízké značky a orientace egocentrické, jež by tedy dle dostupných literárních údajů neměly být věkem ovlivněny [41,42].
Naše výsledky prokázaly, že mezi skupinami pacientů s demencí v důsledku ACH, LBD a FTLD existují rozdíly v postižení prostorové orientace. Na jejich základě lze říci, že pacienti s FTLD si ze všech tří skupin vedli relativně nejlépe. Porucha prostorové orientace také není u těchto pacientů klinicky dominující. Relativně nejhorší výsledek jsme pozorovali u pacientů s DLB. Tyto rozdíly jsou v souladu s hypotézou, kterou jsme si stanovili na základě rozdílného postižení jednotlivých nervových struktur, jimiž se uvedené choroby vyznačují.
Rozdíly v postižení jednotlivých komponent prostorové orientace lze účinně měřit v experimentálním zařízení BVA, a toto vyšetření může tudíž přispět k diferenciálně diagnostické rozvaze u pacientů s různými druhy demencí.
Experimentální zařízení BVA věrně simuluje orientační strategie používané v reálném životě, a může proto být vhodným doplňkem ke standardně používané baterii neuropsychologických testů, které prostorovou orientaci komplexně jako kognitivní doménu nevyšetřují a neumožní ani rozlišit poruchy jejích jednotlivých komponent.
Protokol testu prostorové orientace v BVA je navržen tak, aby byl dobře pochopitelný i pro pacienty s mírnou demencí. Hlavní podmínka vyšetření je dobrá pohyblivost vyšetřovaného, která však není vždy samozřejmostí u této skupiny pacientů, zvláště u pacientů s DLB. Dalšími negativy, která by mohla znemožňovat jeho širší využití, jsou velké prostorové nároky a vysoká cena experimentálního zařízení.
Tato negativa lze do jisté míry obejít použitím virtuální počítačové verze testu, jež je rovněž k dispozici. Počítačová verze vyšetření je prostorově nenáročná a mohou ji absolvovat i pacienti se zhoršenou mobilitou. Nabízí se však otázka, nakolik je toto řešení vhodné pro starší populaci pacientů, kteří se často při práci se samotným počítačem mohou cítit nepohodlně a nejistě. V našich virtuálních testech se tento faktor snažíme minimalizovat tím, že subjektům nabízíme místo klasické počítačové myši tužku a dotykovou obrazovku, takže práce je pak obdobná jako kreslení na papíře.
Určitou limitací této práce je ale nepoměr velikostí jednotlivých skupin, který je dán prevalencí jednotlivých druhů neurodegenerativních demencí v populaci: soubory pacientů s demencí v důsledku DLB a FTLD jsou výrazně menší než soubor pacientů s ACH. I přes výše uvedené limitace se však podařilo prokázat dříve zmíněné specifické rozdíly v prostorové orientaci u jednotlivých demencí. Budoucí práce zahrnující větší soubory pacientů mohou profil postižení prostorové orientace u jednotlivých demencí dále upřesnit či ukázat na další rozdíly, které se na našich menších souborech nemusely projevit.
Prostorová orientace je poměrně málo prozkoumaná kognitivní doména, jež je ovšem důležitá pro každodenní život a její narušení má závažné důsledky pro pacienty i jejich okolí. Další studie v této oblasti mohou zahrnovat podrobnější popis poruch prostorové kognice i u ostatních demencí, především vaskulární demence a jejích subtypů, Parkinsonovy nemoci s demencí nebo vzácnějších diagnóz, jako jsou kortikobazální degenerace, progresivní supranukleární paralýza aj. Takový výzkum může mít potenciální význam pro diferenciální diagnostiku těchto onemocnění.
Jedním z cílů ve výzkumu ACH a jiných demencí je i možnost časné diagnostiky onemocnění. Studie zabývající se srovnáním, zda je prostorová orientace u pacientů trpících demencí postižena dříve než ostatní kognitivní domény, proto mnohou být rovněž velmi přínosné.
Podpořeno granty MZ ČR – RVO, FN v Motole 00064203, GAUK 624012 a 546113, IPL 2/2012 (699002), projektem FNUSA-ICRC (no. CZ.1.05//1.1.00/ 02.0123) z Evropského fondu regionálního rozvoje a výzkumnými projekty AV0Z50110509 a RVO:67985823.
Konflikt zájmů
Dr. Laczó konzultoval pro firmy Pfizer a Polyhymnia-TS. Dr. Hort konzultoval pro firmy Pfizer, Janssen, Merck, Novartis, Elan, Zentiva, Ipsen a Polyhymnia-TS. Dr. Laczó a dr. Hort byli v období od 6/2012 do 5/2014 držiteli akcií firmy Polyhymnia-TS.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jan Laczó, Ph.D.
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: JanLaczo@seznam.cz
Přijato k recenzi: 6. 2. 2014
Přijato do tisku: 20. 5. 2014
Sources
1. McShane R, Gedling K, Keene J, Fairburn C, Jacoby R, Hope T. Getting lost in dementia: a longitudinal study of a behavioral symptom. Int Psychogeriatr 1998; 10(3): 253 – 260.
2. Pai MC, Jacobs WJ. Topographical disorientation in community ‑ residing patients with Alzheimer’s disease. Int J Geriatr Psychiatry 2004; 19(3): 250 – 255.
3. Hely MA, Reid WG, Halliday GM, McRitchie DA, Leicester J, Joffe R et al. Diffuse Lewy body disease: clinical features in nine cases without coexistent Alzheimer’s disease. J Neurol Neurosurg Psychiatry 1996; 60(5): 531 – 538.
4. Vlček K, Levčík D, Nedělská Z, Laczó J, Vyhnálek M, Hort J. Prostorová navigace jako kognitivní doména v diagnostice mírně kognitivní poruchy. Psychiatrie 2011; 15 (Suppl 2): 23 – 27.
5. Kalová E, Vlcek K, Jarolímová E, Bures J. Allothetic orientation and sequential ordering of places is impaired in early stages of Alzheimer’s disease: corresponding results in real space tests and computer tests. Behav Brain Res 2005; 159(2): 175 – 186.
6. Hort J, Laczó J, Vyhnálek M, Bojar M, Bures J, Vlcek K.Spatial navigation deficit in amnestic mild cognitive impairment. Proc Natl Acad Sci U S A 2007; 104(10): 4042 – 4047.
7. Burgess N, Trinkler I, King J, Kennedy A, Cipolotti L. Impaired allocentric spatial memory underlying topographical disorientation. Rev Neurosci 2006; 17(1 – 2): 239 – 251.
8. Laczó J, Vlcek K, Vyhnálek M, Vajnerová O, Ort M, Holmerová I et al. Spatial navigation testing discriminates two types of amnestic mild cognitive impairment. Behav Brain Res 2009; 202(2): 252 – 259. doi: 10.1016/ j.bbr.2009.03.041.
9. Nedelska Z, Andel R, Laczó J, Vlcek K, Horinek D, Lisy J et al. Spatial navigation impairment is proportional to right hippocampal volume. Proc Natl Acad Sci U S A 2012; 109(7): 2590 – 2594. doi: 10.1073/ pnas.1121588109.
10. DeIpolyi AR, Rankin KP, Mucke L, Miller BL, Gorno ‑ Tempini ML. Spatial cognition and the human navigation network in AD and MCI. Neurology 2007; 69(10): 986 – 997.
11. Hartley T, Maguire EA, Spiers HJ, Burgess N. The well‑worn route and the path less traveled: distinct neural bases of route following and wayfinding in humans. Neuron 2003; 37(5): 877 – 888.
12. Colloby SJ, Fenwick JD, Williams ED, Paling SM, Lobotesis K, Ballard C et al. A comparison of (99m)Tc ‑ HMPAO SPET changes in dementia with Lewy bodies and Alzheimer’s disease using statistical parametric mapping. Eur J Nucl Med Mol Imaging 2002; 29(5): 615 – 622.
13. Bellassen V, Iglói K, de Souza LC, Dubois B, Rondi ‑ Reig L. Temporal order memory assessed during spatiotemporal navigation as a behavioral cognitive marker for differential Alzheimer’s disease diagnosis. J Neurosci 2012; 32(6): 1942 – 1952. doi: 10.1523/ JNEUROSCI.4556 ‑ 11.2012.
14. Pengas G, Patterson K, Arnold RJ, Bird CM, Burgess N, Nestor PJ. Lost and found: bespoke memory testing for Alzheimer’s disease and semantic dementia. J Alzheimers Dis 2010; 21(4): 1347 – 1365.
15. Fazekas F, Kleinert R, Offenbacher H, Payer F, Schmidt R, Kleinert G et al. The morphologic correlate of incidental punctate white matter hyperintensities on MR images. AJNR Am J Neuroradiol 12(5): 915 – 921.
16. McKhann G, Drachman D, Folstein M, Katzman R,Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS ‑ ADRDA Work Group* under the auspices of Department of Health and Human Services Task Force on Alzheimer‘s Disease. Neurology 1984; 34(7): 939 – 939.
17. Hort J, Glosová L, Vyhnálek M, Bojar M, Škoda D,Hladíková M. Tau protein a beta amyloid v likvoru u Alzheimerovy choroby. Cesk Slov Neurol N 2007; 70/ 103(1): 30 – 36.
18. McKeith IG, Dickson DW, Lowe J, Emre M, O’Brien JT, Feldman H et al. Diagnosis and management of dementia with Lewy bodies: third report of the DLB Consortium. Neurology 2005; 65(12): 1863 – 1872.
19. Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S et al. Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria. Neurology 1998; 51(6): 1546 – 1554.
20. Tetewsky SJ, Duffy CJ. Visual loss and getting lost in Alzheimer’s disease. Neurology 1999; 52(5): 958 – 965.
21. O’Brien HL, Tetewsky SJ, Avery LM, Cushman LA, Makous W, Duffy CJ. Visual mechanisms of spatial disorientation in Alzheimer’s disease. Cereb Cortex 2001; 11(11): 1083 – 1092.
22. Bird CM, Chan D, Hartley T, Pijnenburg YA, Rossor MN, Burgess N. Topographical short‑term memory differentiates Alzheimer’s disease from frontotemporal lobar degeneration. Hippocampus 2010; 20(10): 1154 – 1169. doi: 10.1002/ hipo.20715.
23. Clinical and neuropathological criteria for frontotemporal dementia. The Lund and Manchester Groups. J Neurol Neurosurg Psychiatry 1994; 57(4): 416 – 418.
24. Mori E, Shimomura T, Fujimori M, Hirono N, Imamura T, Hashimoto M et al. Visuoperceptual impairment in dementia with Lewy bodies. Arch Neurol American Medical Association 2000; 57(4): 489.
25. Mosimann UP, Mather G, Wesnes KA, O’Brien JT, Burn DJ, McKeith IG. Visual perception in Parkinson disease dementia and dementia with Lewy bodies. Neurology 2004; 63(11): 2091 – 2096.
26. Hu XS, Okamura N, Arai H, Higuchi M, Matsui T, Tashiro M et al. 18F ‑ fluorodopa PET study of striatal dopamine uptake in the diagnosis of dementia with Lewy bodies. Neurology 2000; 55(10): 1575 – 1577.
27. Andersen RA, Snyder LH, Li CS, Stricanne B. Coordinate transformations in the representation of spatial information. Curr Opin Neurobiol 1993; 3(2): 171 – 176.
28. McDaniel WF, Via JD, Smith JS, Wells DL, Fu JJ, Bishop JF et al. Unilateral injury of posterior parietal cortex and spatial learning in hooded rats. Behav Brain Res 1995; 70(2): 165 – 179.
29. Maguire EA, Burgess N, Donnett JG, Frackowiak RS,Frith CD, O’Keefe J. Knowing where and getting there: a human navigation network. Science 1998; 280(5365): 921 – 924.
30. Kase CS, Troncoso JF, Court JE, Tapia JF, Mohr JP. Global spatial disorientation. Clinico ‑ pathologic correlations. J Neurol Sci 1977; 34(2): 267 – 278.
31. Ishii K, Hosaka K, Mori T, Mori E. Comparison of FDG ‑ PET and IMP ‑ SPECT in patients with dementia with Lewy bodies. Ann Nucl Med 2004; 18(5): 447 – 451.
32. Du AT, Jahng GH, Hayasaka S, Kramer JH, Rosen HJ,Gorno ‑ Tempini ML et al. Hypoperfusion in frontotemporal dementia and Alzheimer disease by arterial spin labeling MRI. Neurology 2006; 67(7): 1215 – 1220.
33. Hoffman JM, Welsh ‑ Bohmer KA, Hanson M, Crain B, Hulette C, Earl N et al. FDG PET imaging in patients with pathologically verified dementia. J Nucl Med 2000; 41(11): 1920 – 1928.
34. Chow N, Aarsland D, Honarpisheh H, Beyer MK,Somme JH, Elashoff D et al. Comparing hippocampal atrophy in Alzheimer’s dementia and dementia with Lewy bodies. Dement Geriatr Cogn Disord 2012; 34(1): 44 – 50. doi: 10.1159/ 000339727.
35. Kantarci K, Ferman TJ, Boeve BF, Weigand SD, Przybelski S, Vemuri P et al. Focal atrophy on MRI and neuropathologic classification of dementia with Lewy bodies. Neurology 2012; 79(6): 553 – 560. doi: 10.1212/ WNL.0b013e31826357a5.
36. Lindberg O, Walterfang M, Looi JCL, Malykhin N, Ostberg P, Zandbelt B et al. Hippocampal shape analysis in Alzheimer’s disease and frontotemporal lobar degeneration subtypes. J Alzheimers Dis 2012; 30(2): 355 – 365. doi: 10.3233/ JAD ‑ 2012 ‑ 112210.
37. Muñoz ‑ Ruiz MÁ, Hartikainen P, Koikkalainen J, Wolz R, Julkunen V, Niskanen E et al. Structural MRI in frontotemporal dementia: comparisons between hippocampal volumetry, tensor‑based morphometry and voxel‑based morphometry. PLoS One 2012; 7(12): e52531. doi: 10.1371/ journal.pone.0052531.
38. Johnson JK, Diehl J, Mendez MF, Neuhaus J, Shapira JS, Forman M et al. Frontotemporal lobar degeneration: demographic characteristics of 353 patients. Arch Neurol 2005; 62(6): 925 – 930.
39. Gazova I, Laczó J, Rubinova E, Mokrisova I, Hyncicova E, Andel R et al. Spatial navigation in young versus older adults. Front Aging Neurosci 2013; 5 : 94. doi: 10.3389/ fnagi.2013.00094.
40. Gazova I, Vlcek K, Laczó J, Nedelska Z, Hyncicova E, Mokrisova I et al. Spatial navigation – a unique window into physiological and pathological aging. Front Aging Neurosci 2012; 4 : 16. doi: 10.3389/ fnagi.2012.00016.
41. Moffat SD, Resnick SM. Effects of age on virtual environment place navigation and allocentric cognitive mapping. Behav Neurosci 2002; 116(5): 851 – 859.
42. Iaria G, Palermo L, Committeri G, Barton JJ. Age differences in the formation and use of cognitive maps. Behav Brain Res 2009; 196(2): 187 – 191. doi: 10.1016/ j.bbr.2008.08.040.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2014 Issue 4
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Vyšetření senzitivity
- Postižení nervového systému z nutriční nedostatečnosti po bariatrických operacích
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Anaplastické oligodendrogliomy – nadešel čas pro personalizovanou medicínu?
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
- Rozdíly v postižení prostorové orientace u demencí neurodegenerativní etiologie
- Hodnocení písma u pacientů s Parkinsonovou nemocí
- AMETYST – observační studie fáze 4 sledující vliv intramuskulárně podávaného interferonu beta‑1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
- Dědičné ulceromutilující senzitivní neuropatie – klinická, elektrofyziologická a molekulárně genetická studie tří rodin
- Limity zkoušky verbální fluence v diferenciální diagnostice neurologických onemocnění
- Validace dotazníkové sady pro diagnostiku syndromu neklidných nohou v populaci českých těhotných žen
- Nálezy v mozkomíšním moku u dětí s akutním paretickým postižením
- Dlouhodobé sledování kognitivních, emočních a behaviorálních změn u pacientky s roztroušenou sklerózou – kazuistika
- Spinální arteriovenózní malformace – dvě kazuistiky
- Totální avulze bulbu kombinovaná s poraněním chiazmatu – kazuistika
- Prospektivní paměť a její vyšetření – validace Testu paměti pro záměry
- Význam (CA)n repetitivní sekvence genu pro beta‑3 podjednotku GABA(A) receptoru při manifestaci tinnitu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vyšetření senzitivity
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Spinální arteriovenózní malformace – dvě kazuistiky
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
